Research Article
Herbal Munziq améliore les lésions d’ischémie-reperfusion du myocarde en inhibant l’inflammation
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cette étude examine les effets cardioprotecteurs de Munziq, une préparation traditionnelle à base de plantes ouïghoures, sur les lésions d’ischémie-reperfusion myocardique (MIRI) chez les rats présentant des fluides corporels anormaux. Grâce à des méthodes expérimentales complètes, nous démontrons le potentiel de Munziq à atténuer MIRI en supprimant la voie de signalisation NF-κB.
Résumé
L’objectif de cette étude était d’étudier les effets cardioprotecteurs de Munziq sur les lésions anormales d’ischémie-reperfusion myocardique (MIRI) et son mécanisme sous-jacent. Des rats normaux et des rats présentant des effets anormaux sur les fluides corporels ont été prétraités avec Munziq pendant 21 jours. Suite à cela, des modèles MIRI ont été établis. Des modifications histopathologiques et des modifications de l’ultrastructure myocardique ont été observées par coloration à l’hématoxyline et à l’éosine (HE) et par microscopie électronique à transmission pour observer les manifestations pathologiques des lésions myocardiques. Les taux sériques de CK-MB, cTn-T et ICAM-1 ont été détectés par test immuno-enzymatique (ELISA) pour observer les marqueurs liés aux lésions myocardiques. Les niveaux d’IL-1β, d’IL-6 et de TNF-α dans le sérum et les tissus myocardiques ont également été détectés par ELISA pour observer l’effet anti-inflammatoire. Les niveaux d’expression des protéines NIK, IKKα, Pikα et p65 de la voie de signalisation NF-κB ont été détectés par analyse par transfert Western. Les résultats ont montré que les lésions myocardiques dans le groupe ABF MIRI étaient plus graves que dans le groupe témoin MIRI. Le prétraitement de Munziq a le potentiel d’atténuer les changements pathologiques induits par les lésions d’ischémie-reperfusion et pourrait protéger la fonction cardiaque. Les niveaux de protéines de la voie NF-κB et des effecteurs en aval IL-1β, IL-6 et TNF-α étaient significativement régulés à la hausse dans le groupe MIRI tandis qu’ils étaient régulés à la baisse dans le groupe Munziq. Il est intéressant de noter qu’il y avait plus d’activation de la voie de signalisation NF-κB et des niveaux plus élevés de cytokines inflammatoires en aval dans le groupe ABF MIRI. Les résultats suggèrent que l’IRIM était plus sévère dans l’ABF. Munziq a des effets cardioprotecteurs dans l’ischémie et les lésions de reperfusion. Cet effet protecteur peut être exercé en supprimant la voie de signalisation NF-κB.
Introduction
L’ischémie myocardique est une affection dans laquelle le myocarde ne reçoit pas un flux sanguin adéquat, principalement causée par une sténose ou une thrombose des artères coronaires1, ce qui peut entraîner des issues fatales pour les patients 2,3. Étant donné que le métabolisme myocardique est presque exclusivement aérobie et contient des réserves de glycogène très limitées, il est essentiel de rétablir rapidement l’approvisionnement en sang, principalement par ICP ou thrombolyse intraveineuse. Bien qu’une reperfusion myocardique efficace soit cruciale pour améliorer le pronostic du myocarde ischémique, elle introduit également un risque d’ischémie-reperfusion myocardique (MIRI)4,5,6. L’IRIM est un défi important qui a un impact sur l’efficacité des thérapies de reperfusion myocardique7. De multiples facteurs et mécanismes contribuent au développement du MIRI. Par exemple, dans les cellules endothéliales, la reperfusion induit une accumulation d’espèces réactives de l’oxygène (ROS) et un épuisement des piégeurs de radicaux libres, indiquant la présence d’un stress oxydatif 4,8. Ce stress oxydatif peut par la suite déclencher une réponse inflammatoire, conduisant à une libération accrue de facteurs inflammatoires, à une augmentation de la production de molécules d’adhésion et au recrutement de leucocytes 9,10,11. La voie NF-κB (NF-κB) joue un rôle crucial dans la réponse inflammatoire lors d’une ischémie/reperfusion myocardique12. La famille des facteurs de transcription NF-κB chez les mammifères comprend cinq membres : NF-κB1 (également connu sous le nom de p105/p50), NF-κB2 (également connu sous le nom de p100/p52), p65 (également appelé RELA), RELB (l’homologue de l’oncogène viral de la réticuloendothéliose V-Rel) et c-REL13,14. Il a été démontré que l’inhibition de la voie NF-κB atténue les lésions d’ischémie/reperfusion dans divers tissus, notamment le myocarde12,15, l’intestin16, l’ovaire17, le cerveau18,19, les reins20 et le foie21. Notamment, la voie de signalisation NF-κB a été largement documentée en tant que médiateur pivot dans la réponse myocardique à l’ischémie et à la reperfusion12,14, les mécanismes possibles incluent la promotion des réponses inflammatoires, la régulation de l’expression des molécules d’adhésion cellulaire, la participation aux réactions de stress oxydatif et l’influence des voies de mort et de survie cellulaires 12,20,22,23,24,25. Les interventions thérapeutiques visant à atténuer l’activation de NF-κB ont montré un potentiel significatif dans l’atténuation de MIRI23,26 .
La médecine ouïgoure, partie intégrante de la médecine traditionnelle chinoise, est fondée sur la théorie des quatre humeurs : le feu, l’air, l’eau et la terre. Ces humeurs donnent naissance à des fluides corporels tels que le sang, les mucosités, la bile jaune et la bile noire27,28. Le maintien de l’homéostasie dynamique entre ces quatre fluides corporels est crucial pour la santé globale du corps humain. Tout déséquilibre dans ces fluides, appelé fluides corporels déséquilibrés, peut entraîner l’apparition de maladies. Parmi les différents fluides corporels déséquilibrés, le plus important est connu sous le nom de liquide corporel anormal (ABF), également reconnu comme syndrome de Savda anormal (ASS)27,28. Le munziq, une médecine traditionnelle ouïghoure largement utilisée par les médecins ouïghours, est prescrit pour le traitement des fluides corporels anormaux. Il s’agit d’une préparation médicinale à base de plantes comprenant dix espèces médicinales différentes, telles qu’elles sont fournies dans la notice, notamment Cordia dichotoma Forst. f., Anchusaitalica Retz., Glycyrrhiza uralensis Fisch., Adiantum capillusveneris L., Euphorbia humifusa Willd., Ziziphus jujuba Mill., Lavandula angustifolia Mill., Foeniculum vulgare Mill., Melissa officinalis L. et Alhagi pseudoalhagi Desv29. Munziq a été approuvé par la Food and Drug Administration de l’État en 2003 sous le numéro de code Z65020166. Ses composants chimiques actifs englobent le laiton, les phénols, les acides organiques, les acides aminés, la saponine, le sucre et autres. Munziq présente de multiples effets, notamment des effets antioxydants, anti-inflammatoires, immunorégulateurs, anti-agrégation plaquettaire et antithrombotiques 27,28,30.
Nos études précédentes ont montré que le médicament Munziq peut soulager l’ischémie/reperfusion myocardique (MIRI), bien que les mécanismes spécifiques restent incertains. Les effets protecteurs myocardiques de Munziq chez les rats atteints d’ischémie-reperfusion myocardique chez des rats atteints d’un syndrome de Savda anormal ont été mis en évidence. L’inhibition de la voie du facteur nucléaire kappa b protège les lésions d’ischémie/reperfusion myocardique chez les rats traités par le granule Fufang Munziq (Munziq) 27,28,30. Cependant, il existe peu de recherches sur le rôle et le mécanisme de Munziq dans le MIRI.
Cette étude vise à étudier les effets cardioprotecteurs de Munziq sur les lésions d’ischémie-reperfusion myocardique (MIRI) chez les rats présentant un liquide corporel anormal (ABF) et à explorer les mécanismes sous-jacents, en se concentrant particulièrement sur la voie de signalisation NF-κB. L’hypothèse proposée dans cette étude est que le prétraitement de Munziq peut atténuer les changements pathologiques induits par l’IRIM et protéger la fonction cardiaque, potentiellement en supprimant la voie de signalisation NF-κB et les réponses inflammatoires en aval. L’hypothèse est testée en établissant des modèles simulés, de lésions d’ischémie-reperfusion (MIRI) et de lésions d’ischémie-reperfusion + Munziq dans les groupes témoins et ABF. La fonction cardiaque, les indicateurs liés à l’inflammation et les protéines associées à la voie NF-κB sont surveillés.
Protocole
Le rat Sprague-Dawley (SD) mâle adulte pesant de 200 à 220 g a été utilisé conformément aux directives des National Institutes of Health pour le soin et l’utilisation des animaux de laboratoire. Centre d’expérimentation animale de l’Université de médecine du Xinjiang. Des modèles animaux avec des fluides corporels anormaux (ABF) ont été fournis par le Centre des animaux expérimentaux de l’Université de médecine du Xinjiang. Les rats ont été maintenus dans un environnement sec-froid comme décrit précédemment, ce qui est essentiel pour établir le modèle de liquide corporel anormal (ABF) chez les rats, selon la théorie de la médecine traditionnelle ouïghoure et comme démontré dans des études antérieures29,33. Toutes les expériences sur les animaux ont été menées conformément aux directives éthiques de l’Université médicale du Xinjiang et conformément aux directives ARRIVE. Le protocole pour les études sur les animaux vertébrés (rats) a été approuvé par le comité d’éthique institutionnel de l’Université de médecine du Xinjiang (IACUC-20200318-16).
1. Groupement d’animaux, administration de médicaments et établissement du modèle MIRI
- Répartissez au hasard les rats dans les six groupes suivants : i) groupe témoin simulé, ii) groupe témoin MIRI, iii) groupe simulé ABF, iv) groupe ABF MIRI, v) groupe témoin MIRI + Munziq et vi) groupe ABF MIRI + Munziq.
- Hébergez les rats du groupe ABF dans un environnement contrôlé à l’intérieur de boîtes climatiques réglées à une température de 6 °C ± 1 °C et à une plage d’humidité relative de 25 % à 32,8 %. Fournissez aux rats des aliments ordinaires mélangés à de la nourriture froide sèche, à savoir des graines d’orge et de coriandre dans un rapport de 7:1,5:1,5, et appliquez cette méthode pendant 21 jours pour établir le modèle ABF29,33.
- Administrer par voie intragastrique 5 g/kg de Munziq (5,0 g de Munziq dissous dans 1 mL d’eau distillée) au groupe Munziq pendant 21 jours avant la chirurgie MIRI, soit le double de la dose clinique efficace. Pour les animaux non ABF, tels que les groupes Control Sham, Control MIRI et Control MIRI + Munziq, administrer un volume égal de solution saline normale au groupe placebo et au groupe MIRI et administrer Munziq par voie intragastrique au groupe Munziq.
- Après 21 jours de prétraitement, établissez le modèle MIRI.
- Effectuez l’opération dans une salle d’opération dédiée aux animaux équipée de matériaux stériles pour garantir un environnement stérile. Anesthésier les rats avec une injection intrapéritonéale (IP) de pentobarbital sodique (35 mg/kg) ; Observez la relaxation musculaire, la réactivité aux stimuli externes, la fréquence respiratoire et la profondeur pour évaluer l’effet anesthésique. Surveillez ces paramètres toutes les 15 minutes tout au long de la procédure. Si des signes d’anesthésie inadéquate apparaissent (tension musculaire, réponse notable aux stimuli, fréquence respiratoire accrue ou peu profonde), administrez une dose supplémentaire de 20 mg/kg. Maintenez l’anesthésie tout au long de la procédure jusqu’au prélèvement sanguin final. Pendant la procédure, maintenez la température corporelle du rat à 37 °C à l’aide d’un coussin chauffant avec surveillance continue par une sonde de température rectale. Appliquez une pommade vétérinaire sur les yeux pour prévenir la sécheresse pendant l’anesthésie.
- Effectuez une trachéotomie pour la respiration assistée par ventilateur. Avant d’ouvrir la poitrine pour exposer le cœur, lavez le site chirurgical à l’eau savonneuse, rasez la zone chirurgicale et nettoyez la zone avec des solutions antiseptiques telles que la chlorhexidine et l’iode. Utilisez des instruments stériles pour la procédure.
- Pour ouvrir la poitrine et exposer le cœur, utilisez des instruments chirurgicaux thoraciques stériles standard, notamment des ciseaux, des pinces et des écarteurs. Ouvrez la paroi thoracique et exposez le cœur. Identifiez l’artère descendante antérieure gauche (LAD) sous visualisation directe. Il s’agit d’une branche majeure de l’artère coronaire gauche qui se trouve à la surface du cœur. Utilisez une suture 6-0 (4-5 cm), ligaturez le DAL (antérieur gauche descendant) pendant 30 min pour induire une ischémie régionale. Déterminez l’occlusion efficace du DAL en observant une couleur pâle dans le myocarde.
- Après 30 min de ligature, relâchez la ligature et effectuez une reperfusion pendant 120 min. Déterminez la reperfusion du myocarde lorsqu’il retrouve une couleur rouge vif. Chez les rats avec une opération simulée, effectuez la même procédure mais sans ligature du LAD.
- Après la reperfusion, les rats sont restés sous anesthésie induite par le pentobarbital sodique (35 mg/kg, ip)34. Une fois que les rats sont sous anesthésie profonde, prélevez 1 à 2 ml d’échantillons de sang de l’aorte abdominale à l’aide d’un tube de prélèvement sanguin sous vide.
- Après le prélèvement d’un échantillon de sang dans l’aorte abdominale, euthanasiez les rats par luxation cervicale alors qu’ils sont encore sous anesthésie profonde. Prélevez le tissu myocardique de la zone de l’infarctus dans le ventricule gauche à l’aide de pinces et de ciseaux stériles, en veillant à ne prélever que le tissu qui semble pâle et endommagé, ce qui indique la région infarctus. Placez le tissu prélevé dans un récipient stérile pour une analyse plus approfondie.
2. Prélèvement d’échantillons
- Prélèvement d’échantillons de tissu : À l’aide de ciseaux stériles et d’une lame stérile, transectez le cœur horizontalement en deux moitiés le long du point médian de l’axe long du ventricule gauche, perpendiculairement à la direction du cœur. Divisez la moitié de la partie apicale en deux portions : conservez l’une dans du paraformaldéhyde à 4 % pour l’examen morphologique à température ambiante ou à 4 °C pendant 2 à 24 h, et l’autre dans du glutaraldéhyde pour la microscopie électronique à 4 °C pendant 1 à 4 h.
- Divisez la partie de base du cœur, y compris les zones ischémiques et non ischémiques, en deux parties : placez une portion dans un cryoflacon, congelez rapidement le tissu dans de l’azote liquide, puis transférez-le dans un congélateur à ultra-basse température de -80 °C pour des tests de biologie moléculaire. Utilisez l’autre portion fraîche pour la détection des niveaux d’espèces réactives de l’oxygène (ROS) dans les tissus et l’extraction mitochondriale.
- Prélèvement d’échantillons de sérum : À la fin de l’expérience, prélever 1 à 2 ml de sang veineux dans la veine cave inférieure, centrifuger à 1000 x g pendant 10 minutes et stocker le sérum dans un congélateur à ultra-basse température de -80 °C après la séparation.
3. Coloration HE et observation en microscopie électronique à transmission
- Effectuer une coloration HE (coloration à l’hématoxyline-éosine) sur le myocarde ventriculaire conformément à la procédurede routine 35. Fixez les tissus dans du paraformaldéhyde à 4 % pendant 24 h. Enrobez les échantillons dans de la paraffine, coupez-les en sections de 4 μm d’épaisseur et colorez-les à l’aide de la méthode de coloration à l’hématoxyline-éosine selon le protocole. Sélectionnez au hasard cinq champs pour observer les changements histopathologiques au microscope.
- Traitez les tissus myocardiques de rats qui ont été fixés dans du formol, de chaque groupe, pour des expériences de coloration HE en suivant les étapes ci-dessous.
- Placez les sections de tissu dans un incubateur à 65 °C pour une cuisson de 1,5 à 2 minutes.
- Immergez les sections de tissus dans le xylène pendant 10 min, remplacez le xylène et immergez à nouveau pendant 10 minutes supplémentaires. Immergez séquentiellement dans de l’alcool anhydre I et II pendant 5 minutes chacun, puis dans de l’alcool à 95 %, 90 %, 80 % et 70 %, et de l’eau distillée pendant 5 minutes chacun.
- Colorer avec de l’hématoxyline pendant 3 min. Effectuez une différenciation acide avec de l’acide chlorhydrique ajouté à de l’alcool pendant quelques secondes (1-2 s). Mettre fin à la différenciation dans l’eau du robinet pendant 5 min.
- Immerger dans de l’eau distillée à 70 %, 80 %, 90 % et 95 % d’alcool pendant 3 minutes chacun, et dans de l’alcool anhydre I et II pendant 5 minutes chacun.
- Colorer avec 0,5 % d’éosine dans de l’éthanol pendant 1 min, rincer les sections à l’éthanol à 95 % pour enlever l’excès de couleur rouge, puis plonger dans de l’éthanol anhydre pendant 5 min. Immerger dans le xylène I et II pendant 5 min chacun.
- Monter avec du baume neutre. Observer les changements pathologiques du tissu au microscope.
4. Détection ELISA des cytokines sanguines et des indices de lésions cardiaques
- Prélever un échantillon de sérum de rat à partir du sang périphérique par centrifugation à 1000 x g pendant 10 minutes et le conserver à −80 °C. Détectez les niveaux d’indices de lésions cardiaques tels que CK-MB, cTn-T, ICAM-1 et de cytokines inflammatoires telles que IL-1β, IL-6, TNF-α dans le sérum à l’aide de kits ELISA conformément aux instructions du fabricant et comme décrit ci-dessous.
- Laissez tous les réactifs s’équilibrer à la température ambiante (18-25 °C) pendant au moins 30 min, préparez les réactifs selon les instructions du fabricant et préparez-les à l’emploi.
- Mettre en place des puits d’étalonnage et d’échantillonnage, où les puits d’étalonnage contiennent des concentrations connues de solutions d’étalonnage fournies dans le kit d’essai. Ceux-ci sont utilisés pour établir une courbe standard au cours de l’expérience afin de quantifier la concentration spécifique de l’analyte dans les échantillons testés. Ajouter 100 μL d’étalon ou d’échantillon dans chaque puits, mélanger délicatement en agitant, couvrir avec un joint de plaque et incuber à 37 °C pendant 2 h.
- Jetez le liquide, séchez-le en le transvasant et ne le lavez pas. Ajouter 100 μL de solution d’anticorps marqués à la biotine (pré-diluée 1:100) dans chaque puits, couvrir avec un nouveau joint de plaque et incuber à 37 °C pendant 1 h.
- Jetez le liquide des puits, séchez-le par décantation et lavez la plaque 3x. Faire tremper pendant 2 min par lavage, 200 μL par puits, et sécher par décantation.
- Ajouter 100 μL de solution de travail de streptavidine marquée à la peroxydase de raifort dans chaque puits, couvrir d’un nouveau sceau de plaque et incuber à 37 °C pendant 1 h.
- Jetez le liquide des puits, séchez-le en le transvasant et lavez la plaque 5 fois. Faire tremper pendant 2 min par lavage, 200 μL par puits, et sécher par décantation.
- Ajouter séquentiellement 90 μL de solution de substrat dans chaque puits et développer la couleur dans l’obscurité à 37 °C pendant 15 à 30 min.
- Ajouter séquentiellement 50 μL de solution d’arrêt dans chaque puits pour terminer la réaction. Dans les 5 minutes suivant l’arrêt de la réaction, mesurez la densité optique (valeurs OD) de chaque puits en séquence à 450 nm à l’aide d’un lecteur de microplaques.
5. Mesure des niveaux de MDA, NO et LDH
- Après la reperfusion, prélever du tissu myocardique (5 mm x 7 mm) dans la région de l’infarctus dans le ventricule gauche. Détectez la LDH (lactate déshydrogénase) et la MDA (malondialdéhyde) à l’aide de la trousse de dosage de la LDH et de la trousse de dosage de la MDA, en suivant les instructions du fabricant. Détecter le NO à 550 nm à l’aide du kit de dosage de l’oxyde nitrique (NO) conformément aux instructions du fabricant.
6. Analyse par transfert Western
- Extraire les protéines totales des tissus ventriculaires du rat à l’aide de la lyse RIPA. Déterminez la concentration en protéines à l’aide du kit de dosage des protéines BCA.
- Pour préserver les protéines intracellulaires et éviter la dégradation cellulaire, plongez les échantillons dans de l’azote liquide pour les congeler rapidement. Par la suite, récupérez les échantillons congelés et broyez-les en poudre, prélevez environ 100 mg de l’échantillon et ajoutez-les dans un tube à centrifuger pré-refroidi de 1,5 ml. Ajouter 400 μL de tampon de lyse RIPA (supplément avec des inhibiteurs de la protéase et un inhibiteur de la phosphatase à large spectre), puis bien mélanger et laisser reposer le mélange à 4 °C pendant 60 min.
- Centrifuger le mélange à 1000 x g pendant 15 min à 4 °C. Prélever le surnageant et mesurer la concentration en protéines à l’aide de la méthode BCA.
- Diluer les étalons BSA avec un diluant qui correspond au système tampon des échantillons, conformément au tableau 1.
- Préparez les réactifs selon les instructions du fabricant. Sur la base du nombre d’échantillons, mélanger les réactifs A et B dans un rapport de volume de 50:1 pour préparer une quantité adéquate de solution de travail BCA et bien mélanger. Avant de préparer la solution de travail BCA, agitez le réactif A pour bien mélanger.
- Prélever 20 μL de solution étalon de BSA fraîchement préparée et des échantillons dilués (10 fois dilués) du tableau 1 et les ajouter à une plaque à 96 puits.
- Ajouter 200 μL de solution de travail BCA dans chaque puits et bien mélanger. Fermez la plaque, incubez à 37 °C pendant 30 min, puis laissez refroidir à température ambiante ou placez à température ambiante pendant 2 min.
- Mesurez l’absorbance à 562 nm à l’aide d’un lecteur de microplaques et calculez la concentration en protéines dans les échantillons sur la base de la courbe standard.
- Ajouter une quantité appropriée de 5 tampons de chargement SDS-PAGE (contenant du β-mercaptoéthanol) aux échantillons, traiter thermiquement à 100 °C dans de l’eau bouillante pendant 5 minutes pour dénaturer complètement les protéines, centrifuger à 1 000 x g pendant 5 minutes et prélever le surnageant pour l’utiliser.
- La formule du tableau 2 décrit la préparation de gels séparateurs à 15 %, 12 % et 8 %, ainsi que d’un gel à empiler à 5 %. Préparez les solutions en conséquence. Ajoutez la solution de gel de séparation à une hauteur de 2/3 dans la cassette de gel, recouvrez-la d’eau distillée et laissez-la reposer à température ambiante pendant 40 min. Ensuite, ajoutez le gel d’empilage pour remplir la cassette, insérez le peigne et laissez-le reposer pendant 10 min.
- Chargez 9 μL de marqueur protéique pré-coloré dans chaque puits et chargez 50 μg de protéine de l’échantillon par puits.
- Appliquez une tension constante de 80 V jusqu’à ce que le bleu de bromophénol atteigne le gel de séparation, puis appliquez une tension constante de 100 V pendant 90 min. Arrêter l’électrophorèse lorsque le bleu de bromophénol a migré vers la partie inférieure du gel.
- Une fois la FDS-PAGE terminée, plongez la membrane PVDF dans du méthanol pendant 10 s, rincez à l’eau distillée pendant 1 min, puis faites tremper le gel de polyacrylamide, le papier filtre et la membrane PVDF traitée dans un tampon de transfert pendant 10 min.
- Assemblez le sandwich de transfert avec le côté noir des clips vers le bas, suivi d’une éponge-filtre papier-gel-PVDF membrane-papier filtre-éponge-côté transparent des clips. Placez les clips dans la cassette de transfert, en vous assurant que le côté noir du clip fait face au côté noir de la cassette et que le côté blanc fait face au côté rouge. Effectuez le transfert à une tension constante de 100 V et utilisez une membrane PVDF avec un temps de transfert de 60 min.
- Après le transfert, lavez la membrane PVDF à l’eau 3x pendant 5 min chacune. Bloquez la membrane avec une solution bloquante contenant 5 % de lait écrémé en poudre pendant 1 h, puis lavez avec du TBST 3x pendant 5 min chacun.
- Diluer l’anticorps primaire avec du TBST selon les taux de dilution indiqués dans le tableau 3 et incuber à 4 °C pendant la nuit. Les anticorps primaires comprennent l’anticorps anti-NF-κB p65, l’anticorps anti-NF-κB Inducting Kinase (NIK), l’anticorps anti-IKKα et l’anticorps anti-β-actine.
- Rincez la membrane 3x avec 1x TBST pendant 5 min chacune. Ajouter l’anticorps secondaire correctement dilué (comme indiqué au tableau 3) et incuber à température ambiante pendant 1 h. Les anticorps secondaires sont les IgG anti-souris de chèvre conjuguées à HRP et les IgG anti-lapin de chèvre conjuguées à HRP.
- Rincez à nouveau la membrane avec 1x TBST 3x pendant 5 min chacun. Mélangez les solutions de développement A et B, ajoutez 2 mL à la membrane, puis détectez et photographiez à l’aide de l’instrument de chimiluminescence mini.
- Développer la membrane à l’aide d’un réactif de chimiluminescence améliorée. Numérisez le film développé à l’aide du système d’imagerie. Analysez les images du Western blot à l’aide d’un logiciel. Utilisez la β-actine comme contrôle de charge. Calculez le niveau relatif de protéines en fonction de la valeur de gris de la β-actine.
7. Analyse PCR en temps réel (qRT-PCR)
- Extraction totale de l’ARN
- Préparez une solution de DEPC à 0,1 % et de l’alcool traité au DEPC à 70 % selon les instructions du fabricant. Traitez toutes les tailles de tubes de microcentrifugation et divers types de pointes de pipette avec une solution de DEPC à 0,1 %. Tremper toute la nuit, puis autoclave.
- Collecter des cellules dans la phase de croissance logarithmique avec un bon état de croissance. Jetez le milieu de culture de la fiole de culture cellulaire et lavez les cellules 2 fois avec la solution de Hank. Ajouter 1 mL de trypsine par 10 cm² de cellules, agiter doucement pour détacher les cellules et utiliser une pipette pour assurer un détachement complet. Incuber à température ambiante pendant 5 min pour permettre une lyse complète, puis pipeter de haut en bas 7x-10x pour perturber complètement les cellules. Transférez le lysat dans des tubes de 1,5 ml, centrifugez-le et stockez le surnageant.
- Ajouter un volume égal de chloroforme au surnageant, bien mélanger et laisser reposer à température ambiante pendant 10 min. Centrifuger à 4 °C pendant 5 min à 1 000 x g pour séparer les phases. Transférez soigneusement la phase aqueuse supérieure dans un nouveau tube (si vous extrayez de l’ADN et des protéines, conservez la phase inférieure et stockez-la à 4 °C).
- Ajouter l’isopropanol (0,5 mL pour 1 mL de trizol), bien mélanger et laisser reposer à température ambiante pendant 10 min. Centrifugez à 4 °C pendant 10 min à 1 000 x g, retirez délicatement le surnageant et jetez-le.
- Lavez la pastille d’ARN avec de l’éthanol à 75 %, centrifugez-la à 4 °C pendant 5 min à 8 000 x g, retirez délicatement le surnageant et faites sécher la pastille à l’air libre ou sous vide. Dissoudre l’ARN dans 50 μL d’eau DEPC, aliquote et stocker à -70 °C ou procéder à la transcription inverse en ADNc.
- Transcription inverse en ADNc
- Effectuez la transcription inverse de l’ADNc à l’aide d’un kit en suivant les instructions du fabricant.
- PCR quantitative en temps réel
- Concevez des amorces basées sur des séquences de gènes et vérifiez-les à l’aide de BLAST sur le site Web du NCBI. Préparez des solutions mères de 10 μM d’amorces avant et arrière pour CK20 et β-actine. Le tableau 4 montre les séquences d’amorces.
- PCR quantitative en temps réel
- Ajoutez 1 μL d’ADNc, 10 μL de mélange maître 2x, 0,4 μL d’amorce avant et inverse chacun et 8,2 μL d’eau sans RNase dans le système réactionnel.
- Effectuer la PCR avec le programme suivant : Dénaturation initiale à 95 °C pendant 2 min, suivie de 40 cycles de 95 °C pendant 15 s et 60 °C pendant 1 min. Utilisez la β-actine comme contrôle interne. Calculer l’expression relative à l’aide de la méthode 2-ΔΔCt .
8. Analyse statistique
- Utilisez un logiciel commercial pour l’analyse statistique. Présenter les données sous forme de moyenne ± d’écart-type (moyenne ± ET). Effectuez une ANOVA à un facteur pour comparer les différences entre différents groupes. Définissez une différence significative comme p < 0,05.
Résultats
Munziq atténue les changements pathologiques induits par les lésions d’ischémie-reperfusion
Pour examiner les altérations morphologiques dans les tissus myocardiques, nous avons d’abord effectué une coloration EH. Comme le montre la coloration représentative de l’HE sur la figure 1, nous avons observé une dégénérescence granulaire et une dégénérescence vacuolaire dans certaines cellules myocardiques du groupe placebo. De plus, il y avait une présence limitée de globules rouges et une infiltration de lymphocytes entre les cellules myocardiques. Périodiquement, nous avons observé une dilatation et une congestion vasculaires. Les tissus myocardiques du groupe MIRI présentaient une déficience plus sévère et des changements morphologiques plus prononcés. Ces changements comprenaient une dégénérescence granulaire étendue, une dégénérescence vacuolaire, une infiltration de globules rouges et de lymphocytes, une dilatation vasculaire et une congestion. Les lésions du tissu myocardique dans le groupe MIRI ABF étaient plus graves que celles observées dans le groupe MIRI témoin. Cependant, dans les deux groupes de Munziq, certaines cellules myocardiques présentaient une légère dégénérescence granulaire et une dégénérescence vacuolaire. La présence de globules rouges et l’infiltration lymphocytaire, la dilatation vasculaire et la congestion étaient rares. De plus, les résultats indiquent que Munziq présente des effets cardioprotecteurs supérieurs chez les rats MIRI ABF et les rats MIRI témoins. En conclusion, ces résultats suggèrent que le prétraitement de Munziq a le potentiel d’atténuer les changements pathologiques induits par les lésions d’ischémie-reperfusion dans le cœur.
Munziq a amélioré la perturbation des mitochondries et des fibres musculaires cardiaques induite par les lésions d’ischémie/reperfusion
Pour vérifier davantage le rôle protecteur de Munziq dans les lésions MIRI, nous avons examiné l’ultrastructure mitochondriale et les fibres musculaires cardiaques à l’aide de la TEM. Comme le montre la figure 2, les cellules myocardiques du groupe placebo présentaient une structure intacte avec des myofibrilles étroitement disposées et une longueur de sarcomère similaire. La structure du myofilament semblait claire et légèrement lâche, tandis qu’un grand nombre de mitochondries ont été observées. À l’inverse, le groupe MIRI présentait des caractéristiques pathologiques indiquant des cellules myocardiques endommagées, notamment un gonflement cellulaire, une longueur de sarcomère variable, une structure myofilamentaire peu claire et peu disposée. Il a été noté qu’il y avait une perturbation et une dissolution importantes des mitochondries dans le groupe I/R par rapport au groupe fictif. De plus, les fibres du muscle cardiaque étaient irrégulières et fracturées en réponse à une lésion I/R. Il est intéressant de noter que la gravité de ces changements était nettement plus élevée dans le groupe MIRI d’ABF. En revanche, les deux groupes traités par Munziq présentaient des caractéristiques pathologiques atténuées associées à des cellules myocardiques endommagées. Le gonflement des cellules myocardiques a été réduit, et les structures des myofibrilles, du sarcomère, du myofilament et du nombre de mitochondries étaient similaires à celles observées dans le groupe placebo. Collectivement, ces données ont indiqué que le prétraitement de Munziq pourrait atténuer la perturbation des mitochondries et des fibres musculaires cardiaques induite par la chirurgie I/R.
Lésion d’ischémie-reperfusion myocardique exacerbée chez le rat ABF MIRI et Munziq avant le traitement a protégé la fonction cardiaque
Les taux sériques de cTn-T, CK-MB et ICAM-1 ont été détectés à l’aide de la méthode ELISA. Les résultats n’ont révélé aucune disparité perceptible entre le groupe témoin fictif et le groupe témoin ABF. Cependant, il convient de noter que le groupe MIRI ABF présentait des niveaux significativement élevés de cTn-T (figure 3A), CK-MB (figure 3B) et ICAM-1 (figure 3C) par rapport au groupe MIRI témoin. Afin d’évaluer les effets cardioprotecteurs de Munziq, les rats témoins MIRI et les rats ABF MIRI ont été soumis à un prétraitement Munziq. Comme le montre la figure 3, les taux de cTn-T, CK-MB et ICAM-1 ont été considérablement réduits dans le groupe de prétraitement de Munziq. Ces résultats suggèrent que Munziq présente des propriétés cardioprotectrices remarquables chez les rats ABF MIRI.
Pour étudier l’effet du prétraitement Munziq sur les lésions de stress oxydatif induites par l’ischiémie par reperfusion chez les rats ABF et témoins, les modifications de la LDH, de la MDA et du NO ont été mesurées dans le tissu myocardique. Comme le montre la figure 3D,F, le groupe MIRI ABF présentait des niveaux significativement élevés de MDA et des niveaux significativement diminués de NO par rapport au groupe MIRI témoin. Le prétraitement de Munziq a significativement diminué la teneur en LDH et en MDA dans le myocarde ischémique. Dans le même temps, le prétraitement de Munziq a encore augmenté le taux de NO dans le tissu myocardique.
Le prétraitement avec Munziq a atténué l’inflammation de l’IRMI en entravant la production de cytokines pro-inflammatoires
Les cytokines pro-inflammatoires jouent un rôle essentiel dans la médiation de la réponse immunitaire innée, et les cytokines pro-inflammatoires ont été activées au cours de MIRI31. Afin d’étudier plus en détail l’effet anti-inflammatoire de Munziq, les rats témoins MIRI et les rats MIRI ABF ont subi un prétraitement Munziq. Nous avons utilisé la méthode ELISA pour mesurer les taux sériques d’IL-1β, d’IL-6 et de TNF-α et l’analyse qRT-PCR afin d’évaluer les niveaux d’ARNm d’IL-1β, d’IL-6 et de TNF-α dans le tissu myocardique. Les résultats n’ont révélé aucune différence significative dans ces niveaux de cytokines entre le groupe témoin et le groupe ABF. Les niveaux d’IL-1β, d’IL-6 et de TNF-α étaient significativement régulés à la hausse dans le groupe MIRI ABF par rapport au groupe MIRI témoin. Plus précisément, l’IL-1β a montré une augmentation significative à la fois aux niveaux de l’ARNm et des protéines, avec une différence statistiquement significative observée. Bien qu’il n’y ait pas eu de différence dans le niveau d’ARNm pour l’IL-6, une disparité a été observée au niveau des protéines. De même, le TNF-α n’a montré aucune variation dans les niveaux d’ARNm, mais a montré des différences au niveau des protéines. Comme l’illustre la figure 4, les taux d’IL-1β, d’IL-6 et de TNF-α ont diminué de façon notable dans le groupe de prétraitement de Munziq.
Le prétraitement avec Munziq a atténué l’inflammation par la voie du signal NF-κB
La production de cytokines est étroitement liée à l’activation des voies de signalisation NF-κB dans la plupart des stades de la réponse inflammatoire. NF-κB est considéré comme une cible thérapeutique potentielle pour les affections inflammatoires32. Pour évaluer si la voie NF-κB est impliquée dans les effets anti-inflammatoires de Munziq, nous avons d’abord effectué une analyse Western Blot pour mesurer les niveaux d’expression des principaux constituants de la voie NF-κB, y compris NIK, IKKα, pIKKα et p6513. Comme le montre la figure 5, les lésions ischémiques et de reperfusion ont induit une régulation positive notable de NIK, p-IKKα et p-p65 au sein du groupe MIRI. Le traitement avec Munziq a efficacement atténué cette régulation à la hausse. Les résultats ont indiqué que Munziq joue un rôle essentiel dans l’anti-inflammation en supprimant l’activation de la voie de signalisation NF-κB.
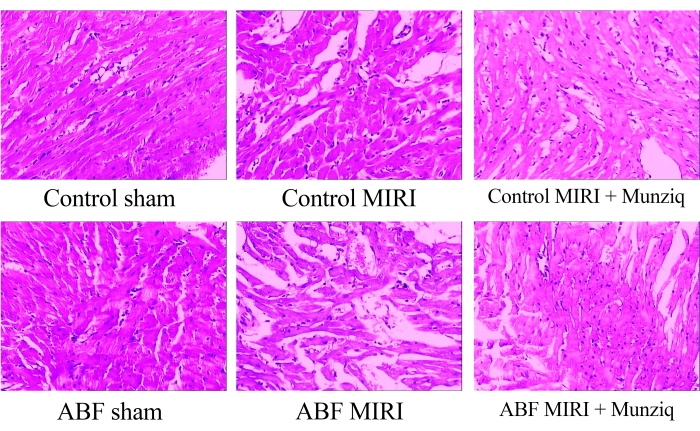
Figure 1 : Modifications morphologiques des tissus myocardiques observées par coloration HE. Des images représentatives de l’HE marquant des images de différents groupes. Grossissement : 100x. Abréviations : ABF = liquide corporel anormal ; MIRI = Lésion d’ischémie-reperfusion myocardique ; (n = 6). Veuillez cliquer ici pour voir une version agrandie de cette figure.
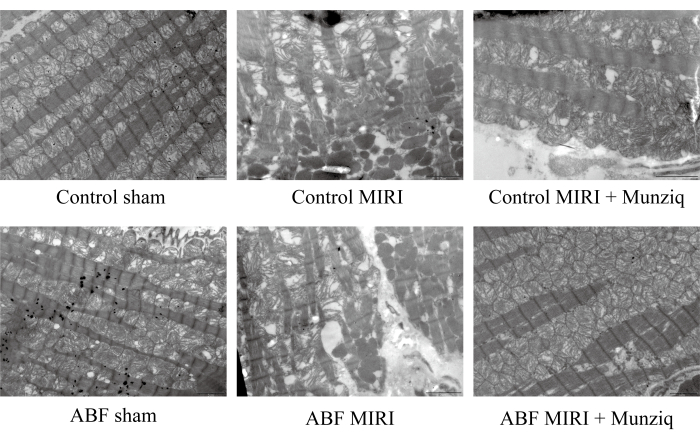
Figure 2 : Munziq a amélioré la perturbation des mitochondries et des fibres musculaires cardiaques induite par les lésions I/R. Un microscope électronique à balayage a été effectué pour observer l’ultrastructure des mitochondries et les changements des fibres musculaires cardiaques. Des images représentatives ont été présentées. Barre d’échelle : 5 μm ; (n=3). Veuillez cliquer ici pour voir une version agrandie de cette figure.
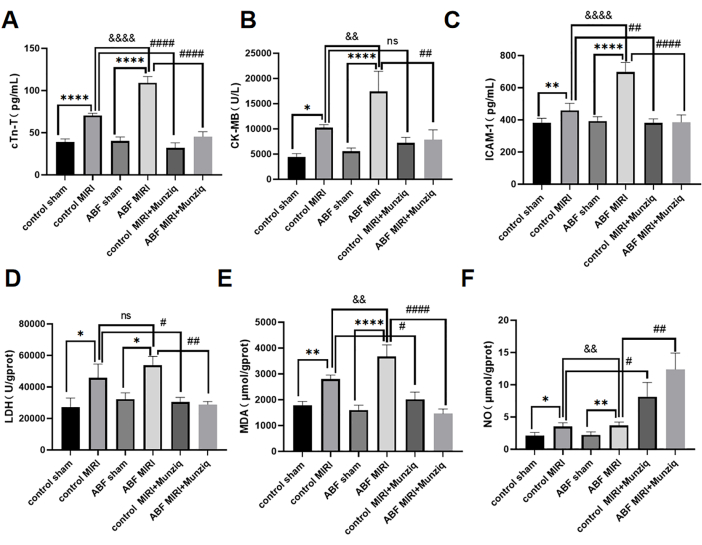
Figure 3 : Lésions d’ischémie-reperfusion myocardique exacerbées chez les rats ABF MIRI, et le prétraitement de Munziq pourrait protéger la fonction cardiaque. (A) Sérum cTn-T, (B) CK-MB et (C) ICAM-1. Les niveaux ont été détectés par ELISA, et les changements de LDH, MDA et NO ont été mesurés dans le tissu myocardique (n = 6). *p<0,05, ** p<0,01, ***p<0,001, ****p<0,0001 Par rapport au groupe fictif ; #p<0,05, ## p<0,01, ###p<0,001, ####p<0,0001 Par rapport au groupe MIRI ; &p<0,05, && p<0,01, &&&p<0,001, &&&&p<0,0001 par rapport au groupe témoin. Les données sont présentées sous forme de moyenne ± d’écart-type. L’analyse statistique a été effectuée à l’aide d’une ANOVA à un facteur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
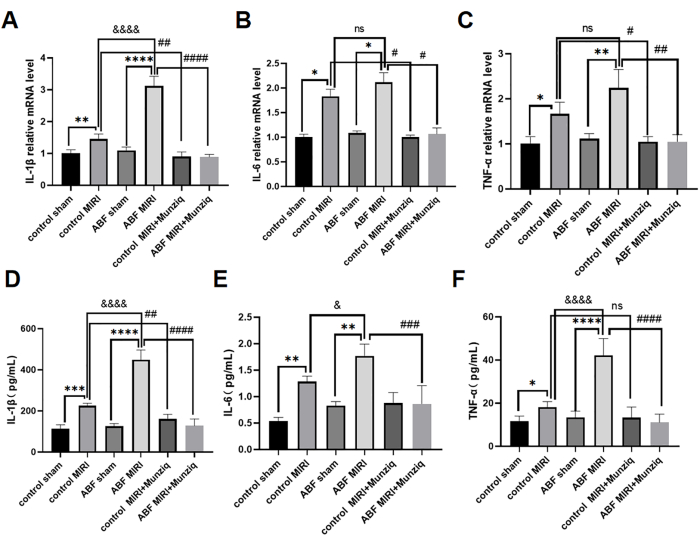
Figure 4 : Le prétraitement avec Munziq a atténué l’inflammation de l’IRIM en empêchant la production de cytokines pro-inflammatoires. La qRT-PCR a détecté les niveaux d’ARNm de (A) IL-1β, (B) IL-6 et (C) TNF-α dans le tissu myocardique. Mesurer les taux (D) d’IL-1β, (E) d’IL-6 et (F) de TNF-α dans le sérum par ELISA (n = 6). *p<0,05, ** p<0,01, ***p<0,001, ****p<0,0001 Par rapport au groupe fictif ; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 Par rapport au groupe MIRI ; &p<0,05, && p<0,01, &&&p<0,001, &&&&p<0,0001 Par rapport au groupe témoin. Les données sont présentées sous forme de moyenne ± d’écart-type. L’analyse statistique a été effectuée à l’aide d’une ANOVA à un facteur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
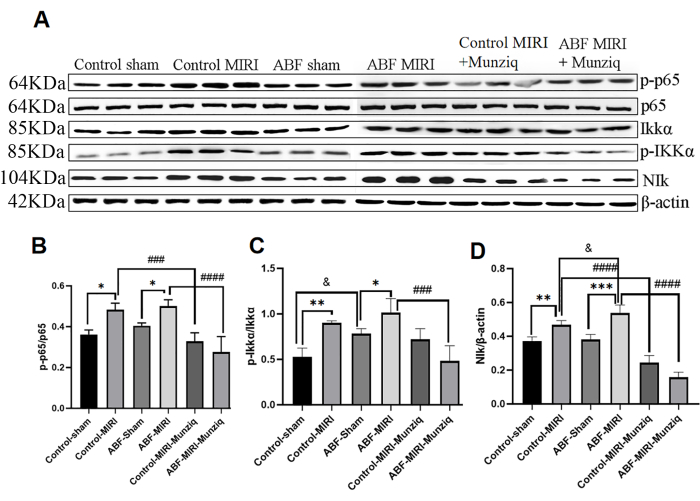
Figure 5 : Le prétraitement avec Munziq a atténué l’inflammation par la voie du signal NF-κB. L’expression des protéines p-IKKα, IKKα, p-p65, p65 et NIk dans le tissu myocardique a été détectée par Western blot (N = 3 pour chaque groupe). (A) Les bandes protéiques observées dans l’analyse par transfert Western. (B-D) Le niveau d’expression relatif est déterminé en fonction de la valeur de gris. *p<0,05, ** p<0,01, ***p<0,001, ****p<0,0001 Par rapport au groupe fictif ; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 Par rapport au groupe MIRI ; &p<0,05, && p<0,01, &&&p<0,001, &&&&p<0,0001 Par rapport au groupe témoin. Les données sont présentées sous forme de moyenne ± d’écart-type. L’analyse statistique a été effectuée à l’aide d’une ANOVA à un facteur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Numéro de tube | Volume du diluant (mL) | Volume BSA (Source) | Concentration finale de BSA (mg/mL) |
| Un | 0 | 20 (solution mère) | 500 |
| B | 2 | 18 (solution mère) | 400 |
| C | 4 | 16 (solution mère) | 300 |
| D | 6 | 14 (solution mère) | 200 |
| E | 8 | 12 (solution mère) | 150 |
| F | 12 | 8 (solution mère) | 100 |
| G | 16 | 4 (solution mère) | 50 |
| H | 20 | 0 (solution mère) | 0 |
Tableau 1 : Tableau de préparation de la concentration standard BSA.
| Gels de séparation | 15 % Gel Empilable | 12 % Gel Empilable | 8 % Gel Empilable | 5 % Gel Empilable | |
| Réactifs | Volume | Volume | Volume | Réactifs | Volume |
| Eau déminéralisée (mL) | 2.76 | 3.96 | 5.52 | Eau déminéralisée (mL) | 4 |
| 30 % d’acrylamide (mL) | 6 | 4.8 | 3.24 | 30 % d’acrylamide (mL) | 1 |
| 1.5mol/lTris.HCl(PH8.8)(mL) | 3 | 3 | 3 | 1,0 M Tris.HCl (pH 6,8 ; mL) | 1 |
| 10 % SDS (μL) | 120 | 120 | 120 | 10 % SDS (μL) | 80 |
| 10 % AP(μL) | 120 | 120 | 120 | 10 % AP(μL) | 60 |
| TEMED(μL) | 4.8 | 4.8 | 7.2 | TEMED(μL) | 8 |
| Volume total (mL) | 12 | 12 | 12 | Volume total (mL) | 6 |
Tableau 2 : Préparation de la concentration du gel.
| Anticorps primaire | Taux de dilution | Anticorps secondaires | Taux de dilution |
| β-actine | 1:1000 | IgG H&L ANTI-SOURIS de chèvre (HRP) | 1:15000 |
| p. 65 [traduction] | 1:1000 | Chèvre anti-Lapin IgG H&L (HRP) | 1:5000 |
| P-P65 | 1:300 | 1:5000 | |
| BCL-2 | 1:1000 | 1:5000 | |
| BAX | 1:1000 | 1:5000 | |
| Drp1 | 1:800 | 1:5000 | |
| Fis1 | 1:1000 | 1:5000 | |
| Mfn2 | 1:800 | 1:5000 |
Tableau 3 : Taux de dilution des anticorps.
| Gène | Séquence d’amorçage (5' à 3') | ||
| IL-1β-F | CTGTGACTCGTGGGATGATG | ||
| IL-1β-R | GGGATTTTGTCGTTGCTTGT | ||
| TNF-α-F | GCCTCTCTCTCTGCCATCAAG | ||
| TNF-α-R | CTCCAAAGTAGACCTGCCCG | ||
| L’IL-6-F | GCCCACCAGGAACGAAAGTC | ||
| L’IL-6-R | GGCAACTGGCTGGGAGTCTC | ||
| bêta-actine-F | CCCATCTATGAGGGTTACGC | ||
| bêta-actine-R | TTTAATGTCACGCACGATTTC | ||
Tableau 4 : Séquences d’amorces.
Discussion
MIRI, qui signifie lésion d’ischémie-reperfusion myocardique, est une complication courante et importante qui survient après une reperfusion myocardique en chirurgie cardiaque36,37, peu de médicaments ou d’adjuvants ont définitivement amélioré les résultats cliniques par rapport aux témoins contemporains38. Par conséquent, il est urgent de mettre au point des thérapies efficaces pour protéger le cœur contre de telles blessures. Munziq, une préparation traditionnelle à base de plantes, a démontré certains effets thérapeutiques sur les lésions d’ischémie-reperfusioncardiaque 27,28,30. Cependant, ces résultats sont préliminaires et les mécanismes sous-jacents restent inconnus. Le but de cette étude était d’étudier et de valider davantage les effets et les mécanismes protecteurs de Munziq sur MIRI.
Selonla médecine traditionnelle ouïghoure, les fluides corporels anormaux sont une manifestation courante de diverses maladies chroniques, y compris les maladies cardiovasculaires. Dans le système médical ouïghour, on pense que l’ABF est le résultat d’un stress à long terme et est considérée comme la source de diverses maladies39. Dans cette étude, un modèle de fluide corporel anormal a été utilisé pour simuler les caractéristiques sous-jacentes des maladies cardiovasculaires nécessitant une chirurgie cardiaque. L’IRM a été induite chez des rats avec ABF pour déterminer la lésion d’ischémie-reperfusion myocardique.
La lésion d’ischémie et de reperfusion est une affection pathologique complexe qui implique plusieurs processus. Il a été rapporté que l’ischémie-reperfusion dans le cœur entraîne des altérations pathologiques du myocarde4. Ces changements pathologiques se manifestent principalement par des cardiomyocytes raccourcis, une structure sarcomérique perturbée, un gonflement mitochondrial41 et des myofibrilles sarcomériques faiblement arrangées, comme observé dans cette étude. Les lésions myocardiques entraînent également des altérations des enzymes sériques. Il est bien connu que les taux de cTnT, CK-MB et ICAM-1 dans le sérum augmentent après une lésion myocardique42,43. Par conséquent, ces biomarqueurs sont utilisés pour évaluer l’étendue des lésions aiguës du myocarde. Dans cette étude, nous avons observé les changements pathologiques du myocarde et l’élévation des enzymes sériques après une lésion d’ischémie-reperfusion, indiquant l’établissement réussi du modèle MIRI. Les résultats ont montré que les lésions myocardiques dans le groupe ABF MIRI étaient plus graves que dans le groupe témoin MIRI. Après le traitement par Munziq, les changements pathologiques ont été sensiblement atténués et les taux d’enzymes sériques ont considérablement diminué. Collectivement, ces résultats démontrent les effets cardioprotecteurs de Munziq pendant l’IRMI.
Dans cette étude, l’artère descendante antérieure gauche (DAL) a été ligaturée pendant 30 min, suivie d’une reperfusion pendant 120 min pour établir un modèle de lésion d’ischémie-reperfusion chez le rat. Une méta-analyse44 résumant 43 études utilisées pour créer des modèles de lésions d’ischémie-reperfusion chez le rat a indiqué que les temps d’ischémie variaient de 30 à 60 minutes, avec une durée de reperfusion de 30 à 120 minutes. Certaines études ont adopté un protocole de 5 min d’ischémie suivi de 5 min de reperfusion, répétée 4x45. Parmi ces méthodes, c’est un protocole de 30 min d’ischémie et 120 min de reperfusion qui a été le plus fréquemment utilisé, apparaissant dans 19 cas. Au cours du processus expérimental, nous avons observé une coloration pâle du myocarde par inspection visuelle directe après 30 min d’ischémie. En plus de l’évaluation visuelle des changements de couleur du myocarde, la surveillance par électrocardiogramme (ECG) a été utilisée pour identifier les signes d’ischémie, tels que l’élévation du segment ST. Les marqueurs sériques, y compris la troponine et la créatine kinase, ainsi que les paramètres hémodynamiques tels que la fréquence cardiaque (FC), la pression diastolique ventriculaire gauche (LVDP) et la pression systolique ventriculaire gauche (LVSP), peuvent tous servir d’indicateurs pour évaluer l’efficacité du modèle d’ischémie46. Dans cette étude, nous nous sommes principalement appuyés sur l’observation visuelle pour évaluer les effets de l’ischémie et de la reperfusion. En raison des variations individuelles entre les rats, il est conseillé de compléter l’inspection visuelle par des mesures objectives supplémentaires pour évaluer l’efficacité de l’ischémie plutôt que d’appliquer une durée ischémique uniforme à tous les rats.
Chez les mammifères, la famille NF-κB se compose de cinq membres, dont l’un est p65 13,47. Il existe deux voies principales d’activation de NF-κB dans les cellules47. Dans la voie canonique, l’activation du complexe IKK (IKKα, IKKβ et IKKγ) conduit à la phosphorylation des protéines IκB, initiant l’activation de NF-κB. Dans la voie non canonique NF-κB, l’activation de NF-κB est médiée par la phosphorylation de NIK et IKKα. De nombreuses preuves suggèrent que la voie NF-κB joue un rôle crucial dans la médiation de l’ischémie et des lésions de reperfusion 48,49,50. Interférer avec l’activation de NF-κB peut atténuer les lésions induites par l’ischémie et la reperfusion51,52. Il est intéressant de noter qu’il y avait plus d’activation de la voie de signalisation NF-κB dans le groupe ABF MIRI et des niveaux plus élevés de cytokines inflammatoires en aval.
Il a été démontré que de nombreux médicaments de la médecine traditionnelle chinoise exercent des effets protecteurs contre l’ischémie et les lésions de reperfusion en modulant la voie NF-κB. Par exemple, Liu et al.53 ont constaté que la quercétine atténuait l’IRM en inhibant la voie NF-κB. Han et al.54 ont rapporté que le jaune d’hydroxysafflor A atténuait le MIRI en inhibant la signalisation TLR4/NF-κB. Cependant, la question de savoir si Munziq exerce un rôle protecteur dans MIRI par le biais de la voie de signalisation NF-κB reste inexplorée. Pour élucider davantage le mécanisme de Munziq, cette étude a analysé les niveaux d’expression des nœuds clés de la voie de signalisation NF-κB, y compris NIK, IKKα, pIKKα et p65. Les résultats ont démontré que les niveaux d’expression de ces protéines étaient significativement régulés à la baisse après le traitement par Munziq, indiquant que Munziq inhibe l’expression des nœuds clés de la voie de signalisation NF-κB pendant MIRI.
Il existe de nombreuses preuves soutenant l’idée que l’activation de NF-κB déclenche la production de protéines inflammatoires et de molécules d’adhésion, entraînant le recrutement des lymphocytes55. Par exemple, Valen et al.56 ont découvert que NF-κB était activé et que les niveaux d’IL-1β et de TNF-α étaient élevés pendant l’ischémie/reperfusion myocardique. De plus, l’IL-6, une cytokine pro-inflammatoire régulée par NF-κB, présente une expression accrue pendant la reperfusion57. Conformément à ces résultats, les résultats de cette étude démontrent que Munziq inhibe significativement les niveaux de cytokines pro-inflammatoires (y compris l’IL-1β, l’IL-6 et le TNF-α) dans le contexte de l’ischémie/reperfusion myocardique (MIRI). On peut en déduire que Munziq exerce ses effets inhibiteurs sur l’expression des cytokines pro-inflammatoires en supprimant la voie de signalisation NF-κB.
En conclusion, les résultats suggèrent que l’IRIM était plus grave dans l’ABF. Munziq a des effets cardioprotecteurs dans l’ischémie et les lésions de reperfusion. Cet effet protecteur peut être exercé en supprimant la voie de signalisation NF-κB. Ces résultats suggèrent que Munziq présente un grand potentiel en tant qu’agent thérapeutique pour protéger le cœur contre les lésions de reperfusion pendant la chirurgie cardiaque.
L’étude présente plusieurs limites. Tout d’abord, l’étude est menée dans un modèle de rat qui, bien qu’il s’agisse d’un modèle translationnel précieux, pourrait ne pas reproduire pleinement la complexité de la maladie cardiovasculaire humaine. Deuxièmement, l’étude se concentre principalement sur la voie de signalisation NF-κB en tant que fondement mécaniste des effets de Munziq. Cependant, l’IRIM est un processus multifactoriel qui peut impliquer diverses autres voies de signalisation et mécanismes moléculaires.
Bien que l’étude actuelle fournisse des informations précieuses sur les effets cardioprotecteurs potentiels de Munziq dans un modèle de rat de lésion d’ischémie-reperfusion myocardique (MIRI), en particulier dans le contexte d’un liquide corporel anormal (ABF), il existe plusieurs domaines à explorer à l’avenir. Une piste pour d’autres recherches consiste à mener des études in vitro à l’aide de cardiomyocytes en culture pour observer directement les effets de Munziq sur les réponses cellulaires à l’ischémie et à la reperfusion. De plus, l’adoption d’une approche multi-omique pourrait offrir une vue plus complète des changements moléculaires associés au traitement par Munziq, révélant potentiellement des voies et des mécanismes supplémentaires qui contribuent à ses effets cardioprotecteurs. Il serait également bénéfique d’explorer différentes doses de Munziq afin de déterminer la dose optimale pour une cardioprotection maximale tout en minimisant les effets secondaires potentiels. Des études à long terme sont nécessaires pour évaluer les effets durables de Munziq sur la fonction cardiaque et pour surveiller tout effet indésirable potentiel associé à une utilisation prolongée.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
CONTRIBUTION DE L’AUTEUR :
Duolikun Mutailifu a réalisé les expériences, Abudusaimi Aini a rédigé la première ébauche du manuscrit et analysé les données ; Aili Aibibula a contribué à la conception et à la conception de l’étude ; Zheng Liu et Abudunaibi Maimaitiaili ont participé à la conception de l’étude ; Abudunaibi Maimaitiaili a organisé les fonds d’étude ; et tous les auteurs ont lu et approuvé le manuscrit final.
Remerciements
Ce travail a été soutenu par la Fondation nationale des sciences naturelles de Chine [numéro de subvention : 82060907] et le programme de culture des talents médicaux et de santé de haut niveau « Tianshan Elite » [subvention n°. TSYC202301B004].
matériels
| Name | Company | Catalog Number | Comments |
| ABI 7500 Real-time PCR | ABI, CA, USA | Used for performing qRT-PCR. | |
| Adult male Sprague-Dawley (SD) rat | Animal Experimental Center of Xinjiang Medical University | ||
| Anti-NF-kB p65, anti-NF-kB Inducing Kinase NIK, anti-IKK alpha, anti-IKK alpha (phospho T23), anti-β-actin | Abcam, CA, USA | Used for Western blot analysis targeting specific proteins. | |
| Anti-TTC11/FIS1 Antibody | abcam | ab71498 | Used for protein detection in Western Blot (WB) experiments. |
| BCA Protein Assay Kit | Tiangen Biotech Co., Ltd., Beijing, China | Used for determining protein concentration. | |
| beta-Actin Loading Control antibody Mouse Mab | Sino Biological | 100166-MM10 | Used for protein detection in Western Blot (WB) experiments. |
| ChemiScope 3300 Imaging System | Clinx Science Instruments, Shanghai, China | Used for scanning developed films from Western blot analysis. | |
| ELISA kit for CK-MB detection | Nanjing Jiancheng Bioengeering Institute(Nanjing, China) | Used for detecting levels of cardiac injury indexes | |
| ELISA kit for cTn-T, ICAM-1, IL-1β, IL-6, TNF-α detection | CUSABIO Biotech CO., Ltd. (Wuhan, China) | Used for detecting levels of cardiac injury indexes and inflammatory cytokines in rat serum samples. | |
| FastQuant RT Kit | TIANGEN, Beijing China | Used for reverse transcription of cDNA. | |
| HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG | Thermo Scientific, Basingstoke, UK | ||
| LDH Assay kit and MDA Assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting LDH and MDA levels in myocardium tissues from the infarct area in the left ventricle. | |
| Munziq | provided by Xinjiang Medical University | The main investigational drug in this study | |
| NF-κB p65 (D14E12) XP Rabbit mAb #8242 | CST | 8242S | Used for protein detection in Western Blot (WB) experiments. |
| Nitric Oxide (NO) assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting NO levels at 550 nm in myocardial tissue. | |
| Phospho-NF-κB p65 (Ser536) (93H1) Rabbit mAb #3033 | CST | 3033S | Used for protein detection in Western Blot (WB) experiments. |
| Quantity One software | Bio-Rad Laboratories, Hercules, CA, USA | Used for analyzing Western blot images. | |
| Recombinant Anti-DRP1 Antibody | abcam | ab184247 | Used for protein detection in Western Blot (WB) experiments. |
| RIPA lysis buffer | Boster Biotechnology Co., Ltd., Wuhan, China | AR0105 | Used for extracting total proteins from rat ventricular tissues. |
| Secondary antibodies (HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG) | Thermo Scientific, Basingstoke, UK | Used for detection following primary antibody incubation in Western blot analysis. | |
| SYBR Select Master Mix | ABI, CA, USA | Used in qRT-PCR analysis on ABI 7500 Real-time PCR instrument. | |
| transmission electron microscope | HitachiS-2400 Hitachi, Tokyo, Japan | Used to examine thin sections of ventricular tissues. | |
| Trizol reagent | Invitrogen Co., Carlsbad, California, USA | Used for RNA extraction from ventricular tissues. |
Références
- Anderson, J. L., Campion, E. W., Morrow, D. A. Acute myocardial infarction. New Engl J Med. 376 (21), 2053-2064 (2017).
- Vos, T., et al. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet. 396 (10258), 1204-1222 (2020).
- Murphy, A., Goldberg, S. Mechanical complications of myocardial infarction. Am J Med. 135 (12), 1401-1409 (2022).
- Heusch, G. Myocardial ischemia/reperfusion: Translational pathophysiology of ischemic heart disease. Medicine. 5 (1), 10-31 (2024).
- Bhatt, D. L., Lopes, R. D., Harrington, R. A. Diagnosis and treatment of acute coronary syndromes. Jama. 327 (7), 662-675 (2022).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: A target for cardioprotection. Cardiovasc Res. 115 (7), 1143-1155 (2019).
- Gunata, M., Parlakpinar, H. A review of myocardial ischaemia/reperfusion injury: Pathophysiology, experimental models, biomarkers, genetics and pharmacological treatment. Cell Biochem Funct. 39 (2), 190-217 (2020).
- He, J., et al. Myocardial ischemia/reperfusion injury: Mechanisms of injury and implications for management (review). Exp Ther Med. 23 (6), 430 (2022).
- Xiang, M., et al. Role of oxidative stress in reperfusion following myocardial ischemia and its treatments. Oxid Med Cell Longevity. 2021, 1-23 (2021).
- Astudillo, A. M., Balboa, M. A., Balsinde, J. Compartmentalized regulation of lipid signaling in oxidative stress and inflammation: Plasmalogens, oxidized lipids and ferroptosis as new paradigms of bioactive lipid research. Prog Lipid Res. 89, 101207 (2023).
- Algoet, M., et al. Myocardial ischemia-reperfusion injury and the influence of inflammation. Trends Cardiovasc Med. 33 (6), 357-366 (2023).
- Zhang, F., et al. Β-cryptoxanthin alleviates myocardial ischaemia/reperfusion injury by inhibiting nf-κb-mediated inflammatory signalling in rats. Arch Physiol Biochem. 128 (4), 1128-1135 (2020).
- Guo, Q., et al. Nf-κb in biology and targeted therapy: New insights and translational implications. Signal Transduct Target Ther. 9 (1), 53 (2024).
- Mi, J., et al. Inhibition of heat shock protein family a member 8 attenuates spinal cord ischemia-reperfusion injury via astrocyte nf-κb/nlrp3 inflammasome pathway. J Neuroinflammation. 18 (1), 170 (2021).
- Zhang, L., Zhao, S., Wang, Y. Diannexin alleviates myocardial ischemia-reperfusion injury by orchestrating cardiomyocyte oxidative damage, macrophage polarization and fibrotic process by tlr4-nf-kb-mediated inactivation of nlrp3 inflammasome. Int Immunopharmacol. 130, 111668 (2024).
- Zhou, Y., et al. Qingchang mixture prevents the intestinal ischemia-reperfusion injury through tlr4/nf-kb pathway. Combinatorial Chem High Throughput Screen. 26 (1), 49-57 (2023).
- Ozturk, A., et al. The protective effects of trimetazidine against ovary ischemia-reperfusion injury via the tlr4/nf-kb signal pathway. J Biochem Mol Toxicol. 36 (8), e23114 (2022).
- Du, S., Deng, Y., Yuan, H., Sun, Y. Safflower yellow b protects brain against cerebral ischemia reperfusion injury through ampk/nf-kb pathway. Evid Based Compl Alt Med. 2019, 1-11 (2019).
- Dong, X., et al. Physcion protects rats against cerebral ischemia-reperfusion injury via inhibition of tlr4/nf-kb signaling pathway. Drug Design Dev Therapy. 15, 277-287 (2021).
- Hashmi, S., et al. Hydrogen sulphide treatment prevents renal ischemia-reperfusion injury by inhibiting the expression of icam-1 and nf-kb concentration in normotensive and hypertensive rats. Biomolecules. 11 (10), 1549 (2021).
- Gao, L., et al. Hic-5 deficiency attenuates hepatic ischemia reperfusion injury through tlr4/nf-κb signaling pathways. Life Sciences. 249, 117517 (2020).
- Xu, Z., et al. Cardioprotection of mab2g4/odn/lip on myocardial ischemia-reperfusion injury via inhibiting the nf-κb signaling pathway. Cardiovas Ther. 2023, 1-15 (2023).
- Xiao, G., et al. Cxcr1 and its downstream nf-κb inflammation signaling pathway as a key target of guanxinning injection for myocardial ischemia/reperfusion injury. Front Immunol. 13, 1007341 (2022).
- Jeddi, S., Gheibi, S., Kashfi, K., Carlström, M., Ghasemi, A. Dose-dependent effects of long-term administration of hydrogen sulfide on myocardial ischemia-reperfusion injury in male wistar rats: Modulation of rkip, nf-κb, and oxidative stress. Int J Mol Sci. 21 (4), 1415 (2020).
- Yao, Y., et al. Targeting camkii-δ9 ameliorates cardiac ischemia/reperfusion injury by inhibiting myocardial inflammation. Circ Res. 130 (6), 887-903 (2022).
- Zhuang, L., Zong, X., Yang, Q., Fan, Q., Tao, R. Interleukin-34-nf-κb signaling aggravates myocardial ischemic/reperfusion injury by facilitating macrophage recruitment and polarization. eBioMedicine. 95, 104744 (2023).
- Maimaitiaili, A., et al. Effects of different doses of savda munziq on myocardial ischemia-reperfusion injury in rats with abnormal savda syndrome. Genet Mol Res. 13 (3), 4729-4735 (2014).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Hao, Y., et al. Transition of the abnormal savda syndrome to the hepatic carcinoma shifted unfolded protein response to autophagy was partly reversed by savda munziq in a rat model. Biomed Pharmacother. 121, 109643 (2020).
- Maimaitiaili, A., Li, J., Aibibula, A., Abudureheman, M. Erratum: Inhibition of nuclear factor kappa b pathway protects myocardial ischemia/reperfusion injury in rats under treatment with fufang munziq granule (munziq). Am J Transl Res. 10 (11), 3876 (2018).
- Zhang, X., et al. Rosa rugosa flavonoids alleviate myocardial ischemia reperfusion injury in mice by suppressing jnk and p38 mapk. Microcirculation. 24 (7), (2017).
- Dong, P., Liu, K., Han, H. The role of nf-κb in myocardial ischemia/reperfusion injury. Curr Prot Peptide Sci. 23 (8), 535-547 (2022).
- Guo, X., et al. Differential integrative omic analysis for mechanism insights and biomarker discovery of abnormal savda syndrome and its unique munziq prescription. Sci Rep. 6, 27831 (2016).
- Awad, A. S. Role of at1 receptors in permeability of the blood-brain barrier in diabetic hypertensive rats. Vascul Pharmacol. 45 (3), 141-147 (2006).
- La, X., et al. Upregulation of pd-1 on cd4(+)cd25(+) t cells is associated with immunosuppression in liver of mice infected with echinococcus multilocularis. Int Immunopharmacol. 26 (2), 357-366 (2015).
- Wu, T., et al. Circulating small extracellular vesicle-encapsulated sema5a-it1 attenuates myocardial ischemia-reperfusion injury after cardiac surgery with cardiopulmonary bypass. Cell Mol Biol Lett. 27 (1), 95 (2022).
- Pinto, A., et al. The extracellular isoform of superoxide dismutase has a significant impact on cardiovascular ischaemia and reperfusion injury during cardiopulmonary bypass. Eur J Cardio-Thor Surg. 50 (6), 1035-1044 (2016).
- Sabe, S. A., Harris, D. D., Broadwin, M., Sellke, F. W. Cardioprotection in cardiovascular surgery. Basic Res Cardiol. 119 (4), 545-568 (2024).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Mamtimin, B., et al. An magnetic resonance-based plasma metabonomic investigation on abnormal savda in different complicated diseases. J Tradl Chinese Med. 34 (2), 166-172 (2014).
- Marin, W., Marin, D., Ao, X., Liu, Y. Mitochondria as a therapeutic target for cardiac ischemia-reperfusion injury (review). Int J Mol Med. 47 (2), 485-499 (2020).
- Novack, V., et al. Troponin criteria for myocardial infarction after percutaneous coronary intervention. Arch Intern Med. 172 (6), 502-508 (2012).
- Kemp, M., Donovan, J., Higham, H., Hooper, J. Biochemical markers of myocardial injury. Br J Anaesth. 93 (1), 63-73 (2004).
- Zhang, D. Z., Jia, M. Y., Wei, H. Y., Yao, M., Jiang, L. H. Systematic review and meta-analysis of the interventional effects of resveratrol in a rat model of myocardial ischemia-reperfusion injury. Front Pharmacol. 15, 1301502 (2024).
- Ta, F. X., Zhang, T., Zhu, C. M. Correlation between mir-21 and the protective effects of resveratrol against myocardial ischemia/reperfusion injury in rats. Chin. J. Arteriosclerosis. 21 (6), 493-496 (2013).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. Am J Physiol Heart Circ Physiol. 314 (4), H812-H838 (2018).
- Oeckinghaus, A., Hayden, M. S., Ghosh, S. Crosstalk in nf-kappab signaling pathways. Nat Immunol. 12 (8), 695-708 (2011).
- Van Der Heiden, K., Cuhlmann, S., Luong Le, A., Zakkar, M., Evans, M. Role of nuclear factor kappab in cardiovascular health and disease. Clin Sci. 118 (10), 593-605 (2010).
- Ha, T., et al. Toll-like receptors: New players in myocardial ischemia/reperfusion injury. Antioxid Redox Signal. 15 (7), 1875-1893 (2011).
- Pourrajab, F., Yazdi, M. B., Zarch, M. B., Zarch, M. B., Hekmatimoghaddam, S. Cross talk of the first-line defense tlrs with pi3k/akt pathway, in preconditioning therapeutic approach. Mol Cell Ther. 3, 4 (2015).
- Wang, Y. H., et al. Lumbrokinase attenuates myocardial ischemia-reperfusion injury by inhibiting tlr4 signaling. J Mol Cell Cardiol. 99, 113-122 (2016).
- Yu, H., et al. Gypenoside protects cardiomyocytes against ischemia-reperfusion injury via the inhibition of mitogen-activated protein kinase mediated nuclear factor kappa b pathway in vitro and in vivo. Front Pharmacol. 7, 148 (2016).
- Liu, X., et al. Peroxisome proliferator-activated receptor gamma (ppargamma) mediates the protective effect of quercetin against myocardial ischemia-reperfusion injury via suppressing the nf-kappab pathway. Am J Transl Res. 8 (12), 5169-5186 (2016).
- Han, D., et al. Hydroxysafflor yellow a alleviates myocardial ischemia/reperfusion in hyperlipidemic animals through the suppression of tlr4 signaling. Sci Rep. 6, 35319 (2016).
- Yang, Q., He, G. W., Underwood, M. J., Yu, C. M. Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury: Perspectives and implications for postischemic myocardial protection. Am J Transl Res. 8 (2), 765-777 (2016).
- Valen, G., Paulsson, G., Vaage, J. Induction of inflammatory mediators during reperfusion of the human heart. Ann Thorac Surg. 71 (1), 226-232 (2001).
- Saini, H. K., et al. Role of tumour necrosis factor-alpha and other cytokines in ischemia-reperfusion-induced injury in the heart. Exp Clin Cardiol. 10 (4), 213-222 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon