Research Article
Herbal Munziq melhora a lesão de isquemia-reperfusão miocárdica inibindo a inflamação
Neste Artigo
Resumo
Este estudo investiga os efeitos cardioprotetores do Munziq, uma preparação tradicional de ervas uigur, na lesão de isquemia-reperfusão miocárdica (MIRI) em ratos com fluido corporal anormal. Por meio de métodos experimentais abrangentes, demonstramos o potencial de Munziq para mitigar o MIRI suprimindo a via de sinalização NF-κB.
Resumo
O objetivo deste estudo foi investigar os efeitos cardioprotetores do Munziq na lesão anormal de isquemia-reperfusão miocárdica (MIRI) do fluido corporal e seu mecanismo subjacente. Ratos normais e ratos com fluido corporal anormal (ABF) foram pré-tratados com Munziq por 21 dias. Em seguida, os modelos MIRI foram estabelecidos. Alterações histopatológicas e alterações da ultraestrutura miocárdica foram observadas pela coloração de Hematoxilina e Eosina (HE) e microscopia eletrônica de transmissão para observar manifestações patológicas de lesão miocárdica. Os níveis séricos de CK-MB, cTn-T e ICAM-1 foram detectados por ensaio imunoenzimático (ELISA) para observar marcadores relacionados à lesão miocárdica. Os níveis de IL-1β, IL-6 e TNF-α no soro e no tecido miocárdico também foram detectados por ELISA para observar o efeito anti-inflamatório. Os níveis de expressão das proteínas relacionadas à via de sinalização NF-κB NIK, IKKα, Pikα e p65 foram detectados pela análise de Western blot. Os resultados mostraram que a lesão miocárdica no grupo MIRI ABF foi mais grave em comparação com o grupo MIRI controle. O pré-tratamento com Munziq tem o potencial de mitigar as alterações patológicas induzidas pela lesão de isquemia-reperfusão e pode proteger a função cardíaca. Os níveis de proteína da via NF-κB e dos efetores a jusante IL-1β, IL-6 e TNF-α foram significativamente regulados positivamente no grupo MIRI, enquanto regulados negativamente no grupo Munziq. Curiosamente, houve mais ativação da via de sinalização NF-κB e níveis mais altos de citocinas inflamatórias a jusante no grupo ABF MIRI. Os resultados sugerem que o MIRI foi mais grave no ABF. Munziq tem efeitos cardioprotetores na lesão de isquemia e reperfusão. Este efeito protetor pode ser atuado suprimindo a via de sinalização NF-κB.
Introdução
A isquemia miocárdica é uma condição em que o miocárdio não recebe fluxo sanguíneo adequado, causada principalmente por estenose ou trombose das artérias coronárias1, o que pode levar a desfechos fatais para os pacientes 2,3. Como o metabolismo miocárdico é quase exclusivamente aeróbico e contém estoques de glicogênio muito limitados, é essencial restaurar o suprimento sanguíneo imediatamente, principalmente por meio de ICP ou trombólise intravenosa. Embora a reperfusão miocárdica eficaz seja crucial para melhorar o prognóstico do miocárdio isquêmico, ela também introduz o risco de lesão miocárdica-reperfusional (IRMI)4,5,6. O MIRI é um desafio significativo que afeta a eficácia das terapias de reperfusão miocárdica7. Múltiplos fatores e mecanismos contribuem para o desenvolvimento do MIRI. Por exemplo, em células endoteliais, a reperfusão induz um acúmulo de espécies reativas de oxigênio (ROS) e uma depleção de sequestradores de radicais livres, indicando a presença de estresse oxidativo 4,8. Esse estresse oxidativo pode subsequentemente desencadear uma resposta inflamatória, levando a uma liberação aumentada de fatores inflamatórios, aumento da produção de moléculas de adesão e recrutamento de leucócitos 9,10,11. A via do fator nuclear kappa-light-chain-enhancer das células B ativadas (NF-κB) desempenha um papel crucial na resposta inflamatória durante a lesão de isquemia/reperfusão miocárdica12. A família de fatores de transcrição NF-κB de mamíferos inclui cinco membros: NF-κB1 (também conhecido como p105/p50), NF-κB2 (também conhecido como p100/p52), p65 (também conhecido como RELA), RELB (o homólogo do oncogene viral da reticuloendoteliose V-Rel) e c-REL13,14. A inibição da via NF-κB demonstrou aliviar a lesão de isquemia/reperfusão em vários tecidos, incluindo o miocárdio12,15, intestino16, ovário17, cérebro18,19, rins20 e fígado21. Notavelmente, a via de sinalização NF-κB tem sido amplamente documentada como um mediador fundamental na resposta miocárdica à isquemia e reperfusão12,14, possíveis mecanismos incluem a promoção de respostas inflamatórias, regulação da expressão de moléculas de adesão celular, participação em reações de estresse oxidativo e influência nas vias de morte celular e sobrevivência 12,20,22,23,24,25. Intervenções terapêuticas destinadas a atenuar a ativação do NF-κB têm mostrado potencial significativo no alívio do MIRI23,26 .
A medicina uigur, parte integrante da medicina tradicional chinesa, baseia-se na teoria dos quatro humores: fogo, ar, água e terra. Esses humores dão origem a fluidos corporais como sangue, catarro, bile amarela e bile negra27,28. A manutenção da homeostase dinâmica entre esses quatro fluidos corporais é crucial para a saúde geral do corpo humano. Qualquer desequilíbrio nesses fluidos, conhecido como fluidos corporais desequilibrados, pode resultar no aparecimento de doenças. Dentre os vários fluidos corporais desequilibrados, o predominante é conhecido como fluido corporal anormal (ABF), também conhecido como síndrome de Savda anormal (SEA)27,28. Munziq, um medicamento tradicional uigur amplamente empregado por médicos uigures, é prescrito para o tratamento de fluidos corporais anormais. É uma preparação medicinal à base de plantas composta por dez espécies medicinais diferentes, conforme fornecido na bula, incluindo Cordia dichotoma Forst. f., Anchusaitalica Retz., Glycyrrhiza uralensis Fisch., Adiantum capillusveneris L., Euphorbia humifusa Willd., Ziziphus jujuba Mill., Lavandula angustifolia Mill., Foeniculum vulgare Mill., Melissa officinalis L. e Alhagi pseudoalhagi Desv29. O Munziq foi aprovado pela Administração Estatal de Alimentos e Medicamentos em 2003 sob o número de código Z65020166. Seus componentes químicos ativos abrangem latão, fenóis, ácidos orgânicos, aminoácidos, saponina, açúcar e outros. O Munziq exibe múltiplos efeitos, incluindo efeitos antioxidantes, anti-inflamatórios, imunorreguladores, antiagregação plaquetária e antitrombóticos 27,28,30.
Nossos estudos anteriores mostraram que o medicamento Munziq pode aliviar a lesão de isquemia/reperfusão miocárdica (MIRI), embora os mecanismos específicos permaneçam obscuros. Foram demonstrados efeitos protetores miocárdicos do Munziq em ratos com lesão miocárdica de isquemia-reperfusão com síndrome de Savda anormal. A inibição da via do fator nuclear kappa b protege a lesão miocárdica de isquemia/reperfusão em ratos em tratamento com grânulo de Fufang Munziq (Munziq) 27,28,30. No entanto, há pesquisas limitadas investigando o papel e o mecanismo de Munziq no MIRI.
Este estudo tem como objetivo investigar os efeitos cardioprotetores do Munziq na lesão de isquemia-reperfusão miocárdica (MIRI) em ratos com fluido corporal anormal (ABF) e explorar os mecanismos subjacentes, particularmente com foco na via de sinalização NF-κB. A hipótese proposta neste estudo é que o pré-tratamento com Munziq pode mitigar as alterações patológicas induzidas pelo MIRI e proteger a função cardíaca, potencialmente suprimindo a via de sinalização NF-κB e as respostas inflamatórias a jusante. A hipótese é testada por meio do estabelecimento dos modelos sham, lesão de isquemia-reperfusão (MIRI) e lesão de isquemia-reperfusão + Munziq nos grupos controle e ABF. A função cardíaca, os indicadores relacionados à inflamação e as proteínas associadas à via NF-κB são monitorados.
Protocolo
Ratos Sprague-Dawley (SD) machos adultos pesando 200-220 g foram usados de acordo com as Diretrizes do National Institutes of Health para o Cuidado e Uso de Animais de Laboratório. Centro Experimental Animal da Universidade Médica de Xinjiang. Modelos animais com fluido corporal anormal (ABF) foram fornecidos pelo Centro de Animais Experimentais da Universidade Médica de Xinjiang. Os ratos foram mantidos em ambiente seco-frio conforme descrito anteriormente, o que é essencial para o estabelecimento do modelo de fluido corporal anormal (ABF) em ratos, de acordo com a teoria da medicina tradicional uigur e conforme demonstrado em estudos anteriores29,33. Todos os experimentos com animais foram conduzidos de acordo com as diretrizes éticas da Universidade Médica de Xinjiang e realizados de acordo com as diretrizes ARRIVE. O protocolo para estudos em animais vertebrados (ratos) foi aprovado pelo comitê de ética institucional da Universidade Médica de Xinjiang (IACUC-20200318-16).
1. Agrupamento animal, administração de medicamentos e estabelecimento do modelo MIRI
- Atribua aleatoriamente os ratos aos seguintes seis grupos: i) grupo simulado controle, ii) grupo MIRI controle, iii) grupo simulado ABF, iv) grupo ABF MIRI, v) grupo controle MIRI + Munziq e vi) grupo ABF MIRI + Munziq.
- Alojar os ratos do grupo ABF em um ambiente controlado dentro de caixas climáticas ajustadas para uma temperatura de 6 °C ± 1 °C e uma faixa de umidade relativa de 25% a 32,8%. Fornecer aos ratos ração comum misturada com ração seca e fria, ou seja, sementes de cevada e coentro na proporção de 7:1,5:1,5, e aplicar esse método por 21 dias para estabelecer o modelo ABF29,33.
- Administrar por administração intragástrica 5 g / kg de Munziq (5,0 g de Munziq dissolvido em 1 mL de água destilada) ao grupo Munziq por 21 dias antes da cirurgia MIRI, que é o dobro da dose clínica efetiva. Para animais sem ABF, como os grupos Controle Simulado, Controle MIRI e Controle MIRI + Munziq, administre um volume igual de solução salina normal ao grupo simulado e ao grupo MIRI e forneça administração intragástrica de Munziq para o grupo Munziq.
- Após 21 dias de pré-tratamento, estabelecer o modelo MIRI.
- Realize a cirurgia em uma sala de cirurgia dedicada a animais, equipada com materiais estéreis para garantir um ambiente estéril. Anestesiar os ratos com uma injeção intraperitoneal (IP) de pentobarbital sódico (35 mg/kg); observar o relaxamento muscular, a capacidade de resposta a estímulos externos e a frequência e profundidade respiratória para avaliar o efeito anestésico. Monitore esses parâmetros a cada 15 minutos durante todo o procedimento. Se aparecerem sinais de anestesia inadequada (tensão muscular, resposta perceptível a estímulos, frequência respiratória aumentada ou superficial), administre uma dose suplementar de 20 mg / kg. Mantenha a anestesia durante todo o procedimento até a coleta final de sangue. Durante o procedimento, manter a temperatura corporal do rato a 37 °C utilizando uma almofada de aquecimento com monitorização contínua através de uma sonda de temperatura rectal. Aplique pomada veterinária nos olhos para evitar o ressecamento durante a anestesia.
- Realize uma traqueostomia para respiração assistida por ventilador. Antes de abrir o tórax para expor o coração, lave o local da cirurgia com água e sabão, raspe a área cirúrgica e limpe a área com soluções anti-sépticas, como clorexidina e iodo. Use instrumentos estéreis para o procedimento.
- Para abrir o tórax e expor o coração, use instrumentos cirúrgicos torácicos estéreis padrão, incluindo tesouras, pinças e afastadores. Abra a parede torácica e exponha o coração. Identifique a artéria descendente anterior (DA) sob visualização direta. É um ramo importante da artéria coronária esquerda que fica na superfície do coração. Use uma sutura 6-0 (4-5 cm), ligue a DA (descendente anterior esquerda) por 30 min para induzir isquemia regional. Determine a oclusão efetiva do LAD observando uma cor pálida no miocárdio.
- Após 30 min de ligadura, liberar a ligadura e realizar a reperfusão por 120 min. Determine a reperfusão do miocárdio quando ele se recuperar para uma cor vermelha brilhante. Em ratos com operação simulada, execute o mesmo procedimento, mas sem ligadura de LAD.
- Após a reperfusão, os ratos permaneceram sob anestesia induzida por pentobarbital sódico (35 mg/kg, ip)34. Quando os ratos estiverem em anestesia profunda, colete 1-2 mL de amostras de sangue da aorta abdominal usando um tubo de coleta de sangue a vácuo.
- Após a coleta de amostra de sangue da aorta abdominal, eutanasiar os ratos por luxação cervical ainda sob anestesia profunda. Colete o tecido do miocárdio da área do infarto no ventrículo esquerdo usando pinças e tesouras estéreis, certificando-se de retirar apenas o tecido que parece pálido e danificado, o que indica a região infartada. Coloque o tecido coletado em um recipiente estéril para análise posterior.
2. Coleta de amostras
- Coleta de amostra de tecido: Usando uma tesoura estéril e uma lâmina estéril, corte o coração horizontalmente em duas metades ao longo do ponto médio do eixo longo do ventrículo esquerdo, perpendicular à direção do coração. Divida metade da parte apical em duas porções: Preserve um em 4% de paraformaldeído para exame morfológico à temperatura ambiente ou 4 ° C por 2-24 h, e o outro em glutaraldeído para microscopia eletrônica a 4 ° C por 1-4 h.
- Divida a parte da base do coração, incluindo as áreas isquêmicas e não isquêmicas, em duas porções: coloque uma porção em um criogenial, congele rapidamente o tecido em nitrogênio líquido e, em seguida, transfira-o para um freezer de temperatura ultrabaixa a -80 ° C para testes de biologia molecular. Use a outra porção fresca para a detecção dos níveis de espécies reativas de oxigênio (ROS) teciduais e extração mitocondrial.
- Coleta de amostra de soro: No ponto final do experimento, retire 1-2 mL de sangue venoso da veia cava inferior, centrifugue a 1000 x g por 10 min e armazene o soro em um freezer de temperatura ultrabaixa a -80 ° C após a separação.
3. Coloração HE e observação de microscopia eletrônica de transmissão
- Realizar coloração HE (coloração de hematoxilina-eosina) no miocárdio ventricular de acordo com o procedimento de rotina35. Fixe os tecidos em paraformaldeído a 4% por 24 h. Incorpore as amostras em parafina, corte-as em seções de 4 μm de espessura e core-as usando o método de coloração hematoxilina-eosina de acordo com o protocolo. Selecione aleatoriamente cinco campos para observar as alterações histopatológicas ao microscópio.
- Processe tecidos miocárdicos de ratos que foram fixados em formalina, de cada grupo, para experimentos de coloração HE seguindo as etapas abaixo.
- Coloque as seções de tecido em uma estufa a 65 ° C para assar por 1,5 a 2.
- Mergulhe as seções de tecido em xileno por 10 min, substitua o xileno e mergulhe novamente por mais 10 min. Mergulhe sequencialmente em álcool anidro I e II por 5 min cada, seguido de álcool 95%, 90%, 80% e 70% e água destilada por 5 min cada.
- Manchar com hematoxilina por 3 min. Realize a diferenciação ácida com ácido clorídrico adicionado em álcool por alguns segundos (1-2 s). Termine a diferenciação em água da torneira por 5 min.
- Mergulhe em água destilada, álcool 70%, 80%, 90% e 95% por 3 min cada, e álcool anidro I e II por 5 min cada.
- Manchar com 0,5% de eosina em etanol por 1 min, enxaguar as seções em etanol 95% para remover o excesso de cor vermelha e, em seguida, mergulhar em etanol anidro por 5 min. Mergulhe em xileno I e II por 5 min cada.
- Monte com bálsamo neutro. Observe as alterações patológicas do tecido ao microscópio.
4. Detecção por ELISA de citocinas sanguíneas e índices de lesão cardíaca
- Obter uma amostra de soro de rato do sangue periférico centrifugando a 1000 x g durante 10 min e conservar a -80 °C. Detectar níveis de índices de lesão cardíaca como CK-MB, cTn-T, ICAM-1 e citocinas inflamatórias como IL-1β, IL-6, TNF-α no soro usando kits ELISA de acordo com as instruções do fabricante e conforme descrito abaixo.
- Deixe todos os reagentes atingirem a temperatura ambiente (18-25 °C) por pelo menos 30 min, prepare os reagentes de acordo com as instruções do fabricante e deixe-os prontos para uso.
- Configure poços padrão e de amostra, onde os poços padrão contêm concentrações conhecidas de soluções padrão fornecidas no kit de ensaio. Estes são usados para estabelecer uma curva padrão durante o experimento para quantificar a concentração específica do analito nas amostras que estão sendo testadas. Adicione 100 μL de padrão ou amostra a cada poço, misture suavemente agitando, cubra com um selo de placa e incube a 37 ° C por 2 h.
- Descarte o líquido, seque por decantação e não lave. Adicione 100 μL de solução de trabalho de anticorpo marcado com biotina (pré-diluído 1:100) a cada poço, cubra com um novo selo de placa e incube a 37 ° C por 1 h.
- Descarte o líquido dos poços, seque por decantação e lave a placa 3x. Deixe de molho por 2 min por lavagem, 200 μL por poço e seque por decantação.
- Adicione 100 μL de solução de trabalho de estreptavidina marcada com peroxidase de rábano a cada poço, cubra com um novo selo de placa e incube a 37 ° C por 1 h.
- Descarte o líquido dos poços, seque por decantação e lave a placa 5x. Deixe de molho por 2 min por lavagem, 200 μL por poço e seque por decantação.
- Adicione sequencialmente 90 μL de solução de substrato a cada poço e desenvolva a cor no escuro a 37 ° C por 15-30 min.
- Adicione sequencialmente 50 μL de solução de parada a cada poço para encerrar a reação. Dentro de 5 minutos após a interrupção da reação, meça a densidade óptica (valores OD) de cada poço em sequência a 450 nm usando um leitor de microplacas.
5. Medição do nível de MDA, NO e LDH
- Após a reperfusão, coletar tecido miocárdico (5 mm x 7 mm) da área do infarto no ventrículo esquerdo. Detecte LDH (lactato desidrogenase) e MDA (malondialdeído) usando o kit de ensaio LDH e o kit de ensaio MDA, seguindo as instruções do fabricante. Detectar NO a 550 nm utilizando o kit de ensaio de óxido nítrico (NO) de acordo com as instruções do fabricante.
6. Análise de Western blot
- Extraia proteínas totais de tecidos ventriculares de ratos usando lise RIPA. Determine a concentração de proteína usando o Kit de Ensaio de Proteína BCA.
- Para preservar as proteínas intracelulares e evitar a degradação celular, mergulhe as amostras em nitrogênio líquido para congelá-las rapidamente. Em seguida, recupere as amostras congeladas e triture-as em pó, pegue aproximadamente 100 mg da amostra e adicione-as a um tubo de centrífuga pré-resfriado de 1,5 mL. Adicionar 400 μL de tampão de lise RIPA (suplemento com inibidores de protease e um inibidor de fosfatase de largo espectro), misturar bem e deixar a mistura repousar a 4 °C durante 60 min.
- Centrifugue a mistura a 1000 x g durante 15 min a 4 °C. Coletar o sobrenadante e medir a concentração de proteínas usando o método BCA.
- Dilua os padrões BSA com um diluente que corresponda ao sistema tampão das amostras, de acordo com a Tabela 1.
- Prepare os reagentes de acordo com as instruções do fabricante. Com base no número de amostras, misture os reagentes A e B em uma proporção de volume de 50:1 para preparar uma quantidade adequada de solução de trabalho de BCA e misture bem. Antes de preparar a solução de trabalho BCA, agite o reagente A para misturar bem.
- Pegue 20 μL de solução padrão BSA recém-preparada e amostras diluídas (diluídas 10 vezes) da Tabela 1 e adicione-as a uma placa de 96 poços.
- Adicione 200 μL de solução de trabalho BCA a cada poço e misture bem. Feche a placa, incube a 37 °C durante 30 min, depois arrefeca à temperatura ambiente ou coloque à temperatura ambiente durante 2 min.
- Meça a absorvância a 562 nm usando um leitor de microplacas e calcule a concentração de proteínas nas amostras com base na curva padrão.
- Adicione uma quantidade apropriada de tampão de carregamento 5x SDS-PAGE (contendo β-mercaptoetanol) às amostras, trate termicamente a 100 ° C em água fervente por 5 min para desnaturar totalmente as proteínas, centrifugue a 1.000 x g por 5 min e leve o sobrenadante para uso.
- A fórmula na Tabela 2 descreve a preparação de géis separadores de 15%, 12% e 8%, bem como um gel de empilhamento de 5%. Prepare as soluções de acordo. Adicione a solução de gel separador a uma altura de 2/3 no de gel, cubra-o com água destilada e deixe repousar em temperatura ambiente por 40 min. Em seguida, adicione o gel de empilhamento para encher o, insira o pente e deixe descansar por 10 min.
- Carregue 9 μL de marcador de proteína pré-corado em cada poço e carregue 50 μg de proteína de amostra por poço.
- Aplique uma tensão constante de 80 V até que o azul de bromofenol atinja o gel de separação e, em seguida, aplique uma tensão constante de 100 V por 90 min. Pare a eletroforese quando o azul de bromofenol tiver migrado para a parte inferior do gel.
- Após a conclusão do SDS-PAGE, mergulhe a membrana de PVDF em metanol por 10 s, enxágue em água destilada por 1 min e, em seguida, mergulhe o gel de poliacrilamida, o papel de filtro e a membrana de PVDF tratada em tampão de transferência por 10 min.
- Monte o sanduíche de transferência com o lado preto dos clipes voltado para baixo, seguido por um lado transparente de papel de filtro de esponja-gel-PVDF de papel de filtro de membrana-esponja. Coloque os clipes no de transferência, certificando-se de que o lado preto do clipe esteja voltado para o lado preto do e o lado branco esteja voltado para o lado vermelho. Realize a transferência a uma tensão constante de 100 V e use uma membrana de PVDF com um tempo de transferência de 60 min.
- Após a transferência, lave a membrana de PVDF com água 3x por 5 min cada. Bloqueie a membrana com uma solução de bloqueio contendo 5% de leite em pó desnatado por 1 h e depois lave com TBST 3x por 5 min cada.
- Diluir o anticorpo primário com TBST de acordo com as razões de diluição indicadas no quadro 3 e incubar a 4 °C durante a noite. Os anticorpos primários incluem anticorpo anti-NF-κB p65, anticorpo anti-NF-κB Indutor de Quinase (NIK), anticorpo anti-IKKα e anticorpo anti-β-actina.
- Enxágue a membrana 3x com 1x TBST por 5 min cada. Adicione o anticorpo secundário adequadamente diluído (conforme Tabela 3) e incube em temperatura ambiente por 1 h. Os anticorpos secundários são IgG anti-camundongo de cabra conjugada com HRP e IgG anti-coelho de cabra conjugada com HRP.
- Enxágue a membrana novamente com 1x TBST 3x por 5 min cada. Misture as soluções de revelação A e B, adicione 2 mL à membrana e detecte e fotografe usando o mini instrumento de quimioluminescência.
- Desenvolva a membrana usando quimioluminescência aprimorada mais reagente. Digitalize o filme revelado usando o sistema de imagem. Analise as imagens de Western blot usando software. Use β-actina como controle de carga. Calcule o nível relativo de proteína com base no valor de cinza da β-actina.
7. Análise de PCR em tempo real (qRT-PCR)
- Extração total de RNA
- Prepare a solução de DEPC a 0,1% e o álcool tratado com DEPC a 70% de acordo com as instruções do fabricante. Trate todos os tamanhos de tubos de microcentrífuga e vários tipos de ponteiras de pipeta com solução DEPC a 0,1%. Mergulhe durante a noite e depois autoclave.
- Colete células na fase de crescimento logarítmico com bom estado de crescimento. Descarte o meio de cultura do frasco de cultura de células e lave as células 2x com a solução de Hank. Adicione 1 mL de tripsina por 10 cm² de células, agite suavemente para desprender as células e use uma pipeta para garantir o descolamento completo. Incube em temperatura ambiente por 5 min para permitir a lise completa e, em seguida, pipete para cima e para baixo 7x-10x para interromper totalmente as células. Transfira o lisado para tubos de 1,5 mL, centrifugue e armazene o sobrenadante.
- Adicione um volume igual de clorofórmio ao sobrenadante, misture bem e deixe repousar em temperatura ambiente por 10 min. Centrifugue a 4 °C por 5 min a 1.000 x g para separar as fases. Transferir cuidadosamente a fase aquosa superior para um novo tubo (se extrair ADN e proteínas, conservar a fase inferior e conservá-la a 4 °C).
- Adicione isopropanol (0,5 mL por 1 mL de trizol), misture bem e deixe repousar em temperatura ambiente por 10 min. Centrifugar a 4 °C durante 10 min a 1.000 x g, retirar cuidadosamente o sobrenadante e eliminá-lo.
- Lave o pellet de RNA com etanol a 75%, centrifugue a 4 °C por 5 min a 8.000 x g, remova suavemente o sobrenadante e seque o pellet ao ar ou a vácuo. Dissolver o RNA em 50 μL de água DEPC, alíquota e armazenar a -70 °C ou proceder à transcrição reversa para cDNA.
- Transcrição reversa para cDNA
- Realize a transcrição reversa do cDNA usando um kit seguindo as instruções do fabricante.
- PCR quantitativo em tempo real
- Projete primers com base em sequências de genes e verifique-os usando o BLAST no site do NCBI. Preparar soluções de estoque de 10 μM de primers diretos e reversos para CK20 e β-actina. A Tabela 4 mostra as sequências de primers.
- PCR quantitativo em tempo real
- Adicione 1 μL de cDNA, 10 μL de mistura principal 2x, 0,4 μL de primer direto e reverso cada e 8,2 μL de água livre de RNase no sistema de reação.
- Realize PCR com o seguinte programa: Desnaturação inicial a 95 °C por 2 min, seguida por 40 ciclos de 95 °C por 15 s e 60 °C por 1 min. Use β-actina como controle interno. Calcule a expressão relativa usando o método 2-ΔΔCt .
8. Análise estatística
- Use um software comercial para análise estatística. Apresente os dados como média ± desvio padrão (média ± DP). Realize ANOVA unidirecional para comparar as diferenças entre diferentes grupos. Defina uma diferença significativa como p < 0,05.
Resultados
Munziq atenua as alterações patológicas induzidas pela lesão de isquemia-reperfusão
Para examinar as alterações morfológicas nos tecidos miocárdicos, inicialmente realizamos a coloração HE. Como a coloração representativa do HE mostrada na Figura 1, observamos degeneração granular e degeneração vacuolar em certas células miocárdicas no grupo simulado. Além disso, houve presença limitada de hemácias e infiltração de linfócitos entre as células miocárdicas. Periodicamente, observamos dilatação e congestão vascular. Os tecidos miocárdicos do grupo MIRI apresentaram comprometimento mais grave e manifestaram alterações morfológicas mais pronunciadas. Essas alterações incluíram degeneração granular extensa, degeneração vacuolar, infiltração de glóbulos vermelhos e linfócitos, dilatação vascular e congestão. A lesão tecidual miocárdica no grupo MIRI do ABF foi mais grave em comparação com a observada no grupo MIRI controle. No entanto, em ambos os grupos Munziq, algumas células miocárdicas apresentaram degeneração granular leve e degeneração vacuolar. A presença de hemácias e infiltração de linfócitos, dilatação vascular e congestão foram escassas. Além disso, os resultados indicam que o Munziq exibe efeitos cardioprotetores superiores em ratos ABF MIRI e ratos controle MIRI. Em conclusão, esses achados sugerem que o pré-tratamento com Munziq tem o potencial de mitigar as alterações patológicas induzidas pela lesão de isquemia-reperfusão no coração.
Munziq melhorou a ruptura das mitocôndrias e fibras musculares cardíacas induzida por lesão de isquemia/reperfusão
Para verificar ainda mais o papel protetor de Munziq na lesão de MIRI, examinamos a ultraestrutura mitocondrial e as fibras musculares cardíacas usando TEM. Conforme ilustrado na Figura 2, as células miocárdicas no grupo simulado exibiram uma estrutura intacta com miofibrilas bem dispostas e comprimento de sarcômero semelhante. A estrutura do miofilamento parecia clara e ligeiramente frouxa, enquanto um grande número de mitocôndrias foi observado. Por outro lado, o grupo MIRI exibiu características patológicas indicativas de células miocárdicas danificadas, incluindo inchaço celular, comprimento variado do sarcômero, estrutura miofilamentar pouco clara e frouxamente organizada. Observou-se que houve extensa interrupção e dissolução das mitocôndrias no grupo I / R em comparação com o grupo simulado. Além disso, as fibras musculares cardíacas eram irregulares e fraturadas em resposta à lesão de I/R. Curiosamente, a gravidade dessas alterações foi notavelmente maior no grupo ABF MIRI. Em contraste, ambos os grupos tratados com Munziq exibiram características patológicas aliviadas associadas a células miocárdicas danificadas. O inchaço das células miocárdicas foi reduzido, e as estruturas das miofibrilas, sarcômero, miofilamento e o número de mitocôndrias foram semelhantes aos observados no grupo simulado. Coletivamente, esses dados indicaram que o pré-tratamento com Munziq poderia mitigar a ruptura das mitocôndrias e fibras musculares cardíacas induzidas pela cirurgia de I / R.
Lesão miocárdica de isquemia-reperfusão exacerbada em rato ABF MIRI e pré-tratamento com Munziq protegeu a função cardíaca
Os níveis séricos de cTn-T, CK-MB e ICAM-1 foram detectados pelo método ELISA. Os resultados não revelaram disparidades perceptíveis entre o grupo placebo controle e o grupo placebo ABF. No entanto, vale ressaltar que o grupo MIRI ABF exibiu níveis significativamente elevados de cTn-T (Figura 3A), CK-MB (Figura 3B) e ICAM-1 (Figura 3C) em comparação com o grupo MIRI controle. Para avaliar os efeitos cardioprotetores do Munziq, tanto os ratos controle MIRI quanto os ratos ABF MIRI foram submetidos ao pré-tratamento com Munziq. Conforme demonstrado na Figura 3, os níveis de cTn-T, CK-MB e ICAM-1 foram notavelmente reduzidos no grupo de pré-tratamento com Munziq. Esses resultados sugerem que o Munziq exibe propriedades cardioprotetoras notáveis em ratos ABF MIRI.
Para investigar o efeito do pré-tratamento com Munziq na lesão por estresse oxidativo induzida por isquemia e reperfusão em ratos ABF e controle, as alterações de LDH, MDA e NO foram medidas no tecido miocárdico. Conforme mostrado na Figura 3D, F, o grupo ABF MIRI exibiu níveis significativamente elevados de MDA e níveis significativamente reduzidos de NO em comparação com o grupo controle MIRI. O pré-tratamento com Munziq diminuiu significativamente o conteúdo de LDH e MDA no miocárdio isquêmico. Ao mesmo tempo, o pré-tratamento com Munziq aumentou ainda mais o nível de NO no tecido miocárdico.
O pré-tratamento com Munziq mitigou a inflamação do MIRI, dificultando a produção de citocinas pró-inflamatórias
As citocinas pró-inflamatórias desempenham um papel crítico na mediação da resposta imune inata, e as citocinas pró-inflamatórias foram ativadas durante o MIRI31. Para investigar melhor o efeito anti-inflamatório do Munziq, tanto os ratos controle MIRI quanto os ratos ABF MIRI foram submetidos ao pré-tratamento com Munziq. Empregamos o método ELISA para medir os níveis séricos de IL-1β, IL-6 e TNF-α e análise de qRT-PCR para avaliar os níveis de mRNA de IL-1β, IL-6 e TNF-α no tecido miocárdico. Os resultados não revelaram diferenças significativas nesses níveis de citocinas entre o grupo controle simulado e o grupo simulado ABF. Os níveis de IL-1β, IL-6 e TNF-α foram significativamente regulados positivamente no grupo ABF MIRI em comparação com o grupo controle MIRI. Especificamente, a IL-1β exibiu um aumento significativo nos níveis de mRNA e proteína, com uma diferença estatisticamente significativa observada. Embora não tenha havido diferença no nível de mRNA para IL-6, uma disparidade foi encontrada no nível da proteína. Da mesma forma, o TNF-α não mostrou nenhuma variação nos níveis de mRNA, mas exibiu diferenças no nível da proteína. Conforme ilustrado na Figura 4, os níveis de IL-1β, IL-6 e TNF-α diminuíram notavelmente no grupo de pré-tratamento com Munziq.
O pré-tratamento com Munziq mitigou a inflamação através da via de sinalização NF-κB
A produção de citocinas está intimamente ligada à ativação das vias de sinalização do NF-κB na maioria dos estágios da resposta inflamatória. O NF-κB é considerado um potencial alvo terapêutico para doenças inflamatórias32. Para avaliar se a via NF-κB está implicada nos efeitos anti-inflamatórios do Munziq, inicialmente realizamos a análise de Western Blot para medir os níveis de expressão dos principais constituintes da via NF-κB, incluindo NIK, IKKα, pIKKα e p6513. Conforme ilustrado na Figura 5, a lesão isquêmica e de reperfusão induziu notável regulação positiva de NIK, p-IKKα e p-p65 dentro do grupo MIRI. O tratamento com Munziq atenuou efetivamente essa regulação positiva. Os resultados indicaram que o Munziq desempenha um papel crítico na anti-inflamação, suprimindo a ativação da via de sinalização NF-κB.
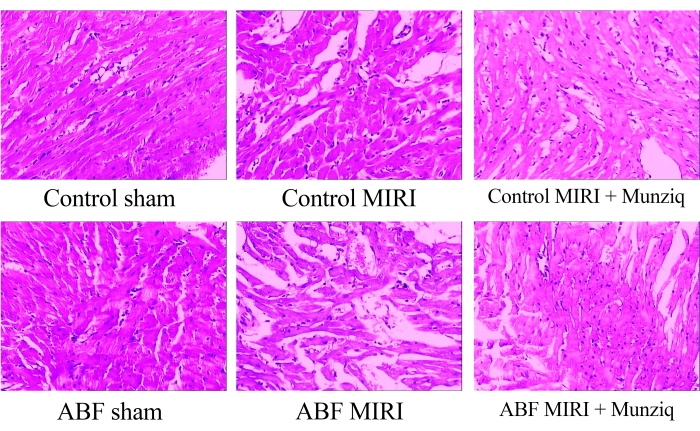
Figura 1: Alterações morfológicas dos tecidos miocárdicos observadas pela coloração HE. Imagens representativas de coloração HE de diferentes grupos. Ampliação: 100x. Abreviaturas: ABF = fluido corporal anormal; MIRI = lesão de isquemia-reperfusão miocárdica; (n=6). Clique aqui para ver uma versão maior desta figura.
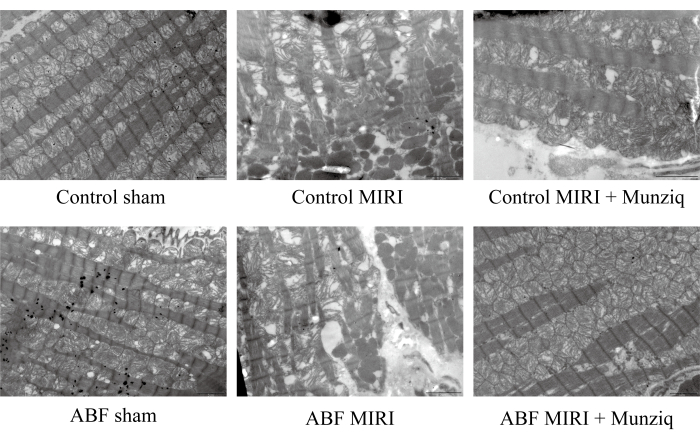
Figura 2: Munziq melhorou a ruptura das mitocôndrias e fibras musculares cardíacas induzida por lesão de I / R. O microscópio eletrônico de varredura foi realizado para observar a ultraestrutura das mitocôndrias e as alterações das fibras musculares cardíacas. Imagens representativas foram mostradas. Barra de escala: 5 μm; (n=3). Clique aqui para ver uma versão maior desta figura.
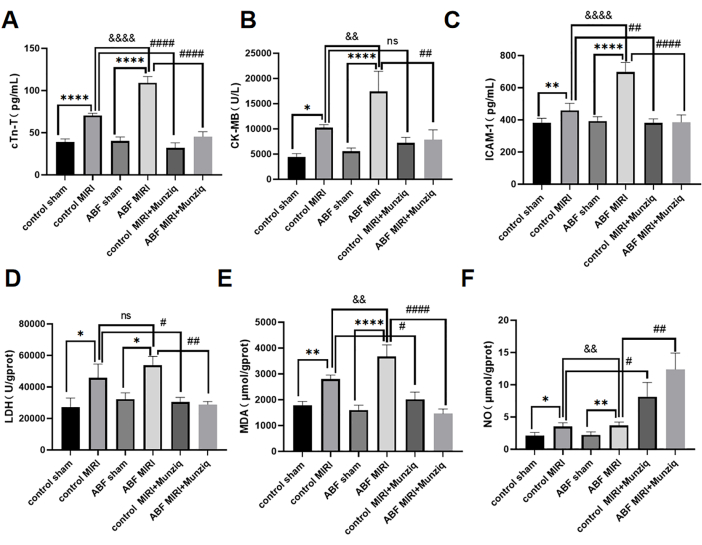
Figura 3: Lesão miocárdica de isquemia-reperfusão exacerbada em ratos ABF MIRI e pré-tratamento com Munziq podem proteger a função cardíaca. (A) CTn-T sérico, (B) CK-MB e (C) ICAM-1. Os níveis foram detectados por ELISA e as alterações em LDH, MDA e NO foram medidas no tecido miocárdico (n=6). *p<0,05, ** p<0,01, ***p<0,001, ****p<0,0001 Em comparação com o grupo simulado; #p<0,05, ## p<0,01, ###p<0,001, ####p<0,0001 Em comparação com o grupo MIRI; &<0,05, && p<0,01, &&&p<0,001, &&&&p<0,0001 Comparado com o grupo controle. Os dados são apresentados como média ± DP. A análise estatística foi realizada por meio de ANOVA de uma via. Clique aqui para ver uma versão maior desta figura.
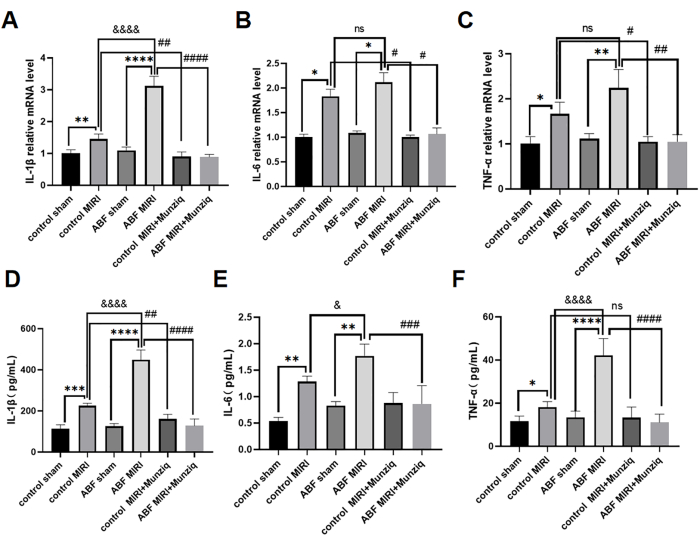
Figura 4: O pré-tratamento com Munziq mitigou a inflamação do MIRI, impedindo a produção de citocinas pró-inflamatórias. qRT-PCR detectou os níveis de mRNA de (A) IL-1β, (B) IL-6 e (C) TNF-α no tecido miocárdico. Meça os níveis de (D) IL-1β, (E) IL-6 e (F) TNF-α no soro por ELISA (n = 6). *p<0,05, ** p<0,01, ***p<0,001, ****p<0,0001 Em comparação com o grupo simulado; #p<0,05, ## p<0,01, ###p<0,001, ####p<0,0001 Em comparação com o grupo MIRI; &<0,05, && p<0,01, &&&p<0,001, &&&&p<0,0001 Comparado com o grupo controle. Os dados são apresentados como média ± DP. A análise estatística foi realizada por meio de ANOVA de uma via. Clique aqui para ver uma versão maior desta figura.
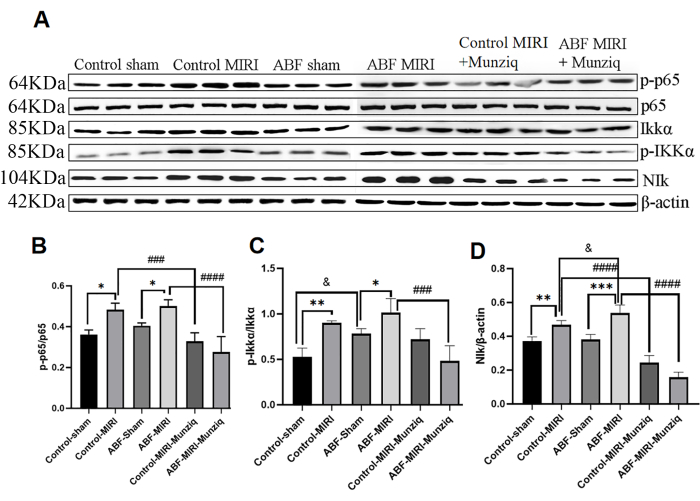
Figura 5: O pré-tratamento com Munziq mitigou a inflamação através da via de sinal NF-κB. A expressão das proteínas p-IKKα, IKKα, p-p65, p65 e NIk no tecido miocárdico foi detectada por Western blot (N = 3 para cada grupo). (A) As bandas de proteína observadas na análise de Western blot. (BD) O nível de expressão relativo é determinado com base no valor de cinza. *p<0,05, ** p<0,01, ***p<0,001, ****p<0,0001 Em comparação com o grupo simulado; #p<0,05, ## p<0,01, ###p<0,001, ####p<0,0001 Em comparação com o grupo MIRI; &p<0,05, && p<0,01, &&&p<0,001, &&&&p<0,0001 Comparado com o grupo controle. Os dados são apresentados como média ± DP. A análise estatística foi realizada por meio de ANOVA de uma via. Clique aqui para ver uma versão maior desta figura.
| Número do tubo | Volume do diluente (mL) | Volume BSA (fonte) | Concentração final de BSA (mg/mL) |
| Um | 0 | 20 (solução-mãe) | 500 |
| B | 2 | 18 (solução-mãe) | 400 |
| C | 4 | 16 (solução-mãe) | 300 |
| D | 6 | 14 (solução-mãe) | 200 |
| E | 8 | 12 (solução-mãe) | 150 |
| F | 12 | 8 (solução-mãe) | 100 |
| G | 16 | 4 (solução-mãe) | 50 |
| H | 20 | 0 (solução-mãe) | 0 |
Tabela 1: Tabela de preparação de concentração padrão da BSA.
| Géis Separadores | 15% de Gel de Empilhamento | 12% de Gel de Empilhamento | 8% de Gel de Empilhamento | Gel de empilhamento 5% | |
| Reagentes | Volume | Volume | Volume | Reagentes | Volume |
| Água deionizada (mL) | 2.76 | 3.96 | 5.52 | Água deionizada (mL) | 4 |
| 30% de acrilamida (mL) | 6 | 4.8 | 3.24 | 30% de acrilamida (mL) | 1 |
| 1.5mol/lTris.HCl (PH8.8) (mL) | 3 | 3 | 3 | 1,0 M Tris.HCl (pH6,8; mL) | 1 |
| 10% SDS (μL) | 120 | 120 | 120 | 10% SDS (μL) | 80 |
| 10% AP (μL) | 120 | 120 | 120 | 10% AP (μL) | 60 |
| TEMED (μL) | 4.8 | 4.8 | 7.2 | TEMED (μL) | 8 |
| Volume Total (mL) | 12 | 12 | 12 | Volume Total (mL) | 6 |
Tabela 2: Preparação da concentração do gel.
| Anticorpo primário | Razão de diluição | Anticorpo secundário | Razão de diluição |
| β-actina | 1:1000 | IgG H&L (HRP) de cabra anti-rato | 1:15000 |
| pág. 65 | 1:1000 | IgG H&L anti-coelho de cabra (HRP) | 1:5000 |
| P-P65 | 1:300 | 1:5000 | |
| BCL-2 | 1:1000 | 1:5000 | |
| BAX | 1:1000 | 1:5000 | |
| Drp1 | 1:800 | 1:5000 | |
| Fis1 | 1:1000 | 1:5000 | |
| Mfn2 | 1:800 | 1:5000 |
Tabela 3: Taxas de diluição de anticorpos.
| Gene | Sequência de primer (5' a 3') | ||
| IL-1β-F | CTGTGACTCGTGGGATGATG | ||
| IL-1β-R | GGGATTTTGTCGTTGCTTGT | ||
| TNF-α-F | GCCTCCTCTCTGCCATCAAG | ||
| TNF-α-R | CTCCAAAGTAGACCTGCCCG | ||
| IL-6-F | GCCCACCAGGAACGAAAGTC | ||
| IL-6-R | GGCAACTGGCTGGAAGTCTC | ||
| beta actina-F | CCCATCTATGAGGGTTACGC | ||
| beta actina-R | TTTAATGTCACGCACGATTTC | ||
Tabela 4: Sequências de primers.
Discussão
MIRI, que significa lesão de isquemia-reperfusão miocárdica, é uma complicação comum e significativa que ocorre após a reperfusão miocárdica em cirurgia cardíaca36,37, poucos fármacos ou adjuvantes têm resultados clínicos definitivamente melhores em comparação com controles contemporâneos38. Portanto, há uma necessidade urgente de terapias eficazes para proteger o coração de tais lesões. Munziq, uma preparação tradicional à base de plantas, demonstrou certos efeitos terapêuticos na lesão de isquemia-reperfusão cardíaca 27,28,30. No entanto, esses achados são preliminares e os mecanismos subjacentes permanecem desconhecidos. O objetivo deste estudo foi investigar e validar os efeitos e mecanismos protetores de Munziq no MIRI.
O fluido corporal anormal é referido como uma manifestação comum de várias doenças crônicas, incluindo doenças cardiovasculares, de acordo com a medicina tradicional uigur39,40. No sistema médico uigur, acredita-se que o AMA seja resultado do estresse de longo prazo e é referido como a fonte de várias doenças39. Neste estudo, um modelo de fluido corporal anormal foi empregado para simular as características subjacentes das doenças cardiovasculares que necessitam de cirurgia cardíaca. O MIRI foi induzido em ratos com ABF para determinar a lesão de isquemia-reperfusão miocárdica.
A lesão de isquemia e reperfusão é uma condição patológica complexa que envolve múltiplos processos. Tem sido relatado que a isquemia-reperfusão no coração leva a alterações patológicas no miocárdio4. Essas alterações patológicas se manifestam principalmente como cardiomiócitos encurtados, estrutura sarcomérica interrompida, inchaço mitocondrial41 e miofibrilas sarcoméricas frouxamente dispostas, como observado neste estudo. A lesão miocárdica também resulta em alterações nas enzimas séricas. Sabe-se que os níveis de cTnT, CK-MB e ICAM-1 no soro aumentam após a lesão miocárdica42,43. Portanto, esses biomarcadores são usados para avaliar a extensão da lesão miocárdica aguda. Neste estudo, observamos as alterações patológicas no miocárdio e a elevação das enzimas séricas após a lesão de isquemia-reperfusão, indicando o estabelecimento bem-sucedido do modelo MIRI. Os resultados mostraram que a lesão miocárdica no grupo MIRI ABF foi mais grave em comparação com o grupo MIRI controle. Após o tratamento com Munziq, as alterações patológicas foram visivelmente aliviadas e os níveis séricos de enzimas diminuíram significativamente. Coletivamente, esses achados demonstram os efeitos cardioprotetores do Munziq durante o MIRI.
Neste estudo, a artéria descendente anterior (DA) foi ligada por 30 min, seguida de reperfusão por 120 min para estabelecer um modelo de lesão de isquemia-reperfusão em ratos. Uma meta-análise44 resumindo 43 estudos utilizados para criar modelos de lesão de isquemia-reperfusão em ratos indicou que os tempos de isquemia variaram de 30 a 60 min, com duração de reperfusão de 30 a 120 min. Alguns estudos adotaram um protocolo de 5 min de isquemia seguido de 5 min de reperfusão, repetido 4x45. Dentre esses métodos, o protocolo de 30 min de isquemia e 120 min de reperfusão foi o mais utilizado, aparecendo em 19 casos. Durante o processo experimental, observamos uma coloração pálida do miocárdio por meio de inspeção visual direta após 30 min de isquemia. Além da avaliação visual das alterações de cor do miocárdio, o eletrocardiograma (ECG) foi empregado para identificar sinais de isquemia, como supradesnivelamento do segmento ST. Marcadores séricos, incluindo troponina e creatina quinase, bem como parâmetros hemodinâmicos como frequência cardíaca (FC), pressão diastólica do ventrículo esquerdo (PDFVE) e pressão sistólica do ventrículo esquerdo (PSVE), podem servir como indicadores para avaliar a eficácia do modelo de isquemia46. Neste estudo, contamos principalmente com a observação visual para avaliar os efeitos da isquemia e da reperfusão. Devido às variações individuais entre os ratos, é aconselhável complementar a inspeção visual com medidas objetivas adicionais para avaliar a eficácia da isquemia, em vez de aplicar uma duração isquêmica uniforme a todos os ratos.
Nos mamíferos, a família NF-κB consiste em cinco membros, um dos quais é p65 13,47. Existem duas vias principais de ativação do NF-κB nas células47. Na via canônica, a ativação do complexo IKK (IKKα, IKKβ e IKKγ) leva à fosforilação das proteínas IκB, iniciando a ativação do NF-κB. Na via não canônica do NF-κB, a ativação do NF-κB é mediada pela fosforilação de NIK e IKKα. Extensas evidências sugerem que a via NF-κB desempenha um papel crucial na mediação da lesão de isquemia e reperfusão 48,49,50. Interferir na ativação do NF-κB pode atenuar a lesão induzida por isquemia e reperfusão 51,52. Curiosamente, houve mais ativação da via de sinalização NF-κB no grupo ABF MIRI e níveis mais altos de citocinas inflamatórias a jusante.
Numerosos medicamentos da medicina tradicional chinesa demonstraram exercer efeitos protetores contra lesões de isquemia e reperfusão, modulando a via NF-κB. Por exemplo, Liu et al.53 descobriram que a quercetina mitigou o MIRI inibindo a via NF-κB. Han et al.54 relataram que o hidroxisafflor amarelo A aliviou o MIRI ao inibir a sinalização TLR4/NF-κB. No entanto, se Munziq exerce um papel protetor no MIRI através da via de sinalização NF-κB permanece inexplorado. Para elucidar ainda mais o mecanismo de Munziq, este estudo analisou os níveis de expressão de nós-chave na via de sinalização NF-κB, incluindo NIK, IKKα, pIKKα e p65. Os resultados demonstraram que os níveis de expressão dessas proteínas foram significativamente regulados negativamente após o tratamento com Munziq, indicando que Munziq inibe a expressão de nós-chave na via de sinalização NF-κB durante o MIRI.
Há extensas evidências que apóiam a noção de que a ativação do NF-κB desencadeia a produção de proteínas inflamatórias e moléculas de adesão, resultando no recrutamento de linfócitos55. Por exemplo, Valen et al.56 descobriram que o NF-κB foi ativado e que os níveis de IL-1β e TNF-α foram elevados durante a isquemia/reperfusão miocárdica. Além disso, a IL-6, uma citocina pró-inflamatória regulada pelo NF-κB, exibe expressão aumentada durante a reperfusão57. Consistente com esses achados, os resultados deste estudo demonstram que o Munziq inibe significativamente os níveis de citocinas pró-inflamatórias (incluindo IL-1β, IL-6 e TNF-α) no contexto da lesão de isquemia/reperfusão miocárdica (MIRI). A partir disso, pode-se inferir que o Munziq exerce seus efeitos inibitórios sobre a expressão de citocinas pró-inflamatórias por meio da supressão da via de sinalização NF-κB.
Em conclusão, os resultados sugerem que o MIRI foi mais grave no ABF. Munziq tem efeitos cardioprotetores na lesão de isquemia e reperfusão. Este efeito protetor pode ser atuado suprimindo a via de sinalização NF-κB. Esses achados sugerem que o Munziq possui grande potencial como agente terapêutico para proteger o coração contra lesões de reperfusão durante a cirurgia cardíaca.
Existem várias limitações do estudo. Em primeiro lugar, o estudo é conduzido em um modelo de rato, que, apesar de ser um modelo translacional valioso, pode não replicar totalmente a complexidade da condição cardiovascular humana. Em segundo lugar, o estudo se concentra principalmente na via de sinalização NF-κB como uma base mecanicista dos efeitos de Munziq. No entanto, o MIRI é um processo multifatorial que pode envolver várias outras vias de sinalização e mecanismos moleculares.
Embora o estudo atual forneça informações valiosas sobre os potenciais efeitos cardioprotetores do Munziq em um modelo de rato de lesão de isquemia-reperfusão miocárdica (MIRI), particularmente no contexto de fluido corporal anormal (ABF), existem várias áreas para exploração futura. Um caminho para pesquisas futuras é realizar estudos in vitro usando cardiomiócitos cultivados para observar diretamente os efeitos do Munziq nas respostas celulares à isquemia e reperfusão. Além disso, a adoção de uma abordagem multiômica pode oferecer uma visão mais abrangente das alterações moleculares associadas ao tratamento com Munziq, potencialmente revelando vias e mecanismos adicionais que contribuem para seus efeitos cardioprotetores. Também seria benéfico explorar diferentes doses de Munziq para determinar a dosagem ideal para cardioproteção máxima, minimizando os possíveis efeitos colaterais. Estudos de longo prazo são necessários para avaliar os efeitos sustentados do Munziq na função cardíaca e monitorar quaisquer efeitos adversos potenciais associados ao uso prolongado.
Divulgações
Os autores não têm nada a divulgar.
CONTRIBUIÇÃO DO AUTOR:
Duolikun Mutailifu realizou os experimentos, Abudusaimi Aini escreveu o rascunho inicial do manuscrito e analisou os dados; Aili Aibibula contribuiu para a concepção e desenho do estudo; Zheng Liu e Abudunaibi Maimaitiaili participaram do desenho do estudo; Abudunaibi Maimaitiaili providenciou os fundos de estudo; e todos os autores leram e aprovaram o manuscrito final.
Agradecimentos
Este trabalho foi apoiado pela Fundação Nacional de Ciências Naturais da China [número da concessão: 82060907] e pelo Programa de Cultivo de Talentos Médicos e de Saúde de Alto Nível 'Tianshan Elite' [Concessão nº. TSYC202301B004].
Materiais
| Name | Company | Catalog Number | Comments |
| ABI 7500 Real-time PCR | ABI, CA, USA | Used for performing qRT-PCR. | |
| Adult male Sprague-Dawley (SD) rat | Animal Experimental Center of Xinjiang Medical University | ||
| Anti-NF-kB p65, anti-NF-kB Inducing Kinase NIK, anti-IKK alpha, anti-IKK alpha (phospho T23), anti-β-actin | Abcam, CA, USA | Used for Western blot analysis targeting specific proteins. | |
| Anti-TTC11/FIS1 Antibody | abcam | ab71498 | Used for protein detection in Western Blot (WB) experiments. |
| BCA Protein Assay Kit | Tiangen Biotech Co., Ltd., Beijing, China | Used for determining protein concentration. | |
| beta-Actin Loading Control antibody Mouse Mab | Sino Biological | 100166-MM10 | Used for protein detection in Western Blot (WB) experiments. |
| ChemiScope 3300 Imaging System | Clinx Science Instruments, Shanghai, China | Used for scanning developed films from Western blot analysis. | |
| ELISA kit for CK-MB detection | Nanjing Jiancheng Bioengeering Institute(Nanjing, China) | Used for detecting levels of cardiac injury indexes | |
| ELISA kit for cTn-T, ICAM-1, IL-1β, IL-6, TNF-α detection | CUSABIO Biotech CO., Ltd. (Wuhan, China) | Used for detecting levels of cardiac injury indexes and inflammatory cytokines in rat serum samples. | |
| FastQuant RT Kit | TIANGEN, Beijing China | Used for reverse transcription of cDNA. | |
| HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG | Thermo Scientific, Basingstoke, UK | ||
| LDH Assay kit and MDA Assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting LDH and MDA levels in myocardium tissues from the infarct area in the left ventricle. | |
| Munziq | provided by Xinjiang Medical University | The main investigational drug in this study | |
| NF-κB p65 (D14E12) XP Rabbit mAb #8242 | CST | 8242S | Used for protein detection in Western Blot (WB) experiments. |
| Nitric Oxide (NO) assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting NO levels at 550 nm in myocardial tissue. | |
| Phospho-NF-κB p65 (Ser536) (93H1) Rabbit mAb #3033 | CST | 3033S | Used for protein detection in Western Blot (WB) experiments. |
| Quantity One software | Bio-Rad Laboratories, Hercules, CA, USA | Used for analyzing Western blot images. | |
| Recombinant Anti-DRP1 Antibody | abcam | ab184247 | Used for protein detection in Western Blot (WB) experiments. |
| RIPA lysis buffer | Boster Biotechnology Co., Ltd., Wuhan, China | AR0105 | Used for extracting total proteins from rat ventricular tissues. |
| Secondary antibodies (HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG) | Thermo Scientific, Basingstoke, UK | Used for detection following primary antibody incubation in Western blot analysis. | |
| SYBR Select Master Mix | ABI, CA, USA | Used in qRT-PCR analysis on ABI 7500 Real-time PCR instrument. | |
| transmission electron microscope | HitachiS-2400 Hitachi, Tokyo, Japan | Used to examine thin sections of ventricular tissues. | |
| Trizol reagent | Invitrogen Co., Carlsbad, California, USA | Used for RNA extraction from ventricular tissues. |
Referências
- Anderson, J. L., Campion, E. W., Morrow, D. A. Acute myocardial infarction. New Engl J Med. 376 (21), 2053-2064 (2017).
- Vos, T., et al. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet. 396 (10258), 1204-1222 (2020).
- Murphy, A., Goldberg, S. Mechanical complications of myocardial infarction. Am J Med. 135 (12), 1401-1409 (2022).
- Heusch, G. Myocardial ischemia/reperfusion: Translational pathophysiology of ischemic heart disease. Medicine. 5 (1), 10-31 (2024).
- Bhatt, D. L., Lopes, R. D., Harrington, R. A. Diagnosis and treatment of acute coronary syndromes. Jama. 327 (7), 662-675 (2022).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: A target for cardioprotection. Cardiovasc Res. 115 (7), 1143-1155 (2019).
- Gunata, M., Parlakpinar, H. A review of myocardial ischaemia/reperfusion injury: Pathophysiology, experimental models, biomarkers, genetics and pharmacological treatment. Cell Biochem Funct. 39 (2), 190-217 (2020).
- He, J., et al. Myocardial ischemia/reperfusion injury: Mechanisms of injury and implications for management (review). Exp Ther Med. 23 (6), 430 (2022).
- Xiang, M., et al. Role of oxidative stress in reperfusion following myocardial ischemia and its treatments. Oxid Med Cell Longevity. 2021, 1-23 (2021).
- Astudillo, A. M., Balboa, M. A., Balsinde, J. Compartmentalized regulation of lipid signaling in oxidative stress and inflammation: Plasmalogens, oxidized lipids and ferroptosis as new paradigms of bioactive lipid research. Prog Lipid Res. 89, 101207 (2023).
- Algoet, M., et al. Myocardial ischemia-reperfusion injury and the influence of inflammation. Trends Cardiovasc Med. 33 (6), 357-366 (2023).
- Zhang, F., et al. Β-cryptoxanthin alleviates myocardial ischaemia/reperfusion injury by inhibiting nf-κb-mediated inflammatory signalling in rats. Arch Physiol Biochem. 128 (4), 1128-1135 (2020).
- Guo, Q., et al. Nf-κb in biology and targeted therapy: New insights and translational implications. Signal Transduct Target Ther. 9 (1), 53 (2024).
- Mi, J., et al. Inhibition of heat shock protein family a member 8 attenuates spinal cord ischemia-reperfusion injury via astrocyte nf-κb/nlrp3 inflammasome pathway. J Neuroinflammation. 18 (1), 170 (2021).
- Zhang, L., Zhao, S., Wang, Y. Diannexin alleviates myocardial ischemia-reperfusion injury by orchestrating cardiomyocyte oxidative damage, macrophage polarization and fibrotic process by tlr4-nf-kb-mediated inactivation of nlrp3 inflammasome. Int Immunopharmacol. 130, 111668 (2024).
- Zhou, Y., et al. Qingchang mixture prevents the intestinal ischemia-reperfusion injury through tlr4/nf-kb pathway. Combinatorial Chem High Throughput Screen. 26 (1), 49-57 (2023).
- Ozturk, A., et al. The protective effects of trimetazidine against ovary ischemia-reperfusion injury via the tlr4/nf-kb signal pathway. J Biochem Mol Toxicol. 36 (8), e23114 (2022).
- Du, S., Deng, Y., Yuan, H., Sun, Y. Safflower yellow b protects brain against cerebral ischemia reperfusion injury through ampk/nf-kb pathway. Evid Based Compl Alt Med. 2019, 1-11 (2019).
- Dong, X., et al. Physcion protects rats against cerebral ischemia-reperfusion injury via inhibition of tlr4/nf-kb signaling pathway. Drug Design Dev Therapy. 15, 277-287 (2021).
- Hashmi, S., et al. Hydrogen sulphide treatment prevents renal ischemia-reperfusion injury by inhibiting the expression of icam-1 and nf-kb concentration in normotensive and hypertensive rats. Biomolecules. 11 (10), 1549 (2021).
- Gao, L., et al. Hic-5 deficiency attenuates hepatic ischemia reperfusion injury through tlr4/nf-κb signaling pathways. Life Sciences. 249, 117517 (2020).
- Xu, Z., et al. Cardioprotection of mab2g4/odn/lip on myocardial ischemia-reperfusion injury via inhibiting the nf-κb signaling pathway. Cardiovas Ther. 2023, 1-15 (2023).
- Xiao, G., et al. Cxcr1 and its downstream nf-κb inflammation signaling pathway as a key target of guanxinning injection for myocardial ischemia/reperfusion injury. Front Immunol. 13, 1007341 (2022).
- Jeddi, S., Gheibi, S., Kashfi, K., Carlström, M., Ghasemi, A. Dose-dependent effects of long-term administration of hydrogen sulfide on myocardial ischemia-reperfusion injury in male wistar rats: Modulation of rkip, nf-κb, and oxidative stress. Int J Mol Sci. 21 (4), 1415 (2020).
- Yao, Y., et al. Targeting camkii-δ9 ameliorates cardiac ischemia/reperfusion injury by inhibiting myocardial inflammation. Circ Res. 130 (6), 887-903 (2022).
- Zhuang, L., Zong, X., Yang, Q., Fan, Q., Tao, R. Interleukin-34-nf-κb signaling aggravates myocardial ischemic/reperfusion injury by facilitating macrophage recruitment and polarization. eBioMedicine. 95, 104744 (2023).
- Maimaitiaili, A., et al. Effects of different doses of savda munziq on myocardial ischemia-reperfusion injury in rats with abnormal savda syndrome. Genet Mol Res. 13 (3), 4729-4735 (2014).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Hao, Y., et al. Transition of the abnormal savda syndrome to the hepatic carcinoma shifted unfolded protein response to autophagy was partly reversed by savda munziq in a rat model. Biomed Pharmacother. 121, 109643 (2020).
- Maimaitiaili, A., Li, J., Aibibula, A., Abudureheman, M. Erratum: Inhibition of nuclear factor kappa b pathway protects myocardial ischemia/reperfusion injury in rats under treatment with fufang munziq granule (munziq). Am J Transl Res. 10 (11), 3876 (2018).
- Zhang, X., et al. Rosa rugosa flavonoids alleviate myocardial ischemia reperfusion injury in mice by suppressing jnk and p38 mapk. Microcirculation. 24 (7), (2017).
- Dong, P., Liu, K., Han, H. The role of nf-κb in myocardial ischemia/reperfusion injury. Curr Prot Peptide Sci. 23 (8), 535-547 (2022).
- Guo, X., et al. Differential integrative omic analysis for mechanism insights and biomarker discovery of abnormal savda syndrome and its unique munziq prescription. Sci Rep. 6, 27831 (2016).
- Awad, A. S. Role of at1 receptors in permeability of the blood-brain barrier in diabetic hypertensive rats. Vascul Pharmacol. 45 (3), 141-147 (2006).
- La, X., et al. Upregulation of pd-1 on cd4(+)cd25(+) t cells is associated with immunosuppression in liver of mice infected with echinococcus multilocularis. Int Immunopharmacol. 26 (2), 357-366 (2015).
- Wu, T., et al. Circulating small extracellular vesicle-encapsulated sema5a-it1 attenuates myocardial ischemia-reperfusion injury after cardiac surgery with cardiopulmonary bypass. Cell Mol Biol Lett. 27 (1), 95 (2022).
- Pinto, A., et al. The extracellular isoform of superoxide dismutase has a significant impact on cardiovascular ischaemia and reperfusion injury during cardiopulmonary bypass. Eur J Cardio-Thor Surg. 50 (6), 1035-1044 (2016).
- Sabe, S. A., Harris, D. D., Broadwin, M., Sellke, F. W. Cardioprotection in cardiovascular surgery. Basic Res Cardiol. 119 (4), 545-568 (2024).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Mamtimin, B., et al. An magnetic resonance-based plasma metabonomic investigation on abnormal savda in different complicated diseases. J Tradl Chinese Med. 34 (2), 166-172 (2014).
- Marin, W., Marin, D., Ao, X., Liu, Y. Mitochondria as a therapeutic target for cardiac ischemia-reperfusion injury (review). Int J Mol Med. 47 (2), 485-499 (2020).
- Novack, V., et al. Troponin criteria for myocardial infarction after percutaneous coronary intervention. Arch Intern Med. 172 (6), 502-508 (2012).
- Kemp, M., Donovan, J., Higham, H., Hooper, J. Biochemical markers of myocardial injury. Br J Anaesth. 93 (1), 63-73 (2004).
- Zhang, D. Z., Jia, M. Y., Wei, H. Y., Yao, M., Jiang, L. H. Systematic review and meta-analysis of the interventional effects of resveratrol in a rat model of myocardial ischemia-reperfusion injury. Front Pharmacol. 15, 1301502 (2024).
- Ta, F. X., Zhang, T., Zhu, C. M. Correlation between mir-21 and the protective effects of resveratrol against myocardial ischemia/reperfusion injury in rats. Chin. J. Arteriosclerosis. 21 (6), 493-496 (2013).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. Am J Physiol Heart Circ Physiol. 314 (4), H812-H838 (2018).
- Oeckinghaus, A., Hayden, M. S., Ghosh, S. Crosstalk in nf-kappab signaling pathways. Nat Immunol. 12 (8), 695-708 (2011).
- Van Der Heiden, K., Cuhlmann, S., Luong Le, A., Zakkar, M., Evans, M. Role of nuclear factor kappab in cardiovascular health and disease. Clin Sci. 118 (10), 593-605 (2010).
- Ha, T., et al. Toll-like receptors: New players in myocardial ischemia/reperfusion injury. Antioxid Redox Signal. 15 (7), 1875-1893 (2011).
- Pourrajab, F., Yazdi, M. B., Zarch, M. B., Zarch, M. B., Hekmatimoghaddam, S. Cross talk of the first-line defense tlrs with pi3k/akt pathway, in preconditioning therapeutic approach. Mol Cell Ther. 3, 4 (2015).
- Wang, Y. H., et al. Lumbrokinase attenuates myocardial ischemia-reperfusion injury by inhibiting tlr4 signaling. J Mol Cell Cardiol. 99, 113-122 (2016).
- Yu, H., et al. Gypenoside protects cardiomyocytes against ischemia-reperfusion injury via the inhibition of mitogen-activated protein kinase mediated nuclear factor kappa b pathway in vitro and in vivo. Front Pharmacol. 7, 148 (2016).
- Liu, X., et al. Peroxisome proliferator-activated receptor gamma (ppargamma) mediates the protective effect of quercetin against myocardial ischemia-reperfusion injury via suppressing the nf-kappab pathway. Am J Transl Res. 8 (12), 5169-5186 (2016).
- Han, D., et al. Hydroxysafflor yellow a alleviates myocardial ischemia/reperfusion in hyperlipidemic animals through the suppression of tlr4 signaling. Sci Rep. 6, 35319 (2016).
- Yang, Q., He, G. W., Underwood, M. J., Yu, C. M. Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury: Perspectives and implications for postischemic myocardial protection. Am J Transl Res. 8 (2), 765-777 (2016).
- Valen, G., Paulsson, G., Vaage, J. Induction of inflammatory mediators during reperfusion of the human heart. Ann Thorac Surg. 71 (1), 226-232 (2001).
- Saini, H. K., et al. Role of tumour necrosis factor-alpha and other cytokines in ischemia-reperfusion-induced injury in the heart. Exp Clin Cardiol. 10 (4), 213-222 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados