Research Article
Herbal Munziq은 염증을 억제하여 심근 허혈-재관류 손상을 개선합니다.
요약
이 연구는 비정상적인 체액을 가진 쥐의 심근 허혈-재관류 손상(MIRI)에 대한 전통적인 위구르 약초 제제인 Munziq의 심장 보호 효과를 조사합니다. 포괄적인 실험 방법을 통해 NF-κB 신호 경로를 억제하여 MIRI를 완화할 수 있는 Munziq의 잠재력을 입증했습니다.
초록
이 연구의 목적은 비정상적인 체액 심근 허혈-재관류 손상(MIRI)에 대한 Munziq의 심장 보호 효과와 그 기전을 조사하는 것이었습니다. 정상 쥐와 비정상적인 체액(ABF)이 있는 쥐는 21일 동안 Munziq으로 전처리했습니다. 이에 따라 MIRI 모델이 확립되었습니다. 심근 손상의 병리학적 징후를 관찰하기 위해 Hematoxylin 및 Eosin(HE) 염색 및 투과 전자 현미경으로 조직병리학적 변화와 심근 초구조 변화를 관찰했습니다. 혈청 CK-MB, cTn-T 및 ICAM-1 수치는 심근 손상 관련 마커를 관찰하기 위해 ELISA(Enzyme-Linked Immunosorbent Assay)에 의해 검출되었습니다. 혈청과 심근 조직의 IL-1β, IL-6 및 TNF-α 수준도 ELISA에 의해 검출되어 항염증 효과를 관찰했습니다. NF-κB 신호 경로 관련 단백질 NIK, IKKα, Pikα 및 p65의 발현 수준은 웨스턴 블롯 분석을 통해 검출되었습니다. 그 결과, ABF MIRI 투여군의 심근 손상이 대조군 MIRI 투여군에 비해 더 심각한 것으로 나타났다. Munziq 전처리는 허혈-재관류 손상으로 인한 병리학적 변화를 완화하고 심장 기능을 보호할 수 있는 잠재력이 있습니다. NF-κB 경로와 다운스트림 효과기 IL-1β, IL-6 및 TNF-α의 단백질 수치는 MIRI 그룹에서 유의하게 상향 조절된 반면, Munziq 그룹에서는 하향 조절되었습니다. 흥미롭게도, ABF MIRI 그룹에서 NF-κB 신호전달 경로가 더 많이 활성화되고 다운스트림 염증성 사이토카인 수치가 더 높았습니다. 연구 결과는 MIRI가 ABF에서 더 심각하다는 것을 시사한다. Munziq은 허혈 및 재관류 손상에 대한 심장 보호 효과가 있습니다. 이러한 보호 효과는 NF-κB 신호전달 경로를 억제함으로써 작용할 수 있습니다.
서문
심근허혈(Myocardial ischemia)은 주로 관상동맥의 협착증 또는 혈전증으로 인해 심근에 적절한 혈류가 공급되지 않는 상태로1, 환자에게 치명적인 결과를 초래할 수 있다 2,3. 심근 대사는 거의 전적으로 유산소 질환이며 글리코겐 저장량이 매우 제한되어 있기 때문에 주로 PCI 또는 정맥 혈전용해술을 통해 혈액 공급을 신속하게 회복하는 것이 필수적입니다. 효과적인 심근 재관류는 허혈성 심근의 예후를 개선하는 데 중요하지만, 심근 허혈-재관류 손상(MIRI)의 위험도 초래합니다4,5,6. MIRI는 심근 재관류 요법의 효능에 영향을 미치는 중요한 과제입니다7. 다양한 요인과 메커니즘이 MIRI의 발전에 기여합니다. 예를 들어, 내피 세포에서 재관류는 활성 산소 종(ROS)의 축적과 자유 라디칼 제거제의 고갈을 유도하여 산화 스트레스의 존재를 나타냅니다 4,8. 이러한 산화 스트레스는 이후 염증 반응을 유발하여 염증 인자의 방출 증가, 접착 분자 생산 증가 및 백혈구 동원으로 이어질 수 있습니다 9,10,11. 활성화된 B 세포의 핵 인자 카파-경쇄-강화제(NF-κB) 경로는 심근허혈/재관류 손상 중 염증 반응에 중요한 역할을 한다12. 포유류 NF-κB 전사 인자 패밀리는 NF-κB1(p105/p50이라고도 함), NF-κB2(p100/p52라고도 함), p65(RELA라고도 함), RELB(V-Rel 망상내피 바이러스 종양유전자의 상동체) 및 c-REL13,14의 5개 구성원을 포함합니다. NF-κB 경로의 억제는 심근12,15, 장16, 난소17, 뇌18,19, 신장20, 간21을 포함한 다양한 조직의 허혈/재관류 손상을 완화하는 것으로 나타났습니다. 특히, NF-κB 신호전달 경로는 허혈 및 재관류에 대한 심근 반응의 중추적인 매개체로 광범위하게 문서화되어 왔으며12,14, 가능한 메커니즘에는 염증 반응 촉진, 세포 접착 분자의 발현 조절, 산화 스트레스 반응 참여, 세포 사멸 및 생존 경로 영향 등이 포함됩니다 12,20,22,23,24,25. NF-κB 활성화를 약화시키는 것을 목표로 하는 치료적 개입은 MIRI23,26을 완화하는 데 상당한 잠재력을 보여주었습니다.
중국 전통 의학의 필수적인 부분인 위구르 의학은 불, 공기, 물, 흙의 네 가지 체액 이론에 기초합니다. 이러한 체액은 혈액, 가래, 노란 담즙, 검은 담즙과 같은 체액을 생성한다27,28. 이 네 가지 체액 사이에서 동적 항상성을 유지하는 것은 인체의 전반적인 건강에 매우 중요합니다. 불균형 체액이라고 하는 이러한 체액의 불균형은 질병의 발병을 초래할 수 있습니다. 다양한 불균형 체액 중에서 가장 두드러진 것은 비정상 체액(ABF)으로 알려져 있으며, 비정상 사브다 증후군(ASS)으로도 알려져 있습니다27,28. 위구르 의사들이 광범위하게 사용하는 전통 위구르 의학인 문지크(Munziq)는 비정상적인 체액을 치료하기 위해 처방됩니다. Cordia dichotoma Forst. f., Anchusaitalica Retz., Glycyrrhiza uralensis Fisch., Adiantum capillusveneris L., Euphorbia humifusa Willd., Ziziphus jujuba Mill., Lavandula angustifolia Mill., Foeniculum vulgare Mill., Melissa officinalis L., Alhagi pseudoalhagi Desv 등 10종의 약초로 구성된 약초 제제입니다29. Munziq은 2003년 국가 식품의약국(FDA)의 코드 번호 Z65020166로 승인되었습니다. 그것의 활성 화학 성분은 황동, 페놀, 유기산, 아미노산, 사포닌, 설탕 등을 포함합니다. Munziq는 항산화, 항염증, 면역 조절, 항혈소판 응집, 항혈전 효과 등 다양한 효과를 나타냅니다 27,28,30.
이전 연구에서는 Munziq 약물이 심근 허혈/재관류 손상(MIRI)을 완화할 수 있음을 보여주었지만 구체적인 메커니즘은 불분명합니다. 비정상적인 Savda 증후군이 있는 심근허혈-재관류 손상 쥐에서 Munziq의 심근 보호 효과가 나타났습니다. 핵 인자 kappa b 경로의 억제는 Fufang Munziq 과립 (Munziq)으로 치료중인 쥐의 심근 허혈 / 재관류 손상을 보호합니다 27,28,30. 그러나 MIRI에서 Munziq의 역할과 메커니즘을 조사한 연구는 제한적입니다.
본 연구는 비정상적인 체액(ABF)을 가진 쥐의 심근허혈-재관류 손상(MIRI)에 대한 Munziq의 심장 보호 효과를 조사하고 특히 NF-κB 신호 경로에 초점을 맞춰 기저 메커니즘을 탐구하는 것을 목표로 합니다. 이 연구에서 제안된 가설은 Munziq 전처리가 NF-κB 신호 경로와 다운스트림 염증 반응을 억제함으로써 MIRI에 의해 유도된 병리학적 변화를 완화하고 심장 기능을 보호할 수 있다는 것입니다. 가설은 대조군과 ABF 그룹 모두에서 가짜, 허혈-재관류 손상(MIRI) 및 허혈-재관류 손상 + Munziq 모델을 설정하여 테스트됩니다. 심장 기능, 염증 관련 지표 및 NF-κB 경로와 관련된 단백질을 모니터링합니다.
프로토콜
체중이 200-220g인 성체 수컷 Sprague-Dawley(SD) 쥐는 실험실 동물의 관리 및 사용에 대한 미국 국립보건원(National Institutes of Health) 지침에 따라 사용되었습니다. 신장 의과 대학의 동물 실험 센터. 비정상 체액(ABF)을 가진 동물 모델은 신장 의과대학의 실험동물센터(Experimental Animal Center of Xinjiang Medical University)에서 제공했다. 쥐는 앞서 설명한 바와 같이 건조하고 추운 환경에 보관되었으며, 이는 전통적인 위구르 의학 이론에 따라 쥐의 비정상적인 체액(ABF) 모델을 확립하는 데 필수적이며 이전 연구에서 입증된 바와 같습니다29,33. 모든 동물 실험은 신장 의과대학의 윤리 지침에 따라 수행되었으며 ARRIVE 지침에 따라 수행되었습니다. 척추동물(쥐) 연구를 위한 프로토콜은 신장 의과대학의 기관 윤리 위원회(IACUC-20200318-16)에서 승인되었습니다.
1. 동물분류, 의약품투여, MIRI 모델 수립
- 쥐를 i) 대조군 가짜 그룹, ii) 대조군 MIRI 그룹, iii) ABF 가짜 그룹, iv) ABF MIRI 그룹, v) 대조군 MIRI + Munziq 그룹 및 vi) ABF MIRI + Munziq 그룹의 6개 그룹에 무작위로 할당합니다.
- ABF 그룹의 쥐를 6°C ± 1°C의 온도와 25%에서 32.8%의 상대 습도 범위로 설정된 기후 상자 내의 통제된 환경에 수용합니다. 쥐에게 건조 차가운 음식, 즉 보리와 고수 씨앗을 7 : 1.5 : 1.5의 비율로 혼합 한 일반 사료를 제공하고이 방법을 21 일 동안 적용하여 ABF 모델을 확립합니다29,33.
- MIRI 수술 전 21일 동안 Munziq 그룹에 5g/kg Munziq(1mL 증류수에 녹인 Munziq 5.0g)를 위내 투여로 투여하며, 이는 효과적인 임상 용량의 두 배입니다. Control Sham, Control MIRI 및 Control MIRI + Munziq 그룹과 같은 비 ABF 동물의 경우 가짜 그룹 및 MIRI 그룹과 동일한 양의 일반 식염수를 투여하고 Munziq 그룹에는 Munziq의 위내 투여를 제공합니다.
- 21일간의 전처리 후 MIRI 모델을 확립합니다.
- 멸균 환경을 보장하기 위해 멸균 재료가 구비된 전용 동물 수술실에서 수술을 진행하십시오. 펜토바르비탈나트륨(35mg/kg)의 복강내 주사(IP)로 쥐를 마취합니다. 근육 이완, 외부 자극에 대한 반응성, 호흡수 및 깊이를 관찰하여 마취 효과를 평가합니다. 절차 전반에 걸쳐 15분마다 이러한 매개변수를 모니터링합니다. 부적절한 마취의 징후가 나타나면(근육 긴장, 자극에 대한 눈에 띄는 반응, 호흡수 증가 또는 얕음) 20mg/kg의 추가 용량을 투여하십시오. 최종 혈액 채취까지 전체 절차 동안 마취를 유지하십시오. 시술하는 동안 직장 온도 프로브를 통해 지속적으로 모니터링하는 가열 패드를 사용하여 쥐의 체온을 37°C로 유지합니다. 마취 중 건조를 방지하기 위해 수의사 연고를 눈에 바르십시오.
- 인공호흡기 보조 호흡을 위한 기관절개술을 수행합니다. 심장을 노출시키기 위해 흉부를 열기 전에 비눗물로 수술 부위를 씻고 수술 부위를 면도한 다음 클로르헥시딘 및 요오드와 같은 소독액으로 해당 부위를 청소하십시오. 시술에는 멸균 기구를 사용하십시오.
- 가슴을 열고 심장을 노출시키려면 가위, 집게, 견인기를 포함한 표준 멸균 흉부 수술 기구를 사용하십시오. 흉벽을 열고 심장을 드러냅니다. 직접 시각화에서 좌측 전방 하강(LAD) 동맥을 식별합니다. 심장 표면에 있는 왼쪽 관상 동맥의 주요 가지입니다. 6-0 봉합사(4-5cm)를 사용하고 LAD(왼쪽 전방 내림차순)를 30분 동안 결찰하여 국소 허혈을 유발합니다. 효과적인 LAD 폐색은 심근에서 옅은 색을 관찰하여 결정합니다.
- 결찰술 30분 후 결찰을 풀고 120분 동안 재관류를 수행합니다. 심근이 밝은 붉은색으로 회복될 때 재관류를 결정합니다. 가짜 수술을 받은 쥐의 경우 LAD 결찰 없이 동일한 절차를 수행합니다.
- 재관류 후, 쥐는 펜토바르비탈 나트륨(sodium pentobarbital, 35 mg/kg, ip)에 의해 유도된 마취 상태를 유지했다(34). 쥐가 깊은 마취에 들어가면 진공 채혈 튜브를 사용하여 복부 대동맥에서 1-2mL의 혈액 샘플을 수집합니다.
- 복부 대동맥에서 혈액 샘플을 채취한 후, 깊은 마취 상태에서 경추 탈구로 쥐를 안락사시킵니다. 멸균 집게와 가위를 사용하여 좌심실의 경색 부위에서 심근 조직을 채취하고, 창백하고 손상된 것처럼 보이는 조직(경색 부위를 나타내는 조직)만 채취합니다. 추가 분석을 위해 수집된 조직을 멸균 용기에 넣습니다.
2. 샘플 수집
- 조직 샘플 채취: 멸균 가위와 멸균 블레이드를 사용하여 심장 방향에 수직인 좌심실 장축의 중간 지점을 따라 심장을 수평으로 두 반으로 교차시킵니다. 정점 부분의 절반을 두 부분으로 나눕니다 : 실온 또는 4 ° C에서 형태 학적 검사를 위해 4 % 파라 포름 알데히드에서 하나를 2-24 시간 동안 보존하고, 다른 하나는 4 ° C에서 1-4 시간 동안 전자 현미경 검사를위한 글루 타르 알데히드로 보존합니다.
- 허혈성 영역과 비허혈성 영역을 포함한 심장의 기저 부분을 두 부분으로 나눕니다: 한 부분을 냉동 용액에 넣고 조직을 액체 질소로 빠르게 동결한 다음 분자 생물학 테스트를 위해 -80°C 초저온 냉동고로 옮깁니다. 다른 신선한 부분은 조직 반응성 산소종(ROS) 수치 및 미토콘드리아 추출을 감지하는 데 사용합니다.
- 혈청 샘플 채취: 실험 종료 시 하대정맥에서 1-2mL의 정맥혈을 채취하고 1000 x g 에서 10분 동안 원심분리한 후 분리 후 -80°C 초저온 냉동고에 혈청을 보관합니다.
3. HE 염색 및 투과 전자 현미경 관찰
- 일상적인 절차에 따라 심실 심근에 HE 염색(hematoxylin-eosin 염색)을 수행합니다35. 4% 파라포름알데히드로 조직을 24시간 동안 고정합니다. 샘플을 파라핀에 삽입하고 4μm 두께의 절편으로 절단한 다음 프로토콜에 따라 헤마톡실린-에오신 염색 방법을 사용하여 염색합니다. 5개의 필드를 무작위로 선택하여 현미경으로 조직병리학적 변화를 관찰합니다.
- 아래 단계에 따라 HE 염색 실험을 위해 각 그룹에서 포르말린으로 고정된 쥐의 심근 조직을 처리합니다.
- 조직 절편을 65°C 인큐베이터에 넣어 1.5-2회 동안 굽습니다.
- 조직 절편을 자일렌에 10분 동안 담그고 자일렌을 교체한 다음 다시 10분 더 담급니다. 무수 알코올 I, II에 각각 5분씩 순차적으로 침지한 후 95%, 90%, 80%, 70% 알코올, 증류수에 각각 5분씩 침지한다.
- 헤마톡실린으로 3분 동안 염색합니다. 알코올에 염산을 첨가하여 몇 초(1-2초) 동안 산성 분화를 수행합니다. 수돗물에서 5분 동안 분화를 종료합니다.
- 증류수, 70%, 80%, 90%, 95% 알코올에 각각 3분, 무수 알코올 I, II에 각각 5분씩 담급니다.
- 에탄올에 0.5% 에신으로 1분 동안 염색하고 95% 에탄올로 섹션을 헹구어 과도한 붉은 색을 제거한 다음 5분 동안 무수 에탄올에 담급니다. 자일렌 I과 II에 각각 5분씩 담급니다.
- 중성 발삼으로 장착하십시오. 현미경으로 조직의 병리학적 변화를 관찰합니다.
4. 혈액 사이토카인 및 심장 손상 지수의 ELISA 검출
- 1000 x g 에서 10분 동안 원심분리하여 말초 혈액에서 쥐 혈청 샘플을 채취하고 -80°C에서 보관합니다. 제조업체의 지침에 따라 아래 설명된 대로 ELISA 키트를 사용하여 혈청 내 CK-MB, cTn-T, ICAM-1과 같은 심장 손상 지수 및 IL-1β, IL-6, TNF-α와 같은 염증성 사이토카인 수준을 감지합니다.
- 모든 시약을 최소 18분 동안 실온(25-30°C)과 평형을 이루고 제조업체의 지침에 따라 시약을 준비하고 사용할 준비를 합니다.
- 표준 웰과 샘플 웰을 설정하며, 표준 웰에는 분석 키트에 제공된 표준 용액의 알려진 농도가 포함되어 있습니다. 이는 테스트 중인 샘플의 특정 분석물 농도를 정량화하기 위해 실험 중에 표준 곡선을 설정하는 데 사용됩니다. 각 웰에 100μL의 표준물질 또는 샘플을 추가하고, 흔들어 부드럽게 혼합하고, 플레이트 씰로 덮고, 37°C에서 2시간 동안 배양합니다.
- 액체를 버리고 디캔팅으로 건조시킨 후 세탁하지 마십시오. 각 웰에 100μL의 비오틴 표지 항체(사전 희석된 1:100) 작업 용액을 추가하고 새 플레이트 씰로 덮은 다음 37°C에서 1시간 동안 배양합니다.
- 우물에서 액체를 버리고 디캔팅으로 건조시킨 다음 플레이트를 3번 세척합니다. 세척당 2분, 웰당 200μL 동안 담그고 디캔팅하여 건조합니다.
- 각 웰에 양고추냉이 과산화효소 표지 스트렙타비딘 작업 용액 100μL를 추가하고 새 플레이트 씰로 덮은 다음 37°C에서 1시간 동안 배양합니다.
- 우물에서 액체를 버리고 디캔팅으로 건조시킨 다음 플레이트를 5번 세척합니다. 세척당 2분, 웰당 200μL 동안 담그고 디캔팅하여 건조합니다.
- 각 웰에 90 μL의 기질 용액을 순차적으로 첨가하고 37 °C의 암흑에서 15-30 분 동안 색상을 현상합니다.
- 각 웰에 50μL의 정지 용액을 순차적으로 첨가하여 반응을 종료합니다. 반응을 중단한 후 5분 이내에 마이크로플레이트 리더를 사용하여 450nm에서 각 웰의 광학 밀도(OD 값)를 순서대로 측정합니다.
5. MDA, NO 및 LDH 수준 측정
- 재관류 후 좌심실의 경색 부위에서 심근 조직(5mm x 7mm)을 채취합니다. 제조업체의 지침에 따라 LDH 분석 키트 및 MDA 분석 키트를 사용하여 LDH(젖산 탈수소효소) 및 MDA(말론디알데히드)를 검출합니다. 제조업체의 지침에 따라 산화질소(NO) 분석 키트를 사용하여 550nm에서 NO를 검출합니다.
6. 웨스턴 블롯 분석
- RIPA lysis를 사용하여 쥐의 심실 조직에서 총 단백질을 추출합니다. BCA 단백질 분석 키트를 사용하여 단백질 농도를 측정합니다.
- 세포 내 단백질을 보존하고 세포 분해를 방지하려면 샘플을 액체 질소에 담가 빠르게 동결시킵니다. 그런 다음 냉동 샘플을 회수하여 분말로 분쇄하고 약 100mg의 샘플을 취하여 예냉각된 1.5mL 원심분리기 튜브에 추가합니다. 400μL의 RIPA 용해 완충액(프로테아제 억제제 및 광범위 포스파타제 억제제 보충)을 추가한 다음 완전히 혼합하고 혼합물을 4°C에서 60분 동안 유지합니다.
- 혼합물을 1000 x g 에서 4°C에서 15분 동안 원심분리합니다. 상층액을 수집하고 BCA 방법을 사용하여 단백질 농도를 측정합니다.
- 표 1에 따라 샘플의 버퍼 시스템과 일치하는 희석제로 BSA 표준물질을 희석합니다.
- 제조업체의 지침에 따라 시약을 준비하십시오. 시료 수에 따라 시약 A와 B를 50:1의 부피 비율로 혼합하여 적절한 양의 BCA 작업 용액을 준비하고 철저히 혼합합니다. BCA 작업 용액을 준비하기 전에 시약 A를 잘 섞도록 흔듭니다.
- 표 1에서 갓 준비한 BSA 표준 용액 20μL와 희석된 샘플(10배 희석)을 취하여 96웰 플레이트에 추가합니다.
- 각 웰에 200μL의 BCA 작업 용액을 넣고 완전히 혼합합니다. 플레이트를 밀봉하고 37°C에서 30분 동안 배양한 다음 실온으로 식히거나 실온에서 2분 동안 둡니다.
- 마이크로플레이트 리더를 사용하여 562nm에서 흡광도를 측정하고 표준 곡선을 기반으로 샘플의 단백질 농도를 계산합니다.
- 샘플에 적당량의 5x SDS-PAGE 로딩 버퍼(β-메르캅토에탄올 함유)를 첨가하고, 단백질을 완전히 변성시키기 위해 끓는 물에 100°C에서 5분 동안 열처리하고, 1,000 x g 에서 5분 동안 원심분리하고, 상등액을 사용하여 사용합니다.
- 표 2의 공식은 15%, 12% 및 8% 분리 겔과 5% 스태킹 겔의 제조를 간략하게 설명합니다. 그에 따라 솔루션을 준비합니다. 분리 젤 용액을 젤 카세트의 2/3 높이까지 추가하고 증류수를 끼워 넣은 다음 실온에서 40분 동안 그대로 둡니다. 그런 다음 스태킹 젤을 추가하여 카세트를 채우고 빗을 삽입한 다음 10분 동안 그대로 둡니다.
- 사전 염색된 단백질 마커 9μL를 각 웰에 로드하고 웰당 50μg의 샘플 단백질을 로드합니다.
- 브로모페놀 블루가 분리 젤에 도달할 때까지 80V의 일정한 전압을 적용한 다음 90분 동안 100V의 일정한 전압을 적용합니다. bromophenol blue가 젤의 아래쪽 부분으로 이동할 때 전기 이동법을 중지하십시오.
- SDS-PAGE의 완료 후에, PVDF 막을 10 s 동안 메탄올에 있는 가라앉히고, 증류수에서 1 분 동안 헹구고, 그 후에 polyacrylamide 젤, 여과지 및 대우된 PVDF 막을 10 분 동안 이동 완충액에 담궈냅니다.
- 클립의 검은색 면이 아래를 향하도록 전사 샌드위치를 조립한 다음 클립의 스폰지 필터 종이-젤-PVDF 멤브레인-필터 종이-스펀지 투명 면을 조립합니다. 클립을 전송 카세트에 넣고 클립의 검은색 면이 카세트의 검은색 면과 향하고 흰색 면이 빨간색 면을 향하도록 합니다. 100V의 정전압에서 전송을 수행하고 전송 시간이 60분인 PVDF 멤브레인을 사용합니다.
- 이식 후 PVDF 멤브레인을 물로 3회씩 5회 세척합니다. 5% 무지방 분유가 함유된 차단 용액으로 멤브레인을 1시간 동안 막은 다음 TBST 3x로 각각 5분 동안 세척합니다.
- 표 3에 열거된 희석 비율에 따라 1차 항체를 TBST로 희석하고 4°C에서 하룻밤 동안 배양한다. 주요 항체는 anti-NF-κB p65 항체, anti-NF-κB Inducing Kinase (NIK) 항체, anti-IKKα 항체 및 anti-β-actin 항체입니다.
- 멤브레인을 3x TBST로 각각 5분 동안 5번 헹굽니다. 적절하게 희석된 2차 항체( 표 3 참조)를 첨가하고 실온에서 1시간 동안 배양합니다. 2차 항체는 HRP-conjugated goat anti-mouse IgG와 HRP-conjugated goat anti-rabbit IgG입니다.
- 멤브레인을 1x TBST 3x로 각각 5분 동안 다시 헹굽니다. 현상 용액 A와 B를 혼합하고 멤브레인에 2mL를 첨가한 다음 미니 화학발광 기기를 사용하여 검출 및 사진을 촬영합니다.
- Enhanced chemiluminescence plus 시약을 사용하여 멤브레인을 개발합니다. 이미징 시스템을 사용하여 현상된 필름을 스캔합니다. 소프트웨어를 사용하여 웨스턴 블롯 이미지를 분석합니다. β-actin을 로딩 컨트롤로 사용합니다. β-actin의 grey 값을 기준으로 상대적인 단백질 수준을 계산합니다.
7. Real-time PCR 분석(qRT-PCR)
- 총 RNA 추출
- 제조업체의 지침에 따라 0.1% DEPC 용액과 70% DEPC 처리 알코올을 준비합니다. 모든 크기의 마이크로 원심분리기 튜브와 다양한 유형의 피펫 팁을 0.1% DEPC 용액으로 처리합니다. 하룻밤 동안 담근 다음 오토클레이브합니다.
- 양호한 성장 상태를 가진 로그 성장 단계에서 세포를 수집합니다. 세포 배양 플라스크에서 배양 배지를 버리고 행크 용액으로 세포를 2x 세척합니다. 세포 10cm²당 트립신 1mL를 첨가하고 부드럽게 흔들어 세포를 분리한 다음 피펫을 사용하여 완전히 분리합니다. 실온에서 5분 동안 배양하여 완전한 용해를 가능하게 한 다음 7x-10x 위아래로 피펫팅하여 세포를 완전히 파괴합니다. 용해물을 1.5mL 튜브로 옮기고 원심분리기한 다음 상층액을 보관합니다.
- 상층액에 같은 부피의 클로로포름을 첨가하고 잘 섞은 후 실온에서 10분 동안 그대로 둡니다. 4°C에서 1,000 x g 에서 5분 동안 원심분리기를 사용하여 상을 분리합니다. 상부 수성상을 새 튜브로 조심스럽게 옮깁니다(DNA와 단백질을 추출하는 경우 하부상을 유지하고 4°C에서 보관).
- 이소프로판올(트리졸 1mL당 0.5mL)을 넣고 잘 섞은 후 실온에서 10분 동안 방치합니다. 4°C에서 1,000 x g에서 10분간 원심분리기를 사용하여 상층액을 부드럽게 제거하고 폐기합니다.
- RNA 펠릿을 75% 에탄올로 세척하고 8,000 x g에서 4°C에서 5분 동안 원심분리한 다음 상층액을 부드럽게 제거하고 펠릿을 자연 건조 또는 진공 건조합니다. RNA를 50μL의 DEPC 물에 용해시키고 분취액을 취한 후 -70°C에서 보관하거나 cDNA로 역전사를 진행합니다.
- cDNA로의 역전사
- 제조업체의 지침에 따라 키트를 사용하여 cDNA의 역전사를 수행합니다.
- Real-time 정량 PCR
- 유전자 염기서열을 기반으로 primer를 설계하고 NCBI 홈페이지에서 BLAST를 이용하여 확인할 수 있습니다. CK20 및 β-actin에 대한 정방향 및 역방향 프라이머의 10μM 원액을 준비합니다. 표 4 는 프라이머 서열을 나타낸다.
- Real-Time 정량 PCR
- 반응 시스템에서 cDNA 1 μL, 2x 마스터 믹스 10 μL, 정방향 및 역방향 프라이머 각각 0.4 μL, RNase-free water 8.2 μL를 추가합니다.
- 다음 프로그램으로 PCR을 수행합니다: 95°C에서 2분 동안 초기 변성, 15초 동안 95°C, 1분 동안 60°C의 40회 사이클. β-actin을 내부 대조군으로 사용하십시오. 2-ΔΔCt 방법을 사용하여 상대 표현식을 계산합니다.
8. 통계 분석
- 통계 분석을 위해 상용 소프트웨어를 사용하십시오. 데이터를 표준 편차± 평균(SD± 평균)으로 표시합니다. 일원 분산 분석을 수행하여 서로 다른 그룹 간의 차이를 비교합니다. 유의한 차이를 p < 0.05로 정의합니다.
결과
Munziq은 허혈-재관류 손상으로 인한 병리학적 변화를 완화합니다.
심근 조직의 형태학적 변화를 조사하기 위해 초기에 HE 염색을 수행했습니다. 그림 1에 나타난 대표적인 HE 염색에서와 같이, 우리는 가짜 그룹의 특정 심근 세포에서 과립 변성 및 액포 변성을 관찰했습니다. 또한 심근 세포 사이에 적혈구와 림프구 침투의 존재가 제한적이었습니다. 주기적으로 혈관 확장과 울혈을 관찰했습니다. MIRI 그룹의 심근 조직은 더 심각한 손상을 보였고 더 뚜렷한 형태학적 변화를 보였습니다. 이러한 변화에는 광범위한 과립 변성, 액포 변성, 적혈구 및 림프구 침윤, 혈관 확장 및 울혈이 포함되었습니다. ABF MIRI 투여군의 심근 조직 손상은 대조군 MIRI 투여군에서 관찰된 것보다 더 심각했다. 그러나 Munziq 그룹 모두에서 일부 심근 세포는 경미한 과립 변성과 액포 변성을 보였습니다. 적혈구와 림프구 침투, 혈관 확장, 울혈 등의 존재는 거의 없었다. 또한, 연구 결과는 Munziq이 ABF MIRI 쥐에서 우수한 심장 보호 효과를 나타내고 MIRI 쥐를 대조군으로 나타낸다는 것을 나타냅니다. 결론적으로, 이러한 결과는 Munziq 전처리가 심장의 허혈-재관류 손상으로 인한 병리학적 변화를 완화할 수 있는 잠재력이 있음을 시사합니다.
Munziq은 허혈/재관류 손상으로 인한 미토콘드리아와 심장 근육 섬유의 파괴를 개선했습니다.
MIRI 손상에서 Munziq의 보호 역할을 추가로 확인하기 위해 TEM을 사용하여 미토콘드리아 미세 구조 및 심장 근육 섬유를 조사했습니다. 그림 2에서 볼 수 있듯이, 가짜 그룹의 심근 세포는 밀접하게 배열된 근섬유와 유사한 육종 길이를 가진 온전한 구조를 보였습니다. 근필라멘트 구조는 투명하고 약간 느슨한 것처럼 보였으며 많은 수의 미토콘드리아가 관찰되었습니다. 반대로, MIRI 그룹은 세포 팽창, 다양한 육종 길이, 불분명하고 느슨하게 배열된 근필라멘트 구조를 포함하여 손상된 심근 세포를 나타내는 병리학적 특성을 보였습니다. I/R 그룹에서 가짜 그룹에 비해 미토콘드리아의 광범위한 파괴 및 해체가 있었다는 점에 주목했습니다. 게다가, 심장 근육 섬유는 불규칙하고 I/R 손상에 대한 반응으로 골절되었습니다. 흥미롭게도, 이러한 변화의 심각성은 ABF MIRI 그룹에서 현저하게 더 높았습니다. 대조적으로, Munziq로 치료받은 두 그룹 모두 손상된 심근 세포와 관련된 완화된 병리학적 특징을 보였습니다. 심근 세포의 부종은 감소했고, 근섬유, 사코메르, 근필라멘트의 구조 및 미토콘드리아의 수는 가짜 그룹에서 관찰된 것과 유사했습니다. 종합적으로 이러한 데이터는 Munziq 전처리가 I/R 수술로 인한 미토콘드리아와 심장 근육 섬유의 파괴를 완화할 수 있음을 나타냅니다.
ABF MIRI 쥐와 Munziq 전처리에서 악화된 심근 허혈-재관류 손상은 심장 기능을 보호했습니다.
cTn-T, CK-MB 및 ICAM-1의 혈청 수치는 ELISA 방법을 사용하여 검출되었습니다. 그 결과, 대조군 가짜 그룹과 ABF 가짜 그룹 간에 눈에 띄는 차이는 없는 것으로 나타났습니다. 그러나, ABF MIRI 그룹이 대조군 MIRI 그룹에 비해 cTn-T(그림 3A), CK-MB(그림 3B) 및 ICAM-1(그림 3C)의 수치가 현저히 높아졌다는 점은 주목할 만하다. Munziq의 심장 보호 효과를 평가하기 위해 대조군 MIRI 쥐와 ABF MIRI 쥐 모두 Munziq 전처리를 받았습니다. 그림 3에서 볼 수 있듯이 cTn-T, CK-MB 및 ICAM-1의 수준은 Munziq 전처리 그룹에서 현저하게 감소했습니다. 이러한 결과는 Munziq이 ABF MIRI 쥐에서 놀라운 심장 보호 특성을 나타낸다는 것을 시사합니다.
ABF 및 대조군 쥐에서 허혈 재관류 유도 산화 스트레스 손상에 대한 Munziq 전처리의 효과를 조사하기 위해 심근 조직에서 LDH, MDA 및 NO의 변화를 측정했습니다. 그림 3D,F에서 볼 수 있듯이, ABF MIRI 그룹은 대조군 MIRI 그룹에 비해 MDA 수치가 현저히 상승하고 NO 수치가 유의하게 감소했습니다. Munziq 전처리는 허혈성 심근에서 LDH 및 MDA의 함량을 유의하게 감소시켰습니다. 동시에 Munziq 전처리는 심근 조직의 NO 수준을 더욱 증가시켰습니다.
Munziq을 사용한 전처리는 전염증성 사이토카인 생성을 방해하여 MIRI의 염증을 완화했습니다.
전염증성 사이토카인은 선천면역 반응을 매개하는 데 중요한 역할을 하며, 전염증성 사이토카인은 MIRI31 동안 활성화되었습니다. Munziq의 항염증 효과를 추가로 조사하기 위해 대조군 MIRI 쥐와 ABF MIRI 쥐 모두 Munziq 전처리를 받았습니다. 혈청 IL-1β, IL-6, TNF-α 수치를 측정하기 위해 ELISA 방법을 사용했고, 심근 조직에서 IL-1β, IL-6, TNF-α의 mRNA 수치를 평가하기 위해 qRT-PCR 분석을 사용했습니다. 그 결과, 이러한 사이토카인 수치는 대조군 가짜 그룹과 ABF 가짜 그룹 간에 유의미한 차이가 없는 것으로 나타났습니다. IL-1β, IL-6 및 TNF-α 수치는 대조군 MIRI 그룹에 비해 ABF MIRI 그룹에서 유의하게 상향 조절되었습니다. 구체적으로, IL-1β는 mRNA와 단백질 수준 모두에서 유의한 증가를 보였으며, 통계적으로 유의미한 차이가 관찰되었습니다. IL-6에 대한 mRNA 수준에는 차이가 없었지만 단백질 수준에서는 차이가 발견되었습니다. 마찬가지로, TNF-α는 mRNA 수준에서는 어떠한 변화도 보이지 않았지만 단백질 수준에서는 차이를 보였다. 그림 4에서 볼 수 있듯이 IL-1β, IL-6 및 TNF-α 수치는 Munziq 전처리 그룹에서 현저하게 감소했습니다.
Munziq을 사용한 전처리는 NF-κB 신호 경로를 통해 염증을 완화시켰습니다.
사이토카인의 생성은 대부분의 염증 반응 단계에서 NF-κB 신호 경로의 활성화와 밀접하게 연결되어 있습니다. NF-κB는 염증성 질환의 잠재적인 치료 대상으로 간주되고 있다32. NF-κB 경로가 Munziq의 항염증 효과와 관련이 있는지 여부를 평가하기 위해 처음에는 NIK, IKKα, pIKKα 및 p65를 포함한 NF-κB 경로의 주요 구성 성분의 발현 수준을 측정하기 위해 웨스턴 블롯 분석을 수행했습니다13. 그림 5에서 볼 수 있듯이, 허혈성 및 재관류 손상은 MIRI 그룹 내에서 NIK, p-IKKα 및 p-p65의 현저한 상향 조절을 유도했습니다. Munziq를 사용한 치료는 이러한 상향 조절을 효과적으로 약화시켰습니다. 그 결과, Munziq는 NF-κB 신호전달 경로의 활성화를 억제함으로써 항염증에 중요한 역할을 하는 것으로 나타났습니다.
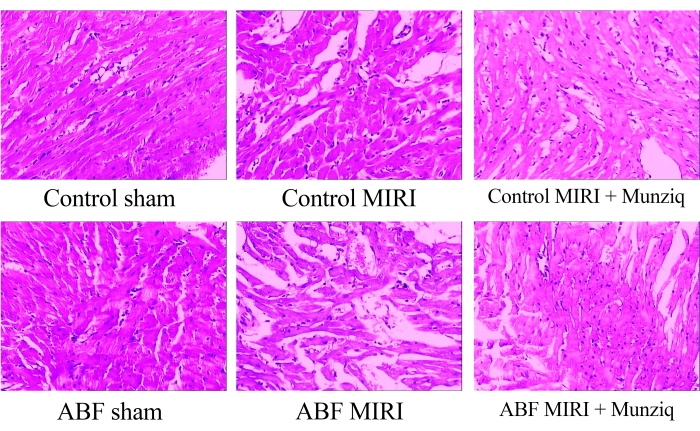
그림 1: HE 염색으로 관찰된 심근 조직의 형태학적 변화. 다양한 그룹의 대표적인 HE 염색 이미지. 배율 : 100x. 약어: ABF = 비정상적인 체액; MIRI = 심근 허혈-재관류 손상; (n=6)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
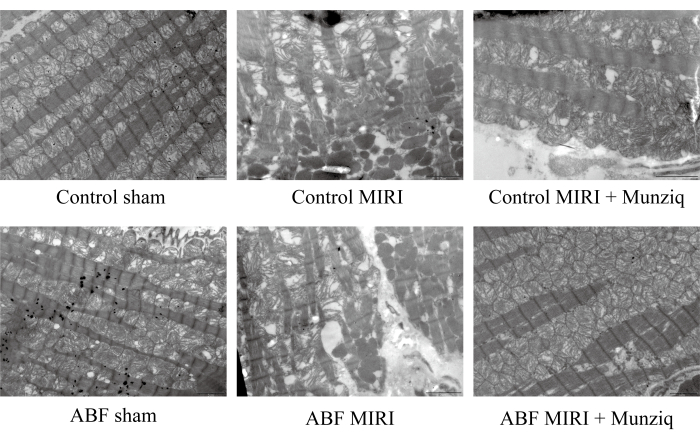
그림 2: Munziq은 I/R 손상으로 인한 미토콘드리아와 심장 근육 섬유의 파괴를 개선했습니다. 미토콘드리아 미세구조와 심장 근육 섬유의 변화를 관찰하기 위해 주사전자현미경을 수행하였다. 대표적인 이미지가 표시되었습니다. 기준자: 5 μm; (n=3)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
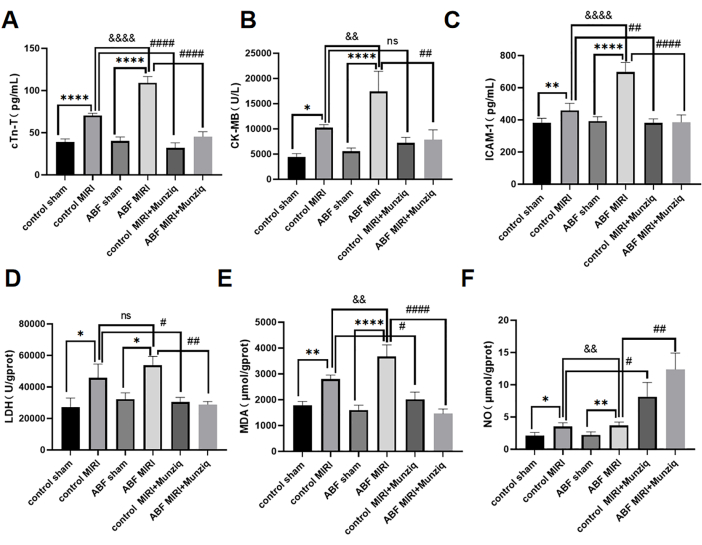
그림 3: ABF MIRI 쥐에서 악화된 심근 허혈-재관류 손상, Munziq 전처리는 심장 기능을 보호할 수 있습니다. (A) 혈청 cTn-T, (B) CK-MB 및 (C) ICAM-1. ELISA에 의해 수치가 검출되었고, 심근 조직(n=6)에서 LDH, MDA 및 NO의 변화를 측정하였다. *p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 가짜 그룹과 비교; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 MIRI 그룹과 비교; &p<0.05, && p<0.01, &&&p<0.001, &&&p<0.0001 대조군과 비교. 데이터는 평균 ± SD로 표시되며, 통계 분석은 일원 ANOVA를 사용하여 수행되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
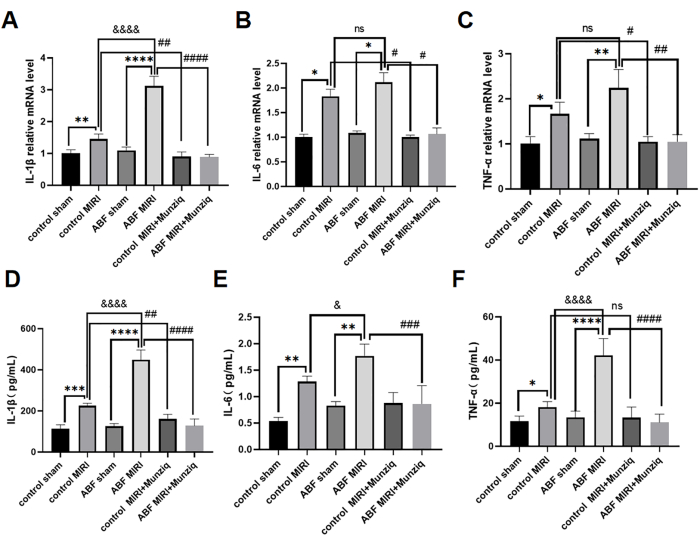
그림 4: Munziq를 사용한 전처리는 전염증성 사이토카인의 생성을 방지하여 MIRI의 염증을 완화했습니다. qRT-PCR은 심근 조직에서 (A) IL-1β, (B) IL-6 및 (C) TNF-α의 mRNA 수치를 검출했습니다. 혈청 내 (D) IL-1β, (E) IL-6 및 (F) TNF-α 수치를 ELISA(n=6)로 측정합니다. *p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 가짜 그룹과 비교; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 MIRI 그룹과 비교; &p<0.05, && p<0.01, &&&p<0.001, &&&p<0.0001 대조군과 비교. 데이터는 평균 ± SD로 표시되며, 통계 분석은 일원 ANOVA를 사용하여 수행되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
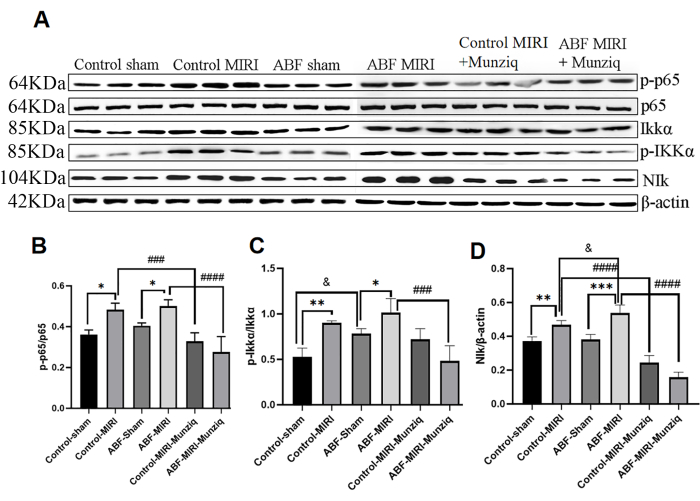
그림 5: Munziq를 사용한 전처리는 NF-κB 신호 경로를 통해 염증을 완화시켰습니다. 심근 조직에서 p-IKKα, IKKα, p-p65, p65 및 NIk 단백질 발현은 웨스턴 블롯(각 그룹당 N=3)으로 검출되었습니다. (A) 웨스턴 블롯 분석에서 관찰된 단백질 띠. (B-D) 상대적 표현 수준은 회색 값에 따라 결정됩니다. *p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 가짜 그룹과 비교; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 MIRI 그룹과 비교; &p<0.05, && p<0.01, &&&p<0.001, &&&p<0.0001 대조군과 비교. 데이터는 평균 ± SD로 표시되며, 통계 분석은 일원 ANOVA를 사용하여 수행되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 튜브 번호 | 희석제 부피 (mL) | BSA 볼륨(소스) | 최종 BSA 농도(mg/mL) |
| A | 0 | 20(원액) | 500 |
| B | 2 | 18(원액) | 400 |
| C | 4 | 16(원액) | 300 |
| D | 6 | 14(원액) | 200 |
| E | 8 | 12 (원액) | 150 |
| F | 12 | 8(원액) | 100 |
| G | 16 | 4(원액) | 50 |
| H | 20 | 0(원액 저장) | 0 |
표 1: BSA 표준 농도 준비 차트.
| 분리 젤 | 15% 스태킹 젤 | 12% 스태킹 젤 | 8% 스태킹 젤 | 5% 스태킹 젤 | |
| 시약 | 음량 | 음량 | 음량 | 시약 | 음량 |
| 탈이온수(mL) | 2.76 | 3.96 | 5.52 | 탈이온수(mL) | 4 |
| 30% 아크릴아미드(mL) | 6 | 4.8 | 3.24 | 30% 아크릴아미드(mL) | 1 |
| 1.5mol / lTris.HCl (PH8.8) (mL) | 3 | 3 | 3 | 1.0M 트리스 HCl (pH6.8; mL) | 1 |
| 10%SDS(μL) | 120 | 120 | 120 | 10%SDS(μL) | 80 |
| 10%AP(μL) | 120 | 120 | 120 | 10%AP(μL) | 60 |
| 테메드(μL) | 4.8 | 4.8 | 7.2 | 테메드(μL) | 8 |
| 총 부피 (mL) | 12 | 12 | 12 | 총 부피 (mL) | 6 |
표 2: 겔 농축 준비.
| 1차 항체 | 희석 비율 | 2차 항체 | 희석 비율 |
| β-액틴 | 1:1000 | 염소 안티 마우스 IgG H&L (HRP) | 1:15000 |
| 65쪽 | 1:1000 | 염소 항토끼 IgG H&L (HRP) | 1:5000 |
| P-P65 | 1:300 | 1:5000 | |
| BCL-2 (영어) | 1:1000 | 1:5000 | |
| 백스 | 1:1000 | 1:5000 | |
| DRP1 | 1:800 | 1:5000 | |
| 피스1 | 1:1000 | 1:5000 | |
| 엠에프엔2 | 1:800 | 1:5000 |
표 3: 항체 희석 비율.
| 유전자 | 프라이머 시퀀스 (5' - 3') | ||
| IL-1β-F | CTGTGACTCGTGGGATGATG | ||
| IL-1β-R | GGGATTTTGTCGTTGCTTGT | ||
| TNF-α-F | GCCTCCTCTCTGCCATCAAG | ||
| TNF-α-R | CTCCAAAGTAGACCTGCCCG | ||
| IL-6-F | GCCCACCAGGAACGAAAGTC | ||
| IL-6-R | GGCAACTGGCTGGAAGTCTC | ||
| 베타 액틴-F | CCCATCTATGAGGGTTACGC | ||
| 베타 액틴-R | 삿삐�� | ||
표 4: 프라이머 염기서열.
토론
MIRI(MIRI)는 심근 허혈-재관류 손상(myocardial ischemia-reperfusion injury)의 약자로, 심장 수술에서 심근 재관류 후 발생하는 흔하고 중요한 합병증이며,36,37, 동시대 대조군에 비해 임상적 결과를 확실히 개선한 약물이나 보조제는 거의 없다38. 따라서 이러한 손상으로부터 심장을 보호하기 위한 효과적인 치료법이 시급히 필요합니다. 전통적인 약초 제제인 Munziq은 심장 허혈-재관류 손상에 대한 특정 치료 효과를 입증했습니다 27,28,30. 그러나 이러한 발견은 예비 단계이며 기본 메커니즘은 아직 알려지지 않았습니다. 본 연구의 목적은 MIRI에 대한 Munziq의 보호 효과와 기전을 추가로 조사하고 검증하는 것이었습니다.
비정상적인 체액은 심혈관 질환을 포함한 다양한 만성 질환의 흔한 증상이라고 하며, 이는 전통적인 위구르 의학39,40에 따르면 그렇다. 위구르족 의료 체계에서 ABF는 장기간의 스트레스의 결과로 여겨지며 다양한 질병의 원인으로 지칭된다39. 본 연구에서는 심장 수술이 필요한 심혈관 질환의 기저 특성을 시뮬레이션하기 위해 비정상 체액 모델을 사용하였다. MIRI는 ABF가 있는 쥐에서 심근 허혈-재관류 손상을 확인하기 위해 유도되었습니다.
허혈 재관류 손상은 여러 과정을 포함하는 복잡한 병리학적 상태입니다. 심장의 허혈-재관류는 심근의 병리학적 변화를 유발하는 것으로 보고되었다4. 이러한 병리학적 변화는 본 연구에서 관찰된 바와 같이 주로 심근세포 단축, 육종 구조 파괴, 미토콘드리아 부종41, 느슨하게 배열된 육종 근섬유로 나타난다. 심근 손상은 또한 혈청 효소의 변화를 초래합니다. 심근 손상 후 혈청 내 cTnT, CK-MB 및 ICAM-1 수치가 증가한다는 것은 잘 알려진 사실이다42,43. 따라서 이러한 바이오마커는 급성 심근 손상의 정도를 평가하는 데 사용됩니다. 본 연구에서는 허혈-재관류 손상 후 심근의 병리학적 변화와 혈청 효소의 상승을 관찰하여 MIRI 모델의 성공적인 확립을 시사하였다. 그 결과, ABF MIRI 투여군의 심근 손상이 대조군 MIRI 투여군에 비해 더 심각한 것으로 나타났다. Munziq 치료 후 병리학적 변화가 눈에 띄게 완화되었고 혈청 효소 수치가 현저히 감소했습니다. 이러한 연구 결과는 MIRI 기간 동안 Munziq의 심장 보호 효과를 입증합니다.
이 연구에서는 좌측 전방 하강동맥(LAD) 동맥을 30분 동안 결찰한 후 120분 동안 재관류를 수행하여 쥐의 허혈-재관류 손상 모델을 확립했습니다. 쥐에서 허혈-재관류 손상 모델을 만드는 데 사용된 43건의 연구를 요약한 메타 분석44 에 따르면 허혈 시간은 30분에서 60분 사이이며 재관류 지속 시간은 30분에서 120분인 것으로 나타났습니다. 일부 연구에서는 허혈 5분 후 재관류 5분을 4x45회 반복하는 프로토콜을 채택했습니다. 이러한 방법 중 30분의 허혈과 120분의 재관류를 포함하는 프로토콜이 가장 자주 사용되었으며, 19건의 사례에서 나타났습니다. 실험 과정에서 허혈 30분 후 직접 육안 검사를 통해 심근의 옅은 착색을 관찰했습니다. 심근 색상 변화에 대한 시각적 평가 외에도 심전도(ECG) 모니터링을 사용하여 ST 분절 상승과 같은 허혈 징후를 식별했습니다. 트로포닌(troponin) 및 크레아틴 키나아제(creatine kinase)를 포함한 혈청 마커와 심박수(HR), 좌심실 이완기 압력(LVDP) 및 좌심실 수축기 혈압(LVSP)과 같은 혈류역학적 매개변수는 모두 허혈 모델의 효과를 평가하는 지표 역할을 할 수 있습니다46. 이 연구에서는 허혈과 재관류의 효과를 평가하기 위해 주로 육안 관찰에 의존했습니다. 쥐 간의 개인차가 있기 때문에 모든 쥐에 균일한 허혈 기간을 적용하는 것보다 허혈의 효능을 평가하기 위한 추가적인 객관적인 측정으로 육안 검사를 보완하는 것이 좋습니다.
포유류에서 NF-κB 계열은 5 개의 구성원으로 구성되며 그 중 하나는 p6513,47입니다. 세포47에서 NF-κB가 활성화되는 두 가지 주요 경로가 있습니다. 표준 경로에서 IKK 복합체(IKKα, IKKβ 및 IKKγ)의 활성화는 IκB 단백질의 인산화를 유도하여 NF-κB 활성화를 시작합니다. 비표준 NF-κB 경로에서 NF-κB 활성화는 NIK 및 IKKα의 인산화에 의해 매개됩니다. 광범위한 증거에 따르면 NF-κB 경로는 허혈 및 재관류 손상을 매개하는 데 중요한 역할을 합니다 48,49,50. NF-κB 활성화를 방해하면 허혈 및 재관류로 인한 손상을 약화시킬 수 있다51,52. 흥미롭게도, ABF MIRI 그룹에서 NF-κB 신호전달 경로가 더 많이 활성화되었고 다운스트림 염증성 사이토카인 수치가 더 높았습니다.
수많은 한의학 약물은 NF-κB 경로를 조절하여 허혈 및 재관류 손상에 대한 보호 효과를 발휘하는 것으로 나타났습니다. 예를 들어, Liu 등[53 ]은 케르세틴이 NF-κB 경로를 억제하여 MIRI를 완화한다는 것을 발견했습니다. Han 등[54 ]은 하이드록시사프플로르 옐로우 A가 TLR4/NF-κB 신호전달을 억제함으로써 MIRI를 완화시킨다고 보고하였다. 그러나 Munziq이 NF-κB 신호 경로를 통해 MIRI에서 보호 역할을 하는지 여부는 아직 밝혀지지 않았습니다. Munziq의 메커니즘을 추가로 설명하기 위해 이 연구는 NIK, IKKα, pIKKα 및 p65를 포함한 NF-κB 신호 경로의 주요 노드의 발현 수준을 분석했습니다. 그 결과, Munziq 치료 후 이러한 단백질의 발현 수준이 유의하게 하향 조절되었음을 보여주었으며, 이는 Munziq이 MIRI 중 NF-κB 신호 경로에서 주요 노드의 발현을 억제한다는 것을 나타냅니다.
NF-κB의 활성화가 염증성 단백질과 접착 분자의 생성을 유발하여 림프구의 동원을 초래한다는 개념을 뒷받침하는 광범위한 증거가 있습니다55. 예를 들어, Valen 등[56 ]은 NF-κB가 활성화되고 심근 허혈/재관류 중에 IL-1β 및 TNF-α 수치가 상승하는 것을 발견했습니다. 또한, NF-κB에 의해 조절되는 전염증성 사이토카인인 IL-6는 재관류 중에 발현이 증가한 것으로 나타났습니다57. 이러한 연구 결과와 일관되게 본 연구의 결과는 Munziq이 심근 허혈/재관류 손상(MIRI)의 맥락에서 전염증성 사이토카인(IL-1β, IL-6 및 TNF-α 포함) 수치를 유의하게 억제한다는 것을 보여줍니다. 이로부터 Munziq이 NF-κB 신호전달 경로의 억제를 통해 전염증성 사이토카인의 발현에 억제 효과를 발휘한다는 것을 추론할 수 있습니다.
결론적으로, 연구 결과는 MIRI가 ABF에서 더 심각하다는 것을 시사한다. Munziq은 허혈 및 재관류 손상에 대한 심장 보호 효과가 있습니다. 이러한 보호 효과는 NF-κB 신호전달 경로를 억제함으로써 작용할 수 있습니다. 이러한 결과는 Munziq이 심장 수술 중 재관류 손상으로부터 심장을 보호하기 위한 치료제로서 큰 잠재력을 가지고 있음을 시사합니다.
이 연구에는 몇 가지 제한 사항이 있습니다. 첫째, 이 연구는 쥐 모델에서 수행되며, 이는 가치 있는 번역 모델임에도 불구하고 인간의 심혈관 상태의 복잡성을 완전히 복제하지 못할 수 있습니다. 둘째, 이 연구는 주로 Munziq 효과의 기계론적 토대로서 NF-κB 신호 경로에 초점을 맞춥니다. 그러나 MIRI는 다양한 다른 신호 전달 경로와 분자 메커니즘을 포함할 수 있는 다인자 과정입니다.
현재 연구는 특히 비정상 체액(ABF)의 맥락에서 심근 허혈-재관류 손상(MIRI)의 쥐 모델에서 Munziq의 잠재적인 심장 보호 효과에 대한 귀중한 통찰력을 제공하지만, 향후 탐구해야 할 몇 가지 영역이 있습니다. 추가 연구를 위한 한 가지 방법은 배양된 심근세포를 사용하여 허혈 및 재관류에 대한 세포 반응에 대한 Munziq의 효과를 직접 관찰하기 위한 체외 연구를 수행하는 것입니다. 또한 다중 오믹스 접근법을 채택하면 Munziq 치료와 관련된 분자 변화에 대한 보다 포괄적인 관점을 제공할 수 있으며, 잠재적으로 심장 보호 효과에 기여하는 추가 경로와 메커니즘을 밝힐 수 있습니다. 또한 잠재적인 부작용을 최소화하면서 최대 심장 보호를 위한 최적의 복용량을 결정하기 위해 다양한 용량의 Munziq를 탐색하는 것도 도움이 될 것입니다. 심장 기능에 대한 Munziq의 지속적인 효과를 평가하고 장기간 사용과 관련된 잠재적인 부작용을 모니터링하기 위해서는 장기적인 연구가 필요합니다.
공개
저자는 공개할 내용이 없습니다.
작성자 기여:
Duolikun Mutailifu가 실험을 수행했고, Abudusaimi Aini가 원고의 초기 초안을 작성하고 데이터를 분석했습니다. Aili Aibibula는 연구의 개념과 설계에 기여했습니다. Zheng Liu와 Abudunaibi Maimaitiaili가 연구 설계에 참여했습니다. 아부두나이비 마이마이티아일리(Abudunaibi Maimaitiaili)는 연구 기금을 마련했다. 그리고 모든 저자는 최종 원고를 읽고 승인했습니다.
감사의 말
이 연구는 중국 국립자연과학재단(National Natural Science Foundation of China)[연구비 수: 82060907]과 '톈산 엘리트(Tianshan Elite)' 고급 의료 및 건강 인재 양성 프로그램[연구비 지원금: ]의 지원을 받았습니다. TSYC202301B004]입니다.
자료
| Name | Company | Catalog Number | Comments |
| ABI 7500 Real-time PCR | ABI, CA, USA | Used for performing qRT-PCR. | |
| Adult male Sprague-Dawley (SD) rat | Animal Experimental Center of Xinjiang Medical University | ||
| Anti-NF-kB p65, anti-NF-kB Inducing Kinase NIK, anti-IKK alpha, anti-IKK alpha (phospho T23), anti-β-actin | Abcam, CA, USA | Used for Western blot analysis targeting specific proteins. | |
| Anti-TTC11/FIS1 Antibody | abcam | ab71498 | Used for protein detection in Western Blot (WB) experiments. |
| BCA Protein Assay Kit | Tiangen Biotech Co., Ltd., Beijing, China | Used for determining protein concentration. | |
| beta-Actin Loading Control antibody Mouse Mab | Sino Biological | 100166-MM10 | Used for protein detection in Western Blot (WB) experiments. |
| ChemiScope 3300 Imaging System | Clinx Science Instruments, Shanghai, China | Used for scanning developed films from Western blot analysis. | |
| ELISA kit for CK-MB detection | Nanjing Jiancheng Bioengeering Institute(Nanjing, China) | Used for detecting levels of cardiac injury indexes | |
| ELISA kit for cTn-T, ICAM-1, IL-1β, IL-6, TNF-α detection | CUSABIO Biotech CO., Ltd. (Wuhan, China) | Used for detecting levels of cardiac injury indexes and inflammatory cytokines in rat serum samples. | |
| FastQuant RT Kit | TIANGEN, Beijing China | Used for reverse transcription of cDNA. | |
| HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG | Thermo Scientific, Basingstoke, UK | ||
| LDH Assay kit and MDA Assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting LDH and MDA levels in myocardium tissues from the infarct area in the left ventricle. | |
| Munziq | provided by Xinjiang Medical University | The main investigational drug in this study | |
| NF-κB p65 (D14E12) XP Rabbit mAb #8242 | CST | 8242S | Used for protein detection in Western Blot (WB) experiments. |
| Nitric Oxide (NO) assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting NO levels at 550 nm in myocardial tissue. | |
| Phospho-NF-κB p65 (Ser536) (93H1) Rabbit mAb #3033 | CST | 3033S | Used for protein detection in Western Blot (WB) experiments. |
| Quantity One software | Bio-Rad Laboratories, Hercules, CA, USA | Used for analyzing Western blot images. | |
| Recombinant Anti-DRP1 Antibody | abcam | ab184247 | Used for protein detection in Western Blot (WB) experiments. |
| RIPA lysis buffer | Boster Biotechnology Co., Ltd., Wuhan, China | AR0105 | Used for extracting total proteins from rat ventricular tissues. |
| Secondary antibodies (HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG) | Thermo Scientific, Basingstoke, UK | Used for detection following primary antibody incubation in Western blot analysis. | |
| SYBR Select Master Mix | ABI, CA, USA | Used in qRT-PCR analysis on ABI 7500 Real-time PCR instrument. | |
| transmission electron microscope | HitachiS-2400 Hitachi, Tokyo, Japan | Used to examine thin sections of ventricular tissues. | |
| Trizol reagent | Invitrogen Co., Carlsbad, California, USA | Used for RNA extraction from ventricular tissues. |
참고문헌
- Anderson, J. L., Campion, E. W., Morrow, D. A. Acute myocardial infarction. New Engl J Med. 376 (21), 2053-2064 (2017).
- Vos, T., et al. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet. 396 (10258), 1204-1222 (2020).
- Murphy, A., Goldberg, S. Mechanical complications of myocardial infarction. Am J Med. 135 (12), 1401-1409 (2022).
- Heusch, G. Myocardial ischemia/reperfusion: Translational pathophysiology of ischemic heart disease. Medicine. 5 (1), 10-31 (2024).
- Bhatt, D. L., Lopes, R. D., Harrington, R. A. Diagnosis and treatment of acute coronary syndromes. Jama. 327 (7), 662-675 (2022).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: A target for cardioprotection. Cardiovasc Res. 115 (7), 1143-1155 (2019).
- Gunata, M., Parlakpinar, H. A review of myocardial ischaemia/reperfusion injury: Pathophysiology, experimental models, biomarkers, genetics and pharmacological treatment. Cell Biochem Funct. 39 (2), 190-217 (2020).
- He, J., et al. Myocardial ischemia/reperfusion injury: Mechanisms of injury and implications for management (review). Exp Ther Med. 23 (6), 430 (2022).
- Xiang, M., et al. Role of oxidative stress in reperfusion following myocardial ischemia and its treatments. Oxid Med Cell Longevity. 2021, 1-23 (2021).
- Astudillo, A. M., Balboa, M. A., Balsinde, J. Compartmentalized regulation of lipid signaling in oxidative stress and inflammation: Plasmalogens, oxidized lipids and ferroptosis as new paradigms of bioactive lipid research. Prog Lipid Res. 89, 101207 (2023).
- Algoet, M., et al. Myocardial ischemia-reperfusion injury and the influence of inflammation. Trends Cardiovasc Med. 33 (6), 357-366 (2023).
- Zhang, F., et al. Β-cryptoxanthin alleviates myocardial ischaemia/reperfusion injury by inhibiting nf-κb-mediated inflammatory signalling in rats. Arch Physiol Biochem. 128 (4), 1128-1135 (2020).
- Guo, Q., et al. Nf-κb in biology and targeted therapy: New insights and translational implications. Signal Transduct Target Ther. 9 (1), 53 (2024).
- Mi, J., et al. Inhibition of heat shock protein family a member 8 attenuates spinal cord ischemia-reperfusion injury via astrocyte nf-κb/nlrp3 inflammasome pathway. J Neuroinflammation. 18 (1), 170 (2021).
- Zhang, L., Zhao, S., Wang, Y. Diannexin alleviates myocardial ischemia-reperfusion injury by orchestrating cardiomyocyte oxidative damage, macrophage polarization and fibrotic process by tlr4-nf-kb-mediated inactivation of nlrp3 inflammasome. Int Immunopharmacol. 130, 111668 (2024).
- Zhou, Y., et al. Qingchang mixture prevents the intestinal ischemia-reperfusion injury through tlr4/nf-kb pathway. Combinatorial Chem High Throughput Screen. 26 (1), 49-57 (2023).
- Ozturk, A., et al. The protective effects of trimetazidine against ovary ischemia-reperfusion injury via the tlr4/nf-kb signal pathway. J Biochem Mol Toxicol. 36 (8), e23114 (2022).
- Du, S., Deng, Y., Yuan, H., Sun, Y. Safflower yellow b protects brain against cerebral ischemia reperfusion injury through ampk/nf-kb pathway. Evid Based Compl Alt Med. 2019, 1-11 (2019).
- Dong, X., et al. Physcion protects rats against cerebral ischemia-reperfusion injury via inhibition of tlr4/nf-kb signaling pathway. Drug Design Dev Therapy. 15, 277-287 (2021).
- Hashmi, S., et al. Hydrogen sulphide treatment prevents renal ischemia-reperfusion injury by inhibiting the expression of icam-1 and nf-kb concentration in normotensive and hypertensive rats. Biomolecules. 11 (10), 1549 (2021).
- Gao, L., et al. Hic-5 deficiency attenuates hepatic ischemia reperfusion injury through tlr4/nf-κb signaling pathways. Life Sciences. 249, 117517 (2020).
- Xu, Z., et al. Cardioprotection of mab2g4/odn/lip on myocardial ischemia-reperfusion injury via inhibiting the nf-κb signaling pathway. Cardiovas Ther. 2023, 1-15 (2023).
- Xiao, G., et al. Cxcr1 and its downstream nf-κb inflammation signaling pathway as a key target of guanxinning injection for myocardial ischemia/reperfusion injury. Front Immunol. 13, 1007341 (2022).
- Jeddi, S., Gheibi, S., Kashfi, K., Carlström, M., Ghasemi, A. Dose-dependent effects of long-term administration of hydrogen sulfide on myocardial ischemia-reperfusion injury in male wistar rats: Modulation of rkip, nf-κb, and oxidative stress. Int J Mol Sci. 21 (4), 1415 (2020).
- Yao, Y., et al. Targeting camkii-δ9 ameliorates cardiac ischemia/reperfusion injury by inhibiting myocardial inflammation. Circ Res. 130 (6), 887-903 (2022).
- Zhuang, L., Zong, X., Yang, Q., Fan, Q., Tao, R. Interleukin-34-nf-κb signaling aggravates myocardial ischemic/reperfusion injury by facilitating macrophage recruitment and polarization. eBioMedicine. 95, 104744 (2023).
- Maimaitiaili, A., et al. Effects of different doses of savda munziq on myocardial ischemia-reperfusion injury in rats with abnormal savda syndrome. Genet Mol Res. 13 (3), 4729-4735 (2014).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Hao, Y., et al. Transition of the abnormal savda syndrome to the hepatic carcinoma shifted unfolded protein response to autophagy was partly reversed by savda munziq in a rat model. Biomed Pharmacother. 121, 109643 (2020).
- Maimaitiaili, A., Li, J., Aibibula, A., Abudureheman, M. Erratum: Inhibition of nuclear factor kappa b pathway protects myocardial ischemia/reperfusion injury in rats under treatment with fufang munziq granule (munziq). Am J Transl Res. 10 (11), 3876 (2018).
- Zhang, X., et al. Rosa rugosa flavonoids alleviate myocardial ischemia reperfusion injury in mice by suppressing jnk and p38 mapk. Microcirculation. 24 (7), (2017).
- Dong, P., Liu, K., Han, H. The role of nf-κb in myocardial ischemia/reperfusion injury. Curr Prot Peptide Sci. 23 (8), 535-547 (2022).
- Guo, X., et al. Differential integrative omic analysis for mechanism insights and biomarker discovery of abnormal savda syndrome and its unique munziq prescription. Sci Rep. 6, 27831 (2016).
- Awad, A. S. Role of at1 receptors in permeability of the blood-brain barrier in diabetic hypertensive rats. Vascul Pharmacol. 45 (3), 141-147 (2006).
- La, X., et al. Upregulation of pd-1 on cd4(+)cd25(+) t cells is associated with immunosuppression in liver of mice infected with echinococcus multilocularis. Int Immunopharmacol. 26 (2), 357-366 (2015).
- Wu, T., et al. Circulating small extracellular vesicle-encapsulated sema5a-it1 attenuates myocardial ischemia-reperfusion injury after cardiac surgery with cardiopulmonary bypass. Cell Mol Biol Lett. 27 (1), 95 (2022).
- Pinto, A., et al. The extracellular isoform of superoxide dismutase has a significant impact on cardiovascular ischaemia and reperfusion injury during cardiopulmonary bypass. Eur J Cardio-Thor Surg. 50 (6), 1035-1044 (2016).
- Sabe, S. A., Harris, D. D., Broadwin, M., Sellke, F. W. Cardioprotection in cardiovascular surgery. Basic Res Cardiol. 119 (4), 545-568 (2024).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Mamtimin, B., et al. An magnetic resonance-based plasma metabonomic investigation on abnormal savda in different complicated diseases. J Tradl Chinese Med. 34 (2), 166-172 (2014).
- Marin, W., Marin, D., Ao, X., Liu, Y. Mitochondria as a therapeutic target for cardiac ischemia-reperfusion injury (review). Int J Mol Med. 47 (2), 485-499 (2020).
- Novack, V., et al. Troponin criteria for myocardial infarction after percutaneous coronary intervention. Arch Intern Med. 172 (6), 502-508 (2012).
- Kemp, M., Donovan, J., Higham, H., Hooper, J. Biochemical markers of myocardial injury. Br J Anaesth. 93 (1), 63-73 (2004).
- Zhang, D. Z., Jia, M. Y., Wei, H. Y., Yao, M., Jiang, L. H. Systematic review and meta-analysis of the interventional effects of resveratrol in a rat model of myocardial ischemia-reperfusion injury. Front Pharmacol. 15, 1301502 (2024).
- Ta, F. X., Zhang, T., Zhu, C. M. Correlation between mir-21 and the protective effects of resveratrol against myocardial ischemia/reperfusion injury in rats. Chin. J. Arteriosclerosis. 21 (6), 493-496 (2013).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. Am J Physiol Heart Circ Physiol. 314 (4), H812-H838 (2018).
- Oeckinghaus, A., Hayden, M. S., Ghosh, S. Crosstalk in nf-kappab signaling pathways. Nat Immunol. 12 (8), 695-708 (2011).
- Van Der Heiden, K., Cuhlmann, S., Luong Le, A., Zakkar, M., Evans, M. Role of nuclear factor kappab in cardiovascular health and disease. Clin Sci. 118 (10), 593-605 (2010).
- Ha, T., et al. Toll-like receptors: New players in myocardial ischemia/reperfusion injury. Antioxid Redox Signal. 15 (7), 1875-1893 (2011).
- Pourrajab, F., Yazdi, M. B., Zarch, M. B., Zarch, M. B., Hekmatimoghaddam, S. Cross talk of the first-line defense tlrs with pi3k/akt pathway, in preconditioning therapeutic approach. Mol Cell Ther. 3, 4 (2015).
- Wang, Y. H., et al. Lumbrokinase attenuates myocardial ischemia-reperfusion injury by inhibiting tlr4 signaling. J Mol Cell Cardiol. 99, 113-122 (2016).
- Yu, H., et al. Gypenoside protects cardiomyocytes against ischemia-reperfusion injury via the inhibition of mitogen-activated protein kinase mediated nuclear factor kappa b pathway in vitro and in vivo. Front Pharmacol. 7, 148 (2016).
- Liu, X., et al. Peroxisome proliferator-activated receptor gamma (ppargamma) mediates the protective effect of quercetin against myocardial ischemia-reperfusion injury via suppressing the nf-kappab pathway. Am J Transl Res. 8 (12), 5169-5186 (2016).
- Han, D., et al. Hydroxysafflor yellow a alleviates myocardial ischemia/reperfusion in hyperlipidemic animals through the suppression of tlr4 signaling. Sci Rep. 6, 35319 (2016).
- Yang, Q., He, G. W., Underwood, M. J., Yu, C. M. Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury: Perspectives and implications for postischemic myocardial protection. Am J Transl Res. 8 (2), 765-777 (2016).
- Valen, G., Paulsson, G., Vaage, J. Induction of inflammatory mediators during reperfusion of the human heart. Ann Thorac Surg. 71 (1), 226-232 (2001).
- Saini, H. K., et al. Role of tumour necrosis factor-alpha and other cytokines in ischemia-reperfusion-induced injury in the heart. Exp Clin Cardiol. 10 (4), 213-222 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유