Research Article
Herbal Munziq mejora la lesión por isquemia-reperfusión miocárdica al inhibir la inflamación
En este artículo
Resumen
Este estudio investiga los efectos cardioprotectores de Munziq, una preparación herbal tradicional uigur, sobre la lesión por isquemia-reperfusión miocárdica (MIRI) en ratas con líquido corporal anormal. A través de métodos experimentales integrales, demostramos el potencial de Munziq para mitigar MIRI mediante la supresión de la vía de señalización NF-κB.
Resumen
El objetivo de este estudio fue investigar los efectos cardioprotectores de Munziq sobre la lesión anormal de isquemia-reperfusión miocárdica (IRIM) y su mecanismo subyacente. Las ratas normales y las ratas con fluido corporal anormal (ABF) fueron pretratadas con Munziq durante 21 días. A raíz de esto, se establecieron los modelos MIRI. Los cambios histopatológicos y los cambios en la ultraestructura miocárdica se observaron mediante tinción con hematoxilina y eosina (HE) y microscopía electrónica de transmisión para observar las manifestaciones patológicas de la lesión miocárdica. Los niveles séricos de CK-MB, cTn-T e ICAM-1 se detectaron mediante un ensayo de inmunoabsorción ligado a enzimas (ELISA) para observar los marcadores relacionados con la lesión miocárdica. Los niveles de IL-1β, IL-6 y TNF-α en suero y tejido miocárdico también se detectaron mediante ELISA para observar el efecto antiinflamatorio. Los niveles de expresión de las proteínas relacionadas con la vía de señalización NF-κB NIK, IKKα, Pikα y p65 se detectaron mediante análisis de Western blot. Los resultados mostraron que la lesión miocárdica en el grupo ABF MIRI fue más grave en comparación con el grupo control. El pretratamiento de Munziq tiene el potencial de mitigar los cambios patológicos inducidos por la lesión por isquemia-reperfusión y podría proteger la función cardíaca. Los niveles de proteínas de la vía NF-κB y los efectores posteriores IL-1β, IL-6 y TNF-α se regularon significativamente al alza en el grupo MIRI, mientras que disminuyeron en el grupo Munziq. Curiosamente, hubo una mayor activación de la vía de señalización NF-κB y niveles más altos de citocinas inflamatorias posteriores en el grupo ABF MIRI. Los resultados sugieren que la MIRI fue más severa en la ABF. Munziq tiene efectos cardioprotectores en la isquemia y la lesión por reperfusión. Este efecto protector puede actuar suprimiendo la vía de señalización NF-κB.
Introducción
La isquemia miocárdica es una condición en la que el miocardio no recibe un flujo sanguíneo adecuado, causada principalmente por estenosis o trombosis de las arterias coronarias1, lo que puede llevar a resultados fatales para los pacientes 2,3. Dado que el metabolismo miocárdico es casi exclusivamente aeróbico y contiene reservas de glucógeno muy limitadas, es esencial restablecer el suministro de sangre rápidamente, principalmente a través de la ICP o la trombólisis intravenosa. Si bien la reperfusión miocárdica efectiva es crucial para mejorar el pronóstico del miocardio isquémico, también introduce el riesgo de lesión por isquemia-reperfusión miocárdica (IRI)4,5,6. La MIRI es un desafío importante que impacta en la eficacia de las terapias de reperfusión miocárdica7. Múltiples factores y mecanismos contribuyen al desarrollo de MIRI. Por ejemplo, en las células endoteliales, la reperfusión induce una acumulación de especies reactivas de oxígeno (ROS) y un agotamiento de los eliminadores de radicales libres, lo que indica la presencia de estrés oxidativo 4,8. Este estrés oxidativo puede desencadenar posteriormente una respuesta inflamatoria, lo que conduce a una mayor liberación de factores inflamatorios, una mayor producción de moléculas de adhesión y el reclutamiento de leucocitos 9,10,11. La vía del factor nuclear kappa-light-chain-enhancer de las células B activadas (NF-κB) desempeña un papel crucial en la respuesta inflamatoria durante la lesión por isquemia/reperfusión miocárdica12. La familia de factores de transcripción NF-κB de mamíferos incluye cinco miembros: NF-κB1 (también conocido como p105/p50), NF-κB2 (también conocido como p100/p52), p65 (también conocido como RELA), RELB (el homólogo del oncogén viral V-Rel reticuloendoteliosis) y c-REL13,14. Se ha demostrado que la inhibición de la vía NF-κB alivia la lesión por isquemia/reperfusión en varios tejidos, incluidos el miocardio 12,15, el intestino16, el ovario17, el cerebro18,19, los riñones20 y el hígado21. En particular, la vía de señalización NF-κB ha sido ampliamente documentada como un mediador fundamental en la respuesta miocárdica a la isquemia y la reperfusión12,14, los posibles mecanismos incluyen la promoción de respuestas inflamatorias, la regulación de la expresión de moléculas de adhesión celular, la participación en reacciones de estrés oxidativo e influencia en las vías de muerte y supervivencia celular 12,20,22,23,24,25. Las intervenciones terapéuticas dirigidas a atenuar la activación de NF-κB han mostrado un potencial significativo en el alivio de MIRI23,26 .
La medicina uigur, parte integral de la medicina tradicional china, se basa en la teoría de los cuatro humores: fuego, aire, agua y tierra. Estos humores dan lugar a fluidos corporales como la sangre, la flema, la bilis amarilla y la bilis negra27,28. El mantenimiento de la homeostasis dinámica entre estos cuatro fluidos corporales es crucial para la salud general del cuerpo humano. Cualquier desequilibrio en estos líquidos, denominado líquido corporal desequilibrado, puede provocar la aparición de enfermedades. Entre los diversos fluidos corporales desequilibrados, el predominante es el conocido como líquido corporal anormal (ABF), también reconocido como síndrome de Savda anormal (SAS)27,28. El munziq, una medicina tradicional uigur ampliamente empleada por los médicos uigures, se prescribe para el tratamiento de fluidos corporales anormales. Es una preparación medicinal a base de hierbas que comprende diez especies medicinales diferentes, como se indica en el prospecto, entre las que se incluyen Cordia dichotoma Forst. f., Anchusaitalica Retz., Glycyrrhiza uralensis Fisch., Adiantum capillusveneris L., Euphorbia humifusa Willd., Ziziphus jujuba Mill., Lavandula angustifolia Mill., Foeniculum vulgare Mill., Melissa officinalis L. y Alhagi pseudoalhagi Desv29. Munziq fue aprobado por la Administración Estatal de Alimentos y Medicamentos en 2003 con el número de código Z65020166. Sus componentes químicos activos abarcan latón, fenoles, ácidos orgánicos, aminoácidos, saponina, azúcar y otros. Munziq presenta múltiples efectos, entre ellos efectos antioxidantes, antiinflamatorios, inmunorreguladores, antiagregación plaquetaria y antitrombóticos 27,28,30.
Nuestros estudios previos han demostrado que el medicamento Munziq puede aliviar la isquemia/lesión por reperfusión miocárdica (MIRI), aunque los mecanismos específicos siguen sin estar claros. Se mostraron los efectos protectores del miocardio de Munziq en ratas con lesión por isquemia-reperfusión miocárdica con síndrome de Savda anormal. La inhibición de la vía del factor nuclear kappa b protege la lesión por isquemia/reperfusión miocárdica en ratas bajo tratamiento con gránulo de Fufang Munziq (Munziq) 27,28,30. Sin embargo, hay pocas investigaciones que investiguen el papel y el mecanismo de Munziq en MIRI.
Este estudio tiene como objetivo investigar los efectos cardioprotectores de Munziq sobre la lesión por isquemia-reperfusión miocárdica (MIRI) en ratas con líquido corporal anormal (ABF) y explorar los mecanismos subyacentes, centrándose especialmente en la vía de señalización NF-κB. La hipótesis propuesta en este estudio es que el pretratamiento con Munziq puede mitigar los cambios patológicos inducidos por MIRI y proteger la función cardíaca, potencialmente mediante la supresión de la vía de señalización NF-κB y las respuestas inflamatorias posteriores. La hipótesis se prueba mediante el establecimiento de modelos simulados, de lesión por isquemia-reperfusión (MIRI) y de lesión por isquemia-reperfusión + Munziq en los grupos control y ABF. Se monitoriza la función cardíaca, los indicadores relacionados con la inflamación y las proteínas asociadas a la vía NF-κB.
Protocolo
Se utilizaron ratas macho adultas Sprague-Dawley (SD) con un peso de 200-220 g de acuerdo con las Directrices de los Institutos Nacionales de Salud para el Cuidado y Uso de Animales de Laboratorio. Centro Experimental Animal de la Universidad Médica de Xinjiang. Los modelos animales con fluido corporal anormal (ABF) fueron proporcionados por el Centro de Animales Experimentales de la Universidad Médica de Xinjiang. Las ratas se mantuvieron en un ambiente seco-frío como se describió anteriormente, lo cual es esencial para establecer el modelo de fluido corporal anormal (ABF) en ratas, de acuerdo con la teoría de la medicina tradicional uigur y como se demostró en estudios previos29,33. Todos los experimentos con animales se llevaron a cabo de acuerdo con las directrices éticas de la Universidad de Medicina de Xinjiang y se llevaron a cabo de acuerdo con las directrices de ARRIVE. El protocolo para estudios con animales vertebrados (ratas) fue aprobado por el comité de ética institucional de la Universidad Médica de Xinjiang (IACUC-20200318-16).
1. Agrupamiento de animales, administración de medicamentos y establecimiento modelo MIRI
- Asigne aleatoriamente ratas a los siguientes seis grupos: i) grupo simulado de control, ii) grupo MIRI de control, iii) grupo simulado ABF, iv) grupo MIRI ABF, v) grupo MIRI + Munziq control y vi) grupo MIRI + Munziq ABF.
- Aloje a las ratas del grupo ABF en un ambiente controlado dentro de cajas climáticas establecidas a una temperatura de 6 °C ± 1 °C y un rango de humedad relativa del 25% al 32,8%. Proporcionar a las ratas alimento ordinario mezclado con alimento frío seco, es decir, semillas de cebada y cilantro en una proporción de 7:1,5:1,5, y aplicar este método durante 21 días para establecer el modelo ABF29,33.
- Administrar por vía intragástrica 5 g/kg de Munziq (5,0 g de Munziq disueltos en 1 mL de agua destilada) al grupo Munziq durante 21 días antes de la cirugía MIRI, lo que supone el doble de la dosis clínica efectiva. En el caso de los animales que no reciben ABF, como los grupos Control Sham, Control MIRI y Control MIRI + Munziq, administrar un volumen igual de solución salina normal al grupo simulado y al grupo MIRI y proporcionar administración intragástrica de Munziq al grupo Munziq.
- Después de 21 días de pretratamiento, establecer el modelo MIRI.
- Realice la cirugía en un quirófano dedicado a animales equipado con materiales estériles para garantizar un entorno estéril. Anestesiar a las ratas con una inyección intraperitoneal (IP) de pentobarbital sódico (35 mg/kg); Observe la relajación muscular, la capacidad de respuesta a los estímulos externos y la frecuencia y profundidad respiratorias para evaluar el efecto anestésico. Controle estos parámetros cada 15 minutos durante todo el procedimiento. Si aparecen signos de anestesia inadecuada (tensión muscular, respuesta notable a los estímulos, frecuencia respiratoria aumentada o superficial), administrar una dosis suplementaria de 20 mg/kg. Mantenga la anestesia durante todo el procedimiento hasta la extracción final de sangre. Durante el procedimiento, mantenga la temperatura corporal de la rata a 37 °C utilizando una almohadilla térmica con monitoreo continuo a través de una sonda de temperatura rectal. Aplique ungüento veterinario en los ojos para evitar la sequedad durante la anestesia.
- Realizar una traqueotomía para la respiración asistida por un ventilador. Antes de abrir el tórax para exponer el corazón, lave el sitio quirúrgico con agua jabonosa, afeite el área quirúrgica y limpie el área con soluciones antisépticas como clorhexidina y yodo. Utilice instrumentos estériles para el procedimiento.
- Para abrir el tórax y exponer el corazón, use instrumentos quirúrgicos torácicos estériles estándar, como tijeras, fórceps y retractores. Abre la pared torácica y expone el corazón. Identifique la arteria descendente anterior izquierda (LAD) bajo visualización directa. Es una rama principal de la arteria coronaria izquierda que se encuentra en la superficie del corazón. Utilice una sutura 6-0 (4-5 cm), ligar el DAA (descendente anterior izquierdo) durante 30 min para inducir isquemia regional. Determine la oclusión efectiva de la DA observando un color pálido en el miocardio.
- Después de 30 min de ligadura, suelte la ligadura y realice la reperfusión durante 120 min. Determinar la reperfusión del miocardio cuando se recupera a un color rojo brillante. En ratas con operación simulada, realizar el mismo procedimiento pero sin ligadura de LAD.
- Después de la reperfusión, las ratas permanecieron bajo anestesia inducida por pentobarbital sódico (35 mg/kg, ip)34. Una vez que las ratas estén bajo anestesia profunda, recoja 1-2 ml de muestras de sangre de la aorta abdominal utilizando un tubo de extracción de sangre al vacío.
- Después de la recolección de muestras de sangre de la aorta abdominal, eutanasiar a las ratas por dislocación cervical mientras aún están bajo anestesia profunda. Recoja el tejido del miocardio de la zona del infarto en el ventrículo izquierdo con pinzas y tijeras estériles, asegurándose de tomar solo el tejido que parece pálido y dañado, lo que indica la región infartada. Coloque el tejido recolectado en un recipiente estéril para su posterior análisis.
2. Recogida de muestras
- Recolección de muestras de tejido: Usando tijeras estériles y una cuchilla estéril, seccione el corazón horizontalmente en dos mitades a lo largo del punto medio del eje largo del ventrículo izquierdo, perpendicular a la dirección del corazón. Divida la mitad de la parte apical en dos porciones: Conserve una en paraformaldehído al 4% para el examen morfológico a temperatura ambiente o 4 °C durante 2-24 h, y la otra en glutaraldehído para microscopía electrónica a 4 °C durante 1-4 h.
- Divida la parte base del corazón, incluidas las áreas isquémica y no isquémica, en dos porciones: coloque una porción en un criovial, congele rápidamente el tejido en nitrógeno líquido y luego transfiéralo a un congelador de temperatura ultrabaja de -80 °C para pruebas de biología molecular. Utilice la otra porción fresca para la detección de los niveles de especies reactivas de oxígeno (ROS) en los tejidos y la extracción mitocondrial.
- Recogida de muestras de suero: Al final del experimento, extraiga 1-2 ml de sangre venosa de la vena cava inferior, centrifugue a 1000 x g durante 10 minutos y almacene el suero en un congelador de temperatura ultrabaja a -80 °C después de la separación.
3. Tinción HE y observación de microscopía electrónica de transmisión
- Realizar la tinción HE (tinción de hematoxilina-eosina) en el miocardio ventricular según el procedimiento rutinario35. Fijar los tejidos en paraformaldehído al 4% durante 24 h. Incrustar las muestras en parafina, cortarlas en secciones de 4 μm de grosor y teñirlas utilizando el método de tinción de hematoxilina-eosina según el protocolo. Seleccione aleatoriamente cinco campos para observar los cambios histopatológicos bajo el microscopio.
- Procese tejidos miocárdicos de ratas que se han fijado en formol, de cada grupo, para experimentos de tinción de HE siguiendo los pasos a continuación.
- Coloque las secciones de tejido en una incubadora a 65 °C para hornear durante 1,5 a 2.
- Sumerja las secciones de tejido en xileno durante 10 minutos, reemplace el xileno y vuelva a sumergir durante otros 10 minutos. Sumerja secuencialmente en alcohol anhidro I y II durante 5 minutos cada uno, seguido de alcohol al 95%, 90%, 80% y 70%, y agua destilada durante 5 minutos cada uno.
- Manchar con hematoxilina durante 3 min. Realizar la diferenciación ácida con ácido clorhídrico añadido en alcohol durante unos segundos (1-2 s). Termine la diferenciación en agua del grifo durante 5 min.
- Sumerja en agua destilada, 70%, 80%, 90% y 95% de alcohol durante 3 min cada uno, y alcohol anhidro I y II durante 5 min cada uno.
- Teñir con eosina al 0,5% en etanol durante 1 min, enjuagar las secciones con etanol al 95% para eliminar el exceso de color rojo, luego sumergir en etanol anhidro durante 5 min. Sumergir en xileno I y II durante 5 minutos cada uno.
- Montura con bálsamo neutro. Observar los cambios patológicos del tejido bajo el microscopio.
4. Detección ELISA de citocinas sanguíneas e índices de lesión cardíaca
- Obtener una muestra de suero de rata de sangre periférica centrifugando a 1000 x g durante 10 min, y almacenar a -80 °C. Detecte los niveles de índices de lesión cardíaca como CK-MB, cTn-T, ICAM-1 y citocinas inflamatorias como IL-1β, IL-6, TNF-α en suero utilizando kits ELISA de acuerdo con las instrucciones del fabricante y como se describe a continuación.
- Deje que todos los reactivos se equilibren a temperatura ambiente (18-25 °C) durante al menos 30 minutos, prepare los reactivos de acuerdo con las instrucciones del fabricante y téngalos listos para su uso.
- Configure pocillos estándar y de muestreo, donde los pocillos estándar contengan concentraciones conocidas de soluciones estándar proporcionadas en el kit de ensayo. Estos se utilizan para establecer una curva estándar durante el experimento para cuantificar la concentración específica de analito en las muestras que se están analizando. Añadir 100 μL de patrón o muestra a cada pocillo, mezclar suavemente agitando, cubrir con una placa sellada e incubar a 37 °C durante 2 h.
- Desechar el líquido, secar por decantación y no lavar. Añadir 100 μL de solución de trabajo de anticuerpos marcados con biotina (prediluidos 1:100) a cada pocillo, cubrir con una nueva placa sellada e incubar a 37 °C durante 1 h.
- Deseche el líquido de los pozos, seque por decantación y lave el plato 3 veces. Remojar durante 2 min por lavado, 200 μL por pocillo, y secar por decantación.
- Agregue 100 μL de solución de trabajo de estreptavidina marcada con peroxidasa de rábano picante a cada pocillo, cubra con un nuevo sello de placa e incube a 37 °C durante 1 h.
- Deseche el líquido de los pozos, seque por decantación y lave el plato 5 veces. Remojar durante 2 min por lavado, 200 μL por pocillo, y secar por decantación.
- Agregue secuencialmente 90 μL de solución de sustrato a cada pocillo y desarrolle el color en la oscuridad a 37 °C durante 15-30 min.
- Agregue secuencialmente 50 μL de solución de parada a cada pocillo para terminar la reacción. Dentro de los 5 minutos posteriores a la detención de la reacción, mida la densidad óptica (valores OD) de cada pocillo en secuencia a 450 nm utilizando un lector de microplacas.
5. Medición del nivel de MDA, NO y LDH
- Después de la reperfusión, recoja tejido de miocardio (5 mm x 7 mm) del área del infarto en el ventrículo izquierdo. Detecte LDH (lactato deshidrogenasa) y MDA (malondialdehído) utilizando el kit de ensayo LDH y el kit de ensayo MDA, siguiendo las instrucciones del fabricante. Detecte el NO a 550 nm utilizando el kit de ensayo de óxido nítrico (NO) de acuerdo con las instrucciones del fabricante.
6. Análisis de Western blot
- Extraiga proteínas totales de los tejidos ventriculares de rata mediante lisis RIPA. Determine la concentración de proteínas con el kit de ensayo de proteínas BCA.
- Para preservar las proteínas intracelulares y evitar la degradación celular, sumerja las muestras en nitrógeno líquido para congelarlas rápidamente. Posteriormente, recupere las muestras congeladas y muélalas hasta convertirlas en polvo, tome aproximadamente 100 mg de la muestra y agréguelas a un tubo de centrífuga preenfriado de 1,5 ml. Añadir 400 μL de tampón de lisis RIPA (complementar con inhibidores de la proteasa y un inhibidor de la fosfatasa de amplio espectro), mezclar bien y dejar reposar la mezcla a 4 °C durante 60 min.
- Centrifugar la mezcla a 1000 x g durante 15 min a 4 °C. Recoger el sobrenadante y medir la concentración de proteínas mediante el método BCA.
- Diluir los patrones BSA con un diluyente que coincida con el sistema tampón de las muestras, de acuerdo con la Tabla 1.
- Prepare los reactivos de acuerdo con las instrucciones del fabricante. En función del número de muestras, mezcle los reactivos A y B en una proporción de volumen de 50:1 para preparar una cantidad adecuada de solución de trabajo de BCA y mezcle bien. Antes de preparar la solución de trabajo de BCA, agite el reactivo A para mezclar bien.
- Tome 20 μL de solución estándar BSA recién preparada y muestras diluidas (10 veces diluidas) de la Tabla 1 y agréguelas a una placa de 96 pocillos.
- Añadir 200 μL de solución de trabajo de BCA a cada pocillo y mezclar bien. Selle la placa, incube a 37 °C durante 30 minutos, luego enfríe a temperatura ambiente o colóquela a temperatura ambiente durante 2 minutos.
- Mida la absorbancia a 562 nm utilizando un lector de microplacas y calcule la concentración de proteínas en las muestras en función de la curva estándar.
- Añadir una cantidad adecuada de tampón de carga 5x SDS-PAGE (que contenga β-mercaptoetanol) a las muestras, tratar térmicamente a 100 °C en agua hirviendo durante 5 min para desnaturalizar completamente las proteínas, centrifugar a 1.000 x g durante 5 min, y tomar el sobrenadante para su uso.
- La fórmula de la Tabla 2 describe la preparación de geles separadores del 15%, 12% y 8%, así como un gel apilable del 5%. Prepare las soluciones en consecuencia. Agregue la solución de gel separador a una altura de 2/3 en el casete de gel, cúbralo con agua destilada y déjelo reposar a temperatura ambiente durante 40 minutos. A continuación, añade el gel apilador para llenar el casete, introduce el peine y déjalo reposar durante 10 min.
- Cargue 9 μL de marcador de proteína previamente teñido en cada pocillo y cargue 50 μg de proteína de muestra por pocillo.
- Aplique un voltaje constante de 80 V hasta que el azul de bromofenol llegue al gel separador, luego aplique un voltaje constante de 100 V durante 90 min. Detenga la electroforesis cuando el azul de bromofenol haya migrado a la parte inferior del gel.
- Una vez finalizado el SDS-PAGE, sumerja la membrana de PVDF en metanol durante 10 s, enjuague con agua destilada durante 1 min y, a continuación, remoje el gel de poliacrilamida, el papel de filtro y la membrana de PVDF tratada en tampón de transferencia durante 10 min.
- Ensamble el sándwich de transferencia con el lado negro de los clips hacia abajo, seguido de un lado transparente de los clips de esponja-papel de filtro-gel-PVDF-papel de filtro de membrana-esponja-transparente. Coloque los clips en el casete de transferencia, asegurándose de que el lado negro del clip mire hacia el lado negro del casete y el lado blanco hacia el lado rojo. Realice la transferencia a un voltaje constante de 100 V y utilice una membrana de PVDF con un tiempo de transferencia de 60 min.
- Después de la transferencia, lave la membrana de PVDF con agua 3 veces durante 5 minutos cada una. Bloquee la membrana con una solución bloqueante que contenga un 5% de leche en polvo descremada durante 1 h, luego lave con TBST 3x durante 5 minutos cada uno.
- Diluir el anticuerpo primario con TBST de acuerdo con las proporciones de dilución enumeradas en la Tabla 3 e incubar a 4 °C durante la noche. Los anticuerpos primarios incluyen el anticuerpo p65 anti-NF-κB, el anticuerpo cinasa inductor (NIK) anti-NF-κB, el anticuerpo anti-IKKα y el anticuerpo anti-β-actina.
- Enjuague la membrana 3 veces con 1x TBST durante 5 minutos cada una. Añada el anticuerpo secundario adecuadamente diluido (según la Tabla 3) e incube a temperatura ambiente durante 1 h. Los anticuerpos secundarios son la IgG anti-ratón conjugada con HRP y la IgG anti-conejo conjugada con HRP.
- Enjuague la membrana nuevamente con 1x TBST 3x durante 5 minutos cada uno. Mezcle las soluciones de revelado A y B, agregue 2 mL a la membrana y detecte y fotografíe con el mini instrumento de quimioluminiscencia.
- Desarrolle la membrana utilizando quimioluminiscencia mejorada más reactivo. Escanee la película revelada utilizando el sistema de imágenes. Analice las imágenes de Western blot utilizando software. Utilice β-actina como control de carga. Calcule el nivel relativo de proteína en función del valor de gris de la β-actina.
7. Análisis de PCR en tiempo real (qRT-PCR)
- Extracción de ARN total
- Prepare una solución de DEPC al 0,1 % y alcohol tratado con DEPC al 70 % de acuerdo con las instrucciones del fabricante. Trate todos los tamaños de tubos de microcentrífuga y varios tipos de puntas de pipeta con una solución de DEPC al 0,1%. Remojar durante la noche, luego esterilizar en autoclave.
- Recolecta células en la fase de crecimiento logarítmico con buen estado de crecimiento. Deseche el medio de cultivo del matraz de cultivo celular y lave las células 2 veces con la solución de Hank. Añadir 1 mL de tripsina por cada 10 cm² de células, agitar suavemente para separar las células y utilizar una pipeta para asegurar un desprendimiento completo. Incubar a temperatura ambiente durante 5 minutos para permitir una lisis completa, luego pipetear hacia arriba y hacia abajo de 7x-10x para interrumpir completamente las células. Transfiera el lisado a tubos de 1,5 ml, centrifugue y almacene el sobrenadante.
- Agregue un volumen igual de cloroformo al sobrenadante, mezcle bien y deje reposar a temperatura ambiente durante 10 minutos. Centrifugar a 4 °C durante 5 min a 1.000 x g para separar las fases. Transfiera con cuidado la fase acuosa superior a un nuevo tubo (si extrae ADN y proteínas, conserve la fase inferior y guárdela a 4 °C).
- Agregue isopropanol (0,5 mL por 1 mL de trizol), mezcle bien y deje reposar a temperatura ambiente durante 10 min. Centrifugar a 4 °C durante 10 min a 1.000 x g, retirar suavemente el sobrenadante y desecharlo.
- Lave el pellet de ARN con etanol al 75%, centrifugue a 4 °C durante 5 min a 8.000 x g, retire suavemente el sobrenadante y seque el pellet al aire o al vacío. Disuelva el ARN en 50 μL de agua DEPC, alícuota, y almacene a -70 °C o proceda a la transcripción inversa a ADNc.
- Transcripción inversa a ADNc
- Realice la transcripción inversa del ADNc utilizando un kit siguiendo las instrucciones del fabricante.
- PCR cuantitativa en tiempo real
- Diseñe cebadores basados en secuencias de genes y compruébelos usando BLAST en el sitio web del NCBI. Prepare soluciones madre de 10 μM de cebadores directos e inversos para CK20 y β-actina. En la Tabla 4 se muestran las secuencias de cebadores.
- PCR cuantitativa en tiempo real
- Agregue 1 μL de ADNc, 10 μL de mezcla maestra 2x, 0,4 μL de cebador directo e inverso cada uno, y 8,2 μL de agua libre de RNasa en el sistema de reacción.
- Realice la PCR con el siguiente programa: Desnaturalización inicial a 95 °C durante 2 min, seguida de 40 ciclos de 95 °C durante 15 s y 60 °C durante 1 min. Utilice la β-actina como control interno. Calcule la expresión relativa utilizando el método 2-ΔΔCt .
8. Análisis estadístico
- Utilice un software comercial para el análisis estadístico. Presentar los datos como media ± desviación estándar (media ± DE). Realice un ANOVA de un factor para comparar las diferencias entre diferentes grupos. Defina una diferencia significativa como p < 0,05.
Resultados
Munziq mitiga los cambios patológicos inducidos por la lesión por isquemia-reperfusión
Para examinar las alteraciones morfológicas en los tejidos miocárdicos, inicialmente realizamos una tinción HE. Como la tinción representativa de HE mostrada en la Figura 1, observamos degeneración granular y degeneración vacuolar en ciertas células miocárdicas del grupo simulado. Además, hubo una presencia limitada de glóbulos rojos e infiltración de linfocitos entre las células miocárdicas. Periódicamente observamos dilatación vascular y congestión. Los tejidos miocárdicos del grupo MIRI mostraron un deterioro más severo y manifestaron cambios morfológicos más pronunciados. Estos cambios incluyeron degeneración granular extensa, degeneración vacuolar, infiltración de glóbulos rojos y linfocitos, dilatación vascular y congestión. La lesión del tejido miocárdico en el grupo ABF MIRI fue más grave en comparación con la observada en el grupo control MIRI. Sin embargo, en ambos grupos de Munziq, algunas células miocárdicas mostraron una degeneración granular leve y una degeneración vacuolar. La presencia de glóbulos rojos y la infiltración de linfocitos, la dilatación vascular y la congestión fueron escasas. Además, los hallazgos indican que Munziq exhibe efectos cardioprotectores superiores en ratas ABF MIRI y ratas MIRI control. En conclusión, estos hallazgos sugieren que el pretratamiento con Munziq tiene el potencial de mitigar los cambios patológicos inducidos por la lesión por isquemia-reperfusión en el corazón.
Munziq mejoró la alteración de las mitocondrias y las fibras del músculo cardíaco inducida por la lesión por isquemia/reperfusión
Para verificar aún más el papel protector de Munziq en la lesión por MIRI, examinamos la ultraestructura mitocondrial y las fibras del músculo cardíaco mediante TEM. Como se muestra en la Figura 2, las células miocárdicas del grupo simulado exhibían una estructura intacta con miofibrillas muy dispuestas y una longitud de sarcómero similar. La estructura del miofilamento parecía clara y ligeramente suelta, mientras que se observó un gran número de mitocondrias. Por el contrario, el grupo MIRI mostró características patológicas indicativas de células miocárdicas dañadas, incluyendo hinchazón celular, longitud variada del sarcómero, estructura de miofilamento poco clara y poco dispuesta. Se observó que hubo una amplia interrupción y disolución de las mitocondrias en el grupo I/R en comparación con el grupo simulado. Además, las fibras del músculo cardíaco eran irregulares y se fracturaban en respuesta a la lesión I/R. Curiosamente, la gravedad de estos cambios fue notablemente mayor en el grupo ABF MIRI. Por el contrario, ambos grupos tratados con Munziq mostraron un alivio de las características patológicas asociadas con las células miocárdicas dañadas. La inflamación de las células miocárdicas se redujo y las estructuras de miofibrillas, sarcómeros, miofilamentos y el número de mitocondrias fueron similares a los observados en el grupo simulado. En conjunto, estos datos indicaron que el pretratamiento con Munziq podría mitigar la alteración de las mitocondrias y las fibras del músculo cardíaco inducida por la cirugía I/R.
La lesión miocárdica por isquemia-reperfusión exacerbada en la rata ABF, MIRI y Munziq pretratamiento protegió la función cardíaca
Los niveles séricos de cTn-T, CK-MB e ICAM-1 se detectaron mediante el método ELISA. Los resultados no revelaron disparidades discernibles entre el grupo de control simulado y el grupo simulado de ABF. Sin embargo, cabe destacar que el grupo ABF MIRI exhibió niveles significativamente elevados de cTn-T (Figura 3A), CK-MB (Figura 3B) e ICAM-1 (Figura 3C) en comparación con el grupo control MIRI. Con el fin de evaluar los efectos cardioprotectores de Munziq, tanto las ratas MIRI control como las ratas MIRI ABF se sometieron al pretratamiento con Munziq. Como se muestra en la Figura 3, los niveles de cTn-T, CK-MB e ICAM-1 se redujeron notablemente en el grupo de pretratamiento de Munziq. Estos resultados sugieren que Munziq exhibe notables propiedades cardioprotectoras en ratas ABF MIRI.
Para investigar el efecto del pretratamiento de Munziq sobre la lesión por estrés oxidativo inducida por isquemia y reperfusión en ABF y ratas control, se midieron los cambios de LDH, MDA y NO en el tejido miocárdico. Como se muestra en la Figura 3D, F, el grupo ABF MIRI exhibió niveles significativamente elevados de MDA y niveles significativamente disminuidos de NO en comparación con el grupo control MIRI. El pretratamiento con Munziq disminuyó significativamente el contenido de LDH y MDA en el miocardio isquémico. Al mismo tiempo, el pretratamiento de Munziq aumentó aún más el nivel de NO en el tejido miocárdico.
El pretratamiento con Munziq mitigó la inflamación del MIRI al dificultar la producción de citocinas proinflamatorias
Las citocinas proinflamatorias desempeñan un papel fundamental en la mediación de la respuesta inmunitaria innata, y las citocinas proinflamatorias se activaron durante MIRI31. Para investigar más a fondo el efecto antiinflamatorio de Munziq, tanto las ratas MIRI de control como las ratas MIRI ABF se sometieron al pretratamiento con Munziq. Empleamos el método ELISA para medir los niveles séricos de IL-1β, IL-6 y TNF-α y el análisis de qRT-PCR para evaluar los niveles de ARNm de IL-1β, IL-6 y TNF-α en el tejido miocárdico. Los resultados no revelaron diferencias significativas en estos niveles de citocinas entre el grupo de control simulado y el grupo simulado de ABF. Los niveles de IL-1β, IL-6 y TNF-α se regularon significativamente al alza en el grupo ABF MIRI en comparación con el grupo control MIRI. Específicamente, IL-1β mostró un aumento significativo tanto a nivel de ARNm como de proteína, observándose una diferencia estadísticamente significativa. Si bien no hubo diferencia en el nivel de ARNm para IL-6, se encontró una disparidad en el nivel de proteínas. Del mismo modo, el TNF-α no mostró ninguna variación en los niveles de ARNm, pero mostró diferencias a nivel de proteínas. Como se ilustra en la Figura 4, los niveles de IL-1β, IL-6 y TNF-α disminuyeron notablemente en el grupo de pretratamiento de Munziq.
El pretratamiento con Munziq mitigó la inflamación a través de la vía de señalización NF-κB
La producción de citocinas está estrechamente relacionada con la activación de las vías de señalización de NF-κB en la mayoría de las etapas de la respuesta inflamatoria. El NF-κB es considerado como una potencial diana terapéutica para las dolencias inflamatorias32. Para evaluar si la vía NF-κB está implicada en los efectos antiinflamatorios de Munziq, inicialmente realizamos un análisis de Western Blot para medir los niveles de expresión de los constituyentes clave de la vía NF-κB, incluidos NIK, IKKα, pIKKα y p6513. Como se muestra en la Figura 5, la lesión isquémica y de reperfusión indujo una notable regulación positiva de NIK, p-IKKα y p-p65 dentro del grupo MIRI. El tratamiento con Munziq atenuó eficazmente esta regulación al alza. Los resultados indicaron que Munziq desempeña un papel fundamental en la antiinflamación al suprimir la activación de la vía de señalización NF-κB.
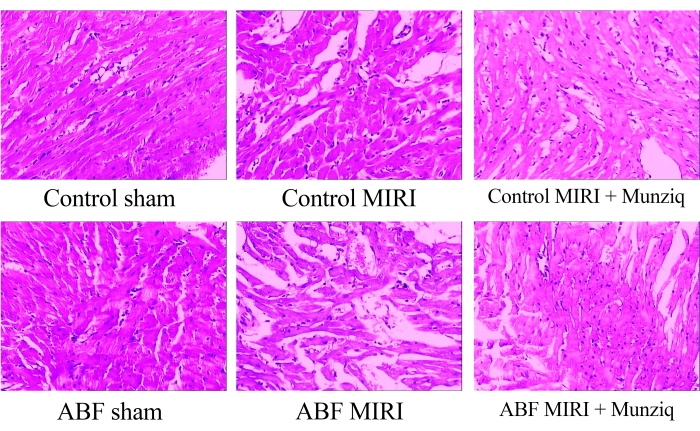
Figura 1: Cambios morfológicos de los tejidos miocárdicos observados por tinción HE. Imágenes representativas de tinción de HE de diferentes grupos. Ampliación: 100x. Abreviaturas: ABF = fluido corporal anormal; MIRI = Lesión miocárdica por isquemia-reperfusión; (n=6). Haga clic aquí para ver una versión más grande de esta figura.
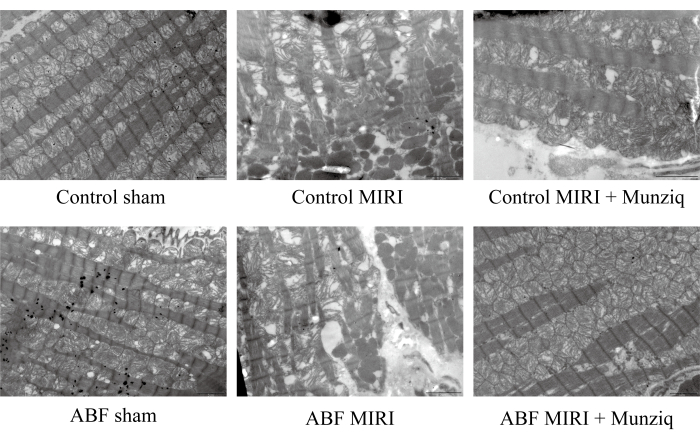
Figura 2: Munziq mejoró la interrupción de las mitocondrias y las fibras del músculo cardíaco inducida por la lesión I/R. Se realizó un microscopio electrónico de barrido para observar los cambios en la ultraestructura de las mitocondrias y en las fibras del músculo cardíaco. Se mostraron imágenes representativas. Barra de escala: 5 μm; (n=3). Haga clic aquí para ver una versión más grande de esta figura.
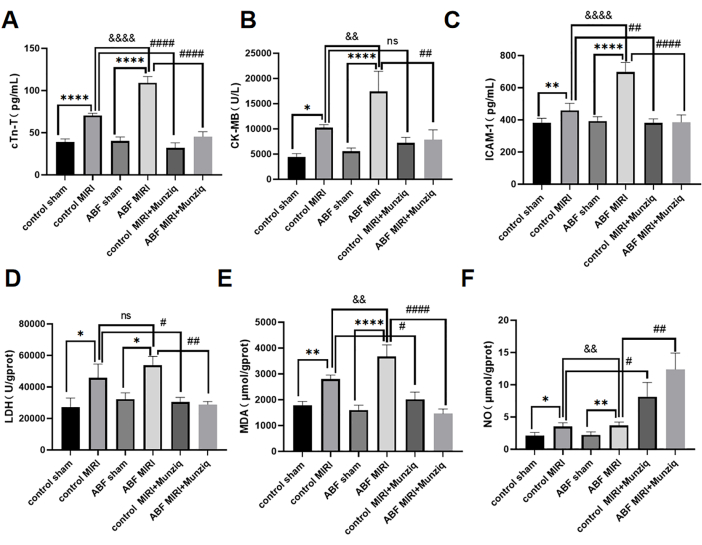
Figura 3: La lesión por isquemia-reperfusión miocárdica se exacerbó en ratas ABF MIRI y el pretratamiento con Munziq podría proteger la función cardíaca. (A) cTn-T sérico, (B) CK-MB y (C) ICAM-1. Los niveles se detectaron mediante ELISA y se midieron los cambios en LDH, MDA y NO en el tejido miocárdico (n=6). *p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 En comparación con el grupo simulado; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 En comparación con el grupo MIRI; &p<0.05, && p<0.01, &&&p<0.001, &&&&p<0.0001 Comparado con el grupo de control. Los datos se presentan como media ± DE. El análisis estadístico se realizó mediante ANOVA de un factor. Haga clic aquí para ver una versión más grande de esta figura.
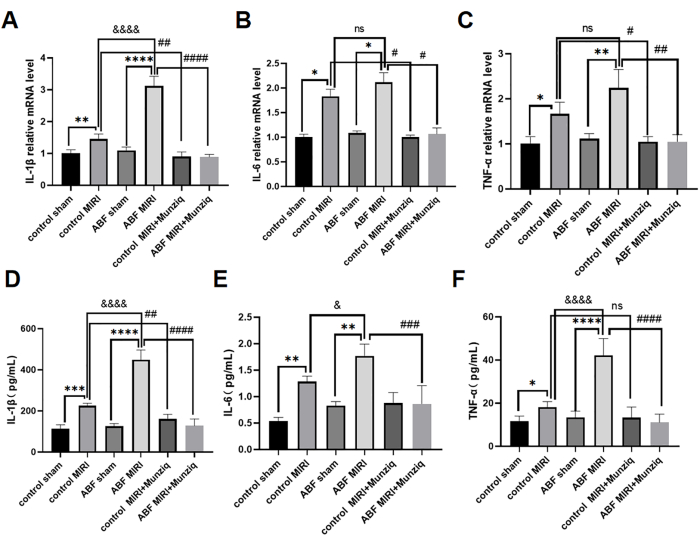
Figura 4: El pretratamiento con Munziq mitigó la inflamación del MIRI al prevenir la producción de citocinas proinflamatorias. La qRT-PCR detectó los niveles de ARNm de (A) IL-1β, (B) IL-6 y (C) TNF-α en el tejido miocárdico. Mida los niveles de (D) IL-1β, (E) IL-6 y (F) TNF-α en suero mediante ELISA (n = 6). *p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 En comparación con el grupo simulado; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 Comparado con el grupo MIRI; &p<0.05, && p<0.01, &&&p<0.001, &&&&p<0.0001 Comparado con el grupo de control. Los datos se presentan como media ± DE. El análisis estadístico se realizó mediante ANOVA de un factor. Haga clic aquí para ver una versión más grande de esta figura.
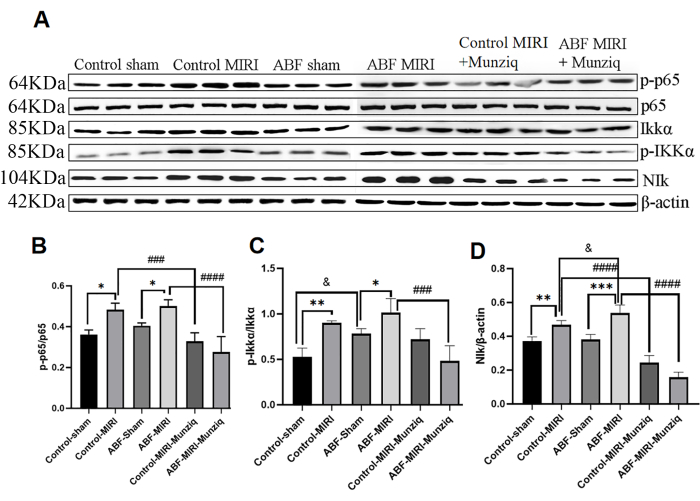
Figura 5: El pretratamiento con Munziq mitigó la inflamación a través de la vía de señal NF-κB. La expresión de las proteínas p-IKKα, IKKα, p-p65, p65 y NIk en el tejido miocárdico se detectó mediante Western blot (N = 3 para cada grupo). (A) Las bandas de proteínas observadas en el análisis de Western blot. (B-D) El nivel de expresión relativo se determina en función del valor de gris. *p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 En comparación con el grupo simulado; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 En comparación con el grupo MIRI; &p<0.05, && p<0.01, &&&p<0.001, &&&&p<0.0001 En comparación con el grupo de control. Los datos se presentan como media ± DE. El análisis estadístico se realizó mediante ANOVA de un factor. Haga clic aquí para ver una versión más grande de esta figura.
| Número de tubo | Volumen del diluyente (mL) | Volumen BSA (fuente) | Concentración final de BSA (mg/mL) |
| Un | 0 | 20 (solución madre) | 500 |
| B | 2 | 18 (solución madre) | 400 |
| C | 4 | 16 (solución madre) | 300 |
| D | 6 | 14 (solución madre) | 200 |
| E | 8 | 12 (solución madre) | 150 |
| F | 12 | 8 (solución madre) | 100 |
| G | 16 | 4 (solución madre) | 50 |
| H | 20 | 0 (solución madre) | 0 |
Tabla 1: Tabla de preparación de concentración estándar BSA.
| Geles separadores | 15% Gel Apilante | 12% Gel Apilante | 8% Gel apilante | 5% Gel apilante | |
| Reactivos | Volumen | Volumen | Volumen | Reactivos | Volumen |
| Agua desionizada (mL) | 2.76 | 3.96 | 5.52 | Agua desionizada (mL) | 4 |
| 30% Acrilamida (mL) | 6 | 4.8 | 3.24 | 30% Acrilamida (mL) | 1 |
| 1.5mol/lTris.HCl (PH8.8)(mL) | 3 | 3 | 3 | 1.0M Tris.HCl (pH6.8; mL) | 1 |
| 10% SDS (μL) | 120 | 120 | 120 | 10% SDS (μL) | 80 |
| 10%AP (μL) | 120 | 120 | 120 | 10%AP (μL) | 60 |
| TEMED (μL) | 4.8 | 4.8 | 7.2 | TEMED (μL) | 8 |
| Volumen total (mL) | 12 | 12 | 12 | Volumen total (mL) | 6 |
Tabla 2: Preparación de la concentración de gel.
| Anticuerpo primario | Relación de dilución | Anticuerpo secundario | Relación de dilución |
| β-actina | 1:1000 | Cabra anti-ratón IgG H&L (HRP) | 1:15000 |
| pág. 65 | 1:1000 | Cabra anti-Conejo IgG H&L (HRP) | 1:5000 |
| P-P65 | 1:300 | 1:5000 | |
| BCL-2 | 1:1000 | 1:5000 | |
| BAX | 1:1000 | 1:5000 | |
| Drp1 | 1:800 | 1:5000 | |
| Fis1 | 1:1000 | 1:5000 | |
| Mfn2 | 1:800 | 1:5000 |
Tabla 3: Ratios de dilución de anticuerpos.
| Gen | Secuencia de cebado (5' a 3') | ||
| IL-1β-F | CTGTGACTCGTGGGATGATG | ||
| IL-1β-R | GGGATTTTGTCGTTGCTTGT | ||
| TNF-α-F | GCCTCCTCTCTGCCATCAAG | ||
| TNF-α-R | CTCCAAAGTAGACCTGCCCG | ||
| IL-6-F | GCCCACCAGGAACGAAAGTC | ||
| IL-6-R | GGCAACTGGCTGGAAGTCTC | ||
| beta actina-F | CCCATCTATGAGGGTTACGC | ||
| beta actina-R | TTTAATGTCACGCACGATTTC | ||
Tabla 4: Secuencias de cebadores.
Discusión
La MIRI, que significa lesión por isquemia-reperfusión miocárdica, es una complicación frecuente y significativa que ocurre después de la reperfusión miocárdica en cirugía cardíaca36,37, pocos fármacos o adyuvantes han mejorado definitivamente los resultados clínicos en comparación con los controles contemporáneos38. Por lo tanto, existe una necesidad urgente de terapias efectivas para proteger el corazón de tales lesiones. Munziq, una preparación herbal tradicional, ha demostrado ciertos efectos terapéuticos sobre la lesión por isquemia-reperfusión cardíaca 27,28,30. Sin embargo, estos hallazgos son preliminares y los mecanismos subyacentes siguen siendo desconocidos. El propósito de este estudio fue investigar más a fondo y validar los efectos y mecanismos protectores de Munziq sobre MIRI.
Los fluidos corporales anormales se consideran una manifestación común de diversas enfermedades crónicas, incluidas las enfermedades cardiovasculares, según la medicina tradicional uigur39,40. En el sistema médico uigur, se cree que el ABF es el resultado del estrés a largo plazo y se lo conoce como la fuente de diversas enfermedades39. En este estudio, se empleó un modelo de fluido corporal anormal para simular las características subyacentes de las enfermedades cardiovasculares que requieren cirugía cardíaca. Se indujo MIRI en ratas con ABF para determinar la lesión miocárdica por isquemia-reperfusión.
La lesión por isquemia-reperfusión es una condición patológica compleja que involucra múltiples procesos. Se ha descrito que la isquemia-reperfusión en el corazón conduce a alteraciones patológicas en el miocardio4. Estos cambios patológicos se manifiestan principalmente como cardiomiocitos acortados, estructura sarcomérica alterada, inflamación mitocondrial41 y miofibrillas sarcoméricas poco dispuestas, como se observó en este estudio. La lesión miocárdica también produce alteraciones en las enzimas séricas. Es bien sabido que los niveles de cTnT, CK-MB e ICAM-1 en el suero aumentan después de una lesión miocárdica42,43. Por lo tanto, estos biomarcadores se utilizan para evaluar el alcance de la lesión miocárdica aguda. En este estudio, observamos los cambios patológicos en el miocardio y la elevación de las enzimas séricas después de la lesión por isquemia-reperfusión, lo que indica el establecimiento exitoso del modelo MIRI. Los resultados mostraron que la lesión miocárdica en el grupo ABF MIRI fue más grave en comparación con el grupo control. Tras el tratamiento con Munziq, los cambios patológicos se aliviaron notablemente y los niveles séricos de enzimas disminuyeron significativamente. En conjunto, estos hallazgos demuestran los efectos cardioprotectores de Munziq durante MIRI.
En este estudio, la arteria descendente anterior (DA) izquierda se ligó durante 30 min, seguido de reperfusión durante 120 min para establecer un modelo de lesión por isquemia-reperfusión en ratas. Un metanálisis44 que resumió 43 estudios utilizados para crear modelos de lesiones por isquemia-reperfusión en ratas indicó que los tiempos de isquemia oscilaron entre 30 y 60 min, con una duración de la reperfusión de 30 a 120 min. Algunos estudios adoptaron un protocolo de 5 min de isquemia seguido de 5 min de reperfusión, repetido 4 x45. Entre estos métodos, el protocolo de 30 min de isquemia y 120 min de reperfusión fue el más utilizado, apareciendo en 19 casos. Durante el proceso experimental, observamos una coloración pálida del miocardio a través de la inspección visual directa después de 30 min de isquemia. Además de la evaluación visual de los cambios de color del miocardio, se empleó la monitorización del electrocardiograma (ECG) para identificar signos de isquemia, como la elevación del segmento ST. Los marcadores séricos, como la troponina y la creatina quinasa, así como los parámetros hemodinámicos, como la frecuencia cardíaca (FC), la presión diastólica del ventrículo izquierdo (LVDP) y la presión sistólica del ventrículo izquierdo (LVSP), pueden servir como indicadores para evaluar la efectividad del modelo de isquemia46. En este estudio, nos basamos principalmente en la observación visual para evaluar los efectos de la isquemia y la reperfusión. Debido a las variaciones individuales entre las ratas, es aconsejable complementar la inspección visual con medidas objetivas adicionales para evaluar la eficacia de la isquemia en lugar de aplicar una duración isquémica uniforme a todas las ratas.
En los mamíferos, la familia NF-κB consta de cinco miembros, uno de los cuales es p6513,47. Hay dos vías principales de activación de NF-κB en las células47. En la vía canónica, la activación del complejo IKK (IKKα, IKKβ e IKKγ) conduce a la fosforilación de las proteínas IκB, iniciando la activación de NF-κB. En la vía no canónica NF-κB, la activación de NF-κB está mediada por la fosforilación de NIK e IKKα. Una amplia evidencia sugiere que la vía NF-κB juega un papel crucial en la mediación de la isquemia y la lesión por reperfusión 48,49,50. La interferencia con la activación de NF-κB puede atenuar la lesión inducida por isquemia y reperfusión51,52. Curiosamente, hubo una mayor activación de la vía de señalización NF-κB en el grupo ABF MIRI y niveles más altos de citocinas inflamatorias posteriores.
Se ha demostrado que numerosos fármacos de la medicina tradicional china ejercen efectos protectores contra la isquemia y la lesión por reperfusión mediante la modulación de la vía NF-κB. Por ejemplo, Liu et al.53 encontraron que la quercetina mitigaba el MIRI al inhibir la vía NF-κB. Han et al.54 reportaron que el amarillo A de hidroxisafflor alivió el MIRI al inhibir la señalización de TLR4/NF-κB. Sin embargo, aún no se ha explorado si Munziq ejerce un papel protector en MIRI a través de la vía de señalización NF-κB. Para dilucidar aún más el mecanismo de Munziq, este estudio analizó los niveles de expresión de nodos clave en la vía de señalización NF-κB, incluidos NIK, IKKα, pIKKα y p65. Los resultados demostraron que los niveles de expresión de estas proteínas se regularon significativamente a la baja después del tratamiento con Munziq, lo que indica que Munziq inhibe la expresión de nodos clave en la vía de señalización NF-κB durante MIRI.
Existe una amplia evidencia que apoya la idea de que la activación de NF-κB desencadena la producción de proteínas inflamatorias y moléculas de adhesión, lo que resulta en el reclutamiento de linfocitos55. Por ejemplo, Valen et al.56 descubrieron que NF-κB se activaba y que los niveles de IL-1β y TNF-α estaban elevados durante la isquemia/reperfusión miocárdica. Además, la IL-6, una citocina proinflamatoria regulada por NF-κB, exhibe una mayor expresión durante la reperfusión57. De acuerdo con estos hallazgos, los resultados de este estudio demuestran que Munziq inhibe significativamente los niveles de citocinas proinflamatorias (incluidas IL-1β, IL-6 y TNF-α) en el contexto de la lesión por isquemia/reperfusión miocárdica (MIRI). A partir de esto, se puede inferir que Munziq ejerce sus efectos inhibidores sobre la expresión de citoquinas proinflamatorias a través de la supresión de la vía de señalización NF-κB.
En conclusión, los resultados sugieren que la MIRI fue más grave en la ABF. Munziq tiene efectos cardioprotectores en la isquemia y la lesión por reperfusión. Este efecto protector puede actuar suprimiendo la vía de señalización NF-κB. Estos hallazgos sugieren que Munziq tiene un gran potencial como agente terapéutico para proteger el corazón contra la lesión por reperfusión durante la cirugía cardíaca.
El estudio tiene varias limitaciones. En primer lugar, el estudio se lleva a cabo en un modelo de rata, que, a pesar de ser un valioso modelo traslacional, puede no replicar completamente la complejidad de la condición cardiovascular humana. En segundo lugar, el estudio se centra principalmente en la vía de señalización NF-κB como base mecanicista de los efectos de Munziq. Sin embargo, MIRI es un proceso multifactorial que puede involucrar otras vías de señalización y mecanismos moleculares.
Si bien el estudio actual proporciona información valiosa sobre los posibles efectos cardioprotectores de Munziq en un modelo de rata de lesión por isquemia-reperfusión miocárdica (MIRI), particularmente en el contexto del fluido corporal anormal (ABF), hay varias áreas para la exploración futura. Una vía para futuras investigaciones es la realización de estudios in vitro con cardiomiocitos cultivados para observar directamente los efectos de Munziq en las respuestas celulares a la isquemia y la reperfusión. Además, la adopción de un enfoque multiómico podría ofrecer una visión más completa de los cambios moleculares asociados con el tratamiento con Munziq, lo que podría revelar vías y mecanismos adicionales que contribuyen a sus efectos cardioprotectores. También sería beneficioso explorar diferentes dosis de Munziq para determinar la dosis óptima para obtener la máxima cardioprotección y minimizar los posibles efectos secundarios. Se necesitan estudios a largo plazo para evaluar los efectos sostenidos de Munziq sobre la función cardíaca y para controlar cualquier posible efecto adverso asociado con el uso prolongado.
Divulgaciones
Los autores no tienen nada que revelar.
CONTRIBUCIÓN DEL AUTOR:
Duolikun Mutailifu realizó los experimentos, Abudusaimi Aini escribió el borrador inicial del manuscrito y analizó los datos; Aili Aibibula contribuyó a la concepción y diseño del estudio; Zheng Liu y Abudunaibi Maimaitiaili participaron en el diseño del estudio; Abudunaibi Maimaitiaili organizó los fondos del estudio; y todos los autores leyeron y aprobaron el manuscrito final.
Agradecimientos
Este trabajo fue apoyado por la Fundación Nacional de Ciencias Naturales de China [Número de subvención: 82060907] y el Programa de Cultivo de Talento Médico y de Salud de Alto Nivel 'Tianshan Elite' [Subvención No. TSYC202301B004].
Materiales
| Name | Company | Catalog Number | Comments |
| ABI 7500 Real-time PCR | ABI, CA, USA | Used for performing qRT-PCR. | |
| Adult male Sprague-Dawley (SD) rat | Animal Experimental Center of Xinjiang Medical University | ||
| Anti-NF-kB p65, anti-NF-kB Inducing Kinase NIK, anti-IKK alpha, anti-IKK alpha (phospho T23), anti-β-actin | Abcam, CA, USA | Used for Western blot analysis targeting specific proteins. | |
| Anti-TTC11/FIS1 Antibody | abcam | ab71498 | Used for protein detection in Western Blot (WB) experiments. |
| BCA Protein Assay Kit | Tiangen Biotech Co., Ltd., Beijing, China | Used for determining protein concentration. | |
| beta-Actin Loading Control antibody Mouse Mab | Sino Biological | 100166-MM10 | Used for protein detection in Western Blot (WB) experiments. |
| ChemiScope 3300 Imaging System | Clinx Science Instruments, Shanghai, China | Used for scanning developed films from Western blot analysis. | |
| ELISA kit for CK-MB detection | Nanjing Jiancheng Bioengeering Institute(Nanjing, China) | Used for detecting levels of cardiac injury indexes | |
| ELISA kit for cTn-T, ICAM-1, IL-1β, IL-6, TNF-α detection | CUSABIO Biotech CO., Ltd. (Wuhan, China) | Used for detecting levels of cardiac injury indexes and inflammatory cytokines in rat serum samples. | |
| FastQuant RT Kit | TIANGEN, Beijing China | Used for reverse transcription of cDNA. | |
| HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG | Thermo Scientific, Basingstoke, UK | ||
| LDH Assay kit and MDA Assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting LDH and MDA levels in myocardium tissues from the infarct area in the left ventricle. | |
| Munziq | provided by Xinjiang Medical University | The main investigational drug in this study | |
| NF-κB p65 (D14E12) XP Rabbit mAb #8242 | CST | 8242S | Used for protein detection in Western Blot (WB) experiments. |
| Nitric Oxide (NO) assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting NO levels at 550 nm in myocardial tissue. | |
| Phospho-NF-κB p65 (Ser536) (93H1) Rabbit mAb #3033 | CST | 3033S | Used for protein detection in Western Blot (WB) experiments. |
| Quantity One software | Bio-Rad Laboratories, Hercules, CA, USA | Used for analyzing Western blot images. | |
| Recombinant Anti-DRP1 Antibody | abcam | ab184247 | Used for protein detection in Western Blot (WB) experiments. |
| RIPA lysis buffer | Boster Biotechnology Co., Ltd., Wuhan, China | AR0105 | Used for extracting total proteins from rat ventricular tissues. |
| Secondary antibodies (HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG) | Thermo Scientific, Basingstoke, UK | Used for detection following primary antibody incubation in Western blot analysis. | |
| SYBR Select Master Mix | ABI, CA, USA | Used in qRT-PCR analysis on ABI 7500 Real-time PCR instrument. | |
| transmission electron microscope | HitachiS-2400 Hitachi, Tokyo, Japan | Used to examine thin sections of ventricular tissues. | |
| Trizol reagent | Invitrogen Co., Carlsbad, California, USA | Used for RNA extraction from ventricular tissues. |
Referencias
- Anderson, J. L., Campion, E. W., Morrow, D. A. Acute myocardial infarction. New Engl J Med. 376 (21), 2053-2064 (2017).
- Vos, T., et al. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet. 396 (10258), 1204-1222 (2020).
- Murphy, A., Goldberg, S. Mechanical complications of myocardial infarction. Am J Med. 135 (12), 1401-1409 (2022).
- Heusch, G. Myocardial ischemia/reperfusion: Translational pathophysiology of ischemic heart disease. Medicine. 5 (1), 10-31 (2024).
- Bhatt, D. L., Lopes, R. D., Harrington, R. A. Diagnosis and treatment of acute coronary syndromes. Jama. 327 (7), 662-675 (2022).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: A target for cardioprotection. Cardiovasc Res. 115 (7), 1143-1155 (2019).
- Gunata, M., Parlakpinar, H. A review of myocardial ischaemia/reperfusion injury: Pathophysiology, experimental models, biomarkers, genetics and pharmacological treatment. Cell Biochem Funct. 39 (2), 190-217 (2020).
- He, J., et al. Myocardial ischemia/reperfusion injury: Mechanisms of injury and implications for management (review). Exp Ther Med. 23 (6), 430 (2022).
- Xiang, M., et al. Role of oxidative stress in reperfusion following myocardial ischemia and its treatments. Oxid Med Cell Longevity. 2021, 1-23 (2021).
- Astudillo, A. M., Balboa, M. A., Balsinde, J. Compartmentalized regulation of lipid signaling in oxidative stress and inflammation: Plasmalogens, oxidized lipids and ferroptosis as new paradigms of bioactive lipid research. Prog Lipid Res. 89, 101207 (2023).
- Algoet, M., et al. Myocardial ischemia-reperfusion injury and the influence of inflammation. Trends Cardiovasc Med. 33 (6), 357-366 (2023).
- Zhang, F., et al. Β-cryptoxanthin alleviates myocardial ischaemia/reperfusion injury by inhibiting nf-κb-mediated inflammatory signalling in rats. Arch Physiol Biochem. 128 (4), 1128-1135 (2020).
- Guo, Q., et al. Nf-κb in biology and targeted therapy: New insights and translational implications. Signal Transduct Target Ther. 9 (1), 53 (2024).
- Mi, J., et al. Inhibition of heat shock protein family a member 8 attenuates spinal cord ischemia-reperfusion injury via astrocyte nf-κb/nlrp3 inflammasome pathway. J Neuroinflammation. 18 (1), 170 (2021).
- Zhang, L., Zhao, S., Wang, Y. Diannexin alleviates myocardial ischemia-reperfusion injury by orchestrating cardiomyocyte oxidative damage, macrophage polarization and fibrotic process by tlr4-nf-kb-mediated inactivation of nlrp3 inflammasome. Int Immunopharmacol. 130, 111668 (2024).
- Zhou, Y., et al. Qingchang mixture prevents the intestinal ischemia-reperfusion injury through tlr4/nf-kb pathway. Combinatorial Chem High Throughput Screen. 26 (1), 49-57 (2023).
- Ozturk, A., et al. The protective effects of trimetazidine against ovary ischemia-reperfusion injury via the tlr4/nf-kb signal pathway. J Biochem Mol Toxicol. 36 (8), e23114 (2022).
- Du, S., Deng, Y., Yuan, H., Sun, Y. Safflower yellow b protects brain against cerebral ischemia reperfusion injury through ampk/nf-kb pathway. Evid Based Compl Alt Med. 2019, 1-11 (2019).
- Dong, X., et al. Physcion protects rats against cerebral ischemia-reperfusion injury via inhibition of tlr4/nf-kb signaling pathway. Drug Design Dev Therapy. 15, 277-287 (2021).
- Hashmi, S., et al. Hydrogen sulphide treatment prevents renal ischemia-reperfusion injury by inhibiting the expression of icam-1 and nf-kb concentration in normotensive and hypertensive rats. Biomolecules. 11 (10), 1549 (2021).
- Gao, L., et al. Hic-5 deficiency attenuates hepatic ischemia reperfusion injury through tlr4/nf-κb signaling pathways. Life Sciences. 249, 117517 (2020).
- Xu, Z., et al. Cardioprotection of mab2g4/odn/lip on myocardial ischemia-reperfusion injury via inhibiting the nf-κb signaling pathway. Cardiovas Ther. 2023, 1-15 (2023).
- Xiao, G., et al. Cxcr1 and its downstream nf-κb inflammation signaling pathway as a key target of guanxinning injection for myocardial ischemia/reperfusion injury. Front Immunol. 13, 1007341 (2022).
- Jeddi, S., Gheibi, S., Kashfi, K., Carlström, M., Ghasemi, A. Dose-dependent effects of long-term administration of hydrogen sulfide on myocardial ischemia-reperfusion injury in male wistar rats: Modulation of rkip, nf-κb, and oxidative stress. Int J Mol Sci. 21 (4), 1415 (2020).
- Yao, Y., et al. Targeting camkii-δ9 ameliorates cardiac ischemia/reperfusion injury by inhibiting myocardial inflammation. Circ Res. 130 (6), 887-903 (2022).
- Zhuang, L., Zong, X., Yang, Q., Fan, Q., Tao, R. Interleukin-34-nf-κb signaling aggravates myocardial ischemic/reperfusion injury by facilitating macrophage recruitment and polarization. eBioMedicine. 95, 104744 (2023).
- Maimaitiaili, A., et al. Effects of different doses of savda munziq on myocardial ischemia-reperfusion injury in rats with abnormal savda syndrome. Genet Mol Res. 13 (3), 4729-4735 (2014).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Hao, Y., et al. Transition of the abnormal savda syndrome to the hepatic carcinoma shifted unfolded protein response to autophagy was partly reversed by savda munziq in a rat model. Biomed Pharmacother. 121, 109643 (2020).
- Maimaitiaili, A., Li, J., Aibibula, A., Abudureheman, M. Erratum: Inhibition of nuclear factor kappa b pathway protects myocardial ischemia/reperfusion injury in rats under treatment with fufang munziq granule (munziq). Am J Transl Res. 10 (11), 3876 (2018).
- Zhang, X., et al. Rosa rugosa flavonoids alleviate myocardial ischemia reperfusion injury in mice by suppressing jnk and p38 mapk. Microcirculation. 24 (7), (2017).
- Dong, P., Liu, K., Han, H. The role of nf-κb in myocardial ischemia/reperfusion injury. Curr Prot Peptide Sci. 23 (8), 535-547 (2022).
- Guo, X., et al. Differential integrative omic analysis for mechanism insights and biomarker discovery of abnormal savda syndrome and its unique munziq prescription. Sci Rep. 6, 27831 (2016).
- Awad, A. S. Role of at1 receptors in permeability of the blood-brain barrier in diabetic hypertensive rats. Vascul Pharmacol. 45 (3), 141-147 (2006).
- La, X., et al. Upregulation of pd-1 on cd4(+)cd25(+) t cells is associated with immunosuppression in liver of mice infected with echinococcus multilocularis. Int Immunopharmacol. 26 (2), 357-366 (2015).
- Wu, T., et al. Circulating small extracellular vesicle-encapsulated sema5a-it1 attenuates myocardial ischemia-reperfusion injury after cardiac surgery with cardiopulmonary bypass. Cell Mol Biol Lett. 27 (1), 95 (2022).
- Pinto, A., et al. The extracellular isoform of superoxide dismutase has a significant impact on cardiovascular ischaemia and reperfusion injury during cardiopulmonary bypass. Eur J Cardio-Thor Surg. 50 (6), 1035-1044 (2016).
- Sabe, S. A., Harris, D. D., Broadwin, M., Sellke, F. W. Cardioprotection in cardiovascular surgery. Basic Res Cardiol. 119 (4), 545-568 (2024).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Mamtimin, B., et al. An magnetic resonance-based plasma metabonomic investigation on abnormal savda in different complicated diseases. J Tradl Chinese Med. 34 (2), 166-172 (2014).
- Marin, W., Marin, D., Ao, X., Liu, Y. Mitochondria as a therapeutic target for cardiac ischemia-reperfusion injury (review). Int J Mol Med. 47 (2), 485-499 (2020).
- Novack, V., et al. Troponin criteria for myocardial infarction after percutaneous coronary intervention. Arch Intern Med. 172 (6), 502-508 (2012).
- Kemp, M., Donovan, J., Higham, H., Hooper, J. Biochemical markers of myocardial injury. Br J Anaesth. 93 (1), 63-73 (2004).
- Zhang, D. Z., Jia, M. Y., Wei, H. Y., Yao, M., Jiang, L. H. Systematic review and meta-analysis of the interventional effects of resveratrol in a rat model of myocardial ischemia-reperfusion injury. Front Pharmacol. 15, 1301502 (2024).
- Ta, F. X., Zhang, T., Zhu, C. M. Correlation between mir-21 and the protective effects of resveratrol against myocardial ischemia/reperfusion injury in rats. Chin. J. Arteriosclerosis. 21 (6), 493-496 (2013).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. Am J Physiol Heart Circ Physiol. 314 (4), H812-H838 (2018).
- Oeckinghaus, A., Hayden, M. S., Ghosh, S. Crosstalk in nf-kappab signaling pathways. Nat Immunol. 12 (8), 695-708 (2011).
- Van Der Heiden, K., Cuhlmann, S., Luong Le, A., Zakkar, M., Evans, M. Role of nuclear factor kappab in cardiovascular health and disease. Clin Sci. 118 (10), 593-605 (2010).
- Ha, T., et al. Toll-like receptors: New players in myocardial ischemia/reperfusion injury. Antioxid Redox Signal. 15 (7), 1875-1893 (2011).
- Pourrajab, F., Yazdi, M. B., Zarch, M. B., Zarch, M. B., Hekmatimoghaddam, S. Cross talk of the first-line defense tlrs with pi3k/akt pathway, in preconditioning therapeutic approach. Mol Cell Ther. 3, 4 (2015).
- Wang, Y. H., et al. Lumbrokinase attenuates myocardial ischemia-reperfusion injury by inhibiting tlr4 signaling. J Mol Cell Cardiol. 99, 113-122 (2016).
- Yu, H., et al. Gypenoside protects cardiomyocytes against ischemia-reperfusion injury via the inhibition of mitogen-activated protein kinase mediated nuclear factor kappa b pathway in vitro and in vivo. Front Pharmacol. 7, 148 (2016).
- Liu, X., et al. Peroxisome proliferator-activated receptor gamma (ppargamma) mediates the protective effect of quercetin against myocardial ischemia-reperfusion injury via suppressing the nf-kappab pathway. Am J Transl Res. 8 (12), 5169-5186 (2016).
- Han, D., et al. Hydroxysafflor yellow a alleviates myocardial ischemia/reperfusion in hyperlipidemic animals through the suppression of tlr4 signaling. Sci Rep. 6, 35319 (2016).
- Yang, Q., He, G. W., Underwood, M. J., Yu, C. M. Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury: Perspectives and implications for postischemic myocardial protection. Am J Transl Res. 8 (2), 765-777 (2016).
- Valen, G., Paulsson, G., Vaage, J. Induction of inflammatory mediators during reperfusion of the human heart. Ann Thorac Surg. 71 (1), 226-232 (2001).
- Saini, H. K., et al. Role of tumour necrosis factor-alpha and other cytokines in ischemia-reperfusion-induced injury in the heart. Exp Clin Cardiol. 10 (4), 213-222 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados