Research Article
草药 Munziq 通过抑制炎症改善心肌缺血再灌注损伤
摘要
本研究调查了传统维吾尔草药制剂 Munziq 对体液异常大鼠心肌缺血再灌注损伤 (MIRI) 的心脏保护作用。通过全面的实验方法,我们证明了 Munziq 通过抑制 NF-κB 信号通路来减轻 MIRI 的潜力。
摘要
本研究的目的是探讨 Munziq 对异常体液心肌缺血再灌注损伤 (MIRI) 的心脏保护作用及其潜在机制。正常大鼠和体液 (ABF) 异常的大鼠用 Munziq 预处理 21 d。在此之后,建立了 MIRI 模型。通过苏木精和伊红 (HE) 染色和透射电子显微镜观察组织病理学改变和心肌超微结构变化,以观察心肌损伤的病理表现。酶联免疫吸附试验 (ELISA) 检测血清 CK-MB 、 cTn-T 和 ICAM-1 水平,观察心肌损伤相关标志物。ELISA 检测血清和心肌组织中 IL-1β 、 IL-6 和 TNF-α 水平,观察抗炎作用。Western blot 检测 NF-κB 信号通路相关蛋白 NIK 、 IKKα 、 Pikα 和 p65 的表达水平。结果显示,与对照组 MIRI 组相比,ABF MIRI 组的心肌损伤更严重。Munziq 预处理有可能减轻缺血再灌注损伤引起的病理变化,并且可以保护心脏功能。MIRI 组 NF-κB 通路和下游效应子 IL-1β 、 IL-6 和 TNF-α 的蛋白水平显著上调,而 Munziq 组下调。有趣的是,ABF MIRI 组 NF-κB 信号通路的激活更多,下游炎性细胞因子水平更高。结果表明 MIRI 在 ABF 中更严重。Munziq 对缺血和再灌注损伤具有心脏保护作用。这种保护作用可以通过抑制 NF-κB 信号通路来发挥作用。
引言
心肌缺血是心肌得不到足够血流的疾病,主要由冠状动脉狭窄或血栓形成引起1,这可能导致患者致命的后果 2,3。由于心肌代谢几乎完全是需氧的,并且包含非常有限的糖原储存,因此必须及时恢复血液供应,主要是通过 PCI 或静脉溶栓。虽然有效的心肌再灌注对于改善缺血性心肌的预后至关重要,但它也引入了心肌缺血再灌注损伤 (MIRI) 的风险 4,5,6。MIRI 是一项影响心肌再灌注疗法疗效的重大挑战7。多种因素和机制有助于 MIRI 的发展。例如,在内皮细胞中,再灌注诱导活性氧 (ROS) 的积累和自由基清除剂的消耗,表明存在氧化应激 4,8。这种氧化应激随后可能引发炎症反应,导致炎症因子释放增加,粘附分子产生增加,白细胞募集 9,10,11。活化 B 细胞的核因子 κ 轻链增强子 (NF-κB) 通路在心肌缺血/再灌注损伤期间的炎症反应中起着至关重要的作用12。哺乳动物 NF-κB 转录因子家族包括五个成员:NF-κB1(也称为 p105/p50)、NF-κB2(也称为 p100/p52)、p65(也称为 RELA)、RELB(V-Rel 网状内皮细胞增生病毒癌基因的同源物)和 c-REL13,14。抑制 NF-κB 通路已被证明可以减轻各种组织的缺血/再灌注损伤,包括心肌12,15、肠道16、卵巢17、大脑18,19、肾脏20 和肝脏21。值得注意的是,NF-κB 信号通路已被广泛证明是心肌对缺血和再灌注反应的关键介质12,14,可能的机制包括促进炎症反应、调节细胞粘附分子的表达、参与氧化应激反应以及影响细胞死亡和存活途径 12,20,22,23,24,25.旨在减弱 NF-κB 活化的治疗干预在缓解 MIRI 方面显示出显着的潜力23,26 。
维吾尔医学是中医不可或缺的一部分,建立在四种体液理论之上:火、气、水和土。这些体液产生体液,如血液、痰液、黄胆汁和黑胆汁27,28。维持这四种体液之间的动态稳态对人体的整体健康至关重要。这些液体中的任何不平衡,称为体液不平衡,都可能导致疾病的发作。在各种不平衡的体液中,最主要的是异常体液 (ABF),也称为异常 Savda 综合征 (ASS)27,28。Munziq 是维吾尔医生广泛使用的一种传统维吾尔药物,用于治疗异常体液。它是一种草药制剂,包括包装说明书中提供的十种不同的药种,包括 Cordia dichotoma Forst. f.、Anchusaitalica Retz.、Glycyrrhiza uralensis Fisch.、Adiantum capillusveneris L.、Euphorbia humifusa Willd.、Ziziphus jujuba Mill.、Lavandula angustifolia Mill.、Foeniculum vulgare Mill.、Melissa officinalis L. 和 Alhagi pseudoalhagi Desv29. Munziq 于 2003 年获得国家食品药品监督管理局批准,代码为 Z65020166。其活性化学成分包括黄铜、酚类、有机酸、氨基酸、皂苷、糖等。Munziq 具有多种作用,包括抗氧化、抗炎、免疫调节、抗血小板聚集和抗血栓形成作用 27,28,30。
我们之前的研究表明,Munziq 药物可以缓解心肌缺血/再灌注损伤 (MIRI),尽管具体机制尚不清楚。显示 Munziq 对 Savda 综合征异常心肌缺血再灌注损伤大鼠的心肌保护作用。抑制核因子 kappa b 通路可保护复方 Munziq 颗粒 (Munziq) 治疗大鼠的心肌缺血/再灌注损伤 27,28,30。 然而,调查 Munziq 在 MIRI 中的作用和机制的研究有限。
本研究旨在探讨 Munziq 对体液异常 (ABF) 大鼠心肌缺血再灌注损伤 (MIRI) 的心脏保护作用,并探讨其潜在机制,尤其关注 NF-κB 信号通路。本研究提出的假设是 Munziq 预处理可以通过抑制 NF-κB 信号通路和下游炎症反应来减轻 MIRI 诱导的病理变化并保护心脏功能。通过在对照组和 ABF 组中建立假、缺血再灌注损伤 (MIRI) 和缺血再灌注损伤 + Munziq 模型来检验该假设。监测心脏功能、炎症相关指标和与 NF-κB 通路相关的蛋白质。
研究方案
根据美国国立卫生研究院实验动物护理和使用指南,使用体重为 200-220 g 的成年雄性 Sprague-Dawley (SD) 大鼠。新疆医科大学动物实验中心.体液异常 (ABF) 的动物模型由新疆医科大学实验动物中心提供。如前所述,将大鼠饲养在干冷环境中,根据传统的维吾尔医学理论和先前的研究所证明,这对于建立大鼠异常体液 (ABF) 模型至关重要29,33。所有动物实验均根据新疆医科大学的伦理指南进行,并按照 ARRIVE 指南进行。脊椎动物 (大鼠) 研究方案由新疆医科大学机构伦理委员会 (IACUC-20200318-16) 批准。
1. 动物分组、给药和 MIRI 模型建立
- 将大鼠随机分配到以下六组:i) 对照假手术组,ii) 对照 MIRI 组,iii) ABF 假手术组,iv) ABF MIRI 组,v) 对照 MIRI + Munziq 组和 vi) ABF MIRI + Munziq 组。
- 将 ABF 组中的大鼠饲养在气候箱内的受控环境中,温度设置为 6 °C ± 1 °C,相对湿度范围为 25% 至 32.8%。以 7:1.5:1.5 的比例为大鼠提供普通饲料与干冷食,即大麦和香菜种子混合,并应用该方法 21 天,建立 ABF 模型29,33。
- 在 MIRI 手术前 21 天,通过胃内给药 5 g/kg Munziq(5.0 g Munziq 溶于 1 mL 蒸馏水中)给予 Munziq 组,这是有效临床剂量的两倍。对于非 ABF 动物,例如对照假手术组、对照 MIRI 和对照 MIRI + Munziq 组,向假手术组和 MIRI 组施用等体积的生理盐水,并为 Munziq 组提供 Munziq 的灌胃给药。
- 预处理 21 天后,建立 MIRI 模型。
- 在配备无菌材料的专用动物手术室进行手术,以确保无菌环境。用戊巴比妥钠 (35 mg/kg) 腹膜内注射 (IP) 麻醉大鼠;观察肌肉松弛、对外部刺激的反应性以及呼吸频率和深度,以评估麻醉效果。在整个过程中每 15 分钟监测一次这些参数。如果出现麻醉不足的迹象(肌肉紧张、对刺激的明显反应、呼吸频率增加或变浅),则给予 20 mg/kg 的补充剂量。在整个过程中保持麻醉,直到最终采血。在此过程中,使用加热垫将大鼠的体温保持在 37 °C,并通过直肠温度探头进行连续监测。在眼睛上涂抹兽医软膏以防止麻醉期间干燥。
- 进行气管切开术,以实现呼吸机辅助呼吸。在打开胸部露出心脏之前,用肥皂水清洗手术部位,刮掉手术部位,并用洗必泰和碘等消毒液清洁该部位。使用无菌器械进行手术。
- 要打开胸部并暴露心脏,请使用标准的无菌胸部手术器械,包括剪刀、镊子和牵开器。打开胸壁,露出心脏。在直接可视化下识别左前降支 (LAD)。它是位于心脏表面的左冠状动脉的主要分支。使用 6-0 缝合线 (4-5 cm),结扎 LAD(左前降线)30 分钟以诱导局部缺血。通过观察心肌中的浅色来确定有效的 LAD 闭塞。
- 连接 30 分钟后,松开结扎管并进行再灌注 120 分钟。确定心肌恢复到亮红色时的再灌注。在进行假手术的大鼠中,执行相同的程序,但不结扎 LAD。
- 再灌注后,大鼠仍处于戊巴比妥钠 (35 mg/kg, ip) 诱导的麻醉状态34。一旦大鼠处于深度麻醉状态,使用真空采血管从腹主动脉收集 1-2 mL 血样。
- 从腹主动脉采集血样后,在深度麻醉下通过宫颈脱位对大鼠实施安乐死。使用无菌镊子和剪刀从左心室的梗塞区域收集心肌组织,确保只取出看起来苍白和受损的组织,这表明梗塞区域。将收集的组织放入无菌容器中进行进一步分析。
2. 样本采集
- 组织样本采集:使用无菌剪刀和无菌刀片,沿左心室长轴的中点垂直于心脏方向,将心脏水平切成两半。将顶端部分的一半分成两部分:将 4% 多聚甲醛中的一份保存在室温或 4 °C 下用于形态学检查2-24 小时,另一份保存在戊二醛中,用于 4 °C 下的电子显微镜检查1-4 小时。
- 将心脏的基部,包括缺血区和非缺血区,分成两部分:将一份放入冷冻管中,用液氮快速冷冻组织,然后转移至-80°C超低温冰箱中进行分子生物学检测。使用另一部分新鲜部分检测组织活性氧 (ROS) 水平和线粒体提取。
- 血清样本采集:实验终点,从下腔静脉抽取 1-2 mL 静脉血,以 1000 x g 离心 10 分钟,分离后将血清储存在 -80 °C 超低温冰箱中。
3. HE 染色和透射电镜观察
- 根据常规程序35 对心室心肌进行 HE 染色(苏木精-伊红染色)。将组织在 4% 多聚甲醛中固定 24 小时。将样品包埋在石蜡中,将它们切成 4 μm 厚的切片,并根据方案使用苏木精-伊红染色方法对其进行染色。随机选择五个视野在显微镜下观察组织病理学变化。
- 按照以下步骤处理来自每组固定在福尔马林中的大鼠的心肌组织,用于 HE 染色实验。
- 将组织切片置于 65 °C 培养箱中烘烤 1.5 至 2 次。
- 将组织切片浸入二甲苯中 10 分钟,更换二甲苯,然后再浸泡 10 分钟。依次浸入无水酒精 I 和 II 中各 5 分钟,然后浸入 95%、90%、80% 和 70% 的酒精中,然后浸入蒸馏水中各 5 分钟。
- 用苏木精染色 3 分钟。用加入酒精中的盐酸进行酸性分化几秒钟 (1-2 s)。终止在自来水中分化 5 分钟。
- 浸入蒸馏水、70%、80%、90% 和 95% 酒精中各 3 分钟,无水醇 I 和 II 各浸泡 5 分钟。
- 用 0.5% 伊红乙醇溶液染色 1 分钟,用 95% 乙醇冲洗切片以去除多余的红色,然后浸入无水乙醇中 5 分钟。浸入二甲苯 I 和 II 中各 5 分钟。
- 用中性香脂镶嵌。在显微镜下观察组织的病理变化。
4. 血液细胞因子和心脏损伤指标的 ELISA 检测
- 通过以 1000 x g 离心 10 分钟从外周血中获得大鼠血清样品,并储存在 -80 °C。 根据制造商的说明,使用 ELISA 试剂盒检测血清中心脏损伤指数(如 CK-MB、cTn-T、ICAM-1)和炎性细胞因子(如 IL-1β、IL-6、TNF-α)的水平,如下所述。
- 让所有试剂平衡至室温 (18-25 °C) 至少 30 分钟,根据制造商的说明准备试剂,并准备好使用。
- 设置标准孔和样品孔,其中标准孔包含检测试剂盒中提供的已知浓度的标准溶液。这些用于在实验过程中建立标准曲线,以量化被测样品中的特定分析物浓度。向每个孔中加入 100 μL 标准品或样品,摇动轻轻混合,盖上板密封,并在 37 °C 下孵育 2 小时。
- 丢弃液体,醒酒晾干,不要洗涤。向每个孔中加入 100 μL 生物素标记的抗体(预稀释 1:100)工作溶液,用新的板密封盖住,并在 37 °C 下孵育 1 小时。
- 丢弃孔中的液体,倾析干燥,然后洗涤板 3 次。每次洗涤浸泡 2 分钟,每孔 200 μL,然后倾析干燥。
- 向每个孔中加入 100 μL 辣根过氧化物酶标记的链霉亲和素工作溶液,盖上新的板密封,并在 37 °C 下孵育 1 小时。
- 丢弃孔中的液体,醒酒干燥,然后洗涤板 5 次。每次洗涤浸泡 2 分钟,每孔 200 μL,然后倾析干燥。
- 依次向每个孔中加入 90 μL 底物溶液,并在 37 °C 的黑暗中显色 15-30 分钟。
- 依次向每个孔中加入 50 μL 终止液以终止反应。在停止反应后 5 分钟内,使用酶标仪在 450 nm 处依次测量每个孔的光密度(OD 值)。
5. MDA、NO 和 LDH 水平的测量
- 再灌注后,从左心室的梗死区域收集心肌组织 (5 mm x 7 mm)。按照制造商的说明,使用 LDH 检测试剂盒和 MDA 检测试剂盒检测 LDH(乳酸脱氢酶)和 MDA(丙二醛)。根据制造商的说明,使用一氧化氮 (NO) 检测试剂盒在 550 nm 处检测 NO。
6. 蛋白质印迹分析
- 使用 RIPA 裂解从大鼠心室组织中提取总蛋白。使用 BCA 蛋白检测试剂盒测定蛋白浓度。
- 为了保存细胞内蛋白质并防止细胞降解,请将样品浸入液氮中以快速冷冻。随后,取回冷冻样品并将其研磨成粉末,取约 100 mg 样品,并将其添加到预冷的 1.5 mL 离心管中。加入 400 μL RIPA 裂解缓冲液(补充蛋白酶抑制剂和广谱磷酸酶抑制剂),然后充分混合并让混合物在 4 °C 下静置 60 分钟。
- 将混合物在 4 °C 下以 1000 x g 离心 15 分钟。 收集上清液并使用 BCA 方法测量蛋白质浓度。
- 根据 表 1,使用与样品缓冲液系统匹配的稀释剂稀释 BSA 标准品。
- 根据制造商的说明准备试剂。根据样品数量,以 50:1 的体积比混合试剂 A 和 B,以制备足量的 BCA 工作溶液并充分混合。在制备 BCA 工作溶液之前,摇动试剂 A 以充分混合。
- 从 表 1 中取 20 μL 新鲜制备的 BSA 标准溶液和稀释样品(稀释 10 倍),并将其添加到 96 孔板中。
- 向每个孔中加入 200 μL BCA 工作溶液并充分混合。密封板,在 37 °C 下孵育 30 分钟,然后冷却至室温或在室温下放置 2 分钟。
- 使用酶标仪测量 562 nm 处的吸光度,并根据标准曲线计算样品中的蛋白质浓度。
- 向样品中加入适量的 5x SDS-PAGE 上样缓冲液(含有 β-巯基乙醇),在 100 °C 下在沸水中热处理 5 分钟以使蛋白质完全变性,以 1,000 x g 离心 5 分钟,并取上清液使用。
- 表 2 中的公式概述了 15%、12% 和 8% 分离凝胶以及 5% 浓缩凝胶的制备方法。相应地准备解决方案。在凝胶盒中加入分离凝胶溶液至 2/3 的高度,用蒸馏水覆盖,并在室温下静置 40 分钟。然后,加入浓缩胶以填充盒,插入梳子,静置 10 分钟。
- 将 9 μL 预染蛋白标记物加载到每个孔中,每孔上样 50 μg 样品蛋白。
- 施加 80 V 的恒定电压,直到溴酚蓝到达分离凝胶,然后施加 100 V 的恒定电压 90 分钟。当溴酚蓝迁移到凝胶下部时,停止电泳。
- SDS-PAGE 完成后,将 PVDF 膜浸入甲醇中 10 秒,用蒸馏水冲洗 1 分钟,然后将聚丙烯酰胺凝胶、滤纸和处理过的 PVDF 膜浸泡在转移缓冲液中 10 分钟。
- 组装转移夹层,夹子的黑色面朝下,然后是海绵-滤纸-凝胶-PVDF 膜-滤纸-海绵-夹子的透明面。将夹子放入转印盒中,确保夹子的黑色面朝向转印盒的黑色面,白色面朝向红色面。在 100 V 的恒定电压下进行转移,并使用转移时间为 60 分钟的 PVDF 膜。
- 转移后,用水洗涤 PVDF 膜 3 次,每次 5 分钟。用含有 5% 脱脂奶粉的封闭溶液封闭膜 1 小时,然后用 TBST 洗涤 3 次,每次 5 分钟。
- 根据 表 3 中列出的稀释比例,用 TBST 稀释一抗,并在 4 °C 下孵育过夜。一抗包括抗 NF-κB p65 抗体、抗 NF-κB 诱导激酶 (NIK) 抗体、抗 IKKα 抗体和抗 β-肌动蛋白抗体。
- 用 1x TBST 冲洗膜 3 次,每次 5 分钟。加入适当稀释的二抗(如 表 3)并在室温下孵育 1 小时。二抗是 HRP 偶联的山羊抗小鼠 IgG 和 HRP 偶联的山羊抗兔 IgG。
- 再次用 1x TBST 冲洗膜 3 次,每次 5 分钟。混合显影液 A 和 B,向膜中加入 2 mL,并使用微型化学发光仪进行检测和拍照。
- 使用增强的化学发光加试剂显影膜。使用成像系统扫描显影胶片。使用软件分析 Western 印迹图像。使用 β-肌动蛋白作为加载对照。根据 β-肌动蛋白的灰度值计算相对蛋白质水平。
7. 实时荧光定量 PCR 分析 (qRT-PCR)
- 总 RNA 提取
- 根据制造商的说明制备 0.1% DEPC 溶液和 70% DEPC 处理的酒精。用 0.1% DEPC 溶液处理所有尺寸的微量离心管和各种类型的移液器吸头。浸泡过夜,然后高压灭菌。
- 收集对数生长期且生长状态良好的细胞。丢弃细胞培养瓶中的培养基,并用 Hank 溶液洗涤细胞 2 次。每 10 cm² 细胞加入 1 mL 胰蛋白酶,轻轻摇晃以分离细胞,并使用移液器确保完全分离。在室温下孵育 5 分钟以完全裂解,然后上下移液 7 次至 10 次以完全破坏细胞。将裂解物转移至 1.5 mL 试管中,离心并储存上清液。
- 向上清液中加入等体积的氯仿,充分混合,并在室温下静置 10 分钟。在 4 °C 下以 1,000 x g 离心 5 分钟以分离相。小心地将上层水相转移到新管中(如果提取 DNA 和蛋白质,保留下层相并将其储存在 4 °C)。
- 加入异丙醇(每 1 mL trizol 0.5 mL),充分混合,并在室温下静置 10 分钟。在 4 °C 下以 1,000 x g 离心 10 分钟,轻轻除去上清液并丢弃。
- 用 75% 乙醇洗涤 RNA 沉淀,在 4 °C 下以 8,000 x g 离心 5 分钟,轻轻去除上清液,然后风干或真空干燥沉淀。将 RNA 溶解在 50 μL DEPC 水中,分装并储存在 -70 °C 或继续逆转录为 cDNA。
- 逆转录为 cDNA
- 按照制造商的说明使用试剂盒进行 cDNA 的逆转录。
- 实时定量 PCR
- 根据基因序列设计引物,并使用 NCBI 网站上的 BLAST 进行检查。制备 10 μM 用于 CK20 和 β-肌动蛋白的正向和反向引物储备溶液。 表 4 显示了引物序列。
- 实时定量 PCR
- 在反应系统中加入 1 μL cDNA、10 μL 2x 预混液、0.4 μL 正向和反向引物以及 8.2 μL 不含 RNase 的水。
- 使用以下程序进行PCR:在95°C下初始变性2分钟,然后是95°C的40个循环15秒和60°C的1分钟。使用 β-肌动蛋白作为内部对照。使用 2-ΔΔCt 方法计算相对表达。
8. 统计分析
- 使用商业软件进行统计分析。将数据表示为平均值±标准差 (均值 ± SD)。执行单因子方差分析以比较不同组之间的差异。将显著差异定义为 p < 0.05。
结果
Munziq 减轻缺血再灌注损伤引起的病理变化
为了检查心肌组织的形态学改变,我们首先进行了 HE 染色。如图 1 所示的代表性 HE 染色,我们在假组的某些心肌细胞中观察到颗粒变性和空泡变性。此外,心肌细胞中红细胞和淋巴细胞浸润的存在有限。我们定期观察到血管扩张和充血。MIRI 组心肌组织损伤更严重,形态学变化更明显。这些变化包括广泛的颗粒变性、空泡变性、红细胞和淋巴细胞浸润、血管扩张和充血。ABF MIRI 组的心肌组织损伤比对照组更严重。然而,在 Munziq 组中,一些心肌细胞均表现出轻度颗粒变性和液泡变性。红细胞和淋巴细胞浸润、血管扩张和充血的存在很少。此外,研究结果表明 Munziq 在 ABF MIRI 大鼠和对照 MIRI 大鼠中表现出优异的心脏保护作用。总之,这些发现表明 Munziq 预处理有可能减轻心脏缺血再灌注损伤引起的病理变化。
Munziq 改善了缺血/再灌注损伤诱导的线粒体和心肌纤维的破坏
为了进一步验证 Munziq 在 MIRI 损伤中的保护作用,我们使用 TEM 检查了线粒体超微结构和心肌纤维。如图 2 所示,假手术组中的心肌细胞表现出完整的结构,肌原纤维排列紧密,肌节长度相似。肌丝结构清晰而略微松散,同时观察到大量线粒体。相反,MIRI 组表现出提示心肌细胞受损的病理特征,包括细胞肿胀、肌节长度不同、肌丝结构不清晰和排列松散。值得注意的是,与假手术组相比,I/R 组存在广泛的线粒体破坏和溶解。此外,心肌纤维不规则,并因 I/R 损伤而断裂。有趣的是,这些变化的严重程度在 ABF MIRI 组中明显更高。相比之下,Munziq 治疗的两组均表现出与心肌细胞受损相关的病理特征减轻。心肌细胞肿胀减轻,肌原纤维、肌节、肌丝结构和线粒体数量与假手术组相似。总的来说,这些数据表明 Munziq 预处理可以减轻 I/R 手术诱导的线粒体和心肌纤维的破坏。
ABF MIRI 大鼠和 Munziq 预处理心肌缺血再灌注损伤加重保护心脏功能
ELISA 法检测血清 cTn-T 、 CK-MB 和 ICAM-1 水平。结果显示,对照假手术组和 ABF 假手术组之间没有明显的差异。然而,值得注意的是,与对照 MIRI 组相比,ABF MIRI 组的 cTn-T (图 3A) 、 CK-MB (图 3B) 和 ICAM-1 (图 3C) 水平显着升高。为了评价 Munziq 的心脏保护作用,对照 MIRI 大鼠和 ABF MIRI 大鼠均接受 Munziq 预处理。如图 3 所示,Munziq 预处理组的 cTn-T 、 CK-MB 和 ICAM-1 水平显着降低。这些结果表明,Munziq 在 ABF MIRI 大鼠中表现出显着的心脏保护特性。
为探讨 Munziq 预处理对 ABF 和对照大鼠缺血再灌注诱导的氧化应激损伤的影响,测量心肌组织中 LDH 、 MDA 和 NO 的变化。如图 3D、F 所示,与对照 MIRI 组相比,ABF MIRI 组的 MDA 水平显着升高,NO 水平显着降低。Munziq 预处理显著降低缺血性心肌中 LDH 和 MDA 的含量。同时,Munziq 预处理进一步增加了心肌组织中 NO 的水平。
Munziq 预处理通过阻碍促炎细胞因子的产生来减轻 MIRI 的炎症
促炎细胞因子在介导先天免疫反应中起关键作用,促炎细胞因子在 MIRI31 期间被激活。为了进一步研究 Munziq 的抗炎作用,对照 MIRI 大鼠和 ABF MIRI 大鼠均接受了 Munziq 预处理。我们采用 ELISA 法测定血清 IL-1β 、 IL-6 和 TNF-α 水平,qRT-PCR 分析测定心肌组织中 IL-1β 、 IL-6 和 TNF-α 的 mRNA 水平。结果显示,对照假手术组和 ABF 假手术组之间的这些细胞因子水平没有显著差异。与对照组 MIRI 组相比,ABF MIRI 组 IL-1β 、 IL-6 和 TNF-α 水平显著上调。具体来说,IL-1β 在 mRNA 和蛋白水平上均表现出显着增加,观察到统计学上的显着差异。虽然 IL-6 的 mRNA 水平没有差异,但在蛋白质水平上发现了差异。同样,TNF-α 在 mRNA 水平上没有表现出任何变化,但在蛋白质水平上表现出差异。如图 4 所示,Munziq 预处理组的 IL-1β、IL-6 和 TNF-α 水平显着降低。
Munziq 预处理通过 NF-κB 信号通路减轻炎症
在炎症反应的大多数阶段,细胞因子的产生与 NF-κB 信号通路的激活密切相关。NF-κB 被认为是炎症性疾病的潜在治疗靶点32。为了评估 NF-κB 通路是否与 Munziq 的抗炎作用有关,我们首先进行了 Western Blot 分析以测量 NF-κB 通路关键成分的表达水平,包括 NIK、IKKα、pIKKα 和 p6513。如图 5 所示,缺血和再灌注损伤诱导 MIRI 组内 NIK、p-IKKα 和 p-p65 的显着上调。用 Munziq 治疗有效地减轻了这种上调。结果表明,Munziq 通过抑制 NF-κB 信号通路的激活在抗炎中发挥关键作用。
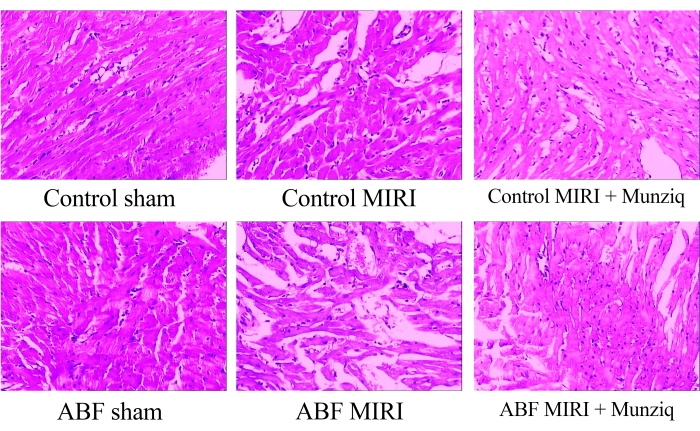
图 1:HE 染色观察到的心肌组织形态变化。 不同组的代表性 HE 染色图像。放大倍率:100 倍。缩写:ABF = 异常体液;MIRI = 心肌缺血再灌注损伤;(n=6) 的 请单击此处查看此图的较大版本。
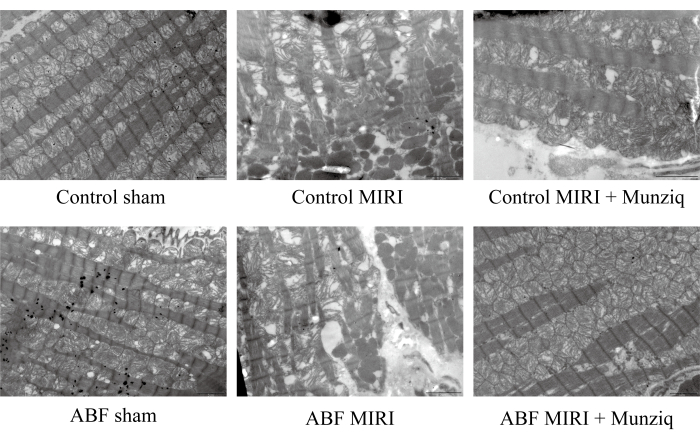
图 2:Munziq 改善了 I/R 损伤诱导的线粒体和心肌纤维的破坏。 扫描电镜观察线粒体超微结构和心肌纤维变化。展示了代表性图像。比例尺:5 μm;(n=3) 的 请单击此处查看此图的较大版本。
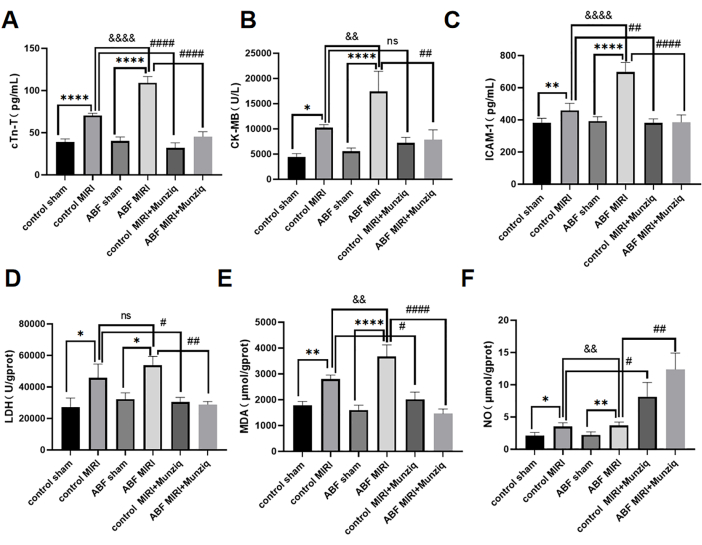
图 3:ABF MIRI 大鼠心肌缺血再灌注损伤加剧,Munziq 预处理可保护心脏功能。 (A) 血清 cTn-T,(B) CK-MB 和 (C) ICAM-1。ELISA 检测水平,测量心肌组织中 LDH 、 MDA 和 NO 的变化 (n=6)。*p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 与假手术组相比; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 与 MIRI 组相比; &p<0.05, && p<0.01, &&&p<0.001, &&&&p<0.0001 与对照组相比。数据以均值± SD 表示。使用单因素方差分析进行统计分析。 请单击此处查看此图的较大版本。
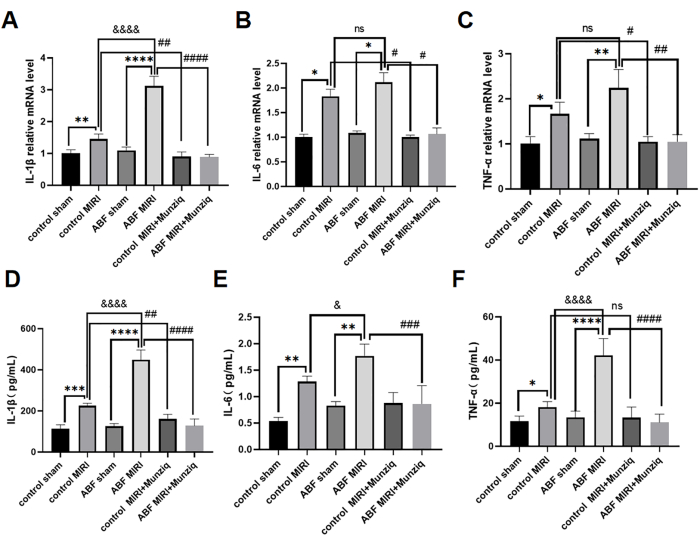
图 4:Munziq 预处理通过阻止促炎细胞因子的产生来减轻 MIRI 的炎症。 qRT-PCR 检测心肌组织中 (A) IL-1β 、 (B) IL-6 和 (C) TNF-α mRNA 水平。通过 ELISA (n=6) 测量血清中的 (D) IL-1β、(E) IL-6 和 (F) TNF-α 水平。*p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 与假手术组相比; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 与 MIRI 组相比; &p<0.05, && p<0.01, &&&p<0.001, &&&<0.0001 与对照组相比。数据以均值± SD 表示。使用单因素方差分析进行统计分析。 请单击此处查看此图的较大版本。
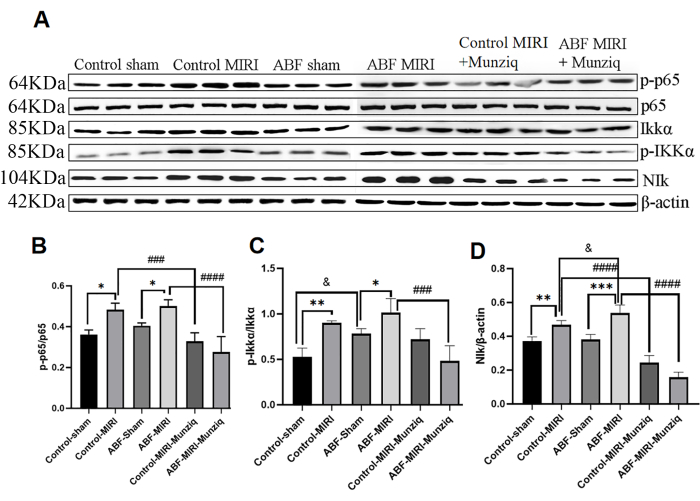
图 5:Munziq 预处理通过 NF-κB 信号通路减轻了炎症。 Western blot 检测心肌组织中 p-IKKα 、 IKKα 、 p-p65 、 p65 和 NIk 蛋白表达 (每组 N = 3)。(A) 在 Western blot 分析中观察到的蛋白质条带。(B - D)相对表达级别是根据灰度值确定的。*p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 与假手术组相比; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 与 MIRI 组相比; &p<0.05, && p<0.01, &&&p<0.001, &&&&p<0.0001 与对照组相比。数据以均值± SD 表示。使用单因素方差分析进行统计分析。 请单击此处查看此图的较大版本。
| 管号 | 稀释剂体积 (mL) | BSA 体积(源) | 最终 BSA 浓度 (mg/mL) |
| 一个 | 0 | 20(储备溶液) | 500 |
| B | 2 | 18 (储备溶液) | 400 |
| C | 4 | 16 (储备溶液) | 300 |
| D | 6 | 14 (储备溶液) | 200 |
| E | 8 | 12 (储备溶液) | 150 |
| F | 12 | 8(储备溶液) | 100 |
| G | 16 | 4 (储备溶液) | 50 |
| H | 20 | 0 (储备液) | 0 |
表 1:BSA 标准品浓度制备图表。
| 分离凝胶 | 15% 堆积凝胶 | 12% 堆积凝胶 | 8% 堆积凝胶 | 5% 堆积凝胶 | |
| 试剂 | 卷 | 卷 | 卷 | 试剂 | 卷 |
| 去离子水 (mL) | 2.76 | 3.96 | 5.52 | 去离子水 (mL) | 4 |
| 30% 丙烯酰胺 (mL) | 6 | 4.8 | 3.24 | 30% 丙烯酰胺 (mL) | 1 |
| 1.5mol/lTris.HCl(PH8.8)(mL) | 3 | 3 | 3 | 1.0M Tris.HCl (pH6.8; mL) | 1 |
| 10%SDS(微升) | 120 | 120 | 120 | 10%SDS(微升) | 80 |
| 10%AP(微升) | 120 | 120 | 120 | 10%AP(微升) | 60 |
| 特米德(μL) | 4.8 | 4.8 | 7.2 | 特米德(μL) | 8 |
| 总体积 (mL) | 12 | 12 | 12 | 总体积 (mL) | 6 |
表 2:凝胶浓度制备。
| 一抗 | 稀释倍率 | 二抗 | 稀释倍率 |
| β-肌动蛋白 | 1:1000 | 山羊抗小鼠 IgG H&L (HRP) | 1:15000 |
| 第 65 页 | 1:1000 | 山羊抗兔 IgG H&L (HRP) | 1:5000 |
| P-P65 系列 | 1:300 | 1:5000 | |
| BCL-2 型 | 1:1000 | 1:5000 | |
| BAX 公司 | 1:1000 | 1:5000 | |
| Drp1 | 1:800 | 1:5000 | |
| 菲斯1 | 1:1000 | 1:5000 | |
| MFN2 | 1:800 | 1:5000 |
表 3:抗体稀释率。
| 基因 | 引物序列(5' 至 3') | ||
| IL-1β-F | CTGTGACTCGTGGGATGATG | ||
| IL-1β-R | GGGATTTTGTCGTTGCTTGT | ||
| TNF-α-F | GCCTCCTCTCTGCCATCAAG | ||
| TNF-α-R | CTCCAAAGTAGACCTGCCCG | ||
| IL-6-F | GCCCACCAGGAACGAAAGTC | ||
| IL-6-R | GGCAACTGGCTGGAAGTCTC | ||
| β 肌动蛋白-F | CCCATCTATGAGGGTTACGC | ||
| β 肌动蛋白-R | TTTAATGTCACGCACGATTTC | ||
表 4:引物序列。
讨论
MIRI 代表心肌缺血再灌注损伤,是心脏手术心肌再灌注后发生的常见且重要的并发症36,37,与同期对照相比,很少有药物或佐剂明确改善临床结果38。因此,迫切需要有效的疗法来保护心脏免受此类损伤。Munziq 是一种传统的草药制剂,已证明对心脏缺血再灌注损伤有一定的治疗作用 27,28,30。然而,这些发现是初步的,潜在机制仍然未知。本研究的目的是进一步研究和验证 Munziq 对 MIRI 的保护作用和机制。
根据传统的维吾尔医学,异常体液被认为是各种慢性疾病的常见表现,包括心血管疾病39,40。在维吾尔医疗系统中,ABF 被认为是长期压力的结果,被称为各种疾病的根源39。在这项研究中,采用异常体液模型来模拟需要心脏手术的心血管疾病的潜在特征。在 ABF 大鼠中诱导 MIRI 以确定心肌缺血再灌注损伤。
缺血再灌注损伤是一种复杂的病理状况,涉及多个过程。据报道,心脏缺血再灌注导致心肌病理改变4。如本研究所观察到的,这些病理变化主要表现为心肌细胞缩短、肌节结构破坏、线粒体肿胀41 和肌节肌原纤维排列松散。心肌损伤也会导致血清酶的改变。众所周知,心肌损伤后血清中 cTnT、CK-MB 和 ICAM-1 的水平升高42,43。因此,这些生物标志物用于评估急性心肌损伤的程度。在本研究中,我们观察到缺血再灌注损伤后心肌的病理变化和血清酶的升高,表明 MIRI 模型的成功建立。结果显示,与对照组 MIRI 组相比,ABF MIRI 组的心肌损伤更严重。用 Munziq 治疗后,病理变化明显缓解,血清酶水平显着降低。总的来说,这些发现证明了 Munziq 在 MIRI 期间的心脏保护作用。
本研究中,结扎左前降支 (LAD) 动脉 30 min,然后再灌注 120 min,建立大鼠缺血再灌注损伤模型。一项荟萃分析44 总结了 43 项用于创建大鼠缺血再灌注损伤模型的研究,表明缺血时间为 30 至 60 分钟,再灌注持续时间为 30 至 120 分钟。一些研究采用了缺血 5 分钟,然后再灌注 5 分钟,重复 4 次45 次的方案。在这些方法中,涉及 30 分钟缺血和 120 分钟再灌注的方案使用最频繁,出现在 19 例病例中。在实验过程中,我们在缺血 30 分钟后通过直接肉眼检查观察到心肌颜色苍白。除了对心肌颜色变化的视觉评估外,还采用心电图 (ECG) 监测来识别缺血迹象,例如 ST 段抬高。血清标志物,包括肌钙蛋白和肌酸激酶,以及心率 (HR)、左心室舒张压 (LVDP) 和左心室收缩压 (LVSP) 等血流动力学参数,都可以作为评估缺血模型46 有效性的指标。在这项研究中,我们主要依靠目视观察来评估缺血和再灌注的影响。由于大鼠之间的个体差异,建议用额外的客观措施来补充肉眼检查以评估缺血的疗效,而不是对所有大鼠应用统一的缺血持续时间。
在哺乳动物中,NF-κB 家族由五个成员组成,其中一个是 p6513,47。细胞中 NF-κB 的激活有两种主要途径47。在经典途径中,IKK 复合体(IKKα、IKKβ 和 IKKγ)的激活导致 IκB 蛋白磷酸化,从而启动 NF-κB 激活。在非经典 NF-κB 通路中,NF-κB 激活由 NIK 和 IKKα 的磷酸化介导。大量证据表明,NF-κB 通路在介导缺血和再灌注损伤中起关键作用 48,49,50。干扰 NF-κB 激活可以减轻缺血和再灌注诱导的损伤51,52。有趣的是,ABF MIRI 组 NF-κB 信号通路的激活更多,下游炎性细胞因子水平更高。
许多中药已被证明通过调节 NF-κB 通路对缺血和再灌注损伤发挥保护作用。例如,Liu 等人53 发现槲皮素通过抑制 NF-κB 通路来减轻 MIRI。Han 等人54 报道,羟基红花黄 A 通过抑制 TLR4/NF-κB 信号传导来缓解 MIRI。然而,Munziq 是否通过 NF-κB 信号通路在 MIRI 中发挥保护作用仍未探索。为了进一步阐明 Munziq 的机制,本研究分析了 NF-κB 信号通路中关键节点的表达水平,包括 NIK 、 IKKα 、 pIKKα 和 p65。结果表明,Munziq 处理后这些蛋白的表达水平显著下调,表明 Munziq 在 MIRI 期间抑制了 NF-κB 信号通路中关键节点的表达。
有大量证据支持 NF-κB 的激活会触发炎症蛋白和粘附分子的产生,从而导致淋巴细胞的募集55。例如,Valen 等人56 发现 NF-κB 被激活,并且在心肌缺血/再灌注期间 IL-1β 和 TNF-α 水平升高。此外,IL-6 是一种受 NF-κB 调节的促炎细胞因子,在再灌注期间表达增加57。与这些发现一致,本研究结果表明,在心肌缺血/再灌注损伤 (MIRI) 的情况下,Munziq 显着抑制促炎细胞因子 (包括 IL-1β 、 IL-6 和 TNF-α) 的水平。由此可以推断 Munziq 通过抑制 NF-κB 信号通路对促炎细胞因子的表达发挥抑制作用。
总之,结果表明 MIRI 在 ABF 中更严重。Munziq 对缺血和再灌注损伤具有心脏保护作用。这种保护作用可以通过抑制 NF-κB 信号通路来发挥作用。这些发现表明,Munziq 作为一种治疗剂在心脏手术中保护心脏免受再灌注损伤具有巨大潜力。
这项研究有几个局限性。首先,该研究是在大鼠模型中进行的,尽管这是一个有价值的转化模型,但可能无法完全复制人类心血管疾病的复杂性。其次,该研究主要集中在 NF-κB 信号通路作为 Munziq 效应的机制基础。然而,MIRI 是一个多因素过程,可能涉及各种其他信号通路和分子机制。
虽然目前的研究为 Munziq 在心肌缺血再灌注损伤 (MIRI) 大鼠模型中的潜在心脏保护作用提供了有价值的见解,特别是在异常体液 (ABF) 的情况下,但仍有几个领域可供未来探索。进一步研究的一种途径是使用培养的心肌细胞进行 体外 研究,以直接观察 Munziq 对细胞对缺血和再灌注反应的影响。此外,采用多组学方法可以更全面地了解与 Munziq 治疗相关的分子变化,从而可能揭示有助于其心脏保护作用的其他途径和机制。探索不同剂量的 Munziq 以确定最大心脏保护的最佳剂量,同时最大限度地减少潜在的副作用也将是有益的。长期研究对于评估 Munziq 对心脏功能的持续影响并监测与长期使用相关的任何潜在不良反应是必要的。
披露声明
作者没有什么可披露的。
作者贡献:
Duolikun Mutailifu 进行了实验,Abudusaimi Aini 撰写了手稿的初稿并分析了数据;Aili Aibibula 为这项研究的构思和设计做出了贡献;Zheng Liu 和 Abudunaibi Maimaitiaili 参与了该研究的设计;Abudunaibi Maimaitiaili 安排了研究资金;所有作者都阅读并批准了最终手稿。
致谢
这项工作得到了中国国家自然科学基金 [批准号:82060907] 和“天山精英”高层次医疗卫生人才培养计划 [批准号] 的支持。TSYC202301B004]。
材料
| Name | Company | Catalog Number | Comments |
| ABI 7500 Real-time PCR | ABI, CA, USA | Used for performing qRT-PCR. | |
| Adult male Sprague-Dawley (SD) rat | Animal Experimental Center of Xinjiang Medical University | ||
| Anti-NF-kB p65, anti-NF-kB Inducing Kinase NIK, anti-IKK alpha, anti-IKK alpha (phospho T23), anti-β-actin | Abcam, CA, USA | Used for Western blot analysis targeting specific proteins. | |
| Anti-TTC11/FIS1 Antibody | abcam | ab71498 | Used for protein detection in Western Blot (WB) experiments. |
| BCA Protein Assay Kit | Tiangen Biotech Co., Ltd., Beijing, China | Used for determining protein concentration. | |
| beta-Actin Loading Control antibody Mouse Mab | Sino Biological | 100166-MM10 | Used for protein detection in Western Blot (WB) experiments. |
| ChemiScope 3300 Imaging System | Clinx Science Instruments, Shanghai, China | Used for scanning developed films from Western blot analysis. | |
| ELISA kit for CK-MB detection | Nanjing Jiancheng Bioengeering Institute(Nanjing, China) | Used for detecting levels of cardiac injury indexes | |
| ELISA kit for cTn-T, ICAM-1, IL-1β, IL-6, TNF-α detection | CUSABIO Biotech CO., Ltd. (Wuhan, China) | Used for detecting levels of cardiac injury indexes and inflammatory cytokines in rat serum samples. | |
| FastQuant RT Kit | TIANGEN, Beijing China | Used for reverse transcription of cDNA. | |
| HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG | Thermo Scientific, Basingstoke, UK | ||
| LDH Assay kit and MDA Assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting LDH and MDA levels in myocardium tissues from the infarct area in the left ventricle. | |
| Munziq | provided by Xinjiang Medical University | The main investigational drug in this study | |
| NF-κB p65 (D14E12) XP Rabbit mAb #8242 | CST | 8242S | Used for protein detection in Western Blot (WB) experiments. |
| Nitric Oxide (NO) assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting NO levels at 550 nm in myocardial tissue. | |
| Phospho-NF-κB p65 (Ser536) (93H1) Rabbit mAb #3033 | CST | 3033S | Used for protein detection in Western Blot (WB) experiments. |
| Quantity One software | Bio-Rad Laboratories, Hercules, CA, USA | Used for analyzing Western blot images. | |
| Recombinant Anti-DRP1 Antibody | abcam | ab184247 | Used for protein detection in Western Blot (WB) experiments. |
| RIPA lysis buffer | Boster Biotechnology Co., Ltd., Wuhan, China | AR0105 | Used for extracting total proteins from rat ventricular tissues. |
| Secondary antibodies (HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG) | Thermo Scientific, Basingstoke, UK | Used for detection following primary antibody incubation in Western blot analysis. | |
| SYBR Select Master Mix | ABI, CA, USA | Used in qRT-PCR analysis on ABI 7500 Real-time PCR instrument. | |
| transmission electron microscope | HitachiS-2400 Hitachi, Tokyo, Japan | Used to examine thin sections of ventricular tissues. | |
| Trizol reagent | Invitrogen Co., Carlsbad, California, USA | Used for RNA extraction from ventricular tissues. |
参考文献
- Anderson, J. L., Campion, E. W., Morrow, D. A. Acute myocardial infarction. New Engl J Med. 376 (21), 2053-2064 (2017).
- Vos, T., et al. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet. 396 (10258), 1204-1222 (2020).
- Murphy, A., Goldberg, S. Mechanical complications of myocardial infarction. Am J Med. 135 (12), 1401-1409 (2022).
- Heusch, G. Myocardial ischemia/reperfusion: Translational pathophysiology of ischemic heart disease. Medicine. 5 (1), 10-31 (2024).
- Bhatt, D. L., Lopes, R. D., Harrington, R. A. Diagnosis and treatment of acute coronary syndromes. Jama. 327 (7), 662-675 (2022).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: A target for cardioprotection. Cardiovasc Res. 115 (7), 1143-1155 (2019).
- Gunata, M., Parlakpinar, H. A review of myocardial ischaemia/reperfusion injury: Pathophysiology, experimental models, biomarkers, genetics and pharmacological treatment. Cell Biochem Funct. 39 (2), 190-217 (2020).
- He, J., et al. Myocardial ischemia/reperfusion injury: Mechanisms of injury and implications for management (review). Exp Ther Med. 23 (6), 430 (2022).
- Xiang, M., et al. Role of oxidative stress in reperfusion following myocardial ischemia and its treatments. Oxid Med Cell Longevity. 2021, 1-23 (2021).
- Astudillo, A. M., Balboa, M. A., Balsinde, J. Compartmentalized regulation of lipid signaling in oxidative stress and inflammation: Plasmalogens, oxidized lipids and ferroptosis as new paradigms of bioactive lipid research. Prog Lipid Res. 89, 101207 (2023).
- Algoet, M., et al. Myocardial ischemia-reperfusion injury and the influence of inflammation. Trends Cardiovasc Med. 33 (6), 357-366 (2023).
- Zhang, F., et al. Β-cryptoxanthin alleviates myocardial ischaemia/reperfusion injury by inhibiting nf-κb-mediated inflammatory signalling in rats. Arch Physiol Biochem. 128 (4), 1128-1135 (2020).
- Guo, Q., et al. Nf-κb in biology and targeted therapy: New insights and translational implications. Signal Transduct Target Ther. 9 (1), 53 (2024).
- Mi, J., et al. Inhibition of heat shock protein family a member 8 attenuates spinal cord ischemia-reperfusion injury via astrocyte nf-κb/nlrp3 inflammasome pathway. J Neuroinflammation. 18 (1), 170 (2021).
- Zhang, L., Zhao, S., Wang, Y. Diannexin alleviates myocardial ischemia-reperfusion injury by orchestrating cardiomyocyte oxidative damage, macrophage polarization and fibrotic process by tlr4-nf-kb-mediated inactivation of nlrp3 inflammasome. Int Immunopharmacol. 130, 111668 (2024).
- Zhou, Y., et al. Qingchang mixture prevents the intestinal ischemia-reperfusion injury through tlr4/nf-kb pathway. Combinatorial Chem High Throughput Screen. 26 (1), 49-57 (2023).
- Ozturk, A., et al. The protective effects of trimetazidine against ovary ischemia-reperfusion injury via the tlr4/nf-kb signal pathway. J Biochem Mol Toxicol. 36 (8), e23114 (2022).
- Du, S., Deng, Y., Yuan, H., Sun, Y. Safflower yellow b protects brain against cerebral ischemia reperfusion injury through ampk/nf-kb pathway. Evid Based Compl Alt Med. 2019, 1-11 (2019).
- Dong, X., et al. Physcion protects rats against cerebral ischemia-reperfusion injury via inhibition of tlr4/nf-kb signaling pathway. Drug Design Dev Therapy. 15, 277-287 (2021).
- Hashmi, S., et al. Hydrogen sulphide treatment prevents renal ischemia-reperfusion injury by inhibiting the expression of icam-1 and nf-kb concentration in normotensive and hypertensive rats. Biomolecules. 11 (10), 1549 (2021).
- Gao, L., et al. Hic-5 deficiency attenuates hepatic ischemia reperfusion injury through tlr4/nf-κb signaling pathways. Life Sciences. 249, 117517 (2020).
- Xu, Z., et al. Cardioprotection of mab2g4/odn/lip on myocardial ischemia-reperfusion injury via inhibiting the nf-κb signaling pathway. Cardiovas Ther. 2023, 1-15 (2023).
- Xiao, G., et al. Cxcr1 and its downstream nf-κb inflammation signaling pathway as a key target of guanxinning injection for myocardial ischemia/reperfusion injury. Front Immunol. 13, 1007341 (2022).
- Jeddi, S., Gheibi, S., Kashfi, K., Carlström, M., Ghasemi, A. Dose-dependent effects of long-term administration of hydrogen sulfide on myocardial ischemia-reperfusion injury in male wistar rats: Modulation of rkip, nf-κb, and oxidative stress. Int J Mol Sci. 21 (4), 1415 (2020).
- Yao, Y., et al. Targeting camkii-δ9 ameliorates cardiac ischemia/reperfusion injury by inhibiting myocardial inflammation. Circ Res. 130 (6), 887-903 (2022).
- Zhuang, L., Zong, X., Yang, Q., Fan, Q., Tao, R. Interleukin-34-nf-κb signaling aggravates myocardial ischemic/reperfusion injury by facilitating macrophage recruitment and polarization. eBioMedicine. 95, 104744 (2023).
- Maimaitiaili, A., et al. Effects of different doses of savda munziq on myocardial ischemia-reperfusion injury in rats with abnormal savda syndrome. Genet Mol Res. 13 (3), 4729-4735 (2014).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Hao, Y., et al. Transition of the abnormal savda syndrome to the hepatic carcinoma shifted unfolded protein response to autophagy was partly reversed by savda munziq in a rat model. Biomed Pharmacother. 121, 109643 (2020).
- Maimaitiaili, A., Li, J., Aibibula, A., Abudureheman, M. Erratum: Inhibition of nuclear factor kappa b pathway protects myocardial ischemia/reperfusion injury in rats under treatment with fufang munziq granule (munziq). Am J Transl Res. 10 (11), 3876 (2018).
- Zhang, X., et al. Rosa rugosa flavonoids alleviate myocardial ischemia reperfusion injury in mice by suppressing jnk and p38 mapk. Microcirculation. 24 (7), (2017).
- Dong, P., Liu, K., Han, H. The role of nf-κb in myocardial ischemia/reperfusion injury. Curr Prot Peptide Sci. 23 (8), 535-547 (2022).
- Guo, X., et al. Differential integrative omic analysis for mechanism insights and biomarker discovery of abnormal savda syndrome and its unique munziq prescription. Sci Rep. 6, 27831 (2016).
- Awad, A. S. Role of at1 receptors in permeability of the blood-brain barrier in diabetic hypertensive rats. Vascul Pharmacol. 45 (3), 141-147 (2006).
- La, X., et al. Upregulation of pd-1 on cd4(+)cd25(+) t cells is associated with immunosuppression in liver of mice infected with echinococcus multilocularis. Int Immunopharmacol. 26 (2), 357-366 (2015).
- Wu, T., et al. Circulating small extracellular vesicle-encapsulated sema5a-it1 attenuates myocardial ischemia-reperfusion injury after cardiac surgery with cardiopulmonary bypass. Cell Mol Biol Lett. 27 (1), 95 (2022).
- Pinto, A., et al. The extracellular isoform of superoxide dismutase has a significant impact on cardiovascular ischaemia and reperfusion injury during cardiopulmonary bypass. Eur J Cardio-Thor Surg. 50 (6), 1035-1044 (2016).
- Sabe, S. A., Harris, D. D., Broadwin, M., Sellke, F. W. Cardioprotection in cardiovascular surgery. Basic Res Cardiol. 119 (4), 545-568 (2024).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Mamtimin, B., et al. An magnetic resonance-based plasma metabonomic investigation on abnormal savda in different complicated diseases. J Tradl Chinese Med. 34 (2), 166-172 (2014).
- Marin, W., Marin, D., Ao, X., Liu, Y. Mitochondria as a therapeutic target for cardiac ischemia-reperfusion injury (review). Int J Mol Med. 47 (2), 485-499 (2020).
- Novack, V., et al. Troponin criteria for myocardial infarction after percutaneous coronary intervention. Arch Intern Med. 172 (6), 502-508 (2012).
- Kemp, M., Donovan, J., Higham, H., Hooper, J. Biochemical markers of myocardial injury. Br J Anaesth. 93 (1), 63-73 (2004).
- Zhang, D. Z., Jia, M. Y., Wei, H. Y., Yao, M., Jiang, L. H. Systematic review and meta-analysis of the interventional effects of resveratrol in a rat model of myocardial ischemia-reperfusion injury. Front Pharmacol. 15, 1301502 (2024).
- Ta, F. X., Zhang, T., Zhu, C. M. Correlation between mir-21 and the protective effects of resveratrol against myocardial ischemia/reperfusion injury in rats. Chin. J. Arteriosclerosis. 21 (6), 493-496 (2013).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. Am J Physiol Heart Circ Physiol. 314 (4), H812-H838 (2018).
- Oeckinghaus, A., Hayden, M. S., Ghosh, S. Crosstalk in nf-kappab signaling pathways. Nat Immunol. 12 (8), 695-708 (2011).
- Van Der Heiden, K., Cuhlmann, S., Luong Le, A., Zakkar, M., Evans, M. Role of nuclear factor kappab in cardiovascular health and disease. Clin Sci. 118 (10), 593-605 (2010).
- Ha, T., et al. Toll-like receptors: New players in myocardial ischemia/reperfusion injury. Antioxid Redox Signal. 15 (7), 1875-1893 (2011).
- Pourrajab, F., Yazdi, M. B., Zarch, M. B., Zarch, M. B., Hekmatimoghaddam, S. Cross talk of the first-line defense tlrs with pi3k/akt pathway, in preconditioning therapeutic approach. Mol Cell Ther. 3, 4 (2015).
- Wang, Y. H., et al. Lumbrokinase attenuates myocardial ischemia-reperfusion injury by inhibiting tlr4 signaling. J Mol Cell Cardiol. 99, 113-122 (2016).
- Yu, H., et al. Gypenoside protects cardiomyocytes against ischemia-reperfusion injury via the inhibition of mitogen-activated protein kinase mediated nuclear factor kappa b pathway in vitro and in vivo. Front Pharmacol. 7, 148 (2016).
- Liu, X., et al. Peroxisome proliferator-activated receptor gamma (ppargamma) mediates the protective effect of quercetin against myocardial ischemia-reperfusion injury via suppressing the nf-kappab pathway. Am J Transl Res. 8 (12), 5169-5186 (2016).
- Han, D., et al. Hydroxysafflor yellow a alleviates myocardial ischemia/reperfusion in hyperlipidemic animals through the suppression of tlr4 signaling. Sci Rep. 6, 35319 (2016).
- Yang, Q., He, G. W., Underwood, M. J., Yu, C. M. Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury: Perspectives and implications for postischemic myocardial protection. Am J Transl Res. 8 (2), 765-777 (2016).
- Valen, G., Paulsson, G., Vaage, J. Induction of inflammatory mediators during reperfusion of the human heart. Ann Thorac Surg. 71 (1), 226-232 (2001).
- Saini, H. K., et al. Role of tumour necrosis factor-alpha and other cytokines in ischemia-reperfusion-induced injury in the heart. Exp Clin Cardiol. 10 (4), 213-222 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。