Research Article
Herbal Munziq משפר את הפגיעה באיסכמיה של שריר הלב על ידי עיכוב דלקת
In This Article
Summary
מחקר זה בוחן את ההשפעות המגנות על הלב של Munziq, תכשיר צמחי מרפא אויגורי מסורתי, על פגיעה באיסכמיה-רפרפוזיה בשריר הלב (MIRI) בחולדות עם נוזל גוף לא תקין. באמצעות שיטות ניסוי מקיפות, אנו מדגימים את הפוטנציאל של Munziq להפחית את MIRI על ידי דיכוי מסלול האיתות NF-κB.
Abstract
מטרת מחקר זה הייתה לחקור את ההשפעות המגנות על הלב של Munziq על פגיעה לא תקינה בנוזל הגוף, פגיעה באיסכמיה-רפרפוזיה של שריר הלב (MIRI) והמנגנון העומד בבסיסה. חולדות רגילות וחולדות עם נוזל גוף לא תקין (ABF) טופלו מראש ב-Munziq במשך 21 יום. בעקבות זאת הוקמו מודלים של MIRI. שינויים היסטופתולוגיים ושינויים במבנה שריר הלב נצפו על ידי מיקרוסקופ אלקטרונים של המטוקסילין ואאוזין (HE) כדי לצפות בביטויים פתולוגיים של פגיעה בשריר הלב. רמות CK-MB, cTn-T ו-ICAM-1 בסרום זוהו על ידי Enzyme-Linked Immunosorbent Assay (ELISA) כדי לצפות בסמנים הקשורים לפגיעה בשריר הלב. רמות IL-1β, IL-6 ו-TNF-α בסרום וברקמת שריר הלב זוהו גם על ידי ELISA כדי לצפות בהשפעה האנטי דלקתית. רמות הביטוי של חלבונים הקשורים למסלול האיתות NF-κB NIK, IKKα, Pikα ו-p65 זוהו על ידי ניתוח כתמים מערביים. התוצאות הראו כי פגיעה בשריר הלב בקבוצת ABF MIRI הייתה חמורה יותר בהשוואה לקבוצת הביקורת MIRI. לטיפול מקדים של Munziq יש פוטנציאל להפחית את השינויים הפתולוגיים הנגרמים על ידי פגיעה באיסכמיה-רפרפוזיה ויכול להגן על תפקוד הלב. רמות החלבון של מסלול NF-κB והאפקטורים במורד הזרם IL-1β, IL-6 ו-TNF-α היו מווסתות באופן משמעותי בקבוצת MIRI בעוד שהן מווסתות כלפי מטה בקבוצת Munziq. מעניין לציין שהייתה יותר הפעלה של מסלול האיתות NF-κB ורמות גבוהות יותר של ציטוקינים דלקתיים במורד הזרם בקבוצת ABF MIRI. התוצאות מצביעות על כך ש-MIRI היה חמור יותר ב-ABF. ל-Munziq יש השפעות מגנות על הלב באיסכמיה ופציעות רפרפוזיה. אפקט מגן זה עשוי לפעול על ידי דיכוי מסלול האיתות NF-κB.
Introduction
איסכמיה של שריר הלב היא מצב שבו שריר הלב אינו מקבל זרימת דם מספקת, הנגרמת בעיקר על ידי היצרות או פקקת של העורקים הכליליים1, מה שעלול להוביל לתוצאות קטלניות עבור חולים 2,3. מכיוון שחילוף החומרים בשריר הלב הוא כמעט אך ורק אירובי ומכיל מאגרי גליקוגן מוגבלים מאוד, חיוני להחזיר את אספקת הדם במהירות, בעיקר באמצעות PCI או פקקת תוך ורידית. בעוד שרפרופוזיה יעילה של שריר הלב חיונית לשיפור הפרוגנוזה של שריר הלב האיסכמי, היא גם מציגה את הסיכון לפגיעה באיסכמיה-רפרפוזיה של שריר הלב (MIRI)4,5,6. MIRI הוא אתגר משמעותי המשפיע על היעילות של טיפולי רפרפוזיה בשריר הלב7. גורמים ומנגנונים רבים תורמים להתפתחות MIRI. לדוגמה, בתאי אנדותל, רפרפוזיה גורמת להצטברות של מיני חמצן תגובתיים (ROS) ולדלדול של נבלות רדיקלים חופשיים, מה שמעיד על נוכחות של מתח חמצוני 4,8. עקה חמצונית זו עלולה לעורר תגובה דלקתית, מה שמוביל לשחרור מוגבר של גורמים דלקתיים, ייצור מוגבר של מולקולות הידבקות וגיוס לויקוציטים 9,10,11. מסלול הגורם הגרעיני קאפה-משפר שרשרת קלה של תאי B פעילים (NF-κB) ממלא תפקיד מכריע בתגובה הדלקתית במהלך איסכמיה של שריר הלב/פגיעה ברפרפוזיה12. משפחת גורמי השעתוק NF-κB של יונקים כוללת חמישה חברים: NF-κB1 (הידוע גם בשם p105/p50), NF-κB2 (הידוע גם בשם p100/p52), p65 (המכונה גם RELA), RELB (ההומולוג של האונקוגן הנגיפי של V-Rel reticuloendotheliosis) ו-c-REL13,14. הוכח כי עיכוב של מסלול NF-κB מקל על פגיעה באיסכמיה/רפרפוזיה ברקמות שונות, כולל שריר הלב12,15, מעי16, שחלה17, מוח18,19, כליות20 וכבד21. יש לציין כי מסלול האיתות NF-κB תועד בהרחבה כמתווך מרכזי בתגובת שריר הלב לאיסכמיה ורפרפוזיה12,14, מנגנונים אפשריים כוללים קידום תגובות דלקתיות, ויסות הביטוי של מולקולות הידבקות תאים, השתתפות בתגובות עקה חמצונית והשפעה על מוות תאים ומסלולי הישרדות 12,20,22,23,24,25. התערבויות טיפוליות שמטרתן להחליש את הפעלת NF-κB הראו פוטנציאל משמעותי בהקלה על MIRI23,26.
הרפואה האויגורית, שהיא חלק בלתי נפרד מהרפואה הסינית המסורתית, מבוססת על תורת ארבעת ההומור: אש, אוויר, מים ואדמה. הומור זה מוליד נוזלי גוף כגון דם, ליחה, מרה צהובה ומרה שחורה27,28. שמירה על הומאוסטזיס דינמי בין ארבעת נוזלי הגוף הללו חיונית לבריאות הכללית של גוף האדם. כל חוסר איזון בנוזלים אלה, המכונה נוזלי גוף לא מאוזנים, עלול לגרום להופעת מחלות. מבין נוזלי הגוף הלא מאוזנים השונים, השולט ידוע כנוזל גוף לא תקין (ABF), המוכר גם כתסמונת סבדה לא תקינה (ASS)27,28. מונזיק, תרופה אויגורית מסורתית הנמצאת בשימוש נרחב על ידי רופאים אויגורים, נרשמת לטיפול בנוזלי גוף חריגים. זהו תכשיר מרפא צמחי המורכב מעשרה מינים רפואיים שונים, כפי שמופיע בתוספת האריזה, כולל Cordia dichotoma Forst. f., Anchusaitalica Retz., Glycyrrhiza uralensis Fisch., Adiantum capillusveneris L., Euphorbia humifusa Willd., Ziziphus jujuba Mill., Lavandula angustifolia Mill., Foeniculum vulgare Mill., Melissa officinalis L., ו-Alhagi pseudoalhagi Desv29. מונזיק אושר על ידי מינהל המזון והתרופות הממלכתי בשנת 2003 תחת הקוד מספר Z65020166. מרכיביו הכימיים הפעילים כוללים פליז, פנולים, חומצות אורגניות, חומצות אמינו, ספונין, סוכר ואחרים. Munziq מציג השפעות מרובות, כולל נוגדי חמצון, אנטי דלקתיים, מווסת חיסוני, אנטי טסיות דם ואנטי-טרומבוטיות 27,28,30.
המחקרים הקודמים שלנו הראו שתרופת מונזיק יכולה להקל על איסכמיה של שריר הלב / פגיעה ברפרפוזיה (MIRI), אם כי המנגנונים הספציפיים עדיין לא ברורים. הוצגו השפעות מגן על שריר הלב של Munziq בחולדות עם פגיעה באיסכמיה של שריר הלב עם תסמונת Savda לא תקינה. עיכוב של מסלול הגורם הגרעיני קאפה b מגן על איסכמיה של שריר הלב / פגיעה ברפרפוזיה בחולדות המטופלות בגרגיר Fufang Munziq (Munziq) 27,28,30. עם זאת, יש מחקר מוגבל החוקר את התפקיד והמנגנון של מונזיק ב-MIRI.
מחקר זה נועד לחקור את ההשפעות המגנות על הלב של Munziq על פגיעה באיסכמיה-רפרפוזיה של שריר הלב (MIRI) בחולדות עם נוזל גוף לא תקין (ABF) ולחקור את המנגנונים הבסיסיים, במיוחד תוך התמקדות במסלול האיתות NF-κB. ההשערה המוצעת במחקר זה היא שטיפול מקדים ב-Munziq יכול להפחית את השינויים הפתולוגיים הנגרמים על ידי MIRI ולהגן על תפקוד הלב, פוטנציאלית על ידי דיכוי מסלול האיתות NF-κB ותגובות דלקתיות במורד הזרם. ההשערה נבדקת על ידי קביעת מודלים של דמה, פגיעה באיסכמיה-רפרפוזיה (MIRI) ופגיעה באיסכמיה-רפרפוזיה + Munziq הן בקבוצת הביקורת והן בקבוצת ה-ABF. מנוטרים תפקוד לב, אינדיקטורים הקשורים לדלקת וחלבונים הקשורים למסלול NF-κB.
Protocol
חולדת Sprague-Dawley (SD) זכר בוגר במשקל 200-220 גרם שימש בהתאם להנחיות המכונים הלאומיים לבריאות לטיפול ושימוש בחיות מעבדה. המרכז הניסויי לבעלי חיים של האוניברסיטה הרפואית שינג'יאנג. מודלים של בעלי חיים עם נוזל גוף חריג (ABF) סופקו על ידי המרכז לבעלי חיים ניסיוניים של האוניברסיטה הרפואית שינג'יאנג. חולדות הוחזקו בסביבה יבשה-קרה כפי שתואר קודם לכן, דבר חיוני לביסוס מודל נוזל הגוף החריג (ABF) בחולדות, על פי תיאוריית הרפואה האויגורית המסורתית וכפי שהודגם במחקרים קודמים29,33. כל הניסויים בבעלי חיים נערכו על פי ההנחיות האתיות של האוניברסיטה הרפואית של שינג'יאנג ובוצעו בהתאם להנחיות ARRIVE. הפרוטוקול למחקרים בבעלי חוליות (חולדות) אושר על ידי הוועדה האתית המוסדית של האוניברסיטה הרפואית של שינג'יאנג (IACUC-20200318-16).
1. קיבוץ בעלי חיים, מתן תרופות והקמת מודל MIRI
- הקצה חולדות באופן אקראי לשש הקבוצות הבאות: i) קבוצת ביקורת דמה, ii) קבוצת ביקורת MIRI, iii) קבוצת דמה ABF, iv) קבוצת ABF MIRI, v) קבוצת ביקורת MIRI + Munziq ו-6) קבוצת ABF MIRI + Munziq.
- שכן את החולדות בקבוצת ABF בסביבה מבוקרת בתוך קופסאות אקלים המוגדרות לטמפרטורה של 6 מעלות צלזיוס ± 1 מעלות צלזיוס וטווח לחות יחסית של 25% עד 32.8%. ספק לחולדות מזון רגיל מעורבב עם מזון קר יבש, כלומר זרעי שעורה וכוסברה ביחס של 7:1.5:1.5, ויישם שיטה זו למשך 21 יום כדי לבסס את מודל ABF29,33.
- יש לתת במתן תוך-קיבה 5 גרם/ק"ג Munziq (5.0 גרם Munziq מומס ב-1 מ"ל מים מזוקקים) לקבוצת Munziq במשך 21 יום לפני ניתוח MIRI, שהוא כפול מהמינון הקליני היעיל. עבור בעלי חיים שאינם ABF, כגון קבוצות Control Sham, Control MIRI ו-Control MIRI + Munziq, יש לתת נפח שווה של מי מלח רגילים לקבוצת הדמה ולקבוצת MIRI ולספק מתן תוך קיבה של Munziq לקבוצת Munziq.
- לאחר 21 יום של טיפול מקדים, קבע את מודל MIRI.
- יש לבצע את הניתוח בחדר ניתוח ייעודי לבעלי חיים המצויד בחומרים סטריליים כדי להבטיח סביבה סטרילית. להרדים את החולדות באמצעות הזרקה תוך-צפקית (IP) של נתרן פנטוברביטל (35 מ"ג/ק"ג); התבונן בהרפיית שרירים, היענות לגירויים חיצוניים וקצב ועומק נשימה כדי להעריך את השפעת ההרדמה. עקוב אחר פרמטרים אלה כל 15 דקות לאורך כל ההליך. אם מופיעים סימנים של הרדמה לא מספקת (מתח שרירים, תגובה ניכרת לגירויים, קצב נשימה מוגבר או רדוד), יש לתת מינון משלים של 20 מ"ג/ק"ג. שמור על הרדמה לאורך כל ההליך עד לאיסוף הדם הסופי. במהלך ההליך, שמור על טמפרטורת גוף החולדה על 37 מעלות צלזיוס באמצעות כרית חימום עם ניטור רציף באמצעות בדיקת טמפרטורת פי הטבעת. מרחו משחה וטרינרית על העיניים כדי למנוע יובש בזמן ההרדמה.
- בצע טרכאוסטומיה לנשימה בעזרת מכונת הנשמה. לפני פתיחת בית החזה כדי לחשוף את הלב, יש לשטוף את מקום הניתוח במי סבון, לגלח את אזור הניתוח ולנקות את האזור בתמיסות חיטוי כגון כלורהקסידין ויוד. השתמש במכשירים סטריליים לצורך ההליך.
- כדי לפתוח את בית החזה ולחשוף את הלב, השתמש במכשירים כירורגיים סטריליים סטנדרטיים של בית החזה, כולל מספריים, מלקחיים ומחזירים. פתחו את דופן בית החזה וחשפו את הלב. זהה את העורק היורד הקדמי השמאלי (LAD) תחת הדמיה ישירה. זהו ענף עיקרי של העורק הכלילי השמאלי השוכן על פני הלב. השתמש בתפר 6-0 (4-5 ס"מ), קשר את ה-LAD (שמאל קדמי יורד) למשך 30 דקות כדי לגרום לאיסכמיה אזורית. קבע חסימת LAD יעילה על ידי התבוננות בצבע חיוור בשריר הלב.
- לאחר 30 דקות של קשירה, שחרר את הקשירה ובצע רפרפוזיה למשך 120 דקות. קבע את הזלוף מחדש של שריר הלב כאשר הוא מתאושש לצבע אדום בוהק. בחולדות עם ניתוח דמה, בצע את אותו הליך אך ללא קשירה של LAD.
- לאחר רפרפוזיה, החולדות נותרו תחת הרדמה המושרה על ידי נתרן פנטוברביטל (35 מ"ג/ק"ג, ip)34. לאחר שהחולדות בהרדמה עמוקה, אספו 1-2 מ"ל של דגימות דם מאבי העורקים הבטני באמצעות צינור איסוף דם ואקום.
- לאחר איסוף דגימות דם מאבי העורקים הבטני, המתת חסד של החולדות על ידי פריקת צוואר הרחם בעודן בהרדמה עמוקה. אוספים את רקמת שריר הלב מאזור האוטם בחדר השמאלי באמצעות מלקחיים ומספריים סטריליים, ומקפידים לקחת רק את הרקמה שנראית חיוורת ופגומה, מה שמעיד על אזור האוטם. הניחו את הרקמה שנאספה בכלי סטרילי להמשך ניתוח.
2. איסוף דוגמאות
- איסוף דגימות רקמות: בעזרת מספריים סטריליים ולהב סטרילי, חצו את הלב אופקית לשני חצאים לאורך נקודת האמצע של הציר הארוך של החדר השמאלי, בניצב לכיוון הלב. חלקו מחצית אחת של החלק האפיקלי לשני חלקים: שמרו אחד ב-4% פרפורמלדהיד לבדיקה מורפולוגית בטמפרטורת החדר או 4 מעלות צלזיוס למשך 2-24 שעות, והשני בגלוטרלדהיד למיקרוסקופ אלקטרונים ב-4 מעלות צלזיוס למשך 1-4 שעות.
- חלקו את החלק הבסיסי של הלב, כולל האזורים האיסכמיים והלא איסכמיים, לשני חלקים: הניחו חלק אחד לתוך קריוביאל, הקפיאו במהירות את הרקמה בחנקן נוזלי, ולאחר מכן העבירו אותה למקפיא בטמפרטורה נמוכה במיוחד של -80 מעלות צלזיוס לבדיקת ביולוגיה מולקולרית. השתמש בחלק הטרי השני לאיתור רמות מיני חמצן תגובתי ברקמות (ROS) ומיצוי מיטוכונדריה.
- איסוף דגימות סרום: בסיום הניסוי, שאבו 1-2 מ"ל של דם ורידי מהווריד הנבוב התחתון, צנטריפוגה ב-1000 x גרם למשך 10 דקות, ואחסנו את הסרום במקפיא בטמפרטורה נמוכה במיוחד של -80 מעלות צלזיוס לאחר ההפרדה.
3. תצפית מיקרוסקופ אלקטרונים של צביעת HE ושידור
- בצע צביעת HE (צביעת המטוקסילין-אאוזין) על שריר הלב החדר לפי נוהל שגרתי35. תקן את הרקמות ב-4% פרפורמלדהיד למשך 24 שעות. הטמיעו את הדגימות בפרפין, חתכו אותן לחלקים בעובי 4 מיקרומטר וצבעו אותן בשיטת צביעת המטוקסילין-אאוזין על פי הפרוטוקול. בחר באופן אקראי חמישה שדות כדי לצפות בשינויים היסטופתולוגיים תחת המיקרוסקופ.
- לעבד רקמות שריר הלב מחולדות שקובעו בפורמלין, מכל קבוצה, לניסויי צביעת HE לפי השלבים הבאים.
- מניחים את חלקי הרקמה באינקובטור של 65 מעלות צלזיוס לאפייה למשך 1.5 עד 2.
- טבלו את חלקי הרקמה בקסילן למשך 10 דקות, החליפו את הקסילן וטבלו שוב למשך 10 דקות נוספות. טבלו ברצף באלכוהול נטול מים I ו-II למשך 5 דקות כל אחד, ואחריו 95%, 90%, 80% ו-70% אלכוהול, ומים מזוקקים למשך 5 דקות כל אחד.
- מכתים עם המטוקסילין למשך 3 דקות. בצע התמיינות חומצית עם חומצה הידרוכלורית בתוספת אלכוהול למשך מספר שניות (1-2 שניות). סיים את ההתמיינות במי ברז למשך 5 דקות.
- טבלו במים מזוקקים, 70%, 80%, 90% ו-95% אלכוהול למשך 3 דקות כל אחד, ואלכוהול נטול מים I ו-II למשך 5 דקות כל אחד.
- מכתים עם 0.5% אאוזין באתנול למשך דקה, שוטפים את החלקים באתנול 95% כדי להסיר עודף צבע אדום, ואז טובלים באתנול נטול מים למשך 5 דקות. טבלו בקסילן I ו-II למשך 5 דקות כל אחד.
- הר עם בלסם ניטרלי. התבונן בשינויים פתולוגיים של הרקמה תחת המיקרוסקופ.
4. זיהוי ELISA של ציטוקינים בדם ומדדי פגיעות לב
- השג דגימת סרום חולדה מדם היקפי על ידי צנטריפוגה ב-1000 x גרם למשך 10 דקות, ואחסן ב-80 מעלות צלזיוס. זיהוי רמות של מדדי פגיעות לב כגון CK-MB, cTn-T, ICAM-1 וציטוקינים דלקתיים כגון IL-1β, IL-6, TNF-α בסרום באמצעות ערכות ELISA בהתאם להוראות היצרן וכמתואר להלן.
- אפשר לכל הריאגנטים להתאזן לטמפרטורת החדר (18-25 מעלות צלזיוס) למשך 30 דקות לפחות, הכינו ריאגנטים לפי הוראות היצרן והכינו אותם לשימוש.
- הגדר בארות סטנדרטיות ובארות דגימה, כאשר הבארות הסטנדרטיות מכילות ריכוזים ידועים של תמיסות סטנדרטיות המסופקות בערכת הבדיקה. אלה משמשים לקביעת עקומה סטנדרטית במהלך הניסוי כדי לכמת את ריכוז האנליט הספציפי בדגימות הנבדקות. מוסיפים 100 מיקרוליטר של סטנדרט או דגימה לכל באר, מערבבים בעדינות על ידי ניעור, מכסים בחותם צלחת ודוגרים בחום של 37 מעלות צלזיוס למשך שעתיים.
- השליכו את הנוזל, יבשו על ידי סילוק ואל תשטפו. הוסף 100 מיקרוליטר של נוגדן עם תווית ביוטין (מדולל מראש 1:100) תמיסת עבודה לכל באר, כסה באטם צלחת חדש ודגירה בטמפרטורה של 37 מעלות צלזיוס למשך שעה.
- השליכו את הנוזל מהבארות, יבשו על ידי סילוק ושטפו את הצלחת פי 3. משרים במשך 2 דקות לכל כביסה, 200 מיקרוליטר לבאר ומייבשים על ידי סילוק.
- הוסף 100 מיקרוליטר של תמיסת עבודה סטרפטווידין עם תווית חזרת פרוקסידאז לכל באר, מכסים בחותם צלחת חדש ודוגרים בטמפרטורה של 37 מעלות צלזיוס למשך שעה.
- השליכו את הנוזל מהבארות, יבשו על ידי סילוק ושטפו את הצלחת פי 5. משרים במשך 2 דקות לכל כביסה, 200 מיקרוליטר לבאר ומייבשים על ידי סילוק.
- הוסף ברצף 90 מיקרוליטר של תמיסת מצע לכל באר, ופתח את הצבע בחושך ב-37 מעלות צלזיוס למשך 15-30 דקות.
- הוסף ברצף 50 מיקרוליטר של תמיסת עצירה לכל באר כדי לסיים את התגובה. תוך 5 דקות לאחר עצירת התגובה, מדוד את הצפיפות האופטית (ערכי OD) של כל באר ברצף ב-450 ננומטר באמצעות קורא מיקרו-פלטות.
5. מדידת רמת MDA, NO ו-LDH
- לאחר רפרפוזיה, אסוף רקמת שריר הלב (5 מ"מ על 7 מ"מ) מאזור האוטם בחדר השמאלי. זיהוי LDH (לקטט דהידרוגנאז) ו-MDA (מלונדיאלדהיד) באמצעות ערכת בדיקת LDH וערכת בדיקת MDA, בהתאם להוראות היצרן. זהה NO ב-550 ננומטר באמצעות ערכת בדיקת תחמוצת החנקן (NO) בהתאם להוראות היצרן.
6. ניתוח כתמים מערביים
- חלץ חלבונים כוללים מרקמות חדריות של חולדות באמצעות ליזיס RIPA. קבע את ריכוז החלבון באמצעות ערכת בדיקת חלבון BCA.
- כדי לשמר חלבונים תוך תאיים ולמנוע פירוק תאי, טבלו את הדגימות בחנקן נוזלי כדי להקפיא אותן במהירות. לאחר מכן, שלפו את הדגימות הקפואות וטחנו אותן לאבקה, קחו כ-100 מ"ג מהדגימה והוסיפו אותן לצינור צנטריפוגה מקורר מראש של 1.5 מ"ל. הוסף 400 מיקרוליטר של מאגר ליזה RIPA (תוסף עם מעכבי פרוטאז ומעכב פוספטאז רחב ספקטרום), ואז ערבב היטב ואפשר לתערובת לעמוד על 4 מעלות צלזיוס למשך 60 דקות.
- צנטריפוגה את התערובת ב-1000 x גרם למשך 15 דקות ב-4 מעלות צלזיוס. אספו את הסופרנטנט ומדדו את ריכוז החלבון בשיטת BCA.
- לדלל תקני BSA עם מדלל התואם את מערכת החיץ של הדגימות, על פי טבלה 1.
- הכן ריאגנטים לפי הוראות היצרן. בהתבסס על מספר הדגימות, מערבבים ריאגנטים A ו-B ביחס נפח של 50:1 כדי להכין כמות מספקת של תמיסת עבודה BCA ולערבב היטב. לפני הכנת תמיסת העבודה BCA, יש לנער את המגיב A כדי לערבב היטב.
- קח 20 מיקרוליטר של תמיסה סטנדרטית של BSA שהוכנה לאחרונה ודגימות מדוללות (מדוללות פי 10) מטבלה 1 והוסף אותן לצלחת של 96 בארות.
- מוסיפים 200 מיקרוליטר של תמיסת עבודה BCA לכל באר ומערבבים היטב. אוטמים את הצלחת, דוגרים בחום של 37 מעלות צלזיוס למשך 30 דקות, ואז מצננים לטמפרטורת החדר או מניחים בטמפרטורת החדר למשך 2 דקות.
- מדוד את הספיגה ב-562 ננומטר באמצעות קורא מיקרו-פלטות וחשב את ריכוז החלבון בדגימות על סמך העקומה הסטנדרטית.
- הוסף כמות מתאימה של מאגר טעינה SDS-PAGE 5x (המכיל β-מרקפטואתנול) לדגימות, טפל בחום ב-100 מעלות צלזיוס במים רותחים למשך 5 דקות כדי לנטרל את החלבונים במלואם, צנטריפוגה ב-1,000 x גרם למשך 5 דקות, וקח את הסופרנטנט לשימוש.
- הנוסחה בטבלה 2 מתארת את ההכנה של ג'לים מפרידים של 15%, 12% ו-8%, כמו גם ג'ל ערימה של 5%. הכן את הפתרונות בהתאם. מוסיפים את תמיסת הג'ל המפרידה לגובה של 2/3 בקלטת הג'ל, מכסים אותה במים מזוקקים ונותנים לה לעמוד בטמפרטורת החדר למשך 40 דקות. לאחר מכן, הוסיפו את ג'ל הערימה למילוי הקסטה, הכניסו את המסרק ותנו לו לשבת במשך 10 דקות.
- טען 9 מיקרוליטר של סמן חלבון צבוע מראש לכל באר, וטען 50 מיקרוגרם של חלבון דגימה לכל באר.
- הפעל מתח קבוע של 80 וולט עד שהברומופנול הכחול יגיע לג'ל המפריד, ואז הפעל מתח קבוע של 100 וולט למשך 90 דקות. עצור את האלקטרופורזה כאשר הברומופנול הכחול נדד לחלק התחתון של הג'ל.
- לאחר השלמת SDS-PAGE, טבלו את קרום ה-PVDF במתנול למשך 10 שניות, שטפו במים מזוקקים למשך דקה אחת, ולאחר מכן השרו את ג'ל הפוליאקרילאמיד, נייר הסינון וממברנת ה-PVDF המטופלת במאגר העברה למשך 10 דקות.
- הרכיבו את כריך ההעברה כשהצד השחור של הקליפים פונה כלפי מטה, ואחריו נייר מסנן ספוג-ג'ל-PVDF מסנן קרום-נייר-ספוג-צד שקוף של הקליפים. הנח את התפסים בקלטת ההעברה, וודא שהצד השחור של התפס פונה לצד השחור של הקסטה והצד הלבן פונה לצד האדום. בצע את ההעברה במתח קבוע של 100 וולט והשתמש בקרום PVDF עם זמן העברה של 60 דקות.
- לאחר ההעברה, יש לשטוף את קרום ה- PVDF במים 3x למשך 5 דקות כל אחד. חסום את הממברנה בתמיסה חוסמת המכילה 5% חלב יבש ללא שומן למשך שעה, ואז שטוף עם TBST 3x למשך 5 דקות כל אחד.
- לדלל את הנוגדן העיקרי ב-TBST בהתאם ליחסי הדילול המפורטים בטבלה 3 ולדגור ב-4 מעלות צלזיוס למשך הלילה. הנוגדנים העיקריים כוללים נוגדן נגד NF-κB p65, נוגדן אנטי-NF-κB השראת קינאז (NIK), נוגדן נגד IKKα ונוגדנים נגד β-אקטין.
- שוטפים את הממברנה 3 פעמים עם 1x TBST למשך 5 דקות כל אחד. מוסיפים את הנוגדן המשני המדולל כראוי (לפי טבלה 3) ודוגרים בטמפרטורת החדר למשך שעה. הנוגדנים המשניים הם IgG נגד עכברים מצומדים לעזים ו-IgG נגד ארנב מצומד HRP.
- שוטפים שוב את הממברנה עם 1x TBST 3x למשך 5 דקות כל אחד. מערבבים את הפתרונות המתפתחים A ו-B, מוסיפים 2 מ"ל לממברנה, ומזהים ומצלמים באמצעות מכשיר הכימילומינסנציה המיני.
- פתח את הממברנה באמצעות כימילומינסנציה משופרת בתוספת ריאגנט. סרוק את הסרט שפותח באמצעות מערכת ההדמיה. נתח את תמונות הכתם המערבי באמצעות תוכנה. השתמש ב-β-actin כבקרת הטעינה. חשב את רמת החלבון היחסית על סמך הערך האפור של β-אקטין.
7. ניתוח PCR בזמן אמת (qRT-PCR)
- מיצוי RNA כולל
- הכן תמיסת 0.1% DEPC ו-70% אלכוהול שטופל ב-DEPC לפי הוראות היצרן. טפל בכל הגדלים של צינורות מיקרו-צנטריפוגה וסוגים שונים של קצות פיפטה בתמיסת DEPC של 0.1%. משרים למשך הלילה, ואז חיטוי.
- אסוף תאים בשלב הצמיחה הלוגריתמי עם מצב צמיחה טוב. השליכו את מדיום התרבית מבקבוק תרבית התאים ושטפו את התאים פי 2 בתמיסה של האנק. הוסיפו 1 מ"ל טריפסין לכל 10 סמ"ר של תאים, נערו בעדינות כדי לנתק את התאים, והשתמשו בפיפטה כדי להבטיח ניתוק מוחלט. דגירה בטמפרטורת החדר למשך 5 דקות כדי לאפשר ליזה מלאה, ואז פיפטה למעלה ולמטה פי 7-10 כדי לשבש את התאים לחלוטין. העבירו את הליזאט לצינורות של 1.5 מ"ל, צנטריפוגה ואחסנו את הסופרנטנט.
- מוסיפים נפח שווה של כלורופורם לסופרנטנט, מערבבים היטב ומניחים לעמוד בטמפרטורת החדר למשך 10 דקות. צנטריפוגה ב-4 מעלות צלזיוס למשך 5 דקות ב-1,000 x גרם להפרדת השלבים. העבירו בזהירות את השלב המימי העליון לצינור חדש (אם מחלצים DNA וחלבונים, שמרו על השלב התחתון ואחסנו אותו בטמפרטורה של 4 מעלות צלזיוס).
- מוסיפים איזופרופנול (0.5 מ"ל לכל 1 מ"ל טריזול), מערבבים היטב ומניחים לעמוד בטמפרטורת החדר למשך 10 דקות. צנטריפוגה בטמפרטורה של 4 מעלות צלזיוס למשך 10 דקות ב-1,000 x גרם, הסר בעדינות את הסופרנטנט והשליך אותו.
- שטפו את כדור ה-RNA עם 75% אתנול, צנטריפוגה ב-4 מעלות צלזיוס למשך 5 דקות ב-8,000 x גרם, הסירו בעדינות את הסופרנטנט וייבשו את הגלולה באוויר או בוואקום. ממיסים את ה-RNA ב-50 מיקרוליטר של מי DEPC, ומאחסנים ב-70 מעלות צלזיוס או המשיכו לשעתוק הפוך ל-cDNA.
- שעתוק הפוך ל-cDNA
- בצע שעתוק הפוך של cDNA באמצעות ערכה בהתאם להוראות היצרן.
- PCR כמותי בזמן אמת
- תכנן פריימרים המבוססים על רצפי גנים ובדוק אותם באמצעות BLAST באתר NCBI. הכן תמיסות מלאי של 10 מיקרומטר של פריימרים קדימה ואחורה עבור CK20 ו-β-אקטין. טבלה 4 מציגה את רצפי הפריימר.
- PCR כמותי בזמן אמת
- הוסף 1 מיקרוליטר של cDNA, 10 מיקרוליטר של תערובת מאסטר 2x, 0.4 מיקרוליטר של פריימר קדימה ואחורה כל אחד, ו-8.2 מיקרוליטר של מים נטולי RNase במערכת התגובה.
- בצע PCR עם התוכנית הבאה: דנטורציה ראשונית ב-95 מעלות צלזיוס למשך 2 דקות, ואחריה 40 מחזורים של 95 מעלות צלזיוס למשך 15 שניות ו-60 מעלות צלזיוס למשך דקה אחת. השתמש ב-β-actin כבקרה הפנימית. חשב ביטוי יחסי באמצעות שיטת 2-ΔΔCt .
8. ניתוח סטטיסטי
- שימוש בתוכנה מסחרית לניתוח סטטיסטי. הצג נתונים כממוצע ± סטיית תקן (ממוצע ± SD). בצע ANOVA חד כיווני כדי להשוות הבדלים בין קבוצות שונות. הגדר הבדל משמעותי כ-p < 0.05.
תוצאות
Munziq מפחית את השינויים הפתולוגיים הנגרמים על ידי פגיעה באיסכמיה-רפרפוזיה
כדי לבחון את השינויים המורפולוגיים ברקמות שריר הלב, ביצענו תחילה צביעת HE. כצביעת ה-HE המייצגת המוצגת באיור 1, ראינו ניוון גרגירי וניוון ואקואולרי בתאי שריר הלב מסוימים בקבוצת הדמה. בנוסף, הייתה נוכחות מוגבלת של כדוריות דם אדומות וחדירת לימפוציטים בין תאי שריר הלב. מעת לעת ראינו התרחבות וגודש בכלי הדם. רקמות שריר הלב מקבוצת MIRI הראו פגיעה חמורה יותר והפגינו שינויים מורפולוגיים בולטים יותר. שינויים אלה כללו ניוון גרגירי נרחב, ניוון ואקואולרי, חדירת כדוריות דם אדומות ולימפוציטים, התרחבות כלי דם וגודש. הפגיעה ברקמת שריר הלב בקבוצת ABF MIRI הייתה חמורה יותר בהשוואה לזו שנצפתה בקבוצת הביקורת MIRI. עם זאת, בשתי קבוצות המונזיק, חלק מתאי שריר הלב הראו ניוון גרגירי קל וניוון ואקואולרי. נוכחות של כדוריות דם אדומות וחדירת לימפוציטים, הרחבת כלי דם וגודש היו נדירים. יתר על כן, הממצאים מצביעים על כך ש-Munziq מפגין השפעות טובות יותר להגנה על הלב בחולדות ABF MIRI ובחולדות MIRI. לסיכום, ממצאים אלה מצביעים על כך שלטיפול מקדים ב-Munziq יש פוטנציאל להפחית את השינויים הפתולוגיים הנגרמים על ידי פגיעה באיסכמיה-רפרפוזיה בלב.
Munziq שיפר את ההפרעה במיטוכונדריה ובסיבי שריר הלב שנגרמו על ידי פגיעה באיסכמיה/רפרפוזיה
כדי לאמת עוד יותר את תפקיד ההגנה של Munziq בפגיעת MIRI, בחנו את המבנה המיטוכונדריאלי וסיבי שריר הלב באמצעות TEM. כפי שמתואר באיור 2, תאי שריר הלב בקבוצת הדמה הראו מבנה שלם עם מיופיברילים מסודרים היטב ואורך סרקומר דומה. מבנה השריר נראה ברור ומעט רופף, בעוד שנצפו מספר רב של מיטוכונדריה. לעומת זאת, קבוצת MIRI הציגה מאפיינים פתולוגיים המעידים על תאי שריר הלב הפגועים, כולל נפיחות תאים, אורך סרקומר מגוון, מבנה מיופילמנט לא ברור ומסודר באופן רופף. צוין כי היה שיבוש נרחב והתמוססות של מיטוכונדריה בקבוצת I/R בהשוואה לקבוצת הדמה. חוץ מזה, סיבי שריר הלב היו לא סדירים ושבורים בתגובה לפגיעה ב-I/R. מעניין שחומרת השינויים הללו הייתה גבוהה יותר באופן משמעותי בקבוצת ABF MIRI. לעומת זאת, שתי הקבוצות שטופלו ב-Munziq הראו מאפיינים פתולוגיים קלים הקשורים לתאי שריר הלב הפגועים. הנפיחות של תאי שריר הלב הצטמצמה, והמבנים של מיופיברילים, סרקומר, שריר ומספר המיטוכונדריה היו דומים לאלה שנצפו בקבוצת הדמה. באופן קולקטיבי, נתונים אלה הצביעו על כך שטיפול מקדים ב-Munziq יכול להפחית את ההפרעה במיטוכונדריה ובסיבי שריר הלב הנגרמים על ידי ניתוח I/R.
פגיעה באיסכמיה-רפרפוזיה של שריר הלב הוחמרה ב-ABF MIRI חולדה וטיפול מקדים ב-Munziq הגנה על תפקוד הלב
רמות הסרום של cTn-T, CK-MB ו-ICAM-1 זוהו בשיטת ELISA. התוצאות לא חשפו הבדלים ניכרים בין קבוצת הביקורת לקבוצת הדמה של ABF. עם זאת, ראוי לציין שקבוצת ABF MIRI הציגה רמות גבוהות משמעותית של cTn-T (איור 3A), CK-MB (איור 3B) ו-ICAM-1 (איור 3C) בהשוואה לקבוצת הביקורת MIRI. על מנת להעריך את ההשפעות המגנות על הלב של מונזיק, הן חולדות הביקורת MIRI והן חולדות ABF MIRI היו נתונים לטיפול מקדים ב-Munziq. כפי שמודגם באיור 3, רמות ה-cTn-T, CK-MB ו-ICAM-1 הופחתו באופן משמעותי בקבוצת הטיפול המקדים של Munziq. תוצאות אלה מצביעות על כך ש-Munziq מפגין תכונות מדהימות להגנה על הלב בחולדות ABF MIRI.
כדי לחקור את ההשפעה של טיפול מקדים ב-Munziq על פגיעה בעקה חמצונית הנגרמת על ידי איסכמיה רפרפוזיה בחולדות ABF וביקורת, נמדדו השינויים של LDH, MDA ו-NO ברקמת שריר הלב. כפי שמוצג באיור 3D,F, קבוצת ABF MIRI הראתה רמות גבוהות משמעותית של MDA ורמות NO נמוכות משמעותית בהשוואה לקבוצת הביקורת MIRI. טיפול מקדים ב-Munziq הפחית משמעותית את תכולת ה-LDH וה-MDA בשריר הלב האיסכמי. במקביל, טיפול מקדים ב-Munziq העלה עוד יותר את רמת ה-NO ברקמת שריר הלב.
טיפול מקדים ב-Munziq מיתן את הדלקת של MIRI על ידי עיכוב ייצור ציטוקינים פרו-דלקתיים
ציטוקינים פרו-דלקתיים ממלאים תפקיד קריטי בתיווך התגובה החיסונית המולדת, וציטוקינים פרו-דלקתיים הופעלו במהלך MIRI31. כדי לחקור עוד יותר את ההשפעה האנטי דלקתית של Munziq, גם חולדות הביקורת MIRI וגם חולדות ABF MIRI עברו טיפול מקדים ב-Munziq. השתמשנו בשיטת ELISA כדי למדוד את רמות ה-IL-1β, IL-6 ו-TNF-α וניתוח qRT-PCR בסרום כדי להעריך את רמות ה-mRNA של IL-1β, IL-6 ו-TNF-α ברקמת שריר הלב. התוצאות לא חשפו הבדלים משמעותיים ברמות הציטוקינים הללו בין קבוצת הביקורת לקבוצת הדמה של ABF. רמות ה-IL-1β, IL-6 ו-TNF-α היו מווסתות באופן משמעותי בקבוצת ABF MIRI בהשוואה לקבוצת הביקורת MIRI. באופן ספציפי, IL-1β הראה עלייה משמעותית הן ברמות ה-mRNA והן ברמת החלבון, עם הבדל מובהק סטטיסטית. אמנם לא היה הבדל ברמת ה-mRNA עבור IL-6, אך נמצא פער ברמת החלבון. באופן דומה, TNF-α לא הראה שונות ברמות ה-mRNA אך הראה הבדלים ברמת החלבון. כפי שמוצג באיור 4, רמות ה-IL-1β, IL-6 ו-TNF-α ירדו באופן משמעותי בקבוצת הטיפול המקדים של Munziq.
טיפול מקדים ב-Munziq מיתן את הדלקת דרך מסלול האות NF-κB
ייצור הציטוקינים קשור קשר הדוק להפעלת מסלולי איתות NF-κB ברוב שלבי התגובה הדלקתית. NF-κB נחשב כמטרה טיפולית פוטנציאלית למחלות דלקתיות32. כדי להעריך אם מסלול NF-κB מעורב בהשפעות האנטי-דלקתיות של Munziq, ערכנו בתחילה ניתוח Western Blot כדי למדוד את רמות הביטוי של מרכיבי מפתח במסלול NF-κB, כולל NIK, IKKα, pIKKα ו-p6513. כפי שמתואר באיור 5, פגיעה איסכמית ורפרפוזיה גרמה לעלייה ניכרת של NIK, p-IKKα ו-p-p65 בקבוצת MIRI. הטיפול ב-Munziq החליש למעשה את הוויסות המוגבר הזה. התוצאות הצביעו על כך שמונזיק ממלא תפקיד קריטי באנטי דלקת על ידי דיכוי הפעלת מסלול האיתות NF-κB.
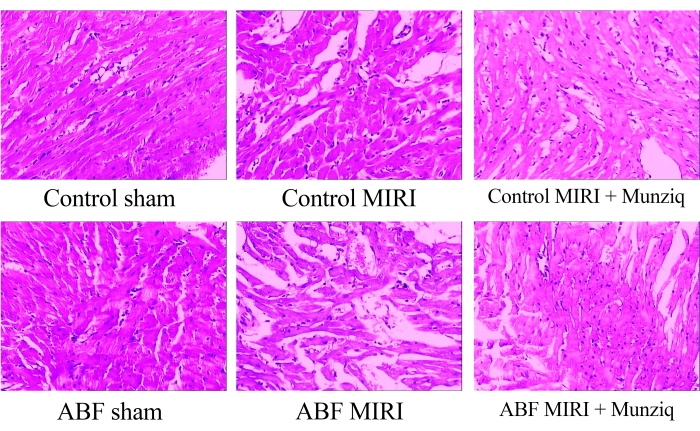
איור 1: שינויים מורפולוגיים של רקמות שריר הלב שנצפו על ידי צביעת HE. HE מייצג מכתים תמונות של קבוצות שונות. הגדלה: פי 100. קיצורים: ABF = נוזל גוף לא תקין; MIRI = פגיעה באיסכמיה-רפרפוזיה של שריר הלב; (n=6). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
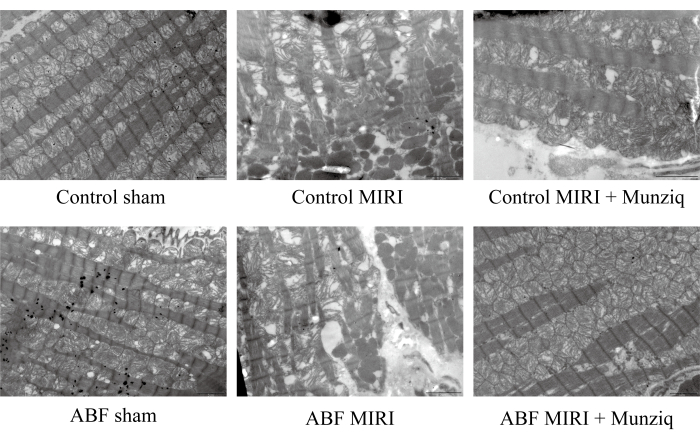
איור 2: Munziq שיפר את ההפרעה של המיטוכונדריה וסיבי שריר הלב שנגרמו על ידי פגיעת I/R. מיקרוסקופ אלקטרונים סורק בוצע כדי לצפות במבנה האולטרה-מבנה של המיטוכונדריה ובשינויים בסיבי שריר הלב. הוצגו תמונות מייצגות. סרגל קנה מידה: 5 מיקרומטר; (n=3). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
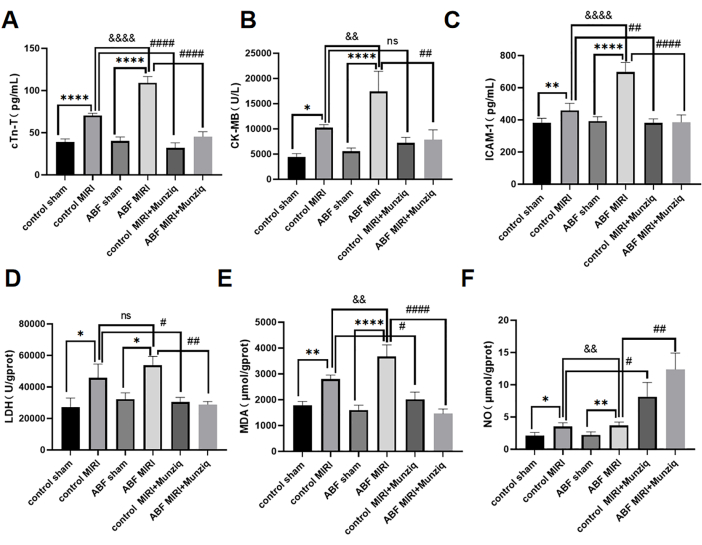
איור 3: פגיעה באיסכמיה-רפרפוזיה של שריר הלב הוחמרה בחולדות ABF MIRI, וטיפול מקדים ב-Munziq יכול להגן על תפקוד הלב. (A) cTn-T בסרום, (B) CK-MB ו-(C) ICAM-1. הרמות זוהו על ידי ELISA, והשינויים ב-LDH, MDA ו-NO נמדדו ברקמת שריר הלב (n=6). *p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 בהשוואה לקבוצת דמה; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 בהשוואה לקבוצת MIRI; &p<0.05, &< 0.01, &&p<0.001, &&&p<0.0001 בהשוואה לקבוצת הביקורת. הנתונים מוצגים כממוצע ± SD. ניתוח סטטיסטי בוצע באמצעות ANOVA חד כיווני. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
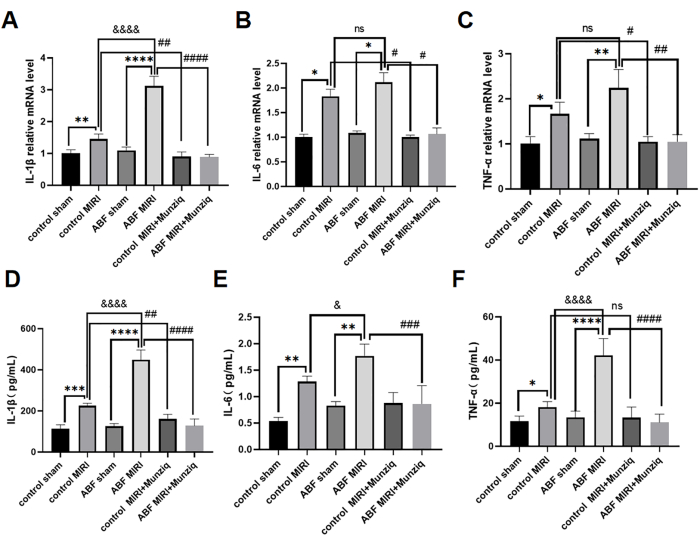
איור 4: טיפול מקדים ב-Munziq הפחית את הדלקת של MIRI על ידי מניעת ייצור ציטוקינים פרו-דלקתיים. qRT-PCR זיהה את רמות ה-mRNA של (A) IL-1β, (B) IL-6 ו-(C) TNF-α ברקמת שריר הלב. מדוד את רמות (D) IL-1β, (E) IL-6 ו-(F) TNF-α בסרום על ידי ELISA (n=6). *p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 בהשוואה לקבוצת דמה; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 בהשוואה לקבוצת MIRI; &p<0.05, & <0.01, &&p<0.001, &&&p<0.0001 בהשוואה לקבוצת הביקורת. הנתונים מוצגים כממוצע ± SD. ניתוח סטטיסטי בוצע באמצעות ANOVA חד כיווני. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
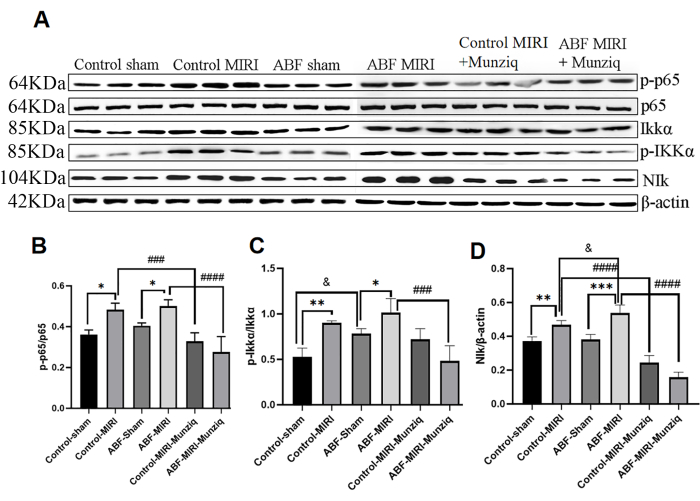
איור 5: טיפול מקדים ב-Munziq מיתן את הדלקת דרך מסלול האות NF-κB. ביטוי החלבון p-IKKα, IKKα, p-p65, p65 ו-NIk ברקמת שריר הלב זוהה על ידי כתם מערבי (N = 3 לכל קבוצה). (A) רצועות החלבון שנצפו בניתוח הכתם המערבי. (ב-ד) רמת הביטוי היחסית נקבעת על סמך הערך האפור. *p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 בהשוואה לקבוצת דמה; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 בהשוואה לקבוצת MIRI; &p<0.05, & p<0.01, &&p<0.001, &&&p<0.0001 בהשוואה לקבוצת הביקורת. הנתונים מוצגים כממוצע ± SD. ניתוח סטטיסטי בוצע באמצעות ANOVA חד כיווני. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| מספר צינור | נפח מדלל (מ"ל) | נפח BSA (מקור) | ריכוז BSA סופי (מ"ג/מ"ל) |
| A | 0 | 20 (פתרון מלאי) | 500 |
| B | 2 | 18 (פתרון מלאי) | 400 |
| C | 4 | 16 (פתרון מלאי) | 300 |
| D | 6 | 14 (פתרון מלאי) | 200 |
| E | 8 | 12 (פתרון מלאי) | 150 |
| F | 12 | 8 (פתרון מלאי) | 100 |
| G | 16 | 4 (פתרון מלאי) | 50 |
| H | 20 | 0 (פתרון מלאי) | 0 |
טבלה 1: תרשים הכנה לריכוז סטנדרטי של BSA.
| ג'לים מפרידים | 15% ג'ל לערימה | 12% ג'ל לערימה | 8% ג'ל לערימה | 5% ג'ל לערימה | |
| ריאגנטים | נפח | נפח | נפח | ריאגנטים | נפח |
| מים נטולי יונים (מ"ל) | 2.76 | 3.96 | 5.52 | מים נטולי יונים (מ"ל) | 4 |
| 30% אקרילאמיד (מ"ל) | 6 | 4.8 | 3.24 | 30% אקרילאמיד (מ"ל) | 1 |
| 1.5mol/lTris.HCl(PH8.8) (מ"ל) | 3 | 3 | 3 | 1.0 מיליון Tris.HCl (pH6.8; מ"ל) | 1 |
| 10% SDS (μL) | 120 | 120 | 120 | 10% SDS (μL) | 80 |
| 10% AP (מיקרוליטר) | 120 | 120 | 120 | 10% AP (מיקרוליטר) | 60 |
| TEMED (מיקרוליטר) | 4.8 | 4.8 | 7.2 | TEMED (מיקרוליטר) | 8 |
| נפח כולל (מ"ל) | 12 | 12 | 12 | נפח כולל (מ"ל) | 6 |
טבלה 2: הכנת ריכוז ג'ל.
| נוגדן ראשוני | יחס דילול | נוגדן משני | יחס דילול |
| β-אקטין | 1:1000 | עיזים נגד עכבר IgG H&L (HRP) | 1:15000 |
| עמ' 65 | 1:1000 | עיזים נגד ארנב IgG H&L (HRP) | 1:5000 |
| פ-עמ65 | 1:300 | 1:5000 | |
| BCL-2 | 1:1000 | 1:5000 | |
| באקס | 1:1000 | 1:5000 | |
| דרפ1 | 1:800 | 1:5000 | |
| פיס1 | 1:1000 | 1:5000 | |
| צרפת | 1:800 | 1:5000 |
טבלה 3: יחסי דילול נוגדנים.
| גן | רצף פריימר (5' עד 3') | ||
| IL-1β-F | CTGTGACTCGTGGGATG | ||
| IL-1β-R | GGGATTTTGTCGTTGCTTGT | ||
| TNF-α-F | GCCTCTCTCTGCCATCAAG | ||
| TNF-α-R | CTCCAAAGTAGACCTGCCCG | ||
| IL-6-F | GCCCACCAGGAACGAAAGTC | ||
| IL-6-R | GGCAACTGGCTGGAAGTCTC | ||
| בטא אקטין-F | CCCATCTATGAGGGTTACGC | ||
| בטא אקטין-R | TTTAATGTCACGCACGATTTC | ||
טבלה 4: רצפי פריימר.
Discussion
MIRI, ראשי תיבות של פגיעה באיסכמיה-רפרפוזיה של שריר הלב, הוא סיבוך שכיח ומשמעותי המתרחש לאחר רפרפוזיה של שריר הלב בניתוחי לב36,37, מעט תרופות או אדג'ובנטים שיפרו באופן סופי את התוצאות הקליניות בהשוואה לבקרות עכשוויות38. לכן, יש צורך דחוף בטיפולים יעילים כדי להגן על הלב מפני פגיעה כזו. Munziq, תכשיר צמחי מרפא מסורתי, הוכיח השפעות טיפוליות מסוימות על פגיעה באיסכמיה-רפרפוזיה של הלב 27,28,30. עם זאת, ממצאים אלה הם ראשוניים, והמנגנונים הבסיסיים נותרו לא ידועים. מטרת מחקר זה הייתה להמשיך לחקור ולאמת את ההשפעות והמנגנונים המגינים של Munziq על MIRI.
נוזל גוף לא תקין מכונה ביטוי שכיח של מחלות כרוניות שונות, כולל מחלות לב וכלי דם, על פי הרפואה האויגורית המסורתית39,40. במערכת הרפואית האויגורית, מאמינים ש-ABF הוא תוצאה של לחץ ארוך טווח ומכונה המקור למחלות שונות39. במחקר זה, נעשה שימוש במודל נוזל גוף לא תקין כדי לדמות את המאפיינים הבסיסיים של מחלות לב וכלי דם המחייבות ניתוח לב. MIRI הושרה בחולדות עם ABF כדי לקבוע את הפגיעה באיסכמיה-רפרפוזיה בשריר הלב.
פגיעה באיסכמיה היא מצב פתולוגי מורכב הכולל מספר תהליכים. דווח כי איסכמיה-רפרפוזיה בלב מובילה לשינויים פתולוגיים בשריר הלב4. שינויים פתולוגיים אלה באים לידי ביטוי בעיקר בקרדיומיוציטים מקוצרים, מבנה סרקומרי משובש, נפיחות מיטוכונדריאלית41 ומיופיברילים סרקומרים מסודרים באופן רופף, כפי שנצפה במחקר זה. פגיעה בשריר הלב גורמת גם לשינויים באנזימי סרום. ידוע היטב שרמות cTnT, CK-MB ו-ICAM-1 בסרום עולות בעקבות פגיעה בשריר הלב42,43. לכן, סמנים ביולוגיים אלה משמשים להערכת היקף הפגיעה החריפה בשריר הלב. במחקר זה, צפינו בשינויים הפתולוגיים בשריר הלב ובעלייה של אנזימי סרום לאחר פגיעה באיסכמיה-רפרפוזיה, מה שמעיד על הקמה מוצלחת של מודל MIRI. התוצאות הראו כי פגיעה בשריר הלב בקבוצת ABF MIRI הייתה חמורה יותר בהשוואה לקבוצת הביקורת MIRI. לאחר הטיפול ב-Munziq, השינויים הפתולוגיים הוקלו באופן ניכר, ורמות האנזים בסרום ירדו משמעותית. באופן קולקטיבי, ממצאים אלה מדגימים את ההשפעות המגנות על הלב של Munziq במהלך MIRI.
במחקר זה, העורק היורד הקדמי השמאלי (LAD) נקשר למשך 30 דקות, ואחריו רפרפוזיה למשך 120 דקות כדי לבסס מודל פגיעה איסכמיה-רפרפוזיה בחולדות. מטא-אנליזה44 המסכמת 43 מחקרים ששימשו ליצירת מודלים של פגיעות איסכמיה-רפרפוזיה בחולדות הצביעה על כך שזמני האיסכמיה נעו בין 30 ל-60 דקות, עם משך רפרפוזיה של 30 עד 120 דקות. חלק מהמחקרים אימצו פרוטוקול של 5 דקות של איסכמיה ואחריו 5 דקות של רפרפוזיה, שחזרו על עצמם4x 45. בין השיטות הללו, נעשה שימוש בפרוטוקול הכולל 30 דקות של איסכמיה ו-120 דקות של רפרפוזיה בתדירות הגבוהה ביותר, שהופיע ב-19 מקרים. במהלך תהליך הניסוי, ראינו צבע חיוור של שריר הלב באמצעות בדיקה ויזואלית ישירה לאחר 30 דקות של איסכמיה. בנוסף להערכה חזותית של שינויים בצבע שריר הלב, נעשה שימוש בניטור אלקטרוקרדיוגרמה (ECG) כדי לזהות סימנים של איסכמיה, כגון עלייה במקטע ST. סמני סרום, כולל טרופונין וקריאטין קינאז, כמו גם פרמטרים המודינמיים כמו דופק (HR), לחץ דיאסטולי של החדר השמאלי (LVDP) ולחץ סיסטולי של החדר השמאלי (LVSP), יכולים כולם לשמש כאינדיקטורים להערכת היעילות של מודל איסכמיה46. במחקר זה, הסתמכנו בעיקר על תצפית חזותית כדי להעריך את ההשפעות של איסכמיה ורפרפוזיה. בשל הבדלים אינדיבידואליים בין חולדות, מומלץ להשלים בדיקה ויזואלית עם מדדים אובייקטיביים נוספים כדי להעריך את יעילות האיסכמיה במקום להחיל משך איסכמי אחיד על כל החולדות.
ביונקים, משפחת NF-κB מורכבת מחמישה פרטים, אחד מהם הוא p6513,47. ישנם שני מסלולים עיקריים להפעלת NF-κB בתאים47. במסלול הקנוני, הפעלת קומפלקס ה-IKK (IKKα, IKKβ ו-IKKγ) מובילה לזרחון של חלבוני IκB, ויוזמת הפעלת NF-κB. במסלול NF-κB הלא קנוני, הפעלת NF-κB מתווכת על ידי זרחון של NIK ו-IKKα. עדויות נרחבות מצביעות על כך שמסלול NF-κB ממלא תפקיד מכריע בתיווך איסכמיה ופגיעה ברפרפוזיה 48,49,50. הפרעה להפעלת NF-κB יכולה להחליש את הפגיעה הנגרמת על ידי איסכמיה ורפרפוזיה51,52. מעניין לציין שהייתה יותר הפעלה של מסלול האיתות NF-κB בקבוצת ABF MIRI ורמות גבוהות יותר של ציטוקינים דלקתיים במורד הזרם.
הוכח כי תרופות רבות ברפואה הסינית המסורתית מפעילות השפעות מגנות מפני איסכמיה ופגיעה ברפרפוזיה על ידי ויסות מסלול NF-κB. לדוגמה, Liu et al.53 מצאו כי קוורצטין ממתן את MIRI על ידי עיכוב מסלול NF-κB. Han et al.54 דיווחו כי הידרוקסיספפלור צהוב A הקל על MIRI על ידי עיכוב איתות TLR4/NF-κB. עם זאת, האם Munziq מפעיל תפקיד מגן ב-MIRI דרך מסלול האיתות NF-κB נותר לא נחקר. כדי להבהיר עוד יותר את המנגנון של Munziq, מחקר זה ניתח את רמות הביטוי של צמתים מרכזיים במסלול האיתות NF-κB, כולל NIK, IKKα, pIKKα ו-p65. התוצאות הראו כי רמות הביטוי של חלבונים אלה היו מווסתות באופן משמעותי לאחר הטיפול ב-Munziq, מה שמצביע על כך ש-Munziq מעכב את הביטוי של צמתים מרכזיים במסלול האיתות NF-κB במהלך MIRI.
ישנן עדויות נרחבות התומכות ברעיון שהפעלת NF-κB מעוררת ייצור של חלבונים דלקתיים ומולקולות הידבקות, וכתוצאה מכך גיוס לימפוציטים55. לדוגמה, Valen et al.56 גילו ש-NF-κB הופעל וכי רמות IL-1β ו-TNF-α היו גבוהות במהלך איסכמיה/רפרפוזיה של שריר הלב. יתר על כן, IL-6, ציטוקין פרו-דלקתי המווסת על ידי NF-κB, מציג ביטוי מוגבר במהלך רפרפוזיה57. בהתאם לממצאים אלה, תוצאות מחקר זה מראות כי Munziq מעכב באופן משמעותי את רמות הציטוקינים הפרו-דלקתיים (כולל IL-1β, IL-6 ו-TNF-α) בהקשר של איסכמיה של שריר הלב/פגיעה ברפרפוזיה (MIRI). מכאן ניתן להסיק כי Munziq מפעיל את השפעותיו המעכבות על ביטוי ציטוקינים פרו-דלקתיים באמצעות דיכוי מסלול האיתות NF-κB.
לסיכום, התוצאות מצביעות על כך ש-MIRI היה חמור יותר ב-ABF. ל-Munziq יש השפעות מגנות על הלב באיסכמיה ופציעות רפרפוזיה. אפקט מגן זה עשוי לפעול על ידי דיכוי מסלול האיתות NF-κB. ממצאים אלה מצביעים על כך שמונזיק טומן בחובו פוטנציאל רב כחומר טיפולי להגנה על הלב מפני פגיעות רפרפוזיה במהלך ניתוח לב.
ישנן מספר מגבלות של המחקר. ראשית, המחקר נערך במודל חולדות, שלמרות היותו מודל תרגומי בעל ערך, ייתכן שלא ישחזר באופן מלא את המורכבות של מצב לב וכלי דם אנושי. שנית, המחקר מתמקד בעיקר במסלול האיתות NF-κB כבסיס מכניסטי להשפעות מונזיק. עם זאת, MIRI הוא תהליך רב-גורמי שעשוי לכלול מסלולי איתות ומנגנונים מולקולריים שונים אחרים.
בעוד שהמחקר הנוכחי מספק תובנות חשובות לגבי ההשפעות הפוטנציאליות להגנה על הלב של Munziq במודל חולדה של פגיעה באיסכמיה-רפרפוזיה של שריר הלב (MIRI), במיוחד בהקשר של נוזל גוף לא תקין (ABF), ישנם מספר תחומים למחקר עתידי. דרך אחת למחקר נוסף היא לערוך מחקרי מבחנה באמצעות קרדיומיוציטים מתורבתים כדי לצפות ישירות בהשפעות של Munziq על תגובות תאיות לאיסכמיה ורפרפוזיה. בנוסף, אימוץ גישה מולטי-אומיקס יכול להציע מבט מקיף יותר על השינויים המולקולריים הקשורים לטיפול במונזיק, מה שעשוי לחשוף מסלולים ומנגנונים נוספים התורמים להשפעות ההגנה על הלב שלו. כדאי גם לבחון מינונים שונים של Munziq כדי לקבוע את המינון האופטימלי להגנה מקסימלית על הלב תוך מזעור תופעות הלוואי הפוטנציאליות. יש צורך במחקרים ארוכי טווח כדי להעריך את ההשפעות המתמשכות של Munziq על תפקוד הלב ולעקוב אחר תופעות לוואי אפשריות הקשורות לשימוש ממושך.
Disclosures
למחברים אין מה לחשוף.
תרומת המחבר:
Duolikun Mutailifu ביצע את הניסויים, Abudusaimi Aini כתב את הטיוטה הראשונית של כתב היד וניתח את הנתונים; אילי אייביבולה תרמה לרעיון ולעיצוב המחקר; ג'נג ליו ואבודוניבי מאימאיטיאילי השתתפו בתכנון המחקר; Abudunaibi Maimaitiaili סידר את קרנות הלימוד; וכל המחברים קראו ואישרו את כתב היד הסופי.
Acknowledgements
עבודה זו נתמכה על ידי הקרן הלאומית למדעי הטבע של סין [מספר מענק: 82060907] והתוכנית לטיפוח כישרונות רפואיים ובריאותיים ברמה גבוהה 'Tianshan Elite' [מענק מס'. TSYC202301B004].
Materials
| Name | Company | Catalog Number | Comments |
| ABI 7500 Real-time PCR | ABI, CA, USA | Used for performing qRT-PCR. | |
| Adult male Sprague-Dawley (SD) rat | Animal Experimental Center of Xinjiang Medical University | ||
| Anti-NF-kB p65, anti-NF-kB Inducing Kinase NIK, anti-IKK alpha, anti-IKK alpha (phospho T23), anti-β-actin | Abcam, CA, USA | Used for Western blot analysis targeting specific proteins. | |
| Anti-TTC11/FIS1 Antibody | abcam | ab71498 | Used for protein detection in Western Blot (WB) experiments. |
| BCA Protein Assay Kit | Tiangen Biotech Co., Ltd., Beijing, China | Used for determining protein concentration. | |
| beta-Actin Loading Control antibody Mouse Mab | Sino Biological | 100166-MM10 | Used for protein detection in Western Blot (WB) experiments. |
| ChemiScope 3300 Imaging System | Clinx Science Instruments, Shanghai, China | Used for scanning developed films from Western blot analysis. | |
| ELISA kit for CK-MB detection | Nanjing Jiancheng Bioengeering Institute(Nanjing, China) | Used for detecting levels of cardiac injury indexes | |
| ELISA kit for cTn-T, ICAM-1, IL-1β, IL-6, TNF-α detection | CUSABIO Biotech CO., Ltd. (Wuhan, China) | Used for detecting levels of cardiac injury indexes and inflammatory cytokines in rat serum samples. | |
| FastQuant RT Kit | TIANGEN, Beijing China | Used for reverse transcription of cDNA. | |
| HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG | Thermo Scientific, Basingstoke, UK | ||
| LDH Assay kit and MDA Assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting LDH and MDA levels in myocardium tissues from the infarct area in the left ventricle. | |
| Munziq | provided by Xinjiang Medical University | The main investigational drug in this study | |
| NF-κB p65 (D14E12) XP Rabbit mAb #8242 | CST | 8242S | Used for protein detection in Western Blot (WB) experiments. |
| Nitric Oxide (NO) assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting NO levels at 550 nm in myocardial tissue. | |
| Phospho-NF-κB p65 (Ser536) (93H1) Rabbit mAb #3033 | CST | 3033S | Used for protein detection in Western Blot (WB) experiments. |
| Quantity One software | Bio-Rad Laboratories, Hercules, CA, USA | Used for analyzing Western blot images. | |
| Recombinant Anti-DRP1 Antibody | abcam | ab184247 | Used for protein detection in Western Blot (WB) experiments. |
| RIPA lysis buffer | Boster Biotechnology Co., Ltd., Wuhan, China | AR0105 | Used for extracting total proteins from rat ventricular tissues. |
| Secondary antibodies (HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG) | Thermo Scientific, Basingstoke, UK | Used for detection following primary antibody incubation in Western blot analysis. | |
| SYBR Select Master Mix | ABI, CA, USA | Used in qRT-PCR analysis on ABI 7500 Real-time PCR instrument. | |
| transmission electron microscope | HitachiS-2400 Hitachi, Tokyo, Japan | Used to examine thin sections of ventricular tissues. | |
| Trizol reagent | Invitrogen Co., Carlsbad, California, USA | Used for RNA extraction from ventricular tissues. |
References
- Anderson, J. L., Campion, E. W., Morrow, D. A. Acute myocardial infarction. New Engl J Med. 376 (21), 2053-2064 (2017).
- Vos, T., et al. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet. 396 (10258), 1204-1222 (2020).
- Murphy, A., Goldberg, S. Mechanical complications of myocardial infarction. Am J Med. 135 (12), 1401-1409 (2022).
- Heusch, G. Myocardial ischemia/reperfusion: Translational pathophysiology of ischemic heart disease. Medicine. 5 (1), 10-31 (2024).
- Bhatt, D. L., Lopes, R. D., Harrington, R. A. Diagnosis and treatment of acute coronary syndromes. Jama. 327 (7), 662-675 (2022).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: A target for cardioprotection. Cardiovasc Res. 115 (7), 1143-1155 (2019).
- Gunata, M., Parlakpinar, H. A review of myocardial ischaemia/reperfusion injury: Pathophysiology, experimental models, biomarkers, genetics and pharmacological treatment. Cell Biochem Funct. 39 (2), 190-217 (2020).
- He, J., et al. Myocardial ischemia/reperfusion injury: Mechanisms of injury and implications for management (review). Exp Ther Med. 23 (6), 430 (2022).
- Xiang, M., et al. Role of oxidative stress in reperfusion following myocardial ischemia and its treatments. Oxid Med Cell Longevity. 2021, 1-23 (2021).
- Astudillo, A. M., Balboa, M. A., Balsinde, J. Compartmentalized regulation of lipid signaling in oxidative stress and inflammation: Plasmalogens, oxidized lipids and ferroptosis as new paradigms of bioactive lipid research. Prog Lipid Res. 89, 101207 (2023).
- Algoet, M., et al. Myocardial ischemia-reperfusion injury and the influence of inflammation. Trends Cardiovasc Med. 33 (6), 357-366 (2023).
- Zhang, F., et al. Β-cryptoxanthin alleviates myocardial ischaemia/reperfusion injury by inhibiting nf-κb-mediated inflammatory signalling in rats. Arch Physiol Biochem. 128 (4), 1128-1135 (2020).
- Guo, Q., et al. Nf-κb in biology and targeted therapy: New insights and translational implications. Signal Transduct Target Ther. 9 (1), 53 (2024).
- Mi, J., et al. Inhibition of heat shock protein family a member 8 attenuates spinal cord ischemia-reperfusion injury via astrocyte nf-κb/nlrp3 inflammasome pathway. J Neuroinflammation. 18 (1), 170 (2021).
- Zhang, L., Zhao, S., Wang, Y. Diannexin alleviates myocardial ischemia-reperfusion injury by orchestrating cardiomyocyte oxidative damage, macrophage polarization and fibrotic process by tlr4-nf-kb-mediated inactivation of nlrp3 inflammasome. Int Immunopharmacol. 130, 111668 (2024).
- Zhou, Y., et al. Qingchang mixture prevents the intestinal ischemia-reperfusion injury through tlr4/nf-kb pathway. Combinatorial Chem High Throughput Screen. 26 (1), 49-57 (2023).
- Ozturk, A., et al. The protective effects of trimetazidine against ovary ischemia-reperfusion injury via the tlr4/nf-kb signal pathway. J Biochem Mol Toxicol. 36 (8), e23114 (2022).
- Du, S., Deng, Y., Yuan, H., Sun, Y. Safflower yellow b protects brain against cerebral ischemia reperfusion injury through ampk/nf-kb pathway. Evid Based Compl Alt Med. 2019, 1-11 (2019).
- Dong, X., et al. Physcion protects rats against cerebral ischemia-reperfusion injury via inhibition of tlr4/nf-kb signaling pathway. Drug Design Dev Therapy. 15, 277-287 (2021).
- Hashmi, S., et al. Hydrogen sulphide treatment prevents renal ischemia-reperfusion injury by inhibiting the expression of icam-1 and nf-kb concentration in normotensive and hypertensive rats. Biomolecules. 11 (10), 1549 (2021).
- Gao, L., et al. Hic-5 deficiency attenuates hepatic ischemia reperfusion injury through tlr4/nf-κb signaling pathways. Life Sciences. 249, 117517 (2020).
- Xu, Z., et al. Cardioprotection of mab2g4/odn/lip on myocardial ischemia-reperfusion injury via inhibiting the nf-κb signaling pathway. Cardiovas Ther. 2023, 1-15 (2023).
- Xiao, G., et al. Cxcr1 and its downstream nf-κb inflammation signaling pathway as a key target of guanxinning injection for myocardial ischemia/reperfusion injury. Front Immunol. 13, 1007341 (2022).
- Jeddi, S., Gheibi, S., Kashfi, K., Carlström, M., Ghasemi, A. Dose-dependent effects of long-term administration of hydrogen sulfide on myocardial ischemia-reperfusion injury in male wistar rats: Modulation of rkip, nf-κb, and oxidative stress. Int J Mol Sci. 21 (4), 1415 (2020).
- Yao, Y., et al. Targeting camkii-δ9 ameliorates cardiac ischemia/reperfusion injury by inhibiting myocardial inflammation. Circ Res. 130 (6), 887-903 (2022).
- Zhuang, L., Zong, X., Yang, Q., Fan, Q., Tao, R. Interleukin-34-nf-κb signaling aggravates myocardial ischemic/reperfusion injury by facilitating macrophage recruitment and polarization. eBioMedicine. 95, 104744 (2023).
- Maimaitiaili, A., et al. Effects of different doses of savda munziq on myocardial ischemia-reperfusion injury in rats with abnormal savda syndrome. Genet Mol Res. 13 (3), 4729-4735 (2014).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Hao, Y., et al. Transition of the abnormal savda syndrome to the hepatic carcinoma shifted unfolded protein response to autophagy was partly reversed by savda munziq in a rat model. Biomed Pharmacother. 121, 109643 (2020).
- Maimaitiaili, A., Li, J., Aibibula, A., Abudureheman, M. Erratum: Inhibition of nuclear factor kappa b pathway protects myocardial ischemia/reperfusion injury in rats under treatment with fufang munziq granule (munziq). Am J Transl Res. 10 (11), 3876 (2018).
- Zhang, X., et al. Rosa rugosa flavonoids alleviate myocardial ischemia reperfusion injury in mice by suppressing jnk and p38 mapk. Microcirculation. 24 (7), (2017).
- Dong, P., Liu, K., Han, H. The role of nf-κb in myocardial ischemia/reperfusion injury. Curr Prot Peptide Sci. 23 (8), 535-547 (2022).
- Guo, X., et al. Differential integrative omic analysis for mechanism insights and biomarker discovery of abnormal savda syndrome and its unique munziq prescription. Sci Rep. 6, 27831 (2016).
- Awad, A. S. Role of at1 receptors in permeability of the blood-brain barrier in diabetic hypertensive rats. Vascul Pharmacol. 45 (3), 141-147 (2006).
- La, X., et al. Upregulation of pd-1 on cd4(+)cd25(+) t cells is associated with immunosuppression in liver of mice infected with echinococcus multilocularis. Int Immunopharmacol. 26 (2), 357-366 (2015).
- Wu, T., et al. Circulating small extracellular vesicle-encapsulated sema5a-it1 attenuates myocardial ischemia-reperfusion injury after cardiac surgery with cardiopulmonary bypass. Cell Mol Biol Lett. 27 (1), 95 (2022).
- Pinto, A., et al. The extracellular isoform of superoxide dismutase has a significant impact on cardiovascular ischaemia and reperfusion injury during cardiopulmonary bypass. Eur J Cardio-Thor Surg. 50 (6), 1035-1044 (2016).
- Sabe, S. A., Harris, D. D., Broadwin, M., Sellke, F. W. Cardioprotection in cardiovascular surgery. Basic Res Cardiol. 119 (4), 545-568 (2024).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Mamtimin, B., et al. An magnetic resonance-based plasma metabonomic investigation on abnormal savda in different complicated diseases. J Tradl Chinese Med. 34 (2), 166-172 (2014).
- Marin, W., Marin, D., Ao, X., Liu, Y. Mitochondria as a therapeutic target for cardiac ischemia-reperfusion injury (review). Int J Mol Med. 47 (2), 485-499 (2020).
- Novack, V., et al. Troponin criteria for myocardial infarction after percutaneous coronary intervention. Arch Intern Med. 172 (6), 502-508 (2012).
- Kemp, M., Donovan, J., Higham, H., Hooper, J. Biochemical markers of myocardial injury. Br J Anaesth. 93 (1), 63-73 (2004).
- Zhang, D. Z., Jia, M. Y., Wei, H. Y., Yao, M., Jiang, L. H. Systematic review and meta-analysis of the interventional effects of resveratrol in a rat model of myocardial ischemia-reperfusion injury. Front Pharmacol. 15, 1301502 (2024).
- Ta, F. X., Zhang, T., Zhu, C. M. Correlation between mir-21 and the protective effects of resveratrol against myocardial ischemia/reperfusion injury in rats. Chin. J. Arteriosclerosis. 21 (6), 493-496 (2013).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. Am J Physiol Heart Circ Physiol. 314 (4), H812-H838 (2018).
- Oeckinghaus, A., Hayden, M. S., Ghosh, S. Crosstalk in nf-kappab signaling pathways. Nat Immunol. 12 (8), 695-708 (2011).
- Van Der Heiden, K., Cuhlmann, S., Luong Le, A., Zakkar, M., Evans, M. Role of nuclear factor kappab in cardiovascular health and disease. Clin Sci. 118 (10), 593-605 (2010).
- Ha, T., et al. Toll-like receptors: New players in myocardial ischemia/reperfusion injury. Antioxid Redox Signal. 15 (7), 1875-1893 (2011).
- Pourrajab, F., Yazdi, M. B., Zarch, M. B., Zarch, M. B., Hekmatimoghaddam, S. Cross talk of the first-line defense tlrs with pi3k/akt pathway, in preconditioning therapeutic approach. Mol Cell Ther. 3, 4 (2015).
- Wang, Y. H., et al. Lumbrokinase attenuates myocardial ischemia-reperfusion injury by inhibiting tlr4 signaling. J Mol Cell Cardiol. 99, 113-122 (2016).
- Yu, H., et al. Gypenoside protects cardiomyocytes against ischemia-reperfusion injury via the inhibition of mitogen-activated protein kinase mediated nuclear factor kappa b pathway in vitro and in vivo. Front Pharmacol. 7, 148 (2016).
- Liu, X., et al. Peroxisome proliferator-activated receptor gamma (ppargamma) mediates the protective effect of quercetin against myocardial ischemia-reperfusion injury via suppressing the nf-kappab pathway. Am J Transl Res. 8 (12), 5169-5186 (2016).
- Han, D., et al. Hydroxysafflor yellow a alleviates myocardial ischemia/reperfusion in hyperlipidemic animals through the suppression of tlr4 signaling. Sci Rep. 6, 35319 (2016).
- Yang, Q., He, G. W., Underwood, M. J., Yu, C. M. Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury: Perspectives and implications for postischemic myocardial protection. Am J Transl Res. 8 (2), 765-777 (2016).
- Valen, G., Paulsson, G., Vaage, J. Induction of inflammatory mediators during reperfusion of the human heart. Ann Thorac Surg. 71 (1), 226-232 (2001).
- Saini, H. K., et al. Role of tumour necrosis factor-alpha and other cytokines in ischemia-reperfusion-induced injury in the heart. Exp Clin Cardiol. 10 (4), 213-222 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved