Research Article
Pflanzliches Munziq lindert myokardiale Ischämie-Reperfusionsschäden durch Hemmung von Entzündungen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In dieser Studie werden die kardioprotektiven Wirkungen von Munziq, einem traditionellen uigurischen Kräuterpräparat, auf die myokardiale Ischämie-Reperfusionsschädigung (MIRI) bei Ratten mit abnormaler Körperflüssigkeit untersucht. Mit umfassenden experimentellen Methoden zeigen wir das Potenzial von Munziq, MIRI durch Unterdrückung des NF-κB-Signalwegs zu schwächen.
Zusammenfassung
Das Ziel dieser Studie war es, die kardioprotektiven Wirkungen von Munziq auf abnormale Körperflüssigkeiten, myokardiale Ischämie-Reperfusionsschäden (MIRI) und den zugrunde liegenden Mechanismus zu untersuchen. Normale Ratten und Ratten mit abnormaler Körperflüssigkeit (ABF) wurden 21 Tage lang mit Munziq vorbehandelt. In der Folge wurden MIRI-Modelle etabliert. Histopathologische Veränderungen und Veränderungen der myokardialen Ultrastruktur wurden durch Hämatoxylin- und Eosin (HE)-Färbung und Transmissionselektronenmikroskopie beobachtet, um pathologische Manifestationen der Myokardverletzung zu beobachten. Die Serumspiegel von CK-MB, cTn-T und ICAM-1 wurden mittels Enzyme-Linked Immunosorbent Assay (ELISA) nachgewiesen, um Marker im Zusammenhang mit Myokardverletzungen zu beobachten. Die Spiegel von IL-1β, IL-6 und TNF-α im Serum und Myokardgewebe wurden ebenfalls mittels ELISA nachgewiesen, um die entzündungshemmende Wirkung zu beobachten. Die Expressionsniveaus der NF-κB-Signalweg-verwandten Proteine NIK, IKKα, Pikα und p65 wurden mittels Western-Blot-Analyse nachgewiesen. Die Ergebnisse zeigten, dass die Myokardschädigung in der ABF-MIRI-Gruppe im Vergleich zur Kontroll-MIRI-Gruppe schwerwiegender war. Die Munziq-Vorbehandlung hat das Potenzial, die durch Ischämie-Reperfusionsschäden induzierten pathologischen Veränderungen zu mildern und könnte die Herzfunktion schützen. Die Proteinspiegel des NF-κB-Signalwegs und der nachgeschalteten Effektoren IL-1β, IL-6 und TNF-α waren in der MIRI-Gruppe signifikant hochreguliert, während sie in der Munziq-Gruppe herunterreguliert waren. Interessanterweise gab es in der ABF-MIRI-Gruppe eine stärkere Aktivierung des NF-κB-Signalwegs und höhere Spiegel an nachgeschalteten inflammatorischen Zytokinen. Die Ergebnisse deuten darauf hin, dass MIRI bei ABF schwerwiegender war. Munziq hat kardioprotektive Wirkungen bei Ischämie und Reperfusionsschäden. Dieser Schutzeffekt kann durch die Unterdrückung des NF-κB-Signalwegs ausgelöst werden.
Einleitung
Myokardischämie ist eine Erkrankung, bei der das Myokard nicht ausreichend durchblutet wird, hauptsächlich verursacht durch Stenose oder Thrombose der Koronararterien1, was für Patienten zu tödlichen Ergebnissen führen kann 2,3. Da der Myokardstoffwechsel fast ausschließlich aerob ist und nur sehr begrenzte Glykogenspeicher enthält, ist es wichtig, die Blutversorgung umgehend wiederherzustellen, vor allem durch PCI oder intravenöse Thrombolyse. Während eine effektive myokardiale Reperfusion für die Verbesserung der Prognose des ischämischen Myokards von entscheidender Bedeutung ist, birgt sie auch das Risiko einer myokardialen Ischämie-Reperfusionsverletzung (MIRI)4,5,6. MIRI ist eine bedeutende Herausforderung, die sich auf die Wirksamkeit von myokardialen Reperfusionstherapien auswirkt7. Mehrere Faktoren und Mechanismen tragen zur Entwicklung von MIRI bei. In Endothelzellen induziert die Reperfusion beispielsweise eine Akkumulation von reaktiven Sauerstoffspezies (ROS) und eine Erschöpfung der Radikalfänger, was auf das Vorhandensein von oxidativem Stress hinweist 4,8. Dieser oxidative Stress kann in der Folge eine Entzündungsreaktion auslösen, die zu einer verstärkten Freisetzung von Entzündungsfaktoren, einer erhöhten Produktion von Adhäsionsmolekülen und der Rekrutierung von Leukozyten führt 9,10,11. Der nukleäre Faktor Kappa-Light-Chain-Enhancer of activated B cells (NF-κB) spielt eine entscheidende Rolle bei der Entzündungsreaktion während einer myokardialen Ischämie/Reperfusionsverletzung12. Die Familie der NF-κB-Transkriptionsfaktoren bei Säugetieren umfasst fünf Mitglieder: NF-κB1 (auch bekannt als p105/p50), NF-κB2 (auch bekannt als p100/p52), p65 (auch als RELA bezeichnet), RELB (das Homolog des viralen Onkogens V-Rel reticuloendotheliose) und c-REL13,14. Es wurde gezeigt, dass die Hemmung des NF-κB-Signalwegs Ischämie/Reperfusionsschäden in verschiedenen Geweben lindert, darunter das Myokard12,15, der Darm16, der Eierstock17, das Gehirn18,19, die Nieren20 unddie Leber 21. Insbesondere wurde der NF-κB-Signalweg als zentraler Mediator bei der myokardialen Reaktion auf Ischämie und Reperfusion ausführlich dokumentiert12,14, mögliche Mechanismen umfassen die Förderung von Entzündungsreaktionen, die Regulierung der Expression von Zelladhäsionsmolekülen, die Teilnahme an oxidativen Stressreaktionen und die Beeinflussung von Zelltod- und Überlebenswegen 12,20,22,23,24,25. Therapeutische Interventionen, die auf eine Abschwächung der NF-κB-Aktivierung abzielen, haben ein erhebliches Potenzial zur Linderung von MIRIgezeigt 23,26 .
Die uigurische Medizin, ein integraler Bestandteil der traditionellen chinesischen Medizin, basiert auf der Theorie der vier Säfte: Feuer, Luft, Wasser und Erde. Diese Säfte führen zu Körperflüssigkeiten wie Blut, Schleim, gelber Galle und schwarzer Galle27,28. Die Aufrechterhaltung der dynamischen Homöostase zwischen diesen vier Körperflüssigkeiten ist entscheidend für die allgemeine Gesundheit des menschlichen Körpers. Jedes Ungleichgewicht dieser Flüssigkeiten, die als unausgeglichene Körperflüssigkeiten bezeichnet werden, kann zum Ausbruch von Krankheiten führen. Unter den verschiedenen unausgeglichenen Körperflüssigkeiten ist die vorherrschende als abnormale Körperflüssigkeit (ABF) bekannt, die auch als abnormales Savda-Syndrom (ASS) bekannt ist27,28. Munziq, ein traditionelles uigurisches Arzneimittel, das von uigurischen Ärzten häufig angewendet wird, wird zur Behandlung von abnormalen Körperflüssigkeiten verschrieben. Es handelt sich um ein pflanzliches Arzneimittelpräparat, das zehn verschiedene Arzneimittelarten umfasst, wie in der Packungsbeilage angegeben, darunter Cordia dichotoma Forst. f., Anchusaitalica Retz., Glycyrrhiza uralensis Fisch., Adiantum capillusveneris L., Euphorbia humifusa Willd., Ziziphus jujuba Mill., Lavandula angustifolia Mill., Foeniculum vulgare Mill., Melissa officinalis L. und Alhagi pseudoalhagi Desv29. Munziq wurde im Jahr 2003 von der State Food and Drug Administration unter der Codenummer Z65020166 zugelassen. Zu seinen aktiven chemischen Bestandteilen gehören Messing, Phenole, organische Säuren, Aminosäuren, Saponin, Zucker und andere. Munziq zeigt mehrere Wirkungen, darunter antioxidative, entzündungshemmende, immunregulatorische, thrombozytenaggregationshemmende und antithrombotische Wirkungen 27,28,30.
Unsere früheren Studien haben gezeigt, dass Munziq-Medikamente die myokardiale Ischämie/Reperfusionsverletzung (MIRI) lindern können, obwohl die spezifischen Mechanismen unklar bleiben. Es wurde eine myokardiale protektive Wirkung von Munziq bei Ratten mit myokardialer Ischämie-Reperfusionsverletzung und abnormalem Savda-Syndrom gezeigt. Die Hemmung des nuklearen Faktor-Kappa-b-Signalwegs schützt vor myokardialer Ischämie/Reperfusionsschäden bei Ratten, die mit Fufang Munziq-Granulat (Munziq) behandelt werden 27,28,30. Es gibt jedoch nur begrenzte Forschungsarbeiten, die die Rolle und den Mechanismus von Munziq bei MIRI untersuchen.
Ziel dieser Studie ist es, die kardioprotektiven Wirkungen von Munziq auf die myokardiale Ischämie-Reperfusionsschädigung (MIRI) bei Ratten mit abnormaler Körperflüssigkeit (ABF) zu untersuchen und die zugrunde liegenden Mechanismen zu untersuchen, wobei der Schwerpunkt auf dem NF-κB-Signalweg liegt. Die in dieser Studie vorgeschlagene Hypothese ist, dass die Vorbehandlung mit Munziq die durch MIRI induzierten pathologischen Veränderungen abschwächen und die Herzfunktion schützen kann, möglicherweise durch Unterdrückung des NF-κB-Signalwegs und nachgeschalteter Entzündungsreaktionen. Die Hypothese wird durch die Etablierung von Scheinmodellen, Ischämie-Reperfusionsschäden (MIRI) und Ischämie-Reperfusionsschäden + Munziq sowohl in Kontroll- als auch in ABF-Gruppen getestet. Die Herzfunktion, entzündungsbezogene Indikatoren und Proteine, die mit dem NF-κB-Signalweg assoziiert sind, werden überwacht.
Protokoll
Ausgewachsene männliche Sprague-Dawley-Ratte (SD) mit einem Gewicht von 200-220 g wurde in Übereinstimmung mit den Richtlinien der National Institutes of Health für die Pflege und Verwendung von Labortieren verwendet. Tierversuchszentrum der Medizinischen Universität Xinjiang. Tiermodelle mit abnormaler Körperflüssigkeit (ABF) wurden vom Experimental Animal Center der Xinjiang Medical University zur Verfügung gestellt. Die Ratten wurden, wie zuvor beschrieben, in einer trocken-kalten Umgebung gehalten, was für die Etablierung des Modells der abnormalen Körperflüssigkeit (ABF) bei Ratten unerlässlich ist, gemäß der Theorie der traditionellen uigurischen Medizin und wie in früheren Studien gezeigt wurde29,33. Alle Tierversuche wurden nach den ethischen Richtlinien der Xinjiang Medical University und in Übereinstimmung mit den ANARRIVE-Richtlinien durchgeführt. Das Protokoll für Studien an Wirbeltieren (Ratten) wurde von der institutionellen Ethikkommission der Medizinischen Universität Xinjiang (IACUC-20200318-16) genehmigt.
1. Tiergruppenbildung, Arzneimittelverabreichung und Etablierung des MIRI-Modells
- Ordnen Sie Ratten nach dem Zufallsprinzip den folgenden sechs Gruppen zu: i) Kontroll-Scheingruppe, ii) Kontroll-MIRI-Gruppe, iii) ABF-Scheingruppe, iv) ABF-MIRI-Gruppe, v) Kontroll-MIRI + Munziq-Gruppe und vi) ABF MIRI + Munziq-Gruppe.
- Halten Sie die Ratten der ABF-Gruppe in einer kontrollierten Umgebung in Klimaboxen, die auf eine Temperatur von 6 °C ± 1 °C und eine relative Luftfeuchtigkeit von 25 % bis 32,8 % eingestellt sind. Geben Sie den Ratten normales Futter, gemischt mit kaltem Trockenfutter, nämlich Gersten- und Koriandersamen im Verhältnis 7:1,5:1,5, und wenden Sie diese Methode 21 Tage lang an, um das ABF-Modellzu etablieren 29,33.
- Verabreichen Sie der Munziq-Gruppe 21 Tage vor der MIRI-Operation 5 g/kg Munziq (5,0 g Munziq gelöst in 1 ml destilliertem Wasser) durch intragastrische Verabreichung, was dem Doppelten der wirksamen klinischen Dosis entspricht. Bei Nicht-ABF-Tieren, wie z. B. der Kontroll-Sham-, Kontroll-MIRI- und Kontroll-MIRI + Munziq-Gruppe, ist der Scheingruppe und der MIRI-Gruppe das gleiche Volumen normaler Kochsalzlösung zu verabreichen und der Munziq-Gruppe Munziq intragastrische Verabreichung zu verabreichen.
- Nach 21 Tagen Vorbehandlung etablieren Sie das MIRI-Modell.
- Führen Sie die Operation in einem speziellen Tieroperationssaal durch, der mit sterilen Materialien ausgestattet ist, um eine sterile Umgebung zu gewährleisten. Betäubung der Ratten mit einer intraperitonealen Injektion (IP) von Natrium-Pentobarbital (35 mg/kg); Beobachten Sie die Muskelentspannung, die Reaktionsfähigkeit auf äußere Reize sowie die Atemfrequenz und -tiefe, um die anästhetische Wirkung zu bewerten. Überwachen Sie diese Parameter während des gesamten Verfahrens alle 15 Minuten. Wenn Anzeichen einer unzureichenden Anästhesie auftreten (Muskelverspannungen, spürbare Reaktion auf Reize, erhöhte oder flache Atemfrequenz), verabreichen Sie eine zusätzliche Dosis von 20 mg/kg. Halten Sie die Narkose während des gesamten Eingriffs bis zur endgültigen Blutentnahme aufrecht. Halten Sie während des Eingriffs die Körpertemperatur der Ratte auf 37 °C mit einem Heizkissen und einer kontinuierlichen Überwachung über einen rektalen Temperaturfühler. Tragen Sie Tierarztsalbe auf die Augen auf, um Trockenheit während der Anästhesie zu verhindern.
- Führen Sie eine Tracheotomie für die beatmungsunterstützte Beatmung durch. Bevor Sie den Brustkorb öffnen, um das Herz freizulegen, waschen Sie die Operationsstelle mit Seifenwasser, rasieren Sie den Operationsbereich und reinigen Sie den Bereich mit antiseptischen Lösungen wie Chlorhexidin und Jod. Verwenden Sie für den Eingriff sterile Instrumente.
- Um den Brustkorb zu öffnen und das Herz freizulegen, verwenden Sie sterile standardmäßige thorakale chirurgische Instrumente wie Scheren, Pinzetten und Retraktoren. Öffne die Brustwand und lege das Herz frei. Identifizieren Sie die linke vordere absteigende Arterie (LAD) unter direkter Visualisierung. Es handelt sich um einen großen Ast der linken Koronararterie, der auf der Oberfläche des Herzens liegt. Verwenden Sie eine 6-0-Naht (4-5 cm) und ligieren Sie den LAD (links anterior absteigend) für 30 Minuten, um eine regionale Ischämie zu induzieren. Bestimmen Sie den effektiven LAD-Verschluss, indem Sie eine blasse Farbe im Myokard beobachten.
- Nach 30 Minuten Ligatur lösen Sie die Ligatur und führen Sie eine Reperfusion für 120 Minuten durch. Bestimmen Sie die Reperfusion des Myokards, wenn es sich zu einer hellroten Farbe erholt. Bei Ratten mit Scheinoperation ist das gleiche Verfahren durchzuführen, jedoch ohne Ligatur von LAD.
- Nach der Reperfusion blieben die Ratten unter Narkose, die durch Natrium-Pentobarbital (35 mg/kg, ip) induziert wurde34. Sobald sich die Ratten in tiefer Narkose befinden, entnehmen Sie 1-2 ml Blutproben aus der Bauchaorta mit einem Vakuum-Blutentnahmeröhrchen.
- Nach der Entnahme einer Blutprobe aus der Bauchaorta werden die Ratten noch unter tiefer Narkose durch Gebärmutterhalsdislokation eingeschläfert. Entnehmen Sie das Myokardgewebe aus dem Infarktbereich im linken Ventrikel mit einer sterilen Pinzette und einer Schere, wobei Sie darauf achten, nur das Gewebe zu entnehmen, das blass und beschädigt erscheint, was auf die Infarktregion hinweist. Legen Sie das gesammelte Gewebe zur weiteren Analyse in einen sterilen Behälter.
2. Probenentnahme
- Entnahme von Gewebeproben: Mit einer sterilen Schere und einer sterilen Klinge das Herz horizontal in zwei Hälften entlang des Mittelpunkts der linksventrikulären Längsachse, senkrecht zur Richtung des Herzens. Teilen Sie eine Hälfte des apikalen Teils in zwei Teile: Einen in 4%igem Paraformaldehyd für die morphologische Untersuchung bei Raumtemperatur oder 4 °C für 2-24 h und den anderen in Glutaraldehyd für die Elektronenmikroskopie bei 4 °C für 1-4 h aufbewahren.
- Teilen Sie den Basisteil des Herzens, einschließlich des ischämischen und des nicht-ischämischen Bereichs, in zwei Teile auf: Geben Sie einen Teil in ein Kryofläschchen, frieren Sie das Gewebe schnell in flüssigem Stickstoff ein und geben Sie es dann für molekularbiologische Tests in einen -80 °C Ultratiefkühlschrank. Verwenden Sie die andere frische Portion für den Nachweis des Gehalts an gewebereaktiven Sauerstoffspezies (ROS) und die Mitochondrienextraktion.
- Entnahme von Serumproben: Am Endpunkt des Experiments werden 1-2 ml venöses Blut aus der unteren Hohlvene entnommen, 10 Minuten lang bei 1000 x g zentrifugiert und das Serum nach der Trennung in einem -80 °C Ultratiefkühlschrank gelagert.
3. HE-Färbung und Betrachtung mit der Transmissionselektronenmikroskopie
- Es ist eine HE-Färbung (Hämatoxylin-Eosin-Färbung) am ventrikulären Myokard gemäß dem Routineverfahren35 durchzuführen. Fixieren Sie das Gewebe 24 h lang in 4% Paraformaldehyd. Betten Sie die Proben in Paraffin ein, schneiden Sie sie in 4 μm dicke Abschnitte und färben Sie sie mit der Hämatoxylin-Eosin-Färbemethode gemäß dem Protokoll. Wählen Sie nach dem Zufallsprinzip fünf Felder aus, um histopathologische Veränderungen unter dem Mikroskop zu beobachten.
- Verarbeiten Sie Myokardgewebe von Ratten, die in Formalin fixiert wurden, aus jeder Gruppe für HE-Färbeexperimente, indem Sie die folgenden Schritte ausführen.
- Legen Sie die Gewebeschnitte in einen 65 °C heißen Inkubator zum Backen für 1,5 bis 2 Personen.
- Tauchen Sie die Gewebeschnitte 10 min lang in Xylol, ersetzen Sie das Xylol und tauchen Sie erneut für weitere 10 min ein. Nacheinander jeweils 5 Minuten lang in wasserfreien Alkohol I und II tauchen, gefolgt von 95 %, 90 %, 80 % und 70 % Alkohol und destilliertem Wasser für jeweils 5 Minuten.
- 3 Min. mit Hämatoxylin färben. Führen Sie eine saure Differenzierung mit Salzsäure durch, die einige Sekunden lang (1-2 s) in Alkohol gegeben wird. Beenden Sie die Differenzierung in Leitungswasser für 5 min.
- Jeweils 3 Minuten lang in destilliertes Wasser, 70 %, 80 %, 90 % und 95 % Alkohol und jeweils 5 Minuten in wasserfreien Alkohol I und II tauchen.
- 1 min mit 0,5 % Eosin in Ethanol färben, die Abschnitte mit 95 % Ethanol abspülen, um überschüssige rote Farbe zu entfernen, dann 5 min in wasserfreies Ethanol tauchen. Jeweils 5 min in Xylol I und II eintauchen.
- Mit neutralem Balsam montieren. Beobachten Sie krankhafte Veränderungen des Gewebes unter dem Mikroskop.
4. ELISA-Nachweis von Blutzytokinen und Herzverletzungsindizes
- Entnahme einer Rattenserumprobe aus peripherem Blut durch Zentrifugieren bei 1000 x g für 10 min und Lagerung bei -80 °C. Ermitteln Sie den Spiegel von Herzverletzungsindizes wie CK-MB, cTn-T, ICAM-1 und inflammatorischen Zytokinen wie IL-1β, IL-6, TNF-α im Serum mit ELISA-Kits gemäß den Anweisungen des Herstellers und wie unten beschrieben.
- Lassen Sie alle Reagenzien mindestens 30 Minuten lang auf Raumtemperatur (18-25 °C) äquilibrieren, bereiten Sie die Reagenzien gemäß den Anweisungen des Herstellers vor und halten Sie sie gebrauchsbereit.
- Richten Sie Standard- und Probenvertiefungen ein, bei denen die Standardvertiefungen bekannte Konzentrationen von Standardlösungen enthalten, die im Assay-Kit enthalten sind. Diese werden verwendet, um während des Experiments eine Standardkurve zu erstellen, um die spezifische Analytkonzentration in den zu testenden Proben zu quantifizieren. Geben Sie 100 μl Standard- oder Probenmaterial in jede Vertiefung, mischen Sie vorsichtig durch Schütteln, decken Sie es mit einem Plattensiegel ab und inkubieren Sie es 2 Stunden lang bei 37 °C.
- Entsorgen Sie die Flüssigkeit, trocknen Sie sie durch Dekantieren und waschen Sie sie nicht. Geben Sie 100 μl Biotin-markierten Antikörper (vorverdünnt 1:100) in jede Vertiefung, decken Sie sie mit einer neuen Plattenversiegelung ab und inkubieren Sie sie 1 h lang bei 37 °C.
- Entsorgen Sie die Flüssigkeit aus den Vertiefungen, trocknen Sie sie durch Dekantieren und waschen Sie die Platte 3x. 2 Minuten pro Waschgang einweichen, 200 μl pro Vertiefung einweichen und durch Dekantieren trocknen.
- Geben Sie 100 μl Meerrettichperoxidase-markierte Streptavidin-Arbeitslösung in jede Vertiefung, decken Sie sie mit einer neuen Plattendichtung ab und inkubieren Sie sie 1 h lang bei 37 °C.
- Entsorgen Sie die Flüssigkeit aus den Vertiefungen, trocknen Sie sie durch Dekantieren und waschen Sie die Platte 5x. 2 Minuten pro Waschgang einweichen, 200 μl pro Vertiefung einweichen und durch Dekantieren trocknen.
- Geben Sie nacheinander 90 μl Substratlösung in jede Vertiefung und entwickeln Sie die Farbe im Dunkeln bei 37 °C für 15-30 Minuten.
- Geben Sie nacheinander 50 μl Stopplösung in jede Vertiefung, um die Reaktion zu beenden. Messen Sie innerhalb von 5 Minuten nach dem Stoppen der Reaktion die optische Dichte (OD-Werte) jeder Vertiefung nacheinander bei 450 nm mit einem Mikroplatten-Reader.
5. Messung des MDA-, NO- und LDH-Wertes
- Nach der Reperfusion wird Myokardgewebe (5 mm x 7 mm) aus dem Infarktbereich im linken Ventrikel entnommen. Weisen Sie LDH (Laktatdehydrogenase) und MDA (Malondialdehyd) mit dem LDH-Assay-Kit und dem MDA-Assay-Kit gemäß den Anweisungen des Herstellers nach. Nachweis von NO bei 550 nm mit dem Stickstoffmonoxid (NO)-Assay-Kit gemäß den Anweisungen des Herstellers.
6. Western-Blot-Analyse
- Extrahieren Sie Gesamtproteine aus ventrikulärem Gewebe von Ratten mit RIPA-Lyse. Bestimmen Sie die Proteinkonzentration mit dem BCA Protein Assay Kit.
- Um intrazelluläre Proteine zu konservieren und einen zellulären Abbau zu verhindern, tauchen Sie die Proben in flüssigen Stickstoff, um sie schnell einzufrieren. Anschließend werden die gefrorenen Proben entnommen und zu einem Pulver gemahlen, etwa 100 mg der Probe entnommen und in ein vorgekühltes 1,5-ml-Zentrifugenröhrchen gegeben. Geben Sie 400 μl RIPA-Lysepuffer hinzu (Ergänzung mit Proteaseinhibitoren und einem Breitband-Phosphatase-Hemmer), mischen Sie die Mischung gründlich und lassen Sie die Mischung 60 Minuten lang bei 4 °C stehen.
- Die Mischung bei 1000 x g für 15 min bei 4 °C zentrifugieren. Sammeln Sie den Überstand und messen Sie die Proteinkonzentration mit der BCA-Methode.
- Verdünnen Sie die BSA-Standards mit einem Verdünnungsmittel, das dem Puffersystem der Proben entspricht, gemäß Tabelle 1.
- Bereiten Sie die Reagenzien gemäß den Anweisungen des Herstellers vor. Basierend auf der Anzahl der Proben die Reagenzien A und B in einem Volumenverhältnis von 50:1 mischen, um eine ausreichende Menge BCA-Arbeitslösung herzustellen, und gründlich mischen. Bevor Sie die BCA-Arbeitslösung zubereiten, schütteln Sie Reagenz A, um es gut zu mischen.
- Nehmen Sie 20 μl frisch zubereitete BSA-Standardlösung und verdünnte Proben (10-fach verdünnt) aus Tabelle 1 und geben Sie sie in eine 96-Well-Platte.
- 200 μl BCA-Arbeitslösung in jede Vertiefung geben und gründlich mischen. Die Platte verschließen, 30 min bei 37 °C inkubieren, dann auf Raumtemperatur abkühlen lassen oder 2 min bei Raumtemperatur stellen.
- Messen Sie die Extinktion bei 562 nm mit einem Mikroplatten-Reader und berechnen Sie die Proteinkonzentration in den Proben auf Basis der Standardkurve.
- Den Proben eine angemessene Menge 5x SDS-PAGE-Ladepuffer (mit β-Mercaptoethanol) zugeben, 5 min bei 100 °C in kochendem Wasser erhitzen, um die Proteine vollständig zu denaturieren, 5 min bei 1.000 x g zentrifugieren und den Überstand zur Verwendung entnehmen.
- Die Formel in Tabelle 2 beschreibt die Herstellung von 15 %, 12 % und 8 % Trenngelen sowie einem 5 % igen Stapelgel. Bereiten Sie die Lösungen entsprechend vor. Geben Sie die Trenngellösung in einer Höhe von 2/3 in die Gelkassette, überziehen Sie sie mit destilliertem Wasser und lassen Sie sie 40 min bei Raumtemperatur stehen. Fügen Sie dann das Stapelgel hinzu, um die Kassette zu füllen, setzen Sie den Kamm ein und lassen Sie ihn 10 Minuten lang einwirken.
- Laden Sie 9 μl vorgefärbten Proteinmarker in jede Vertiefung und laden Sie 50 μg Probenprotein pro Vertiefung.
- Legen Sie eine konstante Spannung von 80 V an, bis das Bromphenolblau das Trenngel erreicht, dann legen Sie eine konstante Spannung von 100 V für 90 min an. Stoppen Sie die Elektrophorese, wenn das Bromphenolblau in den unteren Teil des Gels gewandert ist.
- Tauchen Sie die PVDF-Membran nach Abschluss von SDS-PAGE 10 s lang in Methanol, spülen Sie sie 1 Minute lang in destilliertem Wasser und weichen Sie dann das Polyacrylamidgel, das Filterpapier und die behandelte PVDF-Membran 10 Minuten lang in Transferpuffer ein.
- Montieren Sie das Transfersandwich mit der schwarzen Seite der Clips nach unten, gefolgt von einer Schwamm-Filter-Papier-Gel-PVDF-Membran-Filter-Papier-Schwamm-transparenter Seite der Clips. Setzen Sie die Clips in die Transferkassette ein und stellen Sie sicher, dass die schwarze Seite des Clips zur schwarzen Seite der Kassette und die weiße Seite zur roten Seite zeigt. Führen Sie die Übertragung bei einer konstanten Spannung von 100 V durch und verwenden Sie eine PVDF-Membran mit einer Übertragungszeit von 60 min.
- Waschen Sie die PVDF-Membran nach dem Transfer 3x für jeweils 5 min mit Wasser. Blockieren Sie die Membran 1 h lang mit einer Blockierungslösung mit 5 % fettfreier Trockenmilch und waschen Sie sie dann 3x für jeweils 5 min mit TBST.
- Der Primärantikörper wird gemäß den in Tabelle 3 aufgeführten Verdünnungsverhältnissen mit TBST verdünnt und über Nacht bei 4 °C inkubiert. Zu den primären Antikörpern gehören ein Anti-NF-κB p65-Antikörper, ein Anti-NF-κB-Antikörper mit induzierender Kinase (NIK), ein Anti-IKKα-Antikörper und ein Anti-β-Aktin-Antikörper.
- Spülen Sie die Membran 3x mit 1x TBST für jeweils 5 min aus. Den entsprechend verdünnten Sekundärantikörper (gemäß Tabelle 3) zugeben und 1 h bei Raumtemperatur inkubieren. Bei den Sekundärantikörpern handelt es sich um HRP-konjugiertes Ziegen-Anti-Maus-IgG und HRP-konjugiertes Ziegen-Anti-Kaninchen-IgG.
- Spülen Sie die Bahn nochmals mit 1x TBST 3x für je 5 min aus. Mischen Sie die Entwicklungslösungen A und B, geben Sie 2 mL zur Membran und detektieren und fotografieren Sie sie mit dem Mini-Chemilumineszenz-Instrument.
- Entwickeln Sie die Membran mit verbesserter Chemilumineszenz plus Reagenz. Scannen Sie den entwickelten Film mit dem Bildgebungssystem. Analysieren Sie die Western-Blot-Bilder mit einer Software. Verwenden Sie β-Aktin als Ladesteuerung. Berechnen Sie den relativen Proteingehalt basierend auf dem Grauwert von β-Aktin.
7. Real-time PCR-Analyse (qRT-PCR)
- Extraktion der Gesamt-RNA
- Bereiten Sie 0,1 % DEPC-Lösung und 70 % DEPC-behandelten Alkohol gemäß den Anweisungen des Herstellers vor. Behandeln Sie alle Größen von Mikrozentrifugenröhrchen und verschiedene Arten von Pipettenspitzen mit 0,1%iger DEPC-Lösung. Über Nacht einweichen, dann autoklavieren.
- Sammeln Sie Zellen in der logarithmischen Wachstumsphase mit gutem Wachstumsstatus. Entsorgen Sie das Kulturmedium aus dem Zellkulturkolben und waschen Sie die Zellen 2x mit Hanks Lösung. Fügen Sie 1 ml Trypsin pro 10 cm² Zellen hinzu, schütteln Sie vorsichtig, um die Zellen zu lösen, und verwenden Sie eine Pipette, um eine vollständige Ablösung zu gewährleisten. Inkubieren Sie 5 Minuten lang bei Raumtemperatur, um eine vollständige Lyse zu ermöglichen, und pipettieren Sie dann 7x-10x auf und ab, um die Zellen vollständig aufzubrechen. Übertragen Sie das Lysat in 1,5-ml-Röhrchen, zentrifugieren Sie es und lagern Sie den Überstand.
- Geben Sie ein gleiches Volumen Chloroform in den Überstand, mischen Sie gut und lassen Sie es 10 Minuten bei Raumtemperatur stehen. Zentrifugieren Sie bei 4 °C für 5 min bei 1.000 x g , um die Phasen zu trennen. Die obere wässrige Phase wird vorsichtig in ein neues Röhrchen überführt (bei der Extraktion von DNA und Proteinen ist die untere Phase beizubehalten und bei 4 °C zu lagern).
- Fügen Sie Isopropanol (0,5 mL pro 1 mL Trizol) hinzu, mischen Sie es gut und lassen Sie es 10 Minuten bei Raumtemperatur stehen. Bei 4 °C für 10 min bei 1.000 x g zentrifugieren, den Überstand vorsichtig entfernen und entsorgen.
- Das RNA-Pellet mit 75 % Ethanol waschen, 5 min bei 4 °C bei 8.000 x g zentrifugieren, den Überstand vorsichtig entfernen und das Pellet an der Luft trocknen oder vakuumtrocknen. Löse die RNA in 50 μl DEPC-Wasser auf, aliquot und lagere sie bei -70 °C oder fahre mit der reversen Transkription in cDNA fort.
- Reverse Transkription zu cDNA
- Führen Sie die reverse Transkription von cDNA mit einem Kit gemäß den Anweisungen des Herstellers durch.
- Quantitative Echtzeit-PCR
- Entwerfen Sie Primer auf Basis von Gensequenzen und überprüfen Sie diese mit BLAST auf der NCBI-Website. Bereiten Sie 10 μM Stammlösungen von Vorwärts- und Rückwärtsprimern für CK20 und β-Aktin vor. Tabelle 4 zeigt die Primersequenzen.
- Quantitative Echtzeit-PCR
- Geben Sie 1 μl cDNA, 10 μl 2x Mastermix, je 0,4 μl Forward- und Reverse-Primer und 8,2 μl RNase-freies Wasser in das Reaktionssystem.
- Führen Sie die PCR mit folgendem Programm durch: Anfängliche Denaturierung bei 95 °C für 2 Minuten, gefolgt von 40 Zyklen von 95 °C für 15 s und 60 °C für 1 min. Verwenden Sie β-Aktin als interne Kontrolle. Berechnen Sie den relativen Ausdruck mit der 2-ΔΔCt-Methode .
8. Statistische Auswertung
- Verwenden Sie eine kommerzielle Software für die statistische Analyse. Stellen Sie die Daten als Mittelwert ± Standardabweichung (Mittelwert ± SD) dar. Führen Sie eine unidirektionale ANOVA durch, um die Unterschiede zwischen verschiedenen Gruppen zu vergleichen. Definieren Sie eine signifikante Differenz als p < 0,05.
Ergebnisse
Munziq mildert die pathologischen Veränderungen, die durch Ischämie-Reperfusionsschäden hervorgerufen werden
Um die morphologischen Veränderungen im Myokardgewebe zu untersuchen, führten wir zunächst eine HE-Färbung durch. Wie bei der repräsentativen HE-Färbung in Abbildung 1 konnten wir eine granuläre Degeneration und eine vakuoläre Degeneration in bestimmten Myokardzellen der Scheingruppe beobachten. Darüber hinaus gab es ein begrenztes Vorhandensein von roten Blutkörperchen und Lymphozyteninfiltration unter den Myokardzellen. In regelmäßigen Abständen beobachteten wir eine Gefäßerweiterung und -stauung. Myokardgewebe aus der MIRI-Gruppe zeigten eine schwerere Beeinträchtigung und ausgeprägtere morphologische Veränderungen. Zu diesen Veränderungen gehörten ausgedehnte granuläre Degeneration, vakuoläre Degeneration, Infiltration roter Blutkörperchen und Lymphozyten, Gefäßerweiterung und Stauung. Die Schädigung des Myokardgewebes in der ABF-MIRI-Gruppe war schwerwiegender als in der Kontroll-MIRI-Gruppe. In beiden Munziq-Gruppen zeigten einige Myokardzellen jedoch eine leichte granuläre Degeneration und eine vakuoläre Degeneration. Das Vorhandensein von roten Blutkörperchen und Lymphozyteninfiltration, Gefäßerweiterung und Stauung waren selten. Darüber hinaus deuten die Ergebnisse darauf hin, dass Munziq bei ABF-MIRI-Ratten und Kontroll-MIRI-Ratten überlegene kardioprotektive Wirkungen aufweist. Zusammenfassend deuten diese Ergebnisse darauf hin, dass die Vorbehandlung mit Munziq das Potenzial hat, die durch Ischämie-Reperfusionsschäden im Herzen induzierten pathologischen Veränderungen zu mildern.
Munziq verbesserte die Störung von Mitochondrien und Herzmuskelfasern, die durch Ischämie-/Reperfusionsschäden induziert wurde
Um die protektive Rolle von Munziq bei MIRI-Verletzungen weiter zu verifizieren, untersuchten wir die mitochondriale Ultrastruktur und die Herzmuskelfasern mittels TEM. Wie in Abbildung 2 dargestellt, wiesen die Myokardzellen in der Scheingruppe eine intakte Struktur mit eng angeordneten Myofibrillen und ähnlicher Sarkomerlänge auf. Die Myofilamentstruktur erschien klar und leicht locker, während eine große Anzahl von Mitochondrien beobachtet wurde. Umgekehrt zeigte die MIRI-Gruppe pathologische Merkmale, die auf geschädigte Myokardzellen hinweisen, einschließlich Zellschwellung, unterschiedlicher Sarkomerlänge, unklarer und locker angeordneter Myofilamentstruktur. Es wurde festgestellt, dass es in der I/R-Gruppe im Vergleich zur Scheingruppe eine ausgedehnte Störung und Auflösung der Mitochondrien gab. Außerdem waren die Herzmuskelfasern unregelmäßig und als Reaktion auf I/R-Verletzungen gebrochen. Interessanterweise war der Schweregrad dieser Veränderungen in der ABF MIRI-Gruppe deutlich höher. Im Gegensatz dazu zeigten beide Gruppen, die mit Munziq behandelt wurden, gelinderte pathologische Merkmale, die mit geschädigten Myokardzellen verbunden waren. Die Schwellung der Myokardzellen war reduziert, und die Strukturen von Myofibrillen, Sarkomer, Myofilament und die Anzahl der Mitochondrien waren ähnlich wie in der Scheingruppe. Zusammengenommen deuteten diese Daten darauf hin, dass die Vorbehandlung mit Munziq die durch die I/R-Operation induzierte Störung der Mitochondrien und Herzmuskelfasern abschwächen könnte.
Myokardischämie-Reperfusionsverletzung verschlimmert bei ABF MIRI Ratte und Munziq vor der Behandlung schützten die Herzfunktion
Die Serumspiegel von cTn-T, CK-MB und ICAM-1 wurden mit Hilfe der ELISA-Methode nachgewiesen. Die Ergebnisse zeigten keine erkennbaren Unterschiede zwischen der Kontroll-Scheingruppe und der ABF-Scheingruppe. Es ist jedoch bemerkenswert, dass die ABF-MIRI-Gruppe im Vergleich zur Kontroll-MIRI-Gruppe signifikant erhöhte Spiegel von cTn-T (Abbildung 3A), CK-MB (Abbildung 3B) und ICAM-1 (Abbildung 3C) aufwies. Um die kardioprotektiven Wirkungen von Munziq zu beurteilen, wurden sowohl die Kontroll-MIRI-Ratten als auch die ABF-MIRI-Ratten einer Munziq-Vorbehandlung unterzogen. Wie in Abbildung 3 gezeigt, waren die Spiegel von cTn-T, CK-MB und ICAM-1 in der Munziq-Vorbehandlungsgruppe deutlich reduziert. Diese Ergebnisse deuten darauf hin, dass Munziq bei ABF MIRI-Ratten bemerkenswerte kardioprotektive Eigenschaften aufweist.
Um die Wirkung der Munziq-Vorbehandlung auf Ischämie-Reperfusions-induzierte oxidative Stressschäden bei ABF- und Kontrollratten zu untersuchen, wurden die Veränderungen von LDH, MDA und NO im Myokardgewebe gemessen. Wie in Abbildung 3D,F gezeigt, wies die ABF-MIRI-Gruppe im Vergleich zur Kontroll-MIRI-Gruppe signifikant erhöhte MDA-Spiegel und signifikant verringerte NO-Spiegel auf. Die Munziq-Vorbehandlung verringerte signifikant den Gehalt an LDH und MDA im ischämischen Myokard. Gleichzeitig erhöhte die Vorbehandlung mit Munziq den NO-Spiegel im Myokardgewebe weiter.
Die Vorbehandlung mit Munziq milderte die Entzündung des MIRI, indem sie die Produktion von proinflammatorischen Zytokinen behinderte
Proinflammatorische Zytokine spielen eine entscheidende Rolle bei der Vermittlung der angeborenen Immunantwort, und proinflammatorische Zytokine wurden während MIRI31 aktiviert. Um die entzündungshemmende Wirkung von Munziq weiter zu untersuchen, wurden sowohl die Kontroll-MIRI-Ratten als auch die ABF-MIRI-Ratten einer Munziq-Vorbehandlung unterzogen. Wir verwendeten die ELISA-Methode zur Messung der Serumspiegel von IL-1β, IL-6 und TNF-α und qRT-PCR-Analysen zur Bewertung der mRNA-Spiegel von IL-1β, IL-6 und TNF-α im Myokardgewebe. Die Ergebnisse zeigten keine signifikanten Unterschiede in diesen Zytokinspiegeln zwischen der Kontroll-Scheingruppe und der ABF-Scheingruppe. Die Spiegel von IL-1β, IL-6 und TNF-α waren in der ABF-MIRI-Gruppe im Vergleich zur Kontroll-MIRI-Gruppe signifikant hochreguliert. Insbesondere zeigte IL-1β einen signifikanten Anstieg sowohl auf mRNA- als auch auf Proteinebene, wobei ein statistisch signifikanter Unterschied beobachtet wurde. Während es keinen Unterschied im mRNA-Spiegel für IL-6 gab, wurde ein Unterschied auf Proteinebene festgestellt. In ähnlicher Weise zeigte TNF-α keine Variation der mRNA-Spiegel, sondern Unterschiede auf Proteinebene. Wie in Abbildung 4 dargestellt, waren die Spiegel von IL-1β, IL-6 und TNF-α in der Munziq-Vorbehandlungsgruppe deutlich erniedrigt.
Die Vorbehandlung mit Munziq milderte die Entzündung über den NF-κB-Signalweg
Die Produktion von Zytokinen ist in den meisten Stadien der Entzündungsreaktion eng mit der Aktivierung der NF-κB-Signalwege verbunden. NF-κB gilt als potenzielles therapeutisches Ziel für entzündliche Erkrankungen32. Um zu beurteilen, ob der NF-κB-Signalweg an der entzündungshemmenden Wirkung von Munziq beteiligt ist, führten wir zunächst eine Western-Blot-Analyse durch, um die Expressionsniveaus von Schlüsselkomponenten des NF-κB-Signalwegs zu messen, einschließlich NIK, IKKα, pIKKα und p6513. Wie in Abbildung 5 dargestellt, induzierten ischämische und Reperfusionsschäden eine bemerkenswerte Hochregulation von NIK, p-IKKα und p-p65 innerhalb der MIRI-Gruppe. Die Behandlung mit Munziq schwächte diese Hochregulierung effektiv ab. Die Ergebnisse deuten darauf hin, dass Munziq eine entscheidende Rolle bei der Anti-Inflammation spielt, indem es die Aktivierung des NF-κB-Signalwegs unterdrückt.
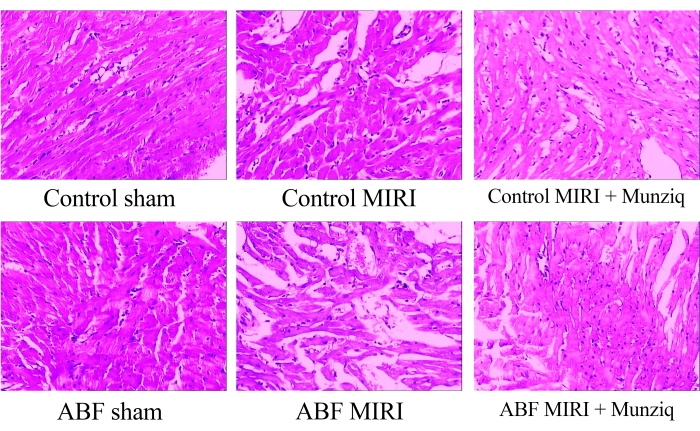
Abbildung 1: Morphologische Veränderungen des Myokardgewebes, die durch HE-Färbung beobachtet wurden. Repräsentative HE-Färbebilder verschiedener Gruppen. Vergrößerung: 100x. Abkürzungen: ABF = abnormale Körperflüssigkeit; MIRI = Myokardischämie-Reperfusionsverletzung; (n=6). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
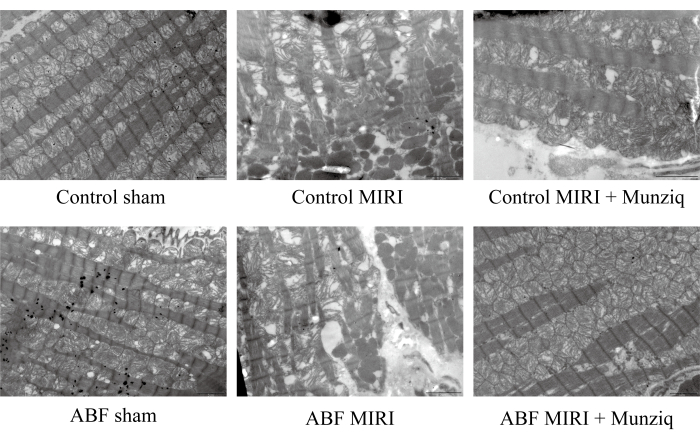
Abbildung 2: Munziq verbesserte die durch I/R-Verletzungen induzierte Störung von Mitochondrien und Herzmuskelfasern. Ein Rasterelektronenmikroskop wurde durchgeführt, um die Veränderungen der Ultrastruktur der Mitochondrien und der Herzmuskelfasern zu beobachten. Es wurden repräsentative Bilder gezeigt. Maßstab: 5 μm; (n=3). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
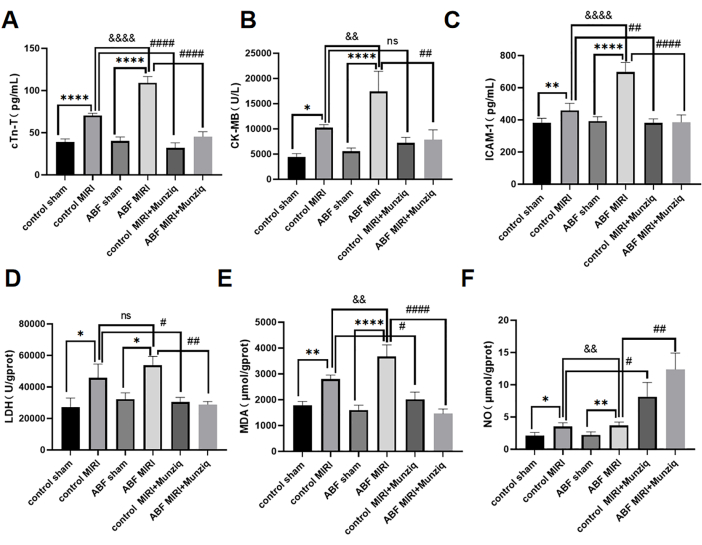
Abbildung 3: Myokardischämie-Reperfusionsschäden, die bei ABF-MIRI-Ratten verschlimmert wurden, und eine Munziq-Vorbehandlung konnten die Herzfunktion schützen. (A) Serum cTn-T, (B) CK-MB und (C) ICAM-1. Die Spiegel wurden mittels ELISA nachgewiesen, und die Veränderungen von LDH, MDA und NO wurden im Myokardgewebe gemessen (n = 6). *p<0,05, ** p<0,01, ***p<0,001, ****p<0,0001 Im Vergleich zur Scheingruppe; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 Im Vergleich zur MIRI-Gruppe; &p<0,05, && p<0,01, &&&p<0,001, &&&&p<0,0001 Im Vergleich zur Kontrollgruppe. Die Daten werden als mittlere ± SD dargestellt. Die statistische Analyse wurde mit Hilfe der unidirektionalen ANOVA durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
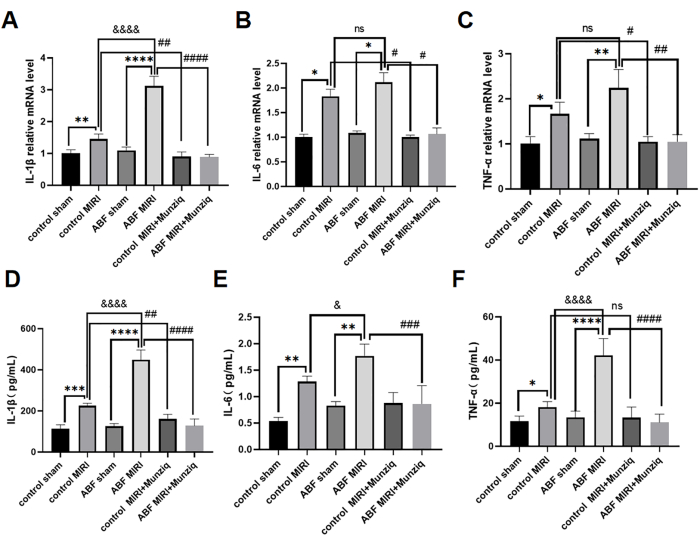
Abbildung 4: Die Vorbehandlung mit Munziq milderte die Entzündung des MIRI, indem sie die Produktion von proinflammatorischen Zytokinen verhinderte. Die qRT-PCR wies die mRNA-Spiegel von (A) IL-1β, (B) IL-6 und (C) TNF-α im Myokardgewebe nach. Messen Sie die (D) IL-1β-, (E) IL-6- und (F) TNF-α-Spiegel im Serum mittels ELISA (n = 6). *p<0,05, ** p<0,01, ***p<0,001, ****p<0,0001 Im Vergleich zur Scheingruppe; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 Im Vergleich zur MIRI-Gruppe; &p<0,05, && p<0,01, &&&p<0,001, &&&&p<0,0001 Im Vergleich zur Kontrollgruppe. Die Daten werden als mittlere ± SD dargestellt. Die statistische Analyse wurde mit Hilfe der unidirektionalen ANOVA durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
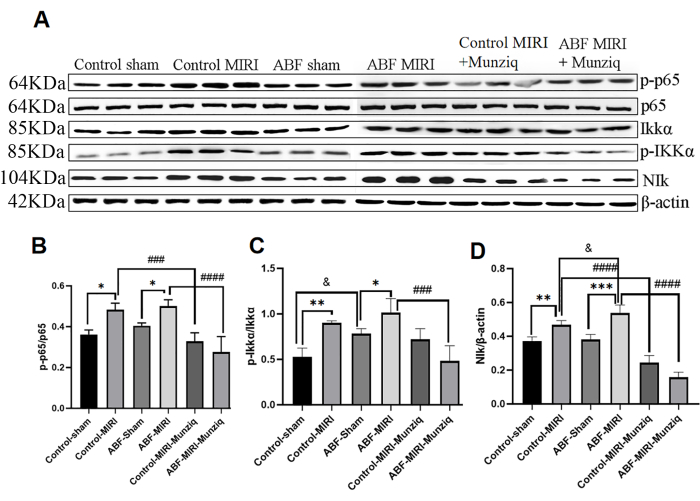
Abbildung 5: Die Vorbehandlung mit Munziq milderte die Entzündung über den NF-κB-Signalweg. Die Expression der Proteine p-IKKα, IKKα, p-p65, p65 und NIk im Myokardgewebe wurde mittels Western Blot nachgewiesen (N = 3 für jede Gruppe). (A) Die Proteinbanden, die in der Western-Blot-Analyse beobachtet wurden. (B-D) Die relative Ausdrucksebene wird basierend auf dem Grauwert bestimmt. *p<0,05, ** p<0,01, ***p<0,001, ****p<0,0001 Im Vergleich zur Scheingruppe; #p<0,05, ## p<0,01, ###p<0,001, ####p<0,0001 Im Vergleich zur MIRI-Gruppe; &p<0,05, && p<0,01, &&&p<0,001, &&&&p<0,0001 Im Vergleich zur Kontrollgruppe. Die Daten werden als mittlere ± SD dargestellt. Die statistische Analyse wurde mit Hilfe der unidirektionalen ANOVA durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Anzahl der Röhren | Volumen des Verdünnungsmittels (ml) | BSA-Band (Quelle) | Endgültige BSA-Konzentration (mg/ml) |
| Ein | 0 | 20 (Stammlösung) | 500 |
| B | 2 | 18 (Stammlösung) | 400 |
| C | 4 | 16 (Stammlösung) | 300 |
| D | 6 | 14 (Stammlösung) | 200 |
| E | 8 | 12 (Stammlösung) | 150 |
| F | 12 | 8 (Stammlösung) | 100 |
| G | 16 | 4 (Stammlösung) | 50 |
| H | 20 | 0 (Stammlösung) | 0 |
Tabelle 1: Vorbereitungstabelle für die BSA-Standardkonzentration.
| Trennende Gele | 15% Stapel-Gel | 12% Stapel-Gel | 8% Stapel-Gel | 5% Stapel-Gel | |
| Reagenzien | Volumen | Volumen | Volumen | Reagenzien | Volumen |
| Deionisiertes Wasser (mL) | 2.76 | 3.96 | 5.52 | Deionisiertes Wasser (mL) | 4 |
| 30% Acrylamid (ml) | 6 | 4.8 | 3.24 | 30% Acrylamid (ml) | 1 |
| 1,5 mol/lTris.HCl (PH8,8) (ml) | 3 | 3 | 3 | 1,0 M Tris.HCl (pH6,8; ml) | 1 |
| 10% SDS (μL) | 120 | 120 | 120 | 10% SDS (μL) | 80 |
| 10% AP (μL) | 120 | 120 | 120 | 10% AP (μL) | 60 |
| TEMED(μL) | 4.8 | 4.8 | 7.2 | TEMED(μL) | 8 |
| Gesamtvolumen (ml) | 12 | 12 | 12 | Gesamtvolumen (ml) | 6 |
Tabelle 2: Zubereitung der Gelkonzentration.
| Primärer Antikörper | Verdünnungsverhältnis | Sekundärer Antikörper | Verdünnungsverhältnis |
| β-Aktin | 1:1000 | Ziege Anti-Maus IgG H&L (HRP) | 1:15000 |
| Seite 65 | 1:1000 | Ziege Anti-Kaninchen IgG H&L (HRP) | 1:5000 |
| P-P65 | 1:300 | 1:5000 | |
| BCL-2 | 1:1000 | 1:5000 | |
| BAX | 1:1000 | 1:5000 | |
| Drp1 | 1:800 | 1:5000 | |
| Fis1 | 1:1000 | 1:5000 | |
| Mfn2 | 1:800 | 1:5000 |
Tabelle 3: Antikörper-Verdünnungsverhältnisse.
| Gen | Primer-Sequenz (5' bis 3') | ||
| IL-1β-F | CTGTGACTCGTGGGATGATG | ||
| IL-1β-R | GGGATTTTGTCGTTGCTTGT | ||
| TNF-α-F | GCCTCCTCTCTGCCATCAAG | ||
| TNF-α-R | CTCCAAAGTAGACCTGCCCG | ||
| IL-6-F | GCCCACCAGGAACGAAAGTC | ||
| IL-6-R | GGCAACTGGCTGGAAGTCTC | ||
| Beta-Aktin-F | CCCATCTATGAGGGTTACGC | ||
| beta Actin-R | TTTAATGTCACGCACGATTTC | ||
Tabelle 4: Primer-Sequenzen.
Diskussion
MIRI, was für Myokardischämie-Reperfusionsverletzung steht, ist eine häufige und signifikante Komplikation, die nach der myokardialen Reperfusion in der Herzchirurgie auftritt36,37, nur wenige Medikamente oder Adjuvantien haben die klinischen Ergebnisse im Vergleich zu gleichzeitigen Kontrollen definitiv verbessert38. Daher besteht ein dringender Bedarf an wirksamen Therapien, um das Herz vor solchen Verletzungen zu schützen. Munziq, ein traditionelles pflanzliches Präparat, hat bestimmte therapeutische Wirkungen auf Herzischämie-Reperfusionsschäden gezeigt 27,28,30. Diese Erkenntnisse sind jedoch vorläufig, und die zugrundeliegenden Mechanismen sind noch unbekannt. Ziel dieser Studie war es, die schützenden Wirkungen und Mechanismen von Munziq auf MIRI weiter zu untersuchen und zu validieren.
Abnorme Körperflüssigkeit wird nach der traditionellen uigurischen Medizin als häufige Manifestation verschiedener chronischer Krankheiten, einschließlich Herz-Kreislauf-Erkrankungen, bezeichnet39,40. Im uigurischen Medizinsystem wird angenommen, dass ABF eine Folge von langfristigem Stress ist und als Quelle verschiedener Krankheiten bezeichnetwird 39. In dieser Studie wurde ein abnormales Körperflüssigkeitsmodell verwendet, um die zugrunde liegenden Merkmale von Herz-Kreislauf-Erkrankungen zu simulieren, die eine Herzoperation erforderlich machen. MIRI wurde bei Ratten mit ABF induziert, um die myokardiale Ischämie-Reperfusionsverletzung zu bestimmen.
Die Ischämie-Reperfusionsverletzung ist eine komplexe pathologische Erkrankung, die mehrere Prozesse umfasst. Es wurde berichtet, dass Ischämie-Reperfusion im Herzen zu pathologischen Veränderungen des Myokards führt4. Diese pathologischen Veränderungen manifestieren sich in erster Linie als verkürzte Kardiomyozyten, gestörte sarkomerische Struktur, mitochondriale Schwellungen41 und locker angeordnete sarkomerische Myofibrillen, wie in dieser Studie beobachtet. Eine Myokardverletzung führt auch zu Veränderungen der Serumenzyme. Es ist allgemein bekannt, dass die Spiegel von cTnT, CK-MB und ICAM-1 im Serum nach einer Myokardschädigung ansteigen42,43. Daher werden diese Biomarker verwendet, um das Ausmaß einer akuten Myokardschädigung zu beurteilen. In dieser Studie beobachteten wir die pathologischen Veränderungen im Myokard und die Erhöhung der Serumenzyme nach Ischämie-Reperfusionsschäden, was auf die erfolgreiche Etablierung des MIRI-Modells hinweist. Die Ergebnisse zeigten, dass die Myokardschädigung in der ABF-MIRI-Gruppe im Vergleich zur Kontroll-MIRI-Gruppe schwerwiegender war. Nach der Behandlung mit Munziq wurden die pathologischen Veränderungen spürbar gelindert und die Serumenzymspiegel deutlich gesenkt. Zusammengenommen zeigen diese Ergebnisse die kardioprotektive Wirkung von Munziq während der MIRI.
In dieser Studie wurde die linke anteriore absteigende Arterie (LAD) für 30 Minuten ligiert, gefolgt von einer Reperfusion für 120 Minuten, um ein Ischämie-Reperfusions-Verletzungsmodell bei Ratten zu etablieren. Eine Meta-Analyse44 , die 43 Studien zusammenfasste, die zur Erstellung von Ischämie-Reperfusions-Verletzungsmodellen bei Ratten verwendet wurden, zeigte, dass die Ischämiezeiten zwischen 30 und 60 Minuten lagen, mit einer Reperfusionsdauer von 30 bis 120 Minuten. Einige Studien verwendeten ein Protokoll von 5 Minuten Ischämie, gefolgt von 5 Minuten Reperfusion, wiederholt 4x45. Unter diesen Methoden wurde ein Protokoll mit 30 min Ischämie und 120 min Reperfusion am häufigsten verwendet, das in 19 Fällen auftrat. Während des experimentellen Prozesses beobachteten wir eine blasse Färbung des Myokards durch direkte visuelle Inspektion nach 30 min Ischämie. Zusätzlich zur visuellen Beurteilung von Farbveränderungen des Myokards wurde die Überwachung des Elektrokardiogramms (EKG) eingesetzt, um Anzeichen einer Ischämie, wie z. B. eine ST-Strecken-Erhöhung, zu erkennen. Serummarker, einschließlich Troponin und Kreatinkinase, sowie hämodynamische Parameter wie Herzfrequenz (HR), linksventrikulärer diastolischer Druck (LVDP) und linksventrikulärer systolischer Druck (LVSP) können als Indikatoren zur Bewertung der Wirksamkeit des Ischämiemodells dienen46. In dieser Studie stützten wir uns hauptsächlich auf visuelle Beobachtung, um die Auswirkungen von Ischämie und Reperfusion zu beurteilen. Aufgrund der individuellen Unterschiede bei Ratten ist es ratsam, die visuelle Inspektion durch zusätzliche objektive Messungen zu ergänzen, um die Wirksamkeit der Ischämie zu beurteilen, anstatt bei allen Ratten eine einheitliche ischämische Dauer anzuwenden.
Bei den Säugetieren besteht die NF-κB-Familie aus fünf Mitgliedern, von denen eines p6513,47 ist. Es gibt zwei Hauptwege der Aktivierung von NF-κB in Zellen47. Im kanonischen Signalweg führt die Aktivierung des IKK-Komplexes (IKKα, IKKβ und IKKγ) zur Phosphorylierung von IκB-Proteinen, wodurch die NF-κB-Aktivierung eingeleitet wird. Im nicht-kanonischen NF-κB-Signalweg wird die NF-κB-Aktivierung durch die Phosphorylierung von NIK und IKKα vermittelt. Umfangreiche Hinweise deuten darauf hin, dass der NF-κB-Signalweg eine entscheidende Rolle bei der Vermittlung von Ischämie und Reperfusionsschäden spielt 48,49,50. Eine Störung der NF-κB-Aktivierung kann die durch Ischämie und Reperfusion induzierte Schädigung abschwächen51,52. Interessanterweise gab es in der ABF-MIRI-Gruppe eine stärkere Aktivierung des NF-κB-Signalwegs und höhere Spiegel an nachgeschalteten inflammatorischen Zytokinen.
Zahlreiche Medikamente der traditionellen chinesischen Medizin haben gezeigt, dass sie eine schützende Wirkung gegen Ischämie und Reperfusionsschäden ausüben, indem sie den NF-κB-Signalweg modulieren. Zum Beispiel fanden Liu et al.53 heraus, dass Quercetin die MIRI abschwächte, indem es den NF-κB-Signalweg hemmte. Han et al.54 berichteten, dass Hydroxysafflorgelb A MIRI durch Hemmung der TLR4/NF-κB-Signalgebung linderte. Ob Munziq über den NF-κB-Signalweg eine schützende Rolle bei MIRI ausübt, bleibt jedoch unerforscht. Um den Mechanismus von Munziq weiter aufzuklären, analysierte diese Studie die Expressionsniveaus von Schlüsselknoten im NF-κB-Signalweg, einschließlich NIK, IKKα, pIKKα und p65. Die Ergebnisse zeigten, dass die Expressionsniveaus dieser Proteine nach der Behandlung mit Munziq signifikant herunterreguliert waren, was darauf hindeutet, dass Munziq die Expression von Schlüsselknoten im NF-κB-Signalweg während der MIRI hemmt.
Es gibt umfangreiche Belege dafür, dass die Aktivierung von NF-κB die Produktion von Entzündungsproteinen und Adhäsionsmolekülen auslöst, was zur Rekrutierung von Lymphozyten führt55. Zum Beispiel entdeckten Valen et al.56 , dass NF-κB aktiviert wurde und dass die Spiegel von IL-1β und TNF-α während der myokardialen Ischämie/Reperfusion erhöht waren. Darüber hinaus zeigt IL-6, ein proinflammatorisches Zytokin, das durch NF-κB reguliert wird, eine erhöhte Expression während der Reperfusion57. In Übereinstimmung mit diesen Ergebnissen zeigen die Ergebnisse dieser Studie, dass Munziq die Spiegel von proinflammatorischen Zytokinen (einschließlich IL-1β, IL-6 und TNF-α) im Rahmen von myokardialer Ischämie/Reperfusionsverletzung (MIRI) signifikant hemmt. Daraus lässt sich ableiten, dass Munziq seine hemmende Wirkung auf die Expression von proinflammatorischen Zytokinen durch die Unterdrückung des NF-κB-Signalwegs ausübt.
Zusammenfassend deuten die Ergebnisse darauf hin, dass MIRI bei ABF schwerwiegender war. Munziq hat kardioprotektive Wirkungen bei Ischämie und Reperfusionsschäden. Dieser Schutzeffekt kann durch die Unterdrückung des NF-κB-Signalwegs ausgelöst werden. Diese Ergebnisse deuten darauf hin, dass Munziq ein großes Potenzial als Therapeutikum zum Schutz des Herzens vor Reperfusionsschäden bei Herzoperationen birgt.
Es gibt mehrere Einschränkungen der Studie. Erstens wird die Studie in einem Rattenmodell durchgeführt, das, obwohl es sich um ein wertvolles translationales Modell handelt, die Komplexität des menschlichen Herz-Kreislauf-Zustands möglicherweise nicht vollständig repliziert. Zweitens konzentriert sich die Studie in erster Linie auf den NF-κB-Signalweg als mechanistische Grundlage für die Wirkung von Munziq. MIRI ist jedoch ein multifaktorieller Prozess, an dem verschiedene andere Signalwege und molekulare Mechanismen beteiligt sein können.
Während die aktuelle Studie wertvolle Einblicke in die potenziellen kardioprotektiven Wirkungen von Munziq in einem Rattenmodell für myokardiale Ischämie-Reperfusionsschäden (MIRI) liefert, insbesondere im Zusammenhang mit abnormaler Körperflüssigkeit (ABF), gibt es mehrere Bereiche für zukünftige Untersuchungen. Ein Weg für weitere Forschung ist die Durchführung von In-vitro-Studien mit kultivierten Kardiomyozyten, um die Auswirkungen von Munziq auf zelluläre Reaktionen auf Ischämie und Reperfusion direkt zu beobachten. Darüber hinaus könnte die Einführung eines Multi-Omics-Ansatzes einen umfassenderen Überblick über die molekularen Veränderungen bieten, die mit der Munziq-Behandlung verbunden sind, und möglicherweise zusätzliche Wege und Mechanismen aufdecken, die zu ihrer kardioprotektiven Wirkung beitragen. Es wäre auch von Vorteil, verschiedene Dosen von Munziq zu untersuchen, um die optimale Dosierung für eine maximale Kardioprotektion zu ermitteln und gleichzeitig mögliche Nebenwirkungen zu minimieren. Langzeitstudien sind notwendig, um die anhaltenden Auswirkungen von Munziq auf die Herzfunktion zu beurteilen und mögliche Nebenwirkungen im Zusammenhang mit längerer Anwendung zu überwachen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
BEITRAG DES AUTORS:
Duolikun Mutailifu führte die Experimente durch, Abudusaimi Aini schrieb den ersten Entwurf des Manuskripts und analysierte die Daten; Aili Aibibula trug zur Konzeption und Gestaltung der Studie bei; Zheng Liu und Abudunaibi Maimaitiaili waren an der Konzeption der Studie beteiligt; Abudunaibi Maimaitiaili organisierte die Studiengelder; und alle Autoren haben das endgültige Manuskript gelesen und genehmigt.
Danksagungen
Diese Arbeit wurde unterstützt von der National Natural Science Foundation of China [Fördernummer: 82060907] und dem "Tianshan Elite" High-Level Medical and Health Talent Cultivation Program [Förder-Nr. TSYC202301B004].
Materialien
| Name | Company | Catalog Number | Comments |
| ABI 7500 Real-time PCR | ABI, CA, USA | Used for performing qRT-PCR. | |
| Adult male Sprague-Dawley (SD) rat | Animal Experimental Center of Xinjiang Medical University | ||
| Anti-NF-kB p65, anti-NF-kB Inducing Kinase NIK, anti-IKK alpha, anti-IKK alpha (phospho T23), anti-β-actin | Abcam, CA, USA | Used for Western blot analysis targeting specific proteins. | |
| Anti-TTC11/FIS1 Antibody | abcam | ab71498 | Used for protein detection in Western Blot (WB) experiments. |
| BCA Protein Assay Kit | Tiangen Biotech Co., Ltd., Beijing, China | Used for determining protein concentration. | |
| beta-Actin Loading Control antibody Mouse Mab | Sino Biological | 100166-MM10 | Used for protein detection in Western Blot (WB) experiments. |
| ChemiScope 3300 Imaging System | Clinx Science Instruments, Shanghai, China | Used for scanning developed films from Western blot analysis. | |
| ELISA kit for CK-MB detection | Nanjing Jiancheng Bioengeering Institute(Nanjing, China) | Used for detecting levels of cardiac injury indexes | |
| ELISA kit for cTn-T, ICAM-1, IL-1β, IL-6, TNF-α detection | CUSABIO Biotech CO., Ltd. (Wuhan, China) | Used for detecting levels of cardiac injury indexes and inflammatory cytokines in rat serum samples. | |
| FastQuant RT Kit | TIANGEN, Beijing China | Used for reverse transcription of cDNA. | |
| HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG | Thermo Scientific, Basingstoke, UK | ||
| LDH Assay kit and MDA Assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting LDH and MDA levels in myocardium tissues from the infarct area in the left ventricle. | |
| Munziq | provided by Xinjiang Medical University | The main investigational drug in this study | |
| NF-κB p65 (D14E12) XP Rabbit mAb #8242 | CST | 8242S | Used for protein detection in Western Blot (WB) experiments. |
| Nitric Oxide (NO) assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting NO levels at 550 nm in myocardial tissue. | |
| Phospho-NF-κB p65 (Ser536) (93H1) Rabbit mAb #3033 | CST | 3033S | Used for protein detection in Western Blot (WB) experiments. |
| Quantity One software | Bio-Rad Laboratories, Hercules, CA, USA | Used for analyzing Western blot images. | |
| Recombinant Anti-DRP1 Antibody | abcam | ab184247 | Used for protein detection in Western Blot (WB) experiments. |
| RIPA lysis buffer | Boster Biotechnology Co., Ltd., Wuhan, China | AR0105 | Used for extracting total proteins from rat ventricular tissues. |
| Secondary antibodies (HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG) | Thermo Scientific, Basingstoke, UK | Used for detection following primary antibody incubation in Western blot analysis. | |
| SYBR Select Master Mix | ABI, CA, USA | Used in qRT-PCR analysis on ABI 7500 Real-time PCR instrument. | |
| transmission electron microscope | HitachiS-2400 Hitachi, Tokyo, Japan | Used to examine thin sections of ventricular tissues. | |
| Trizol reagent | Invitrogen Co., Carlsbad, California, USA | Used for RNA extraction from ventricular tissues. |
Referenzen
- Anderson, J. L., Campion, E. W., Morrow, D. A. Acute myocardial infarction. New Engl J Med. 376 (21), 2053-2064 (2017).
- Vos, T., et al. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet. 396 (10258), 1204-1222 (2020).
- Murphy, A., Goldberg, S. Mechanical complications of myocardial infarction. Am J Med. 135 (12), 1401-1409 (2022).
- Heusch, G. Myocardial ischemia/reperfusion: Translational pathophysiology of ischemic heart disease. Medicine. 5 (1), 10-31 (2024).
- Bhatt, D. L., Lopes, R. D., Harrington, R. A. Diagnosis and treatment of acute coronary syndromes. Jama. 327 (7), 662-675 (2022).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: A target for cardioprotection. Cardiovasc Res. 115 (7), 1143-1155 (2019).
- Gunata, M., Parlakpinar, H. A review of myocardial ischaemia/reperfusion injury: Pathophysiology, experimental models, biomarkers, genetics and pharmacological treatment. Cell Biochem Funct. 39 (2), 190-217 (2020).
- He, J., et al. Myocardial ischemia/reperfusion injury: Mechanisms of injury and implications for management (review). Exp Ther Med. 23 (6), 430 (2022).
- Xiang, M., et al. Role of oxidative stress in reperfusion following myocardial ischemia and its treatments. Oxid Med Cell Longevity. 2021, 1-23 (2021).
- Astudillo, A. M., Balboa, M. A., Balsinde, J. Compartmentalized regulation of lipid signaling in oxidative stress and inflammation: Plasmalogens, oxidized lipids and ferroptosis as new paradigms of bioactive lipid research. Prog Lipid Res. 89, 101207 (2023).
- Algoet, M., et al. Myocardial ischemia-reperfusion injury and the influence of inflammation. Trends Cardiovasc Med. 33 (6), 357-366 (2023).
- Zhang, F., et al. Β-cryptoxanthin alleviates myocardial ischaemia/reperfusion injury by inhibiting nf-κb-mediated inflammatory signalling in rats. Arch Physiol Biochem. 128 (4), 1128-1135 (2020).
- Guo, Q., et al. Nf-κb in biology and targeted therapy: New insights and translational implications. Signal Transduct Target Ther. 9 (1), 53 (2024).
- Mi, J., et al. Inhibition of heat shock protein family a member 8 attenuates spinal cord ischemia-reperfusion injury via astrocyte nf-κb/nlrp3 inflammasome pathway. J Neuroinflammation. 18 (1), 170 (2021).
- Zhang, L., Zhao, S., Wang, Y. Diannexin alleviates myocardial ischemia-reperfusion injury by orchestrating cardiomyocyte oxidative damage, macrophage polarization and fibrotic process by tlr4-nf-kb-mediated inactivation of nlrp3 inflammasome. Int Immunopharmacol. 130, 111668 (2024).
- Zhou, Y., et al. Qingchang mixture prevents the intestinal ischemia-reperfusion injury through tlr4/nf-kb pathway. Combinatorial Chem High Throughput Screen. 26 (1), 49-57 (2023).
- Ozturk, A., et al. The protective effects of trimetazidine against ovary ischemia-reperfusion injury via the tlr4/nf-kb signal pathway. J Biochem Mol Toxicol. 36 (8), e23114 (2022).
- Du, S., Deng, Y., Yuan, H., Sun, Y. Safflower yellow b protects brain against cerebral ischemia reperfusion injury through ampk/nf-kb pathway. Evid Based Compl Alt Med. 2019, 1-11 (2019).
- Dong, X., et al. Physcion protects rats against cerebral ischemia-reperfusion injury via inhibition of tlr4/nf-kb signaling pathway. Drug Design Dev Therapy. 15, 277-287 (2021).
- Hashmi, S., et al. Hydrogen sulphide treatment prevents renal ischemia-reperfusion injury by inhibiting the expression of icam-1 and nf-kb concentration in normotensive and hypertensive rats. Biomolecules. 11 (10), 1549 (2021).
- Gao, L., et al. Hic-5 deficiency attenuates hepatic ischemia reperfusion injury through tlr4/nf-κb signaling pathways. Life Sciences. 249, 117517 (2020).
- Xu, Z., et al. Cardioprotection of mab2g4/odn/lip on myocardial ischemia-reperfusion injury via inhibiting the nf-κb signaling pathway. Cardiovas Ther. 2023, 1-15 (2023).
- Xiao, G., et al. Cxcr1 and its downstream nf-κb inflammation signaling pathway as a key target of guanxinning injection for myocardial ischemia/reperfusion injury. Front Immunol. 13, 1007341 (2022).
- Jeddi, S., Gheibi, S., Kashfi, K., Carlström, M., Ghasemi, A. Dose-dependent effects of long-term administration of hydrogen sulfide on myocardial ischemia-reperfusion injury in male wistar rats: Modulation of rkip, nf-κb, and oxidative stress. Int J Mol Sci. 21 (4), 1415 (2020).
- Yao, Y., et al. Targeting camkii-δ9 ameliorates cardiac ischemia/reperfusion injury by inhibiting myocardial inflammation. Circ Res. 130 (6), 887-903 (2022).
- Zhuang, L., Zong, X., Yang, Q., Fan, Q., Tao, R. Interleukin-34-nf-κb signaling aggravates myocardial ischemic/reperfusion injury by facilitating macrophage recruitment and polarization. eBioMedicine. 95, 104744 (2023).
- Maimaitiaili, A., et al. Effects of different doses of savda munziq on myocardial ischemia-reperfusion injury in rats with abnormal savda syndrome. Genet Mol Res. 13 (3), 4729-4735 (2014).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Hao, Y., et al. Transition of the abnormal savda syndrome to the hepatic carcinoma shifted unfolded protein response to autophagy was partly reversed by savda munziq in a rat model. Biomed Pharmacother. 121, 109643 (2020).
- Maimaitiaili, A., Li, J., Aibibula, A., Abudureheman, M. Erratum: Inhibition of nuclear factor kappa b pathway protects myocardial ischemia/reperfusion injury in rats under treatment with fufang munziq granule (munziq). Am J Transl Res. 10 (11), 3876 (2018).
- Zhang, X., et al. Rosa rugosa flavonoids alleviate myocardial ischemia reperfusion injury in mice by suppressing jnk and p38 mapk. Microcirculation. 24 (7), (2017).
- Dong, P., Liu, K., Han, H. The role of nf-κb in myocardial ischemia/reperfusion injury. Curr Prot Peptide Sci. 23 (8), 535-547 (2022).
- Guo, X., et al. Differential integrative omic analysis for mechanism insights and biomarker discovery of abnormal savda syndrome and its unique munziq prescription. Sci Rep. 6, 27831 (2016).
- Awad, A. S. Role of at1 receptors in permeability of the blood-brain barrier in diabetic hypertensive rats. Vascul Pharmacol. 45 (3), 141-147 (2006).
- La, X., et al. Upregulation of pd-1 on cd4(+)cd25(+) t cells is associated with immunosuppression in liver of mice infected with echinococcus multilocularis. Int Immunopharmacol. 26 (2), 357-366 (2015).
- Wu, T., et al. Circulating small extracellular vesicle-encapsulated sema5a-it1 attenuates myocardial ischemia-reperfusion injury after cardiac surgery with cardiopulmonary bypass. Cell Mol Biol Lett. 27 (1), 95 (2022).
- Pinto, A., et al. The extracellular isoform of superoxide dismutase has a significant impact on cardiovascular ischaemia and reperfusion injury during cardiopulmonary bypass. Eur J Cardio-Thor Surg. 50 (6), 1035-1044 (2016).
- Sabe, S. A., Harris, D. D., Broadwin, M., Sellke, F. W. Cardioprotection in cardiovascular surgery. Basic Res Cardiol. 119 (4), 545-568 (2024).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Mamtimin, B., et al. An magnetic resonance-based plasma metabonomic investigation on abnormal savda in different complicated diseases. J Tradl Chinese Med. 34 (2), 166-172 (2014).
- Marin, W., Marin, D., Ao, X., Liu, Y. Mitochondria as a therapeutic target for cardiac ischemia-reperfusion injury (review). Int J Mol Med. 47 (2), 485-499 (2020).
- Novack, V., et al. Troponin criteria for myocardial infarction after percutaneous coronary intervention. Arch Intern Med. 172 (6), 502-508 (2012).
- Kemp, M., Donovan, J., Higham, H., Hooper, J. Biochemical markers of myocardial injury. Br J Anaesth. 93 (1), 63-73 (2004).
- Zhang, D. Z., Jia, M. Y., Wei, H. Y., Yao, M., Jiang, L. H. Systematic review and meta-analysis of the interventional effects of resveratrol in a rat model of myocardial ischemia-reperfusion injury. Front Pharmacol. 15, 1301502 (2024).
- Ta, F. X., Zhang, T., Zhu, C. M. Correlation between mir-21 and the protective effects of resveratrol against myocardial ischemia/reperfusion injury in rats. Chin. J. Arteriosclerosis. 21 (6), 493-496 (2013).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. Am J Physiol Heart Circ Physiol. 314 (4), H812-H838 (2018).
- Oeckinghaus, A., Hayden, M. S., Ghosh, S. Crosstalk in nf-kappab signaling pathways. Nat Immunol. 12 (8), 695-708 (2011).
- Van Der Heiden, K., Cuhlmann, S., Luong Le, A., Zakkar, M., Evans, M. Role of nuclear factor kappab in cardiovascular health and disease. Clin Sci. 118 (10), 593-605 (2010).
- Ha, T., et al. Toll-like receptors: New players in myocardial ischemia/reperfusion injury. Antioxid Redox Signal. 15 (7), 1875-1893 (2011).
- Pourrajab, F., Yazdi, M. B., Zarch, M. B., Zarch, M. B., Hekmatimoghaddam, S. Cross talk of the first-line defense tlrs with pi3k/akt pathway, in preconditioning therapeutic approach. Mol Cell Ther. 3, 4 (2015).
- Wang, Y. H., et al. Lumbrokinase attenuates myocardial ischemia-reperfusion injury by inhibiting tlr4 signaling. J Mol Cell Cardiol. 99, 113-122 (2016).
- Yu, H., et al. Gypenoside protects cardiomyocytes against ischemia-reperfusion injury via the inhibition of mitogen-activated protein kinase mediated nuclear factor kappa b pathway in vitro and in vivo. Front Pharmacol. 7, 148 (2016).
- Liu, X., et al. Peroxisome proliferator-activated receptor gamma (ppargamma) mediates the protective effect of quercetin against myocardial ischemia-reperfusion injury via suppressing the nf-kappab pathway. Am J Transl Res. 8 (12), 5169-5186 (2016).
- Han, D., et al. Hydroxysafflor yellow a alleviates myocardial ischemia/reperfusion in hyperlipidemic animals through the suppression of tlr4 signaling. Sci Rep. 6, 35319 (2016).
- Yang, Q., He, G. W., Underwood, M. J., Yu, C. M. Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury: Perspectives and implications for postischemic myocardial protection. Am J Transl Res. 8 (2), 765-777 (2016).
- Valen, G., Paulsson, G., Vaage, J. Induction of inflammatory mediators during reperfusion of the human heart. Ann Thorac Surg. 71 (1), 226-232 (2001).
- Saini, H. K., et al. Role of tumour necrosis factor-alpha and other cytokines in ischemia-reperfusion-induced injury in the heart. Exp Clin Cardiol. 10 (4), 213-222 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten