Research Article
Травяной препарат Мунзик улучшает ишемию-реперфузионное повреждение миокарда, подавляя воспаление
В этой статье
Резюме
В этом исследовании изучается кардиопротекторное действие Мунзика, традиционного уйгурского травяного препарата, на ишемическое и реперфузионное повреждение миокарда (MIRI) у крыс с аномальной жидкостью организма. С помощью комплексных экспериментальных методов мы демонстрируем потенциал Munziq по смягчению MIRI путем подавления сигнального пути NF-κB.
Аннотация
Целью данного исследования было изучение кардиопротекторного действия препарата Мунзик на аномальное ишемическое повреждение миокарда жидкостью миокарда (MIRI) и лежащий в его основе механизм. Нормальные крысы и крысы с аномальной жидкостью организма (АБФ) были предварительно обработаны Мунзиком в течение 21 дня. Вслед за этим были созданы модели MIRI. Гистопатологические изменения и изменения ультраструктуры миокарда наблюдали с помощью окрашивания гематоксилином и эозином (ПЭ) и просвечивающей электронной микроскопией для наблюдения за патологическими проявлениями повреждения миокарда. Уровни CK-MB, cTn-T и ICAM-1 в сыворотке крови определяли с помощью иммуноферментного анализа (ИФА) для наблюдения за маркерами, связанными с повреждением миокарда. Уровни IL-1β, IL-6 и TNF-α в сыворотке крови и ткани миокарда также определяли с помощью иммуноферментного анализа для наблюдения за противовоспалительным эффектом. Уровни экспрессии белков, связанных с сигнальным путем NF-κB NIK, IKKα, Pikα и p65, были обнаружены с помощью вестерн-блоттинга. Результаты показали, что повреждение миокарда в группе ABF MIRI было более тяжелым по сравнению с контрольной группой MIRI. Предварительное лечение методом Мунзика может смягчить патологические изменения, вызванные ишемией-реперфузионным повреждением, и может защитить сердечную функцию. Уровни белка пути NF-κB и нисходящих эффекторов IL-1β, IL-6 и TNF-α были значительно повышены в группе MIRI и снижены в группе Munziq. Интересно, что в группе ABF MIRI наблюдалась большая активация сигнального пути NF-κB и более высокие уровни воспалительных цитокинов. Результаты свидетельствуют о том, что MIRI протекал тяжелее при АБФ. Мунзик обладает кардиопротекторным действием при ишемии и реперфузионном повреждении. Этот защитный эффект может быть реализован путем подавления сигнального пути NF-κB.
Введение
Ишемия миокарда — состояние, при котором миокард не получает адекватного кровотока, в первую очередь вызванное стенозом или тромбозом коронарных артерий1, что может привести к летальному исходу для пациентов 2,3. Поскольку метаболизм миокарда является почти исключительно аэробным и содержит очень ограниченные запасы гликогена, важно быстро восстановить кровоснабжение, в первую очередь с помощью ЧКВ или внутривенного тромболизиса. В то время как эффективная реперфузия миокарда имеет решающее значение для улучшения прогноза ишемического миокарда, она также создает риск ишемии-реперфузионного повреждения миокарда (MIRI)4,5,6. MIRI представляет собой серьезную проблему, которая влияет на эффективность реперфузионной терапии миокарда7. Множество факторов и механизмов способствуют развитию MIRI. Например, в эндотелиальных клетках реперфузия вызывает накопление активных форм кислорода (АФК) и истощение запасов свободных радикалов, что указывает на наличие окислительного стресса 4,8. Этот окислительный стресс может впоследствии вызвать воспалительную реакцию, приводящую к усиленному высвобождению воспалительных факторов, увеличению выработки молекул адгезии и набору лейкоцитов 9,10,11. Ядерный фактор каппа-легкая цепь активированных В-клеток (NF-κB) играет решающую роль в воспалительной реакции при ишемии/реперфузионном повреждении миокарда12. Семейство транскрипционных факторов NF-κB млекопитающих включает пять членов: NF-κB1 (также известный как p105/p50), NF-κB2 (также известный как p100/p52), p65 (также известный как RELA), RELB (гомолог вирусного онкогена ретикулоэндотелиоза V-Rel) и c-REL13,14. Было показано, что ингибирование пути NF-κB облегчает ишемию/реперфузионное повреждение в различных тканях, включая миокард12,15, кишечник16, яичники17, мозг18,19, почки20 и печень21. В частности, сигнальный путь NF-κB был широко задокументирован как ключевой медиатор в ответе миокарда на ишемию и реперфузию12,14, возможные механизмы включают стимулирование воспалительных реакций, регуляцию экспрессии молекул клеточной адгезии, участие в реакциях окислительного стресса и влияние на пути гибели и выживания клеток 12,20,22,23,24,25. Терапевтические вмешательства, направленные на ослабление активации NF-κB, показали значительный потенциал в снижении MIRI23,26.
Уйгурская медицина, неотъемлемая часть традиционной китайской медицины, основана на теории четырех жидкостей: огня, воздуха, воды и земли. Эти жидкости дают начало телесным жидкостям, таким как кровь, мокрота, желтая желчь и черная желчь27,28. Поддержание динамического гомеостаза среди этих четырех жидкостей организма имеет решающее значение для общего здоровья человеческого организма. Любой дисбаланс в этих жидкостях, именуемый несбалансированными жидкостями организма, может привести к возникновению заболеваний. Среди различных несбалансированных жидкостей организма преобладающей является аномальная жидкость организма (АБФ), также известная как аномальный синдром Савды (АСС)27,28. Мунзик, традиционная уйгурская медицина, широко используемая уйгурскими врачами, назначается для лечения аномальной жидкости в организме. Это растительный лекарственный препарат, состоящий из десяти различных лекарственных видов, указанных в листке-вкладыше, включая Cordia dichotoma Forst. f., Anchusaitalica Retz., Glycyrrhiza uralensis Fisch., Adiantum capillusveneris L., Euphorbia humifusa Willd., Ziziphus jujuba Mill., Lavandula angustifolia Mill., Foeniculum vulgare Mill., Melissa officinalis L. и Alhagi pseudoalhagi Desv29. Препарат Мунзик был одобрен Государственным управлением по контролю за продуктами и лекарствами в 2003 году под кодовым номером Z65020166. К его активным химическим компонентам относятся латунь, фенолы, органические кислоты, аминокислоты, сапонин, сахар и другие. Munziq проявляет множество эффектов, включая антиоксидантное, противовоспалительное, иммунорегуляторное, антиагрегацию тромбоцитов и антитромботическое действие 27,28,30.
Наши предыдущие исследования показали, что препарат Мунзик может облегчить ишемию/реперфузионное повреждение миокарда (MIRI), хотя конкретные механизмы остаются неясными. Показаны протективные эффекты препарата Мунзик в миокарде у крыс с ишемией-реперфузионным повреждением миокарда с аномальным синдромом Савды. Ингибирование пути ядерного фактора каппа b защищает от ишемии/реперфузионного повреждения миокарда у крыс, получающих лечение гранулами Fufang Munziq (Munziq) 27,28,30. Тем не менее, существует ограниченное количество исследований, изучающих роль и механизм Munziq в MIRI.
Данное исследование направлено на изучение кардиопротекторного действия препарата Munziq на ишемическое и реперфузионное повреждение миокарда (MIRI) у крыс с аномальной жидкостью организма (ABF) и изучение основных механизмов, уделяя особое внимание сигнальному пути NF-kB. Гипотеза, предложенная в этом исследовании, заключается в том, что предварительное лечение Мунзиком может смягчить патологические изменения, вызванные MIRI, и защитить сердечную функцию, потенциально подавляя сигнальный путь NF-κB и последующие воспалительные реакции. Гипотеза проверена путем установления моделей симуляции, ишемии-реперфузионного повреждения (MIRI) и ишемии-реперфузионного повреждения + Munziq как в контрольной группе, так и в группе ABF. Контролируется сердечная функция, показатели, связанные с воспалением, и белки, связанные с путем NF-κB.
протокол
Взрослого самца крысы породы Спрэг-Доули (SD) массой 200-220 г использовали в соответствии с рекомендациями Национальных институтов здравоохранения по уходу и использованию лабораторных животных. Экспериментальный центр животных Синьцзянского медицинского университета. Животные модели с аномальной жидкостью организма (ABF) были предоставлены Центром экспериментальных животных Синьцзянского медицинского университета. Крысы содержались в сухой и холодной среде, как описано ранее, что имеет важное значение для установления модели аномальной жидкости организма (АБФ) у крыс, в соответствии с традиционной теорией уйгурской медицины и как было продемонстрировано в предыдущих исследованиях29,33. Все эксперименты на животных проводились в соответствии с этическими принципами Синьцзянского медицинского университета и в соответствии с руководящими принципами ARRIVE. Протокол исследований позвоночных животных (крыс) был одобрен институциональным этическим комитетом Синьцзянского медицинского университета (IACUC-20200318-16).
1. Группировка животных, введение лекарственных препаратов и создание модели MIRI
- Случайным образом распределите крыс по следующим шести группам: i) контрольная фиктивная группа, ii) контрольная группа MIRI, iii) ABF фиктивная группа, iv) группа ABF MIRI, v) контрольная группа MIRI + Munziq и vi) ABF MIRI + группа Munziq.
- Крысы из группы ABF содержатся в контролируемой среде в климатических боксах с температурой от 6 °C ± 1 °C и относительной влажностью от 25% до 32,8%. Обеспечьте крыс обычным комбикормом, смешанным с сухим холодным кормом, а именно семенами ячменя и кориандра в соотношении 7:1,5:1,5, и применяйте этот метод в течение 21 дня до установления модели АВФ29,33.
- Вводите внутрь 5 г/кг Мунзика (5,0 г Мунзика, растворенного в 1 мл дистиллированной воды) группе Мунзика в течение 21 дня до операции MIRI, что в два раза превышает эффективную клиническую дозу. Для животных, не принимающих ABF, таких как контрольные симуляционные группы, контрольные MIRI и контрольные MIRI + Munziq, введите равное количество нормального физиологического раствора в фиктивную группу и группу MIRI и обеспечьте внутрижелудочное введение Munziq в группе Munziq.
- После 21 дня предварительной обработки установите модель MIRI.
- Проводите операцию в специальной операционной для животных, оборудованной стерильными материалами для обеспечения стерильной среды. Обезболивание крыс с помощью внутрибрюшинной инъекции (ВП) пентобарбитала натрия (35 мг/кг); Наблюдайте за расслаблением мышц, реакцией на внешние раздражители, а также частотой и глубиной дыхания для оценки обезболивающего эффекта. Контролируйте эти параметры каждые 15 минут на протяжении всей процедуры. При появлении признаков недостаточной анестезии (мышечное напряжение, заметная реакция на раздражители, учащенное или поверхностное дыхание) введите дополнительную дозу 20 мг/кг. Поддерживайте анестезию на протяжении всей процедуры до окончательного забора крови. Во время процедуры поддерживайте температуру тела крысы на уровне 37 °C с помощью грелки с непрерывным контролем с помощью ректального датчика температуры. Нанесите ветеринарную мазь на глаза, чтобы предотвратить сухость во время анестезии.
- Выполните трахеостомию для дыхания с помощью аппарата искусственной вентиляции легких. Перед вскрытием грудной клетки, чтобы обнажить сердце, промойте место операции мыльной водой, побрейте операционную область и очистите область антисептическими растворами, такими как хлоргексидин и йод. Используйте для процедуры стерильные инструменты.
- Чтобы вскрыть грудную клетку и обнажить сердце, используйте стандартные стерильные торакальные хирургические инструменты, включая ножницы, щипцы и ретракторы. Откройте грудную стенку и обнажите сердце. Определите левую переднюю нисходящую артерию (ПМЖ) под прямой визуализацией. Это основная ветвь левой коронарной артерии, которая лежит на поверхности сердца. Наложите шов 6-0 (4-5 см), перевязайте ПМЖ (левая передняя нисходящая) в течение 30 минут, чтобы вызвать регионарную ишемию. Определите эффективную окклюзию ПМЖ, наблюдая за бледным цветом миокарда.
- Через 30 минут лигирования освободите лигатуру и выполняйте реперфузию в течение 120 минут. Определяют реперфузию миокарда, когда он восстанавливается до ярко-красного цвета. У крыс с симуляцией операции проводят ту же процедуру, но без лигирования ПМЖ.
- После реперфузии крысы оставались под наркозом, индуцированным пентобарбиталом натрия (35 мг/кг, ip)34. После того, как крысы попадут под глубокую анестезию, соберите 1-2 мл образцов крови из брюшной аорты с помощью вакуумной пробирки для сбора крови.
- После забора образца крови из брюшной аорты усыпьте крыс путем вывиха шейки матки, еще находясь под глубокой анестезией. Соберите ткань миокарда из области инфаркта в левом желудочке с помощью стерильных щипцов и ножниц, следя за тем, чтобы взять только ту ткань, которая выглядит бледной и поврежденной, что указывает на область инфаркта. Поместите собранную ткань в стерильный контейнер для дальнейшего анализа.
2. Забор образцов
- Забор образца ткани: с помощью стерильных ножниц и стерильного лезвия разрежьте сердце горизонтально на две половины вдоль средней точки длинной оси левого желудочка, перпендикулярно направлению сердца. Разделите одну половину апикальной части на две части: одну в 4% параформальдегиде законсервируйте для морфологического исследования при комнатной температуре или 4 °C в течение 2-24 часов, а другую в глутаральдегиде для электронной микроскопии при 4 °C в течение 1-4 часов.
- Разделите базовую часть сердца, включая ишемизированную и неишемическую области, на две части: поместите одну часть в криовиальную камеру, быстро заморозьте ткань в жидком азоте, а затем перенесите ее в морозильную камеру при температуре -80 °C для молекулярно-биологического тестирования. Используйте другую свежую порцию для определения уровня активных форм кислорода (АФК) в тканях и митохондриальной экстракции.
- Сбор образцов сыворотки: В конце эксперимента возьмите 1-2 мл венозной крови из нижней полой вены, центрифугируйте при 1000 x g в течение 10 минут и храните сыворотку в морозильной камере при температуре -80 °C после разделения.
3. Окрашивание HE и наблюдение с помощью просвечивающей электронной микроскопии
- Провести окрашивание ПЭ (окрашивание гематоксилин-эозином) миокарда желудочков в соответствии с рутинной процедурой35. Зафиксируйте ткани в 4% параформальдегиде на 24 ч. Погрузите образцы в парафин, разрежьте их на участки толщиной 4 мкм и окрашивайте методом окрашивания гематоксилин-эозин в соответствии с протоколом. Случайным образом выберите пять полей для наблюдения гистопатологических изменений под микроскопом.
- Обрабатывайте ткани миокарда крыс, которые были зафиксированы в формалине, из каждой группы, для экспериментов по окрашиванию HE, следуя следующим шагам.
- Поместите срезы ткани в инкубатор с температурой 65 °C для запекания на 1,5-2 минуты.
- Погрузите срезы ткани в ксилол на 10 минут, замените ксилол и снова погрузите еще на 10 минут. Последовательно погрузить в безводный спирт I и II на 5 мин каждый, затем 95%, 90%, 80% и 70% спирт и дистиллированную воду на 5 мин каждый.
- Окрашивать гематоксилином в течение 3 мин. Проведите кислотную дифференцировку с добавленной в спирт соляной кислотой в течение нескольких секунд (1-2 с). Прекратить дифференцировку в водопроводной воде на 5 мин.
- Погрузить в дистиллированную воду с содержанием алкоголя 70%, 80%, 90% и 95% на 3 мин и безводный спирт I и II на 5 мин.
- Окрасить 0,5% эозина в этаноле на 1 мин, промыть участки в 95% этаноле для удаления излишков красного цвета, затем погрузить в безводный этанол на 5 мин. Погрузить в ксилол I и II на 5 мин каждый.
- Крепление с нейтральным бальзамом. Наблюдайте за патологическими изменениями тканей под микроскопом.
4. Определение цитокинов крови методом ИФА и индексов повреждения сердца
- Возьмите образец сыворотки крови крыс из периферической крови центрифугированием при 1000 x g в течение 10 мин и храните при температуре −80 °C. Определите уровни индексов повреждения сердца, таких как CK-MB, cTn-T, ICAM-1, и воспалительных цитокинов, таких как IL-1β, IL-6, TNF-α, в сыворотке крови с помощью наборов ELISA в соответствии с инструкциями производителя и как описано ниже.
- Дайте всем реагентам сбалансироваться до комнатной температуры (18-25 °C) в течение не менее 30 минут, приготовьте реагенты в соответствии с инструкциями производителя и подготовьте их к использованию.
- Установите стандартные и пробные лунки, в которых стандартные лунки содержат известные концентрации стандартных растворов, предоставленных в наборе для анализа. Они используются для построения стандартной кривой во время эксперимента для количественной оценки удельной концентрации аналита в испытуемых образцах. Добавьте по 100 мкл стандартного или образца в каждую лунку, аккуратно перемешайте, встряхивая, накройте пломбой и выдерживайте при 37 °C в течение 2 часов.
- Выбросьте жидкость, высушите путем декантации и не стирайте. Добавьте в каждую лунку по 100 мкл рабочего раствора антитела, меченного биотином (предварительно разбавленного 1:100), накройте новой пломбой планшета и инкубируйте при 37 °C в течение 1 ч.
- Слейте жидкость из лунок, высушите путем декантации и промойте пластину 3 раза. Замочите на 2 минуты после стирки, 200 μл на лунку и высушите путем декантации.
- Добавьте в каждую лунку по 100 μл рабочего раствора стрептавидина, меченного пероксидазой хрена, накройте новой пломбой планшета и инкубируйте при 37 °C в течение 1 ч.
- Слейте жидкость из лунок, высушите путем декантации, и промойте пластину 5 раз. Замочите на 2 минуты после стирки, 200 μл на лунку и высушите путем декантации.
- Последовательно добавьте в каждую лунку по 90 μл раствора субстрата и развивайте цвет в темноте при 37 °C в течение 15-30 минут.
- Последовательно добавьте 50 мкл раствора остановки в каждую лунку, чтобы завершить реакцию. В течение 5 мин после остановки реакции измерить оптическую плотность (значения OD) каждой лунки последовательно с длиной волны 450 нм с помощью считывателя микропланшетов.
5. Измерение уровня MDA, NO и LDH
- После реперфузии соберите ткань миокарда (5 мм х 7 мм) из области инфаркта в левом желудочке. Обнаруживайте ЛДГ (лактатдегидрогеназу) и МДА (малоновый диальдегид) с помощью набора для анализа ЛДГ и набора для анализа МДА, следуя инструкциям производителя. Детектируйте NO на длине волны 550 нм с помощью набора для анализа оксида азота (NO) в соответствии с инструкциями производителя.
6. Вестерн-блоттинг
- Извлечь общие белки из тканей желудочков крыс с помощью лизиса RIPA. Определите концентрацию белка с помощью набора для анализа белка BCA.
- Чтобы сохранить внутриклеточные белки и предотвратить клеточную деградацию, погрузите образцы в жидкий азот, чтобы быстро заморозить их. Затем извлеките замороженные образцы и измельчите их в порошок, возьмите примерно 100 мг образца и добавьте его в предварительно охлажденную центрифужную пробирку объемом 1,5 мл. Добавьте 400 мкл буфера для лизиса RIPA (добавка с ингибиторами протеазы и ингибитором фосфатазы широкого спектра действия), затем тщательно перемешайте и дайте смеси настояться при температуре 4 °C в течение 60 минут.
- Центрифугируйте смесь при 1000 x g в течение 15 мин при 4 °C. Соберите надосадочную жидкость и измерьте концентрацию белка методом ВСА.
- Разбавьте стандарты BSA разбавителем, который соответствует буферной системе образцов, в соответствии с таблицей 1.
- Готовьте реактивы в соответствии с инструкциями производителя. Исходя из количества образцов, смешивают реактивы А и В в объемном соотношении 50:1 для приготовления достаточного количества рабочего раствора ВСА и тщательно перемешивают. Перед приготовлением рабочего раствора ВСА встряхните реагент А, чтобы хорошо перемешать.
- Возьмите 20 мкл свежеприготовленного стандартного раствора БСА и разведенных образцов (разбавленных в 10 раз) из таблицы 1 и добавьте их в 96-луночный планшет.
- Добавьте в каждую лунку по 200 мкл рабочего раствора ВСА и тщательно перемешайте. Закройте планшет, выдержите при температуре 37 °C в течение 30 минут, затем остудите до комнатной температуры или поместите при комнатной температуре на 2 минуты.
- Измерьте поглощение на длине волны 562 нм с помощью считывателя микропланшетов и рассчитайте концентрацию белка в образцах на основе стандартной кривой.
- Добавьте к образцам соответствующее количество загрузочного буфера SDS-PAGE (содержащего β-меркаптоэтанол), обрабатывайте при 100 °C в кипящей воде в течение 5 минут для полной денатурации белков, центрифугируйте при 1000 x g в течение 5 минут и принимайте надосадочную жидкость для использования.
- Формула в таблице 2 описывает приготовление 15%, 12% и 8% разделительных гелей, а также 5% укладывающего геля. Подготовьте растворы соответствующим образом. Добавьте разделительный раствор геля на высоту 2/3 в гелевую кассету, залейте ее дистиллированной водой и дайте постоять при комнатной температуре в течение 40 минут. Затем добавьте стекляющий гель, чтобы заполнить кассету, вставьте расческу и оставьте на 10 минут.
- Загрузите 9 μL предварительно окрашенного белкового маркера в каждую лунку и загрузите 50 μг образца белка в лунку.
- Подайте постоянное напряжение 80 В до тех пор, пока бромфенольный синий не достигнет разделительного геля, затем подайте постоянное напряжение 100 В в течение 90 минут. Прекращайте электрофорез, когда бромфенольный синий перекочевал в нижнюю часть геля.
- После завершения SDS-PAGE погрузите мембрану PVDF в метанол на 10 секунд, промойте в дистиллированной воде на 1 минуту, а затем замочите полиакриламидный гель, фильтровальную бумагу и обработанную мембрану PVDF в буфере для переноса на 10 минут.
- Соберите сэндвич для перевода черной стороной зажимов вниз, а затем губчатый фильтр бумага-гель-мембрана из ПВДФ-фильтровальная бумага-губка-прозрачная сторона зажимов. Поместите зажимы в кассету для переноса так, чтобы черная сторона зажима была обращена к черной стороне кассеты, а белая сторона — к красной. Выполните передачу при постоянном напряжении 100 В и используйте мембрану из ПВДФ с временем передачи 60 минут.
- После переноса промойте мембрану из ПВДФ водой 3 раза по 5 минут каждая. Закройте мембрану блокирующим раствором, содержащим 5% обезжиренного сухого молока, на 1 ч, затем промойте TBST 3 раза в течение 5 мин каждый.
- Разбавляют первичное антитело с помощью TBST в соответствии с коэффициентами разведения, указанными в таблице 3 , и инкубируют при 4 °C в течение ночи. К основным антителам относятся антитела против NF-κB p65, антитела против NF-κB индуцирующей киназы (NIK), антитела против IKKα и антитела против β-актина.
- Промойте мембрану 3x с 1x TBST в течение 5 минут каждая. Добавьте соответствующим образом разведенное вторичное антитело (в соответствии с Таблицей 3) и инкубируйте при комнатной температуре в течение 1 ч. Вторичными антителами являются HRP-конъюгированный козий анти-мышиный IgG и HRP-конъюгированный козий анти-кроличий IgG.
- Снова промойте мембрану 1x TBST 3x в течение 5 минут каждая. Смешайте проявляющие растворы А и В, добавьте 2 мл в мембрану, обнажите и сфотографируйте с помощью мини-хемилюминесцентного прибора.
- Разработайте мембрану с использованием усиленной хемилюминесценции и реагента. Отсканируйте проявленную пленку с помощью системы визуализации. Проанализируйте изображения вестерн-блоттинга с помощью программного обеспечения. Используйте β-актин в качестве контроля загрузки. Рассчитайте относительный уровень белка на основе серого значения β-актина.
7. Анализ ПЦР в реальном времени (qRT-PCR)
- Экстракция общей РНК
- Приготовьте 0,1% раствор DEPC и 70% спирт, обработанный DEPC, в соответствии с инструкциями производителя. Обрабатывайте микроцентрифужные пробирки всех размеров и различные типы наконечников для пипеток 0,1% раствором DEPC. Замочить на ночь, затем автоклав.
- Собирайте клетки в логарифмической фазе роста с хорошим статусом роста. Выбросьте питательную среду из колбы для клеточных культур и промойте клетки 2 раза раствором Хэнка. Добавьте 1 мл трипсина на 10 см² клеток, осторожно встряхните, чтобы отделить клетки, и используйте пипетку, чтобы обеспечить полное отделение. Инкубируйте при комнатной температуре в течение 5 минут, чтобы обеспечить полный лизис, затем пипетка вверх и вниз в 7-10 раз, чтобы полностью разрушить клетки. Переложите лизат в пробирки объемом 1,5 мл, поставьте центрифугу и храните надосадочную жидкость.
- Добавьте в надосадочную жидкость равный объем хлороформа, хорошо перемешайте и дайте настояться при комнатной температуре в течение 10 минут. Центрифугируйте при 4 °C в течение 5 мин при 1 000 x g для разделения фаз. Осторожно перенесите верхнюю водную фазу в новую пробирку (если вы извлекаете ДНК и белки, оставьте нижнюю фазу и храните ее при температуре 4 °C).
- Добавьте изопропанол (0,5 мл на 1 мл тризола), хорошо перемешайте и дайте настояться при комнатной температуре в течение 10 минут. Центрифугируйте при температуре 4 °C в течение 10 мин при 1 000 x g, аккуратно удалите надосадочную жидкость и выбросьте ее.
- Промойте гранулу РНК с 75% этанолом, центрифугируйте при 4 °C в течение 5 минут при 8 000 x g, аккуратно удалите надосадочную жидкость и высушите гранулу на воздухе или в вакууме. Растворите РНК в 50 мкл воды DEPC, аликвоте, и храните при -70 °C или приступайте к обратной транскрипции в кДНК.
- Обратная транскрипция в кДНК
- Выполните обратную транскрипцию кДНК с помощью набора, следуя инструкциям производителя.
- Количественная ПЦР в реальном времени
- Разрабатывайте праймеры на основе последовательностей генов и проверяйте их с помощью BLAST на веб-сайте NCBI. Приготовьте 10 мкМ стоковых растворов прямых и обратных праймеров для CK20 и β-актина. В таблице 4 приведены последовательности праймеров.
- Количественная ПЦР в реальном времени
- Добавьте 1 мкл кДНК, 10 мкл 2x мастер-смеси, по 0,4 мкл прямого и обратного праймера и 8,2 мкл воды, не содержащей РНКазы, в реакционную систему.
- Проводят ПЦР по следующей программе: начальная денатурация при 95 °C в течение 2 мин, затем 40 циклов при 95 °C в течение 15 с и 60 °C в течение 1 мин. Используйте β-актин в качестве внутреннего контроля. Вычислить относительное выражение с помощью метода 2-ΔΔCt .
8. Статистический анализ
- Используйте коммерческое программное обеспечение для статистического анализа. Представьте данные в виде среднего ± стандартного отклонения (среднее значение ± SD). Выполните однофакторный ANOVA для сравнения различий между различными группами. Определите значимую разницу как p < 0,05.
Результаты
Munziq смягчает патологические изменения, вызванные ишемии-реперфузионным повреждением
Для изучения морфологических изменений в тканях миокарда мы первоначально проводили окрашивание HE. Как показано на рисунке 1, мы наблюдали гранулярную дегенерацию и вакуолярную дегенерацию в некоторых клетках миокарда в фиктивной группе. Кроме того, наблюдалось ограниченное присутствие эритроцитов и инфильтрация лимфоцитов среди клеток миокарда. Периодически мы наблюдали расширение и застой в сосудах. Ткани миокарда из группы MIRI демонстрировали более выраженные нарушения и более выраженные морфологические изменения. Эти изменения включали обширную гранулярную дегенерацию, вакуолярную дегенерацию, инфильтрацию эритроцитов и лимфоцитов, расширение сосудов и застойные явления. Повреждение тканей миокарда в группе ABF MIRI было более тяжелым по сравнению с тем, которое наблюдалось в контрольной группе MIRI. Тем не менее, в обеих группах Мунзика некоторые клетки миокарда демонстрировали легкую гранулярную дегенерацию и вакуолярную дегенерацию. Наличие инфильтрации эритроцитов и лимфоцитов, расширение сосудов и застойные явления были редкими. Кроме того, полученные данные указывают на то, что Munziq проявляет превосходные кардиопротекторные эффекты у крыс ABF MIRI и контрольных крыс MIRI. В заключение, эти результаты свидетельствуют о том, что предварительное лечение Мунзиком обладает потенциалом для смягчения патологических изменений, вызванных ишемией-реперфузионным повреждением сердца.
Мунзик улучшил нарушение митохондрий и волокон сердечной мышцы, вызванное ишемией/реперфузионным повреждением
Для дальнейшей проверки защитной роли Munziq при повреждении MIRI мы изучили ультраструктуру митохондрий и волокна сердечной мышцы с помощью ПЭМ. Как показано на рисунке 2, клетки миокарда в фиктивной группе демонстрировали интактную структуру с близко расположенными миофибриллами и аналогичной длиной саркомера. Структура миофиламентов казалась четкой и слегка рыхлой, в то время как наблюдалось большое количество митохондрий. И наоборот, в группе MIRI наблюдались патологические характеристики, указывающие на повреждение клеток миокарда, включая набухание клеток, различную длину саркомера, нечеткую и слабо расположенную структуру миофиламента. Было отмечено, что в группе I/R наблюдалось значительное нарушение и растворение митохондрий по сравнению с фиктивной группой. Кроме того, волокна сердечной мышцы были неправильными и ломались в ответ на повреждение внутримышечного введения. Интересно, что выраженность этих изменений была заметно выше в группе ABF MIRI. Напротив, в обеих группах, получавших Мунзик, наблюдалось облегчение патологических признаков, связанных с повреждением клеток миокарда. Отечность клеток миокарда была уменьшена, а структуры миофибрилл, саркомера, миофиламента и количество митохондрий были аналогичны наблюдаемым в группе симуляции. В совокупности эти данные указывают на то, что предварительное лечение Мунзиком может смягчить нарушение митохондрий и волокон сердечной мышцы, вызванное хирургическим вмешательством внутримышечного введения.
Ишемия-реперфузионное повреждение миокарда обострилось у крыс ABF MIRI и Munziq до лечения, защищало сердечную функцию
Сывороточные уровни cTn-T, CK-MB и ICAM-1 определяли методом ИФА. Результаты не выявили заметных расхождений между контрольной фиктивной группой и фиктивной группой ABF. Тем не менее, следует отметить, что в группе ABF MIRI наблюдались значительно повышенные уровни cTn-T (рис. 3A), CK-MB (рис. 3B) и ICAM-1 (рис. 3C) по сравнению с контрольной группой MIRI. Для оценки кардиопротекторных эффектов препарата Мунзик как контрольные крысы MIRI, так и крысы ABF MIRI были подвергнуты предварительной обработке препаратом Мунзик. Как показано на рисунке 3, уровни cTn-T, CK-MB и ICAM-1 были заметно снижены в группе предварительной обработки по методу Мунзика. Эти результаты свидетельствуют о том, что Munziq проявляет замечательные кардиопротекторные свойства у крыс ABF MIRI.
Для изучения влияния предварительной обработки препаратом Мунзик на ишемическое реперфузионно-индуцированное окислительное стрессовое повреждение у крыс ABF и контрольной группы, были измерены изменения ЛДГ, МДА и NO в ткани миокарда. Как показано на рисунке 3D,F, в группе ABF MIRI наблюдался значительно повышенный уровень MDA и значительно сниженный уровень NO по сравнению с контрольной группой MIRI. Предварительная обработка Мунзиком достоверно снижала содержание ЛДГ и МДА в ишемизированном миокарде. В то же время предварительная обработка Мунзиком еще больше повышала уровень NO в ткани миокарда.
Предварительная обработка препаратом Мунзика смягчала воспаление MIRI за счет препятствования продукции провоспалительных цитокинов
Провоспалительные цитокины играют решающую роль в опосредовании врожденного иммунного ответа, а провоспалительные цитокины были активированы во время MIRI31. Для дальнейшего изучения противовоспалительного эффекта Мунзика как контрольные крысы MIRI, так и крысы ABF MIRI прошли предварительную обработку препаратом Munziq. С помощью метода ИФА мы измерили уровни ИЛ-1β, ИЛ-6 и ФНО-α сыворотки крови, а также провели анализ кОТ-ПЦР для оценки уровней мРНК ИЛ-1β, ИЛ-6 и ФНО-α в ткани миокарда. Результаты не выявили существенных различий в уровнях этих цитокинов между контрольной фиктивной группой и группой симуляции ABF. Уровни IL-1β, IL-6 и TNF-α были значительно повышены в группе ABF MIRI по сравнению с контрольной группой MIRI. В частности, IL-1β продемонстрировал значительное увеличение как на уровне мРНК, так и на уровне белка, при этом наблюдалась статистически значимая разница. В то время как не было никакой разницы в уровне мРНК для IL-6, было обнаружено несоответствие на уровне белка. Аналогичным образом, TNF-α не показал каких-либо вариаций в уровнях мРНК, но продемонстрировал различия на уровне белка. Как показано на рисунке 4, уровни IL-1β, IL-6 и TNF-α были заметно снижены в группе предварительной обработки препаратом Мунзик.
Предварительная обработка препаратом Мунзик смягчала воспаление через сигнальный путь NF-κB
Продукция цитокинов тесно связана с активацией сигнальных путей NF-κB на большинстве стадий воспалительной реакции. НФ-κB рассматривается в качестве потенциальной терапевтической мишени при воспалительных заболеваниях32. Чтобы оценить, участвует ли путь NF-κB в противовоспалительных эффектах Munziq, мы первоначально провели анализ Western Blot для измерения уровней экспрессии ключевых компонентов пути NF-κB, включая NIK, IKKα, pIKKα и p6513. Как показано на рисунке 5, ишемическое и реперфузионное повреждение индуцировало заметную апрегуляцию NIK, p-IKKα и p-p65 в группе MIRI. Лечение препаратом Мунзик эффективно ослабляло эту регуляцию. Результаты показали, что Munziq играет решающую роль в противовоспалительном средстве, подавляя активацию сигнального пути NF-κB.
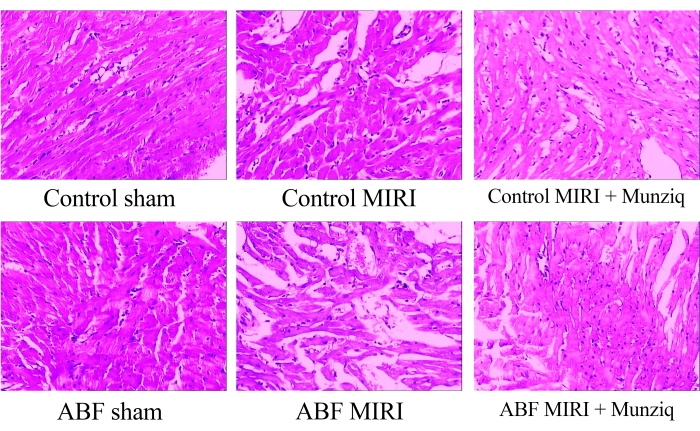
Рисунок 1: Морфологические изменения тканей миокарда, наблюдаемые при окрашивании HE. Репрезентативные HE окрашивают изображения разных групп. Увеличение: 100x. Сокращения: ABF = аномальная жидкость организма; MIRI = ишемиально-реперфузионное повреждение миокарда; (n=6). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
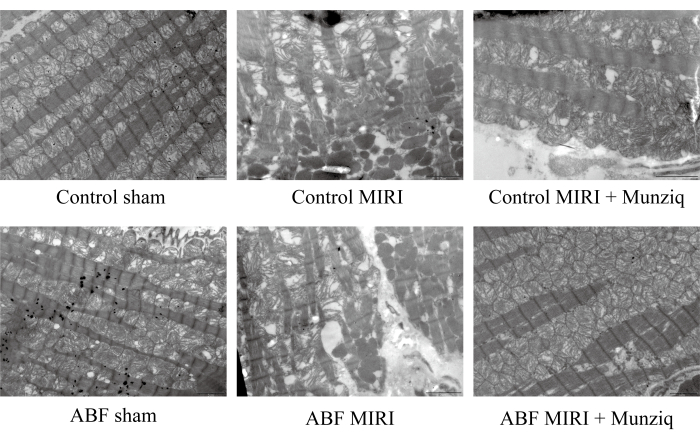
Рисунок 2: Мюнзик улучшил нарушение митохондрий и волокон сердечной мышцы, вызванное повреждением внутривенного введения. С помощью сканирующего электронного микроскопа наблюдали за ультраструктурой митохондрий и изменениями волокон сердечной мышцы. Были показаны репрезентативные изображения. Масштабная линейка: 5 мкм; (n=3). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
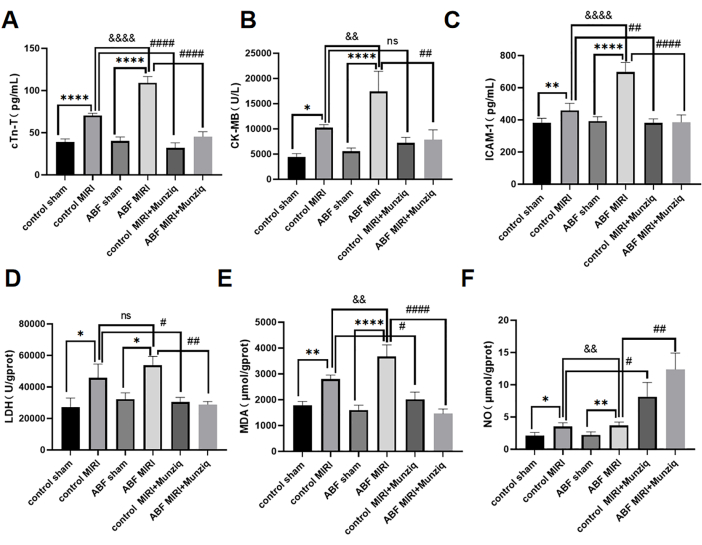
Рисунок 3: Ишемия-реперфузионное повреждение миокарда усугубилось у крыс ABF MIRI, и предварительное лечение Munziq могло защитить сердечную функцию. (A) сывороточный cTn-T, (B) CK-MB и (C) ICAM-1. Уровни определяли с помощью иммуноферментного анализа, а изменения ЛДГ, МДА и NO определяли в ткани миокарда (n=6). *p<0,05, ** p<0,01, ***p<0,001, ****p<0,0001 По сравнению с фиктивной группой; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 По сравнению с группой MIRI; &p<0,05, && p<0,01, &&p<0,001, &&&p<0,0001 По сравнению с контрольной группой. Данные представлены в виде среднего ± SD. Статистический анализ проводили с использованием одностороннего ANOVA. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
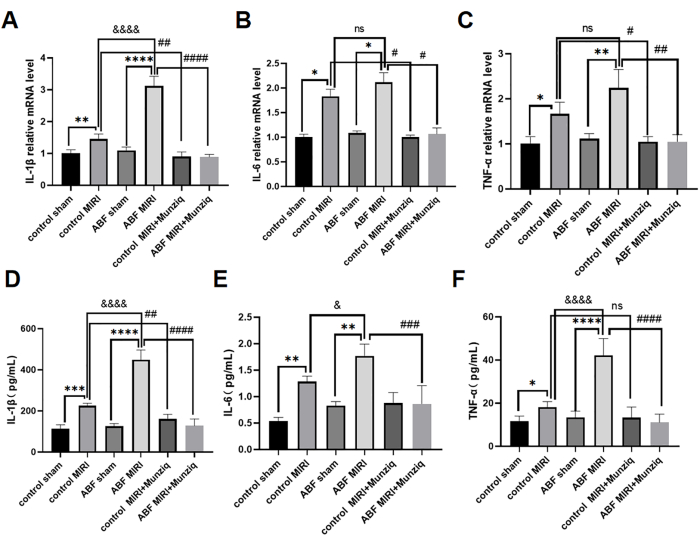
Рисунок 4: Предварительное лечение препаратом Мунзика смягчало воспаление MIRI за счет предотвращения выработки провоспалительных цитокинов. С помощью количественной ОТ-ПЦР были обнаружены уровни мРНК (A) IL-1β, (B) IL-6 и (C) TNF-α в ткани миокарда. Измерьте уровни (D) IL-1β, (E) IL-6 и (F) TNF-α в сыворотке крови с помощью иммуноферментного анализа (n=6). *p<0,05, ** p<0,01, ***p<0,001, ****p<0,0001 По сравнению с фиктивной группой; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 По сравнению с группой MIRI; &p<0,05, && p<0,01, &&&p<0,001, &&&p<0,0001 По сравнению с контрольной группой. Данные представлены в виде среднего ± SD. Статистический анализ проводили с использованием одностороннего ANOVA. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
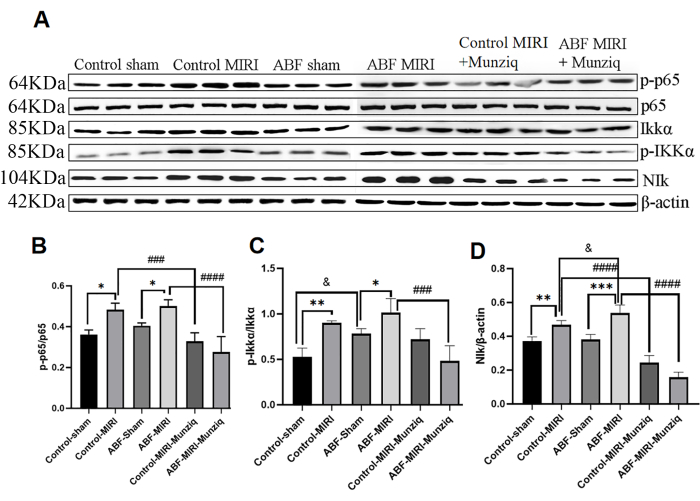
Рисунок 5: Предварительная обработка препаратом Мунзик смягчала воспаление через сигнальный путь NF-κB. Экспрессию белков p-IKKα, IKKα, p-p65, p65 и NIk в ткани миокарда определяли методом вестерн-блоттинга (N = 3 для каждой группы). (А) Белковые полосы, наблюдаемые при вестерн-блоттинге. (Б-Г) Относительный уровень экспрессии определяется на основе значения серого. *p<0,05, ** p<0,01, ***p<0,001, ****p<0,0001 По сравнению с фиктивной группой; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 По сравнению с группой MIRI; &p<0,05, && p<0,01, &&&p<0,001, &&&p<0,0001 По сравнению с контрольной группой. Данные представлены в виде среднего ± SD. Статистический анализ проводили с использованием одностороннего ANOVA. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Номер трубки | Объем разбавителя (мл) | Том BSA (источник) | Конечная концентрация БСА (мг/мл) |
| A | 0 | 20 (стоковый раствор) | 500 |
| B | 2 | 18 (стоковый раствор) | 400 |
| C | 4 | 16 (стоковый раствор) | 300 |
| D | 6 | 14 (стоковый раствор) | 200 |
| E | 8 | 12 (стоковый раствор) | 150 |
| F | 12 | 8 (стоковый раствор) | 100 |
| G | 16 | 4 (стоковый раствор) | 50 |
| H | 20 | 0 (стоковый раствор) | 0 |
Таблица 1: Таблица приготовления стандартной концентрации БСА.
| Разделительные гели | 15% Стекирующий Гель | 12% Укладывающий гель | 8% укладывающий гель | 5% стекирующий гель | |
| Реагентов | Том | Том | Том | Реагентов | Том |
| Деионизированная вода (мл) | 2.76 | 3.96 | 5.52 | Деионизированная вода (мл) | 4 |
| 30% акриламид (мл) | 6 | 4.8 | 3.24 | 30% акриламид (мл) | 1 |
| 1,5 моль/лТрис.HCl(PH8,8)(мл) | 3 | 3 | 3 | 1,0 М Tris.HCl (pH6,8; мл) | 1 |
| 10% SDS (μл) | 120 | 120 | 120 | 10% SDS (μл) | 80 |
| 10%AP (μл) | 120 | 120 | 120 | 10%AP (μл) | 60 |
| ТЕМЕД (μл) | 4.8 | 4.8 | 7.2 | ТЕМЕД (μл) | 8 |
| Общий объем (мл) | 12 | 12 | 12 | Общий объем (мл) | 6 |
Таблица 2: Приготовление концентрации геля.
| Первичное антитело | Коэффициент разбавления | Вторичные антитела | Коэффициент разбавления |
| β-актин | 1:1000 | Козий антимышиный препарат IgG H&L (HRP) | 1:15000 |
| стр65 | 1:1000 | Козий антикроличий IgG H&L (HRP) | 1:5000 |
| -П65 | 1:300 | 1:5000 | |
| БКЛ-2 | 1:1000 | 1:5000 | |
| БАКС | 1:1000 | 1:5000 | |
| Дрп1 | 1:800 | 1:5000 | |
| Фис1 | 1:1000 | 1:5000 | |
| МФН2 | 1:800 | 1:5000 |
Таблица 3: Коэффициенты разведения антител.
| Ген | Последовательность праймеров (от 5' до 3') | ||
| ИЛ-1β-Ф | CTGTGACTCGTGGGATG | ||
| ИЛ-1β-Р | GGGATTTTGTCGTTGCTTGT | ||
| ФНО-α-Ф | GCCTCCTCTCTGCCATCAAG | ||
| ФНО-α-Р | CTCCAAAGTAGACCTGCCCG | ||
| Ил-6-Ф | GCCCACCAGGAACGAAAGTC | ||
| Ил-6-Р | GGCAACTGGCTGGAAGTCTC | ||
| бета-актин-F | CCCATCTATGAGGGTTACGC | ||
| бета-актин-Р | TTTAATGTCACGCACGATTTC | ||
Таблица 4: Последовательности праймеров.
Обсуждение
MIRI, что расшифровывается как ишемия-реперфузионное повреждение миокарда, является распространенным и значительным осложнением, возникающим после реперфузии миокарда в кардиохирургии36,37, немногие препараты или адъюванты определенно улучшили клинические исходы по сравнению с контрольной группой38. Поэтому существует острая необходимость в эффективных методах лечения для защиты сердца от таких травм. Мунзик, традиционный растительный препарат, продемонстрировал определенные терапевтические эффекты при ишемии-реперфузионном повреждении сердца 27,28,30. Тем не менее, эти результаты являются предварительными, и основные механизмы остаются неизвестными. Целью данного исследования было дальнейшее изучение и валидация защитных эффектов и механизмов Мунзика на MIRI.
Аномальная жидкость в организме относится к общему проявлению различных хронических заболеваний, в том числе сердечно-сосудистых, согласно традиционной уйгурской медицине 39,40. В уйгурской медицинской системе считается, что АДФ является результатом длительного стресса и упоминается как источникразличных заболеваний. В этом исследовании была использована модель аномальной жидкости организма для моделирования основных характеристик сердечно-сосудистых заболеваний, которые требуют кардиохирургии. MIRI индуцировали у крыс с АБФ для определения ишемии-реперфузионного повреждения миокарда.
Ишемическое реперфузионное повреждение является сложным патологическим состоянием, включающим в себя множественные процессы. Сообщалось, что ишемия-реперфузия в сердце приводит к патологическим изменениям в миокарде4. Эти патологические изменения в первую очередь проявляются в виде укороченных кардиомиоцитов, нарушения саркомерной структуры, отека митохондрий41 и слабо расположенных саркомерных миофибрилл, как это наблюдается в данном исследовании. Повреждение миокарда также приводит к изменениям в ферментах сыворотки крови. Известно, что уровни cTnT, CK-MB и ICAM-1 в сыворотке крови увеличиваются после повреждения миокарда42,43. Поэтому эти биомаркеры используются для оценки степени острого повреждения миокарда. В данном исследовании мы наблюдали патологические изменения в миокарде и повышение уровня сывороточных ферментов после ишемии-реперфузионного повреждения, что свидетельствует об успешном становлении модели MIRI. Результаты показали, что повреждение миокарда в группе ABF MIRI было более тяжелым по сравнению с контрольной группой MIRI. После лечения препаратом Мунзик патологические изменения заметно уменьшились, а уровень ферментов в сыворотке крови значительно снизился. В совокупности эти результаты демонстрируют кардиопротекторные эффекты Мунзика во время MIRI.
В этом исследовании левая передняя нисходящая артерия (ПМЖ) была перевязана в течение 30 мин с последующей реперфузией в течение 120 мин для установления модели ишемии-реперфузионного повреждения у крыс. Мета-анализ44 , обобщающий 43 исследования, использованные для создания моделей ишемии-реперфузионного повреждения у крыс, показал, что время ишемии варьировало от 30 до 60 минут, а продолжительность реперфузии от 30 до 120 минут. В некоторых исследованиях применялся протокол ишемии в течение 5 минут с последующей реперфузией в течение 5 минут, повторяющихся 4 разав 45 минут. Среди этих методов наиболее часто использовался протокол, включающий 30 минут ишемии и 120 минут реперфузии, который проявился в 19 случаях. Во время экспериментального процесса мы наблюдали бледную окраску миокарда при прямом визуальном осмотре после 30 минут ишемии. В дополнение к визуальной оценке изменений цвета миокарда для выявления признаков ишемии, таких как подъем сегмента ST, применяли мониторинг электрокардиограммы (ЭКГ). Сывороточные маркеры, включая тропонин и креатинкиназу, а также гемодинамические параметры, такие как частота сердечных сокращений (ЧСС), диастолическое давление левого желудочка (LVDP) и систолическое давление левого желудочка (LVSP), могут служить индикаторами для оценки эффективности модели ишемии46. В этом исследовании мы в первую очередь полагались на визуальное наблюдение для оценки эффектов ишемии и реперфузии. Из-за индивидуальных различий среди крыс целесообразно дополнить визуальный осмотр дополнительными объективными мерами для оценки эффективности ишемии, а не применять одинаковую продолжительность ишемии для всех крыс.
У млекопитающих семейство NF-κB состоит из пяти членов, один из которых p6513,47. Существует два основных пути активации NF-κB в клетках47. В каноническом пути активация комплекса IKK (IKKα, IKKβ и IKKγ) приводит к фосфорилированию белков IκB, инициируя активацию NF-κB. В неканоническом пути NF-κB активация NF-κB опосредована фосфорилированием NIK и IKKα. Обширные данные свидетельствуют о том, что путь NF-κB играет решающую роль в опосредовании ишемии и реперфузионного повреждения 48,49,50. Вмешательство в активацию NF-κB может ослабить повреждение, вызванное ишемией и реперфузией51,52. Интересно, что в группе ABF MIRI наблюдалась большая активация сигнального пути NF-κB и более высокие уровни воспалительных цитокинов.
Было показано, что многочисленные препараты традиционной китайской медицины оказывают защитное действие против ишемии и реперфузионного повреждения путем модуляции пути NF-κB. Например, Liu et al.53 обнаружили, что кверцетин смягчает MIRI, ингибируя путь NF-κB. Han et al.54 сообщили, что гидроксисаффлор желтый А смягчает MIRI, ингибируя передачу сигналов TLR4/NF-κB. Тем не менее, оказывает ли Мунзик защитную роль в MIRI через сигнальный путь NF-κB, остается неизученным. Чтобы еще больше прояснить механизм Munziq, в этом исследовании были проанализированы уровни экспрессии ключевых узлов в сигнальном пути NF-κB, включая NIK, IKKα, pIKKα и p65. Результаты показали, что уровни экспрессии этих белков были значительно снижены после лечения Мунзиком, что указывает на то, что Мунзик ингибирует экспрессию ключевых узлов в сигнальном пути NF-κB во время MIRI.
Существует множество доказательств, подтверждающих, что активация NF-κB запускает выработку воспалительных белков и молекул адгезии, что приводит к набору лимфоцитов55. Например, Valen et al.56 обнаружили, что NF-κB активируется и что уровни IL-1β и TNF-α повышаются во время ишемии/реперфузии миокарда. Кроме того, IL-6, провоспалительный цитокин, регулируемый NF-κB, проявляет повышенную экспрессию во время реперфузии57. В соответствии с этими выводами, результаты данного исследования демонстрируют, что Munziq значительно ингибирует уровни провоспалительных цитокинов (включая IL-1β, IL-6 и TNF-α) в контексте ишемии/реперфузионного повреждения миокарда (MIRI). Из этого можно сделать вывод, что Munziq оказывает свое ингибирующее действие на экспрессию провоспалительных цитокинов через подавление сигнального пути NF-κB.
В заключение, полученные результаты свидетельствуют о том, что МИРИ был более серьезным при АБФ. Мунзик обладает кардиопротекторным действием при ишемии и реперфузионном повреждении. Этот защитный эффект может быть реализован путем подавления сигнального пути NF-κB. Эти результаты свидетельствуют о том, что Мунзик обладает большим потенциалом в качестве терапевтического средства для защиты сердца от реперфузионного повреждения во время кардиохирургии.
Существует несколько ограничений исследования. Во-первых, исследование проводится на модели крысы, которая, несмотря на то, что является ценной трансляционной моделью, может не полностью воспроизводить сложность сердечно-сосудистых заболеваний человека. Во-вторых, исследование в первую очередь сосредоточено на сигнальном пути NF-κB как механистической основе эффектов Мунзика. Тем не менее, MIRI является многофакторным процессом, который может включать в себя различные другие сигнальные пути и молекулярные механизмы.
Несмотря на то, что настоящее исследование дает ценную информацию о потенциальных кардиопротекторных эффектах препарата Мунзик в модели ишемии-реперфузионного повреждения миокарда (MIRI) на крысах, особенно в контексте аномальной жидкости организма (АБФ), есть несколько областей для будущих исследований. Одним из направлений дальнейших исследований является проведение исследований in vitro с использованием культивируемых кардиомиоцитов для непосредственного наблюдения за влиянием Munziq на клеточные ответы на ишемию и реперфузию. Кроме того, применение мультиомного подхода может дать более полное представление о молекулярных изменениях, связанных с лечением Мунзика, потенциально выявляя дополнительные пути и механизмы, которые способствуют его кардиопротекторным эффектам. Также было бы полезно изучить различные дозы Мунзика, чтобы определить оптимальную дозировку для максимальной кардиопротекции при минимизации потенциальных побочных эффектов. Необходимы долгосрочные исследования для оценки устойчивого воздействия Мунзика на сердечную функцию и мониторинга любых потенциальных побочных эффектов, связанных с длительным использованием.
Раскрытие информации
Авторам нечего раскрывать.
ВКЛАД АВТОРА:
Дуоликун Мутайлифу проводил эксперименты, Абудусайми Айни писал первоначальный черновик рукописи и анализировал данные; Айли Айбибула внесла свой вклад в концепцию и дизайн исследования; Чжэн Лю и Абудунаиби Маймайтиаили участвовали в разработке исследования; Абудунаиби Маймаитиаили организовал финансирование обучения; и все авторы прочитали и одобрили окончательную версию рукописи.
Благодарности
Эта работа была поддержана Национальным фондом естественных наук Китая [номер гранта: 82060907] и Программой высокого уровня развития медицинских талантов «Элита Тянь-Шань» [Грант No. TSYC202301B004].
Материалы
| Name | Company | Catalog Number | Comments |
| ABI 7500 Real-time PCR | ABI, CA, USA | Used for performing qRT-PCR. | |
| Adult male Sprague-Dawley (SD) rat | Animal Experimental Center of Xinjiang Medical University | ||
| Anti-NF-kB p65, anti-NF-kB Inducing Kinase NIK, anti-IKK alpha, anti-IKK alpha (phospho T23), anti-β-actin | Abcam, CA, USA | Used for Western blot analysis targeting specific proteins. | |
| Anti-TTC11/FIS1 Antibody | abcam | ab71498 | Used for protein detection in Western Blot (WB) experiments. |
| BCA Protein Assay Kit | Tiangen Biotech Co., Ltd., Beijing, China | Used for determining protein concentration. | |
| beta-Actin Loading Control antibody Mouse Mab | Sino Biological | 100166-MM10 | Used for protein detection in Western Blot (WB) experiments. |
| ChemiScope 3300 Imaging System | Clinx Science Instruments, Shanghai, China | Used for scanning developed films from Western blot analysis. | |
| ELISA kit for CK-MB detection | Nanjing Jiancheng Bioengeering Institute(Nanjing, China) | Used for detecting levels of cardiac injury indexes | |
| ELISA kit for cTn-T, ICAM-1, IL-1β, IL-6, TNF-α detection | CUSABIO Biotech CO., Ltd. (Wuhan, China) | Used for detecting levels of cardiac injury indexes and inflammatory cytokines in rat serum samples. | |
| FastQuant RT Kit | TIANGEN, Beijing China | Used for reverse transcription of cDNA. | |
| HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG | Thermo Scientific, Basingstoke, UK | ||
| LDH Assay kit and MDA Assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting LDH and MDA levels in myocardium tissues from the infarct area in the left ventricle. | |
| Munziq | provided by Xinjiang Medical University | The main investigational drug in this study | |
| NF-κB p65 (D14E12) XP Rabbit mAb #8242 | CST | 8242S | Used for protein detection in Western Blot (WB) experiments. |
| Nitric Oxide (NO) assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting NO levels at 550 nm in myocardial tissue. | |
| Phospho-NF-κB p65 (Ser536) (93H1) Rabbit mAb #3033 | CST | 3033S | Used for protein detection in Western Blot (WB) experiments. |
| Quantity One software | Bio-Rad Laboratories, Hercules, CA, USA | Used for analyzing Western blot images. | |
| Recombinant Anti-DRP1 Antibody | abcam | ab184247 | Used for protein detection in Western Blot (WB) experiments. |
| RIPA lysis buffer | Boster Biotechnology Co., Ltd., Wuhan, China | AR0105 | Used for extracting total proteins from rat ventricular tissues. |
| Secondary antibodies (HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG) | Thermo Scientific, Basingstoke, UK | Used for detection following primary antibody incubation in Western blot analysis. | |
| SYBR Select Master Mix | ABI, CA, USA | Used in qRT-PCR analysis on ABI 7500 Real-time PCR instrument. | |
| transmission electron microscope | HitachiS-2400 Hitachi, Tokyo, Japan | Used to examine thin sections of ventricular tissues. | |
| Trizol reagent | Invitrogen Co., Carlsbad, California, USA | Used for RNA extraction from ventricular tissues. |
Ссылки
- Anderson, J. L., Campion, E. W., Morrow, D. A. Acute myocardial infarction. New Engl J Med. 376 (21), 2053-2064 (2017).
- Vos, T., et al. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet. 396 (10258), 1204-1222 (2020).
- Murphy, A., Goldberg, S. Mechanical complications of myocardial infarction. Am J Med. 135 (12), 1401-1409 (2022).
- Heusch, G. Myocardial ischemia/reperfusion: Translational pathophysiology of ischemic heart disease. Medicine. 5 (1), 10-31 (2024).
- Bhatt, D. L., Lopes, R. D., Harrington, R. A. Diagnosis and treatment of acute coronary syndromes. Jama. 327 (7), 662-675 (2022).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: A target for cardioprotection. Cardiovasc Res. 115 (7), 1143-1155 (2019).
- Gunata, M., Parlakpinar, H. A review of myocardial ischaemia/reperfusion injury: Pathophysiology, experimental models, biomarkers, genetics and pharmacological treatment. Cell Biochem Funct. 39 (2), 190-217 (2020).
- He, J., et al. Myocardial ischemia/reperfusion injury: Mechanisms of injury and implications for management (review). Exp Ther Med. 23 (6), 430 (2022).
- Xiang, M., et al. Role of oxidative stress in reperfusion following myocardial ischemia and its treatments. Oxid Med Cell Longevity. 2021, 1-23 (2021).
- Astudillo, A. M., Balboa, M. A., Balsinde, J. Compartmentalized regulation of lipid signaling in oxidative stress and inflammation: Plasmalogens, oxidized lipids and ferroptosis as new paradigms of bioactive lipid research. Prog Lipid Res. 89, 101207 (2023).
- Algoet, M., et al. Myocardial ischemia-reperfusion injury and the influence of inflammation. Trends Cardiovasc Med. 33 (6), 357-366 (2023).
- Zhang, F., et al. Β-cryptoxanthin alleviates myocardial ischaemia/reperfusion injury by inhibiting nf-κb-mediated inflammatory signalling in rats. Arch Physiol Biochem. 128 (4), 1128-1135 (2020).
- Guo, Q., et al. Nf-κb in biology and targeted therapy: New insights and translational implications. Signal Transduct Target Ther. 9 (1), 53 (2024).
- Mi, J., et al. Inhibition of heat shock protein family a member 8 attenuates spinal cord ischemia-reperfusion injury via astrocyte nf-κb/nlrp3 inflammasome pathway. J Neuroinflammation. 18 (1), 170 (2021).
- Zhang, L., Zhao, S., Wang, Y. Diannexin alleviates myocardial ischemia-reperfusion injury by orchestrating cardiomyocyte oxidative damage, macrophage polarization and fibrotic process by tlr4-nf-kb-mediated inactivation of nlrp3 inflammasome. Int Immunopharmacol. 130, 111668 (2024).
- Zhou, Y., et al. Qingchang mixture prevents the intestinal ischemia-reperfusion injury through tlr4/nf-kb pathway. Combinatorial Chem High Throughput Screen. 26 (1), 49-57 (2023).
- Ozturk, A., et al. The protective effects of trimetazidine against ovary ischemia-reperfusion injury via the tlr4/nf-kb signal pathway. J Biochem Mol Toxicol. 36 (8), e23114 (2022).
- Du, S., Deng, Y., Yuan, H., Sun, Y. Safflower yellow b protects brain against cerebral ischemia reperfusion injury through ampk/nf-kb pathway. Evid Based Compl Alt Med. 2019, 1-11 (2019).
- Dong, X., et al. Physcion protects rats against cerebral ischemia-reperfusion injury via inhibition of tlr4/nf-kb signaling pathway. Drug Design Dev Therapy. 15, 277-287 (2021).
- Hashmi, S., et al. Hydrogen sulphide treatment prevents renal ischemia-reperfusion injury by inhibiting the expression of icam-1 and nf-kb concentration in normotensive and hypertensive rats. Biomolecules. 11 (10), 1549 (2021).
- Gao, L., et al. Hic-5 deficiency attenuates hepatic ischemia reperfusion injury through tlr4/nf-κb signaling pathways. Life Sciences. 249, 117517 (2020).
- Xu, Z., et al. Cardioprotection of mab2g4/odn/lip on myocardial ischemia-reperfusion injury via inhibiting the nf-κb signaling pathway. Cardiovas Ther. 2023, 1-15 (2023).
- Xiao, G., et al. Cxcr1 and its downstream nf-κb inflammation signaling pathway as a key target of guanxinning injection for myocardial ischemia/reperfusion injury. Front Immunol. 13, 1007341 (2022).
- Jeddi, S., Gheibi, S., Kashfi, K., Carlström, M., Ghasemi, A. Dose-dependent effects of long-term administration of hydrogen sulfide on myocardial ischemia-reperfusion injury in male wistar rats: Modulation of rkip, nf-κb, and oxidative stress. Int J Mol Sci. 21 (4), 1415 (2020).
- Yao, Y., et al. Targeting camkii-δ9 ameliorates cardiac ischemia/reperfusion injury by inhibiting myocardial inflammation. Circ Res. 130 (6), 887-903 (2022).
- Zhuang, L., Zong, X., Yang, Q., Fan, Q., Tao, R. Interleukin-34-nf-κb signaling aggravates myocardial ischemic/reperfusion injury by facilitating macrophage recruitment and polarization. eBioMedicine. 95, 104744 (2023).
- Maimaitiaili, A., et al. Effects of different doses of savda munziq on myocardial ischemia-reperfusion injury in rats with abnormal savda syndrome. Genet Mol Res. 13 (3), 4729-4735 (2014).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Hao, Y., et al. Transition of the abnormal savda syndrome to the hepatic carcinoma shifted unfolded protein response to autophagy was partly reversed by savda munziq in a rat model. Biomed Pharmacother. 121, 109643 (2020).
- Maimaitiaili, A., Li, J., Aibibula, A., Abudureheman, M. Erratum: Inhibition of nuclear factor kappa b pathway protects myocardial ischemia/reperfusion injury in rats under treatment with fufang munziq granule (munziq). Am J Transl Res. 10 (11), 3876 (2018).
- Zhang, X., et al. Rosa rugosa flavonoids alleviate myocardial ischemia reperfusion injury in mice by suppressing jnk and p38 mapk. Microcirculation. 24 (7), (2017).
- Dong, P., Liu, K., Han, H. The role of nf-κb in myocardial ischemia/reperfusion injury. Curr Prot Peptide Sci. 23 (8), 535-547 (2022).
- Guo, X., et al. Differential integrative omic analysis for mechanism insights and biomarker discovery of abnormal savda syndrome and its unique munziq prescription. Sci Rep. 6, 27831 (2016).
- Awad, A. S. Role of at1 receptors in permeability of the blood-brain barrier in diabetic hypertensive rats. Vascul Pharmacol. 45 (3), 141-147 (2006).
- La, X., et al. Upregulation of pd-1 on cd4(+)cd25(+) t cells is associated with immunosuppression in liver of mice infected with echinococcus multilocularis. Int Immunopharmacol. 26 (2), 357-366 (2015).
- Wu, T., et al. Circulating small extracellular vesicle-encapsulated sema5a-it1 attenuates myocardial ischemia-reperfusion injury after cardiac surgery with cardiopulmonary bypass. Cell Mol Biol Lett. 27 (1), 95 (2022).
- Pinto, A., et al. The extracellular isoform of superoxide dismutase has a significant impact on cardiovascular ischaemia and reperfusion injury during cardiopulmonary bypass. Eur J Cardio-Thor Surg. 50 (6), 1035-1044 (2016).
- Sabe, S. A., Harris, D. D., Broadwin, M., Sellke, F. W. Cardioprotection in cardiovascular surgery. Basic Res Cardiol. 119 (4), 545-568 (2024).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Mamtimin, B., et al. An magnetic resonance-based plasma metabonomic investigation on abnormal savda in different complicated diseases. J Tradl Chinese Med. 34 (2), 166-172 (2014).
- Marin, W., Marin, D., Ao, X., Liu, Y. Mitochondria as a therapeutic target for cardiac ischemia-reperfusion injury (review). Int J Mol Med. 47 (2), 485-499 (2020).
- Novack, V., et al. Troponin criteria for myocardial infarction after percutaneous coronary intervention. Arch Intern Med. 172 (6), 502-508 (2012).
- Kemp, M., Donovan, J., Higham, H., Hooper, J. Biochemical markers of myocardial injury. Br J Anaesth. 93 (1), 63-73 (2004).
- Zhang, D. Z., Jia, M. Y., Wei, H. Y., Yao, M., Jiang, L. H. Systematic review and meta-analysis of the interventional effects of resveratrol in a rat model of myocardial ischemia-reperfusion injury. Front Pharmacol. 15, 1301502 (2024).
- Ta, F. X., Zhang, T., Zhu, C. M. Correlation between mir-21 and the protective effects of resveratrol against myocardial ischemia/reperfusion injury in rats. Chin. J. Arteriosclerosis. 21 (6), 493-496 (2013).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. Am J Physiol Heart Circ Physiol. 314 (4), H812-H838 (2018).
- Oeckinghaus, A., Hayden, M. S., Ghosh, S. Crosstalk in nf-kappab signaling pathways. Nat Immunol. 12 (8), 695-708 (2011).
- Van Der Heiden, K., Cuhlmann, S., Luong Le, A., Zakkar, M., Evans, M. Role of nuclear factor kappab in cardiovascular health and disease. Clin Sci. 118 (10), 593-605 (2010).
- Ha, T., et al. Toll-like receptors: New players in myocardial ischemia/reperfusion injury. Antioxid Redox Signal. 15 (7), 1875-1893 (2011).
- Pourrajab, F., Yazdi, M. B., Zarch, M. B., Zarch, M. B., Hekmatimoghaddam, S. Cross talk of the first-line defense tlrs with pi3k/akt pathway, in preconditioning therapeutic approach. Mol Cell Ther. 3, 4 (2015).
- Wang, Y. H., et al. Lumbrokinase attenuates myocardial ischemia-reperfusion injury by inhibiting tlr4 signaling. J Mol Cell Cardiol. 99, 113-122 (2016).
- Yu, H., et al. Gypenoside protects cardiomyocytes against ischemia-reperfusion injury via the inhibition of mitogen-activated protein kinase mediated nuclear factor kappa b pathway in vitro and in vivo. Front Pharmacol. 7, 148 (2016).
- Liu, X., et al. Peroxisome proliferator-activated receptor gamma (ppargamma) mediates the protective effect of quercetin against myocardial ischemia-reperfusion injury via suppressing the nf-kappab pathway. Am J Transl Res. 8 (12), 5169-5186 (2016).
- Han, D., et al. Hydroxysafflor yellow a alleviates myocardial ischemia/reperfusion in hyperlipidemic animals through the suppression of tlr4 signaling. Sci Rep. 6, 35319 (2016).
- Yang, Q., He, G. W., Underwood, M. J., Yu, C. M. Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury: Perspectives and implications for postischemic myocardial protection. Am J Transl Res. 8 (2), 765-777 (2016).
- Valen, G., Paulsson, G., Vaage, J. Induction of inflammatory mediators during reperfusion of the human heart. Ann Thorac Surg. 71 (1), 226-232 (2001).
- Saini, H. K., et al. Role of tumour necrosis factor-alpha and other cytokines in ischemia-reperfusion-induced injury in the heart. Exp Clin Cardiol. 10 (4), 213-222 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены