Research Article
Il Munziq a base di erbe migliora il danno da ischemia-riperfusione miocardica inibendo l'infiammazione
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo studio indaga gli effetti cardioprotettivi di Munziq, un preparato erboristico tradizionale uiguro, sul danno da ischemia-riperfusione miocardica (MIRI) nei ratti con fluidi corporei anormali. Attraverso metodi sperimentali completi, dimostriamo il potenziale di Munziq nel mitigare la MIRI sopprimendo la via di segnalazione NF-κB.
Abstract
L'obiettivo di questo studio è stato quello di studiare gli effetti cardioprotettivi di Munziq sul danno anomalo da ischemia-riperfusione miocardica del fluido corporeo (MIRI) e il suo meccanismo sottostante. I ratti normali e i ratti con anomalie del fluido corporeo (ABF) sono stati pretrattati con Munziq per 21 giorni. In seguito, sono stati creati i modelli MIRI. I cambiamenti istopatologici e i cambiamenti dell'ultrastruttura miocardica sono stati osservati mediante colorazione con ematossilina ed eosina (HE) e microscopia elettronica a trasmissione per osservare le manifestazioni patologiche del danno miocardico. I livelli sierici di CK-MB, cTn-T e ICAM-1 sono stati rilevati mediante saggio di immunoassorbimento enzimatico (ELISA) per osservare i marcatori correlati al danno miocardico. I livelli di IL-1β, IL-6 e TNF-α nel siero e nel tessuto miocardico sono stati rilevati anche mediante ELISA per osservare l'effetto antinfiammatorio. I livelli di espressione delle proteine correlate alla via di segnalazione NF-κB NIK, IKKα, Pikα e p65 sono stati rilevati mediante analisi Western blot. I risultati hanno mostrato che il danno miocardico nel gruppo ABF MIRI era più grave rispetto al gruppo MIRI di controllo. Il pretrattamento con Munziq ha il potenziale per mitigare i cambiamenti patologici indotti dal danno da ischemia-riperfusione e potrebbe proteggere la funzione cardiaca. I livelli proteici della via NF-κB e degli effettori a valle IL-1β, IL-6 e TNF-α erano significativamente up-regolati nel gruppo MIRI mentre down-regolati nel gruppo Munziq. È interessante notare che c'era una maggiore attivazione della via di segnalazione NF-κB e livelli più elevati di citochine infiammatorie a valle nel gruppo ABF MIRI. I risultati suggeriscono che la MIRI era più grave nell'ABF. Munziq ha effetti cardioprotettivi nell'ischemia e nel danno da riperfusione. Questo effetto protettivo può essere agito sopprimendo la via di segnalazione NF-κB.
Introduzione
L'ischemia miocardica è una condizione in cui il miocardio non riceve un flusso sanguigno adeguato, causata principalmente da stenosi o trombosi delle arterie coronarie1, che può portare a esiti fatali per i pazienti 2,3. Poiché il metabolismo miocardico è quasi esclusivamente aerobico e contiene riserve di glicogeno molto limitate, è essenziale ripristinare prontamente l'afflusso di sangue, principalmente attraverso la PCI o la trombolisi endovenosa. Sebbene un'efficace riperfusione miocardica sia fondamentale per migliorare la prognosi del miocardio ischemico, introduce anche il rischio di danno da ischemia-riperfusione miocardica (MIRI)4,5,6. La MIRI è una sfida significativa che influisce sull'efficacia delle terapie di riperfusione miocardica7. Molteplici fattori e meccanismi contribuiscono allo sviluppo della MIRI. Ad esempio, nelle cellule endoteliali, la riperfusione induce un accumulo di specie reattive dell'ossigeno (ROS) e una deplezione degli scavenger dei radicali liberi, indicando la presenza di stress ossidativo 4,8. Questo stress ossidativo può successivamente innescare una risposta infiammatoria, portando a un maggiore rilascio di fattori infiammatori, a un aumento della produzione di molecole di adesione e al reclutamento di leucociti 9,10,11. Il fattore nucleare kappa-light-chain-enhancer delle cellule B attivate (NF-κB) svolge un ruolo cruciale nella risposta infiammatoria durante il danno da ischemia/riperfusione miocardica12. La famiglia dei fattori di trascrizione NF-κB comprende cinque membri: NF-κB1 (noto anche come p105/p50), NF-κB2 (noto anche come p100/p52), p65 (noto anche come RELA), RELB (l'omologo dell'oncogene virale della reticoloendoteliosio V-Rel) e c-REL13,14. È stato dimostrato che l'inibizione della via NF-κB allevia il danno da ischemia/riperfusione in vari tessuti, tra cui il miocardio 12,15, l'intestino16, l'ovaio17, il cervello18,19, i reni20 e il fegato21. In particolare, la via di segnalazione NF-κB è stata ampiamente documentata come mediatore cardine nella risposta miocardica all'ischemia e alla riperfusione12,14, i possibili meccanismi includono la promozione delle risposte infiammatorie, la regolazione dell'espressione delle molecole di adesione cellulare, la partecipazione alle reazioni di stress ossidativo e l'influenza della morte cellulare e delle vie di sopravvivenza 12,20,22,23,24,25. Gli interventi terapeutici volti ad attenuare l'attivazione di NF-κB hanno mostrato un potenziale significativo nell'alleviare il MIRI23,26.
La medicina uigura, parte integrante della medicina tradizionale cinese, si fonda sulla teoria dei quattro umori: fuoco, aria, acqua e terra. Questi umori danno origine a fluidi corporei come il sangue, il catarro, la bile gialla e la bile nera 27,28. Il mantenimento dell'omeostasi dinamica tra questi quattro fluidi corporei è fondamentale per la salute generale del corpo umano. Qualsiasi squilibrio in questi fluidi, indicato come fluidi corporei squilibrati, può provocare l'insorgenza di malattie. Tra i vari fluidi corporei squilibrati, quello predominante è noto come fluido corporeo anomalo (ABF), riconosciuto anche come sindrome di Savda anormale (ASS)27,28. Il münziq, una medicina tradizionale uigura ampiamente impiegata dai medici uiguri, è prescritta per il trattamento dei fluidi corporei anormali. Si tratta di un preparato medicinale a base di erbe che comprende dieci diverse specie medicinali, come indicato nel foglietto illustrativo, tra cui Cordia dichotoma Forst. f., Anchusaitalica Retz., Glycyrrhiza uralensis Fisch., Adiantum capillusveneris L., Euphorbia humifusa Willd., Ziziphus jujuba Mill., Lavandula angustifolia Mill., Foeniculum vulgare Mill., Melissa officinalis L. e Alhagi pseudoalhagi Desv29. Munziq è stato approvato dalla State Food and Drug Administration nel 2003 con il numero di codice Z65020166. I suoi componenti chimici attivi comprendono ottone, fenoli, acidi organici, aminoacidi, saponine, zucchero e altri. Munziq presenta molteplici effetti, tra cui effetti antiossidanti, antinfiammatori, immunoregolatori, antiaggreganti piastrinici e antitrombotici 27,28,30.
I nostri studi precedenti hanno dimostrato che il farmaco Munziq può alleviare il danno da ischemia/riperfusione miocardica (MIRI), sebbene i meccanismi specifici rimangano poco chiari. Sono stati dimostrati effetti protettivi miocardici di Munziq in ratti con danno da ischemia-riperfusione miocardica con sindrome di Savda anormale. L'inibizione della via del fattore nucleare kappa b protegge il danno da ischemia/riperfusione miocardica nei ratti in trattamento con Fufang Munziq granule (Munziq) 27,28,30. Tuttavia, c'è una ricerca limitata che indaga il ruolo e il meccanismo di Munziq nella MIRI.
Questo studio mira a indagare gli effetti cardioprotettivi di Munziq sul danno da ischemia-riperfusione miocardica (MIRI) nei ratti con anomalie del fluido corporeo (ABF) e ad esplorare i meccanismi sottostanti, concentrandosi in particolare sulla via di segnalazione NF-κB. L'ipotesi proposta in questo studio è che il pretrattamento con Munziq possa mitigare i cambiamenti patologici indotti da MIRI e proteggere la funzione cardiaca, potenzialmente sopprimendo la via di segnalazione NF-κB e le risposte infiammatorie a valle. L'ipotesi viene testata stabilendo modelli sham, danno da ischemia-riperfusione (MIRI) e danno da ischemia-riperfusione + Munziq sia nel gruppo di controllo che in quello ABF. Vengono monitorati la funzione cardiaca, gli indicatori correlati all'infiammazione e le proteine associate alla via NF-κB.
Protocollo
Il ratto maschio adulto di Sprague-Dawley (SD) del peso di 200-220 g è stato utilizzato in conformità con le linee guida del National Institutes of Health per la cura e l'uso degli animali da laboratorio. Centro sperimentale animale dell'Università di medicina dello Xinjiang. Modelli animali con fluidi corporei anormali (ABF) sono stati forniti dall'Experimental Animal Center della Xinjiang Medical University. I ratti sono stati tenuti in un ambiente secco-freddo come descritto in precedenza, che è essenziale per stabilire il modello di fluido corporeo anormale (ABF) nei ratti, secondo la teoria della medicina tradizionale uigura e come dimostrato in studi precedenti29,33. Tutti gli esperimenti sugli animali sono stati condotti secondo le linee guida etiche della Xinjiang Medical University e in conformità con le linee guida ARRIVE. Il protocollo per gli studi sugli animali vertebrati (ratti) è stato approvato dal comitato etico istituzionale della Xinjiang Medical University (IACUC-20200318-16).
1. Raggruppamento degli animali, somministrazione dei farmaci e istituzione del modello MIRI
- Assegnare in modo casuale i ratti ai seguenti sei gruppi: i) gruppo sham di controllo, ii) gruppo MIRI di controllo, iii) gruppo sham ABF, iv) gruppo ABF MIRI, v) gruppo MIRI di controllo + gruppo Munziq e vi) gruppo ABF MIRI + Munziq.
- Alloggiare i ratti del gruppo ABF in un ambiente controllato all'interno di scatole climatiche impostate a una temperatura compresa tra 6 °C ± 1 °C e un intervallo di umidità relativa compreso tra il 25% e il 32,8%. Fornire ai ratti mangime ordinario mescolato con cibo secco freddo, vale a dire semi di orzo e coriandolo in un rapporto di 7:1,5:1,5, e applicare questo metodo per 21 giorni per stabilire il modello ABF29,33.
- Somministrare per somministrazione intragastrica 5 g/kg di Munziq (5,0 g di Munziq disciolti in 1 ml di acqua distillata) al gruppo Munziq per 21 giorni prima dell'intervento chirurgico MIRI, che è il doppio della dose clinica efficace. Per gli animali non ABF, come i gruppi Control Sham, Control MIRI e Control MIRI + Munziq, somministrare un volume uguale di soluzione fisiologica normale al gruppo sham e al gruppo MIRI e fornire la somministrazione intragastrica di Munziq per il gruppo Munziq.
- Dopo 21 giorni di pretrattamento, stabilire il modello MIRI.
- Condurre l'intervento chirurgico in una sala operatoria dedicata agli animali dotata di materiali sterili per garantire un ambiente sterile. Anestetizzare i ratti con un'iniezione intraperitoneale (IP) di pentobarbital sodico (35 mg/kg); Osservare il rilassamento muscolare, la reattività agli stimoli esterni, la frequenza respiratoria e la profondità per valutare l'effetto anestetico. Monitorare questi parametri ogni 15 minuti durante la procedura. Se compaiono segni di anestesia inadeguata (tensione muscolare, risposta evidente agli stimoli, frequenza respiratoria aumentata o superficiale), somministrare una dose supplementare di 20 mg/kg. Mantenere l'anestesia durante l'intera procedura fino al prelievo finale del sangue. Durante la procedura, mantenere la temperatura corporea del ratto a 37 °C utilizzando un termoforo con monitoraggio continuo tramite una sonda di temperatura rettale. Applicare un unguento veterinario sugli occhi per prevenire la secchezza durante l'anestesia.
- Eseguire una tracheostomia per la respirazione assistita da ventilatore. Prima di aprire il torace per esporre il cuore, lavare il sito chirurgico con acqua saponata, radere l'area chirurgica e pulire l'area con soluzioni antisettiche come clorexidina e iodio. Utilizzare strumenti sterili per la procedura.
- Per aprire il torace ed esporre il cuore, utilizzare strumenti chirurgici toracici sterili standard, tra cui forbici, pinze e divaricatori. Apri la parete toracica ed esponi il cuore. Identificare l'arteria discendente anteriore sinistra (LAD) sotto visualizzazione diretta. È un ramo importante dell'arteria coronaria sinistra che si trova sulla superficie del cuore. Utilizzare una sutura 6-0 (4-5 cm), legare il LAD (discendente anteriore sinistro) per 30 minuti per indurre l'ischemia regionale. Determinare l'occlusione LAD efficace osservando un colore pallido nel miocardio.
- Dopo 30 minuti di legatura, rilasciare la legatura ed eseguire la riperfusione per 120 minuti. Determinare la riperfusione del miocardio quando si riprende in un colore rosso vivo. Nei ratti con operazione fittizia, eseguire la stessa procedura ma senza legatura della LAD.
- Dopo la riperfusione, i ratti sono rimasti sotto anestesia indotta dal pentobarbital sodico (35 mg/kg, ip)34. Una volta che i ratti sono in anestesia profonda, raccogliere 1-2 ml di campioni di sangue dall'aorta addominale utilizzando una provetta per la raccolta del sangue sottovuoto.
- Dopo la raccolta del campione di sangue dall'aorta addominale, sopprimere i ratti mediante lussazione cervicale mentre sono ancora in anestesia profonda. Raccogliere il tessuto del miocardio dall'area dell'infarto nel ventricolo sinistro utilizzando pinze e forbici sterili, assicurandosi di prelevare solo il tessuto che appare pallido e danneggiato, che indica la regione infartuata. Mettere il tessuto raccolto in un contenitore sterile per ulteriori analisi.
2. Raccolta dei campioni
- Raccolta del campione di tessuto: utilizzando forbici sterili e una lama sterile, sezionare il cuore orizzontalmente in due metà lungo il punto medio dell'asse lungo del ventricolo sinistro, perpendicolare alla direzione del cuore. Dividere una metà della parte apicale in due porzioni: conservarne una in paraformaldeide al 4% per l'esame morfologico a temperatura ambiente o a 4 °C per 2-24 ore, e l'altra in glutaraldeide per microscopia elettronica a 4 °C per 1-4 ore.
- Dividere la parte base del cuore, comprese le aree ischemiche e non ischemiche, in due porzioni: posizionare una porzione in un crioviale, congelare rapidamente il tessuto in azoto liquido e quindi trasferirlo in un congelatore a bassissima temperatura a -80 °C per i test di biologia molecolare. Utilizzare l'altra porzione fresca per la rilevazione dei livelli di specie reattive dell'ossigeno (ROS) nei tessuti e l'estrazione mitocondriale.
- Raccolta del campione di siero: Al termine dell'esperimento, prelevare 1-2 ml di sangue venoso dalla vena cava inferiore, centrifugare a 1000 x g per 10 minuti e conservare il siero in un congelatore a bassissima temperatura a -80 °C dopo la separazione.
3. Colorazione HE e osservazione al microscopio elettronico a trasmissione
- Eseguire la colorazione HE (colorazione ematossilina-eosina) sul miocardio ventricolare secondo la procedura di routine35. Fissare i tessuti in paraformaldeide al 4% per 24 ore. Incorporare i campioni nella paraffina, tagliarli in sezioni spesse 4 μm e colorarli utilizzando il metodo di colorazione con ematossilina-eosina secondo il protocollo. Seleziona casualmente cinque campi per osservare i cambiamenti istopatologici al microscopio.
- Processare i tessuti miocardici di ratti che sono stati fissati in formalina, di ciascun gruppo, per esperimenti di colorazione HE seguendo i passaggi seguenti.
- Mettere le sezioni di tessuto in un'incubatrice a 65 °C per la cottura per 1,5-2.
- Immergere le sezioni di tessuto nello xilene per 10 minuti, sostituire lo xilene e immergere nuovamente per altri 10 minuti. Immergere in sequenza in alcol anidro I e II per 5 minuti ciascuno, seguiti da alcol al 95%, 90%, 80% e 70% e acqua distillata per 5 minuti ciascuno.
- Colorare con ematossilina per 3 min. Eseguire la differenziazione acida con acido cloridrico aggiunto ad alcool per alcuni secondi (1-2 s). Terminare la differenziazione in acqua di rubinetto per 5 min.
- Immergere in acqua distillata, alcol al 70%, 80%, 90% e 95% per 3 minuti ciascuno e alcol anidro I e II per 5 minuti ciascuno.
- Colorare con lo 0,5% di eosina in etanolo per 1 minuto, sciacquare le sezioni in etanolo al 95% per rimuovere il colore rosso in eccesso, quindi immergere in etanolo anidro per 5 minuti. Immergere in xilene I e II per 5 minuti ciascuno.
- Monta con balsamo neutro. Osservare i cambiamenti patologici del tessuto al microscopio.
4. Rilevamento ELISA di citochine ematiche e indici di danno cardiaco
- Ottenere un campione di siero di ratto dal sangue periferico centrifugando a 1000 x g per 10 minuti e conservare a -80 °C. Rileva i livelli di indici di danno cardiaco come CK-MB, cTn-T, ICAM-1 e citochine infiammatorie come IL-1β, IL-6, TNF-α nel siero utilizzando i kit ELISA secondo le istruzioni del produttore e come descritto di seguito.
- Lasciare che tutti i reagenti si equilibrino a temperatura ambiente (18-25 °C) per almeno 30 minuti, preparare i reagenti secondo le istruzioni del produttore e tenerli pronti per l'uso.
- Impostare pozzetti standard e campioni, in cui i pozzetti standard contengono concentrazioni note di soluzioni standard fornite nel kit di analisi. Questi vengono utilizzati per stabilire una curva standard durante l'esperimento per quantificare la concentrazione specifica dell'analita nei campioni da testare. Aggiungere 100 μl di standard o campione in ciascun pozzetto, mescolare delicatamente agitando, coprire con un sigillo a piastra e incubare a 37 °C per 2 ore.
- Scartare il liquido, asciugare con decantazione e non lavare. Aggiungere 100 μl di soluzione di lavoro di anticorpi marcati con biotina (pre-diluita 1:100) a ciascun pozzetto, coprire con un nuovo sigillo per piastra e incubare a 37 °C per 1 ora.
- Scartare il liquido dai pozzetti, asciugare con decantazione e lavare la piastra 3 volte. Immergere per 2 minuti per lavaggio, 200 μl per pozzetto e asciugare decantando.
- Aggiungere 100 μL di soluzione di lavoro per streptavidina marcata con perossidasi di rafano in ciascun pozzetto, coprire con un nuovo sigillo per piastra e incubare a 37 °C per 1 ora.
- Scartare il liquido dai pozzetti, asciugare con decantazione e lavare la piastra 5 volte. Immergere per 2 minuti per lavaggio, 200 μl per pozzetto e asciugare decantando.
- Aggiungere in sequenza 90 μL di soluzione di substrato a ciascun pozzetto e sviluppare il colore al buio a 37 °C per 15-30 minuti.
- Aggiungere in sequenza 50 μL di soluzione di arresto a ciascun pozzetto per terminare la reazione. Entro 5 minuti dall'arresto della reazione, misurare la densità ottica (valori OD) di ciascun pozzetto in sequenza a 450 nm utilizzando un lettore di micropiastre.
5. Misura dei livelli di MDA, NO e LDH
- Dopo la riperfusione, raccogliere il tessuto del miocardio (5 mm x 7 mm) dall'area dell'infarto nel ventricolo sinistro. Rilevare LDH (lattato deidrogenasi) e MDA (malondialdeide) utilizzando il kit per il dosaggio LDH e il kit per il dosaggio MDA, seguendo le istruzioni del produttore. Rilevare l'NO a 550 nm utilizzando il kit per il dosaggio dell'ossido nitrico (NO) secondo le istruzioni del produttore.
6. Analisi del Western blot
- Estrarre le proteine totali dai tessuti ventricolari di ratto utilizzando la lisi RIPA. Determinare la concentrazione proteica utilizzando il kit per il dosaggio delle proteine BCA.
- Per preservare le proteine intracellulari e prevenire la degradazione cellulare, immergere i campioni in azoto liquido per congelarli rapidamente. Successivamente, recuperare i campioni congelati e macinarli in polvere, prelevare circa 100 mg di campione e aggiungerli a una provetta da centrifuga da 1,5 ml pre-raffreddata. Aggiungere 400 μl di tampone di lisi RIPA (integrare con inibitori della proteasi e un inibitore della fosfatasi ad ampio spettro), quindi mescolare accuratamente e lasciare riposare la miscela a 4 °C per 60 minuti.
- Centrifugare la miscela a 1000 x g per 15 min a 4 °C. Raccogliere il surnatante e misurare la concentrazione proteica utilizzando il metodo BCA.
- Diluire gli standard BSA con un diluente che corrisponda al sistema tampone dei campioni, secondo la Tabella 1.
- Preparare i reagenti secondo le istruzioni del produttore. In base al numero di campioni, miscelare i reagenti A e B in un rapporto di volume di 50:1 per preparare una quantità adeguata di soluzione di lavoro BCA e mescolare accuratamente. Prima di preparare la soluzione di lavoro BCA, agitare il reagente A per mescolare bene.
- Prelevare 20 μl di soluzione standard BSA appena preparata e campioni diluiti (diluiti 10 volte) dalla Tabella 1 e aggiungerli a una piastra a 96 pozzetti.
- Aggiungere 200 μl di soluzione di lavoro BCA in ciascun pozzetto e mescolare accuratamente. Sigillare la piastra, incubare a 37 °C per 30 minuti, quindi raffreddare a temperatura ambiente o porre a temperatura ambiente per 2 minuti.
- Misurare l'assorbanza a 562 nm utilizzando un lettore di micropiastre e calcolare la concentrazione proteica nei campioni in base alla curva standard.
- Aggiungere ai campioni una quantità appropriata di 5 tamponi di caricamento SDS-PAGE (contenenti β-mercaptoetanolo), trattare termicamente a 100 °C in acqua bollente per 5 minuti per denaturare completamente le proteine, centrifugare a 1.000 x g per 5 minuti e prelevare il surnatante per l'uso.
- La formula nella Tabella 2 delinea la preparazione di gel separatori al 15%, 12% e 8%, nonché di un gel impilabile al 5%. Prepara le soluzioni di conseguenza. Aggiungere la soluzione di gel separatore a un'altezza di 2/3 nella cassetta del gel, sovrapporla con acqua distillata e lasciarla riposare a temperatura ambiente per 40 minuti. Quindi, aggiungi il gel impilabile per riempire la cassetta, inserisci il pettine e lascialo riposare per 10 minuti.
- Caricare 9 μL di marcatore proteico precolorato in ciascun pozzetto e caricare 50 μg di proteina campione per pozzetto.
- Applicare una tensione costante di 80 V fino a quando il blu di bromofenolo raggiunge il gel separatore, quindi applicare una tensione costante di 100 V per 90 minuti. Interrompere l'elettroforesi quando il blu di bromofenolo è migrato nella parte inferiore del gel.
- Dopo il completamento di SDS-PAGE, immergere la membrana PVDF in metanolo per 10 s, sciacquare in acqua distillata per 1 minuto, quindi immergere il gel di poliacrilammide, la carta da filtro e la membrana PVDF trattata nel tampone di trasferimento per 10 minuti.
- Assemblare il sandwich di trasferimento con il lato nero delle clip rivolto verso il basso, seguito da una spugna-carta da filtro-gel-membrana PVDF-carta da filtro-spugna-lato trasparente. Posizionare le clip nella cassetta di trasferimento, assicurandosi che il lato nero della clip sia rivolto verso il lato nero della cassetta e il lato bianco sia rivolto verso il lato rosso. Eseguire il trasferimento a una tensione costante di 100 V e utilizzare una membrana in PVDF con un tempo di trasferimento di 60 min.
- Dopo il trasferimento, lavare la membrana in PVDF con acqua 3 volte per 5 minuti ciascuna. Bloccare la membrana con una soluzione bloccante contenente il 5% di latte scremato in polvere per 1 ora, quindi lavare con TBST 3 volte per 5 minuti ciascuno.
- Diluire l'anticorpo primario con TBST secondo i rapporti di diluizione elencati nella Tabella 3 e incubare a 4 °C per una notte. Gli anticorpi primari includono l'anticorpo anti-NF-κB p65, l'anticorpo anti-NF-κB Inducing Kinase (NIK), l'anticorpo anti-IKKα e l'anticorpo anti-β-actina.
- Sciacquare la membrana 3 volte con 1 TBST per 5 minuti ciascuna. Aggiungere l'anticorpo secondario opportunamente diluito (come da Tabella 3) e incubare a temperatura ambiente per 1 ora. Gli anticorpi secondari sono le IgG anti-topo di capra coniugate con HRP e le IgG anti-coniglio di capra coniugate con HRP.
- Risciacquare nuovamente la membrana con 1x TBST 3x per 5 minuti ciascuno. Mescolare le soluzioni di sviluppo A e B, aggiungere 2 mL alla membrana e rilevare e fotografare utilizzando il mini strumento a chemiluminescenza.
- Sviluppare la membrana utilizzando la chemiluminescenza potenziata più il reagente. Scansiona la pellicola sviluppata utilizzando il sistema di imaging. Analizza le immagini del Western blot utilizzando il software. Utilizzare β-actina come controllo del caricamento. Calcola il livello proteico relativo in base al valore di grigio della β-actina.
7. Analisi PCR in tempo reale (qRT-PCR)
- Estrazione dell'RNA totale
- Preparare una soluzione DEPC allo 0,1% e alcol trattato con DEPC al 70% secondo le istruzioni del produttore. Trattare provette per microcentrifuga di tutte le dimensioni e vari tipi di puntali per pipette con una soluzione DEPC allo 0,1%. Immergere per una notte, quindi sterilizzare in autoclave.
- Raccogli le cellule nella fase di crescita logaritmica con un buon stato di crescita. Eliminare il terreno di coltura dal pallone di coltura cellulare e lavare le cellule 2 volte con la soluzione di Hank. Aggiungere 1 mL di tripsina per 10 cm² di cellule, agitare delicatamente per staccare le cellule e utilizzare una pipetta per garantire il completo distacco. Incubare a temperatura ambiente per 5 minuti per consentire la lisi completa, quindi pipettare su e giù 7x-10x per distruggere completamente le cellule. Trasferire il lisato in provette da 1,5 mL, centrifugare e conservare il surnatante.
- Aggiungere un volume uguale di cloroformio al surnatante, mescolare bene e lasciare riposare a temperatura ambiente per 10 minuti. Centrifugare a 4 °C per 5 minuti a 1.000 x g per separare le fasi. Trasferire con cura la fase acquosa superiore in una nuova provetta (se si estraggono DNA e proteine, conservare la fase inferiore e conservarla a 4 °C).
- Aggiungere l'isopropanolo (0,5 ml per 1 ml di trizolo), mescolare bene e lasciare riposare a temperatura ambiente per 10 minuti. Centrifugare a 4 °C per 10 minuti a 1.000 x g, rimuovere delicatamente il surnatante ed eliminarlo.
- Lavare il pellet di RNA con etanolo al 75%, centrifugare a 4 °C per 5 minuti a 8.000 x g, rimuovere delicatamente il surnatante e asciugare il pellet all'aria o sottovuoto. Sciogliere l'RNA in 50 μL di acqua DEPC, aliquotare e conservare a -70 °C o procedere alla trascrizione inversa in cDNA.
- Trascrizione inversa in cDNA
- Eseguire la trascrizione inversa del cDNA utilizzando un kit seguendo le istruzioni del produttore.
- PCR quantitativa in tempo reale
- Progetta primer basati su sequenze geniche e controllali utilizzando BLAST sul sito web dell'NCBI. Preparare soluzioni stock da 10 μM di primer diretti e inversi per CK20 e β-actina. La Tabella 4 mostra le sequenze di primer.
- PCR quantitativa in tempo reale
- Aggiungere 1 μL di cDNA, 10 μL di 2x master mix, 0,4 μL di primer diretto e inverso ciascuno e 8,2 μL di acqua priva di RNasi nel sistema di reazione.
- Eseguire la PCR con il seguente programma: Denaturazione iniziale a 95 °C per 2 minuti, seguita da 40 cicli a 95 °C per 15 s e 60 °C per 1 minuto. Utilizzare la β-actina come controllo interno. Calcola l'espressione relativa utilizzando il metodo 2-ΔΔCt .
8. Analisi statistica
- Utilizzare un software commerciale per l'analisi statistica. Presenta i dati come media ± deviazione standard (media ± SD). Eseguire l'ANOVA unidirezionale per confrontare le differenze tra i diversi gruppi. Definisci una differenza significativa come p < 0,05.
Risultati
Munziq mitiga le alterazioni patologiche indotte dal danno da ischemia-riperfusione
Per esaminare le alterazioni morfologiche nei tessuti miocardici, abbiamo inizialmente condotto la colorazione HE. Come colorazione HE rappresentativa mostrata nella Figura 1, abbiamo osservato la degenerazione granulare e la degenerazione vacuolare in alcune cellule miocardiche del gruppo sham. Inoltre, c'era una presenza limitata di globuli rossi e infiltrazione di linfociti tra le cellule del miocardio. Periodicamente, abbiamo osservato dilatazione e congestione vascolare. I tessuti miocardici del gruppo MIRI hanno mostrato una compromissione più grave e hanno manifestato cambiamenti morfologici più pronunciati. Questi cambiamenti includevano un'estesa degenerazione granulare, degenerazione vacuolare, infiltrazione di globuli rossi e linfociti, dilatazione vascolare e congestione. Il danno del tessuto miocardico nel gruppo ABF MIRI è stato più grave rispetto a quello osservato nel gruppo MIRI di controllo. Tuttavia, in entrambi i gruppi Munziq, alcune cellule miocardiche hanno mostrato una lieve degenerazione granulare e degenerazione vacuolare. La presenza di globuli rossi e infiltrazione di linfociti, dilatazione vascolare e congestione erano scarse. Inoltre, i risultati indicano che Munziq mostra effetti cardioprotettivi superiori nei ratti ABF MIRI e nei ratti MIRI di controllo. In conclusione, questi risultati suggeriscono che il pretrattamento con Munziq ha il potenziale per mitigare i cambiamenti patologici indotti dal danno da ischemia-riperfusione nel cuore.
Munziq ha migliorato la rottura dei mitocondri e delle fibre muscolari cardiache indotta da lesioni da ischemia/riperfusione
Per verificare ulteriormente il ruolo protettivo di Munziq nel danno MIRI, abbiamo esaminato l'ultrastruttura mitocondriale e le fibre muscolari cardiache utilizzando TEM. Come illustrato nella Figura 2, le cellule miocardiche nel gruppo sham mostravano una struttura intatta con miofibrille strettamente disposte e lunghezza del sarcomero simile. La struttura del miofilamento appariva chiara e leggermente allentata, mentre è stato osservato un gran numero di mitocondri. Al contrario, il gruppo MIRI ha mostrato caratteristiche patologiche indicative di cellule miocardiche danneggiate, tra cui gonfiore cellulare, lunghezza variabile del sarcomero, struttura del miofilamento poco chiara e disposta in modo lasco. È stato notato che c'era un'ampia interruzione e dissoluzione dei mitocondri nel gruppo I/R rispetto al gruppo fittizio. Inoltre, le fibre muscolari cardiache erano irregolari e fratturate in risposta alla lesione I/R. È interessante notare che la gravità di questi cambiamenti era notevolmente più elevata nel gruppo ABF MIRI. Al contrario, entrambi i gruppi trattati con Munziq hanno mostrato caratteristiche patologiche alleviate associate a cellule miocardiche danneggiate. Il gonfiore delle cellule miocardiche era ridotto e le strutture delle miofibrille, del sarcomero, del miofilamento e il numero di mitocondri erano simili a quelle osservate nel gruppo fittizio. Collettivamente, questi dati hanno indicato che il pretrattamento con Munziq potrebbe mitigare l'interruzione dei mitocondri e delle fibre muscolari cardiache indotta dalla chirurgia I/R.
Il danno da ischemia-riperfusione miocardica esacerbato nel ratto ABF MIRI e Munziq pretrattamento proteggeva la funzione cardiaca
I livelli sierici di cTn-T, CK-MB e ICAM-1 sono stati rilevati utilizzando il metodo ELISA. I risultati non hanno rivelato disparità evidenti tra il gruppo di controllo sham e il gruppo ABF sham. Tuttavia, è interessante notare che il gruppo ABF MIRI ha mostrato livelli significativamente elevati di cTn-T (Figura 3A), CK-MB (Figura 3B) e ICAM-1 (Figura 3C) rispetto al gruppo MIRI di controllo. Al fine di valutare gli effetti cardioprotettivi di Munziq, sia i ratti MIRI di controllo, sia i ratti ABF MIRI sono stati sottoposti a pretrattamento con Munziq. Come dimostrato nella Figura 3, i livelli di cTn-T, CK-MB e ICAM-1 erano notevolmente ridotti nel gruppo di pretrattamento Munziq. Questi risultati suggeriscono che Munziq mostra notevoli proprietà cardioprotettive nei ratti ABF MIRI.
Per studiare l'effetto del pretrattamento con Munziq sul danno da stress ossidativo indotto da riperfusione ischemica nei ratti ABF e di controllo, sono state misurate le variazioni di LDH, MDA e NO nel tessuto miocardico. Come mostrato nella Figura 3D,F, il gruppo ABF MIRI ha mostrato livelli significativamente elevati di MDA e livelli significativamente ridotti di NO rispetto al gruppo MIRI di controllo. Il pretrattamento con Munziq ha ridotto significativamente il contenuto di LDH e MDA nel miocardio ischemico. Allo stesso tempo, il pretrattamento con Munziq ha ulteriormente aumentato il livello di NO nel tessuto miocardico.
Il pretrattamento con Munziq ha mitigato l'infiammazione della MIRI ostacolando la produzione di citochine pro-infiammatorie
Le citochine pro-infiammatorie svolgono un ruolo critico nel mediare la risposta immunitaria innata e le citochine pro-infiammatorie sono state attivate durante MIRI31. Per studiare ulteriormente l'effetto antinfiammatorio di Munziq, sia i ratti MIRI di controllo che i ratti ABF MIRI sono stati sottoposti a pretrattamento con Munziq. Abbiamo utilizzato il metodo ELISA per misurare i livelli sierici di IL-1β, IL-6 e TNF-α e l'analisi qRT-PCR per valutare i livelli di mRNA di IL-1β, IL-6 e TNF-α nel tessuto miocardico. I risultati non hanno rivelato differenze significative in questi livelli di citochine tra il gruppo sham di controllo e il gruppo sham ABF. I livelli di IL-1β, IL-6 e TNF-α erano significativamente sovraregolati nel gruppo ABF MIRI rispetto al gruppo MIRI di controllo. In particolare, l'IL-1β ha mostrato un aumento significativo sia a livello di mRNA che di proteine, con una differenza statisticamente significativa osservata. Sebbene non vi fosse alcuna differenza nel livello di mRNA per IL-6, è stata riscontrata una disparità a livello proteico. Allo stesso modo, il TNF-α non ha mostrato alcuna variazione nei livelli di mRNA, ma ha mostrato differenze a livello proteico. Come illustrato nella Figura 4, i livelli di IL-1β, IL-6 e TNF-α sono diminuiti notevolmente nel gruppo di pretrattamento Munziq.
Il pretrattamento con Munziq ha mitigato l'infiammazione attraverso la via del segnale NF-κB
La produzione di citochine è strettamente connessa con l'attivazione delle vie di segnalazione NF-κB nella maggior parte degli stadi della risposta infiammatoria. NF-κB è considerato un potenziale bersaglio terapeutico per le malattie infiammatorie32. Per valutare se la via NF-κB è implicata negli effetti anti-infiammatori di Munziq, abbiamo inizialmente condotto un'analisi Western Blot per misurare i livelli di espressione dei costituenti chiave della via NF-κB, tra cui NIK, IKKα, pIKKα e p6513. Come illustrato nella Figura 5, il danno ischemico e da riperfusione ha indotto una notevole sovraregolazione di NIK, p-IKKα e p-p65 all'interno del gruppo MIRI. Il trattamento con Munziq ha attenuato efficacemente questa sovraregolazione. I risultati hanno indicato che Munziq svolge un ruolo critico nell'antinfiammatorio sopprimendo l'attivazione della via di segnalazione NF-κB.
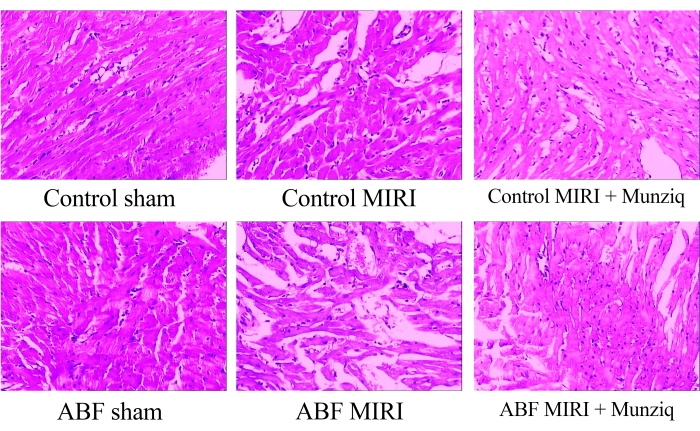
Figura 1: Cambiamenti morfologici dei tessuti miocardici osservati mediante colorazione HE. Immagini rappresentative di colorazione HE di diversi gruppi. Ingrandimento: 100x. Abbreviazioni: ABF = fluido corporeo anormale; MIRI = Danno da ischemia-riperfusione miocardica; (n=6). Clicca qui per visualizzare una versione più grande di questa figura.
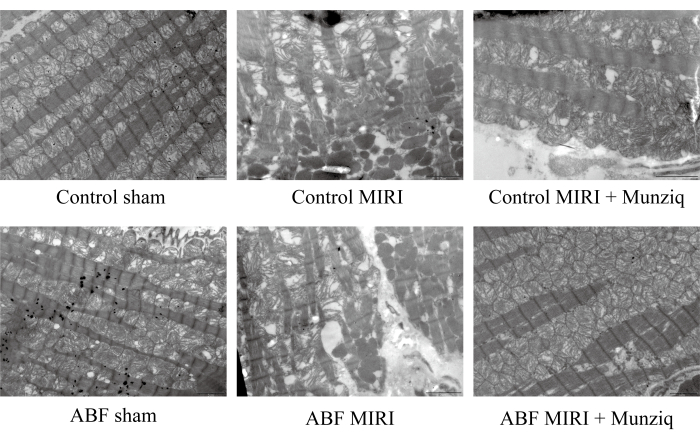
Figura 2: Munziq ha migliorato la distruzione dei mitocondri e delle fibre muscolari cardiache indotta dalla lesione I/R. Il microscopio elettronico a scansione è stato eseguito per osservare l'ultrastruttura dei mitocondri e i cambiamenti delle fibre muscolari cardiache. Sono state mostrate immagini rappresentative. Barra graduata: 5 μm; (n=3). Clicca qui per visualizzare una versione più grande di questa figura.
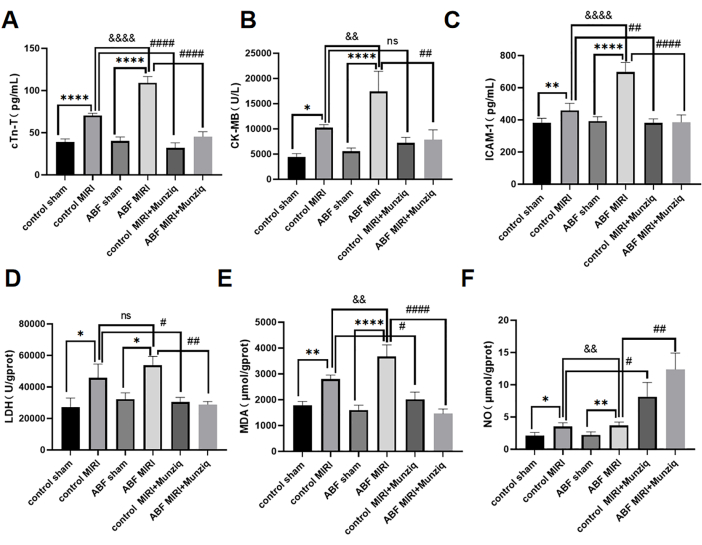
Figura 3: Il danno da ischemia-riperfusione miocardica esacerbato nei ratti ABF MIRI e il pretrattamento con Munziq potrebbe proteggere la funzione cardiaca. (A) CTn-T sierico, (B) CK-MB e (C) ICAM-1. I livelli sono stati rilevati mediante ELISA e le variazioni di LDH, MDA e NO sono state misurate nel tessuto miocardico (n=6). *p<0,05, ** p<0,01, ***p<0,001, ****p<0,0001 Rispetto al gruppo fittizio; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 Rispetto al gruppo MIRI; &p<0,05, && p<0,01, &&p<0,001, &&&p<0,0001 Rispetto al gruppo di controllo. I dati sono presentati come media ± SD. L'analisi statistica è stata eseguita utilizzando ANOVA unidirezionale. Clicca qui per visualizzare una versione più grande di questa figura.
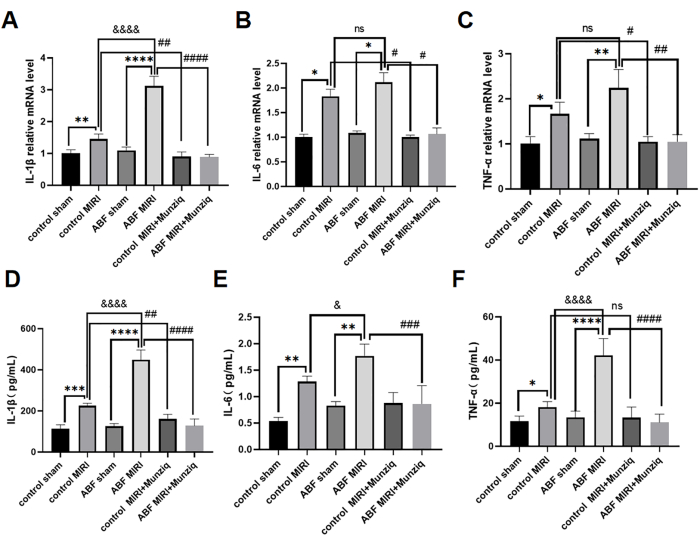
Figura 4: Il pretrattamento con Munziq ha mitigato l'infiammazione del MIRI prevenendo la produzione di citochine pro-infiammatorie. La qRT-PCR ha rilevato i livelli di mRNA di (A) IL-1β, (B) IL-6 e (C) TNF-α nel tessuto miocardico. Misurare i livelli di (D) IL-1β, (E) IL-6 e (F) TNF-α nel siero mediante ELISA (n=6). *p<0,05, ** p<0,01, ***p<0,001, ****p<0,0001 Rispetto al gruppo fittizio; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 Rispetto al gruppo MIRI; &p<0,05, && p<0,01, &&p<0,001, &&&p<0,0001 Rispetto al gruppo di controllo. I dati sono presentati come media ± SD. L'analisi statistica è stata eseguita utilizzando ANOVA unidirezionale. Clicca qui per visualizzare una versione più grande di questa figura.
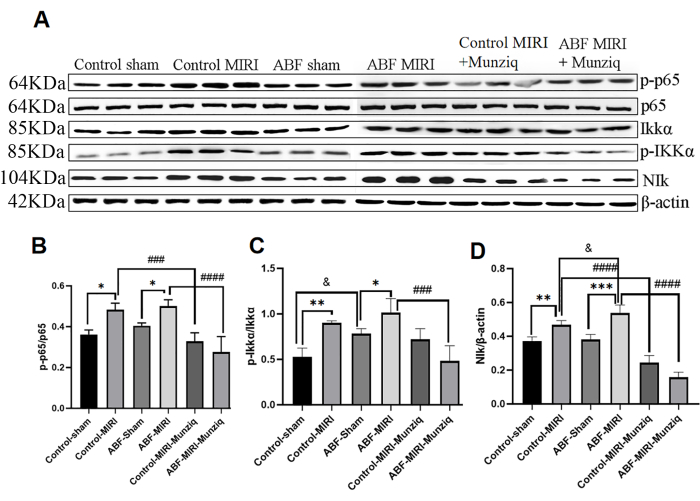
Figura 5: Il pretrattamento con Munziq ha mitigato l'infiammazione attraverso la via del segnale NF-κB. L'espressione delle proteine p-IKKα, IKKα, p-p65, p65 e NIk nel tessuto miocardico è stata rilevata mediante Western blot (N = 3 per ciascun gruppo). (A) Le bande proteiche osservate nell'analisi Western blot. (B-D) Il livello di espressione relativo viene determinato in base al valore di grigio. *p<0,05, ** p<0,01, ***p<0,001, ****p<0,0001 Rispetto al gruppo fittizio; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 Rispetto al gruppo MIRI; &p<0,05, && p<0,01, &&&p<0,001, &&&p<0,0001 Rispetto al gruppo di controllo. I dati sono presentati come media ± SD. L'analisi statistica è stata eseguita utilizzando ANOVA unidirezionale. Clicca qui per visualizzare una versione più grande di questa figura.
| Numero di tubo | Volume del diluente (mL) | Volume BSA (Fonte) | Concentrazione finale di BSA (mg/mL) |
| Un | 0 | 20 (soluzione madre) | 500 |
| B | 2 | 18 (soluzione madre) | 400 |
| C | 4 | 16 (soluzione madre) | 300 |
| D | 6 | 14 (soluzione madre) | 200 |
| E | 8 | 12 (soluzione madre) | 150 |
| F | 12 | 8 (soluzione madre) | 100 |
| G | 16 | 4 (soluzione madre) | 50 |
| H | 20 | 0 (soluzione stock) | 0 |
Tabella 1: Tabella di preparazione della concentrazione standard BSA.
| Gel separatori | 15% Gel Impilabile | 12% Gel Impilabile | 8% Gel Impilabile | 5% Gel Impilabile | |
| Reagenti | Volume | Volume | Volume | Reagenti | Volume |
| Acqua deionizzata (mL) | 2.76 | 3.96 | 5.52 | Acqua deionizzata (mL) | 4 |
| 30% acrilammide (mL) | 6 | 4.8 | 3.24 | 30% acrilammide (mL) | 1 |
| 1,5mol/lTris.HCl(PH8,8)(mL) | 3 | 3 | 3 | 1,0 M Tris.HCl (pH 6,8; mL) | 1 |
| 10% SDS(μL) | 120 | 120 | 120 | 10% SDS(μL) | 80 |
| 10% AP (μL) | 120 | 120 | 120 | 10% AP (μL) | 60 |
| TEMED(μL) | 4.8 | 4.8 | 7.2 | TEMED(μL) | 8 |
| Volume totale (mL) | 12 | 12 | 12 | Volume totale (mL) | 6 |
Tabella 2: Preparazione della concentrazione di gel.
| Anticorpi primari | Rapporto di diluizione | Anticorpi secondari | Rapporto di diluizione |
| β-actina | 1:1000 | Capra anti-Topo IgG H&L (HRP) | 1:15000 |
| p65 | 1:1000 | Capra anti-Coniglio IgG H&L (HRP) | 1:5000 |
| P-P65 | 1:300 | 1:5000 | |
| BCL-2 | 1:1000 | 1:5000 | |
| BAX | 1:1000 | 1:5000 | |
| Drp1 | 1:800 | 1:5000 | |
| Fis1 | 1:1000 | 1:5000 | |
| MFN2 | 1:800 | 1:5000 |
Tabella 3: Rapporti di diluizione degli anticorpi.
| Gene | Sequenza di primer (da 5' a 3') | ||
| IL-1β-F | CTGTGACTCGTGGGATGATG | ||
| IL-1β-R | GGGATTTTGTCGTTGCTTGT | ||
| TNF-α-F | GCCTCCTCTCTGCCATCAAG | ||
| TNF-α-R | CTCCAAAGTAGACCTGCCCG | ||
| IL-6-F | GCCCACCAGGAACGAAAGTC | ||
| IL-6-R | GGCAACTGGCTGGAAGTCTC | ||
| beta actina-F | CCCATCTATGAGGGTTACGC | ||
| beta actina-R | TTTAATGTCACGCACGATTTC | ||
Tabella 4: Sequenze di primer.
Discussione
La MIRI, acronimo di lesione da ischemia-riperfusione miocardica, è una complicanza comune e significativa che si verifica dopo la riperfusione miocardica in cardiochirurgia36,37, pochi farmaci o adiuvanti hanno esiti clinici definitivamente migliorati rispetto ai controlli contemporanei38. Pertanto, c'è un urgente bisogno di terapie efficaci per proteggere il cuore da tali lesioni. Munziq, un preparato erboristico tradizionale, ha dimostrato alcuni effetti terapeutici sul danno da ischemia-riperfusione cardiaca 27,28,30. Tuttavia, questi risultati sono preliminari e i meccanismi sottostanti rimangono sconosciuti. Lo scopo di questo studio è stato quello di indagare e convalidare ulteriormente gli effetti e i meccanismi protettivi di Munziq sulla MIRI.
Il fluido corporeo anormale è indicato come una manifestazione comune di varie malattie croniche, comprese le malattie cardiovascolari, secondo la medicina tradizionale uigura39,40. Nel sistema medico uiguro, si ritiene che l'ABF sia il risultato di uno stress a lungo termine ed è indicato come la fonte di varie malattie39. In questo studio, è stato utilizzato un modello di fluido corporeo anormale per simulare le caratteristiche sottostanti delle malattie cardiovascolari che richiedono un intervento cardiochirurgico. La MIRI è stata indotta nei ratti con ABF per determinare il danno da ischemia-riperfusione miocardica.
Il danno da ischemia e riperfusione è una condizione patologica complessa che coinvolge molteplici processi. È stato riportato che l'ischemia-riperfusione nel cuore porta ad alterazioni patologiche del miocardio4. Questi cambiamenti patologici si manifestano principalmente come cardiomiociti accorciati, struttura sarcomerica interrotta, gonfiore mitocondriale41 e miofibrille sarcomeriche disposte in modo approssimativo, come osservato in questo studio. Il danno miocardico provoca anche alterazioni degli enzimi sierici. È noto che i livelli di cTnT, CK-MB e ICAM-1 nel siero aumentano a seguito di danno miocardico42,43. Pertanto, questi biomarcatori vengono utilizzati per valutare l'entità del danno miocardico acuto. In questo studio, abbiamo osservato i cambiamenti patologici nel miocardio e l'aumento degli enzimi sierici dopo il danno da ischemia-riperfusione, indicando il successo dell'instaurazione del modello MIRI. I risultati hanno mostrato che il danno miocardico nel gruppo ABF MIRI era più grave rispetto al gruppo MIRI di controllo. Dopo il trattamento con Munziq, le alterazioni patologiche sono state notevolmente alleviate e i livelli sierici degli enzimi sono diminuiti significativamente. Collettivamente, questi risultati dimostrano gli effetti cardioprotettivi di Munziq durante la MIRI.
In questo studio, l'arteria discendente anteriore sinistra (LAD) è stata legata per 30 minuti, seguita da riperfusione per 120 minuti per stabilire un modello di danno da ischemia-riperfusione nei ratti. Una meta-analisi44 che riassume 43 studi utilizzati per creare modelli di danno da ischemia-riperfusione nei ratti ha indicato che i tempi di ischemia variavano da 30 a 60 minuti, con una durata della riperfusione da 30 a 120 minuti. Alcuni studi hanno adottato un protocollo di 5 minuti di ischemia seguiti da 5 minuti di riperfusione, ripetuti 4 volte45. Tra questi metodi, è stato utilizzato più frequentemente un protocollo che prevedeva 30 minuti di ischemia e 120 minuti di riperfusione, comparso in 19 casi. Durante il processo sperimentale, abbiamo osservato una colorazione pallida del miocardio attraverso l'ispezione visiva diretta dopo 30 minuti di ischemia. Oltre alla valutazione visiva dei cambiamenti di colore del miocardio, è stato impiegato il monitoraggio dell'elettrocardiogramma (ECG) per identificare i segni di ischemia, come l'elevazione del segmento ST. I marcatori sierici, tra cui la troponina e la creatinchinasi, così come i parametri emodinamici come la frequenza cardiaca (HR), la pressione diastolica ventricolare sinistra (LVDP) e la pressione sistolica ventricolare sinistra (LVSP), possono fungere da indicatori per valutare l'efficacia del modello di ischemia46. In questo studio, ci siamo basati principalmente sull'osservazione visiva per valutare gli effetti dell'ischemia e della riperfusione. A causa delle variazioni individuali tra i ratti, è consigliabile integrare l'ispezione visiva con ulteriori misure oggettive per valutare l'efficacia dell'ischemia piuttosto che applicare una durata ischemica uniforme a tutti i ratti.
Nei mammiferi, la famiglia NF-κB è composta da cinque membri, uno dei quali è p6513,47. Ci sono due principali vie di attivazione di NF-κB nelle cellule47. Nella via canonica, l'attivazione del complesso IKK (IKKα, IKKβ e IKKγ) porta alla fosforilazione delle proteine IκB, avviando l'attivazione di NF-κB. Nella via non canonica di NF-κB, l'attivazione di NF-κB è mediata dalla fosforilazione di NIK e IKKα. Ampie evidenze suggeriscono che la via NF-κB svolge un ruolo cruciale nella mediazione del danno da ischemia e riperfusione 48,49,50. L'interferenza con l'attivazione di NF-κB può attenuare il danno indotto dall'ischemia e dalla riperfusione51,52. È interessante notare che c'era una maggiore attivazione della via di segnalazione NF-κB nel gruppo ABF MIRI e livelli più elevati di citochine infiammatorie a valle.
Numerosi farmaci della medicina tradizionale cinese hanno dimostrato di esercitare effetti protettivi contro l'ischemia e il danno da riperfusione modulando la via NF-κB. Ad esempio, Liu et al.53 hanno scoperto che la quercetina mitiga la MIRI inibendo la via NF-κB. Han et al.54 hanno riportato che il giallo idrossisafflor A allevia la MIRI inibendo la segnalazione TLR4/NF-κB. Tuttavia, rimane inesplorato se Munziq eserciti un ruolo protettivo nella MIRI attraverso la via di segnalazione NF-κB. Per chiarire ulteriormente il meccanismo di Munziq, questo studio ha analizzato i livelli di espressione dei nodi chiave nella via di segnalazione NF-κB, tra cui NIK, IKKα, pIKKα e p65. I risultati hanno dimostrato che i livelli di espressione di queste proteine erano significativamente sottoregolati dopo il trattamento con Munziq, indicando che Munziq inibisce l'espressione dei nodi chiave nella via di segnalazione NF-κB durante la MIRI.
Ci sono ampie prove a sostegno dell'idea che l'attivazione di NF-κB inneschi la produzione di proteine infiammatorie e molecole di adesione, con conseguente reclutamento di linfociti55. Ad esempio, Valen et al.56 hanno scoperto che NF-κB era attivato e che i livelli di IL-1β e TNF-α erano elevati durante l'ischemia/riperfusione miocardica. Inoltre, IL-6, una citochina pro-infiammatoria regolata da NF-κB, mostra un aumento dell'espressione durante la riperfusione57. Coerentemente con questi risultati, i risultati di questo studio dimostrano che Munziq inibisce significativamente i livelli di citochine proinfiammatorie (tra cui IL-1β, IL-6 e TNF-α) nel contesto del danno da ischemia/riperfusione miocardica (MIRI). Da ciò, si può dedurre che Munziq esercita i suoi effetti inibitori sull'espressione di citochine proinfiammatorie attraverso la soppressione della via di segnalazione NF-κB.
In conclusione, i risultati suggeriscono che la MIRI era più grave nell'ABF. Munziq ha effetti cardioprotettivi nell'ischemia e nel danno da riperfusione. Questo effetto protettivo può essere agito sopprimendo la via di segnalazione NF-κB. Questi risultati suggeriscono che Munziq ha un grande potenziale come agente terapeutico per salvaguardare il cuore dal danno da riperfusione durante la cardiochirurgia.
Ci sono diversi limiti dello studio. In primo luogo, lo studio è condotto su un modello di ratto che, nonostante sia un valido modello traslazionale, potrebbe non replicare completamente la complessità della condizione cardiovascolare umana. In secondo luogo, lo studio si concentra principalmente sulla via di segnalazione NF-κB come base meccanicistica degli effetti di Munziq. Tuttavia, la MIRI è un processo multifattoriale che può coinvolgere varie altre vie di segnalazione e meccanismi molecolari.
Sebbene l'attuale studio fornisca preziose informazioni sui potenziali effetti cardioprotettivi di Munziq in un modello di ratto di danno da ischemia-riperfusione miocardica (MIRI), in particolare nel contesto di fluidi corporei anormali (ABF), ci sono diverse aree per l'esplorazione futura. Una strada per ulteriori ricerche è quella di condurre studi in vitro utilizzando cardiomiociti in coltura per osservare direttamente gli effetti di Munziq sulle risposte cellulari all'ischemia e alla riperfusione. Inoltre, l'adozione di un approccio multi-omico potrebbe offrire una visione più completa dei cambiamenti molecolari associati al trattamento con Munziq, rivelando potenzialmente ulteriori percorsi e meccanismi che contribuiscono ai suoi effetti cardioprotettivi. Sarebbe anche utile esplorare diverse dosi di Munziq per determinare il dosaggio ottimale per la massima cardioprotezione, riducendo al minimo i potenziali effetti collaterali. Sono necessari studi a lungo termine per valutare gli effetti duraturi di Munziq sulla funzione cardiaca e per monitorare eventuali effetti avversi potenziali associati all'uso prolungato.
Divulgazioni
Gli autori non hanno nulla da rivelare.
CONTRIBUTO DELL'AUTORE:
Duolikun Mutailifu ha eseguito gli esperimenti, Abudusaimi Aini ha scritto la bozza iniziale del manoscritto e ha analizzato i dati; Aili Aibibula ha contribuito all'ideazione e alla progettazione dello studio; Zheng Liu e Abudunaibi Maimaitiaili hanno partecipato alla progettazione dello studio; Abudunaibi Maimaitiaili ha organizzato i fondi per lo studio; e tutti gli autori hanno letto e approvato il manoscritto finale.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Natural Science Foundation of China [numero di sovvenzione: 82060907] e dal programma di coltivazione di talenti medici e sanitari di alto livello "Tianshan Elite" [sovvenzione n. TSYC202301B004].
Materiali
| Name | Company | Catalog Number | Comments |
| ABI 7500 Real-time PCR | ABI, CA, USA | Used for performing qRT-PCR. | |
| Adult male Sprague-Dawley (SD) rat | Animal Experimental Center of Xinjiang Medical University | ||
| Anti-NF-kB p65, anti-NF-kB Inducing Kinase NIK, anti-IKK alpha, anti-IKK alpha (phospho T23), anti-β-actin | Abcam, CA, USA | Used for Western blot analysis targeting specific proteins. | |
| Anti-TTC11/FIS1 Antibody | abcam | ab71498 | Used for protein detection in Western Blot (WB) experiments. |
| BCA Protein Assay Kit | Tiangen Biotech Co., Ltd., Beijing, China | Used for determining protein concentration. | |
| beta-Actin Loading Control antibody Mouse Mab | Sino Biological | 100166-MM10 | Used for protein detection in Western Blot (WB) experiments. |
| ChemiScope 3300 Imaging System | Clinx Science Instruments, Shanghai, China | Used for scanning developed films from Western blot analysis. | |
| ELISA kit for CK-MB detection | Nanjing Jiancheng Bioengeering Institute(Nanjing, China) | Used for detecting levels of cardiac injury indexes | |
| ELISA kit for cTn-T, ICAM-1, IL-1β, IL-6, TNF-α detection | CUSABIO Biotech CO., Ltd. (Wuhan, China) | Used for detecting levels of cardiac injury indexes and inflammatory cytokines in rat serum samples. | |
| FastQuant RT Kit | TIANGEN, Beijing China | Used for reverse transcription of cDNA. | |
| HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG | Thermo Scientific, Basingstoke, UK | ||
| LDH Assay kit and MDA Assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting LDH and MDA levels in myocardium tissues from the infarct area in the left ventricle. | |
| Munziq | provided by Xinjiang Medical University | The main investigational drug in this study | |
| NF-κB p65 (D14E12) XP Rabbit mAb #8242 | CST | 8242S | Used for protein detection in Western Blot (WB) experiments. |
| Nitric Oxide (NO) assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting NO levels at 550 nm in myocardial tissue. | |
| Phospho-NF-κB p65 (Ser536) (93H1) Rabbit mAb #3033 | CST | 3033S | Used for protein detection in Western Blot (WB) experiments. |
| Quantity One software | Bio-Rad Laboratories, Hercules, CA, USA | Used for analyzing Western blot images. | |
| Recombinant Anti-DRP1 Antibody | abcam | ab184247 | Used for protein detection in Western Blot (WB) experiments. |
| RIPA lysis buffer | Boster Biotechnology Co., Ltd., Wuhan, China | AR0105 | Used for extracting total proteins from rat ventricular tissues. |
| Secondary antibodies (HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG) | Thermo Scientific, Basingstoke, UK | Used for detection following primary antibody incubation in Western blot analysis. | |
| SYBR Select Master Mix | ABI, CA, USA | Used in qRT-PCR analysis on ABI 7500 Real-time PCR instrument. | |
| transmission electron microscope | HitachiS-2400 Hitachi, Tokyo, Japan | Used to examine thin sections of ventricular tissues. | |
| Trizol reagent | Invitrogen Co., Carlsbad, California, USA | Used for RNA extraction from ventricular tissues. |
Riferimenti
- Anderson, J. L., Campion, E. W., Morrow, D. A. Acute myocardial infarction. New Engl J Med. 376 (21), 2053-2064 (2017).
- Vos, T., et al. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet. 396 (10258), 1204-1222 (2020).
- Murphy, A., Goldberg, S. Mechanical complications of myocardial infarction. Am J Med. 135 (12), 1401-1409 (2022).
- Heusch, G. Myocardial ischemia/reperfusion: Translational pathophysiology of ischemic heart disease. Medicine. 5 (1), 10-31 (2024).
- Bhatt, D. L., Lopes, R. D., Harrington, R. A. Diagnosis and treatment of acute coronary syndromes. Jama. 327 (7), 662-675 (2022).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: A target for cardioprotection. Cardiovasc Res. 115 (7), 1143-1155 (2019).
- Gunata, M., Parlakpinar, H. A review of myocardial ischaemia/reperfusion injury: Pathophysiology, experimental models, biomarkers, genetics and pharmacological treatment. Cell Biochem Funct. 39 (2), 190-217 (2020).
- He, J., et al. Myocardial ischemia/reperfusion injury: Mechanisms of injury and implications for management (review). Exp Ther Med. 23 (6), 430 (2022).
- Xiang, M., et al. Role of oxidative stress in reperfusion following myocardial ischemia and its treatments. Oxid Med Cell Longevity. 2021, 1-23 (2021).
- Astudillo, A. M., Balboa, M. A., Balsinde, J. Compartmentalized regulation of lipid signaling in oxidative stress and inflammation: Plasmalogens, oxidized lipids and ferroptosis as new paradigms of bioactive lipid research. Prog Lipid Res. 89, 101207 (2023).
- Algoet, M., et al. Myocardial ischemia-reperfusion injury and the influence of inflammation. Trends Cardiovasc Med. 33 (6), 357-366 (2023).
- Zhang, F., et al. Β-cryptoxanthin alleviates myocardial ischaemia/reperfusion injury by inhibiting nf-κb-mediated inflammatory signalling in rats. Arch Physiol Biochem. 128 (4), 1128-1135 (2020).
- Guo, Q., et al. Nf-κb in biology and targeted therapy: New insights and translational implications. Signal Transduct Target Ther. 9 (1), 53 (2024).
- Mi, J., et al. Inhibition of heat shock protein family a member 8 attenuates spinal cord ischemia-reperfusion injury via astrocyte nf-κb/nlrp3 inflammasome pathway. J Neuroinflammation. 18 (1), 170 (2021).
- Zhang, L., Zhao, S., Wang, Y. Diannexin alleviates myocardial ischemia-reperfusion injury by orchestrating cardiomyocyte oxidative damage, macrophage polarization and fibrotic process by tlr4-nf-kb-mediated inactivation of nlrp3 inflammasome. Int Immunopharmacol. 130, 111668 (2024).
- Zhou, Y., et al. Qingchang mixture prevents the intestinal ischemia-reperfusion injury through tlr4/nf-kb pathway. Combinatorial Chem High Throughput Screen. 26 (1), 49-57 (2023).
- Ozturk, A., et al. The protective effects of trimetazidine against ovary ischemia-reperfusion injury via the tlr4/nf-kb signal pathway. J Biochem Mol Toxicol. 36 (8), e23114 (2022).
- Du, S., Deng, Y., Yuan, H., Sun, Y. Safflower yellow b protects brain against cerebral ischemia reperfusion injury through ampk/nf-kb pathway. Evid Based Compl Alt Med. 2019, 1-11 (2019).
- Dong, X., et al. Physcion protects rats against cerebral ischemia-reperfusion injury via inhibition of tlr4/nf-kb signaling pathway. Drug Design Dev Therapy. 15, 277-287 (2021).
- Hashmi, S., et al. Hydrogen sulphide treatment prevents renal ischemia-reperfusion injury by inhibiting the expression of icam-1 and nf-kb concentration in normotensive and hypertensive rats. Biomolecules. 11 (10), 1549 (2021).
- Gao, L., et al. Hic-5 deficiency attenuates hepatic ischemia reperfusion injury through tlr4/nf-κb signaling pathways. Life Sciences. 249, 117517 (2020).
- Xu, Z., et al. Cardioprotection of mab2g4/odn/lip on myocardial ischemia-reperfusion injury via inhibiting the nf-κb signaling pathway. Cardiovas Ther. 2023, 1-15 (2023).
- Xiao, G., et al. Cxcr1 and its downstream nf-κb inflammation signaling pathway as a key target of guanxinning injection for myocardial ischemia/reperfusion injury. Front Immunol. 13, 1007341 (2022).
- Jeddi, S., Gheibi, S., Kashfi, K., Carlström, M., Ghasemi, A. Dose-dependent effects of long-term administration of hydrogen sulfide on myocardial ischemia-reperfusion injury in male wistar rats: Modulation of rkip, nf-κb, and oxidative stress. Int J Mol Sci. 21 (4), 1415 (2020).
- Yao, Y., et al. Targeting camkii-δ9 ameliorates cardiac ischemia/reperfusion injury by inhibiting myocardial inflammation. Circ Res. 130 (6), 887-903 (2022).
- Zhuang, L., Zong, X., Yang, Q., Fan, Q., Tao, R. Interleukin-34-nf-κb signaling aggravates myocardial ischemic/reperfusion injury by facilitating macrophage recruitment and polarization. eBioMedicine. 95, 104744 (2023).
- Maimaitiaili, A., et al. Effects of different doses of savda munziq on myocardial ischemia-reperfusion injury in rats with abnormal savda syndrome. Genet Mol Res. 13 (3), 4729-4735 (2014).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Hao, Y., et al. Transition of the abnormal savda syndrome to the hepatic carcinoma shifted unfolded protein response to autophagy was partly reversed by savda munziq in a rat model. Biomed Pharmacother. 121, 109643 (2020).
- Maimaitiaili, A., Li, J., Aibibula, A., Abudureheman, M. Erratum: Inhibition of nuclear factor kappa b pathway protects myocardial ischemia/reperfusion injury in rats under treatment with fufang munziq granule (munziq). Am J Transl Res. 10 (11), 3876 (2018).
- Zhang, X., et al. Rosa rugosa flavonoids alleviate myocardial ischemia reperfusion injury in mice by suppressing jnk and p38 mapk. Microcirculation. 24 (7), (2017).
- Dong, P., Liu, K., Han, H. The role of nf-κb in myocardial ischemia/reperfusion injury. Curr Prot Peptide Sci. 23 (8), 535-547 (2022).
- Guo, X., et al. Differential integrative omic analysis for mechanism insights and biomarker discovery of abnormal savda syndrome and its unique munziq prescription. Sci Rep. 6, 27831 (2016).
- Awad, A. S. Role of at1 receptors in permeability of the blood-brain barrier in diabetic hypertensive rats. Vascul Pharmacol. 45 (3), 141-147 (2006).
- La, X., et al. Upregulation of pd-1 on cd4(+)cd25(+) t cells is associated with immunosuppression in liver of mice infected with echinococcus multilocularis. Int Immunopharmacol. 26 (2), 357-366 (2015).
- Wu, T., et al. Circulating small extracellular vesicle-encapsulated sema5a-it1 attenuates myocardial ischemia-reperfusion injury after cardiac surgery with cardiopulmonary bypass. Cell Mol Biol Lett. 27 (1), 95 (2022).
- Pinto, A., et al. The extracellular isoform of superoxide dismutase has a significant impact on cardiovascular ischaemia and reperfusion injury during cardiopulmonary bypass. Eur J Cardio-Thor Surg. 50 (6), 1035-1044 (2016).
- Sabe, S. A., Harris, D. D., Broadwin, M., Sellke, F. W. Cardioprotection in cardiovascular surgery. Basic Res Cardiol. 119 (4), 545-568 (2024).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Mamtimin, B., et al. An magnetic resonance-based plasma metabonomic investigation on abnormal savda in different complicated diseases. J Tradl Chinese Med. 34 (2), 166-172 (2014).
- Marin, W., Marin, D., Ao, X., Liu, Y. Mitochondria as a therapeutic target for cardiac ischemia-reperfusion injury (review). Int J Mol Med. 47 (2), 485-499 (2020).
- Novack, V., et al. Troponin criteria for myocardial infarction after percutaneous coronary intervention. Arch Intern Med. 172 (6), 502-508 (2012).
- Kemp, M., Donovan, J., Higham, H., Hooper, J. Biochemical markers of myocardial injury. Br J Anaesth. 93 (1), 63-73 (2004).
- Zhang, D. Z., Jia, M. Y., Wei, H. Y., Yao, M., Jiang, L. H. Systematic review and meta-analysis of the interventional effects of resveratrol in a rat model of myocardial ischemia-reperfusion injury. Front Pharmacol. 15, 1301502 (2024).
- Ta, F. X., Zhang, T., Zhu, C. M. Correlation between mir-21 and the protective effects of resveratrol against myocardial ischemia/reperfusion injury in rats. Chin. J. Arteriosclerosis. 21 (6), 493-496 (2013).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. Am J Physiol Heart Circ Physiol. 314 (4), H812-H838 (2018).
- Oeckinghaus, A., Hayden, M. S., Ghosh, S. Crosstalk in nf-kappab signaling pathways. Nat Immunol. 12 (8), 695-708 (2011).
- Van Der Heiden, K., Cuhlmann, S., Luong Le, A., Zakkar, M., Evans, M. Role of nuclear factor kappab in cardiovascular health and disease. Clin Sci. 118 (10), 593-605 (2010).
- Ha, T., et al. Toll-like receptors: New players in myocardial ischemia/reperfusion injury. Antioxid Redox Signal. 15 (7), 1875-1893 (2011).
- Pourrajab, F., Yazdi, M. B., Zarch, M. B., Zarch, M. B., Hekmatimoghaddam, S. Cross talk of the first-line defense tlrs with pi3k/akt pathway, in preconditioning therapeutic approach. Mol Cell Ther. 3, 4 (2015).
- Wang, Y. H., et al. Lumbrokinase attenuates myocardial ischemia-reperfusion injury by inhibiting tlr4 signaling. J Mol Cell Cardiol. 99, 113-122 (2016).
- Yu, H., et al. Gypenoside protects cardiomyocytes against ischemia-reperfusion injury via the inhibition of mitogen-activated protein kinase mediated nuclear factor kappa b pathway in vitro and in vivo. Front Pharmacol. 7, 148 (2016).
- Liu, X., et al. Peroxisome proliferator-activated receptor gamma (ppargamma) mediates the protective effect of quercetin against myocardial ischemia-reperfusion injury via suppressing the nf-kappab pathway. Am J Transl Res. 8 (12), 5169-5186 (2016).
- Han, D., et al. Hydroxysafflor yellow a alleviates myocardial ischemia/reperfusion in hyperlipidemic animals through the suppression of tlr4 signaling. Sci Rep. 6, 35319 (2016).
- Yang, Q., He, G. W., Underwood, M. J., Yu, C. M. Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury: Perspectives and implications for postischemic myocardial protection. Am J Transl Res. 8 (2), 765-777 (2016).
- Valen, G., Paulsson, G., Vaage, J. Induction of inflammatory mediators during reperfusion of the human heart. Ann Thorac Surg. 71 (1), 226-232 (2001).
- Saini, H. K., et al. Role of tumour necrosis factor-alpha and other cytokines in ischemia-reperfusion-induced injury in the heart. Exp Clin Cardiol. 10 (4), 213-222 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon