Research Article
Herbal Munziqは、炎症を抑制することにより、心筋虚血-再灌流障害を改善します
要約
この研究では、体液が異常なラットの心筋虚血再灌流障害(MIRI)に対する、ウイグルの伝統的なハーブ製剤であるMunziqの心臓保護効果を調査しています。包括的な実験方法を通じて、NF-κBシグナル伝達経路を抑制することによりMIRIを軽減するMunziqの可能性を実証します。
要約
この研究の目的は、異常な体液心筋虚血再灌流障害(MIRI)とその根底にあるメカニズムに対するムンジクの心臓保護効果を調査することでした。正常なラットおよび異常な体液(ABF)のラットをMunziqで21日間前処理しました。.その後、MIRIモデルが設立されました。組織病理学的変化と心筋の超微細構造の変化をヘマトキシリンとエオシン(HE)染色および透過型電子顕微鏡法で観察し、心筋損傷の病理学的症状を観察しました。血清CK-MB、cTn-T、およびICAM-1レベルは、心筋損傷関連マーカーを観察するために、酵素結合免疫吸着アッセイ(ELISA)によって検出されました。血清および心筋組織中のIL-1β、IL-6、およびTNF-αのレベルもELISAによって検出され、抗炎症効果が観察されました。NF-κBシグナル伝達経路関連タンパク質NIK、IKKα、Pikα、およびp65の発現レベルをウェスタンブロット分析により検出しました。その結果、ABF MIRI群の心筋損傷は、対照群のMIRI群と比較してより深刻であることが示されました。Munziqの前処理は、虚血再灌流障害によって引き起こされる病理学的変化を緩和する可能性があり、心機能を保護する可能性があります。NF-κB経路および下流のエフェクターIL-1β、IL-6、およびTNF-αのタンパク質レベルは、MIRIグループで有意にアップレギュレーションされ、Munziqグループではダウンレギュレーションされました。興味深いことに、ABF MIRIグループでは、NF-κBシグナル伝達経路の活性化が進み、下流の炎症性サイトカインのレベルが高かった。結果は、MIRIがABFでより深刻であったことを示唆しています。ムンジクは虚血および再灌流障害において心臓保護効果があります。この保護効果は、NF-κBシグナル伝達経路を抑制することによって作用し得る。
概要
心筋虚血は、主に冠状動脈の狭窄または血栓症1によって引き起こされる、心筋が十分な血流を受け取らない状態であり、患者2,3に致命的な結果をもたらす可能性があります。心筋代謝はほぼ独占的に好気性であり、グリコーゲン貯蔵が非常に限られているため、主にPCIまたは静脈内血栓溶解療法を通じて、血液供給を迅速に回復することが不可欠です。効果的な心筋再灌流は虚血性心筋の予後を改善するために重要ですが、心筋虚血再灌流障害(MIRI)4,5,6のリスクももたらします。MIRIは、心筋再灌流療法の有効性に影響を与える重要な課題です7。MIRIの発展には、複数の要因とメカニズムが寄与しています。例えば、内皮細胞では、再灌流により活性酸素種(ROS)の蓄積とフリーラジカル捕捉物質の枯渇が誘発され、酸化ストレスの存在が示されます4,8。この酸化ストレスは、その後炎症反応を引き起こし、炎症性因子の放出の増加、接着分子産生の増加、および白血球の動員につながる可能性があります9,10,11。核因子κ-軽鎖活性化B細胞増強剤(NF-κB)経路は、心筋虚血/再灌流障害12の炎症反応において重要な役割を果たす。哺乳類のNF-κB転写因子ファミリーには、NF-κB1(p105/p50とも呼ばれる)、NF-κB2(p100/p52とも呼ばれる)、p65(RELAとも呼ばれる)、RELB(V-Rel網内皮症ウイルスがん遺伝子の相同体)、およびc-REL13,14の5つのメンバーが含まれています。NF-κB経路の阻害は、心筋12,15、腸16、卵巣17、脳18,19、腎臓20、肝臓21など、さまざまな組織における虚血/再灌流障害を緩和することが示されています。特に、NF-κBシグナル伝達経路は、虚血および再灌流に対する心筋応答における極めて重要なメディエーターとして広く文書化されており12,14、可能なメカニズムには、炎症反応の促進、細胞接着分子の発現の調節、酸化ストレス反応への参加、および細胞死および生存経路12,20,22,23への影響が含まれる。24、25。NF-κB 活性化の弱毒を目的とした治療的介入は、MIRI23,26 の緩和に大きな可能性を示しています。
伝統的な中国医学の不可欠な部分であるウイグル医学は、火、空気、水、土の4つの体液の理論に基づいています。これらの体液は、血液、痰、黄色胆汁、黒胆汁などの体液を生じさせます27,28。これら4つの体液の間の動的恒常性の維持は、人体の全体的な健康にとって非常に重要です。これらの体液の不均衡は、体液の不均衡と呼ばれ、病気の発症につながる可能性があります。さまざまな不均衡な体液の中で、主なものは異常体液(ABF)として知られており、異常なサブダ症候群(ASS)としても認識されています27,28。ムンジクは、ウイグルの医師によって広く使用されている伝統的なウイグル医学で、異常な体液の治療に処方されています。これは、Cordia dichotoma Forst. f.、Anchusaitalica Retz.、Glycyrrhiza uralensis Fisch.、Adiantum capillusveneris L.、Euphorbia humifusa Willd.、Ziziphus jujuba Mill.、Lavandula angustifolia Mill.、Foeniculum vulgare Mill.、Melissa officinalis L.、Alhagi pseudoalhagi Desvを含む10種類の薬用種を含むハーブ薬用製剤です29. ムンジクは、2003年に国家食品医薬品局によってコード番号Z65020166で承認されました。その活性化学成分には、真鍮、フェノール、有機酸、アミノ酸、サポニン、砂糖などが含まれます。Munziqは、抗酸化作用、抗炎症作用、免疫調節作用、抗血小板凝集作用、抗血栓作用など、複数の効果を示します27,28,30。
私たちの以前の研究では、ムンジク医学が心筋虚血/再灌流障害(MIRI)を緩和できることが示されていますが、具体的なメカニズムはまだ不明です。異常なSavda症候群の心筋虚血再灌流障害ラットにおけるMunziqの心筋保護効果が示されました。.核因子κb経路の阻害は、Fufang Munziq顆粒(Munziq)27,28,30で治療中のラットの心筋虚血/再灌流障害を保護します。 しかし、MIRIにおけるムンジクの役割とメカニズムを調査する研究は限られています。
この研究は、異常な体液 (ABF) を持つラットの心筋虚血再灌流障害 (MIRI) に対する Munziq の心臓保護効果を調査し、特に NF-κB シグナル伝達経路に焦点を当てて、根本的なメカニズムを調査することを目的としています。この研究で提案された仮説は、Munziq 前処理が MIRI によって引き起こされる病理学的変化を軽減し、心機能を保護することができるというものです。これは、NF-κB シグナル伝達経路と下流の炎症反応を抑制できる可能性があります。この仮説は、対照群と ABF 群の両方で、偽モデル、虚血再灌流障害 (MIRI)、および虚血再灌流障害 + Munziq モデルを確立することによって検証されます。心機能、炎症関連指標、およびNF-κB経路に関連するタンパク質がモニターされます。
プロトコル
体重200〜220 gの成体雄Sprague-Dawley(SD)ラットを、実験動物のケアと使用に関する国立衛生研究所ガイドラインに従って使用しました。.新疆医科大学の動物実験センター。体液異常(ABF)の動物モデルは、新疆医科大学の実験動物センターから提供されました。ラットは、前述のように乾燥した寒冷な環境に置かれましたが、これは、伝統的なウイグル医学理論によれば、また以前の研究で示されたように、ラットの異常な体液(ABF)モデルを確立するために不可欠です29,33。すべての動物実験は、新疆医科大学の倫理ガイドラインに従って実施され、ARRIVEガイドラインに従って実施されました。脊椎動物(ラット)研究のプロトコルは、新疆医科大学の機関倫理委員会(IACUC-20200318-16)によって承認されました。
1. 動物群分け、薬物投与、MIRIモデル構築
- ラットを次の6つのグループにランダムに割り当てます:i)対照偽グループ、ii)対照MIRIグループ、iii)ABF偽グループ、iv)ABF MIRIグループ、v)コントロールMIRI + Munziqグループ、およびvi)ABF MIRI + Munziqグループ。
- ABFグループのラットを、温度6°C±1°C、相対湿度範囲25%〜32.8%に設定された気候ボックス内の制御された環境に収容します。ラットに乾燥した冷たい食物、すなわち大麦とコリアンダーの種子を7:1.5:1.5の比率で混合した通常の飼料を提供し、この方法を21日間適用してABFモデル29,33を確立します。
- MIRI手術の21日前に、5 g / kgのMunziq(5.0 gのMunziqを1 mLの蒸留水に溶解)を胃内投与で投与します。これは有効な臨床用量の2倍です。.対照偽動物群、対照MIRI群、対照MIRI + Munziq群などの非ABF動物の場合、偽群とMIRI群に同量の生理食塩水を投与し、Munziq群にMunziqの胃内投与を提供します。
- 21日間の前処理の後、MIRIモデルを確立します。
- 無菌環境を確保するために、無菌材料を備えた専用の動物手術室で手術を行います。ペントバルビタールナトリウム(35 mg / kg)の腹腔内注射(IP)でラットに麻酔をかけます。筋肉の弛緩、外部刺激に対する反応性、呼吸数と呼吸深度を観察して、麻酔効果を評価します。これらのパラメータは、手順全体を通して15分ごとに監視します。不十分な麻酔の兆候が現れた場合(筋肉の緊張、刺激に対する顕著な反応、呼吸数の増加または浅い)、20 mg / kgの補足用量を投与します。.最終的な採血まで、全手順を通じて麻酔を維持します。処置中は、直腸温度プローブによる連続モニタリングを備えた加熱パッドを使用して、ラットの体温を37°Cに維持します。麻酔中の乾燥を防ぐために、獣医軟膏を目に塗ります。
- 人工呼吸器補助呼吸のために気管切開を行います。胸を開いて心臓を露出させる前に、手術部位を石鹸水で洗い、手術部位を剃り、クロルヘキシジンやヨウ素などの消毒液でその部分をきれいにします。手順には滅菌器具を使用してください。
- 胸を開いて心臓を露出させるには、はさみ、鉗子、開創器などの標準的な滅菌胸部手術器具を使用します。胸壁を開き、心臓を露出させます。直接視覚化の下で左前下行(LAD)動脈を特定します。これは、心臓の表面にある左冠状動脈の主要な枝です。6-0縫合糸(4-5 cm)を使用し、LAD(左前方下行)を30分間結紮して、局所虚血を誘発します。心筋の淡い色を観察することにより、効果的なLAD閉塞を決定します。
- 結紮の30分後、結紮糸を解放し、120分間再灌流を行います。心筋が鮮やかな赤色に回復したときの再灌流を決定します。偽手術を受けたラットでは、LADの結紮なしで同じ手順を実行します。
- 再灌流後、ラットはペントバルビタールナトリウム(35mg / kg、ip)34によって誘発された麻酔下に置かれた。ラットが深い麻酔に入ったら、真空採血管を使用して腹部大動脈から1〜2mLの血液サンプルを採取します。
- 腹部大動脈から血液サンプルを採取した後、深い麻酔下でラットを頸部脱臼によって安楽死させます。滅菌鉗子とハサミを使用して左心室の梗塞領域から心筋組織を採取し、梗塞領域を示す青白くて損傷したように見える組織のみを採取するようにします。収集した組織を滅菌容器に入れて、さらに分析します。
2.サンプル収集
- 組織サンプルの収集:滅菌ハサミと滅菌ブレードを使用して、心臓の方向に垂直な左心室長軸の中点に沿って心臓を水平に2つに分割します。頂端部分の半分を2つの部分に分けます:室温または4°Cで2〜24時間、形態学的検査のために4%パラホルムアルデヒドで1つを保存し、1〜4時間で電子顕微鏡検査のためにグルタルアルデヒドでもう1つを保存します。
- 虚血性領域と非虚血性領域を含む心臓の基部を2つの部分に分割します:1つの部分を凍結バイアルに入れ、組織を液体窒素で急速に凍結し、分子生物学試験のために-80°Cの超低温冷凍庫に移します。他の新鮮な部分は、組織活性酸素種(ROS)レベルの検出とミトコンドリア抽出に使用します。
- 血清サンプル収集:実験のエンドポイントで、下大静脈から1〜2 mLの静脈血を採取し、1000 x g で10分間遠心分離し、分離後に血清を-80°Cの超低温冷凍庫に保管します。
3. HE染色と透過型電子顕微鏡観察
- 日常的な手順35に従って、心室心筋にHE染色(ヘマトキシリン-エオシン染色)を行います。組織を4%パラホルムアルデヒドに24時間固定します。サンプルをパラフィンに包埋し、厚さ4 μmに切断し、プロトコールに従ってヘマトキシリン-エオシン染色法を用いて染色します。5つのフィールドをランダムに選択して、顕微鏡下で組織病理学的変化を観察します。
- ホルマリンで固定したラットの心筋組織を各群から、以下の手順に従ってHE染色実験のために処理します。
- 組織切片を65°Cのインキュベーターに入れ、1.5〜2回ベーキングします。
- 組織切片をキシレンに10分間浸し、キシレンを交換し、さらに10分間再度浸します。無水アルコールIおよびIIにそれぞれ5分間順次浸漬し、続いて95%、90%、80%、および70%アルコール、および蒸留水に各5分間浸漬します。
- ヘマトキシリンで3分間染色します。塩酸をアルコールに数秒間(1〜2秒)加えて酸性分化を行います。水道水での分化を5分間終了します。
- 蒸留水に70%、80%、90%、95%のアルコールをそれぞれ3分間浸し、無水アルコールIおよびIIを各5分間浸します。
- 0.5%エオシンをエタノール溶液で1分間染色し、切片を95%エタノールですすいで余分な赤色を取り除いた後、無水エタノールに5分間浸漬します。キシレンIとIIにそれぞれ5分間浸漬します。
- 中性バルサムでマウントします。顕微鏡下で組織の病理学的変化を観察します。
4. 血中サイトカインと心臓損傷指数のELISA検出
- 末梢血からラット血清サンプルを1000 x g で10分間遠心分離し、-80°Cで保存します。 CK-MB、cTn-T、ICAM-1などの心臓損傷指数、およびIL-1β、IL-6、TNF-αなどの炎症性サイトカインを、メーカーの指示に従って、以下に説明するように、ELISAキットを使用して血清中に検出します。
- すべての試薬を室温(18-25°C)に少なくとも30分間平衡化させ、製造元の指示に従って試薬を調製し、使用準備を整えます。
- 標準ウェルとサンプルウェルをセットアップし、アッセイキットに含まれる既知の濃度の標準溶液が標準ウェルに含まれています。これらは、試験中のサンプル中の特定の分析物濃度を定量化するための標準曲線を確立するために使用されます。各ウェルに100 μLの標準試料またはサンプルを添加し、振とうして穏やかに混合し、プレートシールで覆い、37°Cで2時間インキュベートします。
- 液体を捨て、デキャンタして乾燥させ、洗わないでください。ビオチン標識抗体(1:100に希釈済み)100 μLのワーキング溶液を各ウェルに加え、新しいプレートシールで覆い、37°Cで1時間インキュベートします。
- ウェルから液体を捨て、デカンテーションして乾燥させ、プレートを3回洗浄します。1回の洗浄につき2分間、1ウェルにつき200μLに浸し、デカンテーションして乾燥させます。
- 西洋ワサビペルオキシダーゼ標識ストレプトアビジンワーキング溶液100 μLを各ウェルに加え、新しいプレートシールで覆い、37°Cで1時間インキュベートします。
- ウェルから液体を捨て、デカンテーションして乾燥させ、プレートを5回洗浄します。1回の洗浄につき2分間、1ウェルにつき200μLに浸し、デカンテーションして乾燥させます。
- 各ウェルに90μLの基質溶液を順次添加し、37°Cの暗所で15〜30分間色を現像します。
- 各ウェルに50 μLの停止溶液を順次加えて、反応を終了します。反応停止後5分以内に、マイクロプレートリーダーを用いて各ウェルの光学濃度(OD値)を450nmで順次測定します。
5. MDA、NO、LDHレベルの測定
- 再灌流後、左心室の梗塞領域から心筋組織(5 mm x 7 mm)を採取します。LDH(乳酸デヒドロゲナーゼ)およびMDA(マロンジアルデヒド)は、LDH Assay kitおよびMDA Assay kitを使用して、製造元の指示に従って検出します。製造元の指示に従って、一酸化窒素(NO)アッセイキットを使用して550 nmでNOを検出します。
6. ウェスタンブロット解析
- RIPA溶解法を用いてラット心室組織から総タンパク質を抽出します。BCA Protein Assay Kitを使用してタンパク質濃度を測定します。
- 細胞内タンパク質を保存し、細胞の分解を防ぐために、サンプルを液体窒素に浸して急速に凍結します。その後、凍結したサンプルを取り出して粉末状に粉砕し、約100mgのサンプルを採取し、予冷した1.5mLの遠心チューブに加えます。400 μLのRIPA溶解バッファー(プロテアーゼ阻害剤と広域スペクトルホスファターゼ阻害剤を添加)を加え、十分に混合して4°Cで60分間静置します。
- 混合物を1000 x g で4°Cで15分間遠心分離します。 上清を採取し、BCA法を用いてタンパク質濃度を測定します。
- 表1に従って、サンプルの緩衝系に一致する希釈剤でBSA標準を希釈します。
- 製造元の指示に従って試薬を準備します。サンプル数に基づいて、試薬AとBを50:1の容量比で混合し、適切な量のBCAワーキング溶液を調製し、十分に混合します。BCAワーキング溶液を調製する前に、試薬Aを振ってよく混合します。
- 新たに調製したBSA標準溶液20 μLと希釈サンプル(10倍希釈)を 表1 から取り出し、96ウェルプレートに加えます。
- 各ウェルに200 μLのBCAワーキング溶液を加え、十分に混合します。プレートを密封し、37°Cで30分間インキュベートした後、室温まで冷却するか、室温で2分間静置します。
- マイクロプレートリーダーを使用して562 nmでの吸光度を測定し、標準曲線に基づいてサンプル中のタンパク質濃度を計算します。
- サンプルに5x SDS-PAGEローディングバッファー(β-メルカプトエタノールを含む)を適量添加し、100°Cで沸騰水で5分間加熱処理してタンパク質を完全に変性させ、1,000 x g で5分間遠心分離し、上清を取って使用します。
- 表2の式は、15%、12%、および8%の分離ゲル、および5%スタッキングゲルの調製を概説しています。それに応じてソリューションを準備します。分離ゲル溶液をゲルカセット内の2/3の高さまで加え、蒸留水で覆い、室温で40分間放置します。次に、スタッキングジェルをカセットに充填し、コームを挿入して10分間放置します。
- 染色済みのタンパク質マーカー9 μLを各ウェルにロードし、ウェルあたり50 μgのサンプルタンパク質をロードします。
- ブロモフェノールブルーが分離ゲルに到達するまで80Vの定電圧を印加し、その後100Vの定電圧を90分間印加します。ブロモフェノールブルーがゲルの下部に移動したら、電気泳動を停止します。
- SDS-PAGE終了後、PVDFメンブレンをメタノールに10秒間浸漬し、蒸留水で1分間すすぎた後、ポリアクリルアミドゲル、ろ紙、処理したPVDFメンブレムを転写バッファーに10分間浸漬します。
- クリップの黒い面を下にしてトランスファーサンドイッチを組み立て、続いてクリップのスポンジフィルターペーパー-ジェル-PVDFメンブレンフィルターペーパー-スポンジ-透明な面を組み立てます。クリップの黒面がカセットの黒面に、白い面が赤面に面するように、クリップを転写カセットにセットします。100 Vの定電圧で転写を行い、転写時間60分のPVDFメンブレンを使用します。
- 転写後、PVDFメンブレンを水で3回、それぞれ5分間洗浄します。5%脱脂粉乳を含むブロッキング溶液でメンブレンを1時間ブロックし、TBSTで3回、それぞれ5分間洗浄します。
- 表3に記載されている希釈比に従って一次抗体をTBSTで希釈し、4°Cで一晩インキュベートします。一次抗体には、抗NF-κB p65抗体、抗NF-κB誘導キナーゼ(NIK)抗体、抗IKKα抗体、および抗β-アクチン抗体が含まれます。
- メンブレンを1x TBSTで3回、それぞれ5分間すすぎます。適切に希釈した二次抗体( 表3を参照)を添加し、室温で1時間インキュベートします。二次抗体は、HRP標識ヤギ抗マウスIgGおよびHRP標識ヤギ抗ウサギIgGです。
- メンブレンを再度1x TBST 3xでそれぞれ5分間すすぎます。現像液AとBを混合し、メンブレンに2 mLを添加し、ミニ化学発光装置を使用して検出および撮影します。
- 強化された化学発光プラス試薬を使用してメンブレンを開発します。イメージングシステムを使用して現像フィルムをスキャンします。ソフトウェアを使用してウェスタンブロット画像を解析します。ローディング制御としてβ-actinを使用します。β-アクチンの灰色の値に基づいて相対的なタンパク質レベルを計算します。
7. リアルタイムPCR解析(qRT-PCR)
- 全RNA抽出
- 製造元の指示に従って、0.1%DEPC溶液と70%DEPC処理アルコールを準備します。すべてのサイズの微量遠心チューブとさまざまなタイプのピペットチップを0.1% DEPC溶液で処理します。一晩浸し、次にオートクレーブします。
- 対数成長期の細胞を良好な増殖状態で採取します。細胞培養フラスコから培地を捨て、ハンク溶液で細胞を2回洗浄します。細胞10cm²あたり1mLのトリプシンを加え、穏やかに振って細胞を剥離し、ピペットを使用して完全に剥離します。室温で5分間インキュベートして完全に溶解させた後、7回〜10回ピペットで上下させて細胞を完全に破壊します。ライセートを1.5 mLチューブに移し、遠心分離して上清を保存します。
- 上清に同量のクロロホルムを加え、よく混ぜ合わせ、室温で10分間放置します。4°Cで1,000 x g で5分間遠心分離し、相を分離します。上部水相を新しいチューブに慎重に移します(DNAおよびタンパク質を抽出する場合は、下部相を保持し、4°Cで保存します)。
- イソプロパノール(トリゾール1 mLあたり0.5 mL)を加えてよく混合し、室温で10分間静置します。4°Cで1,000 x gで10分間遠心分離し、上清を静かに取り除いて廃棄します。
- RNAペレットを75%エタノールで洗浄し、4°Cで8,000 x gで5分間遠心分離し、上清を穏やかに除去し、ペレットを風乾または真空乾燥します。RNAを50μLのDEPC水に溶解し、分注し、-70°Cで保存するか、cDNAへの逆転写に進みます。
- cDNAへの逆転写
- キットを使用して、製造元の指示に従ってcDNAの逆転写を行います。
- リアルタイム定量PCR
- 遺伝子配列に基づいてプライマーを設計し、NCBIのウェブサイトでBLASTを使用して確認します。CK20およびβ-actin用のフォワードプライマーおよびリバースプライマーの10 μMストック溶液を調製します。 表4 にプライマー配列を示します。
- リアルタイム定量PCR
- 反応システムにcDNA1 μL、2xマスターミックス10 μL、フォワードプライマーとリバースプライマー各0.4 μL、およびRNaseフリー水8.2 μLを添加します。
- 次のプログラムでPCRを実行します:最初の変性を95°Cで2分間行い、その後、95°Cで15秒間、60°Cで1分間を40サイクルします。内部統制としてβ-actinを使用します。2-ΔΔCt 法を使用して相対式を計算します。
8. 統計分析
- 統計分析には商用ソフトウェアを使用します。データを平均±標準偏差 (平均 ± SD) として表示します。一元配置分散分析を実行して、異なるグループ間の違いを比較します。有意差を p < 0.05 と定義します。
結果
ムンジクは、虚血再灌流障害によって引き起こされる病理学的変化を軽減します
心筋組織の形態変化を調べるために、まずHE染色を行いました。 図1に示す代表的なHE染色法として、偽群の特定の心筋細胞に顆粒変性および液胞変性が観察されました。さらに、心筋細胞間の赤血球とリンパ球の浸潤の存在は限られていました。定期的に血管の拡張とうっ血を観察しました。MIRIグループの心筋組織は、より重度の障害を示し、より顕著な形態学的変化を示しました。これらの変化には、広範な顆粒変性、液胞変性、赤血球とリンパ球の浸潤、血管の拡張、およびうっ血が含まれていました。ABF MIRIグループの心筋組織の損傷は、対照のMIRIグループで観察されたものと比較してより深刻でした。しかし、Munziqグループの両方で、一部の心筋細胞は軽度の顆粒変性と液胞変性を示しました。赤血球の存在とリンパ球の浸潤、血管の拡張、およびうっ血はほとんどありませんでした。さらに、この知見は、ムンジクがABF MIRIラットおよび対照MIRIラットにおいて優れた心臓保護効果を示すことを示している。結論として、これらの知見は、ムンジック前処理が心臓の虚血再灌流障害によって引き起こされる病理学的変化を緩和する可能性があることを示唆しています。
ムンジクは、虚血/再灌流障害によって誘発されるミトコンドリアと心筋線維の破壊を改善しました
MIRI損傷におけるMunziqの保護的役割をさらに検証するために、TEMを使用してミトコンドリアの超微細構造と心筋線維を調べました。 図2に示すように、偽群の心筋細胞は、密集して配置された筋原線維と同様のサルコメアの長さを持つ無傷の構造を示しました。ミオフィラメントの構造は明確でわずかに緩く見えましたが、多数のミトコンドリアが観察されました。一方、MIRIグループは、細胞の腫脹、サルコメアの長さの変化、不明確で緩く配置されたミオフィラメント構造など、心筋細胞の損傷を示す病理学的特徴を示しました。I/Rグループでは、偽グループと比較して、ミトコンドリアの広範な破壊と溶解が見られました。また、心筋線維は不規則で、I/R損傷に反応して骨折していました。興味深いことに、これらの変化の深刻度はABF MIRIグループで著しく高かった。対照的に、ムンジクで治療された両群は、損傷した心筋細胞に関連する緩和された病理学的特徴を示した。心筋細胞の腫脹は減少し、筋原線維、サルコメア、ミオフィラメントの構造、およびミトコンドリアの数は、偽のグループで観察されたものと同様でした。まとめると、これらのデータは、Munziqの前処理がI / R手術によって誘発されるミトコンドリアと心筋線維の破壊を緩和できることを示しました。
ABF MIRIラットおよびMunziq前治療で悪化した心筋虚血再灌流障害は心機能を保護しました
cTn-T、CK-MB、および ICAM-1 の血清レベルは、ELISA 法を使用して検出されました。その結果、対照群とABF偽群との間には識別可能な格差は見られませんでした。しかし、ABF MIRIグループは、対照MIRIグループと比較して、cTn-T(図3A)、CK-MB(図3B)、およびICAM-1(図3C)のレベルが有意に上昇したことは注目に値します。Munziqの心臓保護効果を評価するために、対照MIRIラットとABF MIRIラットの両方にMunziq前処理が行われました。 図3に示すように、cTn-T、CK-MB、およびICAM-1のレベルは、Munziq前処理群で顕著に減少しました。これらの結果は、ムンジクがABF MIRIラットにおいて顕著な心臓保護特性を示すことを示唆しています。
ABFおよび対照ラットの虚血再灌流誘発酸化ストレス損傷に対するMunziq前処理の影響を調査するために、LDH、MDA、およびNOの変化を心筋組織で測定しました。図3D,Fに示すように、ABF MIRIグループは、対照MIRIグループと比較して、MDAレベルが有意に上昇し、NOレベルが有意に減少しました。Munziqの前処理は、虚血性心筋のLDHとMDAの含有量を大幅に減少させました。.同時に、Munziqの前処理は心筋組織のNOレベルをさらに増加させました。
Munziqによる前処理は、炎症誘発性サイトカイン産生を妨げることにより、MIRIの炎症を軽減しました
炎症誘発性サイトカインは自然免疫応答を媒介する上で重要な役割を果たしており、MIRI31では炎症誘発性サイトカインが活性化されました。Munziqの抗炎症効果をさらに調査するために、対照MIRIラットとABF MIRIラットの両方がMunziq前処理を受けました。血清IL-1β、IL-6、TNF-αのelisa法と、心筋組織中のIL-1β、IL-6、TNF-αのmRNAレベルを評価するためのqRT-PCR解析を用いました。その結果、対照の偽群とABF偽群の間で、これらのサイトカインレベルに有意差は見られませんでした。IL-1β、IL-6、およびTNF-αのレベルは、対照のMIRIグループと比較して、ABF MIRIグループで有意にアップレギュレーションされました。具体的には、IL-1βはmRNAレベルとタンパク質レベルの両方で有意な増加を示し、統計的に有意な差が観察されました。IL-6ではmRNAレベルに差はありませんでしたが、タンパク質レベルでは差が見られました。同様に、TNF-αはmRNAレベルに変動を示さなかったが、タンパク質レベルでは差を示した。 図4に示すように、IL-1β、IL-6、およびTNF-αのレベルは、Munziq前処理群で著しく減少しました。
Munziqによる前処理により、NF-κBシグナル経路を介した炎症が緩和されました
サイトカインの産生は、炎症反応のほとんどの段階において、NF-κBシグナル伝達経路の活性化と密接に関連しています。NF-κBは、炎症性疾患の潜在的な治療標的と考えられている32。NF-κB経路がMunziqの抗炎症効果に関与しているかどうかを評価するために、最初にウェスタンブロット分析を実施して、NIK、IKKα、pIKKα、p6513などのNF-κB経路の主要成分の発現レベルを測定しました。 図5に示すように、虚血性および再灌流障害は、MIRIグループ内でNIK、p-IKKα、およびp-p65の顕著なアップレギュレーションを誘発しました。ムンジクによる治療は、このアップレギュレーションを効果的に減衰させました。.その結果、MunziqはNF-κBシグナル伝達経路の活性化を抑制することにより、抗炎症に重要な役割を果たしていることが示されました。
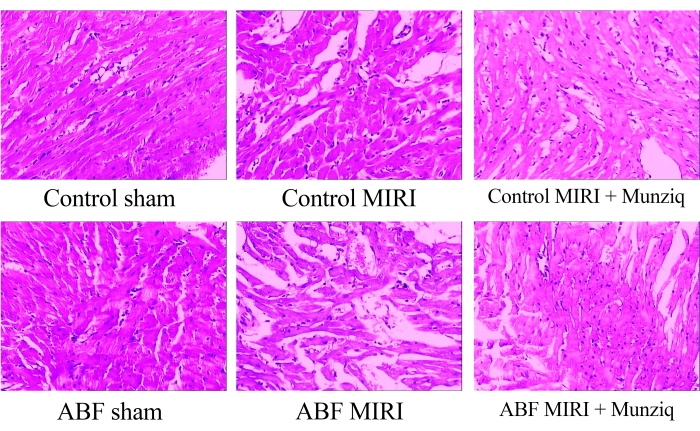
図1:HE染色で観察された心筋組織の形態変化。 さまざまなグループの代表的なHE染色画像。倍率:100倍。略語:ABF =異常な体液;MIRI = 心筋虚血-再灌流障害;(n = 6)です。 この図の拡大版を表示するには、ここをクリックしてください。
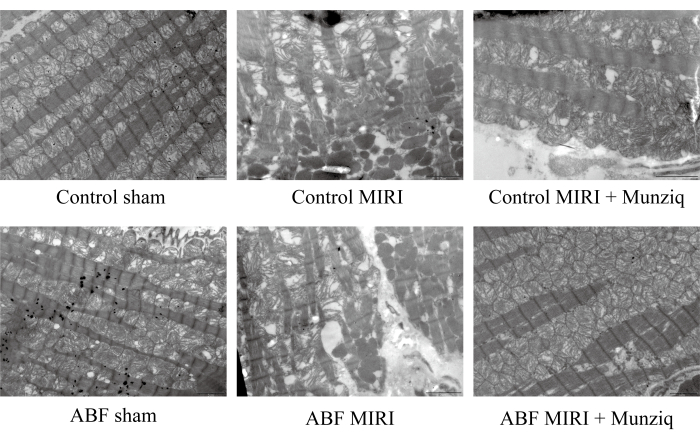
図2:ムンジクは、I/R損傷によって誘発されるミトコンドリアと心筋線維の破壊を改善した。 走査型電子顕微鏡を用いて、ミトコンドリアの超微細構造と心筋線維の変化を観察しました。代表的な画像を示しました。スケールバー:5μm;(n = 3)。 この図の拡大版を表示するには、ここをクリックしてください。
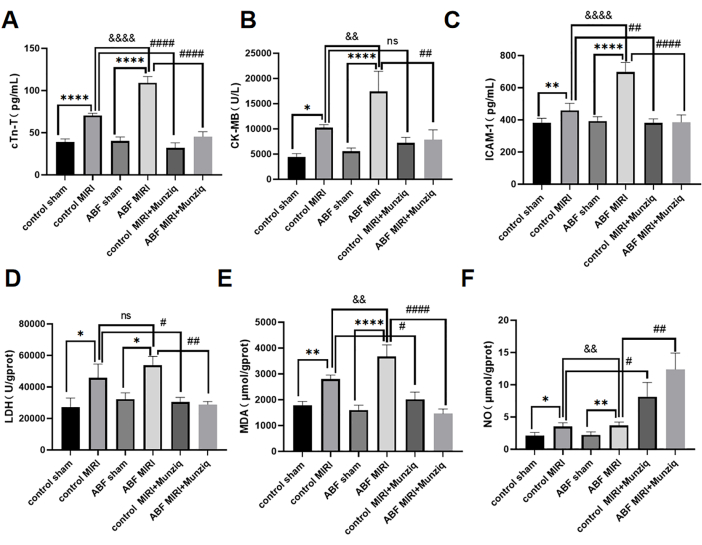
図3:ABF MIRIラットで悪化した心筋虚血再灌流障害、およびMunziq前処理により心機能が保護される可能性があります。 (A)血清cTn-T、(B)CK-MB、および(C)ICAM-1。レベルはELISAによって検出され、LDH、MDA、およびNOの変化が心筋組織で測定されました(n = 6)。*p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 偽グループと比較; #p<0.05、 ## p<0.01、 ###p<0.001、 ####p<0.0001 MIRIグループと比較。 &p<0.05, & p<0.01, &&&p<0.001, &&&p<0.0001 対照群と比較。データは平均SD±示され、統計分析は一元配置分散分析を使用して実行されました。 この図の拡大版を表示するには、ここをクリックしてください。
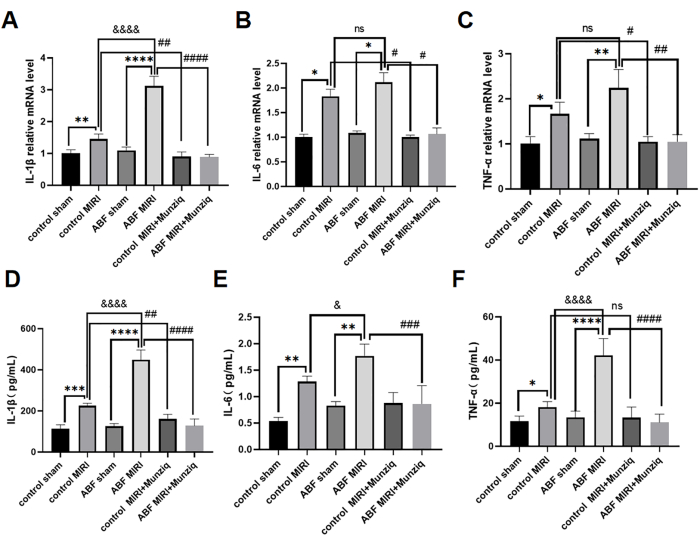
図4:Munziqによる前処理は、炎症誘発性サイトカインの産生を防ぐことにより、MIRIの炎症を軽減しました。 qRT-PCRは、心筋組織中の(A)IL-1β、(B)IL-6、および(C)TNF-αのmRNAレベルを検出しました。血清中の(D)IL-1β、(E)IL-6、(F)TNF-αのレベルをELISA(n = 6)で測定します。*p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 偽グループと比較; #p<0.05、 ## p<0.01、 ###p<0.001、 ####p<0.0001 MIRIグループと比較。 &p<0.05, & p<0.01, &&&p<0.001, &&&p<0.0001 対照群と比較。データは平均SD±示され、統計分析は一元配置分散分析を使用して実行されました。 この図の拡大版を表示するには、ここをクリックしてください。
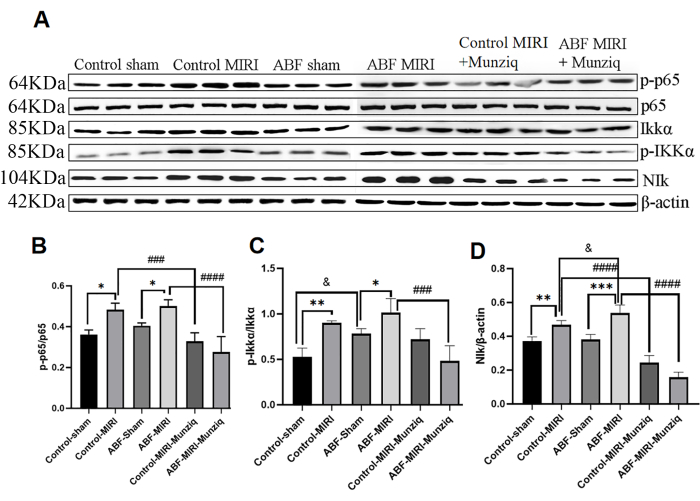
図5:Munziqによる前処理により、NF-κBシグナル経路を介した炎症が緩和されました。 心筋組織におけるp-IKKα、IKKα、p-p65、p65、およびNIkタンパク質の発現をウェスタンブロットで検出しました(各群でN=3)。(A)ウェスタンブロット解析で観察されたタンパク質バンド。(B-D)相対的な表現レベルは、グレーの値に基づいて決定されます。*p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 偽グループと比較; #p<0.05、 ## p<0.01、 ###p<0.001、 ####p<0.0001 MIRIグループと比較。 &p<0.05, & p<0.01, &&p<0.001, &&&<p.0.0001 対照群と比較。データは平均SD±示され、統計分析は一元配置分散分析を使用して実行されました。 この図の拡大版を表示するには、ここをクリックしてください。
| チューブ番号 | 希釈液量(mL) | BSAボリューム(出典) | 最終BSA濃度(mg / mL) |
| ある | 0 | 20(ストックソリューション) | 500 |
| B | 2 | 18(ストックソリューション) | 400 |
| C | 4 | 16(ストックソリューション) | 300 |
| D | 6 | 14(ストックソリューション) | 200 |
| E | 8 | 12(ストックソリューション) | 150 |
| F | 12 | 8(ストックソリューション) | 100 |
| G | 16 | 4(ストックソリューション) | 50 |
| H | 20 | 0 (ストック ソリューション) | 0 |
表1:BSA標準濃度調製チャート。
| 分離ゲル | 15%スタッキングジェル | 12%スタッキングジェル | 8%スタッキングジェル | 5%スタッキングジェル | |
| 試薬 | 容積 | 容積 | 容積 | 試薬 | 容積 |
| 脱イオン水(mL) | 2.76 | 3.96 | 5.52 | 脱イオン水(mL) | 4 |
| 30% アクリルアミド (mL) | 6 | 4.8 | 3.24 | 30% アクリルアミド (mL) | 1 |
| 1.5mol/lトリスHCl(PH8.8)(mL) | 3 | 3 | 3 | 1.0M Tris.HCl (pH6.8; mL) | 1 |
| 10%SDS(μL) | 120 | 120 | 120 | 10%SDS(μL) | 80 |
| 10%AP(μL) | 120 | 120 | 120 | 10%AP(μL) | 60 |
| テメド(μL) | 4.8 | 4.8 | 7.2 | テメド(μL) | 8 |
| 総量(mL) | 12 | 12 | 12 | 総量(mL) | 6 |
表2:ゲル濃縮製剤。
| 一次抗体 | 希釈率 | 二次抗体 | 希釈率 |
| β-アクチン | 1:1000 | ヤギ抗マウスIgG H&L (HRP) | 1:15000 |
| p65 | 1:1000 | ヤギ抗ウサギIgG H&L (HRP) | 1:5000 |
| P-P65 | 1:300 | 1:5000 | |
| BCL-2 | 1:1000 | 1:5000 | |
| バックス | 1:1000 | 1:5000 | |
| Drp1の | 1:800 | 1:5000 | |
| フィス1 | 1:1000 | 1:5000 | |
| MFN2 | 1:800 | 1:5000 |
表3:抗体の希釈倍率。
| 遺伝子 | プライマー配列(5'から3') | ||
| IL-1β-F | CTGTGACTCGTGGGATG | ||
| IL-1β-R | GGGATTTTGTCGTTGCTTGT | ||
| TNF-α-F | GCCTCCTCTCTGCCATCAAG | ||
| TNF-α-R | CTCCAAAGTAGACCTGCCCG | ||
| IL-6-F | GCCCACCAGGAACGAAAGTC | ||
| IL-6-R | GGCAACTGGCTGGAAGTCTCの | ||
| βアクチン-F | CCCATCTATGAGGGTTACGC | ||
| βアクチン-R | TTTAATGTCACGCACGATTTC | ||
表4:プライマー配列。
ディスカッション
MIRIは、心筋虚血再灌流障害の略で、心臓手術36,37における心筋再灌流後に発生する一般的で重大な合併症であり、同時期の対照と比較して臨床転帰を決定的に改善した薬剤やアジュバントはほとんどない38。したがって、そのような損傷から心臓を保護するための効果的な治療法が緊急に必要とされています。伝統的なハーブ製剤であるMunziqは、心臓虚血再灌流障害27,28,30に対する特定の治療効果を実証しています。しかし、これらの知見は予備的なものであり、その根底にあるメカニズムは不明のままです。この研究の目的は、MIRIに対するMunziqの保護効果とメカニズムをさらに調査し、検証することでした。
異常な体液は、伝統的なウイグル医学39,40によると、心血管疾患を含むさまざまな慢性疾患の一般的な症状と呼ばれています。ウイグルの医療システムでは、ABFは長期的なストレスの結果であると考えられており、さまざまな病気の原因と呼ばれています39。この研究では、心臓手術を必要とする心血管疾患の根本的な特性をシミュレートするために、異常な体液モデルが採用されました。MIRIは、心筋虚血再灌流障害を決定するためにABFのラットに誘導されました。
虚血再灌流障害は、複数のプロセスが関与する複雑な病理学的状態です。心臓の虚血再灌流は、心筋4の病理学的変化につながることが報告されています。これらの病理学的変化は、この研究で観察されたように、主に心筋細胞の短縮、肉腫構造の破壊、ミトコンドリアの腫脹41、および緩やかに配置された肉腫筋原線維として現れます。心筋損傷はまた、血清酵素の変化をもたらします。心筋損傷42,43の後に、血清中のcTnT、CK-MB、およびICAM-1のレベルが上昇することはよく知られている。したがって、これらのバイオマーカーは、急性心筋損傷の程度を評価するために使用されます。本研究では、虚血再灌流障害後の心筋の病理学的変化と血清酵素の上昇を観察し、MIRIモデルの確立が成功したことを示しました。その結果、ABF MIRI群の心筋損傷は、対照群のMIRI群と比較してより深刻であることが示されました。Munziqによる治療後、病理学的変化は著しく緩和され、血清酵素レベルは大幅に低下しました。.まとめると、これらの知見は、MIRI中のムンジクの心臓保護効果を示しています。
この研究では、左前下行(LAD)動脈を30分間結紮した後、120分間再灌流して、ラットの虚血再灌流損傷モデルを確立しました。ラットにおける虚血再灌流傷害モデルの作成に用いられた43の研究を要約したメタアナリシス44 は、虚血時間が30〜60分の範囲であり、再灌流時間が30〜120分であることを示した。一部の研究では、5分間の虚血とそれに続く5分間の再灌流、4×45の繰り返しのプロトコルが採用されました。これらの方法の中で、30分の虚血と120分の再灌流を含むプロトコルが最も頻繁に利用され、19例に現れました。実験過程では、虚血の30分後の直接目視検査により、心筋の淡い色が観察されました。心筋の色の変化を視覚的に評価することに加えて、STセグメントの上昇などの虚血の兆候を特定するために、心電図(ECG)モニタリングが採用されました。トロポニンやクレアチンキナーゼなどの血清マーカー、心拍数(HR)、左心室拡張期血圧(LVDP)、左心室収縮期血圧(LVSP)などの血行動態パラメーターはすべて、虚血モデル46の有効性を評価するための指標として役立ちます。この研究では、虚血と再灌流の影響を評価するために、主に目視観察に依存しました。ラット間の個人差のため、すべてのラットに均一な虚血期間を適用するのではなく、虚血の有効性を評価するための追加の客観的手段で目視検査を補完することをお勧めします。.
哺乳動物では、NF-κBファミリーは5つのメンバーからなり、そのうちの1つはp6513,47です。細胞47におけるNF-κBの活性化には、主に2つの経路があります。標準的な経路では、IKK複合体(IKKα、IKKβ、およびIKKγ)の活性化により、IκBタンパク質がリン酸化され、NF-κBの活性化が開始されます。非標準的なNF-κB経路では、NF-κBの活性化はNIKとIKKαのリン酸化によって媒介されます。広範な証拠は、NF-κB経路が虚血および再灌流損傷の媒介において重要な役割を果たすことを示唆している48,49,50。NF-κBの活性化を妨害すると、虚血および再灌流によって誘発される損傷を弱めることができる51,52。興味深いことに、ABF MIRIグループではNF-κBシグナル伝達経路の活性化が進み、下流の炎症性サイトカインのレベルが高かった。
多くの伝統的な漢方薬は、NF-κB経路を調節することにより、虚血および再灌流障害に対する保護効果を発揮することが示されています。例えば、Liuら53 は、ケルセチンがNF-κB経路を阻害することによりMIRIを緩和することを発見しました。Han et al.54 は、ヒドロキシサフロールイエローAがTLR4/NF-κBシグナル伝達を阻害することによりMIRIを緩和することを報告した。しかし、ムンジクがNF-κBシグナル伝達経路を通じてMIRIで保護的な役割を果たしているかどうかは、まだ解明されていません。本研究では、Munziqのメカニズムをさらに解明するために、NF-κBシグナル伝達経路におけるNIK、IKKα、pIKKα、p65などの主要リンパ節の発現レベルを解析しました。その結果、これらのタンパク質の発現レベルは、Munziq治療後に有意に低下したことが示され、MungiqがMIRI中にNF-κBシグナル伝達経路の主要なノードの発現を阻害することを示しています。
NF-κBの活性化が炎症性タンパク質および接着分子の産生を引き起こし、その結果リンパ球が動員されるという考えを支持する広範な証拠がある55。例えば、Valenら56 は、NF-κBが活性化され、心筋虚血/再灌流中にIL-1βおよびTNF-αのレベルが上昇しることを発見しました。さらに、NF-κBによって調節される炎症誘発性サイトカインであるIL-6は、再灌流中に発現の増加を示す57。これらの知見と一致して、この研究の結果は、Munziqが心筋虚血/再灌流障害(MIRI)の状況で炎症誘発性サイトカイン(IL-1β、IL-6、TNF-αを含む)のレベルを有意に阻害することを示しています。このことから、MunziqはNF-κBシグナル伝達経路の抑制を通じて炎症誘発性サイトカインの発現に阻害効果を発揮していると推測できます。
結論として、結果はMIRIがABFでより深刻であったことを示唆しています。ムンジクは虚血および再灌流障害において心臓保護効果があります。この保護効果は、NF-κBシグナル伝達経路を抑制することによって作用し得る。これらの知見は、ムンジックが心臓手術中の再灌流損傷から心臓を保護するための治療薬として大きな可能性を秘めていることを示唆しています。
この研究にはいくつかの制限があります。まず、この研究はラットモデルで行われており、これは貴重なトランスレーショナルモデルであるにもかかわらず、ヒトの心血管疾患の複雑さを完全に再現していない可能性があります。第二に、この研究は主に、Munziqの効果のメカニズム的基盤としてNF-κBシグナル伝達経路に焦点を当てています。ただし、MIRIは多因子プロセスであり、他のさまざまなシグナル伝達経路や分子メカニズムが関与する可能性があります。
現在の研究は、特に異常な体液(ABF)の文脈で、心筋虚血再灌流障害(MIRI)のラットモデルにおけるMunziqの潜在的な心臓保護効果に関する貴重な洞察を提供しますが、将来の調査のためのいくつかの領域があります。さらなる研究の1つの手段は、培養心筋細胞を用いた in vitro 研究を実施し、虚血および再灌流に対する細胞応答に対するMunziqの影響を直接観察することです。さらに、マルチオミクスアプローチを採用することで、ムンジック治療に関連する分子変化をより包括的に把握できる可能性があり、その心臓保護効果に寄与する追加の経路やメカニズムを明らかにする可能性があります。また、潜在的な副作用を最小限に抑えながら、最大限の心臓保護のための最適な投与量を決定するために、さまざまな用量のムンジクを検討することも有益です。心機能に対するMunziqの持続的な影響を評価し、長期使用に関連する潜在的な副作用を監視するには、長期的な研究が必要です。.
開示事項
著者は何も開示していません。
著者の貢献:
ドゥオリクン・ムタイリフが実験を行い、アブドゥサイミ・アイニが原稿の初期草稿を書き、データを分析しました。Aili Aibibulaは、研究の構想とデザインに貢献しました。Zheng Liu氏とAbudunaibi Maimaitiaili氏は、この研究のデザインに参加しました。アブドゥナイビ・マイマイティアイリが研究資金を手配しました。そして、すべての著者が最終原稿を読み、承認しました。
謝辞
この研究は、中国国家自然科学基金会[助成金番号:82060907]および「天山エリート」ハイレベル医療および健康人材育成プログラム[助成金番号]の支援を受けました。TSYC202301B004]。
資料
| Name | Company | Catalog Number | Comments |
| ABI 7500 Real-time PCR | ABI, CA, USA | Used for performing qRT-PCR. | |
| Adult male Sprague-Dawley (SD) rat | Animal Experimental Center of Xinjiang Medical University | ||
| Anti-NF-kB p65, anti-NF-kB Inducing Kinase NIK, anti-IKK alpha, anti-IKK alpha (phospho T23), anti-β-actin | Abcam, CA, USA | Used for Western blot analysis targeting specific proteins. | |
| Anti-TTC11/FIS1 Antibody | abcam | ab71498 | Used for protein detection in Western Blot (WB) experiments. |
| BCA Protein Assay Kit | Tiangen Biotech Co., Ltd., Beijing, China | Used for determining protein concentration. | |
| beta-Actin Loading Control antibody Mouse Mab | Sino Biological | 100166-MM10 | Used for protein detection in Western Blot (WB) experiments. |
| ChemiScope 3300 Imaging System | Clinx Science Instruments, Shanghai, China | Used for scanning developed films from Western blot analysis. | |
| ELISA kit for CK-MB detection | Nanjing Jiancheng Bioengeering Institute(Nanjing, China) | Used for detecting levels of cardiac injury indexes | |
| ELISA kit for cTn-T, ICAM-1, IL-1β, IL-6, TNF-α detection | CUSABIO Biotech CO., Ltd. (Wuhan, China) | Used for detecting levels of cardiac injury indexes and inflammatory cytokines in rat serum samples. | |
| FastQuant RT Kit | TIANGEN, Beijing China | Used for reverse transcription of cDNA. | |
| HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG | Thermo Scientific, Basingstoke, UK | ||
| LDH Assay kit and MDA Assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting LDH and MDA levels in myocardium tissues from the infarct area in the left ventricle. | |
| Munziq | provided by Xinjiang Medical University | The main investigational drug in this study | |
| NF-κB p65 (D14E12) XP Rabbit mAb #8242 | CST | 8242S | Used for protein detection in Western Blot (WB) experiments. |
| Nitric Oxide (NO) assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting NO levels at 550 nm in myocardial tissue. | |
| Phospho-NF-κB p65 (Ser536) (93H1) Rabbit mAb #3033 | CST | 3033S | Used for protein detection in Western Blot (WB) experiments. |
| Quantity One software | Bio-Rad Laboratories, Hercules, CA, USA | Used for analyzing Western blot images. | |
| Recombinant Anti-DRP1 Antibody | abcam | ab184247 | Used for protein detection in Western Blot (WB) experiments. |
| RIPA lysis buffer | Boster Biotechnology Co., Ltd., Wuhan, China | AR0105 | Used for extracting total proteins from rat ventricular tissues. |
| Secondary antibodies (HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG) | Thermo Scientific, Basingstoke, UK | Used for detection following primary antibody incubation in Western blot analysis. | |
| SYBR Select Master Mix | ABI, CA, USA | Used in qRT-PCR analysis on ABI 7500 Real-time PCR instrument. | |
| transmission electron microscope | HitachiS-2400 Hitachi, Tokyo, Japan | Used to examine thin sections of ventricular tissues. | |
| Trizol reagent | Invitrogen Co., Carlsbad, California, USA | Used for RNA extraction from ventricular tissues. |
参考文献
- Anderson, J. L., Campion, E. W., Morrow, D. A. Acute myocardial infarction. New Engl J Med. 376 (21), 2053-2064 (2017).
- Vos, T., et al. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet. 396 (10258), 1204-1222 (2020).
- Murphy, A., Goldberg, S. Mechanical complications of myocardial infarction. Am J Med. 135 (12), 1401-1409 (2022).
- Heusch, G. Myocardial ischemia/reperfusion: Translational pathophysiology of ischemic heart disease. Medicine. 5 (1), 10-31 (2024).
- Bhatt, D. L., Lopes, R. D., Harrington, R. A. Diagnosis and treatment of acute coronary syndromes. Jama. 327 (7), 662-675 (2022).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: A target for cardioprotection. Cardiovasc Res. 115 (7), 1143-1155 (2019).
- Gunata, M., Parlakpinar, H. A review of myocardial ischaemia/reperfusion injury: Pathophysiology, experimental models, biomarkers, genetics and pharmacological treatment. Cell Biochem Funct. 39 (2), 190-217 (2020).
- He, J., et al. Myocardial ischemia/reperfusion injury: Mechanisms of injury and implications for management (review). Exp Ther Med. 23 (6), 430 (2022).
- Xiang, M., et al. Role of oxidative stress in reperfusion following myocardial ischemia and its treatments. Oxid Med Cell Longevity. 2021, 1-23 (2021).
- Astudillo, A. M., Balboa, M. A., Balsinde, J. Compartmentalized regulation of lipid signaling in oxidative stress and inflammation: Plasmalogens, oxidized lipids and ferroptosis as new paradigms of bioactive lipid research. Prog Lipid Res. 89, 101207 (2023).
- Algoet, M., et al. Myocardial ischemia-reperfusion injury and the influence of inflammation. Trends Cardiovasc Med. 33 (6), 357-366 (2023).
- Zhang, F., et al. Β-cryptoxanthin alleviates myocardial ischaemia/reperfusion injury by inhibiting nf-κb-mediated inflammatory signalling in rats. Arch Physiol Biochem. 128 (4), 1128-1135 (2020).
- Guo, Q., et al. Nf-κb in biology and targeted therapy: New insights and translational implications. Signal Transduct Target Ther. 9 (1), 53 (2024).
- Mi, J., et al. Inhibition of heat shock protein family a member 8 attenuates spinal cord ischemia-reperfusion injury via astrocyte nf-κb/nlrp3 inflammasome pathway. J Neuroinflammation. 18 (1), 170 (2021).
- Zhang, L., Zhao, S., Wang, Y. Diannexin alleviates myocardial ischemia-reperfusion injury by orchestrating cardiomyocyte oxidative damage, macrophage polarization and fibrotic process by tlr4-nf-kb-mediated inactivation of nlrp3 inflammasome. Int Immunopharmacol. 130, 111668 (2024).
- Zhou, Y., et al. Qingchang mixture prevents the intestinal ischemia-reperfusion injury through tlr4/nf-kb pathway. Combinatorial Chem High Throughput Screen. 26 (1), 49-57 (2023).
- Ozturk, A., et al. The protective effects of trimetazidine against ovary ischemia-reperfusion injury via the tlr4/nf-kb signal pathway. J Biochem Mol Toxicol. 36 (8), e23114 (2022).
- Du, S., Deng, Y., Yuan, H., Sun, Y. Safflower yellow b protects brain against cerebral ischemia reperfusion injury through ampk/nf-kb pathway. Evid Based Compl Alt Med. 2019, 1-11 (2019).
- Dong, X., et al. Physcion protects rats against cerebral ischemia-reperfusion injury via inhibition of tlr4/nf-kb signaling pathway. Drug Design Dev Therapy. 15, 277-287 (2021).
- Hashmi, S., et al. Hydrogen sulphide treatment prevents renal ischemia-reperfusion injury by inhibiting the expression of icam-1 and nf-kb concentration in normotensive and hypertensive rats. Biomolecules. 11 (10), 1549 (2021).
- Gao, L., et al. Hic-5 deficiency attenuates hepatic ischemia reperfusion injury through tlr4/nf-κb signaling pathways. Life Sciences. 249, 117517 (2020).
- Xu, Z., et al. Cardioprotection of mab2g4/odn/lip on myocardial ischemia-reperfusion injury via inhibiting the nf-κb signaling pathway. Cardiovas Ther. 2023, 1-15 (2023).
- Xiao, G., et al. Cxcr1 and its downstream nf-κb inflammation signaling pathway as a key target of guanxinning injection for myocardial ischemia/reperfusion injury. Front Immunol. 13, 1007341 (2022).
- Jeddi, S., Gheibi, S., Kashfi, K., Carlström, M., Ghasemi, A. Dose-dependent effects of long-term administration of hydrogen sulfide on myocardial ischemia-reperfusion injury in male wistar rats: Modulation of rkip, nf-κb, and oxidative stress. Int J Mol Sci. 21 (4), 1415 (2020).
- Yao, Y., et al. Targeting camkii-δ9 ameliorates cardiac ischemia/reperfusion injury by inhibiting myocardial inflammation. Circ Res. 130 (6), 887-903 (2022).
- Zhuang, L., Zong, X., Yang, Q., Fan, Q., Tao, R. Interleukin-34-nf-κb signaling aggravates myocardial ischemic/reperfusion injury by facilitating macrophage recruitment and polarization. eBioMedicine. 95, 104744 (2023).
- Maimaitiaili, A., et al. Effects of different doses of savda munziq on myocardial ischemia-reperfusion injury in rats with abnormal savda syndrome. Genet Mol Res. 13 (3), 4729-4735 (2014).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Hao, Y., et al. Transition of the abnormal savda syndrome to the hepatic carcinoma shifted unfolded protein response to autophagy was partly reversed by savda munziq in a rat model. Biomed Pharmacother. 121, 109643 (2020).
- Maimaitiaili, A., Li, J., Aibibula, A., Abudureheman, M. Erratum: Inhibition of nuclear factor kappa b pathway protects myocardial ischemia/reperfusion injury in rats under treatment with fufang munziq granule (munziq). Am J Transl Res. 10 (11), 3876 (2018).
- Zhang, X., et al. Rosa rugosa flavonoids alleviate myocardial ischemia reperfusion injury in mice by suppressing jnk and p38 mapk. Microcirculation. 24 (7), (2017).
- Dong, P., Liu, K., Han, H. The role of nf-κb in myocardial ischemia/reperfusion injury. Curr Prot Peptide Sci. 23 (8), 535-547 (2022).
- Guo, X., et al. Differential integrative omic analysis for mechanism insights and biomarker discovery of abnormal savda syndrome and its unique munziq prescription. Sci Rep. 6, 27831 (2016).
- Awad, A. S. Role of at1 receptors in permeability of the blood-brain barrier in diabetic hypertensive rats. Vascul Pharmacol. 45 (3), 141-147 (2006).
- La, X., et al. Upregulation of pd-1 on cd4(+)cd25(+) t cells is associated with immunosuppression in liver of mice infected with echinococcus multilocularis. Int Immunopharmacol. 26 (2), 357-366 (2015).
- Wu, T., et al. Circulating small extracellular vesicle-encapsulated sema5a-it1 attenuates myocardial ischemia-reperfusion injury after cardiac surgery with cardiopulmonary bypass. Cell Mol Biol Lett. 27 (1), 95 (2022).
- Pinto, A., et al. The extracellular isoform of superoxide dismutase has a significant impact on cardiovascular ischaemia and reperfusion injury during cardiopulmonary bypass. Eur J Cardio-Thor Surg. 50 (6), 1035-1044 (2016).
- Sabe, S. A., Harris, D. D., Broadwin, M., Sellke, F. W. Cardioprotection in cardiovascular surgery. Basic Res Cardiol. 119 (4), 545-568 (2024).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Mamtimin, B., et al. An magnetic resonance-based plasma metabonomic investigation on abnormal savda in different complicated diseases. J Tradl Chinese Med. 34 (2), 166-172 (2014).
- Marin, W., Marin, D., Ao, X., Liu, Y. Mitochondria as a therapeutic target for cardiac ischemia-reperfusion injury (review). Int J Mol Med. 47 (2), 485-499 (2020).
- Novack, V., et al. Troponin criteria for myocardial infarction after percutaneous coronary intervention. Arch Intern Med. 172 (6), 502-508 (2012).
- Kemp, M., Donovan, J., Higham, H., Hooper, J. Biochemical markers of myocardial injury. Br J Anaesth. 93 (1), 63-73 (2004).
- Zhang, D. Z., Jia, M. Y., Wei, H. Y., Yao, M., Jiang, L. H. Systematic review and meta-analysis of the interventional effects of resveratrol in a rat model of myocardial ischemia-reperfusion injury. Front Pharmacol. 15, 1301502 (2024).
- Ta, F. X., Zhang, T., Zhu, C. M. Correlation between mir-21 and the protective effects of resveratrol against myocardial ischemia/reperfusion injury in rats. Chin. J. Arteriosclerosis. 21 (6), 493-496 (2013).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. Am J Physiol Heart Circ Physiol. 314 (4), H812-H838 (2018).
- Oeckinghaus, A., Hayden, M. S., Ghosh, S. Crosstalk in nf-kappab signaling pathways. Nat Immunol. 12 (8), 695-708 (2011).
- Van Der Heiden, K., Cuhlmann, S., Luong Le, A., Zakkar, M., Evans, M. Role of nuclear factor kappab in cardiovascular health and disease. Clin Sci. 118 (10), 593-605 (2010).
- Ha, T., et al. Toll-like receptors: New players in myocardial ischemia/reperfusion injury. Antioxid Redox Signal. 15 (7), 1875-1893 (2011).
- Pourrajab, F., Yazdi, M. B., Zarch, M. B., Zarch, M. B., Hekmatimoghaddam, S. Cross talk of the first-line defense tlrs with pi3k/akt pathway, in preconditioning therapeutic approach. Mol Cell Ther. 3, 4 (2015).
- Wang, Y. H., et al. Lumbrokinase attenuates myocardial ischemia-reperfusion injury by inhibiting tlr4 signaling. J Mol Cell Cardiol. 99, 113-122 (2016).
- Yu, H., et al. Gypenoside protects cardiomyocytes against ischemia-reperfusion injury via the inhibition of mitogen-activated protein kinase mediated nuclear factor kappa b pathway in vitro and in vivo. Front Pharmacol. 7, 148 (2016).
- Liu, X., et al. Peroxisome proliferator-activated receptor gamma (ppargamma) mediates the protective effect of quercetin against myocardial ischemia-reperfusion injury via suppressing the nf-kappab pathway. Am J Transl Res. 8 (12), 5169-5186 (2016).
- Han, D., et al. Hydroxysafflor yellow a alleviates myocardial ischemia/reperfusion in hyperlipidemic animals through the suppression of tlr4 signaling. Sci Rep. 6, 35319 (2016).
- Yang, Q., He, G. W., Underwood, M. J., Yu, C. M. Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury: Perspectives and implications for postischemic myocardial protection. Am J Transl Res. 8 (2), 765-777 (2016).
- Valen, G., Paulsson, G., Vaage, J. Induction of inflammatory mediators during reperfusion of the human heart. Ann Thorac Surg. 71 (1), 226-232 (2001).
- Saini, H. K., et al. Role of tumour necrosis factor-alpha and other cytokines in ischemia-reperfusion-induced injury in the heart. Exp Clin Cardiol. 10 (4), 213-222 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved