Research Article
Herbal Munziq, iltihabı inhibe ederek miyokardiyal iskemi-reperfüzyon hasarını iyileştirir
Bu Makalede
Özet
Bu çalışma, geleneksel bir Uygur bitkisel preparatı olan Munziq'in anormal vücut sıvısına sahip sıçanlarda miyokardiyal iskemi-reperfüzyon hasarı (MIRI) üzerindeki kardiyoprotektif etkilerini araştırmaktadır. Kapsamlı deneysel yöntemler sayesinde, Munziq'in NF-κB sinyal yolunu baskılayarak MIRI'yi azaltma potansiyelini gösteriyoruz.
Özet
Bu çalışmanın amacı, Munziq'in anormal vücut sıvısı miyokardiyal iskemi-reperfüzyon hasarı (MIRI) ve altta yatan mekanizması üzerindeki kardiyoprotektif etkilerini araştırmaktır. Normal sıçanlar ve anormal vücut sıvısına (ABF) sahip sıçanlar, 21 gün boyunca Munziq ile ön tedavi edildi. Bunu takiben MIRI modelleri oluşturulmuştur. Miyokard hasarının patolojik belirtilerini gözlemlemek için Hematoksilen ve Eozin (HE) boyama ve transmisyon elektron mikroskobu ile histopatolojik değişiklikler ve miyokardiyal ultrayapı değişiklikleri gözlendi. Serum CK-MB, cTn-T ve ICAM-1 seviyeleri, miyokard hasarı ile ilişkili belirteçleri gözlemlemek için Enzim Bağlantılı İmmünosorbent Testi (ELISA) ile tespit edildi. Serum ve miyokard dokusundaki IL-1β, IL-6 ve TNF-α seviyeleri de anti-inflamatuar etkiyi gözlemlemek için ELISA ile tespit edildi. NF-κB sinyal yolağı ile ilişkili proteinler NIK, IKKα, Pikα ve p65'in ekspresyon seviyeleri Western blot analizi ile tespit edildi. Sonuçlar, ABF MIRI grubundaki miyokard hasarının kontrol MIRI grubuna kıyasla daha şiddetli olduğunu gösterdi. Munziq ön tedavisi, iskemi-reperfüzyon hasarının neden olduğu patolojik değişiklikleri hafifletme potansiyeline sahiptir ve kardiyak fonksiyonu koruyabilir. NF-κB yolunun ve aşağı akış efektörleri IL-1β, IL-6 ve TNF-α'nin protein seviyeleri, MIRI grubunda önemli ölçüde yukarı regüle edilirken, Munziq grubunda aşağı regüle edildi. İlginç bir şekilde, ABF MIRI grubunda NF-κB sinyal yolunun daha fazla aktivasyonu ve daha yüksek seviyelerde aşağı akış inflamatuar sitokin vardı. Sonuçlar, MIRI'nin ABF'de daha şiddetli olduğunu göstermektedir. Munziq'in iskemi ve reperfüzyon hasarında kardiyoprotektif etkileri vardır. Bu koruyucu etki, NF-κB sinyal yolunu baskılayarak gerçekleştirilebilir.
Giriş
Miyokard iskemisi, miyokardın yeterli kan akışı almadığı, esas olarak koroner arterlerin1 darlığı veya trombozunun neden olduğu ve hastalar için ölümcül sonuçlara yol açabilen bir durumdur 2,3. Miyokard metabolizması neredeyse tamamen aerobik olduğundan ve çok sınırlı glikojen depoları içerdiğinden, öncelikle PCI veya intravenöz tromboliz yoluyla kan akışını derhal eski haline getirmek önemlidir. Etkili miyokardiyal reperfüzyon, iskemik miyokardın prognozunu iyileştirmek için çok önemli olmakla birlikte, aynı zamanda miyokardiyal iskemi-reperfüzyon hasarı (MIRI) riskini de beraberinde getirir4,5,6. MIRI, miyokardiyal reperfüzyon tedavilerinin etkinliğini etkileyen önemli bir zorluktur7. MIRI'nin gelişimine çok sayıda faktör ve mekanizma katkıda bulunur. Örneğin, endotel hücrelerinde reperfüzyon, reaktif oksijen türlerinin (ROS) birikmesine ve serbest radikal temizleyicilerin tükenmesine neden olur, bu da oksidatif stresinvarlığını gösterir 4,8. Bu oksidatif stres daha sonra inflamatuar bir yanıtı tetikleyebilir, bu da enflamatuar faktörlerin daha fazla salınmasına, yapışma molekülü üretiminin artmasına ve lökositlerin işe alınmasına yol açabilir 9,10,11. Aktive edilmiş B hücrelerinin (NF-κB) nükleer faktör kappa-hafif zincir arttırıcısı, miyokardiyal iskemi / reperfüzyon hasarı12 sırasında inflamatuar yanıtta çok önemli bir rol oynar. Memeli NF-κB transkripsiyon faktörü ailesi beş üye içerir: NF-κB1 (p105/p50 olarak da bilinir), NF-κB2 (p100/p52 olarak da bilinir), p65 (RELA olarak da adlandırılır), RELB (V-Rel retiküloendotelyalyoz viral onkogeninin homologu) ve c-REL13,14. NF-κB yolunun inhibisyonunun miyokard 12,15, bağırsak16, yumurtalık17, beyin18,19, böbrekler20 ve karaciğer21 dahil olmak üzere çeşitli dokularda iskemi / reperfüzyon hasarını hafiflettiği gösterilmiştir. Özellikle, NF-κB sinyal yolu, iskemi ve reperfüzyona miyokardiyal yanıtta önemli bir aracı olarak kapsamlı bir şekilde belgelenmiştir12,14, olası mekanizmalar arasında inflamatuar yanıtların teşvik edilmesi, hücre adezyon moleküllerinin ekspresyonunun düzenlenmesi, oksidatif stres reaksiyonlarına katılma ve hücre ölümü ve hayatta kalma yollarının etkilenmesi yer alır 12,20,22,23,24,25. NF-κB aktivasyonunu azaltmayı amaçlayan terapötik müdahaleler, MIRI23,26'nın hafifletilmesinde önemli bir potansiyel göstermiştir.
Geleneksel Çin tıbbının ayrılmaz bir parçası olan Uygur tıbbı, dört mizah teorisi üzerine kurulmuştur: ateş, hava, su ve toprak. Bu mizahlar kan, balgam, sarı safra ve kara safra gibi vücut sıvılarına yol açar27,28. Bu dört vücut sıvısı arasında dinamik homeostazın korunması, insan vücudunun genel sağlığı için çok önemlidir. Dengesiz vücut sıvıları olarak adlandırılan bu sıvılardaki herhangi bir dengesizlik, hastalıkların başlamasına neden olabilir. Çeşitli dengesiz vücut sıvıları arasında baskın olanı, anormal Savda sendromu (ASS) olarak da bilinen anormal vücut sıvısı (ABF) olarak bilinir27,28. Uygur doktorlar tarafından yaygın olarak kullanılan geleneksel bir Uygur ilacı olan Munziq, anormal vücut sıvısının tedavisi için reçete edilir. Prospektüsünde belirtildiği gibi on farklı tıbbi türden oluşan bitkisel bir tıbbi preparattır., Cordia dichotoma Forst. f., Anchusaitalica Retz., Glycyrrhiza uralensis Fisch., Adiantum capillusveneris L., Euphorbia humifusa Willd., Ziziphus jujuba Mill., Lavandula angustifolia Mill., Foeniculum vulgare Mill., Melissa officinalis L. ve Alhagi pseudoalhagi Desv29. Munziq, 2003 yılında Devlet Gıda ve İlaç Dairesi tarafından Z65020166 kod numarasıyla onaylanmıştır. Aktif kimyasal bileşenleri pirinç, fenoller, organik asitler, amino asitler, saponin, şeker ve diğerlerini kapsar. Munziq, antioksidan, antienflamatuar, bağışıklık düzenleyici, anti-trombosit agregasyonu ve antitrombotik etkiler dahil olmak üzere birçok etki sergiler 27,28,30.
Önceki çalışmalarımız, Munziq tıbbının miyokardiyal iskemi / reperfüzyon hasarını (MIRI) hafifletebileceğini göstermiştir, ancak spesifik mekanizmalar belirsizliğini korumaktadır. Anormal Savda sendromlu miyokardiyal iskemi-reperfüzyon yaralanması olan sıçanlarda Munziq'in miyokardiyal koruyucu etkileri gösterilmiştir. Nükleer faktör kappa b yolunun inhibisyonu, Fufang Munziq granülü (Munziq) 27,28,30 ile tedavi edilen sıçanlarda miyokardiyal iskemi / reperfüzyon hasarını korur. Bununla birlikte, Munziq'in MIRI'deki rolünü ve mekanizmasını araştıran sınırlı sayıda araştırma bulunmaktadır.
Bu çalışma, anormal vücut sıvısı (ABF) olan sıçanlarda Munziq'in miyokardiyal iskemi-reperfüzyon hasarı (MIRI) üzerindeki kardiyoprotektif etkilerini araştırmayı ve özellikle NF-κB sinyal yolağına odaklanarak altta yatan mekanizmaları araştırmayı amaçlamaktadır. Bu çalışmada önerilen hipotez, Munziq ön tedavisinin MIRI'nin neden olduğu patolojik değişiklikleri hafifletebileceği ve potansiyel olarak NF-κB sinyal yolunu ve aşağı akış inflamatuar yanıtlarını baskılayarak kardiyak fonksiyonu koruyabileceğidir. Hipotez, hem kontrol hem de ABF gruplarında sahte, iskemi-reperfüzyon hasarı (MIRI) ve iskemi-reperfüzyon hasarı + Munziq modelleri oluşturularak test edilmiştir. Kardiyak fonksiyon, inflamasyonla ilgili göstergeler ve NF-κB yolu ile ilişkili proteinler izlenir.
Protokol
200-220 g ağırlığındaki yetişkin erkek Sprague-Dawley (SD) sıçanı, Ulusal Sağlık Enstitüleri Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na uygun olarak kullanıldı. Sincan Tıp Üniversitesi Hayvan Deney Merkezi. Anormal vücut sıvısına (ABF) sahip hayvan modelleri, Sincan Tıp Üniversitesi Deney Hayvanları Merkezi tarafından sağlandı. Sıçanlar, geleneksel Uygur tıbbı teorisine göre ve önceki çalışmalarda gösterildiği gibi, sıçanlarda anormal vücut sıvısı (ABF) modelini oluşturmak için gerekli olan, daha önce tarif edildiği gibi kuru-soğuk bir ortamda tutuldu 29,33. Tüm hayvan deneyleri, Sincan Tıp Üniversitesi'nin etik yönergelerine göre yürütüldü ve ARRIVE yönergelerine uygun olarak gerçekleştirildi. Omurgalı hayvan (sıçan) çalışmaları için protokol, Sincan Tıp Üniversitesi kurumsal etik komitesi tarafından onaylandı (IACUC-20200318-16).
1. Hayvan gruplaması, ilaç uygulaması ve MIRI modelinin kurulması
- Sıçanları aşağıdaki altı gruba rastgele atayın: i) kontrol sahte grubu, ii) kontrol MIRI grubu, iii) ABF sahte grubu, iv) ABF MIRI grubu, v) kontrol MIRI + Munziq grubu ve vi) ABF MIRI + Munziq grubu.
- ABF grubundaki sıçanları, 6 °C ila 1 °C sıcaklığa ve% 25 ila% 32.8 bağıl nem aralığına ayarlanmış iklim kutuları içinde kontrollü bir ortamda ±. Sıçanlara kuru soğuk yiyeceklerle, yani arpa ve kişniş tohumlarıyla 7:1.5:1.5 oranında karıştırılmış normal yem sağlayın ve ABF modelini 29,33 oluşturmak için bu yöntemi21 gün boyunca uygulayın.
- Etkili klinik dozun iki katı olan MIRI ameliyatından 21 gün önce Munziq grubuna 5 g / kg Munziq (1 mL damıtılmış suda çözülmüş 5.0 g Munziq) intragastrik uygulama ile uygulayın. Control Sham, Control MIRI ve Control MIRI + Munziq grupları gibi ABF olmayan hayvanlar için, sham grubuna ve MIRI grubuna eşit miktarda normal salin uygulayın ve Munziq grubu için Munziq'in intragastrik uygulamasını sağlayın.
- 21 günlük ön işlemden sonra MIRI modelini oluşturun.
- Ameliyatı, steril bir ortam sağlamak için steril malzemelerle donatılmış özel bir hayvan ameliyathanesinde gerçekleştirin. Sıçanları intraperitoneal sodyum pentobarbital (35 mg / kg) enjeksiyonu (IP) ile uyuşturun; Anestezik etkiyi değerlendirmek için kas gevşemesini, dış uyaranlara yanıt vermeyi ve solunum hızını ve derinliğini gözlemleyin. Bu parametreleri prosedür boyunca her 15 dakikada bir izleyin. Yetersiz anestezi belirtileri ortaya çıkarsa (kas gerginliği, uyaranlara gözle görülür yanıt, artmış veya sığ solunum hızı), 20 mg / kg'lık ek bir doz uygulayın. Son kan alımına kadar tüm prosedür boyunca anesteziyi koruyun. Prosedür sırasında, rektal sıcaklık probu aracılığıyla sürekli izlemeli bir ısıtma yastığı kullanarak sıçanın vücut sıcaklığını 37 ° C'de tutun. Anestezi sırasında kuruluğu önlemek için gözlere veteriner merhemi sürün.
- Ventilatör destekli solunum için trakeostomi yapın. Kalbi açığa çıkarmak için göğsü açmadan önce ameliyat bölgesini sabunlu suyla yıkayın, ameliyat bölgesini tıraş edin ve bölgeyi klorheksidin ve iyot gibi antiseptik solüsyonlarla temizleyin. Prosedür için steril aletler kullanın.
- Göğsü açmak ve kalbi açığa çıkarmak için makas, forseps ve ekartörler dahil olmak üzere standart steril göğüs cerrahisi aletleri kullanın. Göğüs duvarını açın ve kalbi ortaya çıkarın. Doğrudan görselleştirme altında sol ön inen (LAD) arteri tanımlayın. Kalbin yüzeyinde yer alan sol koroner arterin önemli bir dalıdır. 6-0 sütür (4-5 cm) kullanın, bölgesel iskemiyi indüklemek için LAD'yi (sol ön inen) 30 dakika boyunca bağlayın. Miyokardda soluk bir renk gözlemleyerek etkili LAD oklüzyonunu belirleyin.
- 30 dakikalık ligasyondan sonra ligatürü serbest bırakın ve 120 dakika boyunca reperfüzyon yapın. Parlak kırmızı bir renge döndüğünde miyokardın reperfüzyonunu belirleyin. Sahte operasyonu olan sıçanlarda, aynı prosedürü uygulayın, ancak LAD ligasyonu olmadan.
- Reperfüzyondan sonra, sıçanlar sodyum pentobarbital (35 mg / kg, ip) tarafından indüklenen anestezi altında kaldı 34. Sıçanlar derin anesteziye girdikten sonra, bir vakumlu kan alma tüpü kullanarak abdominal aorttan 1-2 mL kan örneği toplayın.
- Abdominal aorttan kan örneği alındıktan sonra, hala derin anestezi altındayken rahim ağzı çıkığı ile sıçanlara ötenazi yapın. Steril forseps ve makas kullanarak sol ventriküldeki enfarktüs bölgesinden miyokard dokusunu toplayın, sadece enfarktüslü bölgeyi gösteren solgun ve hasarlı görünen dokuyu aldığınızdan emin olun. Toplanan dokuyu daha fazla analiz için steril bir kaba koyun.
2. Örnek toplama
- Doku örneği toplama: Steril makas ve steril bir bıçak kullanarak, kalbi sol ventrikül uzun ekseninin orta noktası boyunca, kalbin yönüne dik olarak yatay olarak iki yarıya kesin. Apikal parçanın yarısını iki parçaya bölün: Oda sıcaklığında veya 4 ° C'de 2-24 saat morfolojik inceleme için% 4'te bir paraformaldehit ve diğerini 1-4 saat boyunca 4 ° C'de elektron mikroskobu için glutaraldehitte saklayın.
- İskemik ve iskemik olmayan alanlar da dahil olmak üzere kalbin taban kısmını iki parçaya bölün: Bir kısmı bir kriyoviyal içine yerleştirin, dokuyu sıvı nitrojen içinde hızla dondurun ve ardından moleküler biyoloji testi için -80 ° C ultra düşük sıcaklıklı bir dondurucuya aktarın. Diğer taze kısmı doku reaktif oksijen türleri (ROS) seviyelerinin tespiti ve mitokondriyal ekstraksiyon için kullanın.
- Serum örneği toplama: Deneyin son noktasında, inferior vena kavadan 1-2 mL venöz kan alın, 1000 x g'da 10 dakika santrifüjleyin ve serumu ayrıldıktan sonra -80 °C ultra düşük sıcaklıklı bir dondurucuda saklayın.
3. HE boyama ve transmisyon elektron mikroskobu gözlemi
- Rutin prosedür35'e göre ventriküler miyokard üzerinde HE boyama (hematoksilen-eozin boyama) yapın. Dokuları 24 saat boyunca% 4 paraformaldehit içinde sabitleyin. Numuneleri parafine gömün, 4 μm kalınlığında bölümler halinde kesin ve protokole göre hematoksilen-eozin boyama yöntemini kullanarak boyayın. Mikroskop altında histopatolojik değişiklikleri gözlemlemek için rastgele beş alan seçin.
- Aşağıdaki adımları izleyerek HE boyama deneyleri için her gruptan formalin içinde sabitlenmiş sıçanlardan alınan miyokard dokularını işleyin.
- Doku bölümlerini 1,5 ila 2 dakika pişirmek için 65 °C'lik bir inkübatöre yerleştirin.
- Doku bölümlerini 10 dakika ksilen'e daldırın, ksileni değiştirin ve 10 dakika daha tekrar daldırın. Sırayla susuz alkol I ve II'ye 5 dakika, ardından %95, %90, %80 ve %70 alkol ve her biri 5 dakika damıtılmış suya batırın.
- 3 dakika boyunca hematoksilen ile boyayın. Alkole eklenen hidroklorik asit ile birkaç saniye (1-2 sn) asidik farklılaşma yapın. Musluk suyundaki farklılaşmayı 5 dakika boyunca sonlandırın.
- Damıtılmış suya, %70, %80, %90 ve %95 alkole 3'er dakika ve susuz alkol I ve II'ye 5'er dakika daldırın.
- Etanol içinde% 0.5 eozin ile 1 dakika boyayın, fazla kırmızı rengi çıkarmak için% 95 etanol ile durulayın, ardından 5 dakika susuz etanole batırın. Ksilen I ve II'ye her biri 5 dakika daldırın.
- Nötr balsam ile monte edin. Mikroskop altında dokunun patolojik değişikliklerini gözlemleyin.
4. Kan sitokinlerinin ve kardiyak hasar indekslerinin ELISA tespiti
- 1000 x g'da 10 dakika santrifüjleyerek periferik kandan sıçan serum örneği alın ve -80 ° C'de saklayın. Serumda CK-MB, cTn-T, ICAM-1 gibi Kardiyak yaralanma indekslerinin ve IL-1β, IL-6, TNF-α gibi inflamatuar sitokinlerin seviyelerini, üreticinin talimatlarına göre ve aşağıda açıklandığı gibi ELISA kitlerini kullanarak tespit edin.
- Tüm reaktiflerin en az 30 dakika oda sıcaklığına (18-25 °C) dengelenmesini bekleyin, reaktifleri üreticinin talimatlarına göre hazırlayın ve kullanıma hazır hale getirin.
- Standart kuyucukların tahlil kitinde sağlanan standart çözeltilerin bilinen konsantrasyonlarını içerdiği standart ve numune kuyuları kurun. Bunlar, test edilen numunelerdeki spesifik analit konsantrasyonunu ölçmek için deney sırasında standart bir eğri oluşturmak için kullanılır. Her bir oyuğa 100 μL standart veya numune ekleyin, çalkalayarak hafifçe karıştırın, bir plaka contası ile örtün ve 37 ° C'de 2 saat inkübe edin.
- Sıvıyı atın, boşaltarak kurutun ve yıkamayın. Her oyuğa 100 μL biotin etiketli antikor (Önceden seyreltilmiş 1:100) çalışma solüsyonu ekleyin, yeni bir plaka contası ile örtün ve 37 ° C'de 1 saat inkübe edin.
- Sıvıyı kuyulardan atın, boşaltarak kurutun ve plakayı 3 kez yıkayın. Yıkama başına 2 dakika, oyuk başına 200 μL bekletin ve boşaltarak kurulayın.
- Her oyuğa 100 μL yaban turpu peroksidaz etiketli streptavidin çalışma solüsyonu ekleyin, yeni bir plaka contası ile örtün ve 37 ° C'de 1 saat inkübe edin.
- Sıvıyı kuyulardan atın, boşaltarak kurutun ve plakayı 5 kez yıkayın. Yıkama başına 2 dakika, oyuk başına 200 μL bekletin ve boşaltarak kurulayın.
- Sırayla her bir oyuğa 90 μL substrat çözeltisi ekleyin ve rengi karanlıkta 37 ° C'de 15-30 dakika boyunca geliştirin.
- Reaksiyonu sonlandırmak için her bir oyuğa sırayla 50 μL durdurma çözeltisi ekleyin. Reaksiyonu durdurduktan 5 dakika sonra, bir mikroplaka okuyucu kullanarak 450 nm'de sırayla her bir oyuğun optik yoğunluğunu (OD değerleri) ölçün.
5. MDA, NO ve LDH Seviyesinin Ölçülmesi
- Reperfüzyondan sonra sol ventriküldeki enfarktüs bölgesinden miyokard dokusu (5 mm x 7 mm) alınır. Üreticinin talimatlarını izleyerek LDH Test kitini ve MDA Test kitini kullanarak LDH (laktat dehidrojenaz) ve MDA'yı (malondialdehit) tespit edin. Üreticinin talimatlarına göre Nitrik Oksit (NO) tahlil kitini kullanarak 550 nm'de NO'yu tespit edin.
6. Batı lekesi analizi
- RIPA lizisi kullanarak sıçan ventriküler dokularından toplam proteinleri çıkarın. BCA Protein Test Kitini kullanarak protein konsantrasyonunu belirleyin.
- Hücre içi proteinleri korumak ve hücresel bozulmayı önlemek için, numuneleri hızla dondurmak için sıvı nitrojene batırın. Daha sonra, donmuş numuneleri alın ve bunları bir toz haline getirin, yaklaşık 100 mg numune alın ve bunları önceden soğutulmuş 1.5 mL'lik bir santrifüj tüpüne ekleyin. 400 μL RIPA lizis tamponu (proteaz inhibitörleri ve geniş spektrumlu bir fosfataz inhibitörü ile takviye) ekleyin, ardından iyice karıştırın ve karışımın 60 dakika boyunca 4 ° C'de beklemesine izin verin.
- Karışımı 1000 x g'da 4 °C'de 15 dakika santrifüjleyin. Süpernatanı toplayın ve BCA yöntemini kullanarak protein konsantrasyonunu ölçün.
- BSA standartlarını, Tablo 1'e göre numunelerin tampon sistemine uyan bir seyreltici ile seyreltin.
- Reaktifleri üreticinin talimatlarına göre hazırlayın. Numune sayısına bağlı olarak, yeterli miktarda BCA çalışma çözeltisi hazırlamak için A ve B reaktiflerini 50: 1 hacim oranında karıştırın ve iyice karıştırın. BCA çalışma çözeltisini hazırlamadan önce, iyice karıştırmak için reaktif A'yı çalkalayın.
- Tablo 1'den 20 μL taze hazırlanmış BSA standart çözeltisi ve seyreltilmiş numuneler (10 kat seyreltilmiş) alın ve bunları 96 oyuklu bir plakaya ekleyin.
- Her kuyucuğa 200 μL BCA çalışma solüsyonu ekleyin ve iyice karıştırın. Plakayı kapatın, 37 ° C'de 30 dakika inkübe edin, ardından oda sıcaklığına soğutun veya 2 dakika oda sıcaklığında bekletin.
- Bir mikroplaka okuyucu kullanarak 562 nm'de absorbansı ölçün ve standart eğriye göre numunelerdeki protein konsantrasyonunu hesaplayın.
- Numunelere uygun miktarda 5x SDS-PAGE yükleme tamponu (β-merkaptoetanol içeren) ekleyin, proteinleri tamamen denatüre etmek için 100 °C'de kaynar suda 5 dakika ısıl işlem yapın, 1.000 x g'da 5 dakika santrifüjleyin ve süpernatanı kullanım için alın.
- Tablo 2'deki formül, %15, %12 ve %8 ayırma jellerinin yanı sıra %5'lik bir istifleme jelinin hazırlanmasını özetlemektedir. Çözümleri buna göre hazırlayın. Ayırma jeli solüsyonunu jel kasetinde 2/3 yüksekliğe kadar ekleyin, üzerine damıtılmış su serpin ve oda sıcaklığında 40 dakika bekletin. Ardından kaseti doldurmak için istifleme jelini ekleyin, tarağı yerleştirin ve 10 dakika bekletin.
- Her oyuklu içine 9 μL önceden boyanmış protein markörü yükleyin ve oyuklu başına 50 μg numune proteini yükleyin.
- Bromofenol mavisi ayırma jeline ulaşana kadar 80 V'luk sabit bir voltaj uygulayın, ardından 90 dakika boyunca 100 V'luk sabit bir voltaj uygulayın. Bromofenol mavisi jelin alt kısmına göç ettiğinde elektroforezi durdurun.
- SDS-PAGE'in tamamlanmasından sonra, PVDF membranını 10 saniye boyunca metanole batırın, 1 dakika boyunca damıtılmış suda durulayın ve ardından poliakrilamid jeli, filtre kağıdını ve işlenmiş PVDF membranını 10 dakika boyunca transfer tamponunda bekletin.
- Transfer sandviçini, klipslerin siyah tarafı aşağı bakacak şekilde birleştirin, ardından klipslerin sünger-filtre kağıdı-jel-PVDF membran-filtre kağıdı-sünger-şeffaf tarafı gelecek şekilde birleştirin. Klipsin siyah tarafının kasetin siyah tarafına ve beyaz tarafının kırmızı tarafa baktığından emin olarak klipsleri aktarım kasetine yerleştirin. Aktarımı 100 V'luk sabit bir voltajda gerçekleştirin ve 60 dakikalık bir aktarım süresine sahip bir PVDF membranı kullanın.
- Transferden sonra, PVDF membranını her biri 5 dakika boyunca 3x su ile yıkayın. Membranı 1 saat boyunca% 5 yağsız kuru süt içeren bir blokaj solüsyonu ile bloke edin, ardından her biri 5 dakika boyunca TBST 3x ile yıkayın.
- Primer antikoru Tablo 3'te listelenen seyreltme oranlarına göre TBST ile seyreltin ve gece boyunca 4 ° C'de inkübe edin. Primer antikorlar arasında anti-NF-κB p65 antikoru, anti-NF-κB İndükleyici Kinaz (NIK) antikoru, anti-IKKα antikoru ve anti-β-aktin antikoru bulunur.
- Membranı 3x TBST ile 1x 5 dakika durulayın. Uygun şekilde seyreltilmiş ikincil antikoru ekleyin ( Tablo 3'e göre) ve oda sıcaklığında 1 saat inkübe edin. İkincil antikorlar, HRP konjuge keçi anti-fare IgG ve HRP konjuge keçi anti-tavşan IgG'dir.
- Membranı tekrar 1x TBST 3x ile her biri 5 dakika durulayın. Geliştirilen çözelti A ve B'yi karıştırın, zara 2 mL ekleyin ve mini kemilüminesans cihazını kullanarak tespit edin ve fotoğraflayın.
- Gelişmiş kemilüminesans artı reaktif kullanarak zarı geliştirin. Geliştirilen filmi görüntüleme sistemini kullanarak tarayın. Yazılım kullanarak Western blot görüntülerini analiz edin. Yükleme kontrolü olarak β-aktin kullanın. β-aktinin gri değerine dayalı olarak bağıl protein seviyesini hesaplayın.
7. Gerçek zamanlı PCR analizi (qRT-PCR)
- Toplam RNA ekstraksiyonu
- Üreticinin talimatlarına göre %0.1 DEPC Çözeltisi ve %70 DEPC ile muamele edilmiş Alkol hazırlayın. Her boyuttaki mikrosantrifüj tüplerini ve çeşitli pipet uçlarını %0,1 DEPC solüsyonu ile işlemden geçirin. Gece boyunca ıslatın, ardından otoklavlayın.
- Logaritmik büyüme evresindeki hücreleri iyi büyüme durumuna sahip toplayın. Kültür ortamını hücre kültürü şişesinden atın ve hücreleri 2x Hank solüsyonu ile yıkayın. 10 cm² hücre başına 1 mL tripsin ekleyin, hücreleri ayırmak için hafifçe sallayın ve tamamen ayrılmasını sağlamak için bir pipet kullanın. Tam lizise izin vermek için oda sıcaklığında 5 dakika inkübe edin, ardından hücreleri tamamen parçalamak için 7x-10x yukarı ve aşağı pipetleyin. Lizatı 1.5 mL'lik tüplere aktarın, santrifüjleyin ve süpernatanı saklayın.
- Süpernatanıma eşit miktarda kloroform ekleyin, iyice karıştırın ve oda sıcaklığında 10 dakika bekletin. Fazları ayırmak için 4 °C'de 5 dakika boyunca 1.000 x g'da santrifüjleyin. Üst sulu fazı dikkatlice yeni bir tüpe aktarın (DNA ve proteinleri çıkarıyorsanız, alt fazı koruyun ve 4 ° C'de saklayın).
- İzopropanol (1 mL trizol başına 0.5 mL) ekleyin, iyice karıştırın ve oda sıcaklığında 10 dakika bekletin. 4 ° C'de 1.000 x g'da 10 dakika santrifüjleyin, süpernatantı nazikçe çıkarın ve atın.
- RNA peletini %75 etanol ile yıkayın, 4 °C'de 8.000 x g'da 5 dakika santrifüjleyin, süpernatanı nazikçe çıkarın ve peleti havayla kurutun veya vakumla kurutun. RNA'yı 50 μL DEPC suyunda çözün, alikot yapın ve -70 °C'de saklayın veya cDNA'ya ters transkripsiyona devam edin.
- cDNA'ya ters transkripsiyon
- Üreticinin talimatlarını izleyerek bir kit kullanarak cDNA'nın ters transkripsiyonunu gerçekleştirin.
- Gerçek zamanlı kantitatif PCR
- Gen dizilerine dayalı primerler tasarlayın ve bunları NCBI web sitesinde BLAST kullanarak kontrol edin. CK20 ve β-aktin için 10 μM ileri ve geri primer stok çözeltileri hazırlayın. Tablo 4 , astar dizilerini göstermektedir.
- Gerçek Zamanlı kantitatif PCR
- Reaksiyon sistemine 1 μL cDNA, 10 μL 2x ana karışım, her biri 0.4 μL ileri ve ters astar ve 8.2 μL RNaz içermeyen su ekleyin.
- Aşağıdaki programla PCR gerçekleştirin: 2 dakika boyunca 95 ° C'de ilk denatürasyon, ardından 15 saniye boyunca 95 ° C'de 40 döngü ve 1 dakika boyunca 60 ° C. Dahili kontrol olarak β-aktin kullanın. 2-ΔΔCt yöntemini kullanarak göreli ifadeyi hesaplayın.
8. İstatistiksel analiz
- İstatistiksel analiz için ticari bir yazılım kullanın. Verileri ortalama ± standart sapma (ortalama ± SD) olarak sunun. Farklı gruplar arasındaki farklılıkları karşılaştırmak için Tek Yönlü ANOVA gerçekleştirin. P < 0.05 olarak anlamlı bir fark tanımlayın.
Sonuçlar
Munziq, iskemi-reperfüzyon hasarının neden olduğu patolojik değişiklikleri hafifletir
Miyokard dokularındaki morfolojik değişiklikleri incelemek için öncelikle HE boyaması yaptık. Şekil 1'de gösterilen temsili HE boyaması olarak, sham grubundaki bazı miyokardiyal hücrelerde granüler dejenerasyon ve vakuolar dejenerasyon gözlemledik. Ek olarak, miyokard hücreleri arasında sınırlı bir kırmızı kan hücresi varlığı ve lenfosit infiltrasyonu vardı. Periyodik olarak damar genişlemesi ve tıkanıklığı gözlemledik. MIRI grubundan miyokard dokuları daha ciddi bozulma sergiledi ve daha belirgin morfolojik değişiklikler gösterdi. Bu değişiklikler arasında geniş granüler dejenerasyon, vakuoler dejenerasyon, kırmızı kan hücresi ve lenfosit infiltrasyonu, vasküler dilatasyon ve tıkanıklık vardı. ABF MIRI grubundaki miyokard dokusu hasarı, kontrol MIRI grubunda gözlenene kıyasla daha şiddetliydi. Bununla birlikte, her iki Munziq grubunda da, bazı miyokard hücreleri hafif granüler dejenerasyon ve vakuoler dejenerasyon gösterdi. Kırmızı kan hücrelerinin varlığı ve lenfosit infiltrasyonu, vasküler dilatasyon ve tıkanıklık azdı. Ayrıca, bulgular Munziq'in ABF MIRI sıçanlarında ve kontrol MIRI sıçanlarında üstün kardiyoprotektif etkiler sergilediğini göstermektedir. Sonuç olarak, bu bulgular Munziq ön tedavisinin kalpte iskemi-reperfüzyon hasarının neden olduğu patolojik değişiklikleri hafifletme potansiyeline sahip olduğunu göstermektedir.
Munziq, iskemi / reperfüzyon hasarının neden olduğu mitokondri ve kalp kası liflerinin bozulmasını iyileştirdi
Munziq'in MIRI hasarındaki koruyucu rolünü daha fazla doğrulamak için, TEM kullanarak mitokondriyal ultrastrüktürü ve kalp kası liflerini inceledik. Şekil 2'de gösterildiği gibi, sahte gruptaki miyokard hücreleri, yakından düzenlenmiş miyofibriller ve benzer sarkomer uzunluğu ile sağlam bir yapı sergiledi. Miyofilament yapısı berrak ve hafif gevşek görünürken, çok sayıda mitokondri gözlendi. Tersine, MIRI grubu, hücre şişmesi, değişen sarkomer uzunluğu, belirsiz ve gevşek düzenlenmiş miyofilament yapısı dahil olmak üzere hasarlı miyokard hücrelerinin göstergesi olan patolojik özellikler sergiledi. I/R grubunda sahte gruba kıyasla mitokondride geniş çaplı bozulma ve çözünme olduğu kaydedildi. Ayrıca, kalp kası lifleri düzensiz ve I/R yaralanmasına yanıt olarak kırılmıştı. İlginç bir şekilde, bu değişikliklerin ciddiyeti ABF MIRI grubunda belirgin şekilde daha yüksekti. Buna karşılık, Munziq ile tedavi edilen her iki grup da hasarlı miyokard hücreleri ile ilişkili hafifletilmiş patolojik özellikler sergiledi. Miyokard hücrelerinin şişmesi azaldı ve miyofibrillerin, sarkomerlerin, miyofilamentlerin yapıları ve mitokondri sayısı, sahte grupta gözlenenlere benzerdi. Toplu olarak, bu veriler Munziq ön tedavisinin I / R cerrahisinin neden olduğu mitokondri ve kalp kası liflerinin bozulmasını azaltabileceğini gösterdi.
Miyokardiyal iskemi-reperfüzyon hasarı ABF, MIRI, sıçan ve Munziq ön tedavisinde şiddetlendi, kardiyak fonksiyon korundu
Serum cTn-T, CK-MB ve ICAM-1 düzeyleri ELISA yöntemi kullanılarak tespit edildi. Sonuçlar, kontrol sahte grubu ile ABF sahte grubu arasında belirgin bir eşitsizlik olmadığını ortaya koydu. Bununla birlikte, ABF MIRI grubunun, kontrol MIRI grubuna kıyasla önemli ölçüde yüksek cTn-T (Şekil 3A), CK-MB (Şekil 3B) ve ICAM-1 (Şekil 3C) seviyeleri sergilemesi dikkat çekicidir. Munziq'in kardiyoprotektif etkilerini değerlendirmek için, hem kontrol MIRI sıçanları hem de ABF MIRI sıçanları Munziq ön tedavisine tabi tutuldu. Şekil 3'te gösterildiği gibi, cTn-T, CK-MB ve ICAM-1 seviyeleri Munziq ön tedavi grubunda önemli ölçüde azalmıştır. Bu sonuçlar, Munziq'in ABF MIRI sıçanlarında dikkate değer kardiyoprotektif özellikler sergilediğini göstermektedir.
Munziq ön tedavisinin ABF ve kontrol sıçanlarında iskemi reperfüzyonunun neden olduğu oksidatif stres hasarı üzerindeki etkisini araştırmak için miyokard dokusunda LDH, MDA ve NO değişiklikleri ölçüldü. Şekil 3D,F'de gösterildiği gibi, ABF MIRI grubu, kontrol MIRI grubuna kıyasla önemli ölçüde yüksek MDA seviyeleri sergiledi ve NO seviyelerini önemli ölçüde azalttı. Munziq ön tedavisi, iskemik miyokardda LDH ve MDA içeriğini önemli ölçüde azalttı. Aynı zamanda, Munziq ön tedavisi miyokard dokusundaki NO seviyesini daha da arttırdı.
Munziq ile ön tedavi, proinflamatuar sitokin üretimini engelleyerek MIRI'nin iltihaplanmasını hafifletti
Pro-inflamatuar sitokinler, doğuştan gelen bağışıklık tepkisine aracılık etmede kritik bir rol oynar ve pro-inflamatuar sitokinler, MIRI31 sırasında aktive edilmiştir. Munziq'in anti-enflamatuar etkisini daha fazla araştırmak için, hem kontrol MIRI sıçanlarına hem de ABF MIRI sıçanlarına Munziq ön tedavisi uygulandı. Serum IL-1β, IL-6 ve TNF-α düzeylerini ölçmek için ELISA yöntemi ve miyokard dokusunda IL-1β, IL-6 ve TNF-α mRNA düzeylerini değerlendirmek için qRT-PCR analizi kullanıldı. Sonuçlar, bu sitokin seviyelerinde kontrol sahte grubu ile ABF sahte grubu arasında anlamlı bir fark olmadığını ortaya koydu. IL-1β, IL-6 ve TNF-α seviyeleri, ABF MIRI grubunda kontrol MIRI grubuna kıyasla önemli ölçüde artmıştır. Spesifik olarak, IL-1β hem mRNA hem de protein seviyelerinde önemli bir artış sergiledi ve istatistiksel olarak anlamlı bir fark gözlendi. IL-6 için mRNA düzeyinde fark bulunmazken, protein düzeyinde eşitsizlik bulundu. Benzer şekilde, TNF-α mRNA seviyelerinde herhangi bir değişiklik göstermedi, ancak protein seviyesinde farklılıklar gösterdi. Şekil 4'te gösterildiği gibi, IL-1β, IL-6 ve TNF-α seviyeleri Munziq ön tedavi grubunda önemli ölçüde azalmıştır.
Munziq ile yapılan ön tedavi, NF-κB sinyal yolu yoluyla iltihabı hafifletti
Sitokinlerin üretimi, inflamatuar yanıtın çoğu aşamasında NF-κB sinyal yollarının aktivasyonu ile sıkı bir şekilde bağlantılıdır. NF-κB, enflamatuar rahatsızlıklar için potansiyel bir terapötik hedef olarak kabul edilir32. NF-κB yolunun Munziq'in anti-inflamasyon etkilerinde rol oynayıp oynamadığını değerlendirmek için, başlangıçta NIK, IKKα, pIKKα ve p6513 dahil olmak üzere NF-κB yolunun temel bileşenlerinin ekspresyon seviyelerini ölçmek için Western Blot analizi gerçekleştirdik. Şekil 5'te gösterildiği gibi, iskemik ve reperfüzyon hasarı, MIRI grubu içinde NIK, p-IKKa ve p-p65'in kayda değer bir şekilde yukarı regülasyonuna neden oldu. Munziq ile yapılan tedavi bu yukarı regülasyonu etkili bir şekilde azalttı. Sonuçlar, Munziq'in NF-κB sinyal yolunun aktivasyonunu baskılayarak anti-inflamasyonda kritik bir rol oynadığını gösterdi.
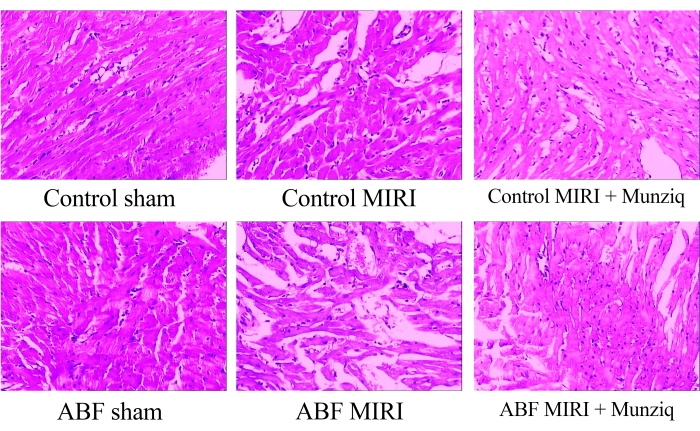
Şekil 1: HE boyama ile gözlenen miyokard dokularının morfolojik değişiklikleri. Farklı grupların temsili HE boyama görüntüleri. Büyütme: 100x. Kısaltmalar: ABF = anormal vücut sıvısı; MIRI = Miyokardiyal İskemi-reperfüzyon hasarı; (n=6). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
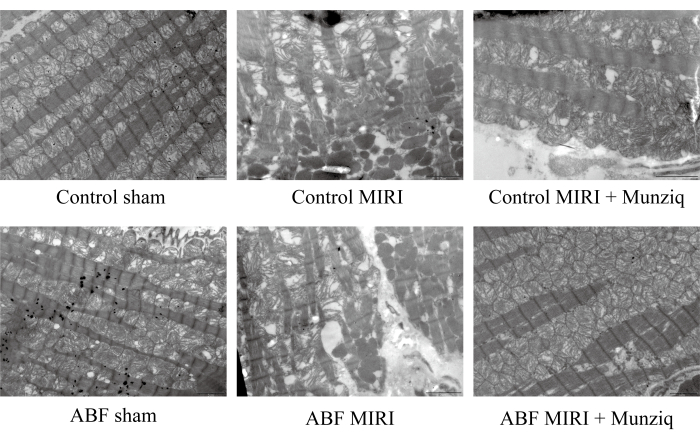
Şekil 2: Munziq, I/R hasarının neden olduğu mitokondri ve kalp kası liflerinin bozulmasını iyileştirdi. Taramalı elektron mikroskobu ile mitokondri üst yapısı ve kalp kası liflerindeki değişimler gözlendi. Temsili resimler gösterildi. Ölçek çubuğu: 5 μm; (n=3). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
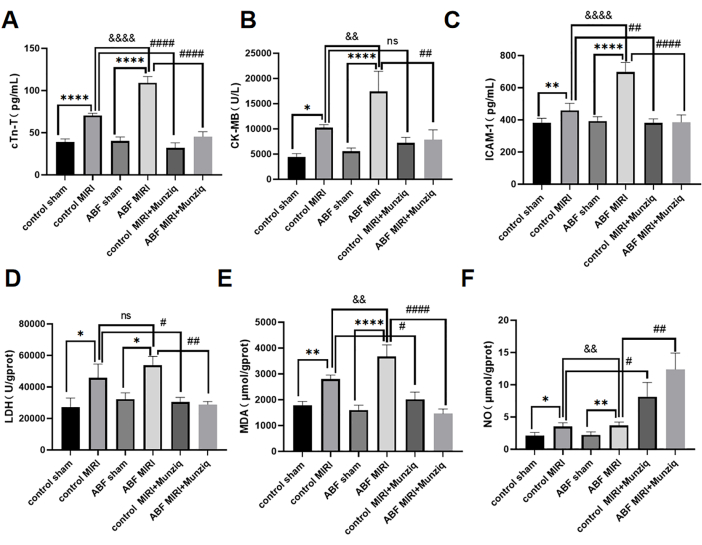
Şekil 3: ABF MIRI sıçanlarında miyokardiyal iskemi-reperfüzyon hasarı şiddetlenmiştir ve Munziq ön tedavisi kardiyak fonksiyonu koruyabilir. (A) serum cTn-T, (B) CK-MB ve (C) ICAM-1. Düzeyler ELISA ile tespit edildi ve miyokard dokusunda LDH, MDA ve NO'daki değişiklikler ölçüldü (n=6). *p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 Sahte grup ile karşılaştırıldığında; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 MIRI grubu ile karşılaştırıldığında; &p<0.05, && p<0.01, &&&p<0.001, &&&&p<0.0001 Kontrol grubu ile karşılaştırıldığında. Veriler ortalama ± SD olarak sunulmuştur. İstatistiksel analiz tek yönlü varyans analizi (ANOVA) kullanılarak yapılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
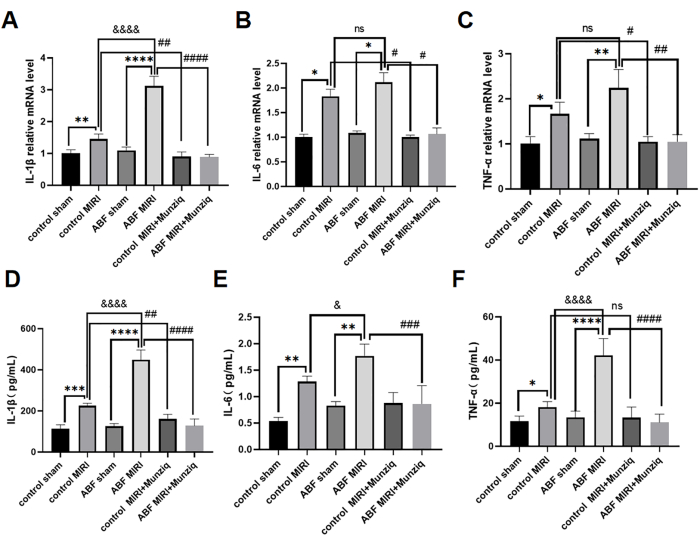
Şekil 4: Munziq ile ön tedavi, proinflamatuar sitokinlerin üretimini önleyerek MIRI'nin iltihaplanmasını hafifletti. qRT-PCR, miyokard dokusunda (A) IL-1β, (B) IL-6 ve (C) TNF-α mRNA seviyelerini tespit etti. Serumda (D) IL-1β, (E) IL-6 ve (F) TNF-α düzeylerini ELISA ile ölçün (n = 6). *p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 Sahte grup ile karşılaştırıldığında; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 MIRI grubu ile karşılaştırıldığında; &p<0.05, && p<0.01, &&&p<0.001, &&&&p<0.0001 Kontrol grubu ile karşılaştırıldığında. Veriler ortalama ± SD olarak sunulmuştur. İstatistiksel analiz tek yönlü varyans analizi (ANOVA) kullanılarak yapılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
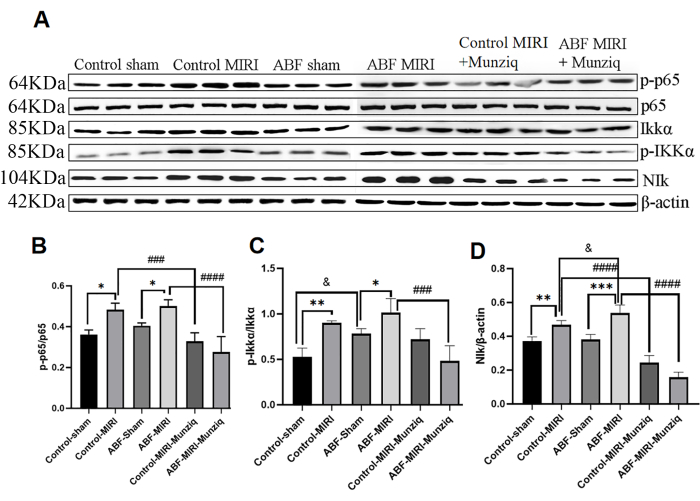
Şekil 5: Munziq ile yapılan ön tedavi, NF-κB sinyal yolu yoluyla iltihabı hafifletti. Miyokard dokusunda p-IKKα, IKKα, p-p65, p65 ve NIk protein ekspresyonu Western blot ile tespit edildi (her grup için N = 3). (A) Western blot analizinde gözlenen protein bantları. (B-D) Göreli ifade düzeyi, gri değere göre belirlenir. *p<0.05, ** p<0.01, ***p<0.001, ****p<0.0001 Sahte grup ile karşılaştırıldığında; #p<0.05, ## p<0.01, ###p<0.001, ####p<0.0001 MIRI grubu ile karşılaştırıldığında; &p<0.05, & p<0.01, &&&p<0.001, &&&&p<0.0001 Kontrol grubu ile karşılaştırıldığında. Veriler ortalama ± SD olarak sunulmuştur. İstatistiksel analiz tek yönlü varyans analizi (ANOVA) kullanılarak yapılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Tüp Numarası | Seyreltici Hacim (mL) | BSA Hacmi (Kaynak) | Son BSA Konsantrasyonu (mg / mL) |
| A | 0 | 20 (stok çözümü) | 500 |
| B | 2 | 18 (stok çözümü) | 400 |
| C | 4 | 16 (stok çözümü) | 300 |
| D | 6 | 14 (stok çözümü) | 200 |
| E | 8 | 12 (stok çözümü) | 150 |
| F | 12 | 8 (stok çözümü) | 100 |
| G | 16 | 4 (stok çözümü) | 50 |
| H | 20 | 0 (stok çözümü) | 0 |
Tablo 1: BSA standart konsantrasyon hazırlama tablosu.
| Ayırıcı Jeller | %15 İstifleme Jeli | %12 İstifleme Jeli | %8 İstifleme Jeli | %5 İstifleme Jeli | |
| Reaktif | Hacim | Hacim | Hacim | Reaktif | Hacim |
| Deiyonize su (mL) | 2.76 | 3.96 | 5.52 | Deiyonize su (mL) | 4 |
| %30 Akrilamid (mL) | 6 | 4.8 | 3.24 | %30 Akrilamid (mL) | 1 |
| 1,5 mol/lTris.HCl(PH8.8)(mL) | 3 | 3 | 3 | 1.0M Tris.HCl (pH6.8; mL) | 1 |
| % 10 SDS (μL) | 120 | 120 | 120 | % 10 SDS (μL) | 80 |
| %10 AP(μL) | 120 | 120 | 120 | %10 AP(μL) | 60 |
| TEMED(μL) | 4.8 | 4.8 | 7.2 | TEMED(μL) | 8 |
| Toplam Hacim (mL) | 12 | 12 | 12 | Toplam Hacim (mL) | 6 |
Tablo 2: Jel konsantrasyonu hazırlığı.
| Birincil Antikor | Seyreltme Oranı | İkincil Antikor | Seyreltme Oranı |
| β-aktin | 1:1000 | Keçi anti-Fare IgG H & L (HRP) | 1:15000 |
| P65 Serisi | 1:1000 | Keçi anti-Tavşan IgG H & L (HRP) | 1:5000 |
| P-P65 Serisi | 1:300 | 1:5000 | |
| BCL-2 (İngilizce) | 1:1000 | 1:5000 | |
| BAX | 1:1000 | 1:5000 | |
| Drp1 Serisi | 1:800 | 1:5000 | |
| Fis1 | 1:1000 | 1:5000 | |
| Mfn2 | 1:800 | 1:5000 |
Tablo 3: Antikor seyreltme oranları.
| Gen | Astar dizisi (5' ila 3') | ||
| IL-1β-F | CTGTGACTCGTGGGATGATG | ||
| IL-1β-R | GGGATTTTGTCGTTGCTTGT | ||
| TNF-α-F | GCCTCCTCTCTGCCATCAAG | ||
| TNF-α-R | CTCCAAAGTAGACCTGCCCG | ||
| IL-6-F | GCCCACCAGGAACGAAAGTC | ||
| IL-6-R | GGCAACTGGCTGGAAGTCTC | ||
| beta aktin-F | CCCATCTATGAGGGTTACGC | ||
| beta aktin-R | TTTAATGTCACGCACGATTTC | ||
Tablo 4: Primer dizileri.
Tartışmalar
Miyokardiyal iskemi-reperfüzyon hasarı anlamına gelen MIRI, kalp cerrahisinde miyokard reperfüzyonundan sonra ortaya çıkan yaygın ve önemli bir komplikasyondur36,37, az sayıda ilaç veya adjuvan, eş zamanlı kontrollere kıyasla klinik sonuçları kesin olarak iyileştirmiştir38. Bu nedenle, kalbi bu tür yaralanmalardan korumak için etkili tedavilere acil ihtiyaç vardır. Geleneksel bir bitkisel preparat olan Munziq, kalp iskemisi-reperfüzyon hasarı üzerinde bazı terapötik etkiler göstermiştir 27,28,30. Bununla birlikte, bu bulgular başlangıç niteliğindedir ve altta yatan mekanizmalar bilinmemektedir. Bu çalışmanın amacı, Munziq'in MIRI üzerindeki koruyucu etkilerini ve mekanizmalarını daha fazla araştırmak ve doğrulamaktı.
Anormal vücut sıvısı, geleneksel Uygur tıbbına göre kardiyovasküler hastalıklar da dahil olmak üzere çeşitli kronik hastalıkların ortak bir tezahürü olarak adlandırılır39,40. Uygur tıp sisteminde ABF'nin uzun süreli stresin bir sonucu olduğuna inanılmakta ve çeşitli hastalıkların kaynağı olarak anılmaktadır39. Bu çalışmada, kalp cerrahisi gerektiren kardiyovasküler hastalıkların altta yatan özelliklerini simüle etmek için anormal bir vücut sıvısı modeli kullanıldı. MIRI, miyokardiyal iskemi-reperfüzyon hasarını belirlemek için ABF'li sıçanlarda indüklendi.
İskemi reperfüzyon hasarı, birden fazla süreci içeren karmaşık bir patolojik durumdur. Kalpte iskemi-reperfüzyonun miyokarddapatolojik değişikliklere yol açtığı bildirilmiştir 4. Bu patolojik değişiklikler öncelikle bu çalışmada gözlendiği gibi kısalmış kardiyomiyositler, bozulmuş sarkomerik yapı, mitokondriyal şişme41 ve gevşek düzenlenmiş sarkomerik miyofibriller olarak kendini gösterir. Miyokard hasarı ayrıca serum enzimlerinde değişikliklere neden olur. Miyokard hasarını takiben serumdaki cTnT, CK-MB ve ICAM-1 düzeylerinin arttığı iyi bilinmektedir42,43. Bu nedenle, bu biyobelirteçler akut miyokard hasarının derecesini değerlendirmek için kullanılır. Bu çalışmada, iskemi-reperfüzyon yaralanması sonrası miyokarddaki patolojik değişiklikleri ve serum enzimlerinin yükselmesini gözlemledik ve bu da MIRI modelinin başarılı bir şekilde kurulduğunu gösterdi. Sonuçlar, ABF MIRI grubundaki miyokard hasarının kontrol MIRI grubuna kıyasla daha şiddetli olduğunu gösterdi. Munzik ile tedaviyi takiben, patolojik değişiklikler gözle görülür şekilde hafifledi ve serum enzim seviyeleri önemli ölçüde azaldı. Toplu olarak, bu bulgular Munziq'in MIRI sırasındaki kardiyo-koruyucu etkilerini göstermektedir.
Bu çalışmada, sıçanlarda iskemi-reperfüzyon yaralanma modeli oluşturmak için sol ön inen (LAD) arter 30 dakika boyunca bağlandı ve ardından 120 dakika boyunca reperfüzyon uygulandı. Sıçanlarda iskemi-reperfüzyon yaralanma modelleri oluşturmak için kullanılan 43 çalışmayı özetleyen bir meta-analiz44 , iskemi sürelerinin 30 ila 60 dakika arasında değiştiğini ve reperfüzyon süresinin 30 ila 120 dakika arasında olduğunu göstermiştir. Bazı çalışmalar, 5 dakikalık iskemi ve ardından 5 dakikalık reperfüzyon, tekrarlanan 4x45 protokolünü benimsemiştir. Bu yöntemler arasında en sık 30 dk iskemi ve 120 dk reperfüzyon içeren bir protokol kullanıldı ve 19 olguda görüldü. Deneysel süreç sırasında, 30 dakikalık iskemiyi takiben doğrudan görsel inceleme yoluyla miyokardda soluk bir renk gözlemledik. Miyokardiyal renk değişikliklerinin görsel değerlendirmesine ek olarak, ST segment yükselmesi gibi iskemi belirtilerini tanımlamak için elektrokardiyogram (EKG) izlemesi kullanıldı. Troponin ve kreatin kinaz dahil olmak üzere serum belirteçlerinin yanı sıra kalp atış hızı (HR), sol ventrikül diyastolik basıncı (LVDP) ve sol ventrikül sistolik basıncı (LVSP) gibi hemodinamik parametrelerin tümü, iskemi modelinin etkinliğini değerlendirmek için gösterge görevi görebilir46. Bu çalışmada, iskemi ve reperfüzyonun etkilerini değerlendirmek için öncelikle görsel gözleme dayandık. Sıçanlar arasındaki bireysel farklılıklar nedeniyle, tüm sıçanlara tek tip bir iskemik süre uygulamak yerine, iskeminin etkinliğini değerlendirmek için görsel incelemenin ek objektif önlemlerle desteklenmesi tavsiye edilir.
Memelilerde, NF-κB ailesi, biri p6513,47 olan beş üyeden oluşur. 47 hücresinde NF-κB'nin aktivasyonunun iki ana yolu vardır. Kanonik yolda, IKK kompleksinin (IKKα, IKKβ ve IKKγ) aktivasyonu, NF-κB aktivasyonunu başlatarak IκB proteinlerinin fosforilasyonuna yol açar. Kanonik olmayan NF-κB yolunda, NF-κB aktivasyonuna NIK ve IKKα'nın fosforilasyonu aracılık eder. Kapsamlı kanıtlar, NF-κB yolunun iskemi ve reperfüzyon hasarına aracılık etmede çok önemli bir rol oynadığını göstermektedir 48,49,50. NF-κB aktivasyonuna müdahale etmek, iskemi ve reperfüzyonun neden olduğu yaralanmayı hafifletebilir51,52. İlginç bir şekilde, ABF MIRI grubunda NF-κB sinyal yolunun daha fazla aktivasyonu ve daha yüksek seviyelerde aşağı akış inflamatuar sitokin vardı.
Çok sayıda geleneksel Çin tıbbı ilacının, NF-κB yolunu modüle ederek iskemi ve reperfüzyon hasarına karşı koruyucu etkiler gösterdiği gösterilmiştir. Örneğin, Liu ve ark.53 , quercetin'in NF-κB yolunu inhibe ederek MIRI'yi hafiflettiğini buldu. Han ve ark.54 , hidroksisafflor sarı A'nın TLR4/NF-κB sinyalini inhibe ederek MIRI'yi hafiflettiğini bildirmiştir. Bununla birlikte, Munziq'in NF-κB sinyal yolu aracılığıyla MIRI'de koruyucu bir rol oynayıp oynamadığı keşfedilmemiştir. Munziq mekanizmasını daha da aydınlatmak için bu çalışma, NIK, IKKα, pIKKα ve p65 dahil olmak üzere NF-κB sinyal yolundaki anahtar düğümlerin ekspresyon seviyelerini analiz etti. Sonuçlar, bu proteinlerin ekspresyon seviyelerinin Munziq tedavisini takiben önemli ölçüde azaldığını gösterdi, bu da Munziq'in MIRI sırasında NF-κB sinyal yolundaki anahtar düğümlerin ekspresyonunu inhibe ettiğini gösteriyor.
NF-κB'nin aktivasyonunun, enflamatuar proteinlerin ve adezyon moleküllerinin üretimini tetiklediği ve lenfositlerin işe alınmasına neden olduğu fikrini destekleyen kapsamlı kanıtlar vardır55. Örneğin, Valen ve ark.56 , miyokardiyal iskemi / reperfüzyon sırasında NF-κB'nin aktive olduğunu ve IL-1β ve TNF-α seviyelerinin yükseldiğini keşfetti. Ayrıca, NF-κB tarafından düzenlenen bir pro-inflamatuar sitokin olan IL-6, reperfüzyon sırasında artan ekspresyon sergiler57. Bu bulgularla tutarlı olarak, bu çalışmanın sonuçları Munziq'in miyokardiyal iskemi / reperfüzyon hasarı (MIRI) bağlamında proinflamatuar sitokinlerin (IL-1β, IL-6 ve TNF-α dahil) seviyelerini önemli ölçüde inhibe ettiğini göstermektedir. Bundan, Munziq'in NF-κB sinyal yolunun baskılanması yoluyla proinflamatuar sitokinlerin ekspresyonu üzerindeki inhibitör etkilerini uyguladığı sonucuna varılabilir.
Sonuç olarak, sonuçlar MIRI'nin ABF'de daha ciddi olduğunu göstermektedir. Munziq'in iskemi ve reperfüzyon hasarında kardiyoprotektif etkileri vardır. Bu koruyucu etki, NF-κB sinyal yolunu baskılayarak gerçekleştirilebilir. Bu bulgular, Munziq'in kalp cerrahisi sırasında kalbi reperfüzyon hasarına karşı korumak için terapötik bir ajan olarak büyük bir potansiyele sahip olduğunu göstermektedir.
Çalışmanın çeşitli sınırlılıkları vardır. İlk olarak, çalışma, değerli bir translasyonel model olmasına rağmen, insan kardiyovasküler durumunun karmaşıklığını tam olarak kopyalayamayan bir sıçan modelinde yürütülmüştür. İkinci olarak, çalışma öncelikle Munziq'in etkilerinin mekanik bir temeli olarak NF-κB sinyal yoluna odaklanmaktadır. Bununla birlikte, MIRI, çeşitli diğer sinyal yollarını ve moleküler mekanizmaları içerebilen çok faktörlü bir süreçtir.
Mevcut çalışma, özellikle anormal vücut sıvısı (ABF) bağlamında, miyokardiyal iskemi-reperfüzyon hasarının (MIRI) bir sıçan modelinde Munziq'in potansiyel kardiyoprotektif etkileri hakkında değerli bilgiler sağlarken, gelecekteki araştırmalar için birkaç alan vardır. Daha fazla araştırma için bir yol, Munziq'in iskemi ve reperfüzyona hücresel yanıtlar üzerindeki etkilerini doğrudan gözlemlemek için kültürlenmiş kardiyomiyositleri kullanarak in vitro çalışmalar yapmaktır. Ek olarak, multi-omik bir yaklaşımın benimsenmesi, Munziq tedavisi ile ilişkili moleküler değişikliklerin daha kapsamlı bir görünümünü sunabilir ve potansiyel olarak kardiyoprotektif etkilerine katkıda bulunan ek yolları ve mekanizmaları ortaya çıkarabilir. Potansiyel yan etkileri en aza indirirken maksimum kardiyoproteksiyon için en uygun dozu belirlemek için farklı Munziq dozlarını araştırmak da faydalı olacaktır. Munziq'in kardiyak fonksiyon üzerindeki kalıcı etkilerini değerlendirmek ve uzun süreli kullanımla ilişkili olası olumsuz etkileri izlemek için uzun süreli çalışmalar gereklidir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
YAZAR KATKISI:
Duolikun Mutailifu deneyleri gerçekleştirdi, Abudusaimi Aini el yazmasının ilk taslağını yazdı ve verileri analiz etti; Aili Aibibula, çalışmanın konseptine ve tasarımına katkıda bulundu; Çalışmanın tasarımına Zheng Liu ve Abudunaibi Maimaitiaili katıldı; Abudunaibi Maimaitiaili çalışma fonlarını düzenledi; ve tüm yazarlar son makaleyi okudu ve onayladı.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı [hibe Numarası: 82060907] ve 'Tianshan Elite' Üst Düzey Tıp ve Sağlık Yetenek Geliştirme Programı [Hibe No. TSYC202301B004].
Malzemeler
| Name | Company | Catalog Number | Comments |
| ABI 7500 Real-time PCR | ABI, CA, USA | Used for performing qRT-PCR. | |
| Adult male Sprague-Dawley (SD) rat | Animal Experimental Center of Xinjiang Medical University | ||
| Anti-NF-kB p65, anti-NF-kB Inducing Kinase NIK, anti-IKK alpha, anti-IKK alpha (phospho T23), anti-β-actin | Abcam, CA, USA | Used for Western blot analysis targeting specific proteins. | |
| Anti-TTC11/FIS1 Antibody | abcam | ab71498 | Used for protein detection in Western Blot (WB) experiments. |
| BCA Protein Assay Kit | Tiangen Biotech Co., Ltd., Beijing, China | Used for determining protein concentration. | |
| beta-Actin Loading Control antibody Mouse Mab | Sino Biological | 100166-MM10 | Used for protein detection in Western Blot (WB) experiments. |
| ChemiScope 3300 Imaging System | Clinx Science Instruments, Shanghai, China | Used for scanning developed films from Western blot analysis. | |
| ELISA kit for CK-MB detection | Nanjing Jiancheng Bioengeering Institute(Nanjing, China) | Used for detecting levels of cardiac injury indexes | |
| ELISA kit for cTn-T, ICAM-1, IL-1β, IL-6, TNF-α detection | CUSABIO Biotech CO., Ltd. (Wuhan, China) | Used for detecting levels of cardiac injury indexes and inflammatory cytokines in rat serum samples. | |
| FastQuant RT Kit | TIANGEN, Beijing China | Used for reverse transcription of cDNA. | |
| HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG | Thermo Scientific, Basingstoke, UK | ||
| LDH Assay kit and MDA Assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting LDH and MDA levels in myocardium tissues from the infarct area in the left ventricle. | |
| Munziq | provided by Xinjiang Medical University | The main investigational drug in this study | |
| NF-κB p65 (D14E12) XP Rabbit mAb #8242 | CST | 8242S | Used for protein detection in Western Blot (WB) experiments. |
| Nitric Oxide (NO) assay kit | Jiancheng Biotech Co., Ltd, Nanjing, China | Used for detecting NO levels at 550 nm in myocardial tissue. | |
| Phospho-NF-κB p65 (Ser536) (93H1) Rabbit mAb #3033 | CST | 3033S | Used for protein detection in Western Blot (WB) experiments. |
| Quantity One software | Bio-Rad Laboratories, Hercules, CA, USA | Used for analyzing Western blot images. | |
| Recombinant Anti-DRP1 Antibody | abcam | ab184247 | Used for protein detection in Western Blot (WB) experiments. |
| RIPA lysis buffer | Boster Biotechnology Co., Ltd., Wuhan, China | AR0105 | Used for extracting total proteins from rat ventricular tissues. |
| Secondary antibodies (HRP conjugated goat anti-mouse IgG, HRP conjugated goat anti-rabbit IgG) | Thermo Scientific, Basingstoke, UK | Used for detection following primary antibody incubation in Western blot analysis. | |
| SYBR Select Master Mix | ABI, CA, USA | Used in qRT-PCR analysis on ABI 7500 Real-time PCR instrument. | |
| transmission electron microscope | HitachiS-2400 Hitachi, Tokyo, Japan | Used to examine thin sections of ventricular tissues. | |
| Trizol reagent | Invitrogen Co., Carlsbad, California, USA | Used for RNA extraction from ventricular tissues. |
Referanslar
- Anderson, J. L., Campion, E. W., Morrow, D. A. Acute myocardial infarction. New Engl J Med. 376 (21), 2053-2064 (2017).
- Vos, T., et al. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: A systematic analysis for the global burden of disease study 2019. Lancet. 396 (10258), 1204-1222 (2020).
- Murphy, A., Goldberg, S. Mechanical complications of myocardial infarction. Am J Med. 135 (12), 1401-1409 (2022).
- Heusch, G. Myocardial ischemia/reperfusion: Translational pathophysiology of ischemic heart disease. Medicine. 5 (1), 10-31 (2024).
- Bhatt, D. L., Lopes, R. D., Harrington, R. A. Diagnosis and treatment of acute coronary syndromes. Jama. 327 (7), 662-675 (2022).
- Hausenloy, D. J., et al. The coronary circulation in acute myocardial ischaemia/reperfusion injury: A target for cardioprotection. Cardiovasc Res. 115 (7), 1143-1155 (2019).
- Gunata, M., Parlakpinar, H. A review of myocardial ischaemia/reperfusion injury: Pathophysiology, experimental models, biomarkers, genetics and pharmacological treatment. Cell Biochem Funct. 39 (2), 190-217 (2020).
- He, J., et al. Myocardial ischemia/reperfusion injury: Mechanisms of injury and implications for management (review). Exp Ther Med. 23 (6), 430 (2022).
- Xiang, M., et al. Role of oxidative stress in reperfusion following myocardial ischemia and its treatments. Oxid Med Cell Longevity. 2021, 1-23 (2021).
- Astudillo, A. M., Balboa, M. A., Balsinde, J. Compartmentalized regulation of lipid signaling in oxidative stress and inflammation: Plasmalogens, oxidized lipids and ferroptosis as new paradigms of bioactive lipid research. Prog Lipid Res. 89, 101207 (2023).
- Algoet, M., et al. Myocardial ischemia-reperfusion injury and the influence of inflammation. Trends Cardiovasc Med. 33 (6), 357-366 (2023).
- Zhang, F., et al. Β-cryptoxanthin alleviates myocardial ischaemia/reperfusion injury by inhibiting nf-κb-mediated inflammatory signalling in rats. Arch Physiol Biochem. 128 (4), 1128-1135 (2020).
- Guo, Q., et al. Nf-κb in biology and targeted therapy: New insights and translational implications. Signal Transduct Target Ther. 9 (1), 53 (2024).
- Mi, J., et al. Inhibition of heat shock protein family a member 8 attenuates spinal cord ischemia-reperfusion injury via astrocyte nf-κb/nlrp3 inflammasome pathway. J Neuroinflammation. 18 (1), 170 (2021).
- Zhang, L., Zhao, S., Wang, Y. Diannexin alleviates myocardial ischemia-reperfusion injury by orchestrating cardiomyocyte oxidative damage, macrophage polarization and fibrotic process by tlr4-nf-kb-mediated inactivation of nlrp3 inflammasome. Int Immunopharmacol. 130, 111668 (2024).
- Zhou, Y., et al. Qingchang mixture prevents the intestinal ischemia-reperfusion injury through tlr4/nf-kb pathway. Combinatorial Chem High Throughput Screen. 26 (1), 49-57 (2023).
- Ozturk, A., et al. The protective effects of trimetazidine against ovary ischemia-reperfusion injury via the tlr4/nf-kb signal pathway. J Biochem Mol Toxicol. 36 (8), e23114 (2022).
- Du, S., Deng, Y., Yuan, H., Sun, Y. Safflower yellow b protects brain against cerebral ischemia reperfusion injury through ampk/nf-kb pathway. Evid Based Compl Alt Med. 2019, 1-11 (2019).
- Dong, X., et al. Physcion protects rats against cerebral ischemia-reperfusion injury via inhibition of tlr4/nf-kb signaling pathway. Drug Design Dev Therapy. 15, 277-287 (2021).
- Hashmi, S., et al. Hydrogen sulphide treatment prevents renal ischemia-reperfusion injury by inhibiting the expression of icam-1 and nf-kb concentration in normotensive and hypertensive rats. Biomolecules. 11 (10), 1549 (2021).
- Gao, L., et al. Hic-5 deficiency attenuates hepatic ischemia reperfusion injury through tlr4/nf-κb signaling pathways. Life Sciences. 249, 117517 (2020).
- Xu, Z., et al. Cardioprotection of mab2g4/odn/lip on myocardial ischemia-reperfusion injury via inhibiting the nf-κb signaling pathway. Cardiovas Ther. 2023, 1-15 (2023).
- Xiao, G., et al. Cxcr1 and its downstream nf-κb inflammation signaling pathway as a key target of guanxinning injection for myocardial ischemia/reperfusion injury. Front Immunol. 13, 1007341 (2022).
- Jeddi, S., Gheibi, S., Kashfi, K., Carlström, M., Ghasemi, A. Dose-dependent effects of long-term administration of hydrogen sulfide on myocardial ischemia-reperfusion injury in male wistar rats: Modulation of rkip, nf-κb, and oxidative stress. Int J Mol Sci. 21 (4), 1415 (2020).
- Yao, Y., et al. Targeting camkii-δ9 ameliorates cardiac ischemia/reperfusion injury by inhibiting myocardial inflammation. Circ Res. 130 (6), 887-903 (2022).
- Zhuang, L., Zong, X., Yang, Q., Fan, Q., Tao, R. Interleukin-34-nf-κb signaling aggravates myocardial ischemic/reperfusion injury by facilitating macrophage recruitment and polarization. eBioMedicine. 95, 104744 (2023).
- Maimaitiaili, A., et al. Effects of different doses of savda munziq on myocardial ischemia-reperfusion injury in rats with abnormal savda syndrome. Genet Mol Res. 13 (3), 4729-4735 (2014).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Hao, Y., et al. Transition of the abnormal savda syndrome to the hepatic carcinoma shifted unfolded protein response to autophagy was partly reversed by savda munziq in a rat model. Biomed Pharmacother. 121, 109643 (2020).
- Maimaitiaili, A., Li, J., Aibibula, A., Abudureheman, M. Erratum: Inhibition of nuclear factor kappa b pathway protects myocardial ischemia/reperfusion injury in rats under treatment with fufang munziq granule (munziq). Am J Transl Res. 10 (11), 3876 (2018).
- Zhang, X., et al. Rosa rugosa flavonoids alleviate myocardial ischemia reperfusion injury in mice by suppressing jnk and p38 mapk. Microcirculation. 24 (7), (2017).
- Dong, P., Liu, K., Han, H. The role of nf-κb in myocardial ischemia/reperfusion injury. Curr Prot Peptide Sci. 23 (8), 535-547 (2022).
- Guo, X., et al. Differential integrative omic analysis for mechanism insights and biomarker discovery of abnormal savda syndrome and its unique munziq prescription. Sci Rep. 6, 27831 (2016).
- Awad, A. S. Role of at1 receptors in permeability of the blood-brain barrier in diabetic hypertensive rats. Vascul Pharmacol. 45 (3), 141-147 (2006).
- La, X., et al. Upregulation of pd-1 on cd4(+)cd25(+) t cells is associated with immunosuppression in liver of mice infected with echinococcus multilocularis. Int Immunopharmacol. 26 (2), 357-366 (2015).
- Wu, T., et al. Circulating small extracellular vesicle-encapsulated sema5a-it1 attenuates myocardial ischemia-reperfusion injury after cardiac surgery with cardiopulmonary bypass. Cell Mol Biol Lett. 27 (1), 95 (2022).
- Pinto, A., et al. The extracellular isoform of superoxide dismutase has a significant impact on cardiovascular ischaemia and reperfusion injury during cardiopulmonary bypass. Eur J Cardio-Thor Surg. 50 (6), 1035-1044 (2016).
- Sabe, S. A., Harris, D. D., Broadwin, M., Sellke, F. W. Cardioprotection in cardiovascular surgery. Basic Res Cardiol. 119 (4), 545-568 (2024).
- Abudunaibi, M., et al. Myocardial protective effects of munziq in myocardial ischemia-reperfusion injury rats with abnormal savda syndrome. Genet Mol Res. 14 (2), 3426-3435 (2015).
- Mamtimin, B., et al. An magnetic resonance-based plasma metabonomic investigation on abnormal savda in different complicated diseases. J Tradl Chinese Med. 34 (2), 166-172 (2014).
- Marin, W., Marin, D., Ao, X., Liu, Y. Mitochondria as a therapeutic target for cardiac ischemia-reperfusion injury (review). Int J Mol Med. 47 (2), 485-499 (2020).
- Novack, V., et al. Troponin criteria for myocardial infarction after percutaneous coronary intervention. Arch Intern Med. 172 (6), 502-508 (2012).
- Kemp, M., Donovan, J., Higham, H., Hooper, J. Biochemical markers of myocardial injury. Br J Anaesth. 93 (1), 63-73 (2004).
- Zhang, D. Z., Jia, M. Y., Wei, H. Y., Yao, M., Jiang, L. H. Systematic review and meta-analysis of the interventional effects of resveratrol in a rat model of myocardial ischemia-reperfusion injury. Front Pharmacol. 15, 1301502 (2024).
- Ta, F. X., Zhang, T., Zhu, C. M. Correlation between mir-21 and the protective effects of resveratrol against myocardial ischemia/reperfusion injury in rats. Chin. J. Arteriosclerosis. 21 (6), 493-496 (2013).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. Am J Physiol Heart Circ Physiol. 314 (4), H812-H838 (2018).
- Oeckinghaus, A., Hayden, M. S., Ghosh, S. Crosstalk in nf-kappab signaling pathways. Nat Immunol. 12 (8), 695-708 (2011).
- Van Der Heiden, K., Cuhlmann, S., Luong Le, A., Zakkar, M., Evans, M. Role of nuclear factor kappab in cardiovascular health and disease. Clin Sci. 118 (10), 593-605 (2010).
- Ha, T., et al. Toll-like receptors: New players in myocardial ischemia/reperfusion injury. Antioxid Redox Signal. 15 (7), 1875-1893 (2011).
- Pourrajab, F., Yazdi, M. B., Zarch, M. B., Zarch, M. B., Hekmatimoghaddam, S. Cross talk of the first-line defense tlrs with pi3k/akt pathway, in preconditioning therapeutic approach. Mol Cell Ther. 3, 4 (2015).
- Wang, Y. H., et al. Lumbrokinase attenuates myocardial ischemia-reperfusion injury by inhibiting tlr4 signaling. J Mol Cell Cardiol. 99, 113-122 (2016).
- Yu, H., et al. Gypenoside protects cardiomyocytes against ischemia-reperfusion injury via the inhibition of mitogen-activated protein kinase mediated nuclear factor kappa b pathway in vitro and in vivo. Front Pharmacol. 7, 148 (2016).
- Liu, X., et al. Peroxisome proliferator-activated receptor gamma (ppargamma) mediates the protective effect of quercetin against myocardial ischemia-reperfusion injury via suppressing the nf-kappab pathway. Am J Transl Res. 8 (12), 5169-5186 (2016).
- Han, D., et al. Hydroxysafflor yellow a alleviates myocardial ischemia/reperfusion in hyperlipidemic animals through the suppression of tlr4 signaling. Sci Rep. 6, 35319 (2016).
- Yang, Q., He, G. W., Underwood, M. J., Yu, C. M. Cellular and molecular mechanisms of endothelial ischemia/reperfusion injury: Perspectives and implications for postischemic myocardial protection. Am J Transl Res. 8 (2), 765-777 (2016).
- Valen, G., Paulsson, G., Vaage, J. Induction of inflammatory mediators during reperfusion of the human heart. Ann Thorac Surg. 71 (1), 226-232 (2001).
- Saini, H. K., et al. Role of tumour necrosis factor-alpha and other cytokines in ischemia-reperfusion-induced injury in the heart. Exp Clin Cardiol. 10 (4), 213-222 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır