Method Article
使用双标记 (MADM) 的马赛克分析开发脑皮质的血统跟踪和克隆分析
摘要
提出了一种利用双标记(MADM)的马赛克分析在单个细胞水平上对候选基因进行血统追踪和功能遗传分析的协议。MADM克隆分析提供了一个定量框架,用于测量个体祖先及其子细胞的增殖行为、细胞输出和血统关系。
摘要
从有限的祖细胞池开始,哺乳动物的大脑皮层形成高度有组织的功能神经回路。然而,控制神经干细胞(NSCs)血统过渡的基础细胞和分子机制,以及神经元和胶质在发育中的神经皮的最终产生仍不清楚。跟踪 NSC 分割模式和映射克隆相关细胞的血统的方法已显著提高。然而,许多当代的血统追踪技术因后代细胞命运缺乏细胞分辨率而受到影响,这对破译后代细胞分裂模式至关重要。呈现是使用双标记 (MADM) 的马赛克分析执行体内克隆分析的协议。MADM 同时操纵单个祖先细胞,以前所未有的单细胞分辨率可视化精确的分裂模式和血统进展。基于 MADM 的血间重组事件在 G2-X 阶段的线粒体,以及时间上可识别的CreERT2,提供了有关克隆的出生日期及其分裂模式的确切信息。因此,MADM系系追踪为单细胞水平上干细胞祖细胞的增殖模式提供了前所未有的定性和定量光学读数。MADM 还允许检查 NSC 血统进展中候选基因的机制和功能要求。这种方法在控制和突变子组的比较分析中独一无二,可以在体内相同的组织环境中进行。在这里,对该协议进行了详细的描述,并演示了利用 MADM 在发育中的大脑皮层中进行克隆分析和血统跟踪的实验范式。重要的是,只要CreERT2驱动器存在,此协议就可以适应在任何穆林干细胞利基执行 MADM 克隆分析。
引言
大脑皮层是一个高度有组织的结构,由六个不同的层组成。皮层包含多种细胞类型,包括神经元和胶质,它们相互作用形成功能神经回路。大多数,如果不是所有的,皮质兴奋投影神经元和胶质来自一个共同的神经干细胞池(NSCs),称为径向胶质祖细胞(RGPs)1,2,3。1,2,3RRGP 本身来自组成早期胚胎神经皮的神经皮细胞(NESCs) 的神经皮细胞。到小鼠胚胎第9天(E9),NESC开始过渡到RGPs4。RGP血统进展需要精确的时间和空间调节,当这个过程受到阻碍时,严重的神经系统疾病,如脑积水、小头症、利森头症或精神分裂症和自闭症等损伤可能导致5,6。5在E10,大多数RGP经历对称增殖分裂,导致神经祖细胞池4,7,的扩展。RRP最终开始不对称地划分,以时间定义的方式产生皮质投影神经元。通过连续的神经生成波,新生神经元迁移到皮质板块形成皮质层,早期出生的神经元占据深层和晚出生的神经元,驻留在表面层8,9,10。,9,10由于与克隆相关的金字塔神经元以很少的切向分散向皮层中径向迁移,子细胞往往形成一个柱状或锥形结构,称为神经元径向单元4,4、11、12、13。11,12,13到E17,胚胎神经源扩张在小鼠14完成。RRGPs也可以产生腺细胞和一些类的胶质,包括星细胞和寡头细胞11,15,16,17,18,19。,15,16,17,18,19RGPs产生神经元和星细胞的潜力似乎在所有皮质区域18中是一致的,大约1/6的神经性RGP也产生胶质11。
目前,控制干细胞沿系时间进展的遗传和表观遗传因素大多不为人知。基因表达的时态模式可能对RGPs20、21、22、23、24中的血统20,21,22,23,决策产生重大影响。时间和空间模式之间的这种紧密关系如何导致跨皮质区域的成人神经元类型的分子多样性尚不清楚。同样,个体干细胞潜力及其细胞输出如何在细胞和分子水平上进行调节,也是一个尚未回答的重要问题。未来的研究有望解决其中一些问题,最终扩展我们对功能皮质电路形成的理解。
发育性神经生物学试图理解大脑中细胞彼此共享的血统关系。最初,很少有研究工具可用于此,许多早期的研究依赖于对透明生物体(如卡诺哈布迪蒂斯25)的分裂模式的视觉观察。近几十年来,现有技术的数量和复杂程度急剧增加,有13、26、27、28、29。,26,27,28,29CRISPR-Cas9基因组编辑系统的出现,通过引入进化的DNA条形码27,30,允许细胞谱系关系的合成重建。最近两个条形码策略的例子包括使用定位指南RNA,引导CRISPR-Cas9到特定的DNA条形码位点或与刻答性Cas9融合的环丁丁胺酶,以目标内源间穿插区域31,32。31,这些技术通过引入条形码提供高度多路复用的方法,这些条形码会随着时间的推移逐渐稳定地积累独特的突变。基因组编辑方法非常有价值,因为它们允许根据这些条形码的共享继承来追溯分析任何两个细胞之间的关系。然而,为了读取单个细胞中的条形码,组织通常必须被破坏,因此有关位置、形态和单个祖先的绝对细胞数的信息丢失。
组合标记范式保留空间信息,原则上也允许区分紧密本地化甚至重叠的克隆33,34。33,要使血统追踪方法具有信息性,它必须以稀疏和不可磨灭的方式标记单个祖先及其后代。值得注意的是,Brainbow35和纸屑36,,37方法使用基于随机多色Cre重组酶的记者从,这些记者从单个位点中表达荧光蛋白的组合。在体内可以实现的大量同时颜色组合,使得在追踪皮质RGP克隆和星细胞34时,这是一个强大的工具。基于Transposon的系统,提供稳定的基因组整合的转基因编码荧光记者和允许皮质祖细胞的血统跟踪也开发了33,38,39,40,41。33,38,39,40,41基于转波森的系统还有一个优势,即记者构建稳定地集成到基因组中,从而可靠地标记与线相关的子细胞。为了具体追踪星细胞谱,已经开发出一些方法,涉及小猪的电穿孔,包括星轨道,它利用编码不同荧光蛋白40,42,的构造的组合。另一种方法,MAGIC标记,引入脑弓载体作为可转换的转基因。这已经成功地用于追踪胚胎神经和星细胞祖细胞34,43。34,最近,通过双重组酶-中端盒交换(MADR)的马赛克分析发现,稳定标记从精确定义的染色体位44中表达转基因元素的突变细胞。这些强大的体内组合标记技术为祖细胞的血统动力学提供了许多见解。然而,这些分析是在固定组织上进行的,提供在定义的发育阶段个体克隆的快照。为了观察单个克隆随时间变化的血统动力学,需要应用与成人牙龈陀螺类似的慢性体内成像方法。
马赛克分析双标记(MADM)是一种强大的双色标记方法,使体内血统跟踪小鼠46,47的单个祖细胞。MADM 标记事件发生需要两个组件:首先,MADM 盒式磁带必须针对同源染色体上的相同位点。盒式磁带由两个嵌合荧光报告器基因组成,eGFP(绿色,[G])和串联二丁二尺番茄(红色,tdT[T])。GT盒式包含 eGFP 的 N 术语和 tdT 的 C 术语,由包含 loxP 站点的内子隔开。TG盒式磁带是反向构造的,具有 tdT 的 N 术语和 eGFP 的 C 术语。其次,Cre重组酶的表达在同一细胞中含有目标M代磁带是必不可少的。在没有Cre的情况下,嵌合盒不表达功能eGFP或tDT,因为它们的编码序列被中断。loxP 站点充当 Cre 中中介的染色体间重组的目标,导致同时重组两个表达盒。如果重组发生在细胞周期的G2阶段,然后是X分离(G2-X),两个子细胞将各表达两个荧光蛋白之一。使用塔莫西芬(TM)对CreER T2活性进行时态调节提供了关于MTM克隆的出生日期及其后代的分裂模式的精确信息(图1A)29,46,47。29,46,47Figure 1A
MADM可以潜在地系统地标记小鼠大脑中单细胞分辨率高的单个克隆,类似于传统但非特异性和费力的方法,如高尔吉染色48或染料填充49。因为只有驱动CreERT2的启动子才能确定克隆 MADM 标记的细胞类型特异性,因此 MADM 原则上可以应用于任何 murine 器官和组织 47、50、51、52 的47,50,51,克隆血统追踪。事实上,研究已经使用 MADM 来揭示来自,,47、50、51、52、53、54、55、56、57、58、59,57,,56等47,50,51,52,53不同组织的,克隆的血统关系。5455MADM实验范式已应用于研究皮质投影神经元、胶质和产后干细胞的血统,,在发育中的新皮质7、11、12、46、60、61、62、63、64、65。,1112,46,60,61,62,63,64,65MADM还用于研究成人牙龈、丘脑、小脑颗粒细胞和克隆细胞的细胞系(见表1的完整列表)47、53、54、56、57、66。 47,53,54,56,57,66
MADM的一个独特特点是能够将突变与一个 MADM 盒式磁带进行基因链接,从而创建基因马赛克(图 1B 和图 2)。这导致野生类型的子细胞标有一个荧光标记(图1B中的tdT)和同源突变兄弟姐妹与另一个(图1B中的eGFP)在未标记的异质环境中。MADM在控制和突变子组的比较分析中独一无二,可以在体内相同的组织环境中进行。最初,MADM盒式磁带被瞄准到Rosa26位点47,但MM对基因功能的分析仅限于对位点有源基因。为了克服(至少部分)这一限制,并扩大基于M <2>的基因分析的可能性,MADM盒式磁带被敲在接近Chr.7 51,Chr.1146和Chr.1251的百分中心。51以所有19只小鼠自体与 MADM 盒式磁带为目标的工作正在进行中,将允许将来几乎任何基因进行研究,为结合功能遗传分析研究发育谱关系提供了一个无与伦比的平台。
研究方案
老鼠协议由机构临床前核心设施(PCF)和奥地利IST内部道德委员会审查。所有育种和实验都是根据奥地利和欧盟动物法,根据奥地利联邦科学和研究部批准的许可证进行的。
1. MADM克隆分析实验鼠的育种
- 设置定时实验 MADM 交配 (>P56;CD-1)在下午晚些时候(下午5:00),并检查阴道塞的程序上午(上午8:00)。插头存在的早晨算作第 0.5 天。有关实验鼠标交配设置的概述,请参阅图 2。确保CreERT2活动和分析的 TM 感应时间点适合解决实验问题。
注:有关更多信息,请参阅下面的图 3和代表性结果。 - 对于产后取样,建立育种,以产生寄养母亲并行。
注:这些应在建立实验育种前1~2天启动。
2. MADM 小鼠的 TM 感应
- 在15 mL或50 mL锥形离心管中溶解,并在室温(RT)下将其放置在摇台上,4小时,确保TM完全溶解,从而准备20mg/mL TM工作溶液。将工作溶液在4°C下用铝箔覆盖,并在2周内使用。
- 为了诱导 MADM 重组事件,使用 1 mL 结核素注射器和 25 G 针头将 TM 内插 (IP) 注射到时间正点怀孕大坝中。根据皮质神经发生阶段,在E10+E15之间注射TM,剂量为1~2mg/怀孕大坝。对于早期时间点(即E10),使用最多1毫克/怀孕大坝(25毫克/千克)来预防妊娠期间的并发症。对于 E11-E15 之间的时间点,请使用 2 mg/怀孕大坝 (50 mg/kg)7。
注:或者,TM可以用口腔胶着进行妊娠后期。 - 对于 MADM 克隆分析到产后时间点,通过剖腹产在 E18+E19 中恢复活胚胎,然后与养母一起饲养幼崽。
注:根据怀孕女性的健康状况,可能没有必要进行剖腹产,但仍需要与养母一起饲养幼崽,因为原TM治疗的母亲可能有哺乳问题。 - 要通过剖腹产恢复活胚胎或取回胚胎时间点进行分析,请通过宫颈错位牺牲怀孕的大坝。
- 将动物放在一个苏皮位置,用70%乙醇对毛皮进行消毒。用手术钳和剪刀在子宫上方的下腹部皮肤上做一个小切口。通过肌肉和腹部肌肉壁进行第二个切口,以揭示腹腔。
- 用剪刀从周围组织分离出子宫。将完整的子宫转移到装满温水的手套上,以提高胚胎存活率,直到每个子宫分别从子宫内取出。
- 使用细尖的剪刀和手指小心地打开子宫壁释放胚胎。不要将脐带切得太近,以防止大量失血。如果要使用胚胎进行分析,请继续执行步骤3.9。如果要培育幼崽,请继续执行步骤2.8。
- 如果需要寄养,在将幼崽转移给养母之前,请清洁幼崽。清洁幼崽时,不时轻轻按压胸部以启动呼吸。放回装满温水的第二只手套上,以提高存活率。
注:用纸巾轻轻取出剩余的安尼翁和/或胎盘,这一点很重要。 - 在将幼崽转移给养母之前,将养母从笼子里取出,取出原来的幼崽,然后更换实验幼崽。把养母还到笼子里
注:有关提高培养接受率的其他建议,请参阅讨论。 - 如果需要基因分型,在 P6+P8 之间收集头趾或尾部活检。
注意:仅在动物实验许可证批准此做法时执行此步骤。
3. 大脑中 MADM 克隆的组织准备
注:对于包括产后组织(+P4)的实验,请继续执行步骤3.1。对于胚胎时间点和早期产后 (P0+P3),继续执行步骤 3.9。
- 用氯胺酮/西拉辛/乙丙胺溶液(分别65毫克、13毫克和2毫克/千克体重)的IP注射麻醉实验 MADM 动物,并确认小鼠通过捏后爪无反应。
注:男性和女性 MADM 小鼠(CD-1 背景)均用于分析。如果需要基因分型,此时收集耳部活检。 - 将麻醉动物放在灌注手术托盘上的上部位置,用70%乙醇对毛皮进行消毒。要开始手术,用剪刀和手术钳小心地切口穿过皮肤的外层,然后通过肌肉层进行第二个切口。抬起胸骨的尖端,在两侧切割结缔组织,格外小心,避免切割肝脏。胸腔是可见的。
- 剪膜片,抬起来露出心。小心修剪肋骨保持架并固定到手术托盘上,以暴露心脏。对于幼崽,完全拆下肋骨笼。
- 将带磷酸盐缓冲盐水 (PBS) 的针头插入左下心室(苍白组织)。使用小虹膜剪刀切口到右中庭的后端(深红色组织),使血液排出。
- 使用 PBS 进行灌注,然后立即在 PBS 中准备新鲜制作的冰冷 4% 半甲醛 (PFA)。对于幼崽 (P4+P10),使用注射器进行灌注。用 10 mL 的 PBS 填充一个注射器,用 10 mL 的 4% PFA 填充另一个注射器。确保已清除注射器中的所有气泡。对于年长的动物,使用近体泵。
- 开始使用 PBS(10 mL,2~4 mL/min 幼崽;20 mL,4~6 mL/min,成人使用近位泵)。如果针头定位正确,肝脏将变得清晰和淡黄色。
- 完成后,从幼崽中取出针头,并将含有PFA的针头插入同一孔中。对于成人,在将 PBS 溶液与冰冷的 PFA 交换之前,请停止近位泵,确保避免吸收管中出现气泡。使用PFA(10 mL,2~4 mL/min,幼崽30 mL,4~6 mL/min,成人使用近位泵)恢复使用。
- 灌注完成后,斩首鼠标,并通过仔细解剖切除大脑。将大脑转移到 4% PFA。使用至少5倍的脑容量(即15 mL锥形离心管中的±5±10 mL PFA),并在4°C孵育过夜,进行灌注后固定,以确保组织完全固定。继续执行步骤 3.10。
- 对于胚胎组织和早期产后组织(即P0+P3),在进行剖腹产后,用剪刀斩首胚胎。如果需要基因分型,此时收集胚胎的尾部。立即解剖大脑,转移到含有2~3 mL的4%PFA/井的12井板。在4°C孵育过夜,用于修复后。
- 第二天早晨,用10 mL(成人)或2~3 mL(胚胎)交换PFA,在RT.将组织转移到磷酸盐缓冲液(PB)中的30%蔗糖溶液,并在4°C的摇杆平台上储存,直到组织沉入溶液中。
- 将大脑嵌入到最佳切削温度(OCT)化合物中,注意为日冕或下垂分切调整大脑。将嵌入模具放在干冰上,直到 OCT 完全不透明(约 10~15 分钟),进行冷冻。将组织储存在-80°C,直到进一步使用。
4. 免疫组织M组准备
- 通过将 OCT 环应用于磁盘,并在开始冻结时将组织块直接放入 OCT 中,将组织块连接到低温恒温器中的试样盘上。确保块正确定向到所需的切割平面。
注:这里,冠状剖面研究皮质 MADM 克隆是详细描述。 - 将低温恒温器中的块温度设置为 -20 °C,将叶片温度设置为 -21 °C。
- 通过将试样盘安装到试样支架上,让组织块调节到腔室温度,并在开始分节前在低温恒温器中保留约 5 分钟。
- 在厚段(45~60 μm)中修剪块,直到达到感兴趣的组织区域。
- 一旦皮层的边缘清晰可见,停止切割并锁定刀片。在修剪块之前,确保刀片已屏蔽。
- 用刀片修剪多余的 OCT,在大脑的四面留下 ±1~2 毫米的 OCT。
- 接下来定向块,使皮层的一个侧边向下,另一个向上(即,皮层最左边缘是指向右)。
- 成人克隆的厚度为45μm,胚胎克隆的厚度为30μm。分别执行每个部分,并使用小刷子在修剪块时保持刀下区域清洁任何留下的碎屑。
注意:如果未完成此操作且节数下降,则可能难以确定切片的正确顺序。 - 如果截面开始卷曲,修剪块的边缘和/或仔细调整玻璃反辊板。
- 对于胚胎克隆分析,将截面直接安装到磨砂幻灯片上。在 37 °C 的加热板上干燥,然后直接进入步骤 5.6。
注:可以向一张幻灯片添加多个部分,但可确保保持顺序顺序。 - 要收集成年克隆,请准备 24 个包含 1 mL PBS/孔的井板(通常每个大脑 5~6 个板)。从第一个井开始,用冷钳按剖面的顺序收集PBS中的单个串行节。
注:成人组织采用浮动截面法,以确保没有遗漏任何截面,并且安装部分不包含皱纹。 - 到达新皮质结束后停止分段。
- 对于成年克隆,继续安装浮动部分。
注:部分可保持在 PBS 中 4 °C,长达 24 小时。
5. 安装成人组织进行成像
注:需要以下工具:小喷漆刷、培养皿、带0.5%Tween(PBS-T)、粘附滑片(材料表)、安装介质(材料表)、盖玻片和钳子的PBS。
- 用 PBS-T 填充培养皿。
注:洗涤剂用于帮助安装过程。如果需要染色对洗涤剂(即糖蛋白)敏感的其他抗原,最好跳过加入 Tween。 - 将粘附幻灯片放入 PBS-T 中,以便其几乎被覆盖到标签上。
- 将第一部分转移到 PBS-T 中。
- 使用小型油漆刷将截面操纵到幻灯片上并排列以保留切割顺序。以相同的方式继续执行所有其他部分。
- 一旦所有部分都到位,将幻灯片(±12×16 节/幻灯片)放在黑暗的幻灯片室中。稍微抬起盖子,使部分完全干燥(约 10~20 分钟),确保它们在随后的步骤中保持粘附。
- 如果对额外的抗原进行免疫组织化学,请直接转到第 6 节或第 7 节。
注:对于胚胎时间点,必须至少对GP和tD执行免疫处理步骤(第6节)。对于成年克隆,只有在同时染色其他抗原时(第 6 节和第 7 节),才需要这样做。 - 用 1x PBS 重新补充和清洗 1x 节,5 分钟,以去除残留的 PBS-T。将 ±1 mL 的 4°、6-二-苯酚(DAPI)稀释在 1x PBS (1 μg/mL) 中,确保覆盖所有部分并孵育 15 分钟。
- 小心地取出DAPI,用1x PBS清洗1x5分钟。取出多余的PBS,干燥±1~2分钟,然后再嵌入110μL的安装介质中。用 24 x 60 mm 盖玻片密封,在成像前让干燥至少 3 小时。
6. 仅用于 GFP 和 td 的免疫
注:本节是胚胎克隆所必需的。
- 水平将幻灯片放在加湿的幻灯片孵化室中。使用蜡标记标记幻灯片边界,以最大限度地减少所需的缓冲区量。
- 带 1x PBS 的补液部分。为了提高染色质量,使用新鲜分段的组织。
- 每张幻灯片添加 250~400 μL 的阻塞缓冲液(0.5% Triton X-100,2~3% 正常驴血清在 1x PBS 中),确保所有部分都包括在内。孵育1小时。
注:洗涤剂(Triton X-100 或 Tween-20)的浓度会因使用的其他原抗体而异,因为某些抗原对洗涤剂比其他抗原更敏感。 - 去除阻塞缓冲液,并在阻断缓冲液中向幻灯片(300±400 μL/幻灯片)添加原抗体。
注:抗GFP/抗tDT(MADM)的标准原抗体反应示例可以使用鸡肉抗GFP(1:500)和兔子抗RFP(1:500)。 - 在4°C下用原抗体孵育过夜。
注:幻灯片必须完全水平地孵育,缓冲器覆盖所有部分。否则,可能导致不平整或不良染色。 - 第二天早上确认,含有原抗体的阻塞缓冲液仍然覆盖幻灯片上的所有部分。如果没有,在RT下重复孵育步骤3~4小时。
- 去除原抗体,用1x PBS洗涤4x,在RT下洗涤10分钟。
- 加入在阻断缓冲液中稀释的二次抗体(300~400μL/幻灯片):Alexa Fluor 488 抗鸡 IgG (1:500) 和 Cy3 抗兔 IgG (1:500)。
- 在 Rt 孵育 2 小时, 保持幻灯片从光线覆盖, 以防止氟磷漂白。
- 去除二次抗体,用1x PBS洗涤2x10分钟。
- 用在PBS中稀释的DAPI(1:5,000)孵育15分钟。
- 用 1x PBS 清洗 1x 部分 10 分钟。
- 在嵌入 110 μL 的安装介质中之前,取出多余的 PBS 并干燥 ±1~2 分钟。
- 用 24 x 60 mm 盖玻片密封,在成像前让干燥至少 3 小时。图像在进行免疫组织化学后 1~2 周内滑动,以确保最佳信号。
7. 用于 GFP、tdT 和其他抗原的免疫
- 执行步骤 6.1~6.3。
- 去除阻塞缓冲液,并在阻断缓冲液中向幻灯片(300±400 μL/幻灯片)添加原抗体。
注:当染色三种或三种或更多抗原(即GP、tdT和感兴趣的蛋白质)和有关蛋白质的抗体在兔子中产生时,建议在1:500稀释时使用抗tDT(山羊)原抗体。三种抗原的原抗体反应与替代 tdT 染色的例子可以使用鸡抗 GFP (1:500),山羊抗 tdT (1:500), 和抗体对感兴趣的蛋白质 (即兔子). - 执行步骤 6.5~6.7。
- 添加在阻断缓冲液中稀释的二次抗体混合物滑动(300~400μL/幻灯片):亚历克萨氟488抗鸡IgG(1:500)、Cy3抗山羊IgG(1:500)和亚历克萨氟647抗兔IgG(1:500)。
- 执行步骤 6.9~6.14。
8. MADM 克隆的共生图像采集和定量
- 识别和记录包含克隆的大脑部分及其在皮层中的位置。
注:克隆跨度的节数因克隆的诱导时间、CreERT2驱动程序和分析时间而异。此步骤可以在共合显微镜或荧光显微镜上执行。 - 使用倒置共体显微镜,首先选择和配置正确的激光线和滤镜。对于 MADM 大脑,选择 DAPI、GFP 和 tDT(激发:358 nm、488 nm 和 554 nm;峰值发射:461 nm、507 nm 和 581 nm)。确保针孔设置为 1 个通风单元,以实现最佳成像质量。
- 对于共和特定设置,图像克隆具有 20 倍的目标和 1 倍的缩放。对于将用于量化的图像,请使用扫描速度像素停留值 1.52±2.06 μs(图像采集软件中的值 7~8),不进行平均。根据需要调整每个通道的激光强度和增益设置。
注:根据所需的图像质量,扫描速度和平均设置可能会有所不同。 - 明确识别克隆后,安排映像切片以覆盖克隆中的所有相关部分。调整 z 堆栈,以便以 1.5 μm/z 堆栈切片的间隔捕获克隆中所有 MADM 标记的单元格。调整平铺区域,以便成像克隆时捕获皮层的整个宽度(即,从皮亚尔表面到语料库)。
- 连续跨越多个截面的图像单个克隆,确保克隆内没有单元格的任何部分仍进行图像成像,以便进行 3D 重建和正确解释单元格空间信息。
- 分析每个部分包含 MADM 克隆的细胞,按顺序从 rostral 到皮层的孔面端。根据单个神经元和胶质的形态和/或标记染色来区分它们。根据核染色 (DAPI) 定义的各层边界并行记录位置信息。
注:有关胚胎分析的代表性结果,请参见图4;参见图 5,了解成人分析的代表性结果。
9. 克隆的串行 3D 重建
注:通过串行大脑部分成像的单个克隆的 3D 重建对于可视化显示以及 3D 克隆体系结构的分析非常有用,并且可以按照以下步骤执行。
- 使用图像采集软件根据采集参数拼接和融合共体平铺图像。打开 .czi 文件,然后在 ZEN软件(Zeiss)中的"处理"选项卡下运行拼接方法。
- 以 TIFF 格式将拼接的图像堆栈导出为单独的 z 平面。打开已拼接的 .czi 文件,然后在"处理"选项卡下运行图像导出方法。对于多通道图像,请导出为红色/绿色/蓝色图像,以便进行后续图像处理。
- 对克隆的每个串行大脑部分重复步骤 9.1 和 9.2。
注:为了精确的3D重建,克隆内的所有大脑部分,包括那些没有标记的细胞,也必须处理。 - 使用开源图像处理软件(如 ImageJ/Fiji67,68)将单个图像串联到单个堆栈中,从最圆体到最圆锥形的 z 平面开始。
注:此时应删除每个大脑部分边缘的任何空白图像。 - 如果需要,请按照步骤 9.5.1=9.5.5,按照步骤 9.5.1=9.5.5 更正从步骤 9.4 获得的图像堆栈,以使用名为"MultiStackReg"的 ImageJ插件进行不对齐。如果不需要图像对齐,请继续执行步骤 9.6。
注:此插件执行具有最高对比度(通常为 DAPI)的通道的图像对齐,然后将记录的变换应用于其他通道,从而允许多通道堆栈进行可靠的图像对齐。必须预安装名为"TurboReg"的辅助插件。- 在 ImageJ 中,安装 [多堆栈Reg]和 [TurboReg]插件。
- 打开从步骤 9.4 获得的克隆图像的图像堆栈进行对齐。在"图像"选项卡下"颜色"选项中,将通道拆分为 DAPI(蓝色)、GFP(绿色)和tDT(红色)。
- 运行 "多堆栈Reg"插件,通过"刚体"转换对齐 DAPI通道并保存转换文件。
- 使用"多堆栈Reg"将保存的转换文件应用于其他两个通道。
- 合并所有三个对齐的通道并保存对齐的堆栈。
- 要将 ImageJ 中的克隆定向,请以垂直方向旋转从步骤 9.4(或对齐后的步骤 9.5.5)获得的克隆图像堆栈,其顶部为 pial 曲面,底部为语料库调用体。如有必要,在 xy 平面中裁剪。
- 对于定性表示和定量分析,生成克隆的最大 z 投影图像(步骤 9.8)或执行克隆的 3D 渲染(步骤 9.9)。
- 在 ImageJ 中,从步骤 9.6 打开图像堆栈,并选择具有投影类型"最大强度"的Z 投影选项。这将生成在同一平面上投影的整个克隆的图像。
- 在 ImageJ 中,从步骤 9.6 打开图像堆栈并选择3D Project z 函数以生成可旋转的克隆的 3D 可视化效果。
注:在此步骤中,在图像采集期间输入与单个 z 堆栈厚度相等的正确切片间隔非常重要。应使用插值工具去除切片之间的间隙。
结果
MADM 导致功能绿色和红色荧光蛋白的重组,两个子细胞在 G2-X 染色体分离事件上各表达两个荧光蛋白之一(图 1A)。由于 MADM 事件导致两个后代血统的永久和独特的标记,因此可以对绿色和红色子细胞血统(子包)进行可量化的评估。变量,包括分裂模式(例如对称与不对称)和原祖先的电位(例如,后代的数量)可以确定。 当追溯性地确定原始祖细胞是否正在经历对称增殖分裂,或在TM诱导时进行不对称的神经原性分裂时,量化每个荧光标记的子clone是信息丰富的。先前的研究将Emx1-CreERT2或内斯特林-克里特T2在皮层中衍生出兴奋投影克隆分为两大类7、11、46。,11,46第一个,即"对称增殖克隆",平均由相当数量的神经元组成,绿色和红色的子克隆各包含四个或更多神经元。第二组"非对称克隆"定义了一类克隆,其中"少数"子克隆包含的神经元少于三个神经元和"多数"子克隆,四个或更多11个。这些定义特定于皮质 RGP,可能需要重新访问其他脑区域和组织。对于两类皮质克隆,后代将分布在表面层和深层层。
在设计 MADM 克隆研究时,必须考虑许多方面。由 TM 管理引起的 MADM 事件的时间是一个关键考虑因素(图 3)。对于E10的皮质兴奋投影神经元 MADM 克隆(即使用Emx1-CreERT2或Nestin-CreERT2),几乎所有 RRGP 仍在进行对称分裂11。因此,在E10与TM的感应捕获多轮增殖RGP扩增,并导致克隆与高神经元数。然而,E10 的 RGP 数量通常很少,因此 TM 管理产生的 MADM 事件很少(有时每个大脑不到一个)。大多数 RRGP 在 E12 周围从对称神经源分裂切换到非对称神经源分。为了瞄准严格不对称的神经质克隆,最好在E12或更晚时诱导(图3)。TM诱导和观察皮层中的 MADM 重组事件之间的时间往往小于 24 小时。 IP 注射是此方法在胚胎阶段施用 TM 的首选方法,因为它在克隆诱导中具有更高的可重复性。同样重要的是保持TM剂量到最低限度,原因有二。首先,如果 MADM 重组速率增加,则诱导多个(可能重叠)克隆的概率更高。其次,如果交付了太多的TM,可能会观察到流产率提高、胚胎再吸收和垃圾大小更小。在E10进行TM注射时,观察到大约一半的怀孕水坝的流产。这种频率从E11开始下降,并减少到大约1/3的怀孕水坝流产。有关 TM 剂量、感应时间以及以前MADM 研究中使用的 CreERT2驱动器的摘要,请参阅表 1。记者在没有TM的情况下观察到一些TM-可驾驶的CreERT2驱动程序69。在没有 TM 的情况下,没有使用Nestin-CreERT2驱动器的 Emx1-CreERT2观察到异位表达式或 MADM 重组事件。这可能是部分由于TM中继的染色体转重组发生在大约1:1,000至1:10,000比cis重组低的频率,降低了异位MTM标记的概率。
规划 MADM 克隆分析实验时要考虑的另一个因素是研究的持续时间。改变TM诱导和实验分析(A)(时间窗口)之间的时间长度显示干细胞动态在一段时间64。胚胎时间窗口短(即 TM/E11+A/E13;TM/E11=A/E16)捕获了胚胎神经生成动力学(图4)。比较两个或两个多个时间窗口的克隆提供了定量洞察产生的细胞数量,以及神经元分布在血统进展的不同阶段如何变化64。为了捕捉单个克隆的全部潜力,有必要将分析的时间窗口扩展到产后或成人时间点7、11、12。,127,图5中显示了在胚胎中诱导并分析在成人中的新皮质克隆的例子。值得注意的是,皮质神经发生大多完成,胶质发生增加E17。大约1/6神经原生RGP也继续产生星细胞和/或寡头细胞11。
对称克隆发生时,RGPs经历一个或多个回合的增殖分裂11。E10+E12之间诱导的RGP克隆平均体积较大,为最终神经元分布提供了更多的空间特征(图4A-C)。神经元相对分布均匀的克隆在深层和表面层中具有"圆柱体"形状,而神经元在较较深层的克隆则形成"圆锥体"形状11。要完全捕获克隆的空间和形态信息,有必要使用顺序图像计算重建每个克隆。为了测量克隆分散,将克隆的肤浅层(LII+VI)中的最大横向分散(在所有维度中测量)与深层(LV/LIV)中的神经元分散进行比较。此比率(分布上:下分布)提供了整个克隆形状的可量化读出。
非对称克隆,其中少数子克隆为三或更少,提供了对单个RGP的神经元输出的洞察(图4D-F和图5A-F)7,11,12。7,11,12多数种群(大亚克隆)可以标记为红色或,绿色,当使用Emx1-CreER T2 或 Nestin-CreERT2(图5G) T27、11、12诱导时,每个克隆平均有大约7,个兴奋投影神经元。通过分析大亚克隆中神经元在表面层和深层层的分布,可以进一步剖析 MADM 克隆中的细胞总数。少数种群(小亚克隆)被互惠的颜色标记,平均每个克隆1~2个细胞(图5H)。总的"单位大小",即平均8~9个神经元,可以通过将小而大的子组加在一起来计算(图5II)7,11,12。7,11,12需要注意的是,虽然RGPs的神经元输出是高度可预测的,但有一定程度的克隆异质性12,70。12,
在 MADM 盒式磁带上引入突变,可以生成基因马赛克,为解剖干细胞血统进展的分子调节器提供了独特的方法。因此,MADM提供了一个无与伦比的实验平台来研究基因的细胞自主功能(例如,它与小头症或大头症的关联)。通过将 MADM 基因马赛克中诱导的克隆与对照 MADM 中诱导的克隆进行比较,可以生成神经元数和分布变化的定量化。先前的基于 MADM 的研究量化了Otx1在克隆水平上小头症形成中的细胞自主功能(例如,见图 6A-E) 11。在另一项研究中,MADM克隆分析表明,Ndel1不是细胞自主调节投影神经元数,而是新生儿神经元进入或迁移皮质板的能力,皮质板随后形成成人皮层46。这些研究证明了 MADM 克隆分析在研究调节皮质发育的基因细胞自主功能方面具有高度定量性。目前,文献中没有使用 MADM 来研究在克隆水平上与巨脑有关的基因的例子。然而,在未来的研究中,对与控制皮质大小相关的基因的分析一般可以提供分子和细胞水平上非常理想的见解。

图1:单干细胞水平的血统追踪和克隆分析的M <2>原理。(A) 要使用 MADM 执行血统跟踪和克隆分析,必须存在两个组件。首先,MADM盒式磁带必须针对同源染色体上的相同位点。盒式磁带由两个嵌合荧光报告器基因组成,eGFP(绿色,[G])和串联二丁二尺番茄(红色,tdT[T])。GT盒式包含 eGFP 的 N 术语和 tdT 的 C 术语,由包含 loxP 站点的内子隔开。TG盒式磁带是反向构造的,具有 tdT 的 N 术语和 eGFP 的 C 术语。其次,Cre重组酶的表达必须出现在包含目标 MADM 盒的单元中。loxP 站点充当 Cre 中介的染色体间重组的目标,导致同时重组两个表达盒。如果重组发生在细胞周期的G2阶段,然后是X分离(G2-X),两个子细胞将表达两个荧光蛋白之一。(B) 在单个克隆水平上进行遗传马赛克分析的 MADM 原理.突变等位基因(点突变、删除、插入、loxP-侧翼条件等)可以通过美的重组引入TG-MADM盒式磁带(参见图2和Hippenmeyer等人,了解如何将突变等位基因引入 MADM 系统的详细信息)。 Figure 1B如果G2-X Cre重组酶-中间体间转重组发生在MADM盒之间,它导致一个GP®同源突变细胞(GeneX-/-)为感兴趣的基因和一个tD-同源野生细胞(GeneX+/+)在一个未标记的异质环境46,47,71。46,47,71克隆分析(即黄细胞)中未使用的替代标记结果先前已详细描述11、46、47。11,46,47请单击此处查看此图的较大版本。
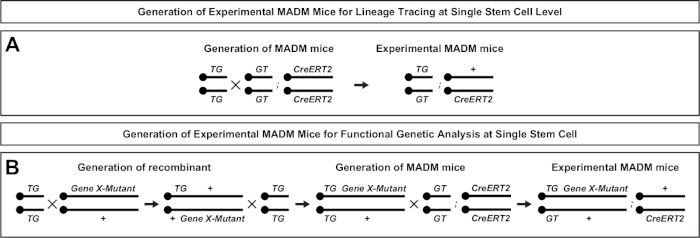
图2:用于生成实验M组小鼠的育种方案,用于血统追踪。育种方案用于生成控制 MADM ( A )和基因 X MADM (B) 实验 MADM 小鼠进行克隆分析.有关 MADM 育种模式的更多信息,请参阅贝蒂等人7和 Hippenmeyer 等人7,46,46。请单击此处查看此图的较大版本。

图3:基于 MADM 的克隆血统分析的时间课程范式。实验设计时间窗口的示意图。对于纵向采样范式,克隆感应的时间点保持不变,分析前的时间长度也各不相同。在渐进间隔采样中,分析的时间点保持不变,但感应时间不同。一种或两种方法的组合可以使用,具体取决于所解决的问题。请单击此处查看此图的较大版本。

图4:发育中和成人新皮质中的M组克隆分析。TM中继的 MADM 克隆诱导在对称增殖 (TM 在 E10) (A-C) 和不对称神经原源 (TM 在 E12) (D-F) 划分 RGPs. 描述的是体内单个 MADM 克隆(TM/E10+A/E16 和 TM/E12+A/E16)(B,E)和成人 (TM/E10+A/P21 和 TM/E12+A/P21)(C,F) 在 MADM-11GT/TG;内丁-克里特T2+/- (B,E)和MADM-11GT/TG;Emx1-CreERT2+/- (C,F)神经元输出独立于亚包颜色和绿色多数/少数子包可以比较红色多数/少数子包在控制条件下7,11。7,大约1/6的成年克隆也含有星细胞和/或橄榄细胞,由白色星号表示。面板B和F分别得到希彭迈尔等人的许可,鲁兰兹和西蒙斯72号分别转载。CP = 皮质板。请单击此处查看此图的较大版本。
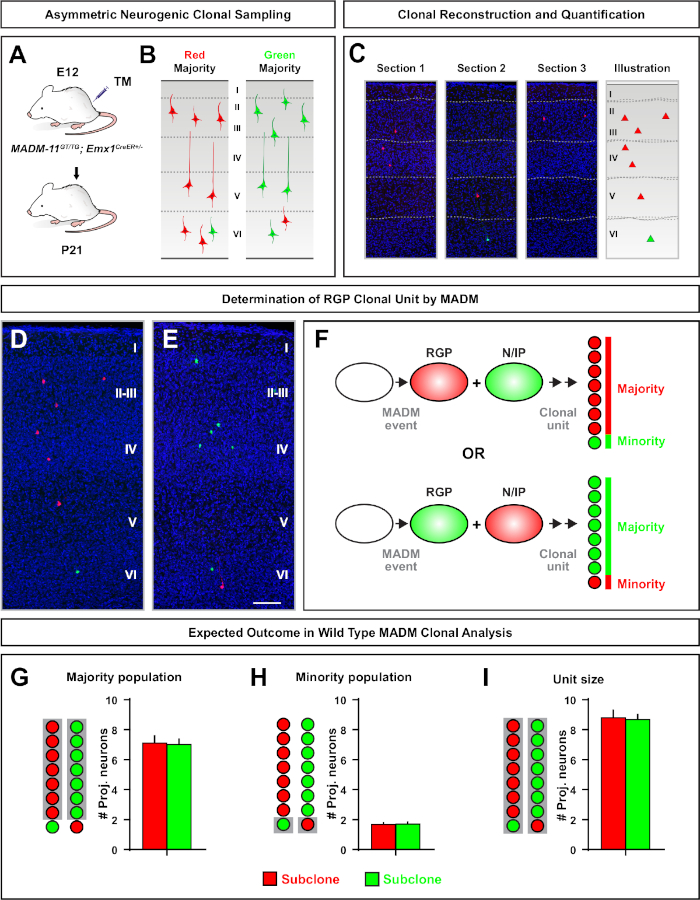
图5:MADM克隆分析,以量化RGP中继神经元输出。使用 MADM7,11分析单个神经原生 RGPs 在克隆水平上的兴奋神经元(单位)产生。(A) 在发育皮层中诱导大部分非对称 MADM 克隆的实验范式。(B) 可能的不对称克隆结果,多数亚克隆在绿色或红色(C)代表连续部分标记,跨越单个神经源非对称克隆(D,E) 3D 重建图像的代表性非对称 G2-X MADM 克隆与多数人口在红色(D)或绿色 (E)在MADM-11GT/TG;Emx1-CreERT2+/-在 E12 进行 TM 感应,在 P21 进行分析。请注意,绿色和红色标记的单元格都是野生类型。(F) 示意两种可能的实验性 MADM 克隆结果的示意图.(G) 量化在 MADM-11 克隆中更新 RGP 所产生的多数种群的规模。(H) 量化在 MADM-11 克隆中更新 RGPs 所产生的少数民族人口规模。(I) 非对称神经原体 MADM-11 克隆单一大小的定量。假设值可能表示均值 = SEM. 比例柱 = 100 μm (D和E) 。TM = 塔莫西芬。请单击此处查看此图的较大版本。
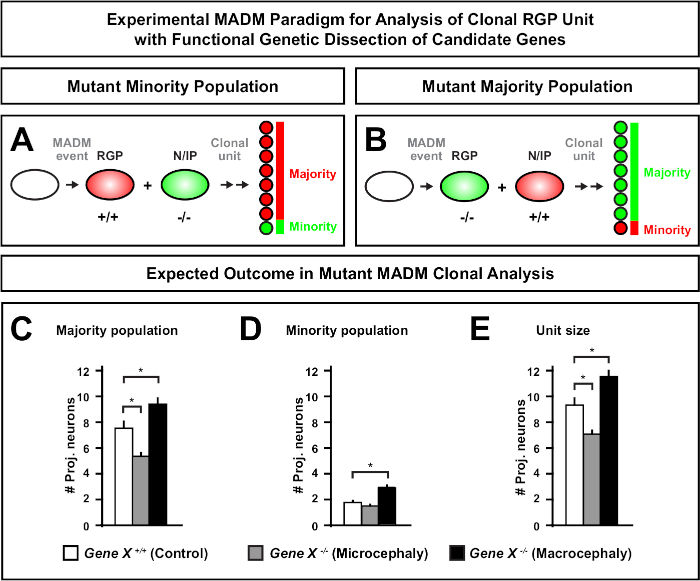
图6:MADM克隆分析,研究导致小头症和巨脑的基因。假设 MADM 克隆分析结果在执行导致小头症或大头症的候选基因的功能基因解剖时。要解剖神经元输出中感兴趣的基因(基因X)的细胞自主功能,MADM要求突变等位基因通过美的重组引入到MDM盒式磁带上(有关如何将突变等位基因引入 MADM 系统的详细信息,另见图 2、HippenmeyerFigure 2等人46和 Laukoter 等人46、73)。,73(A,B)用于克隆RGP单元功能分析的实验 MADM 范式。突变子组可以形成少数 ( A )或多数 (B) 人口.(C-E)定量控制 MADM(白条)、基因-X MADM 小头症(灰色条)和基因-X MADM 巨头黑条)不对称克隆时,假设 MADM 克隆分析结果。(C) 人口规模量化。(D) 少数民族人口规模的量化。(E) 非对称神经源克隆单体大小的定量.假设值可以表示均值 = SEM. S = 假设场景,其中子clone 细胞数的差异可能达到显著性,相对于控制。请单击此处查看此图的较大版本。
表1:文献中的 MADM 克隆研究。文献中包含 MADM 克隆血统实验的研究摘要,包括使用的CreERT2驱动器、TM 剂量和注射时间。请单击此处查看此表(右键单击以下载)。
讨论
介绍了一种使用 MADM 跟踪发育中新皮质中体内单个 RGP 细胞系的方法。当与TM-可感知CreERT2结合使用时,MADM事件可以精确定时,在单细胞水平上提供干细胞分裂模式的一个高度定性和定量的视觉读出。通过滴定交付的TM剂量,在理想情况下,每个皮质半球平均不到一个克隆,从而提供足够的空间分离,以明确区分单个克隆。通过保持组织的完整性,此方法还可以捕获有关位置、形态和绝对细胞数的基本信息。59 Chr. 1147,7、,11、 12,12、46、 56、,56,57、Chr.7 51 的 MADM 盒式磁带和 7 51 的 MADM 盒式磁带,以及751的原 MADM 盒式磁带,已用于 MADM 克隆分析研究。单个细胞的高分辨率提供了对子细胞形态学和克隆关系的前所未有的洞察,并允许活体成像增殖干细胞和新兴克隆46,52。46,
剖腹产和幼崽的培育,用于在产后时间点分析克隆是协议中必要和关键的一步。根据TM治疗的怀孕大坝的健康状况,可能没有必要进行剖腹产。然而,与养母一起饲养幼崽仍然需要,因为TM治疗的母亲可能有哺乳困难。在需要培养不同的CreERT2驱动程序方面,没有观察到任何差异。MADM 线路和寄养母亲都保留在外种 CD-1 背景上。如果不需要剖腹产,用于生成实验幼崽的 TM 处理怀孕大坝可以按照 3R 原则重新用于额外的实验育种(请注意,只有在动物实验许可证批准此做法时才能这样做)。养母可以在分娩后2天内用于培育幼崽,但当养母与必须培育的实验鼠同日分娩时,成功率更高。因此,在步骤1.1中,在实验交配的同时为养母设置定时交配非常重要。保持与原养母的垃圾数量相似,可以提高寄养幼崽的存活率,因此可能需要清除一些原生垃圾。可能改善寄养的其他步骤包括用垃圾和食物摩擦实验者手套(去除手套的气味);剖腹产后用养母脏垃圾和巢的碎片轻轻地摩擦幼崽;和幼崽在寄养老鼠笼中放置之前与养母幼崽亲密接触。
与其他基于记者的血统跟踪方法一样,在选择 MADM 克隆实验的最佳CreERT2驱动程序时,必须仔细考虑。首先,使用的启动子必须在时间和空间上表达利益祖先群体中的重组。找到这种促进者可能具有挑战性,因为一些促进者可能会改变表达模式,或在不同的发展阶段变得沉默。为了提高细胞类型特异性,使用了多个站点特异性重组,每个重组由单独的启动子驱动。当一个或两个重组细胞在同一个细胞中表示时,这将用荧光处理器74、75、76、77,75,76来标记,细胞及其后代。总之,重要的是选择一个CreERT2驱动程序,这是特定于被分析的祖先群体。
此方法中最关键的步骤是克隆的标识,因为所有单元都必须从单个重组事件(步骤 8.1)中明确派生。TM 浓度的滴定可确保每个脑半球少于一组红/绿细胞,并最大限度地提高分析单个克隆(步骤 2.2)7,,11 的概率。如果相邻的细胞群集出现在感兴趣的克隆的 500 μm 范围内,则应丢弃克隆。因此,在克隆出现之前和之后检查多个部分非常重要,以确保附近没有其他重组事件。由于荧光团信号较弱,有必要对胚胎克隆中的eGFP和tDT进行免疫组化学(见第6节)。只有在成人克隆中,如果将添加其他抗原,则建议这样做。成像克隆时,必须捕获克隆位于的皮层的整个宽度(即从皮亚尔表面到语料库,请参见步骤 8.4),不要错过任何细胞。这也便于图像处理期间的图像对齐(第 9 节)。协议第 8 节需要倒置共体显微镜,但可根据可用的显微镜设置进行调整。可以使用荧光显微镜,但建议进行共聚焦显微镜,因为这会导致对焦平面外部的光污染减少。同样重要的是,要调整激光强度和增益,以便明确识别绿色、红色和黄色细胞。无论设置如何,建议使用至少 20 倍的目标,以确保紧密定位的单元格完全空间分离。除了记录所有细胞的皮质深度(步骤8.6)外,还必须使用大脑图集(如艾伦脑图集或其他立体税坐标图)来识别克隆的皮质区域。还应采用文件命名范例,以确保克隆图像易于识别。以下信息可以包含在文件命名中:唯一的图像 ID、拍摄日期图像、动物的基因型、诱导年龄、分析年龄、与同一克隆中其余图像相关的图像编号。
引入一个 MADM 盒式磁带的突变,独特的允许生成基因马赛克71,并允许在克隆,级别7、11、46、62 中,11解剖血统和细胞类型多样性的分子调节器。要使用 MADM 生成遗传马赛克,MADM 盒式磁带必须与感兴趣的基因相同的染色体以美的相源方式连接(有关育种方案,请参见图 2)。这限制了目前与M <3>M的克隆分析,基因位于Chr.75151,Chr.1146,Chr.1251,和Chr.6,对Rosa26位4651点47。未来的研究将使用针对任何染色体的 MADM 盒式磁带,从而允许在克隆水平上对小鼠基因组的几乎所有基因进行镶嵌分析。
最后,MADM不仅限于分析新皮质发育中的祖先细胞。许多干细胞利基的研究可能受益于解决克隆相关细胞的时空排列的能力。通过将 MADM 应用于大脑的其他区域、疾病条件(如癌症)或其他组织 47、50、51、52、53、54、55、56、57、58、59,研究揭示了源自不同类别的祖先和干细胞的克隆的血统关系(有关 MADM 克隆研究当前列表,见表1)。 47,50,51,52,53,54,55,56,57,58,59MADM 的另一个有趣的未来应用是将其与其他功能或亚细胞处理器相结合,这将增加可以从克隆获取的信息量。
披露声明
作者没有什么可透露的。
致谢
我们感谢希彭迈尔实验室的所有成员进行讨论,感谢奥地利IST的生物成像设施、生命科学设施和临床前设施提供技术支持。这项工作得到了奥地利国际投资促进机构基金的支持;R.B. 获得奥地利科学基金(FWF)Lise-Meitner项目(M 2416)的支持;N.A得到奥地利科学基金(FWF)菲尔恩伯格项目(T 1031)的支持;根据第754411号《玛丽·斯科多夫斯卡-库里赠款协议》第754411号授权协议,GC获得了欧洲联盟Horizon 2020研究和创新方案的支持,成为 ISTplus 博士后研究员;A.H. 获得奥地利科学院博士研究金的一个 AAW DOC 的支持。这项研究还得到了欧洲研究理事会(ERC)根据欧盟地平线2020研究和创新方案(赠款协议第725780号LinPro)对S.H的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL tuberculin syringe (Omnifix Luer Lock) | Braun | 9204512N | |
| 1,4-diazabicyclooctane (DABCO) | Roth | 0718.2 | |
| 10 mL Syringe (Omnifix Luer Lock) | Braun | 8508429N | |
| 15 mL conical centrifuge | Sarstedt | 65.554.502 | |
| 24 multi-well dishes | Roth/Greiner Bio-one | CE56.1 | |
| 27- gauge x 3/4 needle (Sterican) | Braun | 16010256E | |
| Corn oil | Sigma | C8267-500ML | |
| Coverslips (24 x 60 mm #1) | Thermo Fisher Scientific (Menzel) | 15747592 | |
| Cryostat Cryostar NX70 | Thermo Fisher Scientific | 957000H | |
| Dako Pen (Wax marker) | Agilent | S200230-2 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Invitrogen | D1306 | |
| Disposable microtome blade (MX35 Ultra) | Thermo Fisher Scientific | 705830 | |
| Fine Forceps (Dumont #5) | Fine Science Tools (FST) | 11254-20 | |
| Glass anti-roll plate | Histocom | M 449980 | |
| Glycerol | Sigma | G5516 | |
| LSM 800 Confocal | Zeiss | ||
| Mounting medium | 25 mg/mL DAPCO, 6 g Glycerol, 2.4 g Mowiol 4-88, 6 mL dH2O, 12 mL 0.2 M Tris-HCl (pH 8.5) | ||
| Mowiol 4-88 | Roth | 0713.2 | |
| Normal donkey serum | Innovative Research | IGDNSER100ML | |
| Paraformaldehyde | Sigma | 441244-1KG | |
| Peristaltic pump 323E/D 400RPM | Watson-Marlow | 036.3124.00A | |
| Sucrose | Sigma | S8501-5KG | |
| Superfrost plus glass slides | Thermo Fisher Scientific | J1800AMNT | |
| Tamoxifen | Sigma | T5648 | |
| Tissue Embedding mold T-12 (22mm square) | Polysciences Inc. | 18986-1 | |
| Tissue-Tek O.C.T | Sakura | 4583 | |
| Triton X-100 | Sigma | T8787-250ML | |
| Trizma hydrochloride | Sigma | 93363 | |
| Tween-20 | Sigma | P9416-100ML | |
| Software and Plugins: | |||
| Fiji | 1.52p | Fiji | |
| MultiStackReg | 1.45 | Download link | |
| TurboReg | EPFL Bioimaging | ||
| Zen Blue | 2.6 | Zeiss | |
| Experimental Models: Organisms/Strains: | |||
| Mouse: Emx1-CreER | The Jackson Laboratory | JAX:027784 | |
| Mouse: MADM-11-GT | The Jackson Laboratory | JAX:013749 | |
| Mouse: MADM-11-TG | The Jackson Laboratory | JAX:013751 | |
| Primary antibodies: | |||
| Chicken anti-GFP 1:500 | Aves Labs | GFP-1020 | |
| Goat anti-tdTomato 1:500 | Sicgen Antibodies | AB8181-200 | |
| Rabbit anti-RFP 1:500 | MBL | PM005 | |
| Secondary antibodies: | |||
| Donkey Anti-Chicken Alexa Fluor 488 1:500 | Jackson Immuno Research | 715-475-150 | |
| Donkey Anti-Goat Cy3 1:500 | Jackson Immuno Research | 705-165-147 | |
| Donkey Anti-Rabbit Cy3 1:500 | Jackson Immuno Research | 711-165-152 |
参考文献
- Malatesta, P., et al. Neuronal or glial progeny: regional differences in radial glia fate. Neuron. 37 (5), 751-764 (2003).
- Miyata, T., Kawaguchi, A., Okano, H., Ogawa, M. Asymmetric inheritance of radial glial fibers by cortical neurons. Neuron. 31 (5), 727-741 (2001).
- Noctor, S. C., Flint, A. C., Weissman, T. A., Dammerman, R. S., Kriegstein, A. R. Neurons derived from radial glial cells establish radial units in neocortex. Nature. 409 (6821), 714-720 (2001).
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30 (1), 465-502 (2014).
- Desikan, R. S., Barkovich, A. J. Malformations of cortical development. Annals of Neurology. 80 (6), 797-810 (2016).
- Gao, R., Penzes, P. Common mechanisms of excitatory and inhibitory imbalance in schizophrenia and autism spectrum disorders. Current Molecular Medicine. 15 (2), 146-167 (2015).
- Beattie, R., et al. Mosaic Analysis with Double Markers Reveals Distinct Sequential Functions of Lgl1 in Neural Stem Cells. Neuron. 94 (3), 517-533 (2017).
- Hippenmeyer, S. Molecular pathways controlling the sequential steps of cortical projection neuron migration. Advances in Experimental Medicine and Biology. 800, 1-24 (2014).
- Lodato, S., Arlotta, P. Generating neuronal diversity in the mammalian cerebral cortex. Annual Review of Cell and Developmental Biology. 31, 699-720 (2015).
- Hansen, A. H., Duellberg, C., Mieck, C., Loose, M., Hippenmeyer, S. Cell Polarity in Cerebral Cortex Development-Cellular Architecture Shaped by Biochemical Networks. Frontiers in Cellular Neuroscience. 11, 176 (2017).
- Gao, P., et al. Deterministic progenitor behavior and unitary production of neurons in the neocortex. Cell. 159 (4), 775-788 (2014).
- Llorca, A., et al. A stochastic framework of neurogenesis underlies the assembly of neocortical cytoarchitecture. eLife. 8, e51381 (2019).
- Ma, J., Shen, Z., Yu, Y. C., Shi, S. H. Neural lineage tracing in the mammalian brain. Current Opinion in Neurobiology. 50, 7-16 (2018).
- Caviness, V., Takahashi, T., Nowakowski, R. Numbers, time and neocortical neuronogenesis: a general developmental and evolutionary model. Trends in Neurosciences. 18 (9), 379-383 (1995).
- Schmechel, D. E., Rakic, P. A Golgi study of radial glial cells in developing monkey telencephalon: morphogenesis and transformation into astrocytes. Anatomy and Embryology. 156 (2), 115-152 (1979).
- Kessaris, N., et al. Competing waves of oligodendrocytes in the forebrain and postnatal elimination of an embryonic lineage. Nature Neuroscience. 9 (2), 173-179 (2006).
- Magavi, S., Friedmann, D., Banks, G., Stolfi, A., Lois, C. Coincident generation of pyramidal neurons and protoplasmic astrocytes in neocortical columns. The Journal of Neuroscience. 32 (14), 4762-4772 (2012).
- Anthony, T. E., Klein, C., Fishell, G., Heintz, N. Radial glia serve as neuronal progenitors in all regions of the central nervous system. Neuron. 41 (6), 881-890 (2004).
- Voigt, T. Development of glial cells in the cerebral wall of ferrets: direct tracing of their transformation from radial glia into astrocytes. The Journal of Comparative Neurology. 289 (1), 74-88 (1989).
- Amberg, N., Laukoter, S., Hippenmeyer, S. Epigenetic cues modulating the generation of cell-type diversity in the cerebral cortex. Journal of Neurochemistry. 149 (1), 12-26 (2019).
- Beattie, R., Hippenmeyer, S. Mechanisms of Radial Glia Progenitor Cell Lineage Progression. FEBS letters. 591 (24), 3993-4008 (2017).
- Telley, L., et al. Temporal patterning of apical progenitors and their daughter neurons in the developing neocortex. Science. 364 (6440), eaav2522 (2019).
- Oberst, P., et al. Temporal plasticity of apical progenitors in the developing mouse neocortex. Nature. 573 (7774), 370-374 (2019).
- Telley, L., et al. Sequential transcriptional waves direct the differentiation of newborn neurons in the mouse neocortex. Science. 351 (6280), 1443 (2016).
- Deppe, U., et al. Cell lineages of the embryo of the nematode Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 75 (1), 376-380 (1978).
- Woodworth, M. B., Girskis, K. M., Walsh, C. A. Building a lineage from single cells: genetic techniques for cell lineage tracking. Nature Reviews Genetics. 18 (4), 230-244 (2017).
- Masuyama, N., Mori, H., Yachie, N. DNA barcodes evolve for high-resolution cell lineage tracing. Current Opinion in Chemical Biology. 52, 63-71 (2019).
- Legue, E., Joyner, A. L. Chapter Ten-Genetic Fate Mapping Using Site-Specific Recombinases. Methods in Enzymology. 477, 153-181 (2010).
- Postiglione, M. P., Hippenmeyer, S. Monitoring neurogenesis in the cerebral cortex: an update. Future Neurology. 9 (3), 323-340 (2014).
- Espinosa-Medina, I., Garcia-Marques, J., Cepko, C., Lee, T. High-throughput dense reconstruction of cell lineages. Open Biology. 9 (12), 190229 (2019).
- Hwang, B., et al. Lineage tracing using a Cas9-deaminase barcoding system targeting endogenous L1 elements. Nature Communications. 10 (1), 1234 (2019).
- Kalhor, R., et al. Developmental barcoding of whole mouse via homing CRISPR. Science. 361 (6405), eaat9804 (2018).
- García-Moreno, F., Vasistha, N. A., Begbie, J., Molnár, Z. CLoNe is a new method to target single progenitors and study their progeny in mouse and chick. Development. 141 (7), 1589-1598 (2014).
- Loulier, K., et al. Multiplex Cell and Lineage Tracking with Combinatorial Labels. Neuron. 81 (3), 505-520 (2014).
- Livet, J., et al. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-62 (2007).
- Snippert, H. J., et al. Intestinal Crypt Homeostasis Results from Neutral Competition between Symmetrically Dividing Lgr5 Stem Cells. Cell. 143 (1), 134-144 (2010).
- Amitai-Lange, A., et al. A method for lineage tracing of corneal cells using multi-color fluorescent reporter mice. Journal of Visualized Experiments. (106), e53370 (2015).
- Vasistha, N. A., et al. Cortical and Clonal Contribution of Tbr2 Expressing Progenitors in the Developing Mouse Brain. Cerebral Cortex. 25 (10), 3290-3302 (2015).
- Chen, F., LoTurco, J. A method for stable transgenesis of radial glia lineage in rat neocortex by piggyBac mediated transposition. Journal of Neuroscience Methods. 207 (2), 172-180 (2012).
- Siddiqi, F., et al. Fate mapping by piggyBac transposase reveals that neocortical GLAST+ progenitors generate more astrocytes than Nestin+ progenitors in rat neocortex. Cerebral Cortex. 24 (2), 508-520 (2014).
- Yoshida, A., et al. Simultaneous expression of different transgenes in neurons and glia by combining in utero electroporation with the Tol2 transposon-mediated gene transfer system. Genes to Cells. 15 (5), 501-512 (2010).
- García-Marqués, J., López-Mascaraque, L. Clonal Identity Determines Astrocyte Cortical Heterogeneity. Cerebral Cortex. 23 (6), 1463-1472 (2013).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884 (2019).
- Kim, G. B., et al. Rapid Generation of Somatic Mouse Mosaics with Locus-Specific, Stably Integrated Transgenic Elements. Cell. 179 (1), 251-267 (2019).
- Pilz, G. A., et al. Live imaging of neurogenesis in the adult mouse hippocampus. Science. 359 (6376), 658 (2018).
- Hippenmeyer, S., et al. Genetic Mosaic Dissection of Lis1 and Ndel1 in Neuronal Migration. Neuron. 68 (4), 695-709 (2010).
- Zong, H., Espinosa, J. S., Su, H. H., Muzumdar, M. D., Luo, L. Mosaic analysis with double markers in mice. Cell. 121 (3), 479-492 (2005).
- Ramón y Cajal, S. . Histologie du système nerveux de l'homme et des vertébrés. , (1911).
- Cowan, W. M. The emergence of modern neuroanatomy and developmental neurobiology. Neuron. 20 (3), 413-426 (1998).
- Ali, S. R., et al. Existing cardiomyocytes generate cardiomyocytes at a low rate after birth in mice. Proceedings of the National Academy of Sciences of the United States of America. 111 (24), 8850-8855 (2014).
- Hippenmeyer, S., Johnson, R. L., Luo, L. Mosaic analysis with double markers reveals cell-type-specific paternal growth dominance. Cell Reports. 3 (3), 960-967 (2013).
- Riccio, P., Cebrian, C., Zong, H., Hippenmeyer, S., Costantini, F. Ret and Etv4 promote directed movements of progenitor cells during renal branching morphogenesis. PLoS Biology. 14 (2), e1002382 (2016).
- Bonaguidi, M. A., et al. In vivo clonal analysis reveals self-renewing and multipotent adult neural stem cell characteristics. Cell. 145 (7), 1142-1155 (2011).
- Mayer, C., et al. Clonally Related Forebrain Interneurons Disperse Broadly across Both Functional Areas and Structural Boundaries. Neuron. 87 (5), 989-998 (2015).
- Muzumdar, M. D., et al. Clonal dynamics following p53 loss of heterozygosity in Kras-driven cancers. Nature Communications. 7, 12685 (2016).
- Shi, W., et al. Ontogenetic establishment of order-specific nuclear organization in the mammalian thalamus. Nature Neuroscience. 20, 516 (2017).
- Wong, S. Z. H., et al. In vivo clonal analysis reveals spatiotemporal regulation of thalamic nucleogenesis. PLoS Biology. 16 (4), e2005211 (2018).
- Xu, H. T., et al. Distinct Lineage-Dependent Structural and Functional Organization of the Hippocampus. Cell. 157 (7), 1552-1564 (2014).
- Brennand, K., Huangfu, D., Melton, D. All β Cells Contribute Equally to Islet Growth and Maintenance. PLoS Biology. 5 (7), e163 (2007).
- Ortiz-Alvarez, G., et al. Adult neural stem cells and multiciliated ependymal cells share a common lineage regulated by the geminin family members. Neuron. 102 (1), 159-172 (2019).
- Kaplan, E. S., Ramos-Laguna, K. A., Mihalas, A. B., Daza, R. A. M., Hevner, R. F. Neocortical Sox9+ radial glia generate glutamatergic neurons for all layers, but lack discernible evidence of early laminar fate restriction. Neural Development. 12 (1), 14 (2017).
- Lv, X., et al. TBR2 coordinates neurogenesis expansion and precise microcircuit organization via Protocadherin 19 in the mammalian cortex. Nature Communications. 10 (1), 3946 (2019).
- Mihalas, A. B., Hevner, R. F. Clonal analysis reveals laminar fate multipotency and daughter cell apoptosis of mouse cortical intermediate progenitors. Development. 145 (17), dev164335 (2018).
- Picco, N., et al. A mathematical insight into cell labelling experiments for clonal analysis. Journal of Anatomy. 235 (3), 687-696 (2019).
- Johnson, C. A., Ghashghaei, H. T. Sp2 regulates late neurogenic but not early expansive divisions of neural stem cells underlying population growth in the mouse cortex. Development. , (2020).
- Espinosa, J. S., Luo, L. Timing Neurogenesis and Differentiation: Insights from Quantitative Clonal Analyses of Cerebellar Granule Cells. The Journal of Neuroscience. 28 (10), 2301 (2008).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Liu, Y., et al. Tamoxifen-independent recombination in the RIP-CreER mouse. PLoS One. 5 (10), e13533 (2010).
- Klingler, E., Jabaudon, D. Do progenitors play dice?. eLife. 9, e54042 (2020).
- Hippenmeyer, S. Dissection of gene function at clonal level using mosaic analysis with double markers. Frontiers in Biology. 8 (6), 557-568 (2013).
- Rulands, S., Simons, B. D. Tracing cellular dynamics in tissue development, maintenance and disease. Current Opinion in Cell Biology. 43, 38-45 (2016).
- Laukoter, S., et al. Imprinted Cdkn1c genomic locus cell-autonomously promotes cell survival in cerebral cortex development. Nature Communications. 11 (1), 195 (2020).
- Daigle, T. L., et al. A Suite of Transgenic Driver and Reporter Mouse Lines with Enhanced Brain-Cell-Type Targeting and Functionality. Cell. 174 (2), 465-480 (2018).
- He, M., et al. Strategies and Tools for Combinatorial Targeting of GABAergic Neurons in Mouse Cerebral Cortex. Neuron. 91 (6), 1228-1243 (2016).
- Yamamoto, M., et al. A multifunctional reporter mouse line for Cre- and FLP-dependent lineage analysis. Genesis. 47 (2), 107-114 (2009).
- Plummer, N. W., et al. Expanding the power of recombinase-based labeling to uncover cellular diversity. Development. 142 (24), 4385 (2015).
- Imayoshi, I., Ohtsuka, T., Metzger, D., Chambon, P., Kageyama, R. Temporal regulation of Cre recombinase activity in neural stem cells. Genesis. 44 (5), 233-238 (2006).
- Sasaki, S., et al. Complete loss of Ndel1 results in neuronal migration defects and early embryonic lethality. Molecular and Cellular Biology. 25 (17), 7812-7827 (2005).
- Acampora, D., et al. Epilepsy and brain abnormalities in mice lacking the Otx1 gene. Nature Genetics. 14 (2), 218-222 (1996).
- Soeda, T., et al. Sox9-expressing precursors are the cellular origin of the cruciate ligament of the knee joint and the limb tendons. Genesis. 48 (11), 635-644 (2010).
- Klezovitch, O., Fernandez, T. E., Tapscott, S. J., Vasioukhin, V. Loss of cell polarity causes severe brain dysplasia in Lgl1 knockout mice. Genes & Development. 18 (5), 559-571 (2004).
- Pimeisl, I. M., et al. Generation and characterization of a tamoxifen-inducible EomesCreER mouse line. Genesis. 51 (10), 725-733 (2013).
- Nakagawa, N., et al. Memo1-Mediated Tiling of Radial Glial Cells Facilitates Cerebral Cortical Development. Neuron. 103 (5), 836-852 (2019).
- Nowotschin, S., et al. The T-box transcription factor Eomesodermin is essential for AVE induction in the mouse embryo. Genes & Development. 27 (9), 997-1002 (2013).
- Balordi, F., Fishell, G. Mosaic removal of hedgehog signaling in the adult SVZ reveals that the residual wild-type stem cells have a limited capacity for self-renewal. Journal of Neuroscience. 27 (52), 14248-14259 (2007).
- Liang, H., et al. Neural development is dependent on the function of specificity protein 2 in cell cycle progression. Development. 140 (3), 552-561 (2013).
- Guo, C., Yang, W., Lobe, C. G. A Cre recombinase transgene with mosaic, widespread tamoxifen-inducible action. Genesis. 32 (1), 8-18 (2002).
- Ahn, S., Joyner, A. L. In vivo analysis of quiescent adult neural stem cells responding to Sonic hedgehog. Nature. 437 (7060), 894-897 (2005).
- Storm, R., et al. The bHLH transcription factor Olig3 marks the dorsal neuroepithelium of the hindbrain and is essential for the development of brainstem nuclei. Development. 136 (2), 295-305 (2009).
- Koundakjian, E. J., Appler, J. L., Goodrich, L. V. Auditory neurons make stereotyped wiring decisions before maturation of their targets. Journal of Neuroscience. 27 (51), 14078-14088 (2007).
- Dor, Y., Brown, J., Martinez, O. I., Melton, D. A. Adult pancreatic β-cells are formed by self-duplication rather than stem-cell differentiation. Nature. 429 (6987), 41-46 (2004).
- Sohal, D. S., et al. Temporally regulated and tissue-specific gene manipulations in the adult and embryonic heart using a tamoxifen-inducible Cre protein. Circulation Research. 89 (1), 20-25 (2001).
- Ventura, A., et al. Restoration of p53 function leads to tumour regression in vivo. Nature. 445 (7128), 661-665 (2007).
- Johnson, L., et al. Somatic activation of the K-ras oncogene causes early onset lung cancer in mice. Nature. 410 (6832), 1111-1116 (2001).
- Tasic, B., et al. Extensions of MADM (mosaic analysis with double markers) in mice. PLoS One. 7 (3), e33332 (2012).
- Yu, J., Carroll, T. J., McMahon, A. P. Sonic hedgehog regulates proliferation and differentiation of mesenchymal cells in the mouse metanephric kidney. Development. 129 (22), 5301-5312 (2002).
- Zhao, H., et al. Role of fibroblast growth factor receptors 1 and 2 in the ureteric bud. Developmental Biology. 276 (2), 403-415 (2004).
- Schuchardt, A., D'Agati, V., Larsson-Blomberg, L., Costantini, F., Pachnis, V. Defects in the kidney and enteric nervous system of mice lacking the tyrosine kinase receptor Ret. Nature. 367 (6461), 380-383 (1994).
- Livet, J., et al. ETS gene Pea3 controls the central position and terminal arborization of specific motor neuron pools. Neuron. 35 (5), 877-892 (2002).
- Volz, K. S., et al. Pericytes are progenitors for coronary artery smooth muscle. eLife. 4, e10036 (2015).
- Cai, C. L., et al. A myocardial lineage derives from Tbx18 epicardial cells. Nature. 454 (7200), 104-108 (2008).
- Lasrado, R., et al. Lineage-dependent spatial and functional organization of the mammalian enteric nervous system. Science. 356 (6339), 722-726 (2017).
- Matsuoka, T., et al. Neural crest origins of the neck and shoulder. Nature. 436 (7049), 347-355 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。