Method Article
Çift Marker (MADM) ile Mozaik Analizi Kullanarak Serebral Korteks Geliştirilmesinde Soy İzleme ve Klonal Analizi
Bu Makalede
Özet
Çift belirteçli (MADM) ile mozaik analizi kullanılarak aday genlerin tek bir hücre düzeyinde soy izleme ve fonksiyonel genetik analizini yapmak için bir protokol sunulmuştur. MADM klonal analizi, bireysel ataların ve kız hücrelerinin proliferatif davranışını, hücresel çıktısını ve soy ilişkisini ölçmek için nicel bir çerçeve sağlar.
Özet
Sınırlı bir ata havuzundan başlayarak, memeli serebral korteks son derece organize fonksiyonel nöral devreler oluşturur. Ancak, nöral kök hücrelerin soy geçişlerini düzenleyen altta yatan hücresel ve moleküler mekanizmalar (NSCs) ve nöron ve glia nihai üretimi gelişmekte olan nöroepitel belirsizliğini koruyor. NSC bölünme desenlerini izleme ve klonla ilişkili hücrelerin soylarını haritalama yöntemleri önemli ölçüde gelişmiştır. Ancak, birçok çağdaş soy izleme teknikleri ata hücre bölünmesi desenleri deşifre etmek için gerekli olan nesil hücre kaderi, hücresel çözünürlük eksikliği muzdarip. Sunulan vivo klonal analiz gerçekleştirmek için çift belirteçleri (MADM) ile mozaik analizi kullanarak bir protokoldür. MADM, tek tek progenitor hücrelerini eş olarak manipüle eder ve eşi görülmemiş tek hücre çözünürlüğünde kesin bölme desenlerini ve soy ilerlemesini görselleştirir. Mitozging-X evresinde MADM tabanlı interkromozomal rekombinasyon olaylari, zamansal indükleyici CreERT2ile birlikte, klonların doğum tarihleri ve bölünme desenleri hakkında kesin bilgi sağlar. Böylece MADM soy takibi, kök hücre atalarının tek hücre düzeyinde ki proliferasyon modunun benzeri görülmemiş nitel ve nicel optik okumalarını sağlar. MADM ayrıca NSC soyundan ilerlemede aday genlerin mekanizmalarının ve fonksiyonel gereksinimlerinin incelenmesine olanak sağlar. Bu yöntem, kontrol ve mutant subklonların karşılaştırmalı analizinin aynı doku ortamında in vivo olarak yapAbildiği benzersizdir. Burada protokol ayrıntılı olarak açıklanmış ve gelişmekte olan serebral kortekste klonal analiz ve soy takibi için MADM'yi kullanmak için deneysel paradigmalar gösterilmiştir. Daha da önemlisi, bu protokol CreERT2 sürücüsü mevcut olduğu sürece, herhangi bir murine kök hücre niş MADM klonal analizi gerçekleştirmek için uyarlanabilir.
Giriş
Serebral korteks altı farklı tabakadan oluşan son derece organize bir yapıdır. Korteks nöronlar ve glia da dahil olmak üzere hücre tipleri çeşitli bir dizi içerir, fonksiyonel nöral devreler oluşturmak için etkileşim. Çoğu, hepsi değilse, kortikal uyarıcı projeksiyon nöronlar ve glia nöral kök hücrelerin ortak bir havuztüretilen (NSCs) radyal glial progenitors olarak bilinen (RGPs)1,2,3. RGP'ler erken embriyonik nöroepitelyumu oluşturan nöroepitelyal kök hücrelerden (NESCs) türetilmiştir. Farelerde embriyonik gün 9 (E9) olarak, NESCs RGPs4geçiş başlar. RGP soy ilerlemesi hassas zamansal ve mekansal düzenleme gerektirir, ve bu süreç engellendiğinde, megalencephaly gibi ciddi nörolojik bozukluklar, mikrosefali, lissencephaly, ya da şizofreni ve otizm gibi bozukluklar neden olabilir5,6. E10 anda, en RGPs simetrik proliferatif bölünmeler geçmesi, nöral progenitor havuzu bir genişleme ile sonuçlanan4,7. RGPs sonunda asimetrik olarak bölmek başlar, zamansal olarak tanımlanmış bir şekilde kortikal projeksiyon nöronlar üreten. Nörogenez ardışık dalgalar sayesinde, yenidoğan nöronlar derin tabakalar ve geç doğan nöronlar yüzeysel tabakalarda ikamet işgal erken doğan nöronlar ile kortikal lamina oluşturan kortikal plaka içine göç8,9,10. Klonsal ilişkili piramidal nöronlar çok az teğetsel dağılım ile korteksiçine radyal göç çünkü, kızı hücreleri bir sütun veya koni şeklinde bir yapı nöronal radyal birimolarakanılacaktır oluşturmak eğilimindedir4 ,11,12,13. E17 ile, embriyonik nörojenik genişleme farelerde tamamlanır14. RGP'ler de ependymal hücreleri ve glia bazı sınıflar üretebilir, astrositler ve oligodendrocytes1dahil,15,16,17,1818,19. RgPs potansiyeli hem nöronlar ve astrositler için ortaya çıkarmak için tüm kortikal bölgeler arasında tutarlı gibi görünüyor18, nörojenik RGP'lerin yaklaşık 1/6 ile de glia11üreten .
Şu anda, soyu boyunca bir kök hücrenin zamansal ilerlemesini düzenleyen genetik ve epigenetik faktörler çoğunlukla bilinmemektedir. Gen ekspresyonunun zamansal desenleri RGPs,20,21 ,22,,23,21,24'tesoy kararları üzerinde önemli bir etkiye sahip olabilir.23 Zamansal ve mekansal desenleme arasındaki bu sıkı örme ilişki kortikal alanlarda yetişkin nöronal tiplerin moleküler çeşitliliğe yol açar nasıl bilinmemektedir. Aynı şekilde, bireysel kök hücre potansiyeli ve hücresel çıkışının hücresel ve moleküler düzeyde nasıl modüle edilir önemli bir cevapsız sorudur. Gelecekteki çalışmalar umarım bu soruların bazılarını ele alacak ve sonuçta işlevsel kortikal devre oluşumu anlayışımızı genişletecektir.
Gelişimsel nörobiyoloji beyindeki hücrelerin birbirleriyle paylaştıkları soy ilişkisini anlamaya çalışıyor. Başlangıçta, çok az araştırma araçları bunun için mevcut, ve birçok erken çalışmalar Caenorhabditis elegans25gibi şeffaf organizmalarda bölünme desenleri görsel gözlemler dayanıyordu . Son yıllarda mevcut tekniklerin sayısı ve sofistike dramatik bir artış gördük13,26,27,28,29. CRISPR-Cas9 genom düzenleme sisteminin ortaya çıkması gelişen DNA barkodları27,,30getirerek hücre soy ilişkilerinin sentetik yeniden yapılanma sağlar. Barkodlama stratejilerinin iki yeni örnek belirli DNA barcode loci veya bir sitidin deaminaz nickaz Cas9 ile endojen interspersed tekrar bölgeleri 31 ,,32hedef erimiş CRISPR-Cas9 yönlendirir homing kılavuzu RNA kullanımı içerir.31 Bu teknolojiler, zaman içinde kademeli ve kademeli olarak benzersiz mutasyonlar biriken barkodların piyasaya sürülmesi yle son derece çok katlı yaklaşımlar sağlar. Genom düzenleme yaklaşımları son derece değerlidir çünkü bu barkodların ortak kalıtımına dayalı olarak herhangi iki hücre arasındaki ilişkinin geriye dönük analizine olanak sağlarlar. Ancak, tek tek hücrelerde barkodları okumak için, doku genellikle bozulmuş olması gerekir, ve bu nedenle bireysel bir atadan pozisyon, morfoloji ve mutlak hücre numaraları ile ilgili bilgiler kaybolur.
Kombinatoryal etiketleme paradigmaları mekansal bilgileri korumak ve prensipte de yakından lokalize hatta örtüşen klonlar arasında ayrım için izin33,34. Bir soy izleme yönteminin bilgilendirici olabilmesi için, bireysel ataları ve bunların atalarını seyrek ve silinmez bir şekilde etiketlemesi gerekir. Özellikle, Brainbow35 ve Konfeti36,37 yaklaşımlar tek bir lokus floresan proteinlerin bir arada ifade stokastik çok renkli Cre rekombinaz tabanlı muhabirler kullanın. In vivo elde edilebilir eşzamanlı renk kombinasyonları geniş sayıda kortikal RGP klonları ve astrositler34izleyerek bu güçlü bir araç yapmak. Floresan muhabirleri kodlayan transgenlerin kararlı genomik entegrasyonunu sağlayan transposon tabanlı sistemler ve kortikal ataların soy takibine izin veren sistemler de geliştirilmiştir33,38,39,40,41. Transposon tabanlı sistemler, muhabirin genoma entegre olması ve bu nedenle lineally ile ilgili kız hücreleri güvenilir bir şekilde etiketlemesi açısından ek bir avantaja sahiptir. Özellikle astrosit soyları izlemek için, star trackde dahil olmak üzere piggyBac transposases elektroporasyon içeren yöntemler bir dizi geliştirilmiştir , farklı floresan proteinleri kodlayan yapılar bir arada kullanır40,42. Başka bir yaklaşım, MAGIC işaretleri, transpozable transgenler olarak Brainbow vektörleri tanıttı. Bu başarıyla embriyonik nöral ve astrosit atalarının iz için kullanılmıştır34,43. Son zamanlarda, çift rekombinaz aracılı kaset değişimi (MADR) ile mozaik analizi, tam olarak tanımlanmış kromozomal loci44transgenik elementleri ifade eden mutant hücreleri koably etiket bulundu. Bu güçlü in vivo kombinatorial etiketleme teknikleri ata hücrelerinin soy dinamikleri içine çok sayıda anlayışlar sağlamıştır. Ancak, bu analizler sabit doku üzerinde yapılır, tanımlanmış bir gelişim aşamasında bireysel klonların bir anlık görüntü sağlayan. Zaman içinde tek klonların soy dinamitlerinde yapılan değişiklikleri gözlemleyebilmek için erişkin dentat giruslarında yapılana benzer kronik in vivo görüntüleme yöntemlerinin45olarak uygulanması gerekmektedir.
Çift belirteçleri ile Mozaik analizi (MADM) farelerde bireysel progenitor hücrelerinin in vivo soy izleme sağlayan güçlü bir çift renk etiketleme yöntemidir46,47. MADM etiketleme olaylarının oluşması için iki bileşen gereklidir: İlk olarak MADM kasetleri homolog kromozomlar üzerindeki özdeş loci'ye hedeflenmelidir. Kasetler iki şimerik floresan muhabir genden oluşur, eGFP (yeşil, [G]) ve tandem dimer Domates (kırmızı, tdT[T]). GT kaseti eGFP'nin N-terminusunu ve loxP sitesi içeren bir intron la ayrılan tdT'nin C-soninusunu içerir. TG kaseti ters, tdT'nin N-terminusu ve eGFP'nin C-terminusu ile ters olarak inşa edilmiştir. İkinci olarak, Cre cre rekombinazın hedeflenen MADM kasetlerini içeren aynı hücrede ifade edilmesi esastır. Creyokluğunda, cihimerik kasetler kodlama dizileri bozulduğu için işlevsel eGFP veya tdT ifade etmez. LoxP siteleri Cre aracılı interkromosomal rekombinasyon için hedef olarak hizmet, aynı anda her iki ifade kasetleri reconstitution sonuçlanan. Hücre döngüsünün G2 evresinde x segregasyon (G2-X) sırasında rekombinasyon gerçekleşirse, iki kız hücresi nin her biri iki floresan proteinden birini ifade eder. Tamoksifen (TM) kullanarak CreERT2 aktivitesinin zamansal düzenleme MADM klonların doğum tarihi ve onların soy bölünme desenleri kesin bilgi sağlar (Şekil 1A)29,46,47.
MADM potansiyel olarak sistematik olarak fare beyninde yüksek tek hücre çözünürlüğü ile tek tek klonları etiketleyebilir golgi boyama48 veya boya dolgu49gibi geleneksel ama nonspesifik ve zahmetli yöntemlere benzer . Sadece creerT2 sürüş organizatörü klonal MADM etiketleme hücre tipi özgüllüğünü belirler çünkü, MADM prensipte herhangi bir murin organ ve doku47boyunca klonal soy izleme için uygulanabilir47 ,50,51,52. Nitekim, çalışmalar zaten çeşitli dokulardan elde edilen klonlar soy ilişkileri ortaya çıkarmak için MADM kullanmış47,50,51,52,53,54,55,56,57,58,59. MADM deneysel paradigmalar kortikal projeksiyon nöronlar çalışma soy uygulanmıştır, glia, ve gelişmekte olan neokorteks doğum sonrası kök hücreler7,11,12,46,60,61,62,63,64,65. MADM ayrıca yetişkin dentat girus, talamus, serebellar granül hücreleri ve klonal düzeyde internöronlar hücre soy çalışması için kullanılmıştır (tam bir liste için Tablo 1 bakınız)47,53,54,56,57,,66.
MADM'nin benzersiz bir özelliği, distal mutasyonları genetik olarak bir MADM kasetine bağlayarak genetik bir mozaik oluşturabilme yeteneğidir(Şekil 1B ve Şekil 2). Bu, etiketli olmayan heterozigot bir ortamda bir floresan belirteç (Şekil 1B'detdT) ve diğerleriyle (Şekil 1B'deeGFP) homozigot mutant kardeşlerle etiketlenmiş yabani tip kız hücreleri ile sonuçlanır. MADM kontrol ve mutant subklonların karşılaştırmalı analizi vivo aynı doku ortamında yapılabilir benzersizdir. Başlangıçta, MADM kasetleri Rosa26 locus47içine hedef, ancak gen fonksiyonuMADM analizi lokus distal genler ile sınırlıydı. (En azından kısmen) bu sınırlamayı aşmak ve MADM tabanlı gen analizleri için olanakları genişletmek için, MADM kasetleri Chr. 751, Chr. 1146ve Chr. 1251sentromeres yakın knocked edildi. MADM kasetleri ile tüm 19 fare otozomhedefleme devam ediyor ve fonksiyonel genetik analiz ile birlikte gelişimsel soy ilişkilerinin incelenmesi için benzersiz bir platform sağlayarak, gelecekte hemen hemen her gen incelenmesi için izin verecektir.
Protokol
Fare protokolleri, IST Austria'daki kurumsal klinik öncesi çekirdek tesisi (PCF) ve iç etik komitesi tarafından gözden geçirilmiştir. Tüm ıslah ve deneyler, Avusturya ve AB hayvan yasalarına uygun olarak Avusturya Federal Bilim ve Araştırma Bakanlığı tarafından onaylanmış bir lisans altında gerçekleştirilmiştir.
1. MADM klonal analizi için deneysel farelerin üremesi
- Zamanlanmış deneysel MADM miatings (>P56; CD-1) öğleden sonra (17:00) ve vajinal fişler için kontrol edin devam sabah (8:00 AM). Fişin mevcut olduğu sabah 0.5 gün olarak sayılır. Deneysel fare miyetleme kurulumuna genel bakış için Şekil 2'ye bakın. CreERT2 aktivitesi nin TM indüksiyonu için zaman puanlarının deneysel soruları ele almak için uygun olduğundan emin olun.
NOT: Daha fazla bilgi için Şekil 3'e ve aşağıdaki temsilci sonuçlara bakın. - Doğum sonrası örnekleme için, paralel olarak koruyucu anneler oluşturmak için üreme kurmak.
NOT: Bunlar deneysel üremelerin kurulmasından 1−2 gün öncesine kadar başlatılmalıdır.
2. MADM farelerinde TM indüksiyonu
- 15 mL veya 50 mL konik santrifüj tüpteki mısır yağına eriterek ve oda sıcaklığında ~4 saat (RT) için sallanan bir platforma yerleştirerek 20 mg/mL TM çalışma çözeltisi hazırlayın ve TM'nin tamamen çözülmesini sağlar. 4 °C'de alüminyum folyo ile kaplı çalışma çözümünü saklayın ve 2 hafta içinde kullanın.
- MADM rekombinasyon olaylarını indüklemek için, 1 mL tüberkülin şırıngası ve 25 G iğneile zamanlanmış hamile barajına tek bir TM intraperitoneally (IP) enjeksiyonu gerçekleştirin. Kortikal nörogenezin evresine bağlı olarak, 1−2 mg/gebe barajıdozunda E10−E15 arasında TM enjekte edin. Erken zaman dilimleri için (yani, E10) gebelik sırasında komplikasyonları önlemek için en fazla 1 mg/gebe barajı (25 mg/kg) kullanın11. E11-E15 arasındaki zaman dilimleri için 2 mg/gebe barajı (50 mg/kg)7kullanın.
NOT: Alternatif olarak, TM geç gebelikler için oral gavaj ile uygulanabilir. - MADM klonal analizi nin doğum sonrası zaman dilimlerine kadar, E18−E19'da sezaryenle canlı embriyoları kurtarın ve sonra bir koruyucu anneyle yavru yetiştirin.
NOT: Gebe kadının sağlık durumuna bağlı olarak sezaryen yapılması gerekli olmayabilir, ancak tm tedavisi gören orijinal annenin emzirme sorunu olabileceğinden, koruyucu anne ile yavru yetiştirmek hala gereklidir. - Sezaryenle canlı embriyoları kurtarmak veya analiz için embriyonik zaman puanlarını almak için, rahim ağzı çıkığı ile gebe barajı kurban etmek.
- Bir supine pozisyonda hayvan yerleştirin ve% 70 etanol ile kürk dezenfekte. Cerrahi forceps ve makas kullanarak rahim üzerinde alt karın deride küçük bir kesi olun. Periton ortaya çıkarmak için kaslar ve karın kas duvarı ile ikinci bir kesi olun.
- Makasla çevredeki dokulardan ayrılarak rahmi çıkarın. Her biri amndan ayrı ayrı çıkarılana kadar embriyo nun sağkalım oranını artırmak için ılık su yla dolu bir eldivene sağlam rahim transferi yapın.
- Embriyoları serbest bırakmak için rahim duvarlarını dikkatlice açmak için ince uçlu makas ve parmakkullanın. Geniş kan kaybını önlemek için göbek kordonlarını vücuda çok yakın kesmeyin. Eğer embriyolar analiz için kullanılacaksa, adım 3.9'a geçin. Eğer yavrular beslenecekse, 2.8.
- Eğer evlatlık vermek gerekiyorsa, yavruları koruyucu anneye aktarmadan önce temizleyin. Yavruları temizlerken, nefes almak için zaman zaman göğsüne hafifçe bastırın. Hayatta kalma oranını artırmak için ılık su ile dolu ikinci bir eldiven geri yerleştirin.
NOT: Kalan amniyonu ve/veya plasentayı kağıt havlu ile nazikçe çıkarmak önemlidir. - Yavruları koruyucu anneye aktarmadan önce, koruyucu anneyi kafesinden çıkarın, orijinal yavruları çıkarın ve deneysel yavruları değiştirin. Üvey anneyi kafesine geri getir.
NOT: Kabul oranlarını artırmak için ek öneriler için tartışmaya bakın. - Genotipleme gerekiyorsa, P6−P8 arasında ton veya kuyruk biyopsisi toplayın.
NOT: Bu adımı yalnızca hayvan deney lisansları bu uygulamayı onaylarsa gerçekleştirin.
3. Beyindeki MADM klonları için doku hazırlığı
NOT: Doğum sonrası doku (≥P4) içeren deneyler için adım 3.1'e devam edin. Embriyonik zaman dilimleri ve erken postnatal (P0−P3) için 3.9 adımdevam edin.
- Deneysel MADM hayvanını bir KEtamin/ksilazin/asetpromazin çözeltisinin IP enjeksiyonuyla (sırasıyla 65 mg, 13 mg ve 2 mg/kg vücut ağırlığı) anesteletin ve farenin pençeyi çimdikleyerek tepkisiz olduğunu doğrulayın.
NOT: Analiz için hem erkek hem de dişi MADM fareler (CD-1 arka planı) kullanılmaktadır. Genotipleme gerekiyorsa, bu noktada kulak biyopsisi toplayın. - Anestezili hayvanı perfüzyon ameliyat tepsisi üzerinde supine pozisyonunda yerleştirin ve %70 etanol ile kürkü dezenfekte edin. Ameliyata başlamak için, dikkatle cildin dış tabakası ve daha sonra kas tabakası ile ikinci bir kesi ile makas ve cerrahi forceps ile bir kesi yapmak. Göğüs kafesinin ucunu kaldırın ve yanlarda bağ dokusunu kesin, karaciğeri kesmemek için ekstra dikkatli olun. Göğüs boşluğu görünür olacak.
- Diyaframı kopar ve kalbi ortaya çıkarmak için kaldırın. Dikkatle göğüs kafesi kırpın ve kalp ortaya çıkarmak için cerrahi tepsiye pin. Yavrular için göğüs kafesini tamamen çıkarın.
- Alt sol ventrikül (soluk doku) içine fosfat tamponlu salin (PBS) ile bir iğne yerleştirin. Küçük iris makas kullanarak sağ atriyumun arka ucuna bir kesi yapmak (koyu kırmızı doku) kan drenaj için.
- PBS ile perfüzyon yapın ve hemen ardından PBS'de hazırlanan taze, buz gibi %4 paraformaldehit (PFA) hazırlayın. Yavrular için (P4−P10) perfüzyon yapmak için şırınga kullanın. Bir şırıngayı 10 mL PBS ve diğerini 10 mL%4 PFA ile doldurun. Şırıngalardaki tüm hava kabarcıklarının çıkarıldığından emin olun. Yaşlı hayvanlar için, peristaltik pompa kullanın.
- PBS ile perfüzyona başlayın (puplarda 2−4 mL/dk'da 10 mL; peristaltik pompa kullanan yetişkinler için 4−6 mL/dk'da 20 mL). İğne doğru konumlandırılırsa karaciğer berraklaşır ve soluk sarı olur.
- Tamamlandıktan sonra, iğneyi yavrulardan çıkarın ve PFA içeren iğneyi aynı deliğe yerleştirin. Yetişkinler için, buz gibi PFA ile PBS çözeltisi alışverişi önce peristaltik pompa durdurmak, alım tüpü kabarcıkları önlemek için emin olun. Peristaltik pompa kullanan yetişkinler için PFA ile devam edin (yavrularda 2−4 mL/dk'da 10 mL; peristaltik pompa kullanan yetişkinler için 4−6 mL/dk'da 30 mL).
- Perfüzyon tamamlandığında, farenin kafasını kes ve dikkatli diseksiyon yoluyla beyni çıkarın. Beyni %4 PfA'ya aktarın. 15 mL konik santrifüj tüpte beyin hacimlerinin en az 5 katını (yani~5−10 mL PFA) kullanın ve dokuların tam fiksasyonunu sağlamak için postperfüzyon fiksasyonu için gece boyunca 4 °C'de kuluçkaya yatırın. Adım 3.10'a devam edin.
- Embriyonik doku ve erken doğum sonrası doku (yani, P0−P3), sezaryen yaptıktan sonra, makasla embriyoların kafasını koparın. Genotipleme gerekiyorsa, bu noktada embriyonun kuyruğunu toplayın. Hemen beyni kesip 2−3 mL ve %4 PFA/well içeren 12 kuyu plakasına aktarın. Postfixasyon için gece boyunca 4 °C'de kuluçkaya yatırın.
- Ertesi sabah PBS'nin 10 mL (yetişkin) veya 2−3 mL (embriyo) ile PfA değişimi ve RT.'de 15 dakika boyunca 3x yıkamayı tekrarlayın.
- Bir katıştırma kalıp optimal kesme sıcaklığı (OCT) bileşik beyin gömmek, ya koronal veya sagital kesit için beyin yönlendirmek için dikkat. Katıştırma kalıbını, OCT tamamen opak hale gelene kadar (~10−15 dk) kuru buzüzerine yerleştirerek dondurun. Daha fazla kullanım anına kadar -80 °C'de dokuyu saklayın.
4. MadM dokusunun immünohistokimya için hazırlanması
- Doku bloğunu diske OCT halkası uygulayarak ve donmaya başladığında bloğu doğrudan OCT'ye yerleştirerek kriyostattaki numune diskine takın. Bloğun istenilen kesme düzlemi için doğru şekilde yönlendirilmesini sağlayın.
NOT: Burada kortikal MADM klonları araştırmak için koronal kesit ayrıntılı olarak açıklanmıştır. - Kriyostattaki blok sıcaklığını -20 °C'ye, bıçak sıcaklığını da -21 °C'ye ayarlayın.
- Numune diskini numune tutucuya monte ederek doku bloğunun oda sıcaklığına uyum sağlamasına izin verin ve kesite başlamadan önce ~5 dk kriyostatta bırakın.
- Kalın kesitlerde trim bloğu (45−60 μm) doku bölgesine ulaşınana kadar.
- Korteksin kenarı açıkça görülebildiğinde, kesiti durdurun ve bıçağı kilitleyin. Bloğu kesmeden önce bıçağın korundığından emin olun.
- Bir bıçakla dokuyu çevreleyen fazla OCT'yi kırpın ve beynin her tarafında ~1−2 mm EKIM bırakarak.
- Daha sonra bloğu korteksin lateral kenarlarından birinin aşağı ya da diğerinin yukarı doğru yönlendirilmesi (yani korteksin en rostral kenarı sağa doğru işaret edilebilsin) yönlendirin.
- Yetişkin klonlar için 45 μm kalınlığında ve embriyonik klonlar için 30 m kalınlığında kesitbaşlar. Her bölümü ayrı ayrı gerçekleştirin ve bıçağın altındaki alanı bloğu kırpırken kalan enkazlardan temizlemek için küçük bir fırça kullanın.
NOT: Bu yapılmazsa ve bir bölüm düşerse, dilimlerin doğru sırasını belirlemek zor olabilir. - Bölümler kıvrılmaya başlarsa, bloğun kenarlarını kırpın ve/veya cam antiroll plakasını dikkatlice ayarlayın.
- Embriyonik klon analizi için, doğrudan buzlu bir slayt bölümleri monte. Doğrudan adım 5.6'ya geçmeden önce 37 °C'de Bir ısıtma plakası üzerinde kurulayın.
NOT: Bir slayta birkaç bölüm eklenebilir, ancak sıralı sıranın korundığından emin olun. - Yetişkin klonları toplamak için, 1 mL PBS/kuyu içeren 24 kuyu plakası hazırlayın (genellikle beyin başına 5−6 plaka). İlk kuyudan başlayarak, soğuk çerkesler ile bölümleme sırasına göre PBS'de tek tek seri bölümleri toplarlar.
NOT: Yüzen kesit yöntemi, yetişkin dokular için hiçbir bölümün kaçırılmaması ve monte edilmiş bölümlerin kırışıklık içermemesini sağlamak için benimsenmiştir. - Neokorteksin ucuna ulaşıldıktan sonra kesit yapmayı durdurun.
- Yetişkin klonlar için, kayan bölümleri montaj devam edin.
NOT: Kesitler PBS'de 4 °C'de 24 saate kadar tutulabilir.
5. Görüntüleme için erişkin dokunun montajı
NOT: Aşağıdaki araçlar gereklidir: küçük boya fırçası, Petri kabı, PBS %0.5 Ara (PBS-T), yapışma slaytları(Malzeme Tablosu),montaj ortamı(Malzeme Tablosu),kapaklar ve çerkezlikler.
- Petri kabını PBS-T ile doldurun.
NOT: Deterjan montaj işlemine yardımcı olmak için kullanılır. Deterjanlara duyarlı ek antijenler için boyama (yani, glikoproteinler) gerekliise, En iyisi Tween ilavesini atlamaktır. - PBS-T'ye neredeyse etiketle kaplanmış olacak şekilde bir yapışma slaytı yerleştirin.
- İlk bölümü PBS-T'ye aktarın.
- Küçük bir boya fırçası kullanarak, slayt üzerine bölüm manevra ve kesme sırasını korumak için düzenlemek. Diğer tüm bölümlerde aynı şekilde ilerleyin.
- Tüm bölümler yerleştirildikten sonra, slaydın (~12−16 bölüm/slayt) koyu bir slayt odasına yerleştirin. Bölümlerin tamamen kurumasını sağlamak için kapağı hafifçe kaldırın (~10−20 dk), sonraki adımlarda yapışmalarını bekleyin.
- Ek antijenler için immünohistokimya yapıyorsanız, doğrudan bölüm 6 veya 7'ye ilerleyin.
NOT: Embriyonik zaman dilimleri için en az GFP ve tdT için immünboyama adımları nın yapılması gerekmektedir (bölüm 6). Yetişkin klonlar için bu sadece paralel ek antijenler için boyama (bölüm 6 ve 7) gereklidir. - Rehydrate ve yıkama bölümleri 1x 1x PBS ile 5 dakika kalıntı PBS-T kaldırmak için. 1x PBS (1 μg/mL) seyreltilmiş ~1 mL 4',6-diamidino-2-fenilindole (DAPI) slayt uygulayın, tüm bölümleri kaplı ve 15 dakika kuluçka sağlanması.
- DAPI'yi dikkatlice çıkarın ve 1x 1x PBS ile 5 dk. Fazla PBS'yi çıkarın ve 110 μL montaj ortamına gömmeden önce ~1−2 dk kurulayın. 24 x 60 mm kapaklı kapatın ve görüntülemeden önce en az 3 saat kurulayın.
6. Sadece GFP ve tdT için immünboyama
NOT: Bu bölüm embriyonik klonlar için gereklidir.
- Yatay olarak, nemlendirilmiş bir slayt kuluçka odasına kaydırışyerleştirin. Gerekli arabellek miktarını en aza indirmek için bir balmumu işaretçisi ile slayt sınırları işaretleyin.
- 1x PBS ile rehydrate bölümleri. Boyama kalitesini artırmak için, taze kesitli doku ile çalışın.
- Slayt başına 250−400 μL blokaj tamponu (%0.5 Triton X-100, 1x PBS'de %2−3 normal eşek serumu) ekleyerek tüm bölümlerin kaplanmasını sağlar. 1 saat kuluçka.
NOT: Bazı antijenler deterjanlara karşı diğerlerinden daha duyarlı olduğundan, deterjan konsantrasyonu (Triton X-100 veya Tween-20) kullanılan ek birincil antikorlara bağlı olarak değişir. - Engelleme arabelleği kaldırın ve slayt (300−400 μL/slide) engelleme arabelleği birincil antikorlar ekleyin.
NOT: Anti-GFP/anti-tdT (MADM) için standart bir primer antikor reaksiyonu örneği tavuk anti-GFP (1:500) ve tavşan anti-RFP (1:500) kullanabilirsiniz. - Bir gecede 4 °C'de birincil antikorlarla kuluçkaya yatırın.
NOT: Slaytlar tüm bölümleri kaplayan tampon ile mükemmel yatay olarak kuluçkaya yatırılmalıdır. Aksi takdirde, düzensiz veya kötü boyama neden olabilir. - Ertesi sabah, birincil antikorları olan engelleme tamponunun slayttaki tüm bölümleri kapsadığını doğrulayın. Değilse, rt de 3−4 saat için kuluçka adımını tekrarlayın.
- Birincil antikorları çıkarın ve RT'de 10 dakika boyunca 1x PBS ile 4x yıkayın.
- Kaydırma tamponu engelleme seyreltilmiş ikincil antikorlar ekleyin (300−400 μL/slayt): Alexa Fluor 488 anti-tavuk IgG (1:500) ve Cy3 anti-tavşan IgG (1:500).
- 2 saat boyunca RT'de kuluçka yada takın.
- İkincil antikorları çıkarın ve 10 dakika boyunca 1x PBS ile 2x yıkayın.
- 15 dakika pbs (1:5.000) seyreltilmiş DAPI ile kuluçka.
- 10 dakika boyunca 1x PBS ile 1x yıkama bölümleri.
- 110 μL montaj ortamına gömmeden önce ~1−2 dk boyunca fazla PBS'yi çıkarın ve kurulayın.
- 24 x 60 mm kapaklı kapatın ve görüntülemeden önce en az 3 saat kurulayın. En iyi sinyali sağlamak için immünohistokimyayaptıktan sonra 1−2 hafta içinde görüntü kaydırır.
7. GFP, tdT ve ek antijenler için immünboyama
- 6.1−6.3 adımlarını gerçekleştirin.
- Engelleme arabelleği kaldırın ve slayt (300−400 μL/slide) engelleme arabelleği birincil antikorlar ekleyin.
NOT: Üç veya daha fazla antijen (yani, GFP, tdT ve ilgi proteini) boyama ve ilgi proteini için antikor tavşan yükseltildi, bu anti-tdT kullanılması tavsiye edilir (keçi) birincil antikor 1:500 bir seyreltme. Alternatif tdT boyama ile üç antijenler için birincil antikor reaksiyonu bir örnek tavuk anti-GFP (1:500), keçi anti-tdT (1:500) ve ilgi proteinkarşı antikor kullanabilirsiniz (yani, tavşan). - 6.5−6.7 adımlarını gerçekleştirin.
- Kaydırma (300−400 μL/slide) tampon engelleme seyreltilmiş ikincil bir antikor karışımı ekleyin: Alexa Fluor 488 anti-tavuk IgG (1:500), Cy3 anti-keçi IgG (1:500) ve Alexa Fluor 647 anti-tavşan IgG (1:500).
- 6.9−6.14 adımlarını gerçekleştirin.
8. CONfocal görüntü edinimi ve MADM klonların nicelleştirilmesi
- Kortekste klonları ve konumlarını içeren beyin bölümlerini belirleyin ve belgelayın.
NOT: Bir klonun kapsadığı bölümlerin sayısı, klonun ne zaman indüklediğine, CreERT2 sürücüsüne ve analiz zamanına bağlı olarak değişir. Bu adım konfokal mikroskop veya epifloresan mikroskobu nda yapılabilir. - Ters bir confocal mikroskop kullanarak, doğru lazer çizgileri ve filtreleri seçerek ve yapılandırarak başlayın. MADM beyinleri için SıRASıYLa DAPI, GFP ve tdT'yi seçin (uyarma: sırasıyla 358 nm, 488 nm ve 554 nm; tepe emisyon: 461 nm, 507 nm ve 581 nm). İğne deliğinin optimum görüntüleme kalitesi için 1 havadar üniteye ayarlandığından emin olun.
- Konfokal özel ayarlar için, 20x nesnel ve 1x zoom ile görüntü klonları. Nicelemelerde kullanılacak görüntüler için, ortalama değeri olmayan 1,52−2,06 μs (görüntü edinme yazılımındaki 7−8 değeri) tarama hızı pikseli değeri kullanın. Lazer yoğunluğunu ve her kanal için kazanç ayarlarını uygun şekilde ayarlayın.
NOT: Gerekli görüntü kalitesine bağlı olarak, tarama hızı ve ortalama ayarları değişebilir. - Klon açıkça tanımlandıktan sonra, klondaki tüm ilgili bölümleri kapsayacak şekilde görüntüleme karoları düzenleyin. Z yığınını, klondaki tüm MADM etiketli hücrelerin 1,5 μm/z-stack dilimi aralığında yakalanması için ayarlayın. Klonu görüntülerken korteksin tüm genişliğinin yakalanması için karo bölgesini ayarlayın (yani pial yüzeyden korpus callosum'a kadar).
- Bir klon içinde hücreleri olmayan herhangi bir bölümün hala 3D yeniden yapılanma ve hücre uzamsal bilgilerindoğru yorumlanması amacıyla görüntülanmasını sağlayarak, art arda birden fazla bölüme yayılan görüntü tek tek klonlar.
- Bir MADM klonu hücrelerini içeren her bölümü rostral'den korteksin kaudal ucuna kadar sırayla analiz edin. Morfolojisi ve/veya marker boyamalarına göre bireysel nöronları ve glia'ları ayırt edin. Nükleer boyama (DAPI) tarafından tanımlanan ilgili katman sınırlarına göre konumsal bilgileri paralel olarak kaydedin.
NOT: Embriyonik analiz için temsili sonuçlar için Şekil 4'e ve yetişkin analizi için temsili sonuçlar için Şekil 5'e bakınız.
9. Klonların Seri 3D rekonstrüksiyonu
NOT: Seri beyin bölümleri üzerinden görüntülenen tek tek klonların 3Boyutlu rekonstrüksiyonu görsel görüntülemenin yanı sıra 3D klonal mimarilerin analizi için de yararlıdır ve aşağıdaki adımlara göre yapılabilir.
- Görüntü edinme yazılımı kullanılarak edinme parametrelerine dayalı dikiş ve sigorta confocal karo görüntüleri. .czi dosyasını açın ve zen yazılımındaki (Zeiss) İşlem sekmesi altında Dikiş yöntemini çalıştırın.
- Dikişli görüntü yığınlarını TIFF formatında tek tek z düzlemleri olarak dışa aktarın. Dikişli .czi dosyasını açın ve ardından İşlem sekmesi altında Görüntü Dışa Aktarma yöntemini çalıştırın. Çok kanallı görüntüler için, sonraki görüntü işleme için Kırmızı/Yeşil/Mavi görüntüleri olarak dışa aktarın.
- Bir klonun her seri beyin bölümü için 9.1 ve 9.2 adımlarını tekrarlayın.
NOT: Doğru 3D rekonstrüksiyon için, etiketli hücreleri olmayanlar da dahil olmak üzere bir klon içindeki tüm beyin bölümleri de işlenmelidir. - ImageJ/Fiji67,,68gibi açık kaynak görüntü işleme yazılımını kullanarak en kaudal z-düzleminden en kaudal z-düzlemine kadar tek bir yığın halinde tek bir yığın halinde tek bir yığın halinde görüntü birleştirir.
NOT: Bu noktada her beyin bölümünün kenarlarındaki boş görüntüler çıkarılmalıdır. - Gerekirse, 9.5.1−9.5.5 adımlarını izleyerek "MultiStackReg" adlı bir ImageJ eklentisi kullanarak yanlış hizalama için 9.4 adımından elde edilen görüntü yığınını düzeltin. Görüntü hizalaması gerekli değilse, adım 9.6'ya geçin.
NOT: Bu eklenti, kanalın görüntü hizalanmasını en yüksek kontrasta (genellikle DAPI) gerçekleştirir ve ardından kaydedilen dönüşümü diğer kanallara uygular ve böylece çok kanallı yığınların güvenilir görüntü hizalanmasına olanak sağlar. "TurboReg" adlı bir yardımcı eklenti önceden yüklenmelidir.- ImageJ'de "MultiStackReg" ve "TurboReg" eklentilerini yükleyin.
- 9.4 adımdan elde edilen klon görüntülerinin görüntü yığınını hizalamak için açın. Görüntü sekmesi altında Renk seçeneği içinde kanalları DAPI (mavi), GFP (yeşil) ve tdT (kırmızı) olarak bölün.
- Run "MultiStackReg" eklentisi tarafından DAPI kanal hizalamak için "Rigid Body" dönüşüm ve dönüşüm dosyası kaydedin.
- Kaydedilen dönüşüm dosyasını "MultiStackReg" kullanarak diğer iki kanala uygulayın.
- Hizalanmış üç kanalı birleştirin ve hizalanmış yığını kaydedin.
- ImageJ'deki klonu yönlendirmek için 9.4.adımdan (veya hizalamadan sonra 9.5.5 adımdan) elde edilen klon görüntülerini üstteki pial yüzeyle dikey bir yönde ve alttaki korpus callosum ile döndürün. Gerekirse xy düzleminde kırpma.
- Hem nitel sunum hem de nicel analiz için maksimum z-projeksiyon görüntüsü (adım 9.8) oluşturun veya klonun 3B işlemesini (adım 9.9) gerçekleştirin.
- ImageJ'de, 9.6 adımdan görüntü yığınını açın ve projeksiyon türü Max yoğunluğunasahip Z projeksiyon seçeneğini seçin. Bu, aynı düzlemde yansıtılan tüm klonun görüntüsünü oluşturur.
- ImageJ'de, 9.6 adımdan görüntü yığınını açın ve döndürülebilen klonun 3B görselleştirmesini oluşturmak için 3B Project z işlevini seçin.
NOT: Bu adımda, görüntü edinimi sırasında tek tek z yığınlarının kalınlığına eşdeğer doğru dilim aralığını giriş yapmak önemlidir. Enterpolasyon aracı dilimler arasındaki boşlukları kaldırmak için kullanılmalıdır.
Sonuçlar
MADM, g2-X kromozom uyrum olayları üzerine iki floresan proteinden birini ifade eden iki kız hücresi ile fonksiyonel yeşil ve kırmızı floresan proteinlerin yeniden yapılandırılmasıyla sonuçlanır(Şekil 1A). MADM olayları iki soyundan gelen iki soyların kalıcı ve belirgin bir şekilde etiketlemeile sonuçlanmasıyla sonuçlandığı için, yeşil ve kırmızı kız hücre soylarının (subklonlar) ölçülebilir değerlendirmesi yapılabilir. Orijinal atanın bölme deseni (örn. simetrik karşı asimetrik) ve potansiyeli (örn. soyundan gelen inanca sayısı) gibi değişkenler belirlenebilir. Orijinal progenitor hücrenin TM indüksiyonu sırasında simetrik proliferatif bölünmeler mi yoksa asimetrik nörojenik bölünmeler mi geçirdiğini geriye dönük olarak belirlerken, floresan olarak etiketlenmiş her bir subklonun ölçülmesi bilgilendiricidir. Önceki çalışmalarda gruplu Emx1-CreERT2 veya Nestin-CreERT2 iki geniş sınıflar7içine kortekste uyarıcı projeksiyon klonları elde edilen,11,46. İlk, "simetrik proliferatif klonlar" olarak adlandırılır, nöronların önemli sayıda ortalama oluşur, her biri dört veya daha fazla nöron içeren hem yeşil hem de kırmızı subklonlar ile. İkinci grup, "asimetrik klonlar" "azınlık" subklon az üç nöron ve "çoğunluk" subklon, dört veya daha fazla11içeren klonlar bir sınıf tanımlar. Bu tanımlar kortikal RGP'lere özgüdir ve diğer beyin bölgeleri ve dokular için tekrar gözden alınması gerekebilir. Kortikal klonların her iki sınıf için, döl yüzeysel ve derin tabakalar boyunca dağıtılacaktır.
MADM klonal çalışmaları tasarlarken göz önünde bulundurulması gereken bir takım hususlar vardır. MADM olaylarının TM'nin yönetimi tarafından indüklenme zamanı önemli bir husustur (Şekil 3). Kortikal uyarıcı projeksiyon nöron MADM klonları için (yani, Emx1-CreERT2 veya Nestin-CreERT2kullanarak) E10, hemen hemen tüm RGP'ler hala simetrik bölünmeler geçiyordu11. Bu nedenle, TM ile E10 indüksiyon proliferatif RGP amplifikasyon birden fazla tur yakalanan ve yüksek nöron numaraları ile klonlar sonuçlandı. Ancak, E10'daki RGP sayısı genellikle küçüktü ve bu nedenle TM yönetimi çok az MADM olayı oluşturdu (bazen beyin başına birden az). RGP'lerin çoğu E12 civarında simetrik nörojenik bölünmelere geçti. Kesinlikle asimetrik nörojenik klonları hedeflemek için, E12 veya daha sonra indüklemek en iyisiydi (Şekil 3). TM indüksiyonu ile korteksteki MADM rekombinasyon olaylarının gözlemlenme süresi 24 h.'den az olması eğilimindeydi. Ayrıca iki nedenden dolayı en az TM dozu tutmak için önemlidir. İlk olarak, MADM rekombinasyon oranı artarsa, birden fazla indükleme olasılığı, belki de örtüşen, klonlar daha yüksektir. İkinci olarak, çok fazla TM teslim edilirse, kürtaj oranı artar, embriyo reabsorbsiyon, ve daha küçük çöp boyutları görülebilir. E10'da TM enjeksiyonları yapıldığında tüm gebe barajların yaklaşık yarısında kürtaj gözlendi. Bu frekans E11'den itibaren azalmış ve gebe barajların yaklaşık 1/3'üne düşmüştür. Önceki MADM çalışmalarında kullanılan TM dozlarının, indüksiyon sürelerinin ve CreERT2 sürücülerinin bir özeti için Tablo 1'ebakın. TM yokluğunda Muhabir aktivitesi bazı TM-indüklenebilir CreERT2 sürücüleri ile gözlendi69. Nestin-CreERT2 sürücülerinin Emx1-CreERT2'si ile TM yokluğunda ektopik ekspresyon veya MADM rekombinasyon olayları gözlenmedi. Bunun nedeni kısmen TM aracılı kromozomtrans-rekombinasyonlarının cis-rekombinasyonlara göre yaklaşık 1:1.000 ile 1:10.000 arasında daha düşük frekansta meydana gelmesi nden kaynaklanmaktadır ve ektopik MADM etiketleme olasılığını azaltır.
MADM klonal analiz deneyi planlarken göz önünde bulundurulması gereken bir diğer faktör de çalışmanın süresidir. TM indüksiyonu ile deney analiz edildiğinde (A) (zaman penceresi) arasındaki sürenin uzunluğunun değişmesi, zaman içinde kök hücre dinamiklerini gösterir64. Kısa embriyonik zaman pencereleri (yani, TM/E11−A/E13; TM/E11−A/E16) embriyonik nörogenezin dinamiklerini yakalamış(Şekil 4). İki veya daha fazla zaman penceresinden klonlar karşılaştırarak üretilen hücrelerin sayısı ve nasıl nöron dağılımı soy ilerlemesi farklı aşamalarında değişir nasıl kantitatif anlayış sağlar64. Bireysel klonların tüm potansiyelini yakalamak için, doğum sonrası veya yetişkin zaman noktaları7,11,,12içine analiz zaman penceresi uzatmak için gereklidir. Embriyoda indüklenen ve erişkin olarak analiz edilen neokortikal klonların örnekleri Şekil 5'tegösterilmiştir. Dikkat, kortikal nörogenez çoğunlukla tamamlanır ve gliogenez E17 artar. Yaklaşık 1/6 nörojenik RGP de astrositler ve / veya oligodendrocytes11oluşturmak için devam .
Simetrik klonlar RGP'ler bir veya daha fazla proliferatif bölünme11tur geçmesi oluşur. E10−E12 arasında indüklenen RGP klonları ortalama boyutu daha büyüktü ve son nöron dağılımının daha fazla uzamsal özelliği ni sağladılar (Şekil 4A-C). Derin ve yüzeysel katmanlar boyunca nispeten eşit olarak dağıtılan nöronlar ile klonlar bir "silindir" şekil aldı süre nöronlar daha derin tabakalar daha yüzeysel tabakalar dağılmış klonlar bir "koni" şekil11geliştirdi . Bir klonun mekansal ve morfolojik bilgilerini tam olarak yakalamak için, her klonu ardışık görüntüler kullanarak hesaplamalı olarak yeniden yapılandırmak gerekiyordu. Klonal dağılım ölçmek için, bir klonun yüzeysel tabakalarında (LII−VI) maksimal lateral dağılım (tüm boyutlarda ölçülür) derin tabakalarda nöron dağılımıyla karşılaştırıldı (LV/LIV). Bu oran (dağılım üst:dağılım alt) genel klon şekli ölçülebilir bir okuma sağladı.
Asimetrik klonlar, azınlık subklonunüç veya daha az olduğu, tek bir RGP nöronal çıkış içine fikir sağlanan (Şekil 4D-F ve Şekil 5A-F)7,11,12. Emx1-CreERT2 veya Nestin-CreERT2(Şekil 5G)7,11,12kullanılarak indüklenen klon başına yaklaşık yedi uyarıcı projeksiyon nöron ortalaması ile, çoğunluk popülasyonu (büyük subklon) kırmızı veya yeşil olarak etiketlenebilir.12 MADM klonundaki toplam hücre sayısı, büyük alt klondaki nöronların yüzeysel ve derin tabakalar arasında dağılımı analiz edilerek daha fazla incelenebilir. Azınlık popülasyonu (küçük subklon) karşılıklı renk ile etiketlendi ve klon başına ortalama 1−2 hücre(Şekil 5H)idi. Ortalama 8−9 nöron olan toplam "birim boyut", küçük ve büyük subklonları bir araya getirerek hesaplanabilir (Şekil 5I)7,11,12. Bu RGPs nöronal çıkışı son derece öngörülebilir iken, klonal heterojenlik bir dereceye kadar olduğunu unutmayınönemlidir 12,70.
MADM kasetine mutasyon distalinin getirilmesi genetik mozaiklerin oluşmasını sağlayarak kök hücre soyundan ilerlemenin moleküler düzenleyicilerini incelemek için benzersiz bir yöntem sağlar. Bu nedenle MADM, bir genin hücre özerk işlevini incelemek için benzersiz bir deneysel platform sağlar (örn. mikrosefali veya makrosefali ile ilişkisi). MADM genetik mozaisinde indüklenen klonları kontrol MADM'de indüklenen klonlarla karşılaştırarak, nöron sayılarında ve dağılımındaki değişikliklerin son derece nicel bir okuması oluşturulabilir. Önceki MADM tabanlı çalışmalar, Otx1'in mikrosefali oluşumundaki hücre otonom işlevini klonal düzeyde ölçtü (temsili bir örnek için Şekil 6A-E'ye bakınız)11. Başka bir çalışmada, MADM klonal analiz Ndel1 hücre özerk projeksiyon nöron numaraları düzenleyen olmadığını gösterdi, ama bunun yerine yeni doğan nöronların yeteneği girmek veya kortikal plaka içinde göç, hangi daha sonra yetişkin korteks oluşturur46. Bu çalışmalar, kortikal gelişimi düzenleyen genlerin hücre özerk fonksiyonlarını incelerken MADM klonal analizinin son derece nicel doğasını göstermiştir. Şu anda literatürde madm kullanarak klonal düzeyde makrosefali ile ilgili genleri incelemek için örnek bulunmamaktadır. Ancak, genel olarak kortikal boyutun kontrolü ile ilgili genlerin gelecekteki çalışmalarda analizi moleküler ve hücresel düzeyde son derece arzu edilen anlayışlar sağlayabilir.

Şekil 1: Tek kök hücre düzeyinde soy izleme ve klonal analiz için MADM prensibi. (A) MADM ile soy izleme ve klonal analiz yapmak için iki bileşenin bulunması gerekir. İlk olarak MADM kasetleri homolog kromozomlar üzerinde özdeş lokuslara hedeflenmelidir. Kasetler iki şimerik floresan muhabir genden oluşur, eGFP (yeşil, [G]) ve tandem dimer Domates (kırmızı, tdT[T]). GT kaseti eGFP'nin N-terminusunu ve loxP sitesi içeren bir intron la ayrılan tdT'nin C-soninusunu içerir. TG kaseti ters, tdT'nin N-terminusu ve eGFP'nin C-terminusu ile ters olarak inşa edilmiştir. İkinci olarak, Cre rekombinaz ifadesi hedeflenen MADM kasetleri içeren hücrede meydana gelmelidir. LoxP siteleri Cre aracılı interkromosomal rekombinasyon için bir hedef olarak hizmet, aynı anda her iki ifade kasetleri reconstitution sonuçlanan. Hücre döngüsünün G2 evresinde x segregasyon (G2-X) sırasında rekombinasyon oluşursa, iki kız hücre iki floresan proteinden birini ifade eder. (B) TEK bir klon düzeyinde genetik mozaik analizi için MADM prensibi. Mutant aleller (nokta mutasyonları, silmeler, eklemeler, loxP-kanatlı koşullu aleller Şekil 1B'detasvir edildiği gibi, vb.) meiyotik rekombinasyon yoluyla TG-MADM kasetine distal olarak tanıtılabilir (madm sistemine mutant alellerin nasıl sokulabileceği hakkında ayrıntılı bilgi için Şekil 2 ve Hippenmeyer vd.46'ya bakınız). Eğer MadM kasetleri arasında G2-X Cre rekombinaz aracılı interkromososomal trans-rekombinasyon oluşursa, ilgi geni için bir GFP+ homozigot mutant hücre(GeneX-/-) ve etiketsiz heterozigotortamda,47,bir tdT+ homozigot yabani hücre(GeneX+/+) ilesonuçlanır. Klonal analizde kullanılmayan alternatif etiketleme sonuçları (yani, sarı hücreler) daha önce ayrıntılı olarak açıklanmıştır11,46,47. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
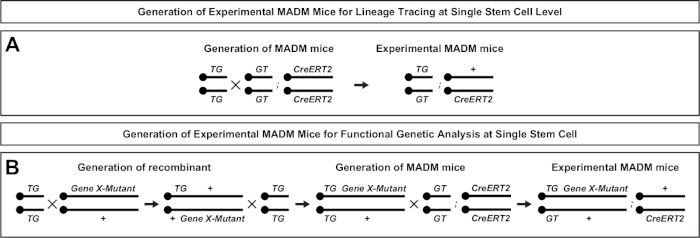
Şekil 2: Soy izleme için deneysel MADM farelerinin üretimi için üreme şemaları. Klonal analiz için madm (A) ve Gene X MADM(B)deneysel MADM farelerin üretimi için üreme şeması. For more information regarding MADM breeding paradigms see Beattie et al.7 and Hippenmeyer et al.7,46. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: MADM tabanlı klonal soy analizi için zaman kursu paradigmaları. Deneysel tasarım zaman pencerelerinin şeması. Uzunlamasına örnekleme paradigmaları için klon indüksiyonunun zaman dilimi sabit kalmıştır ve analizden önceki süre değişkendir. Progresif aralıklı örneklemede, analiz indüksiyon unzamanı sabit kaldı, ancak indüksiyon zamanı değişkenlik gösteriyordu. Ele verilen sorulara bağlı olarak bir veya her iki yaklaşımın bir kombinasyonu kullanılabilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Gelişmekte olan ve erişkin neokortekste MADM klonal analizi. Simetrik olarak proliferatif (E10'da TM)(A-C)ve asimetrik nörojenik (E12'de TM)(D-F)rgp'leri bölen TM aracılı MADM klon indüksiyonu. MadM-11GT/TG'de(TM/E10−A/E16 ve TM/E12−A/E16) (B,E10−A/P21 ve TM/E12−A/P21)(C,F) geliþtirmede vivo olarak bireysel MADM klonları;B,E Nestin-CreERT2+/- (B,E) ve MADM-11GT/TG; Emx1-CreERT2+/- (C,F). Nöron çıkışı subklon renginden bağımsızdı ve yeşil çoğunluk/azınlık alt klonları kontrol koşulları altında kırmızı çoğunluk/azınlık alt klonlarıile karşılaştırılabilirdi 7,11. Yetişkin klonların yaklaşık 1/6'sı da beyaz yıldızlarla gösterilen astrositler ve/veya oligodendrositler içeriyordu. B ve F panelleri sırasıyla Hippenmeyer ve ark.46 ve Rulands ve Simons72'ninizniyle çoğaltılır. CP = Kortikal plaka. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
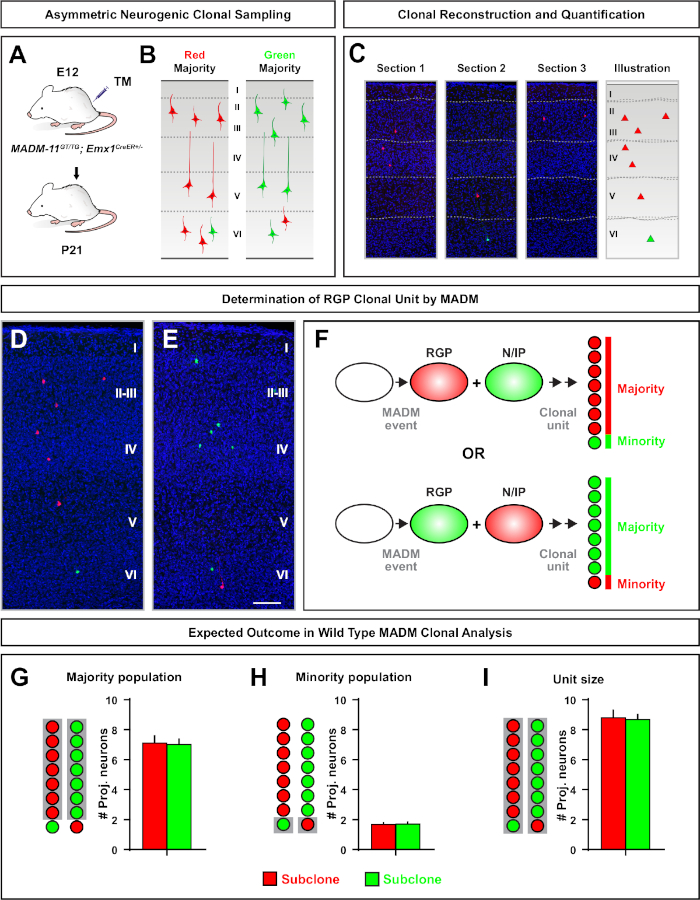
Şekil 5: RGP aracılı nöron çıktısını ölçmek için MADM klonal analizi. MADM7,11kullanarak klonal düzeyde bireysel nörojenik RGP'ler ile uyarıcı nöron (birim) üretiminin analizi. (A) Gelişmekte olan kortekste çoğunlukla asimetrik MADM klonları indükleyen deneysel paradigma. (B) MadM-11GT/TG'deçoğunluğu nisbete olan temsili asimetrik G2-X MADMD,Eklonların 3D rekonstrüksiyon görüntülerine yayılan yeşil veya kırmızı(C)temsili ardışık bölümlerde yeşil veya kırmızı etiketli çoğunluk subklonu ile olası asimetrik klon sonuçları ;DE Emx1-CreERT2+/- E12'de TM indüksiyonu ve P21'de analiz. Hem yeşil hem de kırmızı etiketli hücrelerin vahşi türü olduğuna dikkat edin. (F) İki olası deneysel MADM klon sonuçlarını gösteren şema. (G) MADM-11 klonlarında RGP'lerin yenilenmesinden kaynaklanan çoğunluk nüfusunun büyüklüğünün ölçülmesi. (H) MADM-11 klonlarında RGP'lerin yenilenmesinden kaynaklanan azınlık nüfusunun büyüklüğünün ölçülmesi. (I) Asimetrik nörojenik MADM-11 klonların üniter boyutunun ölçülmesi. Varsayımsal değerler ortalama ± SEM. Ölçek çubuğu = 100 μm (D ve E'yi temsil edebilir. TM = Tamoksifen. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
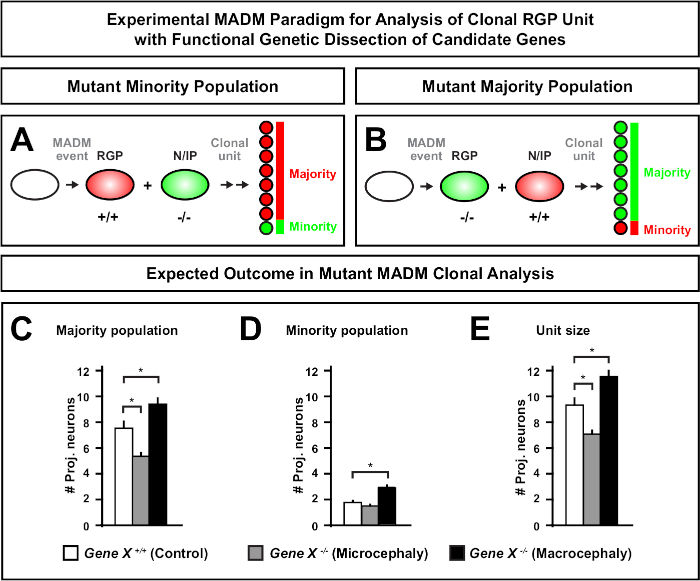
Şekil 6: MADM klonal analizi mikrosefali ve makrosefaliye yol açan genleri incelemek için. Mikrosefaliye veya makrosefaliye yol açan aday genlerin fonksiyonel genetik diseksiyonu yapılırken varsayımsal MADM klonal analiz sonuçları. Nöran çıkışında bir genin hücre otonom fonksiyonlarını incelemek için(Gene X)nöron çıkışında MADM alellerinin meiyotik rekombinasyon yoluyla MADM kasetlerine distal olarak tanıtılması gerekir (MADM sistemine mutant alellerin nasıl tanıtılabildiğini ayrıntılar için şekil 2, Hippenmeyer ve ark.46, ve Laukoter vd.46,73). (A,B) Klonal RGP birimlerinin fonksiyonel analizi için deneysel MADM paradigması gösteren şema. Mutant subklon azınlık(A)veya çoğunluk (B) popülasyonunu oluşturabilir. (C-E) Varsayımsal MADM klonal analiz sonuçları kontrol MADM (beyaz çubuklar), Gene-X MADM mikrosefali (gri çubuklar) ve Gene-X MADM makrosefali siyah çubuklar) asimetrik klonlar ölçer. (C) Çoğunluk nüfusunun büyüklüğünün ölçülmesi. (D) Azınlık nüfusunun büyüklüğünün ölçülmesi. (E) Asimetrik nörojenik klonların üniter boyutunun nicelleştirilmesi. Varsayımsal değerler ortalama ± SEM. S = Alt klon hücre numarasındaki farkın kontrole göre öneme ulaşabileceği varsayımsal senaryoyu temsil edebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: MadM literatürde klonal çalışmalar. Kullanılan CreERT2 sürücüsü, TM dozu ve enjeksiyon zamanı dahil olmak üzere MADM klonal soy deneyleri içeren literatürdeki çalışmaların özeti. Bu tabloyu görüntülemek için lütfen buraya tıklayın (İndirmek için sağ tıklayın).
Tartışmalar
Gelişmekte olan neokortekste in vivo in vivo'nun bireysel RGP'lerinin hücre soyunlarını izlemek için MADM'yi kullanan bir yöntem tanımlanmıştır. TM-indüklenebilir CreERT2ile kombine edildiğinde, MADM olayları tam olarak zamanlanabilir, tek hücre düzeyinde kök hücre bölünmesi desenleri son derece nitel ve nicel görsel okuma sağlayan. TM'nin dozunu titrating ederek, ideal bir durumda kortikal yarımküre başına ortalama bir klondan daha az bir klon elde edilebilir, bireysel klonları kesin olarak ayırt etmek için yeterli uzamsal ayrım sağlanabilir. Doku bütünlüğünü koruyarak, bu yöntem aynı zamanda pozisyon, morfoloji ve mutlak hücre numaraları ile ilgili temel bilgileri yakalar. Chr.,117,11,12,46,56,57, Chr. 751ve Rosa2647,53,,59 orijinal MADM üzerinde MADM kasetleri MADM klonal analiz çalışmalarında kullanılmıştır. Bireysel hücrelerin yüksek çözünürlük hem morfolojisi ve kız hücrelerinin klonal ilişki içine benzeri görülmemiş bir fikir sağlar ve çoğalan kök hücreleri ve gelişmekte olan klonlar canlı görüntüleme sağlar46,52.
Sezaryen ve doğum sonrası zaman noktalarında klonların analizi için yavruların teşvik edilmesi protokolde gerekli ve kritik bir adımdır. TM ile tedavi edilen gebe barajının sağlık durumuna bağlı olarak sezaryen yapılması gerekli olmayabilir. Ancak, bir koruyucu anne ile yavru yetiştirme hala gereklidir, TM tedavi anne sorun emzirme olabilir çünkü. Farklı CreERT2 sürücüleri ile teşvik ihtiyacı hiçbir fark gözlenmiştir. Hem MADM hatları hem de koruyucu anneler, cd-1 arka planında korunur. Sezaryen gerekli değilse, deneysel yavrular üretmek için kullanılan TM ile tedavi edilen gebe barajı 3R prensiplerine uygun olarak ek deneysel ıslahlar için yeniden kullanılabilir (bunun ancak hayvan deneysel lisansları bu uygulamayı onaylarsa yapılabileceğini unutmayın). Koruyucu anneler doğumdan sonraki 2 gün içinde yavruları beslemek için kullanılabilir, ancak koruyucu anneler, teşvik edilmesi gereken deneysel farelerle aynı gün doğum yaptığında daha yüksek başarı oranları gözlenmiştir. Bu nedenle, adım 1.1'deki deneysel miyatlara paralel olarak koruyucu anneler için zamanlanmış miatingler kurmak önemlidir. Orijinal koruyucu annenin çöp olarak benzer bir çöp sayısı bakımı koruyucu yavruların hayatta kalma oranını artırabilir, ve bu nedenle orijinal çöp tüm bazı kaldırılması gerekli olabilir. Fostering artırabilir ek adımlar çöp ve gıda ile deneyeldiven sürtünme içerir (eldiven kokusunu kaldırmak için); koruyucu annenin kirli çöp ve yuva parçaları ile sezaryen sonra yavaşça yavruları sürtünme; ve yavruların koruyucu fare kafesine yerleştirilmeden önce yavrularının yavrularıyla yakın temas halinde olmaları.
Diğer muhabir tabanlı soy izleme yöntemlerinde olduğu gibi MADM klonal deneyleri için en uygun CreERT2 sürücüsü seçilirken dikkatli olunmalıdır. İlk olarak, kullanılan organizatör ilgi atası popülasyonunda hem zamansal hem de mekansal rekombinaz ifade etmelidir. Bazı organizatörler ifade kalıplarını değiştirebilir veya geliştirmenin farklı aşamalarında susturulabilir, çünkü bu organizatörü bulmak zor olabilir. Hücre tipi özgüllüğünü artırmak için her biri ayrı organizatörler tarafından yönlendirilen birden fazla siteye özgü rekombinates kullanılmıştır. Bir veya her iki rekombinases aynı hücrede ifade edildiğinde, bu etiketler hücre ve bir floresan muhabiri ile soyundan74,75,76,77. Özetle, analiz edilen ataların popülasyonuna özgü bir CreERT2 sürücüsü seçmek önemlidir.
Bu yöntemdeki en kritik adım bir klonun tanımlanmasıdır, çünkü tüm hücreler tek bir rekombinasyon olayından kesin olarak türetilmelidir (adım 8.1). TM konsantrasyonunun titrasyonu, beyin yarımküresi başına bir kümeden daha az kırmızı/yeşil hücre sağlar ve tek bir klonu analiz etme olasılığını en üst düzeye çıkarır (adım 2.2)7,,11. Klonlar, komşu hücre kümelerinin ilgi alanının 500 m'sinde oluşması durumunda atılmalıdır. Bu nedenle, bir klonun ortaya çıkmasından önce ve sonra birkaç bölümü incelemek önemlidir. Florofororların zayıf sinyali nedeniyle embriyonik klonlarda eGFP ve tdT immünohistokimyası yapmak gerekmektedir (bkz. bölüm 6). Bu sadece yetişkin klonlar için tavsiye edilir ek antijenler colabeled olacak. Klonları görüntülerken, korteksin bulunduğu yerin tüm genişliğini yakalamak önemlidir (örneğin, pial yüzeyden korpus callosum'a; bkz. adım 8.4) herhangi bir hücreyi kaçırmamak için. Bu, görüntü işleme sırasında görüntü hizalamayı da kolaylaştırır (bölüm 9). Protokolün 8. Epifloresan mikroskopisi kullanılabilir, ancak odak düzleminin dışından Gelen ışık kontaminasyonunda azalmaya yol açtığı için konfokal mikroskopi önerilir. Ayrıca lazer yoğunluğu ve kazanç böylece yeşil, kırmızı ve sarı hücreler kesin olarak tespit edilebilir ayarlanır önemlidir. Kurulumne bakılmaksızın, yakın konumlandırılmış hücrelerin tam uzamsal ayrıştırmasını sağlamak için en az 20x'lik bir hedef kullanılması önerilir. Tüm hücrelerin kortikal derinliğini kaydetmenin yanı sıra (adım 8.6), klonların bulunduğu kortikal bölgeler, Allen Beyin atlası veya diğer stereotaksik koordinat haritaları gibi bir beyin atlası kullanılarak tanımlanmalıdır. Klon görüntülerinin kolayca tanımlanadığından emin olmak için bir dosya adlandırma paradigması da benimsenmelidir. Aşağıdaki bilgiler dosya adlandırma dahil edilebilir: benzersiz görüntü kimliği, tarih görüntü alınmıştır, hayvan genotip, indüksiyon yaşı, analiz yaşı, aynı klon dan görüntülerin geri kalanı ile ilgili görüntü numarası.
Bir MADM kasetine mutasyon distal girişi belirgin genetik mozaiklerin üretimi sağlar71 ve klonal düzeyde soy ve hücre tipi çeşitliliği moleküler düzenleyicilerin diseksiyon sağlar7,11,46,62. MADM ile genetik bir mozaik oluşturmak için MADM kasetleri meiotik olarak ilgi geniile aynı kromozoma bağlanmalıdır (üreme düzeni için Şekil 2'ye bakınız). Bu, MADM ile mevcut klonal analizini Chr. 751, Chr. 1146, Chr. 1251ve Chr. 6 distal'dan Rosa26 locus47'yekadar olan genlerle sınırlandırır. Gelecekteki çalışmalarda herhangi bir kromozomu hedefleyen MADM kasetleri kullanılacak ve klonal düzeyde fare genomunun hemen hemen tüm genlerinin mozaik analizine izin verilecektir.
Son olarak, MADM gelişmekte olan neokorteks ata hücrelerinin analizi ile sınırlı değildir. Birçok kök hücre nişleri çalışma klonsal ilişkili hücrelerin spatiotemporal düzenlemeleri çözmek için yeteneği yararlanabilir. MADM'i beynin diğer bölgelerine uygulayarak, hastalık koşulları (örn. kanser), veya diğer dokularda47,,50,51,52,53,54,55,56,57,58, 58,59, çalışmalar, progenitor ve kök hücrelerin çeşitli sınıflarından elde edilen klonlarda soy ilişkilerini ortaya koymuştur (MADM klonal çalışmaların güncel listesi için Tablo 1'e bakınız). MADM'in gelecekteki bir diğer ilginç uygulaması da bunu klonlardan elde edilebilen bilgi nin derecesini artıracak ek fonksiyonel veya hücre altı muhabirlerle birleştirmektir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Hippenmeyer laboratuvarının tüm üyelerine, IsT Avusturya'daki Biyogörüntüleme Tesisi, Yaşam Bilimi Tesisi ve Klinik Öncesi Tesis'e teknik destek için teşekkür ederiz. Bu çalışma IST Austria kurumsal fonları tarafından desteklenmiştir; R.B., Avusturya Bilim Fonu (FWF) Lise-Meitner programı (M 2416) tarafından destek aldı; N.A, Avusturya Bilim Fonu (FWF) Firnberg-Programm (T 1031) tarafından destek aldı; GC, Marie Skłodowska-Curie hibe anlaşması no. 754411 kapsamında Avrupa Birliği'nin Horizon 2020 araştırma ve yenilik programından ISTplus doktora sonrası araştırmacı olarak destek aldı; A.H., Avusturya Bilimler Akademisi Doktora Bursu'ndan destek aldı. Bu çalışma aynı zamanda Avrupa Birliği'nin Horizon 2020 araştırma ve yenilik programı (hibe anlaşması No 725780 LinPro) kapsamında S.H. için Avrupa Araştırma Konseyi (ERC) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL tuberculin syringe (Omnifix Luer Lock) | Braun | 9204512N | |
| 1,4-diazabicyclooctane (DABCO) | Roth | 0718.2 | |
| 10 mL Syringe (Omnifix Luer Lock) | Braun | 8508429N | |
| 15 mL conical centrifuge | Sarstedt | 65.554.502 | |
| 24 multi-well dishes | Roth/Greiner Bio-one | CE56.1 | |
| 27- gauge x 3/4 needle (Sterican) | Braun | 16010256E | |
| Corn oil | Sigma | C8267-500ML | |
| Coverslips (24 x 60 mm #1) | Thermo Fisher Scientific (Menzel) | 15747592 | |
| Cryostat Cryostar NX70 | Thermo Fisher Scientific | 957000H | |
| Dako Pen (Wax marker) | Agilent | S200230-2 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Invitrogen | D1306 | |
| Disposable microtome blade (MX35 Ultra) | Thermo Fisher Scientific | 705830 | |
| Fine Forceps (Dumont #5) | Fine Science Tools (FST) | 11254-20 | |
| Glass anti-roll plate | Histocom | M 449980 | |
| Glycerol | Sigma | G5516 | |
| LSM 800 Confocal | Zeiss | ||
| Mounting medium | 25 mg/mL DAPCO, 6 g Glycerol, 2.4 g Mowiol 4-88, 6 mL dH2O, 12 mL 0.2 M Tris-HCl (pH 8.5) | ||
| Mowiol 4-88 | Roth | 0713.2 | |
| Normal donkey serum | Innovative Research | IGDNSER100ML | |
| Paraformaldehyde | Sigma | 441244-1KG | |
| Peristaltic pump 323E/D 400RPM | Watson-Marlow | 036.3124.00A | |
| Sucrose | Sigma | S8501-5KG | |
| Superfrost plus glass slides | Thermo Fisher Scientific | J1800AMNT | |
| Tamoxifen | Sigma | T5648 | |
| Tissue Embedding mold T-12 (22mm square) | Polysciences Inc. | 18986-1 | |
| Tissue-Tek O.C.T | Sakura | 4583 | |
| Triton X-100 | Sigma | T8787-250ML | |
| Trizma hydrochloride | Sigma | 93363 | |
| Tween-20 | Sigma | P9416-100ML | |
| Software and Plugins: | |||
| Fiji | 1.52p | Fiji | |
| MultiStackReg | 1.45 | Download link | |
| TurboReg | EPFL Bioimaging | ||
| Zen Blue | 2.6 | Zeiss | |
| Experimental Models: Organisms/Strains: | |||
| Mouse: Emx1-CreER | The Jackson Laboratory | JAX:027784 | |
| Mouse: MADM-11-GT | The Jackson Laboratory | JAX:013749 | |
| Mouse: MADM-11-TG | The Jackson Laboratory | JAX:013751 | |
| Primary antibodies: | |||
| Chicken anti-GFP 1:500 | Aves Labs | GFP-1020 | |
| Goat anti-tdTomato 1:500 | Sicgen Antibodies | AB8181-200 | |
| Rabbit anti-RFP 1:500 | MBL | PM005 | |
| Secondary antibodies: | |||
| Donkey Anti-Chicken Alexa Fluor 488 1:500 | Jackson Immuno Research | 715-475-150 | |
| Donkey Anti-Goat Cy3 1:500 | Jackson Immuno Research | 705-165-147 | |
| Donkey Anti-Rabbit Cy3 1:500 | Jackson Immuno Research | 711-165-152 |
Referanslar
- Malatesta, P., et al. Neuronal or glial progeny: regional differences in radial glia fate. Neuron. 37 (5), 751-764 (2003).
- Miyata, T., Kawaguchi, A., Okano, H., Ogawa, M. Asymmetric inheritance of radial glial fibers by cortical neurons. Neuron. 31 (5), 727-741 (2001).
- Noctor, S. C., Flint, A. C., Weissman, T. A., Dammerman, R. S., Kriegstein, A. R. Neurons derived from radial glial cells establish radial units in neocortex. Nature. 409 (6821), 714-720 (2001).
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30 (1), 465-502 (2014).
- Desikan, R. S., Barkovich, A. J. Malformations of cortical development. Annals of Neurology. 80 (6), 797-810 (2016).
- Gao, R., Penzes, P. Common mechanisms of excitatory and inhibitory imbalance in schizophrenia and autism spectrum disorders. Current Molecular Medicine. 15 (2), 146-167 (2015).
- Beattie, R., et al. Mosaic Analysis with Double Markers Reveals Distinct Sequential Functions of Lgl1 in Neural Stem Cells. Neuron. 94 (3), 517-533 (2017).
- Hippenmeyer, S. Molecular pathways controlling the sequential steps of cortical projection neuron migration. Advances in Experimental Medicine and Biology. 800, 1-24 (2014).
- Lodato, S., Arlotta, P. Generating neuronal diversity in the mammalian cerebral cortex. Annual Review of Cell and Developmental Biology. 31, 699-720 (2015).
- Hansen, A. H., Duellberg, C., Mieck, C., Loose, M., Hippenmeyer, S. Cell Polarity in Cerebral Cortex Development-Cellular Architecture Shaped by Biochemical Networks. Frontiers in Cellular Neuroscience. 11, 176 (2017).
- Gao, P., et al. Deterministic progenitor behavior and unitary production of neurons in the neocortex. Cell. 159 (4), 775-788 (2014).
- Llorca, A., et al. A stochastic framework of neurogenesis underlies the assembly of neocortical cytoarchitecture. eLife. 8, e51381 (2019).
- Ma, J., Shen, Z., Yu, Y. C., Shi, S. H. Neural lineage tracing in the mammalian brain. Current Opinion in Neurobiology. 50, 7-16 (2018).
- Caviness, V., Takahashi, T., Nowakowski, R. Numbers, time and neocortical neuronogenesis: a general developmental and evolutionary model. Trends in Neurosciences. 18 (9), 379-383 (1995).
- Schmechel, D. E., Rakic, P. A Golgi study of radial glial cells in developing monkey telencephalon: morphogenesis and transformation into astrocytes. Anatomy and Embryology. 156 (2), 115-152 (1979).
- Kessaris, N., et al. Competing waves of oligodendrocytes in the forebrain and postnatal elimination of an embryonic lineage. Nature Neuroscience. 9 (2), 173-179 (2006).
- Magavi, S., Friedmann, D., Banks, G., Stolfi, A., Lois, C. Coincident generation of pyramidal neurons and protoplasmic astrocytes in neocortical columns. The Journal of Neuroscience. 32 (14), 4762-4772 (2012).
- Anthony, T. E., Klein, C., Fishell, G., Heintz, N. Radial glia serve as neuronal progenitors in all regions of the central nervous system. Neuron. 41 (6), 881-890 (2004).
- Voigt, T. Development of glial cells in the cerebral wall of ferrets: direct tracing of their transformation from radial glia into astrocytes. The Journal of Comparative Neurology. 289 (1), 74-88 (1989).
- Amberg, N., Laukoter, S., Hippenmeyer, S. Epigenetic cues modulating the generation of cell-type diversity in the cerebral cortex. Journal of Neurochemistry. 149 (1), 12-26 (2019).
- Beattie, R., Hippenmeyer, S. Mechanisms of Radial Glia Progenitor Cell Lineage Progression. FEBS letters. 591 (24), 3993-4008 (2017).
- Telley, L., et al. Temporal patterning of apical progenitors and their daughter neurons in the developing neocortex. Science. 364 (6440), eaav2522 (2019).
- Oberst, P., et al. Temporal plasticity of apical progenitors in the developing mouse neocortex. Nature. 573 (7774), 370-374 (2019).
- Telley, L., et al. Sequential transcriptional waves direct the differentiation of newborn neurons in the mouse neocortex. Science. 351 (6280), 1443 (2016).
- Deppe, U., et al. Cell lineages of the embryo of the nematode Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 75 (1), 376-380 (1978).
- Woodworth, M. B., Girskis, K. M., Walsh, C. A. Building a lineage from single cells: genetic techniques for cell lineage tracking. Nature Reviews Genetics. 18 (4), 230-244 (2017).
- Masuyama, N., Mori, H., Yachie, N. DNA barcodes evolve for high-resolution cell lineage tracing. Current Opinion in Chemical Biology. 52, 63-71 (2019).
- Legue, E., Joyner, A. L. Chapter Ten-Genetic Fate Mapping Using Site-Specific Recombinases. Methods in Enzymology. 477, 153-181 (2010).
- Postiglione, M. P., Hippenmeyer, S. Monitoring neurogenesis in the cerebral cortex: an update. Future Neurology. 9 (3), 323-340 (2014).
- Espinosa-Medina, I., Garcia-Marques, J., Cepko, C., Lee, T. High-throughput dense reconstruction of cell lineages. Open Biology. 9 (12), 190229 (2019).
- Hwang, B., et al. Lineage tracing using a Cas9-deaminase barcoding system targeting endogenous L1 elements. Nature Communications. 10 (1), 1234 (2019).
- Kalhor, R., et al. Developmental barcoding of whole mouse via homing CRISPR. Science. 361 (6405), eaat9804 (2018).
- García-Moreno, F., Vasistha, N. A., Begbie, J., Molnár, Z. CLoNe is a new method to target single progenitors and study their progeny in mouse and chick. Development. 141 (7), 1589-1598 (2014).
- Loulier, K., et al. Multiplex Cell and Lineage Tracking with Combinatorial Labels. Neuron. 81 (3), 505-520 (2014).
- Livet, J., et al. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-62 (2007).
- Snippert, H. J., et al. Intestinal Crypt Homeostasis Results from Neutral Competition between Symmetrically Dividing Lgr5 Stem Cells. Cell. 143 (1), 134-144 (2010).
- Amitai-Lange, A., et al. A method for lineage tracing of corneal cells using multi-color fluorescent reporter mice. Journal of Visualized Experiments. (106), e53370 (2015).
- Vasistha, N. A., et al. Cortical and Clonal Contribution of Tbr2 Expressing Progenitors in the Developing Mouse Brain. Cerebral Cortex. 25 (10), 3290-3302 (2015).
- Chen, F., LoTurco, J. A method for stable transgenesis of radial glia lineage in rat neocortex by piggyBac mediated transposition. Journal of Neuroscience Methods. 207 (2), 172-180 (2012).
- Siddiqi, F., et al. Fate mapping by piggyBac transposase reveals that neocortical GLAST+ progenitors generate more astrocytes than Nestin+ progenitors in rat neocortex. Cerebral Cortex. 24 (2), 508-520 (2014).
- Yoshida, A., et al. Simultaneous expression of different transgenes in neurons and glia by combining in utero electroporation with the Tol2 transposon-mediated gene transfer system. Genes to Cells. 15 (5), 501-512 (2010).
- García-Marqués, J., López-Mascaraque, L. Clonal Identity Determines Astrocyte Cortical Heterogeneity. Cerebral Cortex. 23 (6), 1463-1472 (2013).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884 (2019).
- Kim, G. B., et al. Rapid Generation of Somatic Mouse Mosaics with Locus-Specific, Stably Integrated Transgenic Elements. Cell. 179 (1), 251-267 (2019).
- Pilz, G. A., et al. Live imaging of neurogenesis in the adult mouse hippocampus. Science. 359 (6376), 658 (2018).
- Hippenmeyer, S., et al. Genetic Mosaic Dissection of Lis1 and Ndel1 in Neuronal Migration. Neuron. 68 (4), 695-709 (2010).
- Zong, H., Espinosa, J. S., Su, H. H., Muzumdar, M. D., Luo, L. Mosaic analysis with double markers in mice. Cell. 121 (3), 479-492 (2005).
- Ramón y Cajal, S. . Histologie du système nerveux de l'homme et des vertébrés. , (1911).
- Cowan, W. M. The emergence of modern neuroanatomy and developmental neurobiology. Neuron. 20 (3), 413-426 (1998).
- Ali, S. R., et al. Existing cardiomyocytes generate cardiomyocytes at a low rate after birth in mice. Proceedings of the National Academy of Sciences of the United States of America. 111 (24), 8850-8855 (2014).
- Hippenmeyer, S., Johnson, R. L., Luo, L. Mosaic analysis with double markers reveals cell-type-specific paternal growth dominance. Cell Reports. 3 (3), 960-967 (2013).
- Riccio, P., Cebrian, C., Zong, H., Hippenmeyer, S., Costantini, F. Ret and Etv4 promote directed movements of progenitor cells during renal branching morphogenesis. PLoS Biology. 14 (2), e1002382 (2016).
- Bonaguidi, M. A., et al. In vivo clonal analysis reveals self-renewing and multipotent adult neural stem cell characteristics. Cell. 145 (7), 1142-1155 (2011).
- Mayer, C., et al. Clonally Related Forebrain Interneurons Disperse Broadly across Both Functional Areas and Structural Boundaries. Neuron. 87 (5), 989-998 (2015).
- Muzumdar, M. D., et al. Clonal dynamics following p53 loss of heterozygosity in Kras-driven cancers. Nature Communications. 7, 12685 (2016).
- Shi, W., et al. Ontogenetic establishment of order-specific nuclear organization in the mammalian thalamus. Nature Neuroscience. 20, 516 (2017).
- Wong, S. Z. H., et al. In vivo clonal analysis reveals spatiotemporal regulation of thalamic nucleogenesis. PLoS Biology. 16 (4), e2005211 (2018).
- Xu, H. T., et al. Distinct Lineage-Dependent Structural and Functional Organization of the Hippocampus. Cell. 157 (7), 1552-1564 (2014).
- Brennand, K., Huangfu, D., Melton, D. All β Cells Contribute Equally to Islet Growth and Maintenance. PLoS Biology. 5 (7), e163 (2007).
- Ortiz-Alvarez, G., et al. Adult neural stem cells and multiciliated ependymal cells share a common lineage regulated by the geminin family members. Neuron. 102 (1), 159-172 (2019).
- Kaplan, E. S., Ramos-Laguna, K. A., Mihalas, A. B., Daza, R. A. M., Hevner, R. F. Neocortical Sox9+ radial glia generate glutamatergic neurons for all layers, but lack discernible evidence of early laminar fate restriction. Neural Development. 12 (1), 14 (2017).
- Lv, X., et al. TBR2 coordinates neurogenesis expansion and precise microcircuit organization via Protocadherin 19 in the mammalian cortex. Nature Communications. 10 (1), 3946 (2019).
- Mihalas, A. B., Hevner, R. F. Clonal analysis reveals laminar fate multipotency and daughter cell apoptosis of mouse cortical intermediate progenitors. Development. 145 (17), dev164335 (2018).
- Picco, N., et al. A mathematical insight into cell labelling experiments for clonal analysis. Journal of Anatomy. 235 (3), 687-696 (2019).
- Johnson, C. A., Ghashghaei, H. T. Sp2 regulates late neurogenic but not early expansive divisions of neural stem cells underlying population growth in the mouse cortex. Development. , (2020).
- Espinosa, J. S., Luo, L. Timing Neurogenesis and Differentiation: Insights from Quantitative Clonal Analyses of Cerebellar Granule Cells. The Journal of Neuroscience. 28 (10), 2301 (2008).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Liu, Y., et al. Tamoxifen-independent recombination in the RIP-CreER mouse. PLoS One. 5 (10), e13533 (2010).
- Klingler, E., Jabaudon, D. Do progenitors play dice?. eLife. 9, e54042 (2020).
- Hippenmeyer, S. Dissection of gene function at clonal level using mosaic analysis with double markers. Frontiers in Biology. 8 (6), 557-568 (2013).
- Rulands, S., Simons, B. D. Tracing cellular dynamics in tissue development, maintenance and disease. Current Opinion in Cell Biology. 43, 38-45 (2016).
- Laukoter, S., et al. Imprinted Cdkn1c genomic locus cell-autonomously promotes cell survival in cerebral cortex development. Nature Communications. 11 (1), 195 (2020).
- Daigle, T. L., et al. A Suite of Transgenic Driver and Reporter Mouse Lines with Enhanced Brain-Cell-Type Targeting and Functionality. Cell. 174 (2), 465-480 (2018).
- He, M., et al. Strategies and Tools for Combinatorial Targeting of GABAergic Neurons in Mouse Cerebral Cortex. Neuron. 91 (6), 1228-1243 (2016).
- Yamamoto, M., et al. A multifunctional reporter mouse line for Cre- and FLP-dependent lineage analysis. Genesis. 47 (2), 107-114 (2009).
- Plummer, N. W., et al. Expanding the power of recombinase-based labeling to uncover cellular diversity. Development. 142 (24), 4385 (2015).
- Imayoshi, I., Ohtsuka, T., Metzger, D., Chambon, P., Kageyama, R. Temporal regulation of Cre recombinase activity in neural stem cells. Genesis. 44 (5), 233-238 (2006).
- Sasaki, S., et al. Complete loss of Ndel1 results in neuronal migration defects and early embryonic lethality. Molecular and Cellular Biology. 25 (17), 7812-7827 (2005).
- Acampora, D., et al. Epilepsy and brain abnormalities in mice lacking the Otx1 gene. Nature Genetics. 14 (2), 218-222 (1996).
- Soeda, T., et al. Sox9-expressing precursors are the cellular origin of the cruciate ligament of the knee joint and the limb tendons. Genesis. 48 (11), 635-644 (2010).
- Klezovitch, O., Fernandez, T. E., Tapscott, S. J., Vasioukhin, V. Loss of cell polarity causes severe brain dysplasia in Lgl1 knockout mice. Genes & Development. 18 (5), 559-571 (2004).
- Pimeisl, I. M., et al. Generation and characterization of a tamoxifen-inducible EomesCreER mouse line. Genesis. 51 (10), 725-733 (2013).
- Nakagawa, N., et al. Memo1-Mediated Tiling of Radial Glial Cells Facilitates Cerebral Cortical Development. Neuron. 103 (5), 836-852 (2019).
- Nowotschin, S., et al. The T-box transcription factor Eomesodermin is essential for AVE induction in the mouse embryo. Genes & Development. 27 (9), 997-1002 (2013).
- Balordi, F., Fishell, G. Mosaic removal of hedgehog signaling in the adult SVZ reveals that the residual wild-type stem cells have a limited capacity for self-renewal. Journal of Neuroscience. 27 (52), 14248-14259 (2007).
- Liang, H., et al. Neural development is dependent on the function of specificity protein 2 in cell cycle progression. Development. 140 (3), 552-561 (2013).
- Guo, C., Yang, W., Lobe, C. G. A Cre recombinase transgene with mosaic, widespread tamoxifen-inducible action. Genesis. 32 (1), 8-18 (2002).
- Ahn, S., Joyner, A. L. In vivo analysis of quiescent adult neural stem cells responding to Sonic hedgehog. Nature. 437 (7060), 894-897 (2005).
- Storm, R., et al. The bHLH transcription factor Olig3 marks the dorsal neuroepithelium of the hindbrain and is essential for the development of brainstem nuclei. Development. 136 (2), 295-305 (2009).
- Koundakjian, E. J., Appler, J. L., Goodrich, L. V. Auditory neurons make stereotyped wiring decisions before maturation of their targets. Journal of Neuroscience. 27 (51), 14078-14088 (2007).
- Dor, Y., Brown, J., Martinez, O. I., Melton, D. A. Adult pancreatic β-cells are formed by self-duplication rather than stem-cell differentiation. Nature. 429 (6987), 41-46 (2004).
- Sohal, D. S., et al. Temporally regulated and tissue-specific gene manipulations in the adult and embryonic heart using a tamoxifen-inducible Cre protein. Circulation Research. 89 (1), 20-25 (2001).
- Ventura, A., et al. Restoration of p53 function leads to tumour regression in vivo. Nature. 445 (7128), 661-665 (2007).
- Johnson, L., et al. Somatic activation of the K-ras oncogene causes early onset lung cancer in mice. Nature. 410 (6832), 1111-1116 (2001).
- Tasic, B., et al. Extensions of MADM (mosaic analysis with double markers) in mice. PLoS One. 7 (3), e33332 (2012).
- Yu, J., Carroll, T. J., McMahon, A. P. Sonic hedgehog regulates proliferation and differentiation of mesenchymal cells in the mouse metanephric kidney. Development. 129 (22), 5301-5312 (2002).
- Zhao, H., et al. Role of fibroblast growth factor receptors 1 and 2 in the ureteric bud. Developmental Biology. 276 (2), 403-415 (2004).
- Schuchardt, A., D'Agati, V., Larsson-Blomberg, L., Costantini, F., Pachnis, V. Defects in the kidney and enteric nervous system of mice lacking the tyrosine kinase receptor Ret. Nature. 367 (6461), 380-383 (1994).
- Livet, J., et al. ETS gene Pea3 controls the central position and terminal arborization of specific motor neuron pools. Neuron. 35 (5), 877-892 (2002).
- Volz, K. S., et al. Pericytes are progenitors for coronary artery smooth muscle. eLife. 4, e10036 (2015).
- Cai, C. L., et al. A myocardial lineage derives from Tbx18 epicardial cells. Nature. 454 (7200), 104-108 (2008).
- Lasrado, R., et al. Lineage-dependent spatial and functional organization of the mammalian enteric nervous system. Science. 356 (6339), 722-726 (2017).
- Matsuoka, T., et al. Neural crest origins of the neck and shoulder. Nature. 436 (7049), 347-355 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır