Method Article
二重マーカーを用いたモザイク解析を用いた大脳皮質の開発における系統トレースとクローン解析(MADM)
要約
二重マーカー(MADM)を用いたモザイク解析を用いて、単一細胞レベルで候補遺伝子の系統トレースと機能遺伝子解析を行うプロトコルを紹介する。MADMクローン解析は、個々の前駆細胞とその娘細胞の増殖行動、細胞出力、および系統関係を測定するための定量的枠組みを提供します。
要約
哺乳類大脳皮質は、限られた前駆子のプールから始まり、高度に組織化された機能的神経回路を形成する。しかし、神経幹細胞(NSC)の系統転移を調節する基礎となる細胞および分子メカニズムと、発達中の神経エピテリウムにおけるニューロンおよびグリアの最終的な産生は不明のままである。NSC分裂パターンを追跡し、クローン関連細胞の系統をマッピングする方法は劇的に進歩した。しかし、多くの現代系統トレース技術は、前駆細胞分裂パターンを解読するために不可欠な前生細胞運命の細胞分解能の欠如に苦しんでいる。提示は、二重マーカー(MADM)を用いたモザイク解析を用いたプロトコルで、生体内クローン解析を行う。MADMは、個々の前駆細胞を同時に操作し、前例のない単一細胞分解能で正確な分割パターンと系統進行を可視化します。MMベースの軟体間組換えイベントは、ヒト誘導性CreER T2と共に、ヒト誘導性CreERT2のG2-X相における、クローンの生年月日およびその分割パターンに関する正確な情報を提供する。したがって、MADM系統トレースは、単一細胞レベルでの幹細胞前駆物質の増殖モードの前例のない質的および定量的な光学読み出しを提供する。MADMはまたNSC系統進行の候補遺伝子のメカニズムおよび機能要件の検討を可能にする。この方法は、制御と変異サブクローンの比較分析が生体内の同じ組織環境で行うことができるという中でユニークである。ここで、プロトコルについて詳細に説明し、開発中の大脳皮質におけるクローン解析および系統トレースにMADMを採用するための実験的パラダイムが示されている。重要なことに、このプロトコルは、CreERT2ドライバが存在する限り、任意のマウス幹細胞ニッチにおいてMADMクローン分析を実行するように適応することができる。
概要
大脳皮質は、6つの異なる層で構成される高度に組織化された構造である。皮質は、機能的な神経回路を形成するために相互作用するニューロンやグリアを含む細胞タイプの多様な配列が含まれています。ほとんどの, すべてではないにしても, 皮質興奮性の投影ニューロンとグリアは、放射状グリア前駆体として知られている神経幹細胞 (NSC) の共通プールに由来します (RRP)11,2,,3.RGP自体は、初期胚性神経エピテリウムを構成する神経上皮幹細胞(NESC)に由来する。マウスの胚性9日目(E9)によって、NESCはRMP4に移行し始める。RGP系統進行は、正確な時間的および空間的調節を必要とし、かつこのプロセスが妨げられると、腸脳症、小頭症、リセンスファリー、または統合失調症および自閉症などの障害などの重篤な神経疾患が55,66を生じ得る。E10では、ほとんどのRMPは対称増殖分裂を受け、その結果、神経前駆細胞プール44,77が拡大する。最終的にRGPは非対称的に分裂し始め、一時的に定義された方法で皮質投影ニューロンを産生する。神経新生の連続した波を介して、新生児ニューロンは、深層を占める初期のニューロンと表面層88、9、109,10に存在する後期生まれのニューロンを有する皮質薄層を形成する皮質プレートに移行する。クローン関連の錐体ニューロンは、接線分散が非常に少ない皮質に放射状に移動するため、娘細胞は、ニューロン放射状ユニット44、11、12、1311,12,と呼ばれるカラムまたは円錐形の構造を形成する傾向がある。13E17により、マウス14において胚性神経原性拡張が完了する。RGPはまた、アストロサイトとオリゴデンドロ,サイト1、15、16、17、18、19,15,16を含む、名誉細胞およびいくつかのクラスのグリア17,18を19産生することができる。RGPが神経細胞とアストロサイトの両方を生み出す可能性は、全ての皮質領域18で一貫しているようで、約1/6の神経性RRPもグリア11を産生する。
現在、その系統に沿った幹細胞の経時的な進行を調節する遺伝的およびエピジェネティック要因はほとんど知られていない。遺伝子発現の一時的なパターンは、RMP20、21、22、23、24,21,22,23における系統決定に大きな影響を24与える可能性がある。時間的パターンと空間的パターニングの間のこの緊密な結び付き関係が、皮質領域全体の成体ニューロン型の分子多様性にどのようにつながりかは不明である。同様に、個々の幹細胞電位とその細胞出力が細胞レベルおよび分子レベルでどのように変調されているかも、重要な未回答の問題である。今後の研究は、これらの質問のいくつかに対処し、最終的には機能性皮質回路形成に関する理解を深めるだろう。
発生神経生物学は、脳内の細胞が互いに共有する系統関係を理解することを目指しています。当初は、非常に少数の研究ツールは、このために利用可能であった、と多くの初期の研究は、カエノハブディティスエレガンスなどの透明な生物の分裂パターンの視覚的観察に依存していました25.ここ数十年で,、13、26、27、28、29,26,27の技術の数と洗練が劇的に増加しています。28,29CRISPR-Cas9ゲノム編集システムの出現により、進化するDNAバーコード27,30を導入することにより、30細胞系統関係の合成再構築が可能になります。バーコード戦略の最近の2つの例としては、CRISPR-Cas9を特定のDNAバーコード・ロシに誘導するホーミングガイドRNAまたはニッカーゼCas9と融合したシチジン・デアミナーゼを使用して、内因性間包化反復領域31,32,32を標的とする。これらの技術は、時間の経過とともに徐々に安定的にユニークな突然変異を蓄積するバーコードの導入を通じて、高度に多重化されたアプローチを提供します。ゲノム編集手法は、これらのバーコードの共有継承に基づいて、任意の2つの細胞間の関係を遡及的に分析できるため、非常に価値があります。しかし、個々の細胞のバーコードを読み取るためには、組織は通常破壊されなければならないため、個々の前駆体からの位置、形態、および絶対細胞数に関する情報は失われる。
結合標識パラダイムは、空間情報を保存し、原則として、密接に局在するクローン33,34,34を区別することを可能にする。系統トレース法が有益であるには、個々の前駆者とその子孫にまばらで消えない方法でラベルを付ける必要があります。特に、Brainbow35とConfetti36、37のアプローチは、37単一の遺伝子座から蛍光タンパク質の組み合わせを発現する確率的多色クレリコンビナーゼベースのレポーターを使用しています。インビボで達成することができる同時色の組み合わせの広範な数は、皮質RGPクローンとアストロサイト34をトレースするときに、この強力なツールになります。蛍光レポーターをコードするトランス遺伝子の安定したゲノム統合を提供するトランスポゾン系システムと、皮質前駆細胞の系統トレースを許可するシステムも33,38,39,40,41に開発されている。33,38,39,40,41トランスポゾン系システムは、レポーターがゲノムに安定的に統合し、それにより、線状に関連する娘細胞を確実に標識するという点で付加的な利点を有する。アストロサイト系統を具体的に追跡するために、異なる蛍光タンパク質40,42,42をコードする構築物の組み合わせを利用したスタートラックを含むピギーババックトランスポーゼのエレクトロポレーションを伴う多くの方法が開発されている。もう一つのアプローチであるMAGICマーカーは、転写可能なトランス遺伝子としてBrainbowベクターを導入する。これは正常に胚性神経およびアストロサイト前駆細胞34、43,43を追跡するために使用されています。近年、デュアルリコンビナーゼ媒介カセット交換(MADR)によるモザイク解析は、正確に定義された染色体座遺伝子44からトランスジェニック要素を発現する変異細胞を安定的に標識することを発見した。これらの強力なin vivoの組み合わせ標識技術は、前駆細胞の系統動態に多くの洞察を提供してきた。しかし、これらの分析は固定組織で行われ、定義された発達段階で個々のクローンのスナップショットを提供する。一つのクローンの系統動態の経時変化を観察するためには、成体のデンテート回で行われたものと同様の慢性インビボイメージング法を45に適用する必要がある。
二重マーカー(MADM)を用いたモザイク解析は、マウス46,47,47における個々の前駆細胞の生体内系統トレースを可能にする強力な二重色標識法である。MADM標識イベントを発生させるには2つのコンポーネントが必要です:まず、MADMカセットは同一の遺伝子座を同一の染色体に対象としなければなりません。カセットは、eGFP(緑色、G)とタンデムダイマートマト(赤、tdT[T])の2つのキメラ蛍光レポーター遺伝子で構成されています。GTカセットは、eGFPのN末語とtdTのC末語を含み、loxP部位を含むイントロンで分離する。TGカセットは逆に構築され、tdTのN末語とeGFPのC末語が付いています。第2に、標的MADMカセットを含む同じ細胞内のクレリコンビナーゼの発現が必須である。Creがない場合、キメラカセットはコード配列が破壊されるため、機能的なeGFPまたはtdTを発現しません。loxP部位は、クレメディアされた染色体間組換えの標的となり、両方の発現カセットの再構成を同時に行う。細胞周期のG2フェーズ中に再結合が起こり、その後にX分離(G2-X)が起こった場合、2つの娘細胞はそれぞれ2つの蛍光タンパク質のうちの1つを発現する。タモキシフェン(TM)を用いたCreERT2活性の時間的調節は、MADMクローンの生年月日及びそれらの子孫の除算パターンに関する正確な情報を提供する(図1A)29、46、47。29,46,47
MADMは、ゴルジ染色48または染料充填49のような従来の非特異的かつ骨の折れる方法に類似した、マウス脳内の高い単一細胞分解能を有する個々のクローンを体系的に標識することができる。CreERT2を駆動するプロモーターのみがクローンMADM標識の細胞型特異性を決定するので、MADMは原則として、任意のマウス器官および組織全体のクローン系統トレースに適用することができる47、50、51、52。47,50,51,52実際、研究は、多様な組織に由来するクローンの系統関係を明らかにするためにMADMを使用しています47,,50,,51,,52,,53,,54,,55,,56,,57,,58,,59.MADM実験パラダイムは、,新皮質7,,,,,,7、11、12、46、60、61、62、63、64、6511,12の皮質投影ニューロン、グリア、および出生後幹細胞の系統を研究するために適用されてきた。46606162636465MADMはまた、成体のデンテート回、視床、小脳顆粒細胞、およびクローンレベルのインターニューロンにおける細胞系統を研究するためにも使用されてきた(完全なリストについては表1を参照)47、53、54、56、57、66。47,53,54,56,57,66
MADMのユニークな特徴は、1つのMADMカセットに遠位の突然変異を遺伝的に連結する機能であり、それによって遺伝的モザイクを作成する(図1Bおよび図2)。この結果、一方の蛍光マーカー(図1BのtdT)で標識された野生型のドーター細胞と、他方のホモ接合変異体兄弟(図1BのeGFP)が標識されていない異種性環境で生じる。MADMは、制御と変異サブクローンの比較分析が生体内の同じ組織環境で行うことができるという中でユニークである。もともとMADMカセットはRosa26遺伝子座47に標的化されたが、遺伝子機能のMADM分析は遺伝子の遺伝子に限定されていた。この制限を(少なくとも部分的には)克服し、MADMベースの遺伝子分析の可能性を拡大するために、MADMカセットはChr.751、Chr.1146、およびChr.1251の中心に近いところにノックされました。MADMカセットを搭載した19個のマウスオートソームすべてを標的にすることは進行中であり、将来的に事実上あらゆる遺伝子を研究することを可能にし、機能的遺伝子解析と組み合わせた発達系統関係の研究のための比類のないプラットフォームを提供する。
プロトコル
マウスプロトコルは、ISTオーストリアの機関前臨床コア施設(PCF)および内部倫理委員会によって審査されました。すべての繁殖と実験は、オーストリアとEUの動物法に従ってオーストリア連邦科学研究省によって承認されたライセンスの下で行われました。
1. MADMクローン解析用の実験用マウスの育種
- 時間指定実験 MADM 交配をセットアップする (>P56;CD-1)午後遅く(午後5時)に、経膣のプラグが進行する朝(午前8時)をチェックします。プラグが存在する朝は 0.5 日としてカウントされます。実験的なマウスの交配設定の概要については、図 2を参照してください。CreERT2活性および分析のTM誘導のタイムポイントが実験問題に対応するのに適切であることを確認します。
注: 詳細については、図 3と下記の代表的な結果を参照してください。 - 出生後サンプリングでは、並行して里親を生成するために繁殖を設定します。
注意: これらは、実験用の繁殖を設定する前に、1-2日まで開始する必要があります。
2. MADMマウスにおけるTM誘導
- コーンオイルに15mLまたは50mL円錐遠心管に溶解し、室温(RT)で〜4時間のロッキングプラットフォームに置き、TMが完全に溶解していることを確認して、20mg/mL TMの作業溶液を調製します。アルミホイルで覆われた4°Cで作業溶液を保管し、2週間以内に使用してください。
- MADMの再結合イベントを誘導するために、1 mLの結核菌注射器と25G針を用いて、TMの腹腔内(IP)を時当たりの妊娠ダムに注射する。皮質神経新生の段階に応じて、E10-E15間のTMを1-2 mg/妊娠ダムの用量で注入してください。早期の時点(E10)の場合、妊娠11の間の合併症を予防するために最大1mg/妊娠ダム(25mg/kg)を使用する。E11-E15間のタイムポイントは2mg /妊娠ダム(50mg /kg)7を使用してください。
注:あるいは、TMは後期妊娠のための経口ギャージで投与することができる。 - MADMクローン解析で出生後のタイムポイントを解析するには、帝王切開を通じてE18-E19で生きた胚を回収し、養母と一緒に子犬を育てます。
注:妊娠中の女性の健康状態によっては、帝王切開を行う必要はないかもしれませんが、元のTM治療を受けた母親が授乳に問題を抱えている可能性があるため、里親と一緒に子犬を育てる必要があります。 - 帝王切開で生きた胚を回収するか、または分析のために胚のタイムポイントを取り出すために、子宮頸部脱臼によって妊娠したダムを犠牲にする。
- 動物をサピーヌの位置に置き、70%エタノールで毛皮を消毒します。外科的鉗子とはさみを使用して、子宮の上腹部の皮膚に小さな切開を行います。腹膜を明らかにするために筋肉と腹筋壁を通して第二の切開を行います.
- 周囲の組織からはさみで切り離して子宮を取り除きます。インタクトな子宮を温水で満たされた手袋に移し、それぞれが羊膜から個別に取り除かれるまで胚生存率を高める。
- 細かい先端のはさみと指を使用して、子宮壁を慎重に開いて胚を放出します。大きな失血を防ぐために、臍帯を体の近くに切りすぎないでください。胚を分析に使用する場合は、ステップ3.9に進みます。子犬を育成する場合は、ステップ2.8に進みます。
- 養育が必要な場合は、子犬を養母に移す前に子犬を清掃してください。子犬を掃除しながら、時々胸を軽く押して呼吸を開始します。生存率を向上させるために、暖かい水で満たされた第二の手袋に戻します。
注:残りの羊膜や胎盤をペーパータオルで静かに取り除く必要があります。 - 子犬を里親に移す前に、ケージから里親を取り除き、元の子犬を取り除き、実験的な子犬に置き換えてください。里親をケージに戻します。
注: 受け入れ率の促進を改善するための追加の提案については、ディスカッションを参照してください。 - ジェノタイピングが必要な場合は、P6-P8間のつま先または尾の生検を収集します。
注: この手順は、動物実験ライセンスがこの実習を承認した場合にのみ実行してください。
3. MADM クローンの脳内組織準備
注:出生後組織(≥P4)を含む実験の場合は、ステップ3.1に進みます。胚のタイムポイントと早期出生後(P0-P3)の場合は、ステップ3.9に進みます。
- ケタミン/キシラジン/アセプロマジン溶液(それぞれ65mg、13mg、および2mg/kg体重)のIP注入で実験MADM動物を麻酔し、後足をつまんでマウスが反応しないことを確認します。
注: 男性と女性の両方の MADM マウス (CD-1 バックグラウンド) は、分析に使用されます。ジェノタイピングが必要な場合は、この時点で耳の生検を収集します。 - 麻酔動物を灌流手術トレイの上のスペイン位置に置き、70%エタノールで毛皮を消毒します。手術を開始するには、皮膚の外層を通してハサミと外科用鉗子で切開し、筋肉層を通して2回目の切開を慎重に行います。胸骨の先端を持ち上げ、肝臓を切断しないように特別な注意を払って、側面の結合組織を切断します。胸腔が見えます。
- 横隔膜を切り取り、心臓を明らかにするために持ち上げます。慎重に心臓を露出させるために外科用トレイにリブケージとピンをトリミングします。子犬の場合は、リブケージを完全に取り外します。
- リン酸緩衝生理食塩液(PBS)の針を左下心室(paler組織)に挿入します。小さな虹彩はさみを使用すると、血液が排出される右心房(暗赤色組織)の後端に切開を行う。
- PBSですぐに作りたての氷冷4%パラホルムアルデヒド(PFA)での灌流を行う。子犬(P4-P10)の場合は、注射器を使用して灌流を行います。1つの注射器を10mLのPBSで満たし、もう1つは4%PFAの10 mLで満たします。シリンジ内のすべての気泡が取り除かれていることを確認します。古い動物の場合は、蠕動ポンプを使用してください。
- PBS(子犬では2-4 mL/分で10 mL、蠕動ポンプを使用する大人の場合は4-6 mL/minで20 mL)でパーファを開始します。針が正しく配置されていれば、肝臓は透明になり、淡い黄色になります。
- 完成したら、子犬から針を取り出し、PFAを含む針を同じ穴に挿入します。成人の場合は、PBS溶液を氷冷PFAと交換する前に蠕動ポンプを停止し、取り込みチューブの泡を避けるようにしてください。PFA(子犬の場合は2-4 mL/minで10mL、蠕動ポンプを使用する大人の場合は4-6 mL/minで30 mL)を再開します。
- 灌流が完了したら、マウスの首を切り落とし、慎重に解剖して脳を取り除く。4%PFAに脳を移す。少なくとも5倍の脳容積(すなわち、15 mL円錐形遠心分離管のPFAの5-10 mL)を使用し、組織の完全な固定を確実にするために、4°Cで一晩インキュベートする。ステップ 3.10 に進みます。
- 胚組織および出生後初期組織(すなわち、P0−P3)については、帝王切開を行った後、胚をはさみで切断する。ジェノタイピングが必要な場合は、この時点で胚の尾部を収集します。すぐに脳を解剖し、4%PFA/ウェルの2-3 mLを含む12ウェルプレートに移す。4°Cで一晩インキュベートして後置きする。
- 翌朝、PFAをPBSの10 mL(成体)または2-3 mL(胚)と交換し、RTで15分間3倍の洗浄を繰り返します。
- 脳を埋め込み型に最適な切断温度(OCT)化合物に埋め込み、コロナまたは矢状の切断のために脳を向くように注意してください。OCT が完全に不透明になるまで、埋め込み金型をドライアイスに配置してフリーズします(10~15 分)。さらに使用するまで-80°Cで組織を保管してください。
4. 免疫組織化学のためのMADM組織の調製
- 凍結し始めると、ディスクにOCTのリングを適用し、ブロックをOCTに直接配置することによって、クライオスタットの標本ディスクにティッシュブロックを取り付けます。ブロックが目的の切断面に正しく向けられていることを確認します。
注: ここでは、皮質MADMクローンを調査するためのコロナ断面について詳しく説明します。 - クライオスタットのブロック温度を-20°Cに、ブレード温度を-21°Cに設定します。
- 標本ディスクを標本ホルダーに取り付けることでチャンバー温度に調整し、切断を開始する前に、組織ブロックを約5分間凍結スタットに残します。
- 目的の組織領域に到達するまで、厚いセクション(45-60 μm)でブロックをトリムします。
- 皮質の縁がはっきりと見えたら、切断を止めてブレードをロックします。ブロックをトリミングする前に、ブレードがシールドされていることを確認してください。
- 骨を持つ組織を囲む余分なOCTをトリミングし、脳の全ての側面に1-2mmのOCTを残します。
- 次に、皮質の横端の1つが下方に向き、もう1つが上向きになるようにブロックを向けます(すなわち、皮質の最も多い鼻の縁が右に向いています)。
- 成体クローンの場合は45μm、胚クローンでは30μmの厚さで切り離し始めます。各セクションを個別に実行し、小さなブラシを使用して、ブロックをトリミングしながら残された破片のナイフの下の領域をきれいに保ちます。
注: この処理を行わない場合、セクションが落ちると、スライスの正しい順序を判断することが困難になる場合があります。 - セクションがカールし始めた場合は、ブロックの端をトリミングしたり、ガラスのアンチロールプレートを慎重に調整します。
- 胚性クローン分析の場合は、セクションをフロストスライドに直接取り付けます。37°Cの加熱プレートで乾燥してから、ステップ5.6に直接進みます。
注: 1 つのスライドに複数のセクションを追加できますが、順番に並べ替えが維持されるようにします。 - 成虫クローンを収集するには、1 mLのPBS/well(通常、脳あたり5-6プレート)を含む24のウェルプレートを準備します。最初の井戸から始めて、コールド鉗子で切り離す順序でPBSの個々のシリアルセクションを集める。
注:フローティングセクション法は、セクションが見逃されていないことを確認し、マウントされたセクションにしわが含まれていないことを保証するために、成体組織に採用されています。 - 新皮質の終わりに達したら、切除を停止します。
- 成体クローンの場合は、フローティングセクションの取り付けに進みます。
注:セクションは、最大24時間4°CでPBSに保管することができます。
5. イメージング用の成体組織の取り付け
注:次のツールが必要です:小さな塗料ブラシ、ペトリ皿、PBS 0.5%トゥイーン(PBS-T)、接着スライド(材料表)、取り付け媒体(材料表)、カバーリップ、鉗子。
- ペトリ皿にPBS-Tを入れます。
注意:洗剤は、取り付けプロセスの助けに使用されます。洗剤に敏感な追加の抗原(すなわち、糖タンパク質)の染色が必要な場合は、Tweenの添加をスキップするのが最善です。 - 貼着スライドをPBS-Tに入れ、ラベルに覆われるようにします。
- 最初のセクションを PBS-T に移します。
- 小さなペイントブラシを使用して、スライド上のセクションを操縦し、切断の順序を維持するためにそれを配置します。これ以降のすべてのセクションで同じ方法で進めます。
- すべてのセクションが配置されたら、スライド(〜12~16セクション/スライド)を暗いスライドチャンバーに配置します。蓋を少し持ち上げて、セクションを完全に乾燥させます(〜10〜20分)、後続のステップで付着した状態を保ちます。
- 追加の抗原に対して免疫染色を行う場合は、セクション6または7に直接進む。
注意:胚のタイムポイントについては、少なくともGFPおよびtdT(セクション6)に対して免疫染色手順を実行する必要があります。成体クローンの場合、これは、追加の抗原を並行して染色する場合にのみ必要です(セクション6および7)。 - 水分補給し、残留PBS-Tを除去するために5分間1xPBSでセクション1xを洗浄します。スライドに、1x PBS(1 μg/mL)で希釈した4′,6-ジミジノ-2-フェニリンドール(DAPI)の~1 mLを塗布し、すべてのセクションを覆い、15分間インキュベートします。
- DAPIを慎重に取り出し、1x PBSで1xを5分間洗い、110μLの取り付け媒体に埋め込む前に、余分なPBSを取り除き、約1〜2分間乾燥します。24 x 60 mmのカバースリップでシールし、イメージングの前に少なくとも3時間乾燥させます。
6. GFPおよびtdTのみの免疫染色
注: このセクションは、胚性クローンに必要です。
- 加湿スライドインキュベーションチャンバーに水平にスライドを配置します。必要なバッファーの量を最小限に抑えるために、ワックス マーカーでスライド境界をマークします。
- 1x PBSで水分補給セクション。染色品質を向上させるために、切り離された新しい組織で作業します。
- スライドごとに250-400 μLのブロッキングバッファ(0.5%トリトンX-100、1x PBSで2-3%ノーマルロバ血清)を追加し、すべてのセクションがカバーされていることを確認します。1時間インキュベートする。
注:一部の抗原は他のものよりも洗剤に敏感であるため、洗浄剤(Triton X-100またはTween-20)の濃度は、使用される追加の一次抗体によって異なります。 - ブロッキングバッファを取り外し、ブロッキングバッファ内の一次抗体をスライドに追加します(300-400 μL/スライド)。
注:抗GFP/抗tdT(MADM)の標準的な一次抗体反応の例は、チキン抗GFP(1:500)とウサギの抗RFP(1:500)を使用することができます。 - 一次抗体を4°Cで一晩インキュベートする。
注:スライドは、すべてのセクションをカバーするバッファで完全に水平にインキュベートする必要があります。それ以外の場合は、不均等または汚れが悪くなる可能性があります。 - 翌朝、一次抗体を持つブロッキングバッファーがスライド上のすべてのセクションをカバーしていることを確認します。それでない場合は、RTで3-4時間のインキュベーションステップを繰り返します。
- 一次抗体を除去し、RTで10分間1x PBSで4倍洗浄します。
- ブロッキングバッファーで希釈した二次抗体をスライド(300-400 μL/スライド)に加える):アレクサFluor 488抗鶏IgG(1:500)およびCy3抗ウサギIgG(1:500)
- 2時間RTでインキュベートし、蛍光色素の漂白を防ぐために、スライドを光から覆いておいてください。
- 二次抗体を取り除き、10分間PBSで2倍洗います。
- DAPIをPBS(1:5,000)で15分間希釈してインキュベートします。
- 1x PBSで10分間洗浄します。
- 110 μLの取り付け媒体に埋め込む前に、余分なPBSを取り除き、約1〜2分間乾燥します。
- 24 x 60 mmのカバースリップでシールし、イメージングの前に少なくとも3時間乾燥させます。最適なシグナルを確実にするために免疫検査を行った後、1~2週間以内に画像スライドします。
7. GFP、tdT、および追加抗原の免疫染色
- ステップ 6.1-6.3 を実行します。
- ブロッキングバッファを取り外し、ブロッキングバッファ内の一次抗体をスライドに追加します(300-400 μL/スライド)。
注:3つ以上の抗原(すなわち、GFP、tdT、および目的タンパク質)の染色と目的タンパク質の抗体をウサギで上げた場合、抗tdT(ヤギ)一次抗体を1:500の希釈で使用することが推奨されます。代替tdT染色を伴う3つの抗原に対する一次抗体反応の一例は、抗GFP(1:500)、ヤギ抗tdT(1:500)、および目的のタンパク質(ウサギ)に対する抗体を使用することができる。 - ステップ 6.5-6.7 を実行します。
- ブロッキングバッファーで希釈した二次抗体ミックスをスライド(300-400 μL/スライド)に追加する:アレクサFluor 488抗鶏IgG(1:500)、Cy3抗ヤギIgG(1:500)、アレクサフルオール647抗ウサギIgG(1:500)。
- ステップ 6.9-6.14 を実行します。
8. MADMクローンの共焦点画像取得と定量化
- クローンと皮質内のそれらの位置を含む脳のセクションを識別し、文書化します。
注: クローンが使用するセクション数は、クローンが誘導された時期、CreERT2ドライバ、および分析の時間によって異なります。このステップは、共焦点顕微鏡または蛍光顕微鏡のいずれかで行うことができる。 - 反転共焦点顕微鏡を使用して、正しいレーザーラインとフィルタを選択して構成します。MADM脳の場合は、DAPI、GFP、およびtdT(励起:358 nm、488 nm、554 nm、それぞれピークエミッション:461 nm、507nm、581 nm)を選択します。最適なイメージング品質を実現するため、ピンホールが 1 つの風通しの良いユニットに設定されていることを確認します。
- 共焦点固有の設定では、20x の目的と 1 倍のズームを持つイメージ クローン。定量に使用する画像の場合、平均化なしで、1.52-2.06 μs(画像取得ソフトウェアでは値 7-8)のスキャン速度ピクセルの位取り値を使用します。必要に応じて、各チャンネルのレーザー強度とゲイン設定を調整します。
注: 必要な画質に応じて、スキャン速度と平均化の設定が異なる場合があります。 - クローンが明確に識別されたら、クローン内のすべての関連セクションをカバーするようにイメージングタイルを配置します。クローン内のすべてのMADMラベル付きセルが1.5 μm/zスタックスライスの間隔でキャプチャされるようにZスタックを調整します。タイル領域を調整して、クローンをイメージングする際に皮質の全幅がキャプチャされるようにします(すなわち、パイル表面から脳梁まで)。
- 連続して複数のセクションにまたがる個々のクローンを画像化し、クローン内のセルを持たないセクションを、3D再構成およびセル空間情報の正しい解釈のために画像化します。
- MADMクローンの細胞を含む各セクションを、野間の尾部から尾端まで順次分析する。個々のニューロンとグリアを、その形態および/またはマーカー染色に基づいて区別する。核染色(DAPI)によって定義されたそれぞれの層境界に基づいて、位置情報を並列に記録する。
注: 胚分析の代表的な結果については図 4を、成人分析の代表的な結果については図 5を参照してください。
9. クローンのシリアル3D再構成
注:シリアル脳セクションで画像化された個々のクローンの3D再構築は、視覚的な表示だけでなく、3Dクローンアーキテクチャの分析に役立ち、次の手順に従って実行できます。
- 画像取得ソフトウェアを使用して、取得パラメータに基づいて、共焦点タイル画像をステッチおよびヒューズします。.czi ファイルを開き、ZEN ソフトウェア (Zeiss) の[処理] タブでスティッチ法を実行します。
- ステッチされたイメージ スタックを個々の Z 平面として TIFF 形式で書き出します。ステッチされた .czi ファイルを開き、[処理] タブでイメージエクスポート方法を実行します。マルチチャンネル画像の場合は、後続の画像処理のために赤/緑/青画像として書き出します。
- クローンのシリアル脳セクションごとに手順 9.1 と 9.2 を繰り返します。
注: 正確な 3D 再構成のために、ラベル付き細胞を含まないクローン内のすべての脳セクションも処理する必要があります。 - ImageJ/Fiji67,68,68などのオープンソースの画像処理ソフトウェアを使用して、最も多くの rostral から最も大きな大体 z プレーンまでの順に個々の画像を単一のスタックに連結します。
注: 各脳セクションの端にある空白の画像は、この時点で削除する必要があります。 - 必要に応じて、手順 9.5.1-9.5.5 に従って、"MultiStackReg"という名前の ImageJ プラグインを使用して、手順 9.4 から取得したイメージ スタックを修正します。イメージの配置が不要な場合は、手順 9.6 に進みます。
注:このプラグインは、最も高いコントラスト(通常はDAPI)でチャンネルの画像のアライメントを実行し、その後、マルチチャンネルスタックの信頼性の高い画像のアライメントを可能にする、他のチャンネルに記録された変換を適用します。"TurboReg"という補助プラグインがプレインストールされている必要があります。- ImageJ で、 "MultiStackReg" および "TurboReg" プラグインをインストールします。
- 手順 9.4 から取得したクローン イメージのイメージ スタックを開いて整列させます。[イメージ] タブの [色] オプション内で、チャネルを DAPI (青)、GFP (緑)、および tdT (赤) に分割します。
- "MultiStackReg"プラグインを実行して、DAPI チャネルを "リジッド ボディ" 変換で整列させ、変換ファイルを保存します。
- 保存した変換ファイルを"MultiStackReg"を使用して他の 2 つのチャネルに適用します。
- 3 つの整列されたチャネルをすべて結合し、整列したスタックを保存します。
- ImageJでクローンを向けるには、ステップ9.4(または配置後のステップ9.5.5)から得られたクローン画像のスタックを、上部に円膜面を、底部にコーパス梁を持つ垂直方向に回転させます。必要に応じて、xy 平面でトリミングします。
- 定性的な表示と定量分析の両方で、最大 z 投影イメージを生成するか(ステップ 9.8)、またはクローンの 3D レンダリング(ステップ 9.9)を実行します。
- ImageJ で、ステップ 9.6 からイメージ スタックを開き、投影タイプの最大強度の Z 投影オプションを選択します。これにより、同じ平面上に投影されたクローン全体のイメージが生成されます。
- ImageJ で、ステップ 9.6 からイメージ スタックを開き、3D Project Z 関数を選択して、回転可能なクローンの 3D ビジュアライゼーションを生成します。
注: この手順では、イメージ取得時に個々の Z スタックの厚みと同じ正しいスライス間隔を入力することが重要です。補間ツールは、スライス間のギャップを除去するために使用する必要があります。
結果
MADMは、G2-X染色体分離事象の際に2つの蛍光タンパク質のうちの1つを発現する2つの娘細胞を有する機能性緑色および赤色蛍光タンパク質の再構成をもたらす(図1A)。MADMイベントは2つの子孫系統の永続的かつ明確な標識をもたらすので、緑と赤の娘細胞系統(サブクローン)の定量可能な評価を行うことができる。元の前駆子の除算パターン(例えば、対称対非対称)および電位(例えば、子孫の数)を含む変数を決定することができる。 蛍光標識サブクローンの各々を定量化することは、元の前駆細胞がTM誘導時に対称増殖分裂、または非対称的な神経原性分裂を受けているかどうかをさかのぼって判断する際に有益である。これまでの研究では、Emx1-CreERT2またはNestin-CreERT2は、皮質中の興奮性プロジェクションクローンを2つの広いクラス7、11、4611,46にグループ化した。7最初の「対称増殖クローン」と呼ばれるものは、かなりの数のニューロンの平均で構成され、緑と赤の両方のサブクローンがそれぞれ4つ以上のニューロンを含む。第2のグループである「非対称クローン」は、「少数派」サブクローンが3つ以下のニューロンと「多数派」サブクローンを含むクローンのクラスを定義する。4つ以上の11個。これらの定義は皮質RMPに特異的であり、他の脳領域および組織のために再検討する必要があるかもしれない。皮質クローンの両方のクラスでは、子孫は表面的および深い層全体に分布する。
MADMクローン研究を設計する際には、考慮しなければならないいくつかの側面があります。TMの投与によってMADM事象が誘発される時間は重要な考慮事項である(図3)。E10での皮質興奮性投影ニューロンMADMクローン(すなわち、Emx1-CreERT2またはNestin-CreERT2を使用する)については、ほぼすべてのRRPがまだ対称的な分割を受けていた11。したがって、TMを有するE10での誘導は、増殖RGP増幅の複数のラウンドをキャプチャし、高いニューロン数を持つクローンをもたらした。しかし、E10でのRGPの数は一般的に少なく、したがってTM投与は非常に少数のMADMイベントを生成した(時には脳あたり1つ未満)。RMPの大半は、E12の周りで対称から非対称神経原性部門に切り替えました。厳密に非対称神経原性クローンを標的とするためには、E12以降で誘導するのが最善であった(図3)。TM誘導と皮質におけるMADM再結合事象の観察までの間の時間は24時間未満である傾向があった。また、2つの理由でTM用量を最小限に抑えることも重要です。まず、MADM再結合率が増加した場合、複数の、おそらく重なり合う、クローンを誘導する確率が高くなる。第二に、あまりにも多くのTMが送達された場合、中絶の増加率、胚の再吸収、および小さなごみサイズが観察される可能性がある。TM注射がE10で送達された時、全ての妊娠ダムの約半分で中絶が観察された。この周波数はE11以降に減少し、中止する妊娠ダムの約1/3に減少しました。以前の MADM 研究で使用された TM 用量、誘導時間、および CreERT2ドライバの概要については、表 1を参照してください。TMの不在時のレポーター活性は、いくつかのTM誘導性CreERT2ドライバ69で観察された。TMの存在しない場合の異所性発現またはMADM再結合イベントは、ネスチン-CreERT2ドライバのEmx1-CreERT2では観察されなかった。これは、TM媒介染色体トランスコンビネーションがシス・リコンビネーションよりも約1:1,000から1:10,000低い周波数で起こり、異所性MADM標識の確率を低下させるという事実に部分的に起因する可能性があります。
MADM クローン解析実験を計画する際に考慮すべきもう 1 つの要因は、研究の期間です。TM誘導と実験を分析した時間(A)の間の時間の長さを変化させる(時間枠)は、時間64に対する幹細胞のダイナミクスを表示する。短い胚の時間枠(すなわち、TM/E11-A/E13;TM/E11-A/E16)は、胚性神経新生のダイナミクスを捉えた(図4)。2つ以上の時間枠からクローンを比較すると、生産される細胞の数と、系統進行の異なる段階でのニューロン分布の変化に関する定量的な洞察が得られる64.個々のクローンの可能性全体を捉えるためには、分析した時間枠を出生後または成人のタイムポイント77、11、1211,12に拡張する必要がある。胚で誘導され、成体で分析された新皮質クローンの例を図5に示す。注目すべきは、皮質神経新生はほとんど完了し、E17によって多発性が増加する。約1/6神経原性RGPもまた、アストロサイトおよび/またはオリゴデンドロサイト11の生成に進む。
対称クローンは、RRP が 1 回以上の増殖分割11を受けると発生します。E10-E12の間に誘導されたRGPクローンは、平均してサイズが大きく、最終的なニューロン分布のより多くの空間的特徴を提供した(図4A-C)。深層および表面層全体に比較的均等に分布するニューロンを有するクローンは「円柱」形状をとり、ニューロンを持つクローンは深層よりも表面層に分散し、「円錐」形状11を開発した。クローンの空間的情報や形態学的情報を完全にキャプチャするには、逐次画像を用いて各クローンを計算的に再構築する必要があった。クローン分散を測定するために、クローンの表面層(LII−VI)における最大横分散(全次元で測定)を、深層(LV/LIV)におけるニューロン分散と比較した。この比率(分布上:分布下)は、クローン形状全体の定量可能な読み出しを提供した。
非対称クローンは、少数サブクローンが3以下であったが、単一のRGP(図4D-Fおよび図5A−F)7、11、127,11の神経細胞出力に関する洞察を提供した。A-F大多数の集団(大きなサブクローン)は赤または緑色で標識することができ、Emx1-CreER T2またはNestin-CreERT2(図5GG)7、11、12を使用して誘発された場合7、11,12クローン当たり平均約7個のT2興奮性予測ニューロンを有する。MADMクローン内の細胞の総数は、表面層および深層にわたる大きなサブクローン内のニューロンの分布を分析することによって、さらに解剖することができる。少数集団(小サブクローン)は相互色でラベル付けされ、クローン当たり平均1-2細胞であった(図5H)。平均8-9ニューロンであった「単位サイズ」の合計は、小さなサブクローンと大きなサブクローンを一緒に加えることによって計算することができた(図57I)7、11、12。11,12IRGPの神経細胞の出力は非常に予測可能であったが、クローン異質性の程度があったことに注意することが重要である。70
MADMカセットに遠位変異を導入することで、遺伝的モザイクを生成することができ、幹細胞系の進行の分子調節因子を解剖する独自の方法を提供します。したがって、MADMは、遺伝子の細胞自律機能(例えば、小頭症またはマクロセファリーとの関連)を研究するための比類のない実験的プラットフォームを提供する。MADM遺伝的モザイクで誘導されたクローンをコントロールMADMで誘導されたクローンと比較することにより、ニューロン数と分布の変化の高度に定量的な読み出しを生成することができます。これまでのMADMベースの研究では、クローンレベルでの小頭症形成におけるOtx1の細胞自律機能を定量化した(代表的な例については図6A-Eを参照)11。別の研究では、MADMクローン解析は、Ndel1が細胞自律的に投影ニューロン数を調節するのではなく、新生児ニューロンが皮質プレート内に入ったり移動したりする能力を示し、後に成体皮質46を形成する。これらの研究は、皮質の発達を調節する遺伝子の細胞自律機能を研究する際にMADMクローン解析の高度に定量的な性質を実証した。現在、マクロセファリーに関与する遺伝子をクローンレベルで研究するためにMADMを使用した文献には例がない。しかし、将来の研究では、一般的に皮質のサイズの制御に関連する遺伝子の分析は、分子および細胞レベルで非常に望ましい洞察を提供することができます。

図1:単一幹細胞レベルにおける系統トレースおよびクローン解析のためのMADM原理(A) MADM を使用して系統トレースおよびクローン解析を実行するには、2 つのコンポーネントが存在する必要があります。まず、MADMカセットは、同一の遺伝子座を同一の染色体に対象としなければならない。カセットは、eGFP(緑色、G)とタンデムダイマートマト(赤、tdT[T])の2つのキメラ蛍光レポーター遺伝子で構成されています。GTカセットは、eGFPのN末語とtdTのC末語を含み、loxP部位を含むイントロンで分離する。TGカセットは逆に構築され、tdTのN末語とeGFPのC末語が付いています。第2に、Creリコンビナーゼの発現は、標的MADMカセットを含む細胞内で起こらなければならない。loxP部位は、クレメディアされた染色体間組換えの標的となり、両方の発現カセットの再構成を同時に行う。細胞周期のG2期に再結合が起こり、その後にX分離(G2-X)が起こった場合、2つの娘細胞は2つの蛍光タンパク質のうちの1つを発現する。(B) 単一クローンレベルでの遺伝的モザイク解析のための MADM 原理。変異アレル(図1Bに示すように、点突然変異、欠失、挿入、loxP横腹条件付き対立遺伝子など)は、Meiotic組み合わせを介してTG-MADMカセットに遠位を導入することができる(図2およびヒッペンマイヤーら46はMADM系に変異対立遺伝子を導入する方法の詳細については46)。G2-X Creリコンビナーゼ媒介性染色体インターコンビネーションがMADMカセット間で起こると、対象遺伝子に対して1つのGFP+ホモ接合突然変異細胞(GeneX-/-)が生じ、非標識ヘテロジーゴグ環境で,47,1つのtdT+ホモzygous野生型細胞(GeneX+/+)が生じる。クローン解析で使用されない代替標識結果(すなわち、黄色の細胞)は、前に詳細11、46、4746,47に記載されている。11この図の大きなバージョンを表示するには、ここをクリックしてください。
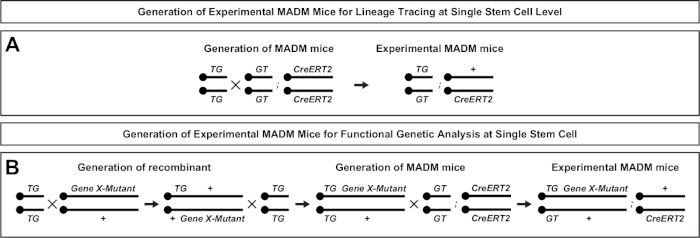
図2:系統トレース用の実験MADMマウスの生成のための育種スキーム。コントロールMADM(A)および遺伝子X MADM(B)のクローン分析Bのための実験的MADMマウスの生成のための繁殖スキーム。MADMの繁殖パラダイムの詳細については、 Beattieら7およびヒッペンマイヤーら7,,46を参照してください。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3: MADMベースのクローン系統解析のための時間経過パラダイム実験設計のタイム ウィンドウの概略図。縦方向サンプリングパラダイムの場合、クローン誘導のタイムポイントは一定のままで、分析前の時間は変化しました。プログレッシブインターバルサンプリングでは、分析の時点は一定のままでしたが、誘導時間は変化しました。対処する質問に応じて、一方または両方のアプローチの組み合わせを使用できます。この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:現像および成人新皮質におけるMADMクローン分析TM媒介MADMクローン誘導は、RRPを分けて対称増殖(E10におけるTM)(A-C)および非対称神経原性(E12のTM)(D-F)で誘導する。 現像(TM/E10-A/E16およびTM/E12-A/E16)および成人(TM/E10-A/P21およびTM/E12-A/P21)(C,F)の開発中の個々のB,EC,FA-CD-FMADMクローンが現像されています。 GT/TGネスチンクリーアーT2+/- (B,E) およびMADM-11GT/TG;Emx1-CreERT2+/- (C,F)。ニューロン出力はサブクローン色と無関係であり、制御条件77,1111の下で赤い多数派/少数サブクローンと比較することができた。成体クローンの約1/6には、白いアスタリスクで示されるアストロサイトおよび/またはオリゴデンドロサイトも含まれていた。パネルBとFはそれぞれヒッペンマイヤーら46とルーランズとサイモンズ72の許可を得て再現されています。CP = 皮質プレート。この図の大きなバージョンを表示するには、ここをクリックしてください。
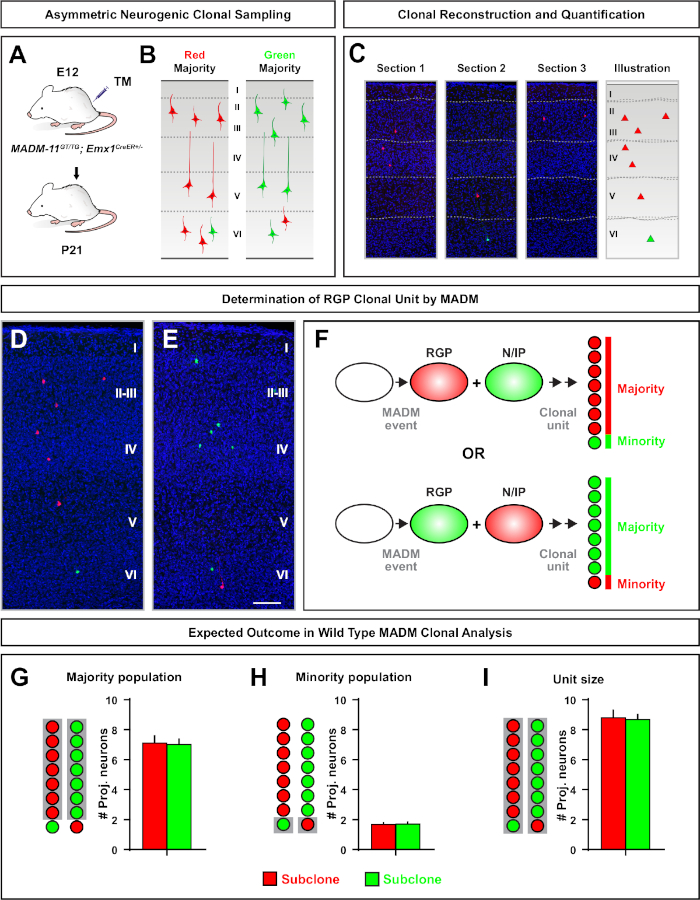
図5: RGP媒介ニューロンの出力を定量化するMADMクローン解析MADM,7,11を用いたクローンレベルでの個々の神経原性RMPによる興奮性ニューロン(単位7)産生の解析()開発中の皮質においてほとんど非対称MADMクローンを誘導するための実験的パラダイム。(B) 緑色または赤色のいずれかのサブクローンで標識された大多数のサブクローンを伴う不斉クローンの結果の可能性 (C) 単一の神経原性非対称クローン(D,E)代表の非対称 G2-X MADM クローンの 3D 再構成画像 (D) または緑色 (E) MADM-GT/TGGT/TGの過半数の集団Emx1-CreERT2+-とE12でのTM誘導、P21での分析。緑と赤の両方のラベル付きセルは野生のタイプであることに注意してください。(F)2つの実験MADMクローンの結果を示す回路図。(G) MADM-11 クローンでの RGP の更新から生じる大多数の集団のサイズの定量化。(H) MADM-11 クローンでの RGP の更新から生じる少数集団のサイズの定量化。(I) 非対称神経原性MADM-11クローンの単一サイズの定量化。仮説値は、平均値 ±SEM. スケールバー = 100 μm(DおよびE)を表す可能性があります。TM = タモキシフェン。この図の大きなバージョンを表示するには、ここをクリックしてください。
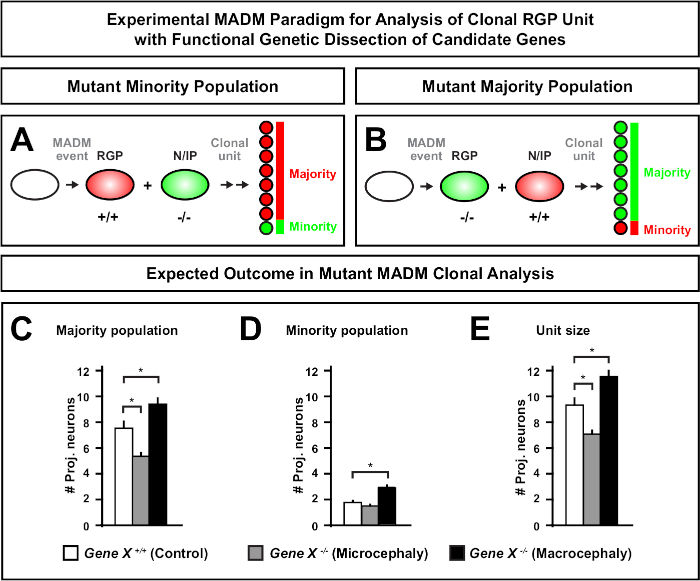
図6: 小頭症やマクロ頭症に至る遺伝子を研究するためのMADMクローン解析小頭症またはマクロ頭症を引き起こし得る遺伝子の機能的な遺伝子解剖を行う場合、仮MADMクローン解析結果。対象遺伝子の細胞自律機能を解剖するためには(Gene X)、変異型対立遺伝子をMEIotic組み合わせによってMADMカセットに遠位導入する必要がある(詳細については、MADM系,に変異対立遺伝子を導入する方法については、図2、Hippenmeyerら46、およびLaukoterら46)。(A,B)クローンRGP単位の機能解析のための実験MADMパラダイムを示す模式図。変異サブクローンは、少数派(A)または過半数(B)集団を形成することができる。(C-E)仮MADMクローン分析は、コントロールMADM(白色バー)、遺伝子-X MADM小頭症(灰色のバー)および遺伝子-X MADM MADMマクロセファリーブラックバーを定量する場合に結果を示す非対称クローンである。(C) 大多数の人口のサイズの定量化。(D) 少数民族の規模の定量化。(E) 非対称神経原性クローンのユニタリサイズの定量化仮説値は、サブクローン細胞数の差が制御に対して有意性に達する可能性がある平均±SEM. S = 仮説シナリオを表す可能性がある。この図の大きなバージョンを表示するには、ここをクリックしてください。
表1: 文献におけるMADMクローン研究MADMクローナル系統実験を含む文献における研究の概要は、使用されるCreERT2ドライバ、TM用量、および注射の時間を含む。こちらの表を表示するには、ここをクリックしてください (右クリックしてダウンロードしてください)。
ディスカッション
現像新皮質における生体内の個々のRRPの細胞系統を追跡するためにMADMを用いた方法が記載されている。TM誘導性CreERT2と組み合わせると、MADMイベントを正確にタイミングを計ることができ、単一細胞レベルでの幹細胞分割パターンの高度で定量的な視覚的読み出しを提供します。送達されるTMの用量を評価することにより、理想的な状況では、皮質半球当たり1クローン未満の平均が得られ、個々のクローンを明確に区別するための十分な空間分離を提供することができる。組織の完全性を維持することにより、この方法はまた位置、形態、および絶対細胞数に関する必須情報を取り込む。MADM カセット Chr. 117,,11,12,46,56,57, Chr. 751, そしてRosa2647,,53,,59のオリジナル MADM は MADM クローン解析研究で使用されています。個々の細胞の高解像度は、形態と娘細胞のクローン関係の両方に前例のない洞察を提供し、増殖幹細胞および新興クローン46,52,52のライブイメージングを可能にする。
帝王切開および出生後タイムポイントにおけるクローンの分析のための子犬の育成は、プロトコルにおいて必要かつ重要なステップである。TM治療済み妊娠ダムの健康状態によっては、帝王切開を行う必要がない場合があります。しかし、TM治療を受けた母親は授乳に苦労する可能性があるため、里親と一緒に子犬を育てる必要があります。異なるCreERT2ドライバを使用して育成する必要性に違いは見られていません。MADMラインと里親の両方が、上達したCD-1のバックグラウンドで維持されています。帝王切開が必要でない場合、実験用子犬を生成するために使用されるTM処置の妊娠ダムは、3Rの原則に従って追加の実験的繁殖のために再利用することができる(これは、動物実験ライセンスがこの慣行を承認した場合にのみ行うことができることに注意してください)。里親は出産後2日以内に子犬の育成に使用できるが、里親が里親を産むのと同じ日に出産すると成功率が高いことが観察されている。したがって、ステップ1.1で実験的な交配と並行して里親のための時取り合いを設定することが重要です。元の里親のごみと同様のごみ番号を維持することは、養育された子犬の生存率を向上させる可能性があるため、元のごみの一部を取り除く必要があります。育成を改善する可能性のある追加のステップは、(手袋の香りを取り除くために)ごみや食べ物で実験者の手袋をこすることが含まれます。帝王切開後に子犬を、養母の汚れたごみや巣の破片で優しくこすりつけます。そして、里親マウスケージに配置する前に、里親の子犬と密接に接触している子犬の配置。
他のレポーターベースの系統トレース方法と同様に、MADMクローン実験に最適なCreERT2ドライバを選択する際には、慎重に検討する必要があります。まず、使用されるプロモーターは、関心のある前駆体集団において時間的および空間的にリコンビナーゼを発現しなければならない。このプロモーターを見つけることは、一部のプロモーターが発現パターンを変更したり、開発の異なる段階で沈黙したりすることがあるため、困難な場合があります。細胞型特異性を改善するために、複数部位特異的リコンビナーーゼが、それぞれ別々のプロモーターによって駆動され、使用されてきた。一方または両方のリコンビナーサが同じ細胞内で発現する場合、これは蛍光レポーター74、75、76、7775,76,で細胞とその子孫にラベルを付けます。74要約すると、分析される前駆者の集団に固有のCreERT2ドライバを選択することが重要です。
この方法で最も重要なステップは、すべての細胞が単一の組み換えイベントから明確に誘導されなければならないので、クローンの同定である(ステップ8.1)。TM濃度の滴定は、脳半球当たりの赤/緑細胞の1つのクラスター未満を保証し、単一のクローンを分析する確率を最大化します (ステップ 2.2)7,,11.対象クローンの500μm以内に細胞の隣接するクラスターが発生した場合、クローンは廃棄する必要があります。したがって、クローンの出現前後のいくつかのセクションを調べて、近くに追加の再結合イベントがないことを確認することが重要です。フルオロフォアのシグナルが弱いため、胚性クローンでeGFPおよびtdTの免疫体化学を行う必要がある(セクション6参照)。これは、追加の抗原がコラベル化される場合にのみ、成体クローンで推奨されます。クローンをイメージングする場合、クローンが配置されている皮質の全幅(すなわち、pial表面から脳梁まで、ステップ8.4を参照)の全幅を捕捉することが重要です。これにより、画像処理時の画像の配置も容易になります(セクション9)。プロトコルのセクション8は、反転共焦点顕微鏡を必要とするが、利用可能な顕微鏡のセットアップに応じて適合させることができる。蛍光顕微鏡は使用できますが、焦点面外からの光汚染の減少につながるため、共焦点顕微鏡が推奨されます。また、レーザーの強度とゲインを調整して、緑、赤、黄色の細胞を明確に識別できることも重要です。設定に関係なく、近くに配置されたセルの完全な空間分離を確保するために、少なくとも 20 倍の目標を使用することをお勧めします。すべての細胞の皮質深度を記録することに加えて(ステップ8.6)、クローンが位置する皮質領域は、アレン・ブレイン・アトラスまたは他の立体的座標マップなどの脳アトラスを使用して同定されなければならない。クローンイメージを容易に識別できるように、ファイル命名パラダイムも採用する必要があります。ファイル命名には、一意の画像ID、撮影した日付画像、動物の遺伝子型、誘導年齢、解析年齢、同クローンからの残りの画像との関連で画像番号の情報を含めることができる。
1つのMADMカセットに位数の変異の導入は、遺伝的モザイク71の生成を独特に可能にし、クローンレベル77、11、46、6211,における系統および細胞型多様性の分子調節因子の解剖を可能にする。46,62MADMを用いて遺伝的モザイクを生成するには、MADMカセットが目的の遺伝子と同じ染色体に精機的にリンクされている必要があります(繁殖スキームの図2を参照)。これは、MADMを用いた現在のクローン解析を、Chr. 751、Chr. 1146、Chr.1251、およびRosa26軌跡47に遠位した遺伝子に制限する。今後の研究では、任意の染色体を標的とするMADMカセットを使用し、クローンレベルでマウスゲノムの事実上すべての遺伝子のモザイク分析を可能にする。
最後に、MADMは、現像新皮質における前駆細胞の分析に限定されない。多くの幹細胞ニッチの研究は、クローン関連細胞の時空間的な配置を解決する能力の恩恵を受けることができる。MADMを脳の他の領域に適用することにより、疾患状態(例えば、癌)、または他の組織47、50、51、52、53、54、55、56、57、58、59の研究は、前駆細胞および幹細胞の多様なクラスに由来するクローンにおける系統関係を明らかにした(MADMalon研究の現在のリストについては表1参照)。47,50,51,52,53,54,55,56,57,58,59MADMのもう一つの興味深い将来のアプリケーションは、クローンから取得できる情報の程度を増加させる追加の機能または細胞内レポーターと組み合わせることです。
開示事項
著者らは開示するものは何もない。
謝辞
ヒッペンマイヤー研究所のメンバー全員に、ISTオーストリアのバイオイメージング施設、ライフサイエンス施設、前臨床施設の皆様に、技術サポートをいただき、ありがとうございました。この作業は、ISTオーストリアの機関資金によって支援されました。R.B.はオーストリア科学基金(FWF)リーゼ・マイトナー・プログラム(M 2416)から支援を受けました。N.Aはオーストリア科学基金(FWF)フィルンバーグ・プログラミング(T 1031)から支援を受けました。GCは、ISTplus博士研究員としてマリー・スクウォトフスカ・キュリー交付金第754411年に基づく欧州連合(EU)のHorizon 2020研究・イノベーションプログラムから支援を受けました。A.H. は、ÖAW DOC (オーストリア科学アカデミー博士課程) から支援を受けました。この研究はまた、欧州連合(EU)のHorizon 2020研究イノベーションプログラム(補助金契約No 725780 LinPro)の下で欧州研究評議会(ERC)によってS.H.に支持されました。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL tuberculin syringe (Omnifix Luer Lock) | Braun | 9204512N | |
| 1,4-diazabicyclooctane (DABCO) | Roth | 0718.2 | |
| 10 mL Syringe (Omnifix Luer Lock) | Braun | 8508429N | |
| 15 mL conical centrifuge | Sarstedt | 65.554.502 | |
| 24 multi-well dishes | Roth/Greiner Bio-one | CE56.1 | |
| 27- gauge x 3/4 needle (Sterican) | Braun | 16010256E | |
| Corn oil | Sigma | C8267-500ML | |
| Coverslips (24 x 60 mm #1) | Thermo Fisher Scientific (Menzel) | 15747592 | |
| Cryostat Cryostar NX70 | Thermo Fisher Scientific | 957000H | |
| Dako Pen (Wax marker) | Agilent | S200230-2 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Invitrogen | D1306 | |
| Disposable microtome blade (MX35 Ultra) | Thermo Fisher Scientific | 705830 | |
| Fine Forceps (Dumont #5) | Fine Science Tools (FST) | 11254-20 | |
| Glass anti-roll plate | Histocom | M 449980 | |
| Glycerol | Sigma | G5516 | |
| LSM 800 Confocal | Zeiss | ||
| Mounting medium | 25 mg/mL DAPCO, 6 g Glycerol, 2.4 g Mowiol 4-88, 6 mL dH2O, 12 mL 0.2 M Tris-HCl (pH 8.5) | ||
| Mowiol 4-88 | Roth | 0713.2 | |
| Normal donkey serum | Innovative Research | IGDNSER100ML | |
| Paraformaldehyde | Sigma | 441244-1KG | |
| Peristaltic pump 323E/D 400RPM | Watson-Marlow | 036.3124.00A | |
| Sucrose | Sigma | S8501-5KG | |
| Superfrost plus glass slides | Thermo Fisher Scientific | J1800AMNT | |
| Tamoxifen | Sigma | T5648 | |
| Tissue Embedding mold T-12 (22mm square) | Polysciences Inc. | 18986-1 | |
| Tissue-Tek O.C.T | Sakura | 4583 | |
| Triton X-100 | Sigma | T8787-250ML | |
| Trizma hydrochloride | Sigma | 93363 | |
| Tween-20 | Sigma | P9416-100ML | |
| Software and Plugins: | |||
| Fiji | 1.52p | Fiji | |
| MultiStackReg | 1.45 | Download link | |
| TurboReg | EPFL Bioimaging | ||
| Zen Blue | 2.6 | Zeiss | |
| Experimental Models: Organisms/Strains: | |||
| Mouse: Emx1-CreER | The Jackson Laboratory | JAX:027784 | |
| Mouse: MADM-11-GT | The Jackson Laboratory | JAX:013749 | |
| Mouse: MADM-11-TG | The Jackson Laboratory | JAX:013751 | |
| Primary antibodies: | |||
| Chicken anti-GFP 1:500 | Aves Labs | GFP-1020 | |
| Goat anti-tdTomato 1:500 | Sicgen Antibodies | AB8181-200 | |
| Rabbit anti-RFP 1:500 | MBL | PM005 | |
| Secondary antibodies: | |||
| Donkey Anti-Chicken Alexa Fluor 488 1:500 | Jackson Immuno Research | 715-475-150 | |
| Donkey Anti-Goat Cy3 1:500 | Jackson Immuno Research | 705-165-147 | |
| Donkey Anti-Rabbit Cy3 1:500 | Jackson Immuno Research | 711-165-152 |
参考文献
- Malatesta, P., et al. Neuronal or glial progeny: regional differences in radial glia fate. Neuron. 37 (5), 751-764 (2003).
- Miyata, T., Kawaguchi, A., Okano, H., Ogawa, M. Asymmetric inheritance of radial glial fibers by cortical neurons. Neuron. 31 (5), 727-741 (2001).
- Noctor, S. C., Flint, A. C., Weissman, T. A., Dammerman, R. S., Kriegstein, A. R. Neurons derived from radial glial cells establish radial units in neocortex. Nature. 409 (6821), 714-720 (2001).
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30 (1), 465-502 (2014).
- Desikan, R. S., Barkovich, A. J. Malformations of cortical development. Annals of Neurology. 80 (6), 797-810 (2016).
- Gao, R., Penzes, P. Common mechanisms of excitatory and inhibitory imbalance in schizophrenia and autism spectrum disorders. Current Molecular Medicine. 15 (2), 146-167 (2015).
- Beattie, R., et al. Mosaic Analysis with Double Markers Reveals Distinct Sequential Functions of Lgl1 in Neural Stem Cells. Neuron. 94 (3), 517-533 (2017).
- Hippenmeyer, S. Molecular pathways controlling the sequential steps of cortical projection neuron migration. Advances in Experimental Medicine and Biology. 800, 1-24 (2014).
- Lodato, S., Arlotta, P. Generating neuronal diversity in the mammalian cerebral cortex. Annual Review of Cell and Developmental Biology. 31, 699-720 (2015).
- Hansen, A. H., Duellberg, C., Mieck, C., Loose, M., Hippenmeyer, S. Cell Polarity in Cerebral Cortex Development-Cellular Architecture Shaped by Biochemical Networks. Frontiers in Cellular Neuroscience. 11, 176 (2017).
- Gao, P., et al. Deterministic progenitor behavior and unitary production of neurons in the neocortex. Cell. 159 (4), 775-788 (2014).
- Llorca, A., et al. A stochastic framework of neurogenesis underlies the assembly of neocortical cytoarchitecture. eLife. 8, e51381 (2019).
- Ma, J., Shen, Z., Yu, Y. C., Shi, S. H. Neural lineage tracing in the mammalian brain. Current Opinion in Neurobiology. 50, 7-16 (2018).
- Caviness, V., Takahashi, T., Nowakowski, R. Numbers, time and neocortical neuronogenesis: a general developmental and evolutionary model. Trends in Neurosciences. 18 (9), 379-383 (1995).
- Schmechel, D. E., Rakic, P. A Golgi study of radial glial cells in developing monkey telencephalon: morphogenesis and transformation into astrocytes. Anatomy and Embryology. 156 (2), 115-152 (1979).
- Kessaris, N., et al. Competing waves of oligodendrocytes in the forebrain and postnatal elimination of an embryonic lineage. Nature Neuroscience. 9 (2), 173-179 (2006).
- Magavi, S., Friedmann, D., Banks, G., Stolfi, A., Lois, C. Coincident generation of pyramidal neurons and protoplasmic astrocytes in neocortical columns. The Journal of Neuroscience. 32 (14), 4762-4772 (2012).
- Anthony, T. E., Klein, C., Fishell, G., Heintz, N. Radial glia serve as neuronal progenitors in all regions of the central nervous system. Neuron. 41 (6), 881-890 (2004).
- Voigt, T. Development of glial cells in the cerebral wall of ferrets: direct tracing of their transformation from radial glia into astrocytes. The Journal of Comparative Neurology. 289 (1), 74-88 (1989).
- Amberg, N., Laukoter, S., Hippenmeyer, S. Epigenetic cues modulating the generation of cell-type diversity in the cerebral cortex. Journal of Neurochemistry. 149 (1), 12-26 (2019).
- Beattie, R., Hippenmeyer, S. Mechanisms of Radial Glia Progenitor Cell Lineage Progression. FEBS letters. 591 (24), 3993-4008 (2017).
- Telley, L., et al. Temporal patterning of apical progenitors and their daughter neurons in the developing neocortex. Science. 364 (6440), eaav2522 (2019).
- Oberst, P., et al. Temporal plasticity of apical progenitors in the developing mouse neocortex. Nature. 573 (7774), 370-374 (2019).
- Telley, L., et al. Sequential transcriptional waves direct the differentiation of newborn neurons in the mouse neocortex. Science. 351 (6280), 1443 (2016).
- Deppe, U., et al. Cell lineages of the embryo of the nematode Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 75 (1), 376-380 (1978).
- Woodworth, M. B., Girskis, K. M., Walsh, C. A. Building a lineage from single cells: genetic techniques for cell lineage tracking. Nature Reviews Genetics. 18 (4), 230-244 (2017).
- Masuyama, N., Mori, H., Yachie, N. DNA barcodes evolve for high-resolution cell lineage tracing. Current Opinion in Chemical Biology. 52, 63-71 (2019).
- Legue, E., Joyner, A. L. Chapter Ten-Genetic Fate Mapping Using Site-Specific Recombinases. Methods in Enzymology. 477, 153-181 (2010).
- Postiglione, M. P., Hippenmeyer, S. Monitoring neurogenesis in the cerebral cortex: an update. Future Neurology. 9 (3), 323-340 (2014).
- Espinosa-Medina, I., Garcia-Marques, J., Cepko, C., Lee, T. High-throughput dense reconstruction of cell lineages. Open Biology. 9 (12), 190229 (2019).
- Hwang, B., et al. Lineage tracing using a Cas9-deaminase barcoding system targeting endogenous L1 elements. Nature Communications. 10 (1), 1234 (2019).
- Kalhor, R., et al. Developmental barcoding of whole mouse via homing CRISPR. Science. 361 (6405), eaat9804 (2018).
- García-Moreno, F., Vasistha, N. A., Begbie, J., Molnár, Z. CLoNe is a new method to target single progenitors and study their progeny in mouse and chick. Development. 141 (7), 1589-1598 (2014).
- Loulier, K., et al. Multiplex Cell and Lineage Tracking with Combinatorial Labels. Neuron. 81 (3), 505-520 (2014).
- Livet, J., et al. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-62 (2007).
- Snippert, H. J., et al. Intestinal Crypt Homeostasis Results from Neutral Competition between Symmetrically Dividing Lgr5 Stem Cells. Cell. 143 (1), 134-144 (2010).
- Amitai-Lange, A., et al. A method for lineage tracing of corneal cells using multi-color fluorescent reporter mice. Journal of Visualized Experiments. (106), e53370 (2015).
- Vasistha, N. A., et al. Cortical and Clonal Contribution of Tbr2 Expressing Progenitors in the Developing Mouse Brain. Cerebral Cortex. 25 (10), 3290-3302 (2015).
- Chen, F., LoTurco, J. A method for stable transgenesis of radial glia lineage in rat neocortex by piggyBac mediated transposition. Journal of Neuroscience Methods. 207 (2), 172-180 (2012).
- Siddiqi, F., et al. Fate mapping by piggyBac transposase reveals that neocortical GLAST+ progenitors generate more astrocytes than Nestin+ progenitors in rat neocortex. Cerebral Cortex. 24 (2), 508-520 (2014).
- Yoshida, A., et al. Simultaneous expression of different transgenes in neurons and glia by combining in utero electroporation with the Tol2 transposon-mediated gene transfer system. Genes to Cells. 15 (5), 501-512 (2010).
- García-Marqués, J., López-Mascaraque, L. Clonal Identity Determines Astrocyte Cortical Heterogeneity. Cerebral Cortex. 23 (6), 1463-1472 (2013).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884 (2019).
- Kim, G. B., et al. Rapid Generation of Somatic Mouse Mosaics with Locus-Specific, Stably Integrated Transgenic Elements. Cell. 179 (1), 251-267 (2019).
- Pilz, G. A., et al. Live imaging of neurogenesis in the adult mouse hippocampus. Science. 359 (6376), 658 (2018).
- Hippenmeyer, S., et al. Genetic Mosaic Dissection of Lis1 and Ndel1 in Neuronal Migration. Neuron. 68 (4), 695-709 (2010).
- Zong, H., Espinosa, J. S., Su, H. H., Muzumdar, M. D., Luo, L. Mosaic analysis with double markers in mice. Cell. 121 (3), 479-492 (2005).
- Ramón y Cajal, S. . Histologie du système nerveux de l'homme et des vertébrés. , (1911).
- Cowan, W. M. The emergence of modern neuroanatomy and developmental neurobiology. Neuron. 20 (3), 413-426 (1998).
- Ali, S. R., et al. Existing cardiomyocytes generate cardiomyocytes at a low rate after birth in mice. Proceedings of the National Academy of Sciences of the United States of America. 111 (24), 8850-8855 (2014).
- Hippenmeyer, S., Johnson, R. L., Luo, L. Mosaic analysis with double markers reveals cell-type-specific paternal growth dominance. Cell Reports. 3 (3), 960-967 (2013).
- Riccio, P., Cebrian, C., Zong, H., Hippenmeyer, S., Costantini, F. Ret and Etv4 promote directed movements of progenitor cells during renal branching morphogenesis. PLoS Biology. 14 (2), e1002382 (2016).
- Bonaguidi, M. A., et al. In vivo clonal analysis reveals self-renewing and multipotent adult neural stem cell characteristics. Cell. 145 (7), 1142-1155 (2011).
- Mayer, C., et al. Clonally Related Forebrain Interneurons Disperse Broadly across Both Functional Areas and Structural Boundaries. Neuron. 87 (5), 989-998 (2015).
- Muzumdar, M. D., et al. Clonal dynamics following p53 loss of heterozygosity in Kras-driven cancers. Nature Communications. 7, 12685 (2016).
- Shi, W., et al. Ontogenetic establishment of order-specific nuclear organization in the mammalian thalamus. Nature Neuroscience. 20, 516 (2017).
- Wong, S. Z. H., et al. In vivo clonal analysis reveals spatiotemporal regulation of thalamic nucleogenesis. PLoS Biology. 16 (4), e2005211 (2018).
- Xu, H. T., et al. Distinct Lineage-Dependent Structural and Functional Organization of the Hippocampus. Cell. 157 (7), 1552-1564 (2014).
- Brennand, K., Huangfu, D., Melton, D. All β Cells Contribute Equally to Islet Growth and Maintenance. PLoS Biology. 5 (7), e163 (2007).
- Ortiz-Alvarez, G., et al. Adult neural stem cells and multiciliated ependymal cells share a common lineage regulated by the geminin family members. Neuron. 102 (1), 159-172 (2019).
- Kaplan, E. S., Ramos-Laguna, K. A., Mihalas, A. B., Daza, R. A. M., Hevner, R. F. Neocortical Sox9+ radial glia generate glutamatergic neurons for all layers, but lack discernible evidence of early laminar fate restriction. Neural Development. 12 (1), 14 (2017).
- Lv, X., et al. TBR2 coordinates neurogenesis expansion and precise microcircuit organization via Protocadherin 19 in the mammalian cortex. Nature Communications. 10 (1), 3946 (2019).
- Mihalas, A. B., Hevner, R. F. Clonal analysis reveals laminar fate multipotency and daughter cell apoptosis of mouse cortical intermediate progenitors. Development. 145 (17), dev164335 (2018).
- Picco, N., et al. A mathematical insight into cell labelling experiments for clonal analysis. Journal of Anatomy. 235 (3), 687-696 (2019).
- Johnson, C. A., Ghashghaei, H. T. Sp2 regulates late neurogenic but not early expansive divisions of neural stem cells underlying population growth in the mouse cortex. Development. , (2020).
- Espinosa, J. S., Luo, L. Timing Neurogenesis and Differentiation: Insights from Quantitative Clonal Analyses of Cerebellar Granule Cells. The Journal of Neuroscience. 28 (10), 2301 (2008).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Liu, Y., et al. Tamoxifen-independent recombination in the RIP-CreER mouse. PLoS One. 5 (10), e13533 (2010).
- Klingler, E., Jabaudon, D. Do progenitors play dice?. eLife. 9, e54042 (2020).
- Hippenmeyer, S. Dissection of gene function at clonal level using mosaic analysis with double markers. Frontiers in Biology. 8 (6), 557-568 (2013).
- Rulands, S., Simons, B. D. Tracing cellular dynamics in tissue development, maintenance and disease. Current Opinion in Cell Biology. 43, 38-45 (2016).
- Laukoter, S., et al. Imprinted Cdkn1c genomic locus cell-autonomously promotes cell survival in cerebral cortex development. Nature Communications. 11 (1), 195 (2020).
- Daigle, T. L., et al. A Suite of Transgenic Driver and Reporter Mouse Lines with Enhanced Brain-Cell-Type Targeting and Functionality. Cell. 174 (2), 465-480 (2018).
- He, M., et al. Strategies and Tools for Combinatorial Targeting of GABAergic Neurons in Mouse Cerebral Cortex. Neuron. 91 (6), 1228-1243 (2016).
- Yamamoto, M., et al. A multifunctional reporter mouse line for Cre- and FLP-dependent lineage analysis. Genesis. 47 (2), 107-114 (2009).
- Plummer, N. W., et al. Expanding the power of recombinase-based labeling to uncover cellular diversity. Development. 142 (24), 4385 (2015).
- Imayoshi, I., Ohtsuka, T., Metzger, D., Chambon, P., Kageyama, R. Temporal regulation of Cre recombinase activity in neural stem cells. Genesis. 44 (5), 233-238 (2006).
- Sasaki, S., et al. Complete loss of Ndel1 results in neuronal migration defects and early embryonic lethality. Molecular and Cellular Biology. 25 (17), 7812-7827 (2005).
- Acampora, D., et al. Epilepsy and brain abnormalities in mice lacking the Otx1 gene. Nature Genetics. 14 (2), 218-222 (1996).
- Soeda, T., et al. Sox9-expressing precursors are the cellular origin of the cruciate ligament of the knee joint and the limb tendons. Genesis. 48 (11), 635-644 (2010).
- Klezovitch, O., Fernandez, T. E., Tapscott, S. J., Vasioukhin, V. Loss of cell polarity causes severe brain dysplasia in Lgl1 knockout mice. Genes & Development. 18 (5), 559-571 (2004).
- Pimeisl, I. M., et al. Generation and characterization of a tamoxifen-inducible EomesCreER mouse line. Genesis. 51 (10), 725-733 (2013).
- Nakagawa, N., et al. Memo1-Mediated Tiling of Radial Glial Cells Facilitates Cerebral Cortical Development. Neuron. 103 (5), 836-852 (2019).
- Nowotschin, S., et al. The T-box transcription factor Eomesodermin is essential for AVE induction in the mouse embryo. Genes & Development. 27 (9), 997-1002 (2013).
- Balordi, F., Fishell, G. Mosaic removal of hedgehog signaling in the adult SVZ reveals that the residual wild-type stem cells have a limited capacity for self-renewal. Journal of Neuroscience. 27 (52), 14248-14259 (2007).
- Liang, H., et al. Neural development is dependent on the function of specificity protein 2 in cell cycle progression. Development. 140 (3), 552-561 (2013).
- Guo, C., Yang, W., Lobe, C. G. A Cre recombinase transgene with mosaic, widespread tamoxifen-inducible action. Genesis. 32 (1), 8-18 (2002).
- Ahn, S., Joyner, A. L. In vivo analysis of quiescent adult neural stem cells responding to Sonic hedgehog. Nature. 437 (7060), 894-897 (2005).
- Storm, R., et al. The bHLH transcription factor Olig3 marks the dorsal neuroepithelium of the hindbrain and is essential for the development of brainstem nuclei. Development. 136 (2), 295-305 (2009).
- Koundakjian, E. J., Appler, J. L., Goodrich, L. V. Auditory neurons make stereotyped wiring decisions before maturation of their targets. Journal of Neuroscience. 27 (51), 14078-14088 (2007).
- Dor, Y., Brown, J., Martinez, O. I., Melton, D. A. Adult pancreatic β-cells are formed by self-duplication rather than stem-cell differentiation. Nature. 429 (6987), 41-46 (2004).
- Sohal, D. S., et al. Temporally regulated and tissue-specific gene manipulations in the adult and embryonic heart using a tamoxifen-inducible Cre protein. Circulation Research. 89 (1), 20-25 (2001).
- Ventura, A., et al. Restoration of p53 function leads to tumour regression in vivo. Nature. 445 (7128), 661-665 (2007).
- Johnson, L., et al. Somatic activation of the K-ras oncogene causes early onset lung cancer in mice. Nature. 410 (6832), 1111-1116 (2001).
- Tasic, B., et al. Extensions of MADM (mosaic analysis with double markers) in mice. PLoS One. 7 (3), e33332 (2012).
- Yu, J., Carroll, T. J., McMahon, A. P. Sonic hedgehog regulates proliferation and differentiation of mesenchymal cells in the mouse metanephric kidney. Development. 129 (22), 5301-5312 (2002).
- Zhao, H., et al. Role of fibroblast growth factor receptors 1 and 2 in the ureteric bud. Developmental Biology. 276 (2), 403-415 (2004).
- Schuchardt, A., D'Agati, V., Larsson-Blomberg, L., Costantini, F., Pachnis, V. Defects in the kidney and enteric nervous system of mice lacking the tyrosine kinase receptor Ret. Nature. 367 (6461), 380-383 (1994).
- Livet, J., et al. ETS gene Pea3 controls the central position and terminal arborization of specific motor neuron pools. Neuron. 35 (5), 877-892 (2002).
- Volz, K. S., et al. Pericytes are progenitors for coronary artery smooth muscle. eLife. 4, e10036 (2015).
- Cai, C. L., et al. A myocardial lineage derives from Tbx18 epicardial cells. Nature. 454 (7200), 104-108 (2008).
- Lasrado, R., et al. Lineage-dependent spatial and functional organization of the mammalian enteric nervous system. Science. 356 (6339), 722-726 (2017).
- Matsuoka, T., et al. Neural crest origins of the neck and shoulder. Nature. 436 (7049), 347-355 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved