Method Article
איתור השושלת וניתוח שבטים בפיתוח קליפת המוח באמצעות ניתוח פסיפס עם סמנים כפולים (MADM)
In This Article
Summary
פרוטוקול לבצע מעקב שושלת היוחסין ניתוח גנטי פונקציונלי של גנים המועמדים ברמת תא בודד באמצעות ניתוח פסיפס עם סמנים כפולים (MADM) מוצג. ניתוח שבטים MADM מספק מסגרת כמותית כדי למדוד את ההתנהגות ההתרבות, הפלט הסלולר, ואת הקשר השושלת של ושלתי בודדים ותאי הבת שלהם.
Abstract
קליפת המוח של היונקים יוצרת. מעגלים עצביים פונקציונליים מאוד מושלתי עם זאת, המנגנון הסלולר והמולקולרי הבסיסי המסדיר את מעברי השושלת של תאי גזע עצביים (NSCs) ובסופו של דבר הפקה של נוירונים ו glia בהתפתחות נוירואפיתל נשאר ברור. שיטות למעקב אחר דפוסי החטיבה לבטחון לאומי ולמפות את השושלת של התאים הקשורים clonally מתקדמים באופן דרמטי. עם זאת, הרבה טכניקות מעקב של השושלת העכשווית סובלים מחוסר הרזולוציה התאית של הגורל תאים הצאצא, אשר חיוני לפענוח דפוסי החלוקה תא מחולל קדמון. הציג הוא פרוטוקול באמצעות ניתוח פסיפס עם סמנים כפולים (MADM) לבצע בניתוח vivo שבטים. ב-MADM במקביל מניפולציה בתאי קדמון בודדים ומדמיין דפוסי חלוקה מדויקים והתקדמות השושלת ברזולוציית תא בודדת חסרת תקדים. מבוסס MADM מבוססי אירועים שילוב מחדש במהלך השלב G2-X של mitosis, יחד עם זמניות inducible CreerT2, לספק מידע מדויק על תאריכי הלידה של שיבוטים דפוסי החלוקה שלהם. לפיכך, מעקב MADM השושלת מספק הקריאות אופטי כמותי איכותניות וכמותית של מצב התפשטות של תא גזע ושלתי ברמת התא בודד. MADM מאפשרת גם לבדיקת המנגנונים והדרישות הפונקציונליות של הגנים המועמדים בהתקדמות השושלת ההמועצה לבטחון לאומי. שיטה זו היא ייחודית בניתוח השוואתי של בקרה ושיבוטים מוטציה ניתן לבצע באותה סביבה רקמה ב vivo. כאן, הפרוטוקול מתואר בפרוטרוט, והתפיסות הנסיוניות להעסיק את MADM עבור ניתוח שבטים ומעקב השושלת בקליפת המוח המתפתח מומחש. חשוב מכך, פרוטוקול זה יכול להיות מותאם לבצע ניתוח שבטים MADM בנישה כל מורטין תא גזע, כל עוד מנהל ההתקן של CreerT2 קיים.
Introduction
קליפת המוח היא מבנה מאורגן מאוד המורכב משש שכבות נפרדות. קליפת המוח מכילה מערך מגוון של סוגי תאים כולל נוירונים ו גליה, אשר מקיימים אינטראקציה של מעגלים עצביים פונקציונליים. רוב, אם לא כולם, הקרנה בקליפת הגזע נוירונים ולגליה נגזר מתוך מאגר משותף של התאים העצביים העצבית (NSCs) המכונה גליה הרדיאלי ושלתי (rgps)1,2,3. RGPs עצמם נגזרות של תאי גזע נוירואפיתל (NESCs) ההלחנה נוירואפיתל מוקדם מתחלקים. ביום העובריים 9 (E9) בעכברים, NESCs מתחיל לעבור לתוך RGPs4. Rgp התקדמות השושלת דורש באופן מדויק ורגולציה מרחבית, וכאשר תהליך זה מפריע, הפרעות נוירולוגיות חמורות כגון מגלונצפלוס, microcephaly, lissencephaly, או ליקויים כגון סכיזופרניה ואוטיזם יכול לגרום5,6. בשנת E10, רוב rgps לעבור מחלקות מתרבים סימטרי, וכתוצאה מכך התרחבות של בריכת הקדמון העצבי4,7. RGPs בסופו של דבר להתחיל לחלק סימטרית, לייצר נוירונים הקרנה הקורטיקלית באופן זמני מוגדר. באמצעות גלים רצופים של נוירוגנזה, הנירמול היילוד להגר לתוך לוחית קליפת המוח ויוצרים למינציה הקליפת המוח עם הנוירונים הנולדים מוקדם הכובש שכבות עמוקות והנוירונים הנולדים מאוחר המתגוררים שכבות שטחיות8,9,10. בגלל clonally הנוירונים הקשורים הניריונים להעביר רדיוally לתוך קליפת המוח עם פיזור מאוד קטן, תאים בתים נוטים ליצור טור או מבנה חרוט בצורת המכונה יחידה הרדיאלי עצביים4,11,12,13. על ידי E17, הרחבה מתחלקים הנוירוגניים הושלמה עכברים14. Rgps יכול גם לייצר תאים ependymal וכמה מחלקות של גליה, כולל אסטרוציטים ו oligodendrocytes הפוך1,15,16,17,18,19. הפוטנציאל של rgps כדי להצמיח הן נוירונים ו אסטרוציטים נראה עקבי על פני כל האזורים קליפת המוח18, עם כ 1/6 של הנוירוגניים rgps גם להפקת glia11.
כיום, הגורמים הגנטיים והאפיגנטיים המסדיר את ההתקדמות הטמפורלית של תא גזע לאורך שושלת היוחסין שלה הם בעיקר לא ידועים. דפוסי הזמני של ביטוי גנים יכול להיות השפעה ניכרת על החלטות השושלת ב rgps20,21,22,23,24. כיצד זה מערכת יחסים הדוקה בין הזמני לבין מרחבית מוביל מגוון מולקולרי של סוגים נוירוונאליות מבוגרים באזורים הקורטיקליים לא ידוע. כמו כן, כיצד הפוטנציאל של תא גזע בודד התפוקה התאית שלו מאופנן ברמה התאית והמולקולרית היא שאלה חשובה ומלא מענה. מחקרים עתידיים בתקווה לטפל בכמה מהשאלות האלה, בסופו של דבר הרחבת ההבנה שלנו של היווצרות מעגלים קורטיקלית תפקודית.
בביולוגיה התפתחותית מבקשת להבין את מערכת היחסים של שושלת היוחסין שתאים במוח משתפים אחד עם השני. בתחילה, מעט מאוד כלי מחקר היו זמינים עבור זה, ומחקרים מוקדמים רבים הסתמך על תצפיות ויזואליות של דפוסי החלוקה באורגניזמים שקופים כגון האלגיה של Caenorditis25. העשורים האחרונים ראו עלייה דרמטית במספר ותחכום של טכניקות זמין13,26,27,28,29. הופעתה של מערכת עריכת הגנום crispr-Cas9 מאפשר שחזור סינתטי של קשרי השושלת של התא על ידי החדרת ברקודים DNA מתפתחת27,30. שתי דוגמאות האחרונות של אסטרטגיות barcoding כוללים את השימוש של מדריך ביות RNA המכוון crispr-Cas9 כדי ספציפי ברקוד ה-DNA הבית או cytidine deaminase התמזגו עם nickase Cas9 למקד את היעד באזורים חוזרים31,32. טכנולוגיות אלה מספקים גישות מובנות מאוד דרך המבוא של ברקודים כי בהדרגה לצבור מוטציות ייחודיות לאורך זמן. גישות לעריכת הגנום הן בעלות ערך רב משום שהן מאפשרות ניתוח רטרואקטיבי של היחסים בין שני תאים המבוססים על הירושה המשותפת של ברקודים אלה. עם זאת, כדי לקרוא את ברקודים בתאים בודדים, הרקמה בדרך כלל חייב להיות מופרת, ולכן מידע לגבי מיקום, מורפולוגיה, ומספרי התאים המוחלט של מחולל קדמון בודד הוא איבד.
קומבינטורית תיוג תבניות לשמר מידע מרחבי ועקרונית גם לאפשר את ההבחנה בין מקומי היטב או אפילו חופפים שיבוטים33,34. עבור שיטת העקיבה השושלת כדי להיות אינפורמטיבי זה חייב לתייג ושלתי בודדים שלהם צאצאים בצורה דלילה ומלא מחיק. בעיקר, המוח35 ו קונפטי36,37 גישות להשתמש סטוכסטי recombinase היצורים הצבעוניים מבוססי כתבים המבטאים שילוב של חלבונים פלורסנט מתוך לוקוס יחיד. המספר הנרחב של שילובים צבע סימולטני שניתן להשיג ב vivo להפוך את זה כלי רב עוצמה בעת מעקב שיבוטים rgp הקורטיקלית ו אסטרוציטים34. טרנספסון מערכות מבוססות מתן שילוב גנומי יציבה של כתבים פלורסנט קידוד המתיר מעקב השושלת של קליפת הושלתי יש גם פיתח33,38,39,40,41. טרנספסון מערכות מבוססות יש יתרון נוסף בכך מבנה העיתונאי להשתלב באופן מובן לתוך הגנום, ובכך באופן אמין התווית תאים ביתי הקשורות לבנות. כדי לעקוב אחר האסטרוציטים באופן ספציפי, מספר שיטות פותחו כי כרוך אלקטרופורציה של הטרנספט הספיצסים כולל מסלול כוכב, אשר עושה שימוש בשילוב של בנייה קידוד החלבונים פלורסנט שונים40,42. גישה נוספת, סמנים הקסם, מציג וקטורים בריינרד ברייסייבל כמו הטרנספנאין. זה כבר בשימוש בהצלחה להתחקות אחר עצבי מתחלקים אסטרוציט ושלתי34,43. לאחרונה, ניתוח פסיפס על ידי החלפת קלטת dual-recombinase-בתיווך (MADR) נמצא באופן בלתי נשכח תאים מוטנטים לבטא אלמנטים טרנסגניים מתוך המלון המוגדר בדיוק כרומוזום44. אלה חזקים בטכניקות תיוג vivo קומבינטורית סיפקו תובנות רבות לדינמיקה של שושלת היוחסין של תאים מחולל. עם זאת, ניתוחים אלה מבוצעים על רקמה קבועה, מתן תמונה של שיבוטים בודדים בשלב התפתחותי מוגדר. כדי לצפות בשינויים הדינמיקה השושלת של שיבוטים יחיד לאורך זמן, כרונית בשיטות הדמיה vivo דומה לאלה שבוצעו פיתול כישור למבוגרים בלבד צריך להיות מיושם45.
פסיפס ניתוח עם סמנים כפולים (madm) הוא בעל עוצמה כפול תיוג צבע שיטה המאפשרת מעקב vivo השושלת של תאים בודדים של מחולל שושלת בעכברים46,47. שני מרכיבים נחוצים עבור אירועים תיוג MADM להתרחש: ראשית, הקלטות MADM חייב להיות ממוקד זהה הרוח על הכרומוזומים הומוולוגיים. הקלטות מורכבות משני גנים של כתבת פלורסנט של צ'יאריק, eGFP (ירוק, [G]) ועגבניה דו-דימר (אדום, tdT [T]). הקלטת GT מכיל את ה-N-טרמינוס של egfp ואת C-הטרמינוס של tdt, מופרדים על ידי אינטרון המכיל אתר loxp. הקלטת TG בנויה בהיפוך, עם ה-N-טרמינוס של tdt ו-C הטרמינוס של egfp. שנית, הביטוי של היצור recombinase באותו תא המכיל את הקלטות madm ממוקד חיוני. בהעדר של היצור, הקלטות הצ לא מבטאותegfp פונקציונליים או tdt משום שרצפי הקידוד שלהם מובלים. אתרי ה-loxP משמשים כיעד לשילוב מחדש של מתווכת ביניהם, והתוצאה היא החוקה של שתי קלטות הביטוי בו זמנית. אם שילוב מחדש מתרחש במהלך השלב G2 של מחזור התא ואחריו הפרדה של X (G2-X), שתי התאים בתים לבטא אחד משני חלבונים פלורסנט. הוויסות הזמני של פעילות creerT2 באמצעות טממוקסיפן (TM) מספק מידע מדויק על תאריך הלידה של שיבוטים madm ואת דפוסי החלוקה של צאצאי שלהם (איור 1a)29,46,47.
MADM יכול פוטנציאל שיטתי תווית שיבוטים בודדים עם רזולוציה גבוהה תא יחיד במוח העכבר דומה מסורתי אך לא ספציפי שיטות מפרך כמו Golgi צביעת48 או מילוי צבע49. כי רק היזם המניע creerT2 קובע את סוג התא ספציפיות של תיוג madm שבטים, madm יכול בעיקרון להיות מיושם עבור השושלת היוחסין מעקב בכל איבר murine ורקמות47,50,51,52. אכן, מחקרים כבר השתמשו madm לחשוף את קשרי השושלת במשובטים שמקורם ברקמות שונות47,50,51,52,53,54,55,56,57,58,59. תבניות ניסיוני madm הוחלו על שושלת היוחסין של הקרנה בקליפת המוח נוירונים, גליה, ותאי גזע לידה ב קליפת מוח מפתח7,11,12,46,60,61,62,63,64,65. Madm שימש גם כדי ללמוד היוחסין של התאים בבית המשפחה gyrus מבוגרים, תלמוס, המוח בתאי גרגר עושה לבלר, ו interneurons ברמת המשובטים (ראה שולחן 1 עבור רשימה מלאה)47,53,54,56,57,66.
תכונה ייחודית של MADM היא היכולת לקשר גנטית מוטציות מאשר לקלטת MADM אחד, ובכך ליצור פסיפס גנטי (איור 1B ואיור 2). התוצאה היא בתאי בת מסוג פראי המסומנים עם סמן פלורסנט אחד (tdT באיור 1B) ו homozygous מוטציה אחים עם השני (egfp באיור 1b) בסביבה heterozygous ללא תווית. MADM הוא ייחודי בניתוח זה השוואתי של שליטה subclones מוטציה ניתן לבצע בסביבה רקמה זהה ב vivo. במקור, הקלטות MADM המיועדים לתוך Rosa26 לוקוס47, אבל ניתוח madm של הפונקציה גנטי היה מוגבל גנים המרוחק לוקוס. כדי להתגבר (לפחות חלקית) מגבלה זו ולהרחיב את האפשרויות של ניתוח מבוסס MADM הגנים, הקלטות MADM הפילו קרוב למרכז הריכוז של Chr. 751, Chr. 1146, ו Chr. 1251. מיקוד כל 19 העכבר האוטומטי עם הקלטות MADM הוא בעיצומו ויאפשר כמעט כל גן להיות למדו בעתיד, מתן פלטפורמה שאין כמוה למחקר של קשרי השושלת ההתפתחותית בשילוב עם ניתוח גנטי פונקציונלי.
Protocol
פרוטוקולי עכבר נבדקו על ידי מתקן ליבה טרום קלינית מוסדית (PCF) וועדה אתית פנימית ב IST אוסטריה. כל הרבייה והניסויים בוצעו תחת רישיון שאושר על ידי המשרד הפדרלי למדע ומחקר של אוסטריה בהתאם לחוקי החיות האוסטרי והאירופי.
1. גידול עכברים ניסיוניים לניתוח שבטים MADM
- הגדר מתגים מתוזמנים של מערכת MADM (> P56; CD-1) בשעות אחר הצהריים המאוחרות (5:00 PM) ולבדוק אטמי הנרתיק ההליך בוקר (8:00 AM). הבוקר שבו התוסף נחשב כיום 0.5. ראה איור 2 למבט כולל על כיוונון ההזדווגות של העכבר הנסיוני. ודא כי נקודות זמן עבור אינדוקציה TM של פעילות וניתוח של CreerT2 מתאימים לטיפול בשאלות ניסיוני.
הערה: לקבלת מידע נוסף, התייחס לאיור 3 ולתוצאות מייצגות להלן. - לדגימה לאחר הלידה, להגדיר ברגים ליצור אמהות אומנה במקביל.
הערה: יש להתחיל את היום עד 1 ימים לפני הקמת מספר מעבר ניסיוני.
2. האינדוקציה TM בעכברים MADM
- להכין 20 mg/mL TM פתרון העבודה על ידי המסת אותו בשמן תירס בתוך 15 מ"ל או 50 mL הצינורית צנטריפוגה ו הצבת אותו על פלטפורמת נדנדה עבור ~ 4 h בטמפרטורת החדר (RT), הבטחת TM הוא התפרקה לחלוטין. חנות פתרון עבודה ב 4 ° c מכוסה רדיד אלומיניום ושימוש בתוך 2 שבועות.
- כדי לגרום לאירועים שילוב MADM מחדש, לספק הזרקה אחת של TM intraperitoneally (IP) באמצעות מזרק 1 מ ג ו 25 גרם מחט לתוך סכר בהריון מתוזמן. בהתאם לשלב של נוירוגנזה קורטיקלית, הכנס TM בין E10-E15 במינון של 1-2 מ"ג/סכר בהריון. עבור נקודות זמן מוקדמות (כלומר, E10) להשתמש במקסימום של 1 מ"ג/סכר בהריון (25 מ"ג/ק"ג) כדי למנוע סיבוכים במהלך ההריון11. עבור נקודות זמן בין E11-E15 להשתמש 2 מ"ג/סכר הריון (50 מ"ג/ק"ג)7.
הערה: לחילופין, TM יכול להיות מנוהל עם gavage אוראלי עבור הריונות מאוחרת. - עבור ניתוח שבטים MADM לפוסט זמן לידה, לשחזר עוברים חיים ב E18-E19 באמצעות ניתוח קיסרי, ולאחר מכן לגדל גורים עם אמא אומנת.
הערה: בהתאם למצב הבריאותי של האישה ההרה, ייתכן שלא יהיה צורך לבצע ניתוח קיסרי אך העלאת גורים עם האם המאמצת עדיין נדרש משום שהאמא המקורית TM מטופל עלול להיות בעייתי מניקה. - כדי לשחזר עוברים חיים על ידי ניתוח קיסרי או לאחזר נקודות זמן עובריים לניתוח, להקריב את הסכר בהריון על ידי פריקה צוואר הרחם.
- מניחים את החיה במצב פרקדן ולחטא פרווה עם 70% אתנול. לעשות חתך קטן בעור בבטן התחתונה מעל הרחם באמצעות מלקחיים כירורגי ומספריים. להפוך את החתך השני דרך השרירים ואת הקיר שרירי הבטן כדי לחשוף את צפק.
- להסיר את הרחם על ידי הפרדת הרקמות הסובבות עם מספריים. העבר הרחם ללא פגע על כפפה מלאה במים חמים כדי להגדיל את שיעור ההישרדות העובר עד שכל אחד מהם מוסר מן השפיר על בנפרד.
- השתמש מספריים עדינים ואצבעות לפתוח בזהירות את קירות הרחם כדי לשחרר עוברי. אל תחתוך את מיתרי הטבור קרוב מדי לגוף כדי למנוע אובדן דם נרחב. אם יש להשתמש בעוברים לצורך ניתוח, המשך לשלב 3.9. , אם הגורים יהיו מאומץ. המשך לשלב 2.8
- אם יש צורך בטיפוח, נקו את הגורים לפני שהעבירו לאמא המאמצת. בזמן ניקוי הגורים, הקישו בעדינות על החזה מפעם לפעם כדי להתחיל לנשום. הניחו חזרה על כפפה שנייה מלאה במים חמים כדי לשפר את שיעור ההישרדות.
הערה: חשוב להסיר בעדינות את השפיר הנותרים ו/או השליה עם מגבת נייר. - לפני שהעבירו את הגורים לאמא המאמצת, הסר את האם המאמצת מהכלוב, הסר את הגורים המקוריים והחלף עם הגורים הניסיוניים. . החזר את האמא המאמצת לכלוב שלה
הערה: עיין בדיון לקבלת הצעות נוספות לשיפור שיעורי הקבלה. - אם יש צורך בהקלדה, לאסוף ביופסיה או זנב בין P6-P8.
הערה: בצע צעד זה רק אם רשיונות ניסוי בעלי חיים מאשרים פרקטיקה זו.
3. הכנת רקמות עבור שיבוטים MADM במוח
הערה: לניסויים הכוללים רקמת פוסט-לידה (≥ P4), המשך לשלב 3.1. עבור נקודות זמן עובריים והפוסטנטאל מוקדמת (P0-P3), המשיכו לשלב 3.9.
- להפחית את בעלי החיים הניסיוני MADM עם הזרקת IP של פתרון קטמין/xylazine אזין (65 mg, 13 מ"ג, ו 2 מ"ג/ק"ג משקל הגוף, בהתאמה) ולאשר כי העכבר אינו מגיב על ידי צובט את הרגל האחוריות.
הערה: עכברים ממין זכר וגם נקבה MADM הנשי (CD-1 רקע) משמשים לניתוח. אם יש צורך בהקלדת הגנוזה, אסוף את ביופסיות האוזניים בשלב זה. - מניחים את החיה מורדם במצב פרקדן על מגש הניתוח זלוף ולחטא פרווה עם 70% אתנול. כדי להתחיל בניתוח, בזהירות לעשות חתך עם מספריים ומלקחיים כירורגי דרך השכבה החיצונית של העור ולאחר מכן החתך השני דרך שכבת השריר. הרימו את קצה עצם החזה וחתכו את רקמת החיבור בצדדים, ולוקחים זהירות נוספת כדי להימנע מחיתוך הכבד. חלל החזה יהיה גלוי.
- לגזור את הסרעפת ולהרים כדי לחשוף את הלב. לקצץ בזהירות את כלוב הצלעות ואת הסיכה מגש כירורגי כדי לחשוף את הלב. . לגורים, הסר את כלוב הצלעות לחלוטין
- הכנס מחט עם תמיסת מלח מוזרמת פוספט (PBS) לחדר השמאלי התחתון (רקמת paler). באמצעות מספריים קשתית קטנה לעשות חתך לקצה האחורי של האטריום הימני (רקמה אדומה כהה) כדי לנקז את הדם.
- בצע זלוף עם PBS ואחריו מיד על ידי תוצרת טרייה, קרח קר 4% פאראפורמלדהיד (בלייס) הכין ב-PBS. עבור הגורים (P4-P10) להשתמש מזרקים כדי לבצע perfusion. מלא מזרק אחד עם 10 מ ל של PBS ואחר עם 10 מ ל של 4% בתחתית. ודא שכל בועות האוויר בתוך מזרקים הוסרו. עבור חיות מבוגרות יותר, השתמש במשאבה פריסטלטית.
- התחילו בירי עם ה-PBS (10 מ"ל ב-2 ל -4 מ"ל/מינימום בגורים; 20 מ ל ב-4 ל-6 מ"ל/min למבוגרים באמצעות משאבה פריסטלטית). הכבד יהיה ברור וצהוב חיוור אם המחט ממוקם כראוי.
- לאחר השלמת, להסיר את המחט מתוך הגורים ולהכניס את המחט המכילה למעלה לתוך החור אותו. עבור מבוגרים, לעצור את המשאבה הפריסטטית לפני החלפת הפתרון PBS עם קרח קר למטה, הקפד להימנע בועות אבובים ספיגה. המשך להמשיך עם השימוש בלגון (10 מ ל ב-2 ל -4 מ"ל/מינימום בגורים; 30 מ ל ב -4 מ ל/מינימום למבוגרים באמצעות משאבה פריסטלטית).
- כאשר זלוף הושלמה, לערוף את ראשו של העכבר ולהסיר את המוח באמצעות ניתוח זהיר. העברת המוח ל 4% בכיוון הכיתה. השתמש לפחות 5x כרכים המוח (כלומר, ~ 5-10 מ ל של התחתית בתוך 15 מ"ל צנטר צנטריפוגה) ו דגירה לילה ב 4 ° צ' עבור קיבעון postperfusion כדי להבטיח קיבוע מלאה של רקמות. . המשך לצעוד 3.10
- לרקמות עובריים ולרקמות הפוסט-לידה המוקדמות (כלומר, P0-P3), לאחר ביצוע סעיף קיסרי, ערוף את ראשו של העוברים במספריים. אם יש צורך בהקלדה, אסוף את זנב העובר בנקודה זו. מייד מבתר את המוח ומעביר לצלחת 12% המכילה 2 ל -3 מ ל של 4% בחצי הג. המשך הלילה ב -4 מעלות צלזיוס לקיבוע.
- בשעות הבוקר שלאחר ההחלפה בלרוק עם 10 מ ל (מבוגר) או 2 ל-3 מ ל (העובר) של PBS וחזרה לכביסה 3 x עבור 15 דקות ב-RT. העברת רקמות ל 30% סוכרוז במאגר פוספט (PB) והחנות ב 4 ° c על פלטפורמת נדנדה עד הרקמה כיורים בתמיסה.
- הטמע את המוח בטמפרטורת חיתוך אופטימלית (OCT) בתבנית הטבעה, ודואגת לכוון את המוח לכיוון משני הצדדים או למשונן. הקפא על ידי הצבת תבנית ההטבעה על קרח יבש עד שאוק הופך לאטום לחלוטין (~ 10-15 דקות). לאחסן רקמות ב-80 ° c עד שימוש נוסף.
4. הכנת רקמת MADM עבור אימונוהיסטוכימיה
- חבר את בלוק הרקמה לדיסק הדגימה בקריוסטט על ידי החלת טבעת של OCT לדיסק והצבת הבלוק ישירות לתוך ה-OCT כאשר הוא מתחיל לקפוא. ודא שהבלוק מכוון כראוי למישור החיתוך הרצוי.
הערה: כאן, הודעה מקורלית לחקור שיבוטים MADM קורטיקלית מתוארת בפרוטרוט. - הגדר את טמפרטורת הבלוק בקריוסטט ל-20 ° c וטמפרטורת הלהב ל-21 ° c.
- אפשר לחסום את הרקמה להסתגל לטמפרטורה הקאמרית על ידי הרכבה של הדיסק הדגימה למחזיק הדגימה ולעזוב בהקפאה עבור ~ 5 דקות לפני תחילת החסימה.
- חיתוך בלוק במקטעים עבים (45 עד 60 μm) עד להגעה לאזור הרקמה של הריבית.
- ברגע שקצה הקליפה נראה בבירור, הפסק לפרוש ונעל את הלהב. ודא שהלהב מוגן לפני גזיזת הבלוק.
- קצץ את OCT העודף מסביב לרקמה בלהב, ועוזב ~ 1-2 מילימטר של OCT בכל צדי המוח.
- הבא האוריינט הבלוק כך שאחד הקצוות הצדדיים של הקליפה מכוון כלפי מטה והשני כלפי מעלה (כלומר, הקצה הrostral ביותר של הקליפה מכוון ימינה).
- התחל לסדר עם עובי של 45 יקרומטר עבור שיבוטים למבוגרים ו 30 יקרומטר עבור שיבוטים עובריים. לבצע כל מקטע בנפרד ולהשתמש מברשת קטנה כדי לשמור על האזור מתחת לסכין נקי של כל פסולת שנותרה בעת גזיזת את הבלוק.
הערה: אם הדבר לא נעשה ומקטע נופל, ייתכן שיהיה קשה לקבוע את הסדר הנכון של הפרוסות. - אם מקטעים מתחילים תלתל, לקצץ את קצות הבלוק ו/או בזהירות להתאים את צלחת הזכוכית אנטי רול.
- לניתוח שיבוט עובריים, מקטעי הטעינה ישירות לשקופית חלבית. ייבוש על צלחת חימום ב 37 ° c לפני שממשיכים ישירות לשלב 5.6.
הערה: ניתן להוסיף מספר מקטעים לשקופית אחת, אך להבטיח שהסדר הרציף יישמר. - כדי לאסוף שיבוטים מבוגרים, להכין 24 לוחות המכיל 1 מ ל של PBS/ובכן (בדרך כלל, 5-6 לוחות למוח). החל מן הבאר הראשונה, עם מלקחיים קר לאסוף סעיפים סדרתיים בודדים ב-PBS לפי סדר המיון.
הערה: שיטת הסעיף הצף מאומצת לרקמת מבוגרים כדי להבטיח שאין מקטעים שאינם מחמיץ ושמקטעים נטענים אינם מכילים קמטים. - הפסיקו לדבר ברגע שיגיע סוף הקליפה.
- עבור שיבוטים למבוגרים, המשך להרכבה מקטעים צפים.
הערה: ניתן לשמור מקטעים ב-PBS ב-4 ° צ' עד 24 שעות.
5. הרכבה רקמות מבוגרים להדמיה
הערה: הכלים הבאים נדרשים: מברשת צבע קטנה, צלחת פטרי, PBS עם 0.5% רצף (PBS-T), שקופיות הדבקה (טבלת חומרים), הרכבה בינונית (טבלת חומרים), כיסוי, ומלקחיים.
- ממלאים צלחת פטרי עם PBS-T.
הערה: חומרי ניקוי משמשים לסיוע בתהליך ההרכבה. אם הצביעת עבור אנטיגנים נוספים רגישים לדטרגנטים (כלומר, גליקורופנס) הוא הכרחי, עדיף לדלג על תוספת של רצף. - הנח שקופית הדבקה לתוך ה-PBS-T כך שהיא כמעט מכוסה עד לתווית.
- העבירו את החלק הראשון. לערוץ הPBS-טי
- באמצעות מברשת צבע קטנה, לתמרן את הקטע על השקופית ולסדר אותו כדי לשמר את סדר החיתוך. המשיכו באותו אופן עם כל הסעיפים הנוספים.
- לאחר שכל המקטעים נמצאים במיקום, הצב את השקופית (~ 12 לל16 מקטעים/שקופית) בחדר שקופית כהה. הרימו מעט את המכסה כדי לאפשר לחלקים להתייבש לחלוטין (~ 10-20 דקות) ולהבטיח שהם יישארו מלאים בצעדים הבאים.
- במקרה של ביצוע אימונוהיסטוכימיה עבור אנטיגנים נוספים, המשך ישירות לסעיף 6 או 7.
הערה: עבור נקודות זמן עובריים, יש צורך לבצע שלבים מותמים עבור לפחות GFP ו-tdT (סעיף 6). עבור שיבוטים למבוגרים, זה נדרש רק אם הצביעת עבור אנטיגנים נוספים במקביל (סעיפים 6 ו -7). - מייבשים ורוחצים את סעיפים 1 x עם PBS 1x עבור 5 דקות כדי להסיר PBS-T שיורית. להחיל ~ 1 mL של 4 ′, 6-diamidino-2-פנייילידול (DAPI) מדולל ב-1x PBS (1 μg/mL) לשקופית, להבטיח את כל הסעיפים מכוסים ו מודלת עבור 15 דקות.
- הסר בזהירות את ה-DAPI ושטוף 1x עם PBS 1x עבור 5 דקות. הסרת העודפים PBS ויבש עבור ~ 1 על 2 דקות לפני הטבעה ב-110 μL של הרכבה בינונית. חותם עם שמיכות 24 x 60 מ"מ ולתת יבש לפחות 3 h לפני הדמיה.
6. כתמים חיסוני של GFP ו-tdT בלבד
הערה: סעיף זה נחוץ עבור שיבוטים עובריים.
- מניחים את השקופיות אופקית בחדר הדגירה של מחולל שקופיות. סמן גבולות שקופית באמצעות סמן שעווה כדי למזער את כמות המאגר הדרושה.
- מייבשים מקטעים עם 1x PBS. כדי לשפר את איכות הצביעת, לעבוד עם רקמה טרייה.
- הוסף 250 ליטר מאגר חוסם (0.5% טריטון X-100, 2-3% סרום חמור רגיל ב-1x PBS) לכל שקופית, וודא שכל המקטעים מכוסים. . מודטה לשעה
הערה: ריכוז חומרי הניקוי (טריטון X-100 או רצף הזמן 20) ישתנה בהתאם לנוגדנים העיקריים הנוספים המשמשים כיוון שמספר אנטיגנים רגישים יותר לדטרגנטים מאחרים. - הסרת מאגר חסימות והוספת נוגדנים ראשיים לחסימה במאגר לשקופית (300-400 μL/שקופית).
הערה: דוגמה לתגובת נוגדן ראשונית סטנדרטית נגד GFP/anti-tdT (MADM) יכול להשתמש עוף נגד GFP (1:500) ו ארנב anti-RFP (1:500). - דגירה עם נוגדנים הראשי לילה ב 4 ° c.
הערה: השקופיות חייבות להיות מודולות לחלוטין אופקית עם מאגר המכסה את כל המקטעים. אחרת, כתמים לא מאוזנים או ירודים עלול לגרום. - אשר בבוקר שלמחרת שמאגר החסימות עם הנוגדנים הראשיים עדיין מכסה את כל המקטעים בשקופית. אם לא, חזור על צעד הדגירה עבור 3 עד 4 h בשעה RT.
- הסר נוגדנים עיקריים ולשטוף 4x עם PBS 1x עבור 10 דקות ב RT.
- הוסף נוגדנים משנית מדולל במאגר חסימת לשקופית (300 ליטר μL/שקופית): אלקסה Fluor 488 נגד עוף IgG (1:500) ו Cy3 אנטי ארנב IgG (1:500).
- מודטה ב RT עבור 2 h. השאר שקופיות מכוסות מאור כדי למנוע הלבנת של fluorophores.
- הסר נוגדנים משניים ושטוף 2x עם PBS 1x עבור 10 דקות.
- דגירה עם DAPI מדולל ב-PBS (1:5000) עבור 15 דקות.
- שטוף סעיפים 1x עם PBS 1x עבור 10 דקות.
- להסיר את העודפים PBS ויבש עבור ~ 1 על 2 דקות לפני הטבעה של 110 μL של הרכבה בינונית.
- חותם עם שמיכות 24 x 60 מ"מ ולתת יבש לפחות 3 h לפני הדמיה. תמונה שקופיות בתוך 1 עד 2 שבועות לאחר ביצוע אימונוהיסטוכימיה כדי להבטיח אות אופטימלי.
7. כתמים חיסוני של GFP, tdT, ו אנטיגנים נוספים
- בצע את השלבים 6.1-6.3.
- הסרת מאגר חסימות והוספת נוגדנים ראשיים לחסימה במאגר לשקופית (300-400 μL/שקופית).
הערה: כאשר מכתים שלושה או יותר אנטיגנים (כלומר, GFP, tdT, וחלבון של עניין) ואת הנוגדן עבור חלבון הריבית הועלה בארנב, מומלץ להשתמש anti-tdT (עז) הנוגדן הראשי על דילול של 1:500. דוגמה לתגובת נוגדן העיקרי עבור שלושה אנטיגנים עם כתמים tdT חלופיים יכול להשתמש עוף נגד GFP (1:500), עז anti-tdT (1:500), ו נוגדן נגד חלבון הריבית (כלומר, ארנב). - בצע את שלבים 6.5-6.7.
- הוסף מיקס נוגדן משני מדולל במאגר חסימת לשקופית (300 ליטר-400 μL/שקופית): אלקסה Fluor 488 נגד עוף IgG (1:500), Cy3 נגד עז IgG (1:500), ו אלקסה Fluor 647 אנטי ארנב IgG (1:500).
- בצע את השלבים 6.9-6.14.
8. רכישת תמונה וקוונפיקציה של שיבוטים MADM
- לזהות ולתעד את הסעיפים המכילים שיבוטים ואת מיקומם בקליפת המוח.
הערה: מספר המקטעים שמתפרס על-ידי שיבוט ישתנה בהתאם למועד המושרה של השכפול, למנהל ההתקן של CreerT2 ולזמן הניתוח. ניתן לבצע שלב זה גם במיקרוסקופ מוקד או במיקרוסקופ אפיפייתי. - באמצעות מיקרוסקופ קונפוקלית וקד הפוך, להתחיל על ידי בחירת וקביעת התצורה של קווי לייזר נכונה מסננים. עבור מוחות MADM, בחר DAPI, GFP, ו-tdT (עירור: 358 nm, 488 nm, ו 554 nm, בהתאמה; שיא פליטת: 461 nm, 507 nm, ו-581 nm, בהתאמה). ודא שהחור מוגדר ליחידה אוורירית אחת לאיכות הדמיה אופטימלית.
- עבור הגדרות ספציפיות המוקד, שיבוטים תמונה עם מטרה 20x ו-1x זום. עבור תמונות שישמשו בכמת, השתמש בערך מהירות סריקה לשכון בערכים של 1.52-2.06 μs (ערכים 7-8 בתוכנה לרכישת תמונות) ללא ממוצע. להתאים את עוצמת הלייזר ולהשיג הגדרות עבור כל ערוץ לפי הצורך.
הערה: בהתאם לאיכות התמונה הדרושה, הגדרות עבור מהירות סריקה וחישוב ממוצע עשויות להשתנות. - לאחר שיבוט מזוהה בבירור, לארגן אריחי הדמיה כדי לכסות את כל הסעיפים הרלוונטיים שיבוט. התאימו את מחסנית ה-z כך שכל התאים המסומנים ב-MADM בשכפול נלכדים עם מרווח זמן של פרוסת מחסנית 1.5 μm/z. כוונן את אזור האריחים כך שרוחב כולו של קליפת הקליפה ייתפס בעת הדמיה של השכפול (כלומר, ממשטח הפיקה אל ה-callosum).
- תמונה שיבוטים בודדים פורש מקטעים מרובים ברציפות, להבטיח כי כל מקטעים ללא תאים בתוך שיבוט הם עדיין בתמונה למטרת שחזור תלת-ממד ופרשנות נכונה של מידע מרחבי התא.
- לנתח כל מקטע המכיל תאים של שיבוט MADM ברציפות מrostral אל קצה caudal של קליפת המוח. הבחנה בודדים נוירונים ו גליה מבוסס על המבנה שלהם ו/או סימן כתמים. הקלט מידע מעבר במקביל לפי גבולות השכבות המתאימות שהוגדרו על-ידי כתמים גרעיניים (DAPI).
הערה: ראו איור 4 עבור תוצאות מייצגות לניתוח עובריים ואיור 5 עבור תוצאות מייצגות לניתוח למבוגרים.
9. סדרתי 3D שחזור של שיבוטים
הערה: שחזור תלת-ממד של שיבוטים בודדים המוצגים על מקטעים המוח הסדרתי הוא שימושי עבור תצוגה חזותית, כמו גם ניתוח של ארכיטקטורות שבטים תלת-ממדיים, ניתן לבצע בהתאם לשלבים הבאים.
- תפר והפתיל מיזוג תמונות באריחים מבוסס על פרמטרי רכישה באמצעות תוכנה לרכישת תמונות. פתח קובץ. czi ולאחר מכן הפעל את שיטת התפרים תחת הכרטיסייה עיבוד בתוכנה זן (zeiss).
- ייצוא ערימות תמונה תפור כמו z מטוסי מטוסים בפורמט TIFF. פתח את הקובץ תפור. czi ולאחר מכן הפעל את שיטת ייצוא התמונה תחת הכרטיסיה עיבוד . עבור תמונות רב-ערוצי, לייצא כמו תמונות אדום/ירוק/כחול לעיבוד התמונה הבאה.
- חזור על שלבים 9.1 ו-9.2 עבור כל חלק במוח הטורי של שיבוט.
הערה: לשחזור מדויק תלת-ממדי, כל חלקי המוח בתוך שיבוט, כולל אלה ללא תאים המסומנים בתווית, חייבים להיות גם מעובדים. - ששרשר תמונות בודדות לערימה אחת בסדר החל מrostral ביותר כדי להגיע למישור ה-caudal z ביותר באמצעות תוכנת עיבוד תמונות קוד פתוח כגון imagej/פיג'י67,68.
הערה: יש להסיר את כל התמונות הריקות בקצות כל מקטע מוח. - במקרה הצורך, תקן את מחסנית התמונה שמתקבלת משלב 9.4 עבור יישור שגוי באמצעות התוסף ImageJ שנקרא "Multistackreg" על-ידי ביצוע השלבים 9.5.1-9.5.5. אם אין צורך ביישור תמונה, המשך לשלב 9.6.
הערה: תוסף זה מבצע יישור תמונה של הערוץ עם הניגודיות הגבוהה ביותר (בדרך כלל DAPI) ולאחר מכן מחיל את השינוי המוקלט על ערוצים אחרים, ובכך מאפשר יישור תמונה אמין של ערימות רב-ערוצי. תוסף עזר שנקרא "Turboreg" חייב להיות מותקן מראש.- ב-ImageJ, התקן את התוספים "Multistackreg" ו-"turboreg".
- פתח את ערימת התמונות של תמונות שיבוט שהתקבלו משלב 9.4 ליישור. פצל ערוצים לתוך DAPI (כחול), GFP (ירוק) ו-tdT (אדום) בתוך אפשרות הצבע תחת כרטיסיית תמונה .
- הפעל "Multistackreg" תוסף כדי ליישר ערוץ dapi על ידי שינוי "גוף נוקשה" ולשמור את קובץ השינוי.
- החל את קובץ ההמרה השמור על שני הערוצים האחרים באמצעות "Multistackreg".
- מזג את כל שלושת הערוצים המיושרים ושמור את המחסנית המיושרת.
- כדי לכוון את השכפול ב-ImageJ לסובב מחסנית של תמונות שיבוט שהתקבלו משלב 9.4 (או step 9.5.5 לאחר יישור) בכיוון אנכי עם משטח pial על גבי הקצה התחתון של הקורפוס. . חתוך במישור הxy במידת הצורך
- עבור מצגת איכותית וניתוח כמותי, צור תמונה מקסימלית של הקרנת z (שלב 9.8) או בצע עיבוד תלת-ממדי (שלב 9.9) של השכפול.
- ב-ImageJ, פתחו את מחסנית התמונה משלב 9.6 ובחרו אפשרות הקרנה Z עם עוצמת הקרנה מקסימלית. זה יפיק תמונה של השיבוט כולו מוקרן על אותו מישור.
- ב-ImageJ, פתחו את מחסנית התמונה משלב 9.6 ובחרו בפונקציה 3d של פרוייקט z כדי ליצור הדמיה תלת-ממדית של השכפול שניתן לסובב.
הערה: חשוב בשלב זה כדי להזין את מרווח הפרוסה הנכון המקבילה לעובי הערימות הבודדות במהלך רכישת תמונה. יש להשתמש בכלי האינטרפולציה כדי להסיר פערים בין פרוסות.
תוצאות
MADM תוצאות החוקה של חלבונים בצבע ירוק ואדום פונקציונלי עם שתי תאים בתים כל אחד ביטוי אחד משני חלבונים פלורסנט על כרומוזום G2-X אירועי הפרדה (איור 1א). בגלל אירועים MADM התוצאה לתיוג קבוע וברורים של שני ליננים הצאצא, הערכה הניתנים לשינוי של התאים הירוק והאדום של תא ביתי (subclones) ניתן לבצע. משתנים כולל דפוס חלוקה (למשל, סימטרי לעומת אסימטרי) ופוטנציאל (למשל, מספר צאצאי) של הקדמון המקורי ניתן לקבוע. כימות כל שיבוט מסומן בתווית משנה כאשר בדיעבד לקבוע אם התא המקורי הקדמון עובר מחלקות ההתרבות סימטרי, או אסימטרי, מחלקות נוירוגניים בזמן האינדוקציה TM. מחקרים קודמים מקובצים Emx1-creert2 או nestin-T2 creer שיבוטים השלכה הנגזרים ההטלה בקליפת המוח לשתישיעוריםרחבים7,11,46. הראשון, כינה "שיבוטים סימטרי מתרבים", מורכבים בממוצע של מספר ניכר של נוירונים, עם שני שיבוטים ירוק ואדום המכיל ארבעה או יותר נוירונים כל אחד. הקבוצה השנייה, "שיבוטים אסימטריים" מגדיר מחלקה של שיבוטים שבהם "מיעוט" תת-שיבוט מכיל פחות משלושה נוירונים ואת "הרוב" subclone, ארבעה או יותר11. הגדרות אלה הם ספציפיים RGPs בקליפת המוח וייתכן שיהיה צורך לעבור בעיון עבור אזורי מוחי אחרים ורקמות. עבור שני כיתות של שיבוטים קורטיקלית, צאצאים יחולקו לאורך שכבות שטחיות ועמוקים.
בעת עיצוב לימודי שבטים MADM יש מספר היבטים שיש לקחת בחשבון. הזמן שבו אירועים MADM המושרה על ידי המינהל של TM הוא שיקול מפתח (איור 3). עבור הקרנה בקליפת הבית הטלה ההקרנה MADM שיבוטים (כלומר, באמצעות Emx1-CreERT2 או Nestin-CreerT2) ב E10, כמעט כל rgps היו עדיין במחלקות סימטרי11. לכן, אינדוקציה ב E10 עם TM לכדו סיבובים מרובים של הגברה RGP מתרבים והביא שיבוטים עם מספרי עצב גבוה. עם זאת, מספר RGPs ב E10 היה בדרך כלל קטן, ולכן הממשל TM שנוצר מאוד מאוד אירועים MADM (לפעמים פחות מאחד לכל מוח). רוב ה-RGPs הוחלף ממחלקות נוירוגניים סימטריות בסביבות E12. כדי למקד את המשובטים הנוירוגניים אסימטרי לחלוטין, זה היה הטוב ביותר לגרום ב-E12 או מאוחר יותר (איור 3). הזמן בין אינדוקציה TM והתבוננות שילוב מחדש של MADM האירועים בקליפת המוח נטו להיות פחות מ -24 h. הזריקות היו השיטה המועדפת לניהול TM בשלבים עובריים עבור שיטה זו משום שהוא הוביל לשגות יותר בשבטים. חשוב גם לשמור על מינון TM למינימום משתי סיבות. ראשית, אם מגדיל את הקצב מחדש MADM, ההסתברות של גרימת מרובים, אולי חופפים, שיבוטים הוא גבוה יותר. שנית, אם הרבה יותר מדי TM מועברת, שיעור מוגבר של הפלות, העובר מחדש, וגדלים המלטה קטן יותר עשוי להיות נצפתה. הפלות בערך כמחצית של כל הסכרים בהריון נצפתה כאשר זריקות TM נמסרו ב E10. תדירות זו ירדה מ E11 ופחתה ל כ 1/3 בקירוב של סכרים הריון ביטול. לסיכום של מינונים TM, האינדוקציה פעמים, ונהגים CreerT2 המשמשים במחקרים madm הקודם, להפנות לטבלה 1. פעילות עיתונאי בהעדר TM נצפתה עם כמה TM-inducible CreerT2 מנהלי התקן T269. ביטוי חוץ רחמי או MADM שילוב אירועים מחדש בהעדר TM לא נצפתה עם Emx1-Creert2 של מנהלי ההתקנים T2 של nestin-creer . זה עשוי להיות באופן חלקי בשל העובדה כי TM בתיווך כרומוזום טרנס שילובים להתרחש בערך 1:1000 כדי 1:10000 בתדר נמוך יותר מאשר cis-שילובים, הפחתת ההסתברות של התוויות MADM רחמי.
גורם נוסף שכדאי לשקול בעת תכנון ניסוי בניתוח שבטים MADM הוא משך המחקר. שינוי אורך הזמן בין אינדוקציה TM וכאשר הניסוי היה ניתח (א) (חלון זמן) מציג את הדינמיקה של תא גזע לאורך זמן64. חלונות זמן עובריים קצרים (כלומר, TM/E11-A/E13; TM/E11-A/E16) כבשו את הדינמיקה של נוירוגנזה עובריים (איור 4). השוואת שיבוטים משני חלונות או יותר זמן מספק תובנה כמותית למספר התאים המיוצרים ואיך התפלגות העצב משתנה בשלבים שונים של התקדמות השושלת64. כדי ללכוד את כל הפוטנציאל של שיבוטים בודדים, יש צורך להאריך את חלון הזמן שנותחו לתוך לידה או מבוגרים timepoints7,11,12. דוגמאות של שיבוטים נאוקורטיקליים המושרה העובר ונותחו במבוגר מוצגים באיור 5. של הערה, נוירוגנזה קורטיקלית היא השלימה ברובו, gliogenesis מגדילה על ידי E17. כ 1/6 rgp נוירוגניים גם להמשיך ליצור אסטרוציטים ו/או oligodendrocytes הפוך11.
שיבוטים סימטריים להתרחש כאשר RGPs עוברים אחד או יותר סיבובים של חלוקה מתרבים11. שיבוטים RGP המושרה בין E10-E12 היו בממוצע גדול יותר בגודל וסיפק יותר תכונות מרחבי של התפלגות תא העצב הסופי (איור 4A-C). שיבוטים עם נוירונים באופן יחסי מופץ יחסית ברחבי שכבות עמוק ושטחי לקח על "גליל" צורה תוך שיבוטים עם נוירונים יותר מפוזרים בשכבות שטחיות מאשר שכבות עמוקות פיתח "חרוט" צורה11. כדי ללכוד במלואו את המידע המרחבי והורפולוגית של שיבוט, היה צורך לשחזר באופן משני את כל השכפול באמצעות תמונות רציפות. כדי למדוד פיזור שבטים, הפיזור הרוחבי המקסימלי (שנמדד בכל הממדים) ברבדים שטחיים (LII-VI) של שיבוט הושוו לפיזור הנוירונים ברבדים עמוקים (LV/ליב). יחס זה (התפלגות עליונה: הפצה נמוכה יותר) סיפק הבדיקה הניתנת לכימות של צורת השכפול הכוללת.
שיבוטים אסימטריים, היכן שיבוט המיעוט היה שלוש או פחות, סיפק תובנה לפלט העצבי של rgp יחיד (איור 4D-F ואיור 5a-f)7,11,12. אוכלוסיית רוב (subclone גדול) יכול להיות מתויג גם באדום או ירוק, עם ממוצע של כ -7 הקרנה מרגש הנוירונים לכל שיבוט כאשר המושרה באמצעות Emx1-creert2 או nestin-creert2(איור 5G)7,11,12. המספר הכולל של תאים שיבוט MADM יכול להיות נוסף על ידי ניתוח התפלגות הנוירונים בשכפול גדול ברחבי שכבות שטחיות ועמוקים. אוכלוסיית המיעוט (תת-שיבוט קטנה) הותווית על ידי הצבע ההופכי והייתה בממוצע 1-2 תאים לכל שיבוט (איור 5H). סה כ "גודל יחידה", אשר היה בממוצע 8-9 נוירונים, יכול להיות מחושב על ידי הוספת משנה קטנים וגדולים יחד (איור 5I)7,11,12. חשוב לציין כי בעוד הפלט העצבי של rgps היה צפוי מאוד, היה מידה של שבטים טרוגניות12,70.
הקדמה של מוטציה באמצעות הקלטת MADM מאפשר את הדור של פסיפסים גנטיים, מתן שיטה ייחודית לנתח את הרגולטורים המולקולריים של התקדמות השושלת של תא גזע. ככזה, MADM מספק פלטפורמה ניסיונית ללא תחרות כדי ללמוד את הפונקציה האוטונומית התא של הגן (למשל, האגודה שלה microcephaly או macrocephaly). על ידי השוואת שיבוטים המושרה בפסיפס גנטי MADM למשובטים המושרה ב-MADM שליטה, הבדיקה כמותית מאוד של שינויים מספרי נוירונים והפצה ניתן ליצור. מחקרים מבוססי MADM הקודם לכמת את הפונקציה האוטונומית התא של Otx1 ב microcephaly היווצרות ברמת המשובטים (ראה איור 6A-E עבור דוגמה ייצוגית)11. במחקר אחר, ניתוח שבטים MADM הראה כי Ndel1 אינו תא באופן עצמאי לווסת מספרים תא הקרנה, אבל במקום את היכולת של נוירונים היילוד להיכנס או להעביר בתוך הצלחת קליפת המוח, אשר מאוחר יותר צורות קליפת המבוגר46. מחקרים אלה הפגינו את האופי הכמותי ביותר של ניתוח שבטים MADM בחקר הפונקציות האוטונומית התא של גנים המסדירים פיתוח קורטיקלית. אין כרגע דוגמאות בספרות באמצעות MADM ללמוד גנים מעורבים מקרוצפליה ברמת המשובטים. עם זאת, במחקרים עתידיים בניתוח של גנים הרלוונטיים לשליטה בגודל הקורטיקלית בכלל יכולים לספק תובנות רצויות מאוד ברמה המולקולרית והתאית.

איור 1: עקרון MADM למעקב אחר השושלת וניתוח שבטים במפלס תא גזע אחד. (א) לבצע מעקב אחר השושלת וניתוח שבטים עם madm, שני רכיבים חייב להיות נוכח. ראשית, יש לכוון את הקלטות MADM לאותו משכן זהה על כרומוזומים הומוולוגיים. הקלטות מורכבות משני גנים של כתבת פלורסנט של צ'יאריק, eGFP (ירוק, [G]) ועגבניה דו-דימר (אדום, tdT [T]). הקלטת GT מכיל את ה-N-טרמינוס של egfp ואת C-הטרמינוס של tdt, מופרדים על ידי אינטרון המכיל אתר loxp. הקלטת TG בנויה בהיפוך, עם ה-N-טרמינוס של tdt ו-C הטרמינוס של egfp. שנית, הביטוי של היצורים recombinase חייב להתרחש בתא המכיל את הקלטות madm המיועד. אתרי ה-loxP משמשים כיעד לשילוב מחדש של מתווכת היצורים, והתוצאה היא החוקה של שתי קלטות הביטוי בו זמנית. אם שילוב מחדש מתרחש במהלך השלב G2 של מחזור התא ואחריו הפרדה X (G2-X), שתי התאים בתים יהיה לבטא אחד משני חלבונים פלורסנט. (ב) עקרון מאדמ לניתוח של פסיפס גנטי ברמת שיבוט אחת. אלולים מוטנטים (מוטציות הנקודה, מחיקות, הוספות, loxp-מוקף תנאי אללים מותנה כפי שתוארה באיור 1b, וכו ') ניתן להציג מחדש את הקלטת TG-madm באמצעות השילוב meiotic (לראות איור 2 ו היפאנמייר ואח '46 לפרטים על איך להציג אללים מוטציות ל אם recombinase מתווך-X מתווכת הקשר בין השני מתקיים בין הקלטות madm זה התוצאות באחד gfp + homozygous מוטציה תא (genex-/-) הגן של עניין אחד tdt + homozygous תא סוג פראי (genex+/+) בסביבה heterozygous בלתי מתויג46,47,71. התוצאות תיוג חלופי לא נעשה שימוש בניתוח המשובטים (כלומר, תאים צהובים) תוארו בעבר בפירוט11,46,47. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
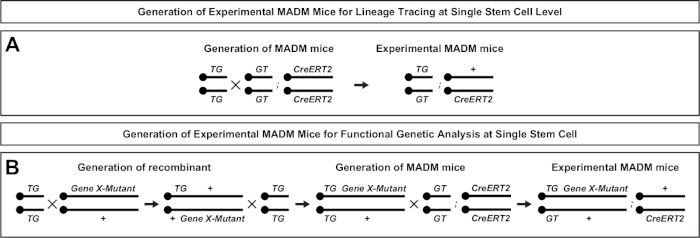
איור 2: מערכות רבייה עבור הדור של עכברים MADM ניסיוני עבור מעקב השושלת. מערכת רבייה עבור הדור של שליטה MADM (א) ו ג'ין X madm (ב) הניסויים עכברים לניתוח שבטים. למידע נוסף אודות תבניות הרבייה של madm ר' ביטלט ואח '7 והיפאנמייר ואח '7,46. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: מסלול הזמן בדיקת שושלת היוחסין מבוסס MADM מבוססי. סכימטי של חלונות הזמן עיצוב ניסיוני. עבור תבניות האורך של הדגימה, נקודת הזמן של אינדוקציה שיבוט נשארה קבועה ואורך התקופה לפני ניתוח מגוונת. בדגימת מרווח מתקדם, נקודת הזמן של הניתוח נשארה קבועה, אך זמן האינדוקציה מגוון. ניתן להשתמש בשילוב בין אחת לשתי הגישות בהתאם לשאלות שמטופלות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: ניתוח שבטים MADM המתפתח והבוגר בקליפת המוח. TM בתיווך madm אינדוקציה שיבוט ב סימטרי מתרבים (tm ב E10) (A-C) ו סימטרית תפלת רכזית (tm ב E12) (D-F) חלוקת rgps. מתוארים הם שיבוטים מאדמ בודדים ב vivo בפיתוח (TM/E10-a/E16 ו-tm/E12-a/E16) (ב, E) ובוגרים (tm/E10) (C, F) ב -madm-11GT/TG; Nestin-creerT2 +/- (ב, ה) ו -madm-11GT/TG; Emx1-creerT2 +/- (ג, F). הפלט תא העצב היה עצמאי של צבע שיבוט והרוב ירוק/תת מיעוט שיבוטים יכול להיות מושווה הרוב7האדום/מיעוט שיבוטים תחת תנאישליטה 7,11. כ 1/6 של שיבוטים למבוגרים גם הכיל אסטרוציטים ו/או oligodendrocytes הפוך, המצוין על ידי כוכביות לבנות. פאנלים B ו- F משוחזרים באישור היפאנמייר ואח 'מ46 ורונדס וסימונס72, בהתאמה. CP = לוחית הקורטיקלית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
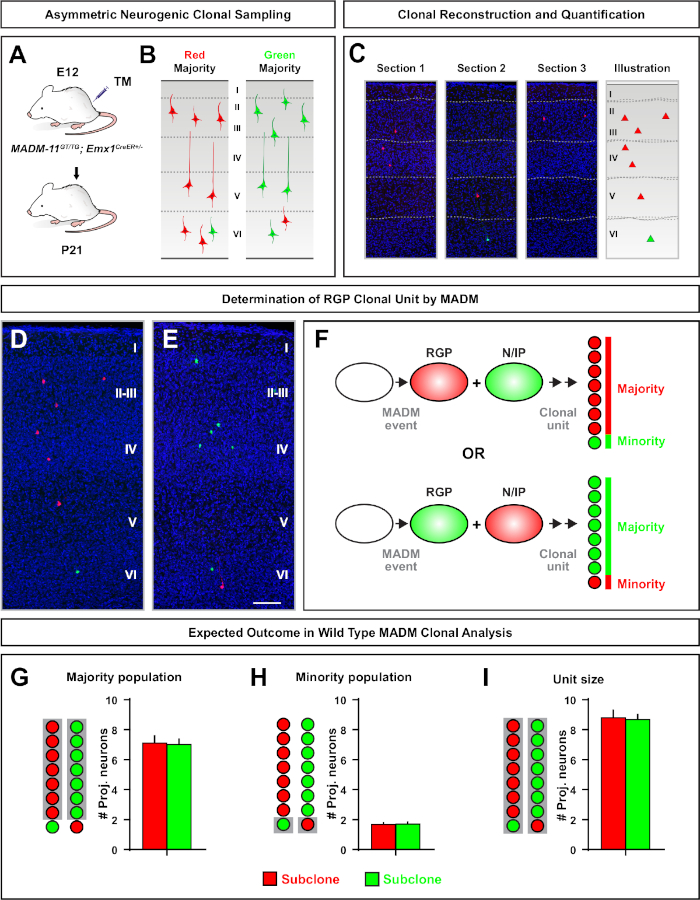
איור 5: ניתוח שבטים MADM כדי ככמת RGP בתיווך פלט תא העצב. ניתוח של הפקת תא עצב (יחידת) הפקה של מערכת העצבים האינדיבידואלית ברמת המשובטים באמצעות MADM7,11. (א) הפרדיגמה הניסיונית לגרימת שיבוטים מmadm אסימטריים בעיקר בקליפת המוח המתפתחת. (ב) אפשרי שיבוט אסימטרי התוצאות עם שיבוט משנה הרוב המסומן בצבע ירוק או אדום (C) מקטעים רצופים הפורש שיבוט אסימטרי נוירוגניים אחת (D, E) 3d שחזור תמונות של הנציגה אסימטרית מג-X שיבוטים מmadm עם רוב האוכלוסייה באדום (ד) או ירוק (E) ב madm-11GT/TG Emx1-CreERT2 +/- עם אינדוקציה TM ב E12 וניתוח ב P21. הערה התאים הירוקים והאדומים המסומנים הם סוג פראי. (F) סכמטי המציין את שני התוצאות הנסיוניות האפשריות madm שיבוט. (ז) קוונפיקציה של גודל האוכלוסייה רוב הנובעים מחידוש RGPS ב madm-11 שיבוטים. (ח) קוונפיקציה של גודל אוכלוסיית המיעוט הנובעים מחידוש rgps ב madm-11 שיבוטים. (I) כימות של הגודל היוניטרית של המשובטים הנוירוגניים מדגני-11. ערכים היפוטעיים יכולים לייצג ממוצע ± SEM. סרגל קנה מידה = 100 יקרומטר (D ו- E). TM = טמוקסיפן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
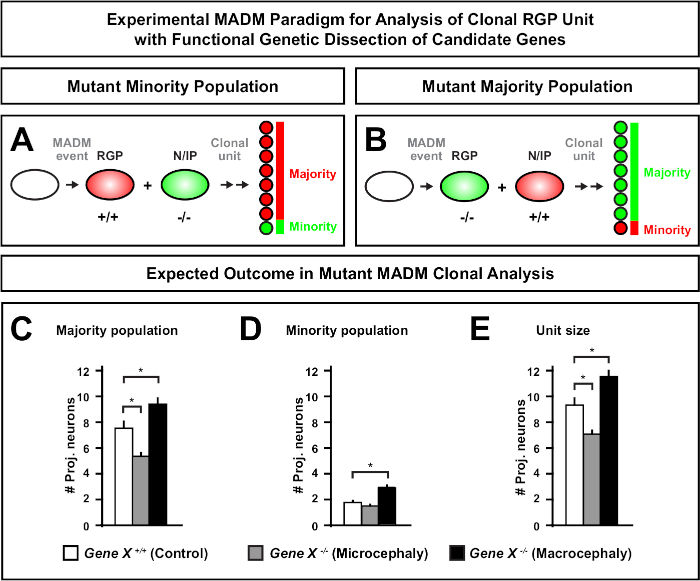
איור 6: ניתוח שבטים MADM כדי ללמוד גנים להוביל microcephaly ו macrocephaly. ניתוח היפותטי MADM שבטים התוצאות בעת ביצוע ניתוח גנטי פונקציונלי של גנים המועמדים להוביל microcephaly או macrocephaly. כדי לנתח את הפונקציות האוטונומיות התא של גן של עניין (gene X) על פלט תא העצב, madm דורש מוטציה אללים כדי להיות מוצג בפני הקלטות madm דרך reiotic שילוב (לפרטים כיצד להחדיר אללים המוטציות לתוך מערכת madm לראות גם איור 2, היפאנמייר et al.46, ו laukoter et al.46,73). (א, ב) סכמטי המציין את הפרדיגמה הניסיונית MADM לניתוח פונקציונלי של יחידות RGP שבטים. שיבוט התת-מוטציות יכול ליצור את אוכלוסיית המיעוט (A) או הרוב (B). (C-E) ניתוח היפותטי MADM שבטים התוצאות כאשר כימות שליטה MADM (ברים לבנים), ג'ין-x madm microcephaly (ברים אפורים) ו -ג'ין-x madm מקרוצפליה שחור ברים) אסימטרי שיבוטים. (ג) קוונפיקציה של גודל אוכלוסיית הרוב. (ד) קוונפיקציה של גודל אוכלוסיית המיעוט. (ה) קוונפיקציה של הגודל האוניטרי של שיבוטים נוירוגניים אסימטריים. ערכים היפוטטיים יכולים לייצג את הממוצע ± SEM. S = תרחיש היפותטי שבו ההפרש במספר התאים המשניים של השכפול עשוי להגיע למשמעות, יחסית לשליטה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
שולחן 1: לימודי שבטים MADM בספרות. סיכום של מחקרים בספרות המכילה MADM השושלת שבטים ניסויים, כולל CreerT2 מנהל התקן בשימוש, מינון TM, ואת זמן ההזרקה. אנא לחץ כאן כדי להציג טבלה זו (לחץ לחיצה ימנית כדי להוריד).
Discussion
שיטה להשתמש MADM לעקוב אחר השושלת הסלולרית של RGPs בודדים בvivo בקליפת המוח המתפתחת מתוארת. בשילוב עם TM-inducible CreerT2, אירועים madm יכול להיות בדיוק מתוזמן, מתן בדיקה חזותית איכותית מאוד כמותית של דפוסי החלוקה של תא גזע ברמת התא בודד. על ידי titrating המינון של TM מועברת, במצב אידיאלי ממוצע של פחות משיבוט אחד לחצי הכדור הקליפת המוח ניתן להשיג, מתן הפרדה מרחבית נאותה להבדיל חד משמעית שיבוטים בודדים. על ידי שמירה על שלמות רקמות, שיטה זו גם לוכדת מידע חיוני לגבי מיקום, מורפולוגיה, ומספרי תאים מוחלטים. קלטות madm על Chr. 11,11,12,46,56,57, על chr. 751, ואת madm המקורי ב Rosa2647,53,59 שימשו במחקרים madm שבטים. ברזולוציה גבוהה של תאים בודדים מספק תובנה חסרת תקדים לתוך המבנה והקשר שבטיים של תאים ביתי ומאפשרת הדמיה חיה של תאי גזע מתרבים ושיבוטים המתעוררים46,52.
ניתוח קיסרי וטיפוח הגורים לניתוח של שיבוטים בשעת לידה פוסט לידה הוא צעד הכרחי וקריטי בפרוטוקול. בהתאם למצב הבריאותי של הסכר בהריון TM שטופלו, ייתכן שלא יהיה צורך לבצע ניתוח קיסרי. עם זאת, העלאת גורים עם אמא אומנת עדיין נדרש, כי האם TM מטופלים יכול להיות בעייתי מנקה. הבדלים לא נצפו בצורך לטפח עם נהגים שונים של CreerT2 . שני קווי MADM ואמהות מאמצות נשמרים על רקע CD-1 החוצה. אם ניתוח קיסרי אינו הכרחי, הסכר TM שטופלו בהריון בשימוש כדי לייצר כלבלבים ניסיוני ניתן לעשות שימוש חוזר עבור ברים ניסיוניים נוספים בהתאם לעקרונות של 3R (לשים לב כי זה יכול להיעשות רק אם רישיונות בעלי חיים לאשר לאשר בפרקטיקה זו). אמהות מאמצות יכולות לשמש לטיפוח הגורים בתוך יומיים לאחר שילדו, אך שיעורי הצלחה גבוהים יותר נצפו כאשר אמהות מאמצות נותנות לידה באותו היום כמו העכברים הניסיוניים שחייבים להיות מאומצים. לכן, חשוב להגדיר מתגים מתוזמנים עבור אמהות מאמצות במקביל למטגים ניסיוניים בשלב 1.1. שמירה על מספר המלטה דומה המלטה של אמא אומנת המקורי יכול לשפר את שיעור ההישרדות של הגורים הטיפחו, ולכן הסרה של חלק כל המלטה המקורי עשוי להיות הכרחי. צעדים נוספים העשויים לשפר את הטיפוח כוללים לשפשף את כפפות הניסויים בפסולת ומזון (כדי להסיר את ניחוח הכפפות); לשפשף בעדינות את הגורים לאחר ניתוח קיסרי עם שברי המלטה המלוכלכת של אמא אומנה, לקנן; והצבת הגורים במגע הקרוב עם גורי האם המאמצת לפני מיקומם בכלוב העכבר המאומץ.
כמו בשיטות אחרות המבוססות על כתב היוחסין, שיקול זהיר יש לנקוט בעת בחירת הנהג האופטימלי של CreerT2 עבור ניסויים שבטים madm. ראשית, היזם צריך להביע את הrecombinase הן זמנית באופן זמני באוכלוסייה הקדמון של העניין. מציאת מיזם זה יכול להיות מאתגר, משום שיזמים מסוימים עשויים לשנות דפוסי ביטוי או להיות מושתקים בשלבים שונים של התפתחות. כדי לשפר את סוג התא הספציפי recombinases ספציפיים לאתר, כל אחד מהם מונע על ידי היזמים נפרדים, נעשה שימוש. כאשר אחד או שניהם recombinases מבוטאים באותו תא, זה מתייג את התא ואת צאצאה עם כתבת פלורסנט74,75,76,77. לסיכום, חשוב לבחור את מנהל ההתקן של CreerT2 הספציפי לאוכלוסיה של ושלתי מנותח.
השלב הקריטי ביותר בשיטה זו הוא זיהוי של שיבוט, מכיוון שעל כל התאים להיות נגזרים באופן חד משמעי מאירוע שילוב מחדש יחיד (שלב 8.1). טיטור של ריכוז TM מבטיח פחות מאשכול אחד של תאים אדומים/ירוקים לחצי הכדור המוח ומגדיל את ההסתברות לנתח שיבוט יחיד (שלב 2.2)7,11. יש להיפטר ממשובטים אם אשכולות שכנים של תאים מתרחשים בתוך 500 יקרומטר של שיבוט של ריבית. לכן, חשוב לבחון מספר סעיפים לפני ואחרי הופעתו של שיבוט כדי להבטיח כי אין אירועים נוספים שילוב מחדש בקרבת מקום. בשל האות החלשה של fluorophores, יש צורך לבצע אימונוהיסטוכימיה עבור eGFP ו tdT ב שיבוטים עובריים (ראה סעיף 6). זה מומלץ רק בשיבוטים למבוגרים אם אנטיגנים נוספים יהיו מיופילים. כאשר הדמיה שיבוטים, חשוב ללכוד את הרוחב כולו של קליפת המוח שבו השיבוט ממוקם (כלומר, ממשטח pial כדי callosum קורפוס; ראה שלב 8.4) כדי לא להחמיץ תאים. פעולה זו מקלה גם על יישור תמונה במהלך עיבוד תמונה (סעיף 9). סעיף 8 של הפרוטוקול דורש מיקרוסקופ קונפוקלית וקד הפוך, אבל ניתן להתאים בהתאם לכיוונון המיקרוסקופ זמין. ניתן להשתמש במיקרוסקופיה אפיפלואורסצנטית, אך מיקרוסקופיה קונפוקלית מומלצת משום שזה מוביל לירידה בזיהום האור מחוץ למישור המיקוד. חשוב גם שעוצמת הלייזר והרווח מותאמים כך שניתן יהיה לזהות את התאים הירוקים, האדומים והצהובים. ללא קשר לכיוונון, מומלץ להשתמש במטרה של 20x לפחות כדי להבטיח הפרדה מרחבית מלאה של תאים ממוקמים היטב. בנוסף להקלטה של עומק קליפת המוח של כל התאים (שלב 8.6), אזורים קורטיקליים שבהם המשובטים ממוקמים חייב להיות מזוהה באמצעות אטלס המוח כגון אטלס המוח אלן או מפות קואורדינטות סטריאוטקאית אחרת. הפרדיגמה למתן שמות לקבצים צריכה להיות גם מאומצת כדי לוודא שתמונות שיבוט ניתנות לזיהוי בקלות. ניתן לכלול את המידע הבא בשמות הקבצים: מזהה תמונה ייחודי, תמונת תאריך צולמה, גנוטיפ של בעל חיים, גיל אינדוקציה, גיל ניתוח, מספר תמונה ביחס לשאר התמונות מאותו שיבוט.
הקדמה של מוטציה בתוך הקלטת madm אחד באופן מאפשר את הדור של פסיפסים גנטיים71 ומאפשר את הניתוח של הרגולטורים המולקולריים של השושלת ואת סוג התאים השונות ברמה שבטיים7,11,46,62. כדי ליצור פסיפס גנטי עם MADM, את הקלטות MADM חייב להיות מקושר באופן דומה לכרומוזום זהה כמו גן העניין (ראה איור 2 לצורך רבייה). זה מגביל את ניתוח המשובטים הנוכחי עם MADM לגנים הממוקמים Chr. 751, chr. 1146, chr. 1251, ו Chr. 6 הRosa26 לוקוס47. מחקרים עתידיים ישתמשו בקלטות MADM ממוקדות כל כרומוזום, המתיר ניתוח פסיפס של כמעט כל הגנים של הגנום העכבר ברמת המשובטים.
לבסוף, MADM אינו מוגבל לניתוח של תאים מחולל קדמון בקליפת המוח המתפתחת. המחקר של נישות רבות של תאי גזע יכול להפיק תועלת מהיכולת לפתור הסדרים זמן של תאים קשורים. על-ידי החלת madm לאזורים אחרים של המוח, תנאי מחלה (למשל, סרטן), או ברקמות אחרות47,50,51,52,53,54,55,56,57,58, 59,, מחקריםחשפו שושלת היוחסין קשרים במשובטים נגזר מכיתות מגוונות של מחולל שבטים ותאי גזע (ראה שולחן 1 לרשימה עוד יישום מעניין בעתיד של MADM היא לשלב אותו עם כתבים פונקציונליים או subcellular נוספים, אשר יגדיל את מידת המידע שניתן לרכוש מן המשובטים.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
אנו מודים לכל חברי המעבדה לדיון, מתקן Bioimaging, מדעי החיים ומתקן טרום-קליני באוסטריה IST לתמיכה טכנית. עבודה זו נתמכת על ידי קרנות מוסדיים של הIST האוסטרי; R.B. קיבל תמיכה מקרן המדע האוסטרי (FWF) ליזה מייטנר (M 2416); נ. א. התקבלה תמיכה מקרן המדע האוסטרית (FWF) פירברג-פרוגרמה (T 1031); GC קיבל תמיכה מאופק 2020 של האיחוד האירופי תוכנית מחקר וחדשנות תחת מארי Skłodowska-קירי מענק הסכם No. 754411 כעמית ISTplus פוסט דוקטורט; A.H. קיבל תמיכה מ-ÖAW DOC (מלגת הדוקטורט של האקדמיה האוסטרית למדעים). מחקר זה היה נתמך גם על ידי מועצת המחקר האירופי (ERC) תחת אופק האיחוד האירופי של 2020 תוכנית מחקר וחדשנות (הסכם הענקת No 725780 LinPro) כדי S.H.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL tuberculin syringe (Omnifix Luer Lock) | Braun | 9204512N | |
| 1,4-diazabicyclooctane (DABCO) | Roth | 0718.2 | |
| 10 mL Syringe (Omnifix Luer Lock) | Braun | 8508429N | |
| 15 mL conical centrifuge | Sarstedt | 65.554.502 | |
| 24 multi-well dishes | Roth/Greiner Bio-one | CE56.1 | |
| 27- gauge x 3/4 needle (Sterican) | Braun | 16010256E | |
| Corn oil | Sigma | C8267-500ML | |
| Coverslips (24 x 60 mm #1) | Thermo Fisher Scientific (Menzel) | 15747592 | |
| Cryostat Cryostar NX70 | Thermo Fisher Scientific | 957000H | |
| Dako Pen (Wax marker) | Agilent | S200230-2 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Invitrogen | D1306 | |
| Disposable microtome blade (MX35 Ultra) | Thermo Fisher Scientific | 705830 | |
| Fine Forceps (Dumont #5) | Fine Science Tools (FST) | 11254-20 | |
| Glass anti-roll plate | Histocom | M 449980 | |
| Glycerol | Sigma | G5516 | |
| LSM 800 Confocal | Zeiss | ||
| Mounting medium | 25 mg/mL DAPCO, 6 g Glycerol, 2.4 g Mowiol 4-88, 6 mL dH2O, 12 mL 0.2 M Tris-HCl (pH 8.5) | ||
| Mowiol 4-88 | Roth | 0713.2 | |
| Normal donkey serum | Innovative Research | IGDNSER100ML | |
| Paraformaldehyde | Sigma | 441244-1KG | |
| Peristaltic pump 323E/D 400RPM | Watson-Marlow | 036.3124.00A | |
| Sucrose | Sigma | S8501-5KG | |
| Superfrost plus glass slides | Thermo Fisher Scientific | J1800AMNT | |
| Tamoxifen | Sigma | T5648 | |
| Tissue Embedding mold T-12 (22mm square) | Polysciences Inc. | 18986-1 | |
| Tissue-Tek O.C.T | Sakura | 4583 | |
| Triton X-100 | Sigma | T8787-250ML | |
| Trizma hydrochloride | Sigma | 93363 | |
| Tween-20 | Sigma | P9416-100ML | |
| Software and Plugins: | |||
| Fiji | 1.52p | Fiji | |
| MultiStackReg | 1.45 | Download link | |
| TurboReg | EPFL Bioimaging | ||
| Zen Blue | 2.6 | Zeiss | |
| Experimental Models: Organisms/Strains: | |||
| Mouse: Emx1-CreER | The Jackson Laboratory | JAX:027784 | |
| Mouse: MADM-11-GT | The Jackson Laboratory | JAX:013749 | |
| Mouse: MADM-11-TG | The Jackson Laboratory | JAX:013751 | |
| Primary antibodies: | |||
| Chicken anti-GFP 1:500 | Aves Labs | GFP-1020 | |
| Goat anti-tdTomato 1:500 | Sicgen Antibodies | AB8181-200 | |
| Rabbit anti-RFP 1:500 | MBL | PM005 | |
| Secondary antibodies: | |||
| Donkey Anti-Chicken Alexa Fluor 488 1:500 | Jackson Immuno Research | 715-475-150 | |
| Donkey Anti-Goat Cy3 1:500 | Jackson Immuno Research | 705-165-147 | |
| Donkey Anti-Rabbit Cy3 1:500 | Jackson Immuno Research | 711-165-152 |
References
- Malatesta, P., et al. Neuronal or glial progeny: regional differences in radial glia fate. Neuron. 37 (5), 751-764 (2003).
- Miyata, T., Kawaguchi, A., Okano, H., Ogawa, M. Asymmetric inheritance of radial glial fibers by cortical neurons. Neuron. 31 (5), 727-741 (2001).
- Noctor, S. C., Flint, A. C., Weissman, T. A., Dammerman, R. S., Kriegstein, A. R. Neurons derived from radial glial cells establish radial units in neocortex. Nature. 409 (6821), 714-720 (2001).
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30 (1), 465-502 (2014).
- Desikan, R. S., Barkovich, A. J. Malformations of cortical development. Annals of Neurology. 80 (6), 797-810 (2016).
- Gao, R., Penzes, P. Common mechanisms of excitatory and inhibitory imbalance in schizophrenia and autism spectrum disorders. Current Molecular Medicine. 15 (2), 146-167 (2015).
- Beattie, R., et al. Mosaic Analysis with Double Markers Reveals Distinct Sequential Functions of Lgl1 in Neural Stem Cells. Neuron. 94 (3), 517-533 (2017).
- Hippenmeyer, S. Molecular pathways controlling the sequential steps of cortical projection neuron migration. Advances in Experimental Medicine and Biology. 800, 1-24 (2014).
- Lodato, S., Arlotta, P. Generating neuronal diversity in the mammalian cerebral cortex. Annual Review of Cell and Developmental Biology. 31, 699-720 (2015).
- Hansen, A. H., Duellberg, C., Mieck, C., Loose, M., Hippenmeyer, S. Cell Polarity in Cerebral Cortex Development-Cellular Architecture Shaped by Biochemical Networks. Frontiers in Cellular Neuroscience. 11, 176 (2017).
- Gao, P., et al. Deterministic progenitor behavior and unitary production of neurons in the neocortex. Cell. 159 (4), 775-788 (2014).
- Llorca, A., et al. A stochastic framework of neurogenesis underlies the assembly of neocortical cytoarchitecture. eLife. 8, e51381 (2019).
- Ma, J., Shen, Z., Yu, Y. C., Shi, S. H. Neural lineage tracing in the mammalian brain. Current Opinion in Neurobiology. 50, 7-16 (2018).
- Caviness, V., Takahashi, T., Nowakowski, R. Numbers, time and neocortical neuronogenesis: a general developmental and evolutionary model. Trends in Neurosciences. 18 (9), 379-383 (1995).
- Schmechel, D. E., Rakic, P. A Golgi study of radial glial cells in developing monkey telencephalon: morphogenesis and transformation into astrocytes. Anatomy and Embryology. 156 (2), 115-152 (1979).
- Kessaris, N., et al. Competing waves of oligodendrocytes in the forebrain and postnatal elimination of an embryonic lineage. Nature Neuroscience. 9 (2), 173-179 (2006).
- Magavi, S., Friedmann, D., Banks, G., Stolfi, A., Lois, C. Coincident generation of pyramidal neurons and protoplasmic astrocytes in neocortical columns. The Journal of Neuroscience. 32 (14), 4762-4772 (2012).
- Anthony, T. E., Klein, C., Fishell, G., Heintz, N. Radial glia serve as neuronal progenitors in all regions of the central nervous system. Neuron. 41 (6), 881-890 (2004).
- Voigt, T. Development of glial cells in the cerebral wall of ferrets: direct tracing of their transformation from radial glia into astrocytes. The Journal of Comparative Neurology. 289 (1), 74-88 (1989).
- Amberg, N., Laukoter, S., Hippenmeyer, S. Epigenetic cues modulating the generation of cell-type diversity in the cerebral cortex. Journal of Neurochemistry. 149 (1), 12-26 (2019).
- Beattie, R., Hippenmeyer, S. Mechanisms of Radial Glia Progenitor Cell Lineage Progression. FEBS letters. 591 (24), 3993-4008 (2017).
- Telley, L., et al. Temporal patterning of apical progenitors and their daughter neurons in the developing neocortex. Science. 364 (6440), eaav2522 (2019).
- Oberst, P., et al. Temporal plasticity of apical progenitors in the developing mouse neocortex. Nature. 573 (7774), 370-374 (2019).
- Telley, L., et al. Sequential transcriptional waves direct the differentiation of newborn neurons in the mouse neocortex. Science. 351 (6280), 1443 (2016).
- Deppe, U., et al. Cell lineages of the embryo of the nematode Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 75 (1), 376-380 (1978).
- Woodworth, M. B., Girskis, K. M., Walsh, C. A. Building a lineage from single cells: genetic techniques for cell lineage tracking. Nature Reviews Genetics. 18 (4), 230-244 (2017).
- Masuyama, N., Mori, H., Yachie, N. DNA barcodes evolve for high-resolution cell lineage tracing. Current Opinion in Chemical Biology. 52, 63-71 (2019).
- Legue, E., Joyner, A. L. Chapter Ten-Genetic Fate Mapping Using Site-Specific Recombinases. Methods in Enzymology. 477, 153-181 (2010).
- Postiglione, M. P., Hippenmeyer, S. Monitoring neurogenesis in the cerebral cortex: an update. Future Neurology. 9 (3), 323-340 (2014).
- Espinosa-Medina, I., Garcia-Marques, J., Cepko, C., Lee, T. High-throughput dense reconstruction of cell lineages. Open Biology. 9 (12), 190229 (2019).
- Hwang, B., et al. Lineage tracing using a Cas9-deaminase barcoding system targeting endogenous L1 elements. Nature Communications. 10 (1), 1234 (2019).
- Kalhor, R., et al. Developmental barcoding of whole mouse via homing CRISPR. Science. 361 (6405), eaat9804 (2018).
- García-Moreno, F., Vasistha, N. A., Begbie, J., Molnár, Z. CLoNe is a new method to target single progenitors and study their progeny in mouse and chick. Development. 141 (7), 1589-1598 (2014).
- Loulier, K., et al. Multiplex Cell and Lineage Tracking with Combinatorial Labels. Neuron. 81 (3), 505-520 (2014).
- Livet, J., et al. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-62 (2007).
- Snippert, H. J., et al. Intestinal Crypt Homeostasis Results from Neutral Competition between Symmetrically Dividing Lgr5 Stem Cells. Cell. 143 (1), 134-144 (2010).
- Amitai-Lange, A., et al. A method for lineage tracing of corneal cells using multi-color fluorescent reporter mice. Journal of Visualized Experiments. (106), e53370 (2015).
- Vasistha, N. A., et al. Cortical and Clonal Contribution of Tbr2 Expressing Progenitors in the Developing Mouse Brain. Cerebral Cortex. 25 (10), 3290-3302 (2015).
- Chen, F., LoTurco, J. A method for stable transgenesis of radial glia lineage in rat neocortex by piggyBac mediated transposition. Journal of Neuroscience Methods. 207 (2), 172-180 (2012).
- Siddiqi, F., et al. Fate mapping by piggyBac transposase reveals that neocortical GLAST+ progenitors generate more astrocytes than Nestin+ progenitors in rat neocortex. Cerebral Cortex. 24 (2), 508-520 (2014).
- Yoshida, A., et al. Simultaneous expression of different transgenes in neurons and glia by combining in utero electroporation with the Tol2 transposon-mediated gene transfer system. Genes to Cells. 15 (5), 501-512 (2010).
- García-Marqués, J., López-Mascaraque, L. Clonal Identity Determines Astrocyte Cortical Heterogeneity. Cerebral Cortex. 23 (6), 1463-1472 (2013).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884 (2019).
- Kim, G. B., et al. Rapid Generation of Somatic Mouse Mosaics with Locus-Specific, Stably Integrated Transgenic Elements. Cell. 179 (1), 251-267 (2019).
- Pilz, G. A., et al. Live imaging of neurogenesis in the adult mouse hippocampus. Science. 359 (6376), 658 (2018).
- Hippenmeyer, S., et al. Genetic Mosaic Dissection of Lis1 and Ndel1 in Neuronal Migration. Neuron. 68 (4), 695-709 (2010).
- Zong, H., Espinosa, J. S., Su, H. H., Muzumdar, M. D., Luo, L. Mosaic analysis with double markers in mice. Cell. 121 (3), 479-492 (2005).
- Ramón y Cajal, S. . Histologie du système nerveux de l'homme et des vertébrés. , (1911).
- Cowan, W. M. The emergence of modern neuroanatomy and developmental neurobiology. Neuron. 20 (3), 413-426 (1998).
- Ali, S. R., et al. Existing cardiomyocytes generate cardiomyocytes at a low rate after birth in mice. Proceedings of the National Academy of Sciences of the United States of America. 111 (24), 8850-8855 (2014).
- Hippenmeyer, S., Johnson, R. L., Luo, L. Mosaic analysis with double markers reveals cell-type-specific paternal growth dominance. Cell Reports. 3 (3), 960-967 (2013).
- Riccio, P., Cebrian, C., Zong, H., Hippenmeyer, S., Costantini, F. Ret and Etv4 promote directed movements of progenitor cells during renal branching morphogenesis. PLoS Biology. 14 (2), e1002382 (2016).
- Bonaguidi, M. A., et al. In vivo clonal analysis reveals self-renewing and multipotent adult neural stem cell characteristics. Cell. 145 (7), 1142-1155 (2011).
- Mayer, C., et al. Clonally Related Forebrain Interneurons Disperse Broadly across Both Functional Areas and Structural Boundaries. Neuron. 87 (5), 989-998 (2015).
- Muzumdar, M. D., et al. Clonal dynamics following p53 loss of heterozygosity in Kras-driven cancers. Nature Communications. 7, 12685 (2016).
- Shi, W., et al. Ontogenetic establishment of order-specific nuclear organization in the mammalian thalamus. Nature Neuroscience. 20, 516 (2017).
- Wong, S. Z. H., et al. In vivo clonal analysis reveals spatiotemporal regulation of thalamic nucleogenesis. PLoS Biology. 16 (4), e2005211 (2018).
- Xu, H. T., et al. Distinct Lineage-Dependent Structural and Functional Organization of the Hippocampus. Cell. 157 (7), 1552-1564 (2014).
- Brennand, K., Huangfu, D., Melton, D. All β Cells Contribute Equally to Islet Growth and Maintenance. PLoS Biology. 5 (7), e163 (2007).
- Ortiz-Alvarez, G., et al. Adult neural stem cells and multiciliated ependymal cells share a common lineage regulated by the geminin family members. Neuron. 102 (1), 159-172 (2019).
- Kaplan, E. S., Ramos-Laguna, K. A., Mihalas, A. B., Daza, R. A. M., Hevner, R. F. Neocortical Sox9+ radial glia generate glutamatergic neurons for all layers, but lack discernible evidence of early laminar fate restriction. Neural Development. 12 (1), 14 (2017).
- Lv, X., et al. TBR2 coordinates neurogenesis expansion and precise microcircuit organization via Protocadherin 19 in the mammalian cortex. Nature Communications. 10 (1), 3946 (2019).
- Mihalas, A. B., Hevner, R. F. Clonal analysis reveals laminar fate multipotency and daughter cell apoptosis of mouse cortical intermediate progenitors. Development. 145 (17), dev164335 (2018).
- Picco, N., et al. A mathematical insight into cell labelling experiments for clonal analysis. Journal of Anatomy. 235 (3), 687-696 (2019).
- Johnson, C. A., Ghashghaei, H. T. Sp2 regulates late neurogenic but not early expansive divisions of neural stem cells underlying population growth in the mouse cortex. Development. , (2020).
- Espinosa, J. S., Luo, L. Timing Neurogenesis and Differentiation: Insights from Quantitative Clonal Analyses of Cerebellar Granule Cells. The Journal of Neuroscience. 28 (10), 2301 (2008).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Liu, Y., et al. Tamoxifen-independent recombination in the RIP-CreER mouse. PLoS One. 5 (10), e13533 (2010).
- Klingler, E., Jabaudon, D. Do progenitors play dice?. eLife. 9, e54042 (2020).
- Hippenmeyer, S. Dissection of gene function at clonal level using mosaic analysis with double markers. Frontiers in Biology. 8 (6), 557-568 (2013).
- Rulands, S., Simons, B. D. Tracing cellular dynamics in tissue development, maintenance and disease. Current Opinion in Cell Biology. 43, 38-45 (2016).
- Laukoter, S., et al. Imprinted Cdkn1c genomic locus cell-autonomously promotes cell survival in cerebral cortex development. Nature Communications. 11 (1), 195 (2020).
- Daigle, T. L., et al. A Suite of Transgenic Driver and Reporter Mouse Lines with Enhanced Brain-Cell-Type Targeting and Functionality. Cell. 174 (2), 465-480 (2018).
- He, M., et al. Strategies and Tools for Combinatorial Targeting of GABAergic Neurons in Mouse Cerebral Cortex. Neuron. 91 (6), 1228-1243 (2016).
- Yamamoto, M., et al. A multifunctional reporter mouse line for Cre- and FLP-dependent lineage analysis. Genesis. 47 (2), 107-114 (2009).
- Plummer, N. W., et al. Expanding the power of recombinase-based labeling to uncover cellular diversity. Development. 142 (24), 4385 (2015).
- Imayoshi, I., Ohtsuka, T., Metzger, D., Chambon, P., Kageyama, R. Temporal regulation of Cre recombinase activity in neural stem cells. Genesis. 44 (5), 233-238 (2006).
- Sasaki, S., et al. Complete loss of Ndel1 results in neuronal migration defects and early embryonic lethality. Molecular and Cellular Biology. 25 (17), 7812-7827 (2005).
- Acampora, D., et al. Epilepsy and brain abnormalities in mice lacking the Otx1 gene. Nature Genetics. 14 (2), 218-222 (1996).
- Soeda, T., et al. Sox9-expressing precursors are the cellular origin of the cruciate ligament of the knee joint and the limb tendons. Genesis. 48 (11), 635-644 (2010).
- Klezovitch, O., Fernandez, T. E., Tapscott, S. J., Vasioukhin, V. Loss of cell polarity causes severe brain dysplasia in Lgl1 knockout mice. Genes & Development. 18 (5), 559-571 (2004).
- Pimeisl, I. M., et al. Generation and characterization of a tamoxifen-inducible EomesCreER mouse line. Genesis. 51 (10), 725-733 (2013).
- Nakagawa, N., et al. Memo1-Mediated Tiling of Radial Glial Cells Facilitates Cerebral Cortical Development. Neuron. 103 (5), 836-852 (2019).
- Nowotschin, S., et al. The T-box transcription factor Eomesodermin is essential for AVE induction in the mouse embryo. Genes & Development. 27 (9), 997-1002 (2013).
- Balordi, F., Fishell, G. Mosaic removal of hedgehog signaling in the adult SVZ reveals that the residual wild-type stem cells have a limited capacity for self-renewal. Journal of Neuroscience. 27 (52), 14248-14259 (2007).
- Liang, H., et al. Neural development is dependent on the function of specificity protein 2 in cell cycle progression. Development. 140 (3), 552-561 (2013).
- Guo, C., Yang, W., Lobe, C. G. A Cre recombinase transgene with mosaic, widespread tamoxifen-inducible action. Genesis. 32 (1), 8-18 (2002).
- Ahn, S., Joyner, A. L. In vivo analysis of quiescent adult neural stem cells responding to Sonic hedgehog. Nature. 437 (7060), 894-897 (2005).
- Storm, R., et al. The bHLH transcription factor Olig3 marks the dorsal neuroepithelium of the hindbrain and is essential for the development of brainstem nuclei. Development. 136 (2), 295-305 (2009).
- Koundakjian, E. J., Appler, J. L., Goodrich, L. V. Auditory neurons make stereotyped wiring decisions before maturation of their targets. Journal of Neuroscience. 27 (51), 14078-14088 (2007).
- Dor, Y., Brown, J., Martinez, O. I., Melton, D. A. Adult pancreatic β-cells are formed by self-duplication rather than stem-cell differentiation. Nature. 429 (6987), 41-46 (2004).
- Sohal, D. S., et al. Temporally regulated and tissue-specific gene manipulations in the adult and embryonic heart using a tamoxifen-inducible Cre protein. Circulation Research. 89 (1), 20-25 (2001).
- Ventura, A., et al. Restoration of p53 function leads to tumour regression in vivo. Nature. 445 (7128), 661-665 (2007).
- Johnson, L., et al. Somatic activation of the K-ras oncogene causes early onset lung cancer in mice. Nature. 410 (6832), 1111-1116 (2001).
- Tasic, B., et al. Extensions of MADM (mosaic analysis with double markers) in mice. PLoS One. 7 (3), e33332 (2012).
- Yu, J., Carroll, T. J., McMahon, A. P. Sonic hedgehog regulates proliferation and differentiation of mesenchymal cells in the mouse metanephric kidney. Development. 129 (22), 5301-5312 (2002).
- Zhao, H., et al. Role of fibroblast growth factor receptors 1 and 2 in the ureteric bud. Developmental Biology. 276 (2), 403-415 (2004).
- Schuchardt, A., D'Agati, V., Larsson-Blomberg, L., Costantini, F., Pachnis, V. Defects in the kidney and enteric nervous system of mice lacking the tyrosine kinase receptor Ret. Nature. 367 (6461), 380-383 (1994).
- Livet, J., et al. ETS gene Pea3 controls the central position and terminal arborization of specific motor neuron pools. Neuron. 35 (5), 877-892 (2002).
- Volz, K. S., et al. Pericytes are progenitors for coronary artery smooth muscle. eLife. 4, e10036 (2015).
- Cai, C. L., et al. A myocardial lineage derives from Tbx18 epicardial cells. Nature. 454 (7200), 104-108 (2008).
- Lasrado, R., et al. Lineage-dependent spatial and functional organization of the mammalian enteric nervous system. Science. 356 (6339), 722-726 (2017).
- Matsuoka, T., et al. Neural crest origins of the neck and shoulder. Nature. 436 (7049), 347-355 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved