Method Article
이중 마커를 이용한 모자이크 분석을 이용한 대뇌 피질 개발의 계보 추적 및 클론 분석(MADM)
요약
이중 마커(MADM)를 이용한 모자이크 분석을 이용하여 단일 세포 수준에서 후보 유전자의 계보 추적 및 기능성 유전자 분석을 수행하는 프로토콜이 제시된다. MADM 클로날 분석은 개별 전조자와 그들의 딸 세포의 증식 행동, 세포 출력 및 혈통 관계를 측정하는 정량적인 틀을 제공합니다.
초록
전구의 제한된 풀에서 시작, 포유류 대뇌 피질은 고도로 조직 된 기능성 신경 회로를 형성한다. 그러나, 신경 줄기 세포의 혈통 전이를 조절 하는 기본 세포 및 분자 메커니즘 (NSC) 그리고 개발 신경 에피테륨에서 신경 세포와 glia의 최종 생산 불분명 남아. NSC 분할 패턴을 추적하고 복제 관련 셀의 계보를 매핑하는 방법이 극적으로 진행되었습니다. 그러나, 많은 현대 혈통 추적 기술은 선천성 세포 분열 패턴을 해독하기 위해 필수적인 자손 세포 운명의 세포 해상도의 부족때문에 손해를 입습니다. 제시된 것은 생체 내 복제 분석에서 수행하기 위해 이중 마커(MADM)를 이용한 모자이크 분석을 사용하는 프로토콜이다. MADM은 개별 전구 세포를 수반적으로 조작하고 전례없는 단일 세포 해상도에서 정확한 분할 패턴 및 계보 진행을 시각화합니다. MADM 기반 의 상호 염색체 재조합 이벤트 동안 미토시스의 G2-X 단계 동안, 과도하게 유도 CreERT2와함께, 클론의 생년월일과 그 분할 패턴에 대한 정확한 정보를 제공합니다. 따라서, MADM 계보 추적은 단일 세포 수준에서 줄기 세포 전조자의 증식 모드의 전례 없는 질적 및 정량적 광학 판독을 제공한다. MADM은 또한 NSC 혈통 진행에서 후보 유전자의 메커니즘 및 기능적 요구 사항을 검사할 수 있습니다. 이 방법은 대조군 및 돌연변이 서브클론의 비교 분석이 생체 내의 동일한 조직 환경에서 수행될 수 있다는 점에서 독특하다. 여기서, 프로토콜은 상세히 기술되고, 개발 중인 대뇌 피질에서 클로날 분석 및 혈통 추적을 위해 MADM을 사용하는 실험 패러다임이 입증된다. 중요하게도, 이 프로토콜은 CreERT2 드라이버가 존재하는 한, 어떤 뮤린 줄기 세포 틈새 시장에서 MADM 클로날 분석을 수행하기 위하여 적응될 수 있다.
서문
대뇌 피질은 6개의 뚜렷한 층으로 구성된 고도로 조직된 구조물입니다. 피질은 기능성 신경 회로를 형성하기 위하여 상호 작용하는 신경과 glia를 포함하여 세포 모형의 다양한 배열을 포함합니다. 대부분의 경우, 전부는 아니지만, 피질 흥분 성 프로젝션 뉴런및 신경아는 방사형 신경교선 전구체 (RGPs),1,2,23로알려진 신경 줄기 세포 (NSCs)의 일반적인 풀에서 파생된다. RGPs 자체는 초기 배아 신경상피성 구성 신경상피성 줄기 세포 (NESCs)에서 파생됩니다. 마우스에서 배아일 9 (E9)에 의해, NESCs는 RGPs4로전환하기 시작합니다. RGP 혈통 진행은 정확한 측두및 공간 조절을 필요로 하고, 이 과정이 방해될 때, megalencephaly, microcephaly, lissencephaly, 또는 정신 분열증과 자폐증과 같은 손상과 같은 가혹한 신경 장애는5,,6귀착될 수 있습니다. E10에서 대부분의 RGPs는 대칭 증식 부문을 거치며 신경 전조 풀4,,7의확장이 발생합니다. RGPs는 결국 비대칭으로 분할하기 시작하여 일시적으로 정의된 방식으로 피질 프로젝션 뉴런을 생성합니다. 신경 발생의 연속파를 통해 신생아 뉴런은 피상층8,,9,,10에거주하는 깊은 층과 늦게 태어난 뉴런을 차지하는 초기 태어난 뉴런을 차지하는 피질 라미네이트를 형성하는 피질 판으로 이동한다. 복제관련 피라미드뉴런은 접선 분산이 거의 없는 피질로 방사되어 이동하기 때문에, 딸 세포는4,11,12,,13의신경방사형유닛이라고불리는 컬럼 또는 콘 모양의 구조를 형성하는 경향이 있다., E17에 의해, 배아 신경 발생 팽창은 마우스(14)에서완료된다. RGPs는 또한 상층세포 및 올리고원드로시테,1,,,15,16,17,,18,,19를포함하는 일부 종류의 glia를 생성할 수 있다. RGPs의 잠재력은 뉴런과 성상세포를 모두 발생시키는 것으로 보이며, 신경성 RGPs의 약 1/6은 또한 glia11을생산하는 모든 피질영역(18)에걸쳐 일관된 것으로 보인다.
현재, 그것의 혈통을 따라 줄기 세포의 측두진행을 통제하는 유전 및 후성 유전학 요인은 대부분 알려지지 않습니다. 유전자 발현의 시간적 패턴은 RGPs20,21,,,22,,23,,24에서혈통 결정에 상당한 영향을 미칠 수 있다. 측두와 공간 패터닝 사이의 이 단단히 뜨개질 관계가 피질 부위를 가로 질러 성인 신경 유형의 분자 다양성으로 이어지는 방법은 알려져 있지 않습니다. 마찬가지로, 개별 줄기 세포 잠재력과 세포 출력이 세포 및 분자 수준에서 변조되는 방법은 중요한 대답없는 질문입니다. 향후 연구는 이러한 질문 중 일부를 잘해결하여 궁극적으로 기능성 피질 회로 형성에 대한 이해를 확대할 것입니다.
발달 신경생물학은 두뇌에 있는 세포가 서로 공유하는 혈통 관계를 이해하기 위하여 노력합니다. 처음에는 연구 도구가 거의 제공되지 않았으며, 많은 초기 연구는 Caenorhabditis elegans25와같은 투명한 유기체에서 분열 패턴의 시각적 관찰에 의존했습니다. 최근 수십 년 동안사용가능한 기술의 수와 정교함이 급격한 증가,,26,,27,,28,,29. CRISPR-Cas9 게놈 편집 시스템의 출현은 진화하는 DNA 바코드를 도입하여 세포 혈통 관계의 합성 재구성을 가능하게한다 27,,30. 바코드 전략의 2개의 최근 예는 CRISPR-Cas9를 특정 DNA 바코드 로시 또는 니코아제 Cas9와 융합한 시티딘 데아미나아제로 지시하는 호밍 가이드 RNA의 사용을 포함하여 내인성 산재반복영역(31,,32)을표적으로 한다. 이러한 기술은 시간이 지남에 따라 고유한 돌연변이를 점진적으로 안정적으로 축적하는 바코드도입을 통해 매우 멀티플렉스화된 접근 방식을 제공합니다. 게놈 편집 접근법은 이러한 바코드의 공유 상속에 기초하여 두 세포 사이의 관계를 소급 분석할 수 있기 때문에 매우 유용합니다. 그러나, 개별 적인 세포에 있는 바코드를 읽으려면, 조직은 일반적으로 중단되어야 하고, 따라서 개별 선조에서 위치, 형태학 및 절대 세포 수에 관하여 정보가 분실됩니다.
조합 라벨링 패러다임은 공간 정보를 보존하고 원칙적으로 밀접하게 지역화되거나 겹치는클론(33,34)의34구별을 허용한다. 계보 추적 방법을 유익하게 하려면 개별 선조와 자손에 희소하고 지울 수 없는 방식으로 라벨을 부착해야 합니다. 특히, Brainbow35 및 색종이36,,37 접근법은 단일 궤적에서 형광 단백질의 조합을 표현하는 확률다색 Cre 재조합 기자를 사용합니다. 생체 내에서 달성 할 수있는 동시 색상 조합의 광범위한 수는 피질 RGP 클론과 성상 세포34를추적 할 때이 강력한 도구를 합니다. 형광 기자를 코딩하는 트랜스게놈의 안정적인 게놈 통합을 제공하는 트랜스포손 기반 시스템 및 피질 전조자의 시야도 추적 허용도33,,38,,39,,40,,41을개발했다. 트랜스포슨 계시스템은 리포터가 게놈에 안정적으로 통합하여 라인 관련 딸 세포를 안정적으로 라벨화한다는 점에서 추가적인 이점이 있다. 특히 성상세포 혈통을 추적하기 위해, 스타 트랙을포함한 돼지박 트랜스포가스의 전기포지를 포함하는 여러 가지 방법이 개발되었으며, 이는 상이한 형광단백질40,,42를코딩하는 구조의 조합을 이용하여 한다. 또 다른 접근 법, MAGIC 마커,트랜스 포지셔닝 트랜스 유전자로 Brainbow 벡터를 소개합니다. 이것은 성공적으로 배아 신경 및 성상세포 선조34,,43을추적하는 데 사용되었습니다. 최근에는 이중 재조합 카세트 교환(MADR)에 의한 모자이크 분석은 정확하게 정의된 염색체로시(44)로부터형질원원소를 발현하는 돌연변이 세포를 안정적으로 라벨링하는 것으로 나타났다. 이러한 강력한 생체 내 결합 라벨링 기술은 전구 세포의 계보 역학에 대한 수많은 통찰력을 제공했습니다. 그러나 이러한 분석은 고정 된 조직에서 수행되며 정의 된 발달 단계에서 개별 클론의 스냅 샷을 제공합니다. 시간이 지남에 따라 단일 클론의 계보 역학의 변화를 관찰하기 위해, 성인 덴테이트 자이러스에서 수행된 것과 유사한 만성 생체 내 이미징 방법은45를적용할 필요가 있다.
이중 마커(MADM)를 이용한 모자이크 분석은마우스(46,,47)에서개별 전구 세포의 생체 혈통 추적을 가능하게 하는 강력한 이중 색 라벨링 방법입니다. MADM 라벨링 이벤트가 발생하려면 두 가지 구성 요소가 필요합니다: 첫째, MADM 카세트는 동종 염색체에 동일한 로시를 대상으로 해야합니다. 카세트는 2개의 키메라 형광 기자 유전자, eGFP (녹색, [G]) 및 탠덤 디머 토마토 (빨간색, tdT[T])로 구성됩니다. GT 카세트에는 eGFP의 N 종단과 tdT의 C-종단이 포함되어 있으며, 록스P 부위를 포함하는 인트론으로 구분됩니다. TG 카세트는 TdT의 N 종점과 eGFP의 C-종점으로 반비례하여 구성됩니다. 둘째, 표적 MADM 카세트를 포함하는 동일한 세포에서 Cre 재조합의 발현이 필수적이다. Cre가없는 경우, 키메라 카세트는 코딩 서열이 중단되기 때문에 기능성 eGFP 또는 tdT를 표현하지 않습니다. loxP 사이트는 Cre 매개 인터크로모솜 재조합의 대상역할을 하므로 두 식 카세트의 재구성이 동시에 수행됩니다. X 분리 (G2-X)에 선행된 세포 주기의 G2 단계 도중 재조합이 생기는 경우에, 2개의 딸 세포는 각각 2개의 형광 단백질 의 한을 발현할 것입니다. 타목시펜(TM)을 이용한 CreERT2 활동의 시간적 조절은 MADM 클론의 생년월일과 자손의 분할 패턴에 대한 정확한 정보를제공한다(도 1A)29,,46,,47.
MADM은 잠재적으로 체계적으로 골기 염색 같은 전통적이지만 비특이적이고 힘든 방법과 유사한 마우스 뇌에서 높은 단일 세포 해상도로 개별 클론을 라벨 수있습니다 48 또는 염료 충전49. CreERT2를 운전하는 프로모터만이 클로날 MADM 라벨링의 세포형 특이성을 결정하기 때문에, MADM은 원칙적으로 모든 뮤린 장기 및,조직(47,50, 51,51,52)에걸쳐 클론 계보 추적을 위해 적용될 수 있다., 실제로, 연구는 이미 다양한 조직에서 파생 된 클론의 혈통 관계를 밝히기 위해 MADM을 사용하여47,,50,,51,52,,53,,54,,55,,56,,,57,,58,,59. MADM 실험 패러다임은 개발 중인 신생아7,,11, 12,,,46,,60, 61,,,61,62,,63,64, 64,,65에서피질 프로젝션 뉴런, glia 및 산후 줄기 세포에서 계보를 연구하기 위해 적용되었다.62 MADM은 또한 성인 성축 자이러스, 시상, 소뇌 과립 세포 및 클로날 수준에서 간 뉴런 (전체 목록에 대한 표 1 참조)47,53,,,54,,56,,57,,66에서세포 계보를 연구하는 데 사용되었습니다.
MADM의 독특한 특징은 한 MADM 카세트에 돌연변이를 유전적으로 연결하여 유전 모자이크(도1B 및 도 2)를생성하는 능력입니다. 이로 인해 1개의 형광 마커(도 1B의tdT)와 다른 균질 돌연변이 형제(도 1B의eGFP)로 표지되지 않은 이종수구 환경에서 표시되지 않은 딸 세포가 생성됩니다. MADM은 대조군 및 돌연변이 서브클론의 비교 분석이 생체 내동일한 조직 환경에서 수행될 수 있다는 점에서 독특하다. 원래 MADM 카세트는 Rosa26 궤적(47)으로표적으로 삼았지만, 유전자 기능의 MADM 분석은 궤적에 대한 유전자 에 대한 종량제로 제한되었다. 이러한 한계를 극복하고 MADM 기반 유전자 분석가능성을 확대하기 위해 MADM 카세트는 Chr. 751,Chr. 1146,Chr. 1251의센트로메레스에 가깝게 두드렸다. MADM 카세트로 19개의 마우스 자가를 대상으로 하는 것이 진행 중이며, 기능성 유전 분석과 결합하여 발달 계보 관계 연구를 위한 비교할 수 없는 플랫폼을 제공함으로써, 미래에 거의 모든 유전자를 연구할 수 있게 될 것이다.
프로토콜
마우스 프로토콜은 IST 오스트리아의 기관 전임상 핵심 시설(PCF)과 내부 윤리 위원회에 의해 검토되었습니다. 모든 번식 과 실험은 오스트리아와 유럽 연합 동물 법에 따라 오스트리아 연방 과학 연구부의 승인 된 라이센스에 따라 수행되었습니다.
1. MADM 클론 분석을 위한 실험마우스 의 사육
- 시간 조정된 실험적인 MADM 짝짓기 설정(>P56; CD-1) 늦은 오후 (5:00 PM)에서 질 플러그를 확인하여 진행 아침 (8:00 AM)을 확인하십시오. 플러그가 존재하는 아침은 0.5일로 계산됩니다. 실험 마우스 짝짓기 설정에 대한 개요는 그림 2를 참조하십시오. 실험적인 질문에 대해 CreERT2 활동 및 분석의 TM 유도에 대한 시간점을 적절히 처리합니다.
참고: 자세한 내용은 그림 3 및 아래의 대표적인 결과를 참조하십시오. - 산후 샘플링의 경우, 사육을 설정하여 수양 모친을 병렬로 생성합니다.
참고: 실험적인 번식을 설정하기 전에 최대 1-2일까지 시작해야 합니다.
2. MADM 마우스에서 TM 유도
- 15mL 또는 50mL 원심분리기 튜브의 옥수수 오일에 용해하고 실온(RT)에서 ~4h의 흔들 플랫폼에 배치하여 TM이 완전히 용해되도록 20 mg/mL TM 작업 용액을 준비하십시오. 알루미늄 호일로 덮인 4°C의 작업 용액을 보관하고 2주 이내에 사용하십시오.
- MADM 재조합 이벤트를 유도하기 위해, 1mL 결핵 주사기와 25G 바늘을 사용한 TM 내측(IP)을 적시에 임신댐에 전달한다. 피질 신경 발생의 단계에 따라, 1-2 mg/임신 댐의 복용량에 E10−E15 사이 TM을 주입. 초기 시간점(즉, E10)의 경우 임신 중 합병증을 예방하기 위해 최대 1mg/임신 댐(25 mg/kg)을 사용하여 임신 중 합병증을예방한다. E11-E15 사이의 시간 포인트의 경우 2 mg / 임신 댐 (50 mg / kg)7을사용하십시오.
참고: 또는, TM은 늦은 임신을 위한 경구 gavage로 관리될 수 있습니다. - MADM 클로날 분석을 위해 출생 후 시점으로, 제왕 절개를 통해 E18−E19에서 살아있는 배아를 회수한 다음 수양 어머니와 함께 새끼를 올립니다.
참고: 임산부의 건강 상태에 따라 제왕절개를 할 필요는 없지만 원래 TM 치료 어머니가 수유에 어려움을 겪을 수 있기 때문에 수양 어머니와 함께 새끼를 키우는 것이 여전히 필요합니다. - 제왕 절개에 의해 살아있는 배아를 복구하거나 분석을 위해 배아 시점을 회수하려면 자궁 경부 탈구로 임신 한 댐을 희생하십시오.
- 동물을 수핀 위치에 놓고 70 %의 에탄올로 모피를 소독하십시오. 외과 용 집게와 가위를 사용하여 자궁 위의 하복부에서 피부에 작은 절개를하십시오. 복막을 드러내기 위해 근육과 복부 근육 벽을 통해 두 번째 절개를 합니다.
- 가위로 주변 조직에서 분리하여 자궁을 제거합니다. 양수에서 개별적으로 제거될 때까지 배아 생존율을 높이기 위해 따뜻한 물로 채워진 장갑에 온전한 자궁을 전달한다.
- 미세 기울어진 가위와 손가락을 사용하여 자궁 벽을 조심스럽게 열어 배아를 방출하십시오. 광범위한 혈액 손실을 방지하기 위해 몸에 너무 가까이 탯줄을 잘라하지 마십시오. 배아가 분석을 위해 사용될 경우, 3.9 단계로 진행하십시오. 새끼를 양육해야 하는 경우, 2.8단계로 진행하십시오.
- 양육이 필요한 경우 새끼를 위탁 모에게 옮기기 전에 청소하십시오. 새끼를 청소하는 동안, 부드럽게 호흡을 시작하기 위해 수시로 가슴을 누릅니다. 생존율을 높이기 위해 따뜻한 물로 채워진 두 번째 장갑에 다시 놓습니다.
참고: 남은 양수 및/또는 태반을 종이 타월로 부드럽게 제거하는 것이 중요합니다. - 새끼를 위탁 어머니에게 옮기기 전에, 그녀의 새장에서 수양 어머니를 제거하고 원래 새끼를 제거하고 실험용 새끼로 대체하십시오. 수양 어머니를 케이지로 돌려보내라.
참고: 수용률 을 높이기 위한 추가 제안에 대한 토론을 참조하십시오. - 지장 현상이 필요한 경우 P6-P8 사이의 발가락 또는 꼬리 생검을 수집하십시오.
참고: 동물 실험 라이센스가 이 연습을 승인하는 경우에만 이 단계를 수행합니다.
3. 뇌의 MADM 클론에 대한 조직 준비
참고: 산후 조직(≥P4)을 포함하는 실험의 경우 3.1단계로 진행하십시오. 배아 시점과 조기 산후 (P0−P3)의 경우 3.9 단계를 계속합니다.
- 케타민/자일라진/아세프로마진 용액(각각 65mg, 13mg, 2 mg/kg 체중)의 IP 주사로 실험적인 MADM 동물을 마취하고 마우스가 뒷발을 꼬집어 반응이 없는지 확인한다.
참고: 남성과 여성 MADM 마우스(CD-1 배경)는 모두 분석에 사용됩니다. 지장질이 필요한 경우, 이 시점에서 귀 생검을 수집합니다. - 마취된 동물을 관류 수술 트레이에 수핀 위치에 놓고 70%의 에탄올로 털을 소독합니다. 수술을 시작하려면 피부의 바깥층을 통해 가위와 외과 용 집게를 절개한 다음 근육 층을 통해 두 번째 절개를 하십시오. 흉골의 끝을 들어 올리고 측면에 결합 조직을 잘라, 간 절단을 피하기 위해 여분의주의를 복용. 흉부 구멍이 보입니다.
- 격막을 잘라서 들어 올려 심장을 드러냅니다. 조심스럽게 흉곽을 손질하고 심장을 노출하기 위해 수술 트레이에 고정합니다. 새끼의 경우 갈비뼈 케이지를 완전히 제거하십시오.
- 인산염 완충식식염(PBS)을 가진 바늘을 왼쪽 심실(창자 조직)에 삽입합니다. 작은 홍채 가위를 사용하면 혈액이 배수할 수 있도록 오른쪽 아트리움(어두운 붉은 조직)의 후방 끝에 절개를 합니다.
- PBS와 관전을 수행하고 PBS에서 준비된 갓 만든 얼음 차가운 4 % 파라 포름알데히드 (PFA)가 즉시 수행됩니다. 새끼 (P4-P10)의 경우 주사기를 사용하여 관류를 수행합니다. PBS 10mL로 주사기 1개를 채우고 다른 주사기는 4% PFA의 10mL로 채웁니다. 주사기의 모든 기포가 제거되었는지 확인합니다. 오래된 동물의 경우 연동 펌프를 사용하십시오.
- PBS(새끼 2-4mL/분에서 10mL, 연동 펌프를 사용하는 성인을 위한 4-6 mL/분에서 20mL)으로 침투하기 시작합니다. 바늘이 올바르게 배치되면 간은 명확하고 옅은 노란색이 될 것입니다.
- 완료되면 새끼에서 바늘을 제거하고 PFA를 포함하는 바늘을 동일한 구멍에 삽입하십시오. 성인의 경우 PBS 솔루션을 얼음차가운 PFA와 교환하기 전에 연막 펌프를 중지하여 조리개 튜브의 거품을 피하십시오. PFA (새끼 2-4 mL / 분에서 10 mL, 연동 펌프를 사용하는 성인을위한 4-6 mL / 분에서 30 mL)로 다시 perfusing.
- 관류가 완료되면 마우스를 참수하고 주의 깊은 해부를 통해 뇌를 제거하십시오. 뇌를 4% PFA로 옮기. 적어도 5 배 뇌 볼륨 (즉, 15 mL 원심 분리기 튜브에서 PFA의 ~ 5-10 mL)를 사용하고 조직의 완전한 고정을 위해 4 °C에서 하룻밤 배양하십시오. 3.10 단계를 계속합니다.
- 배아 조직 및 초기 산후 조직 (즉, P0−P3)의 경우 제왕 절개를 수행 한 후 가위로 배아를 참수하십시오. 지평이 필요한 경우, 이 시점에서 배아의 꼬리를 수집합니다. 즉시 뇌를 해부하고 4 % PFA / 웰의 2-3 mL을 포함하는 12 웰 플레이트로 전송합니다. 사후 고정을 위해 4 °C에서 하룻밤 동안 배양하십시오.
- 다음날 아침 교환 PFA는 PBS의 10mL(성인) 또는 2-3mL(embryo)을 교환하고 RT에서 15분 동안 3배 를 반복세척하여 인산염 완충(PB)의 30% 자당 용액으로 30% 전달하고, 조직이 용액에 가라앉을 때까지 흔들 플랫폼에 4°C에 보관한다.
- 최적의 절삭 온도에 뇌를 포함 (OCT) 화합물 포함 금형, 관상 또는 처진 단면에 대 한 뇌의 방향을 주의. 10월이 완전히 불투명해질 때까지 드라이 아이스에 내장 금형을 배치하여 동결하십시오(~10-15분). 추가 사용이 될 때까지 -80 °C에 티슈를 보관하십시오.
4. 면역 조직 화학을위한 MADM 조직의 준비
- 디스크에 OCT의 링을 적용하고 동결되기 시작할 때 10 월에 블록을 직접 배치하여 극저온의 표본 디스크에 조직 블록을 부착하십시오. 블록이 원하는 절단 평면에 대해 올바르게 지향되는지 확인합니다.
참고: 여기, 피질 MADM 클론을 조사하기 위한 관상 단면은 자세히 설명되어 있습니다. - 극저온의 블록 온도를 -20°C로 설정하고 블레이드 온도를 -21°C로 설정합니다.
- 시편 디스크를 시편 홀더에 장착하여 조직 블록이 챔버 온도에 적응하고 단면을 시작하기 전에 ~5 분 동안 극저온에 둡니다.
- 관심있는 조직 영역에 도달 할 때까지 두꺼운 섹션 (45-60 μm)에서 블록을 트림합니다.
- 피질의 가장자리가 명확하게 보이면 단면을 멈추고 블레이드를 잠급합니다. 블록을 트리밍하기 전에 블레이드를 보호합니다.
- 블레이드로 조직을 둘러싼 초과 OCT를 트리밍하여 뇌의 모든 면에 ~1-2mm의 10월을 남깁니다.
- 다음으로 피질의 측면 가장자리 중 하나가 아래쪽으로 향하고 다른 위쪽으로 향하게 되도록 블록을 방향을 지정합니다 (즉, 피질의 가장 로스트랄 가장자리가 오른쪽으로 뾰족합니다).
- 성인용 클론의 두께는 45μm, 배아 클론의 경우 30μm로 단면하기 시작합니다. 각 섹션을 개별적으로 수행하고 작은 브러시를 사용하여 블록을 트리밍하는 동안 남은 파편의 칼 아래 영역을 깨끗하게 유지합니다.
참고: 이 작업이 완료되지 않고 단면이 떨어지면 슬라이스의 올바른 순서를 결정하기어려울 수 있습니다. - 단면이 말리기 시작하면 블록의 가장자리를 다듬거나 유리 안티롤 플레이트를 신중하게 조정합니다.
- 배아 클론 분석을 위해 섹션을 서리가 내린 슬라이드에 직접 장착하십시오. 37°C에서 가열 플레이트에서 건조한 후 5.6단계로 직접 진행하십시오.
참고: 여러 섹션을 하나의 슬라이드에 추가할 수 있지만 순차 순서가 유지되도록 할 수 있습니다. - 성인 클론을 수집하려면 PBS / 웰 1 mL (일반적으로 뇌 당 5-6 플레이트)를 포함하는 24 개의 웰 플레이트를 준비하십시오. 첫 번째 우물에서 시작하여 콜드 집게가 PBS에서 개별 직렬 섹션을 섹션화 순서로 수집합니다.
참고: 부동 단면 방법은 성인용 조직에 채택되어 단면도가 누락되지 않고 장착된 섹션에 주름이 들어 있지 않도록 합니다. - 신피질의 끝에 도달하면 단면조정을 중지합니다.
- 성인 클론의 경우 부동 섹션을 장착하십시오.
참고: 섹션은 PBS에서 최대 24시간 동안 4°C로 보관할 수 있습니다.
5. 이미징을 위한 성인 조직 장착
참고 : 다음 도구가 필요합니다 : 작은 페인트 브러시, 페트리 접시, 0.5 % 트위엔 (PBS-T), 접착 슬라이드(재료의 표),장착 매체(재료의 표),커버립, 집게와 PBS.
- 페트리 접시를 PBS-T로 채웁니다.
참고: 세제는 장착 공정을 돕기 위해 사용됩니다. 세제(즉, 당단백질)에 민감한 추가 항원(즉, 당단백질)에 염색이 필요한 경우, Tween의 첨가를 건너뛰는 것이 가장 좋습니다. - 접착 슬라이드를 PBS-T에 배치하여 레이블에 거의 가려지도록 합니다.
- 첫 번째 섹션을 PBS-T로 전송합니다.
- 작은 페인트 브러시를 사용하여 섹션을 슬라이드로 기동하여 절단 순서를 유지하도록 정렬합니다. 모든 추가 섹션과 동일한 방식으로 진행합니다.
- 모든 섹션이 배치되면 슬라이드(~12-16개 섹션/슬라이드)를 어두운 슬라이드 챔버에 놓습니다. 뚜껑을 약간 들어 올려 섹션이 완전히 건조할 수 있도록(~10-20분) 후속 단계에서 부착상태를 유지합니다.
- 추가 항원용 면역히스토화학을 수행하는 경우, 6항 또는 7절로 직접 진행한다.
참고: 배아 시점의 경우 적어도 GFP 및 tdT(섹션 6)에 대한 면역 스테인닝 단계를 수행해야 합니다. 성인 클론의 경우, 이것은 병렬로 추가 항원 (섹션 6 및 7)에 대한 염색 경우에만 필요합니다. - 잔류 PBS-T를 제거하기 위해 5 분 동안 1 x PBS로 섹션 1배를 재수화하고 세척합니다. 슬라이드에 1x PBS(1 μg/mL)로 희석된 4′,6-diamidino-2-페닐린돌(DAPI)의 1mL를 적용하여 모든 섹션을 15분 동안 커버하고 배양할 수 있도록 합니다.
- DAPI를 조심스럽게 제거하고 1x PBS로 5분 동안 세척하십시오. 24 x 60mm 커버슬립으로 밀봉하고 이미징 전에 적어도 3 시간 동안 건조시키십시오.
6. GFP 및 tdT전용 면역스테인링
참고: 이 섹션은 배아 클론에 필요합니다.
- 가습 슬라이드 인큐베이션 챔버에 슬라이드를 수평으로 배치합니다. 필요한 버퍼의 양을 최소화하기 위해 왁스 마커로 슬라이드 경계를 표시합니다.
- 1배 PBS로 섹션을 다시 수분처리합니다. 염색 품질을 향상시키기 위해 갓 단면된 조직과 함께 작업하십시오.
- 슬라이드당 블로킹 버퍼250-400 μL(트리톤 X-100 0, 2-3% 일반 당나귀 세럼 1배 PBS)을 추가하여 모든 섹션을 다룹니다. 1 시간 동안 인큐베이션하십시오.
참고: 일부 항원들이 다른 항원보다 세제에 더 민감하기 때문에 세제(Triton X-100 또는 Tween-20)의 농도는 사용되는 추가 1차 항체에 따라 달라집니다. - 블로킹 버퍼를 제거하고 슬라이드에 버퍼를 차단하는 데 1차 항체를 추가합니다(300-400 μL/슬라이드).
참고: 항-GFP/안티-tdT(MADM)에 대한 표준 1차 항체 반응의 예는 닭 항GFP(1:500) 및 토끼 안티RFP(1:500)를 사용할 수 있다. - 4°C에서 하룻밤 사이에 1차 항체를 배양한다.
참고: 모든 섹션을 덮는 버퍼로 슬라이드를 완벽하게 수평으로 배양해야 합니다. 그렇지 않으면 얼룩이 고르지 않거나 얼룩이 발생할 수 있습니다. - 다음 날에 1차 항체를 가진 차단 버퍼가 슬라이드의 모든 부분을 여전히 덮고 있는지 확인합니다. 그렇지 않은 경우 RT에서 3-4 h의 인큐베이션 단계를 반복하십시오.
- 1 차적인 항체를 제거하고 RT에서 10 분 동안 1x PBS로 4 x를 씻으면.
- 슬라이드 버퍼에 희석 된 이차 항체를 추가 (300-400 μL /슬라이드): 알렉사 플루어 488 안티 치킨 IgG (1:500) 및 Cy3 안티 래빗 IgG (1:500).
- 2 시간 동안 RT에서 인큐베이션하십시오. 형광의 표백을 방지하기 위해 빛에서 덮인 슬라이드를 유지하십시오.
- 이차 항체를 제거하고 10 분 동안 1 x PBS로 2 배 세척하십시오.
- 15 분 동안 PBS (1:5,000)에서 희석 된 DAPI와 인큐베이션.
- 1x PBS로 1x을 10분 동안 세척합니다.
- 여분의 PBS를 제거하고 장착 매체의 110 μL에 포함하기 전에 ~ 1-2 분 동안 건조하십시오.
- 24 x 60mm 커버슬립으로 밀봉하고 이미징 전에 적어도 3 시간 동안 건조시키십시오. 최적의 신호를 보장하기 위해 면역 조직 화학을 수행 한 후 1-2 주 이내에 이미지가 슬라이드됩니다.
7. GFP, tdT 및 추가 항원용 면역 염색
- 6.1-6.3 단계를 수행합니다.
- 블로킹 버퍼를 제거하고 슬라이드에 버퍼를 차단하는 데 1차 항체를 추가합니다(300-400 μL/슬라이드).
참고: 3개 이상의 항원(즉, GFP, tdT 및 관심 있는 단백질)과 관심 있는 단백질에 대한 항체를 염색할 때, 1:500의 희석시 항tdTT(염소) 1차 항체를 사용하는 것이 좋습니다. 대체 tdT 염색을 가진 3개의 항원에게 1차 항체 반응의 예는 관심있는 단백질에 대하여 닭 항GFP (1:500), 염소 항ttTT (1:500), 및 관심있는 단백질에 대하여 항체를 사용할 수 있었습니다 (즉, 토끼). - 단계 6.5-6.7을 수행합니다.
- 슬라이드 버퍼에 희석 된 이차 항체 믹스를 추가 (300-400 μL /슬라이드): 알렉사 플루어 488 안티 치킨 IgG (1:500), Cy3 안티 염소 IgG (1:500), 알렉사 플루어 647 안티 래빗 IgG (1:500).
- 단계 6.9-6.14를 수행합니다.
8. MADM 클론의 공초점 이미지 수집 및 정량화
- 클론과 피질에 있는 그들의 위치를 포함하는 두뇌 단면도를 확인하고 문서화합니다.
참고: 클론 스팬 섹션의 수는 복제본을 유도한 시기, CreERT2 드라이버 및 분석 시간에 따라 달라집니다. 이 단계는 공초점 현미경 또는 상피 현미경에서 수행될 수 있습니다. - 반전된 공초점 현미경을 사용하여 올바른 레이저 라인과 필터를 선택하고 구성하는 것으로 시작합니다. MADM 두뇌의 경우 DAPI, GFP 및 tdT(각지: 358nm, 488nm 및 554nm, 각각 554nm; 최고 방출: 461nm, 507nm, 581nm)를 선택한다. 최적의 이미징 품질을 위해 핀홀이 1개의 통풍이 좋은 장치로 설정되어 있는지 확인합니다.
- 공초점 특정 설정의 경우 20배 목표및 1x 줌을 갖춘 이미지 클론입니다. 정량화에 사용되는 이미지의 경우 평균 없이 1.52-2.06 μs(이미지 수집 소프트웨어의 값 7-8값)의 스캔 속도 픽셀 거주 값을 사용합니다. 레이저 강도를 적절히 조정하고 각 채널에 대한 게인 설정을 조정합니다.
참고: 필요한 이미지 품질에 따라 스캔 속도와 평균설정이 다를 수 있습니다. - 복제본이 명확하게 식별되면 복제본의 모든 관련 섹션을 커버하기 위해 이미징 타일을 정렬합니다. 복제본의 모든 MADM 표지된 셀이 1.5 μm/z 스택 슬라이스간격으로 캡처되도록 z 스택을 조정합니다. 클론을 이미징할 때 피질의 전체 폭이 포획되도록 타일 영역을 조정합니다(즉, 피알 표면에서 코퍼스 캘로섬까지).
- 이미지 개별 클론은 여러 섹션에 걸쳐 연속적으로, 복제본 내의 세포가 없는 모든 섹션이 여전히 3D 재구성 및 세포 공간 정보의 올바른 해석을 위해 이미지화되도록 합니다.
- ROStral에서 피질의 caudal 끝에 MADM 클론의 세포를 포함하는 각 단면을 순차적으로 분석합니다. 그들의 형태 및/또는 마커 염색에 따라 개별 신경및 glia를 구별합니다. 핵 염색(DAPI)에 의해 정의된 각 층 경계를 기반으로 위치 정보를 병렬로 기록합니다.
참고: 배아 분석을 위한 대표적인 결과에 대한 그림 4및 성인 분석을 위한 대표적인 결과에 대한 그림 5를 참조하십시오.
9. 클론의 직렬 3D 재구성
참고: 직렬 뇌 섹션을 통해 이미지된 개별 클론의 3D 재구성은 시각적 디스플레이뿐만 아니라 3D 클로날 아키텍처의 분석에 유용하며 다음 단계에 따라 수행될 수 있습니다.
- 이미지 수집 소프트웨어를 사용하여 획득 매개 변수를 기반으로 공초점 타일 이미지를 스티치하고 융합합니다. .czi 파일을 열고 ZEN 소프트웨어(Zeiss)의 처리 탭에서 스티치 메서드를 실행합니다.
- 스티치 이미지 스택을 TIFF 형식으로 개별 z-평면으로 내보냅니다. 스티치 .czi 파일을 열고 처리 탭에서 이미지 내보내기 메서드를 실행합니다. 멀티채널 이미지의 경우 후속 이미지 처리를 위해 빨간색/녹색/파란색 이미지로 내보냅니다.
- 복제본의 각 직렬 뇌 섹션에 대해 9.1 및 9.2 단계를 반복합니다.
참고: 정확한 3D 재구성을 위해, 표지된 세포가 없는 것을 포함하여 클론 내의 모든 뇌 단면도또한 처리되어야 합니다. - ImageJ/Fiji67,,68과같은 오픈 소스 이미지 프로세싱 소프트웨어를 사용하여 가장 로스트랄에서 가장 caudal z-plane에 이르기까지 개별 이미지를 단일 스택에 연결합니다.
참고: 각 뇌 섹션의 가장자리에 있는 빈 이미지는 이 시점에서 제거해야 합니다. - 필요한 경우 9.5.1-9.5단계를 따라"MultiStackReg"라는ImageJ 플러그인을 사용하여 정렬 불량에 대해 9.4 단계에서 얻은 이미지 스택을 수정합니다. 이미지 정렬이 필요하지 않은 경우 9.6단계로 진행합니다.
참고: 이 플러그인은 가장 높은 대비(일반적으로 DAPI)를 가진 채널의 이미지 정렬을 수행한 다음 기록된 변환을 다른 채널에 적용하여 멀티채널 스택의 안정적인 이미지 정렬을 허용합니다. "TurboReg"라는보조 플러그인을 사전 설치해야 합니다.- ImageJ에서 "멀티 스택 레그"와"터보 레그"플러그인을설치합니다.
- 9.4 단계에서 얻은 복제 이미지의 이미지 스택을 열어 정렬합니다. 이미지를 탭 에서 색상 옵션 내에서 DAPI(파란색), GFP(녹색), TdT(빨간색)로 채널을 분할합니다.
- 실행 "멀티 스택Reg" 플러그인에 의해 DAPI 채널을 정렬"강체" 변환 및 변환 파일을 저장합니다.
- 저장된 변환 파일을"MultiStackReg"를사용하여 다른 두 채널에 적용합니다.
- 정렬된 세 채널을 모두 병합하고 정렬된 스택을 저장합니다.
- ImageJ에서 클론을 방향을 지정하기 위해 상단의 피알 표면과 하단의 코퍼스 캘로섬과 수직 방향으로 9.4 단계 (또는 정렬 후 9.5.5 단계)에서 얻은 클론 이미지의 스택을 회전합니다. 필요한 경우 xy 평면에서 자르기.
- 정성적 프리젠테이션과 정량적 분석 모두최대 z 프로젝션 이미지(단계 9.8)를 생성하거나 클론의 3D 렌더링(단계 9.9)을 수행합니다.
- ImageJ에서 9.6 단계에서 이미지 스택을 열고 투영 유형 Max 강도로 Z 프로젝션 옵션을 선택합니다. 이렇게 하면 동일한 평면에 투영된 전체 복제본의 이미지가 생성됩니다.
- ImageJ에서 9.6 단계에서 이미지 스택을 열고 3D 프로젝트 z 함수를 선택하여 회전할 수 있는 복제본의 3D 시각화를 생성합니다.
참고: 이 단계에서는 이미지 수집 중에 개별 z 스택의 두께에 해당하는 올바른 슬라이스 간격을 입력하는 것이 중요합니다. 보간 도구를 사용하여 슬라이스 간의 간격을 제거해야 합니다.
결과
MADM은 G2-X 염색체 분리이벤트(도 1A)에대한 두 개의 형광 단백질 중 하나를 각각 발현하는 두 개의 딸 세포로 기능성 녹색 및 적색 형광 단백질의 재구성을 초래한다. MADM 이벤트는 두 후손 혈통의 영구적이고 뚜렷한 라벨링을 초래하기 때문에 녹색 및 빨간색 딸 세포 계보 (서브클론)의 정량적 평가를 수행 할 수 있습니다. 원래 선조의 분할 패턴(예를 들어, 대칭 대 비대칭) 및 전위(예를 들어, 자손의 수)를 포함하는 변수를 결정할 수 있다. TM 유도 시 원래 전조 세포가 대칭 증식 부문 또는 비대칭 신경성 분열을 겪고 있는지 소급하여 결정할 때 각 형광성 표지 된 서브클론을 정량화하는 것은 유익합니다. 이전 연구는 두 개의 넓은 클래스로 피질에서 Emx1-CreERT2 또는 네신-CreERT2 유래 흥분 투영 클론을 그룹화7,,11,,46. 첫 번째, 라고 "대칭 증식 복제", 뉴런의 상당한 수의 평균에 구성, 각각 4 개 이상의 뉴런을 포함하는 녹색과 빨간색 서브 클론모두. 두 번째 그룹인 "비대칭 클론"은 "소수" 서브클론이 3개 미만의 뉴런과 "대다수" 서브클론, 4개 이상의11개이상의 클론클래스를 정의한다. 이러한 정의는 피질 RGPs에 특정 하 고 다른 뇌 영역 및 조직에 대 한 다시 방문 해야 할 수 있습니다. 두 종류의 피질 클론의 경우, 자손은 피상적 층과 깊은 층 전체에 분포됩니다.
MADM 복제 연구를 설계할 때 고려해야 할 여러 가지 측면이 있습니다. MADM 이벤트가 TM의 투여에 의해 유도되는 시간은 주요 고려사항(도3)이다. E10에서 피질 흥분 성 프로젝션 뉴런 MADM 클론(즉, Emx1-CreERT2 또는 네신-크리어T2사용)의경우 거의 모든 RGPs가 여전히 대칭부문(11)을겪고 있었다. 따라서, TM을 가진 E10에서 유도는 증식 RGP 증폭의 다중 라운드를 캡처하고 높은 뉴런 숫자를 가진 클론의 결과로. 그러나, E10에서 RG의 수는 일반적으로 작아서 TM 투여는 거의 MADM 이벤트를 생성했습니다 (때로는 뇌 당 하나 미만). RGPs의 대다수는 E12의 주위에 비대칭 신경원색 분열로 대칭에서 전환했습니다. 엄격하게 비대칭 신경성 클론을 표적으로 하기 위하여는, E12 이상(도 3)에서유도하는 것이 가장 좋았다. TM 유도와 피질에서 MADM 재결합 이벤트를 관찰하는 시간 사이의 시간은 24시간 미만인 경향이 있었다. 또한 두 가지 이유로 TM 용량을 최소한으로 유지하는 것이 중요합니다. 첫째, MADM 재조합 속도가 증가하면 여러, 아마도 겹치는 클론을 유도할 확률이 높습니다. 둘째, 너무 많은 TM이 전달되면 낙태, 배아 재흡수 및 더 작은 쓰레기 크기가 증가합니다. 모든 임신 한 댐의 약 절반에서 낙태는 TM 주사가 E10에서 전달되었을 때 관찰되었습니다. 이 빈도는 E11에서 이후 감소하고 임신 한 댐의 약 1/3으로 감소했습니다. TM 용량, 유도 시간 및 이전 MADM 연구에서 사용되는 CreERT2 드라이버의 요약은 표 1을참조하십시오. TM의 부재에서 기자 활동은 일부 TM 유도 CreERT2 드라이버(69)와관찰되었다. 네스틴-크리어T2 드라이버의 Emx1-CreERT2와 함께 TM이 없는 경우 Ectopic 발현 또는 MADM 재결합 이벤트가 관찰되지 않았다. 이는 TM 매개 염색체 트랜스 재조합이 시스 재조합보다 약 1:1,000에서 1:10,000 의 낮은 주파수에서 발생하여 자궁 외 MADM 라벨링의 가능성을 감소시키기 때문일 수 있습니다.
MADM 복제 분석 실험을 계획할 때 고려해야 할 또 다른 요소는 연구 기간입니다. TM 유도 사이의 시간의 길이와 실험이 분석된 시점(A) (시간 창) 시간이 지남에 따라 줄기 세포 역학을표시한다 64. 짧은 배아 시간 창 (즉, TM / E11−A / E13; TM/E11-A/E16)은 배아 신경 발생의 역학을 포착하였다(도4). 2개 이상의 시간 창에서 클론을 비교하면 생성된 세포의 수와 신경 분포가 계보 진행64의다른 단계에서 어떻게 변화하는지에 대한 정량적 통찰력을 제공한다. 개별 클론의 전체 잠재력을 포착하려면 산후 또는 성인 시점으로 분석된 시간 창을7,,11,,12로연장할 필요가 있다. 배아에서 유도되고 성인에서 분석된 신코르티컬 클론의 예는 도 5에도시된다. 참고로, 피질 신경 발생은 대부분 완료되고 gliogenesis는 E17에 의해 증가합니다. 약 1/6 신경유발성 RGP는 또한 성상세포 및/또는 올리고원드로시테(11)를 생성하기 위해 진행한다.11
대칭 클론은 RGPs가 증식부문(11)의하나 이상의 라운드를 겪을 때 발생합니다. E10−E12 사이에 유도된 RGP 클론은 평균적으로 크기가 더 크고 최종 뉴런분포(도 4A-C)의공간적 특징을 더 많이 제공했다. 깊은 층과 피상층 전체에 비교적 동등하게 분포된 뉴런을 가진 클론은 "실린더" 모양을 취했고, 뉴런을 가진 클론은 더 깊은 층보다 피상층에 더 분산되어 있는 "원뿔"모양(11)을개발했다. 클론의 공간 및 형태학적 정보를 완전히 캡처하려면 순차적 이미지를 사용하여 각 클론을 계산적으로 재구성해야 했습니다. 클로날 분산을 측정하기 위해 클론의 피상층(LII−VI)에서 최대 측면 분산(모든 차원에서 측정)은 깊은 층(LV/LIV)의 뉴런 분산과 비교하였다. 이 비율(분포 상부:분포 아래)은 전체 클론 셰이프의 정량화 가능한 판독을 제공했습니다.
소수 서브클론이 3개 이하인 비대칭 클론은 단일 RGP(도4D-F 및 도 5A-F)7,11,,12의뉴런출력에대한 통찰력을 제공했다. 대다수 집단(대형 서브클론)은 Emx1-CreERT2 또는 네신-크리어T2(그림5G)7,11,,12를사용하여 유도될 때 클론 당 약 7개의 흥분 투영 뉴런의 평균과 함께 빨간색 또는 녹색으로 표시될 수 있다., MADM 클론의 총 세포 수는 피상및 깊은 층을 가로 질러 큰 서브클론의 뉴런 분포를 분석하여 더 해부 될 수 있습니다. 소수 집단(소형 서브클론)은 상호 색으로 표시되었고 클론당 평균 1-2세포(그림 5H)였다. 평균 8-9 뉴런이었던 총 "단위 크기"는 크고 작은 서브클론을 함께 추가하여 계산할 수있습니다(그림 5I)7,,11,,12. RGPs의 신경 출력이 매우 예측 가능했지만, 복제이질성(12,,70)의정도가 있었다는 점에 유의하는 것이 중요합니다.
MADM 카세트에 돌연변이 해스의 도입은 유전 모자이크의 생성을 가능하게 하고, 줄기 세포 혈통 진행의 분자 조절을 해부하는 독특한 방법을 제공한다. 이와 같이, MADM은 유전자의 세포 자율 적 기능 (예를 들어, 소두증 또는 대식세포에 대한 협회)을 연구하는 비교할 수없는 실험 플랫폼을 제공합니다. MADM 유전 모자이크에서 유도된 클론을 대조군 MADM에서 유도한 클론과 비교함으로써, 뉴런 수 및 분포의 변화에 대한 고정량적 판독이 생성될 수 있다. 이전 MADM 기반 연구는 클로날 수준에서 소두증 형성에서 Otx1의 세포 자율 기능을 정량화 (대표적인 예에 대한 도 6A-E 참조)11. 또 다른 연구에서, MADM 클론 분석은 Ndel1이 세포 자율적으로 프로젝션 뉴런 수를 조절하지 않고, 대신 신생아 뉴런이 피질 플레이트 내에서 들어오거나 이동하는 능력을 보여 주었으며, 이는 나중에 성인피질(46)을형성한다. 이 연구 결과는 피질 발달을 통제하는 유전자의 세포 자율 기능을 공부에 있는 MADM 클론 분석의 고정량적 본질을 보여주었습니다. 현재 MADM을 사용하여 복제 수준에서 대식세포에 연루된 유전자를 연구하는 예는 없습니다. 그러나, 피질 크기의 제어와 관련된 유전자의 향후 연구 분석은 분자 및 세포 수준에서 매우 바람직한 통찰력을 제공 할 수 있습니다.

그림 1: 단일 줄기 세포 수준에서 리니지 추적 및 복제 분석을 위한 MADM 원리. (A)MADM을 사용하여 계보 추적 및 복제 분석을 수행하려면 두 가지 구성 요소가 있어야 합니다. 첫째, MADM 카세트는 동종 염색체에 동일한 로시를 대상으로해야합니다. 카세트는 2개의 키메라 형광 기자 유전자, eGFP (녹색, [G]) 및 탠덤 디머 토마토 (빨간색, tdT[T])로 구성됩니다. GT 카세트에는 eGFP의 N 종단과 tdT의 C-종단이 포함되어 있으며, 록스P 부위를 포함하는 인트론으로 구분됩니다. TG 카세트는 TdT의 N 종점과 eGFP의 C-종점으로 반비례하여 구성됩니다. 둘째, Cre 재조합의 발현은 표적 MADM 카세트를 포함하는 세포에서 이루어져야 한다. loxP 사이트는 Cre 매개 인터크로모솜 재조합의 표적이 되어 두 식 카세트의 재구성을 동시에 합니다. X 분리 (G2-X) 뒤에 세포 주기의 G2 단계 도중 재조합이 생기는 경우에, 2개의 딸 세포는 2개의 형광 단백질 의 한을 발현할 것입니다. (B)단일 클론 수준에서 유전 모자이크 분석을 위한 MADM 원리. 돌연변이 알레일(도 1B등에 묘사된 바와 같이 점 돌연변이, 삭제, 삽입, loxP-측면 조건부 대립 유전자)은 메이오틱 재결합을 통해 TG-MADM 카세트에 탈경을 도입할 수 있다(그림 2 및 히펜마이어 등46 참조). G2-X Cre 재조합-매개 인터크로모솜 트랜스-재조합이 MADM 카세트 사이에 발생하면 GFP+ 호질가성 돌연변이 세포(GeneX-/-) 1개의 GFP+ 호모자구스 돌연변이세포(GeneX-/-)-/-1개의 TdT+ 호모자구스 야생형 세포(GeneX+/+)를 위한 관심유전자및 1개의 tdT+ 호모자구스 야생형세포(GeneX+/+)를+/+,47,,47.71 클로날 분석(즉, 황색 세포)에서 사용되지 않는 대체 라벨링 결과는 이전에상세하게 11,46,,47로기술되었다., 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
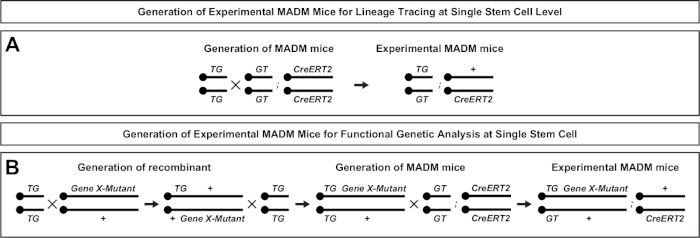
그림 2: 계보 추적을 위한 실험적인 MADM 마우스의 생성을 위한 사육 계획. 복제 분석을 위한 대조군 MADM(A) 및 유전자 X MADM(B) 실험MADM 마우스의 생성을 위한 사육 방식.AB MADM 사육 패러다임에 대한 자세한 내용은 Beattie 외7 및 히펜마이어 외7,,46을참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: MADM 기반 복제 계보 분석을 위한 타임코스 패러다임. 실험 설계 시간 창의 회로도. 세로 샘플링 패러다임의 경우 클론 유도의 시점이 일정하게 유지되고 분석 전의 기간은 다양했습니다. 점진적 간격 샘플링에서 분석 의 시간포인트는 일정하게 유지되었지만 유도 시간은 다양했습니다. 해결된 질문에 따라 하나 또는 두 가지 접근 방식의 조합을 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 개발 및 성인 신피질의 MADM 클로날 분석. TM 매개 MADM 클론 유도대칭 증식 (TM at E10)(A-C)및 비대칭 신경 유발 물질 (E12에서 TM)(D-F)RGPs를 분할. 묘사 된 개발 (TM / E10−A / E16 및 TM / E12−A / E16)(B, E)및 성인 (TM / E10−A / P21 및 TM / E12−A / P21)(C, F) MADM-11/ GTG에서생체 내 개별 MADM 클론이 묘사됩니다. 네신-크리어T2+/- (B, E)및 MADM-11GT/TG; Emx1-CreERT2+/- (C, F). 뉴런 출력은 서브클론 색상과 독립적이었고 녹색 다수/소수 자 서브클론은 제어 조건7,,11에서적색 과반수/소수 자 서브클론과 비교할 수 있다. 성인 클론의 대략 1/6은 또한 백색 별표로 표시된 성상 세포 및/또는 올리고드엔드로시테를 포함했습니다. 패널 B와 F는 히펜마이어 외46과 룰란스와 시몬스(72)의허가로 각각 재현됩니다. CP = 피질 플레이트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
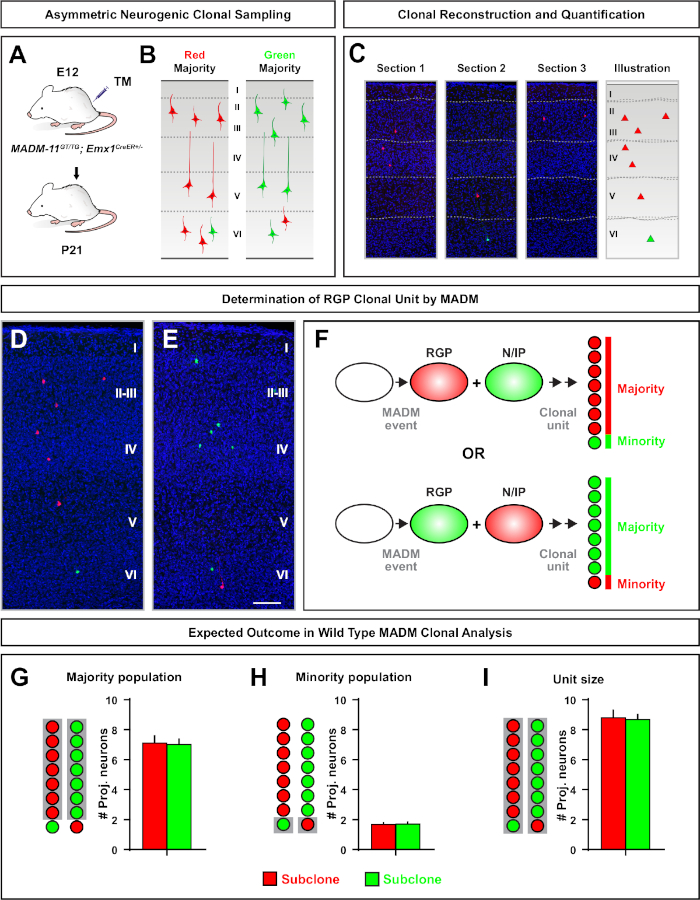
그림 5: MADM 클론 분석은 RGP 매개 뉴런 출력을 정량화한다. MADM7,,11을사용하여 클론 수준에서 개별 신경 유발 RGPs에 의한 흥분성 뉴런(unit) 생산의 분석. (A)개발 피질에서 주로 비대칭 MADM 클론을 유도하기 위한 실험 패러다임. (B)가능한 비대칭 클론 결과 녹색 또는 빨간색(C)단일 신경 성 비대칭 클론(D,E)3D 재구성 이미지의 대표적인 비대칭 G2-X MADM 클론의 대표 연속 섹션은 빨간색(D)또는 녹색(E) MADM-11GT/TG에서; Emx1-CreERT2+/- E12에서 TM 유도 및 P21의 분석. 녹색과 빨간색 으로 표시된 셀은 야생 유형입니다. (F)두 가지 가능한 실험 MADM 클론 결과를 나타내는 회로도. (G)MADM-11 클론에서 RGP 를 갱신하여 발생하는 대다수 인구의 크기를 정량화한다. (H)MADM-11 클론에서 RGP 를 갱신하여 발생하는 소수 집단의 크기를 정량화한다. (I)비대칭 신경유발 MADM-11 클론의 단일 크기의 정량화. 가설값은 평균 ±SEM. 스케일 바 = 100D μm(D 및 E)을나타낼 수 있다. TM = 타목시펜. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
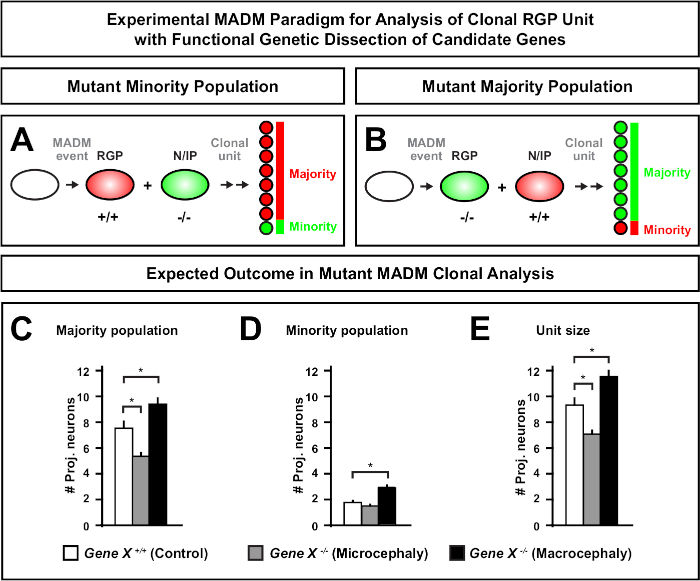
그림 6: MADM 클론 분석은 소두증과 대식세포로 이끌어 내는 유전자를 연구하기 위하여 분석합니다. 가상의 MADM 클론 분석은 소두증 또는 대식세포로 이끌어 내는 후보 유전자의 기능적인 유전 해부를 능력을 발휘할 때 결과. 신경출력에 대한 관심유전자(Gene X)의세포자율기능을 해부하기 위해서는, MADM은 메이오틱 재조합을 통해 MADM 카세트에 돌연변이 알레를 도입해야 한다(자세한 내용은 도 2,히펜마이어 외 46, 라우코터 등 도 2, 히펜마이어 등 46, 라우코터 등 도 2, 히펜마이어 등 46, 라우코터 등 도2,히펜마이어 등 46, 라우코터 등 도 2, 히펜마이어 등46,및 라우코터 등76)을참조한다.73 (A,B) 클로날 RGP 장치의 기능 적 분석을위한 실험 적인 MADM 패러다임을 나타내는 회로도. 돌연변이 서브클론은소수(A)또는대다수(B)집단을 형성할 수 있다. (C-E) 가상의 MADM 클론 분석은 제어 MADM (흰색 막대), 유전자 X MADM 소두증 (회색 막대) 및 유전자 X MADM 매크로 팔리 검은 막대) 비대칭 클론을 정량화 할 때 결과를 제공합니다. (C)대다수 인구의 크기의 정량화. (D)소수 집단의 크기를 정량화한다. (E)비대칭 신경유발 성 클론의 단일 크기의 정량화. 가상 값은 평균 ± SEM. S = 서브클론 셀 수의 차이가 제어에 비해 중요성에 도달 할 수있는 가상 시나리오를 나타낼 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 문학에 있는 MADM 클로날 연구. MADM 클로날 계보 실험을 포함하는 문헌에 있는 연구 요약, 사용된 CreERT2 드라이버를 포함하여, TM 복용량 및 주입의 시간. 이 테이블을 보려면 여기를 클릭하십시오 (다운로드하려면 마우스 오른쪽 클릭).
토론
개발 중인 신피질에서 생체내에서 개별 RGPs의 세포 혈통을 추적하기 위해 MADM을 사용하는 방법이 설명되어 있다. TM 유도 형 CreERT2와결합하면 MADM 이벤트가 정확하게 시간 조정 될 수 있으므로 단일 셀 수준에서 줄기 세포 분열 패턴의 질적 및 정량적 시각적 판독을 제공합니다. 전달된 TM의 용량을 적정함으로써, 이상적인 상황에서 피질 반구당 1개 미만의 클론의 평균을 얻을 수 있으며, 개별 클론을 명확하게 구별하기 위한 적절한 공간 분리를 제공한다. 조직 무결성을 유지함으로써,이 방법은 또한 위치, 형태학 및 절대 세포 수에 관한 필수 정보를 캡처합니다. MADM 카세트는 Chr. 117,11,,,12,,46,,56,,57,Chr. 751, Rosa2647,53, 59의,59 오리지널 MADM이 MADM 클론 분석 연구에 사용되었습니다., 개별 세포의 고해상도는 딸 세포의 형태학 그리고 복제 관계에 전례없는 통찰력을 제공하고 증식 줄기 세포와 신흥 클론46,,52의살아있는 이미징을 허용합니다.
제왕 절개 및 산후 시점에서 클론의 분석을위한 새끼의 육성은 프로토콜에 필요하고 중요한 단계입니다. TM 치료 임신 댐의 건강 상태에 따라 제왕 절개를 수행 할 필요가 없을 수 있습니다. 그러나 TM 치료 어머니가 수유에 어려움을 겪을 수 있기 때문에 수양 어머니와 함께 새끼를 키우는 것은 여전히 필요합니다. 다른 CreERT2 드라이버로 육성할 필요성에 차이가 관찰되지 않았습니다. MADM 라인과 수양 모친은 모두 근친 CD-1 배경에서 유지됩니다. 제왕 절개가 필요하지 않은 경우 실험용 새끼를 생성하는 데 사용되는 TM 처리 임신 댐은 3R원칙에 따라 추가 실험 사육을 위해 재사용할 수 있습니다(동물 실험 라이센스가 이 관행을 승인하는 경우에만 이 작업을 수행할 수 있음). 수양 어머니는 출산 후 2 일 이내에 새끼를 양육하는 데 사용할 수 있지만, 양육해야 하는 실험 마우스와 같은 날에 출산 할 때 더 높은 성공률이 관찰되었습니다. 따라서, 1.1 단계에서 실험 짝짓기와 병행하여 수양 어머니를 위한 시간 조정된 짝짓기를 설정하는 것이 중요합니다. 원래 수양 어머니의 쓰레기와 유사한 쓰레기 수를 유지하는 것은 양육 새끼의 생존율을 향상시킬 수 있으므로 원래의 모든 쓰레기에 일부를 제거해야합니다. 육성을 개선할 수 있는 추가 단계는 실험자의 장갑을 쓰레기와 음식으로 문지르는 것을 포함합니다(장갑의 향기를 제거하기 위해); 제왕 절개 후 새끼를 수양 어머니의 더러운 쓰레기와 둥지 조각으로 부드럽게 문지르는; 그리고 위탁 마우스 케이지에 배치하기 전에 수양 어머니의 새끼와 밀접한 접촉에 새끼의 배치.
다른 리포터 기반 리니지 추적 방법과 마찬가지로 MADM 복제 실험에 적합한 CreERT2 드라이버를 선택할 때주의 해야 합니다. 첫째, 사용되는 프로모터는 관심있는 선조 인구에서 현세적으로 그리고 공간적으로 재조합을 표현해야합니다. 일부 프로모터는 표현 패턴을 변경하거나 다양한 개발 단계에서 침묵할 수 있기 때문에 이 프로모터를 찾는 것은 어려울 수 있습니다. 세포 형 특이성을 향상시키기 위해 다중 부위 별 재조합, 각각 별도의 프로모터에 의해 구동, 사용되었습니다. 하나 또는 둘 다 재조합이 동일한 세포에서 발현될 때, 이것은 형광 기자74,75,,,76,,77로세포및 그것의 자손을 표지합니다. 요약하면 분석중인 선조의 인구에 특정한 CreERT2 드라이버를 선택하는 것이 중요합니다.
이 방법에서 가장 중요한 단계는 모든 셀이 단일 재결합 이벤트(단계 8.1)에서 명확하게 파생되어야 하기 때문에 클론을 식별하는 것입니다. TM 농도의 적정은 뇌 반구 당 적색/녹색 세포의 1개 미만의 클러스터를 보장하고 단일 클론(단계 2.2)7,,11을분석할 확률을 최대화한다. 클론은 인접한 셀 클러스터가 관심 있는 클론의 500 μm 이내에 발생하는 경우 폐기해야 합니다. 따라서 복제본이 출현하기 전과 후에 여러 섹션을 검사하여 근처에 추가 재조합 이벤트가 없는지 확인하는 것이 중요합니다. 형광의 약한 신호로 인해 배아 클론에서 eGFP 및 tdT에 대한 면역 히스토케를 수행해야합니다 (섹션 6 참조). 이것은 추가 항원이 공동 표지될 경우에 성인 클론에서만 추천됩니다. 클론을 이미징할 때 클론이 있는 피질의 전체 너비(즉, 피알 표면에서 코퍼스 캘로섬까지, 8.4단계를 참조)를 캡처하여 세포를 놓치지 않는 것이 중요합니다. 또한 이미지 처리(섹션 9)에서 이미지 정렬을 용이하게 합니다. 프로토콜의 섹션 8은 반전된 공초점 현미경을 요구하지만 사용 가능한 현미경 설정에 따라 적응될 수 있습니다. 상피 현미경 검사는 사용할 수 있지만, 공초점 현미경 검사는 초점 평면 외부에서 빛 오염의 감소로 이어질 수 있기 때문에 권장됩니다. 또한 레이저 강도와 게인이 조정되어 녹색, 빨간색 및 황색 세포를 명확하게 식별할 수 있도록 하는 것도 중요합니다. 설정에 관계없이, 밀접하게 배치 된 세포의 전체 공간 분리를 보장하기 위해 적어도 20 배의 목표를 사용하는 것이 좋습니다. 클론이 있는 모든 세포의 피질 깊이(Step 8.6)를 기록하는 것 외에도, 알렌 브레인 아틀라스 또는 기타 스테레오탁스 좌표 맵과 같은 뇌 아틀라스를 사용하여 클론이 있는 피질 영역을 식별해야 한다. 파일 명명 패러다임도 채택하여 복제 이미지를 쉽게 식별할 수 있도록 해야 합니다. 파일 명명에 고유한 이미지 ID, 날짜 이미지가 촬영, 동물의 유전자형, 유도 연령, 분석 연령, 이미지 번호 와 같은 복제본의 나머지 이미지와 관련된 이미지 번호 : 다음 정보는 파일 명명에 포함 될 수 있습니다.
하나의 MADM 카세트에 돌연변이 해스의 도입은 특유의 유전모자이크(71)의 생성을 허용하고 복제 레벨7,11,,46,,62에서계보 및 세포형 다양성의 분자 조절기의 해부를 허용한다., MADM을 가진 유전 모자이크를 생성하기 위하여는, MADM 카세트는 관심있는 유전자와 같은 염색체에 메이오트로 연결되어야 합니다 (번식 계획에 대한 그림 2 참조). 이는 MADM을 가진 현재 클로날 분석을 Chr. 751,Chr. 1146,Chr. 1251 Rosa26 및 Chr. 6 단면에 위치한 유전자로제한합니다. 향후 연구는 어떤 염색체든을 표적으로 한 MADM 카세트를 사용하여 복제 수준에서 마우스 게놈의 거의 모든 유전자의 모자이크 분석을 허용합니다.
마지막으로, MADM은 개발 중인 신피질에서 선구 세포의 분석에 국한되지 않는다. 많은 줄기 세포 틈새 틈새의 연구는 복제 관련 세포의 현면 배열을 해결하는 기능에서 혜택을 누릴 수 있습니다. 뇌의 다른 부위에 MADM을 적용하, 질환 상태(예를 들어, 암), 또는 다른조직에서47,,50,,51,,52,,53,,54,,55,56,,57,,58,,59,연구 결과는 선조 및 줄기 세포의 다양한 클래스에서 파생된 클론의 혈통 관계를 밝혔다(현재 MADM 연구 목록은 표 1 참조)., MADM의 또 다른 흥미로운 미래 응용 프로그램은 클론에서 획득 할 수있는 정보의 정도를 증가시킬 것이다 추가 기능 또는 세포 외 기자와 결합하는 것입니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
우리는 기술 지원을 위해 IST 오스트리아의 히펜마이어 실험실, 바이오 이미징 시설, 생명 과학 시설 및 사전 임상 시설에 대한 모든 회원들에게 감사드립니다. 이 작품은 IST 오스트리아 기관 기금에 의해 지원되었다; R.B.는 오스트리아 과학 기금(FWF) 리세-마이트너 프로그램(M 2416)의 지원을 받았습니다. N.A는 오스트리아 과학 기금 (FWF) Firnberg-Programm (T 1031)로부터 지원을 받았습니다. GC는 ISTplus 박사 후 동료로 마리 Skłodowska-Curie 보조금 계약 번호 754411에 따라 유럽 연합의 호라이즌 2020 연구 및 혁신 프로그램에서 지원을 받았다; A.H.는 ÖAW DOC(오스트리아 과학 아카데미 박사 펠로우십)의 지원을 받았습니다. 이 연구는 또한 유럽 연합 (EU)의 호라이즌 2020 연구 및 혁신 프로그램 (보조금 계약 번호 725780 LinPro)에 따라 유럽 연구 위원회 (ERC)에 의해 지원되었다 S.H.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL tuberculin syringe (Omnifix Luer Lock) | Braun | 9204512N | |
| 1,4-diazabicyclooctane (DABCO) | Roth | 0718.2 | |
| 10 mL Syringe (Omnifix Luer Lock) | Braun | 8508429N | |
| 15 mL conical centrifuge | Sarstedt | 65.554.502 | |
| 24 multi-well dishes | Roth/Greiner Bio-one | CE56.1 | |
| 27- gauge x 3/4 needle (Sterican) | Braun | 16010256E | |
| Corn oil | Sigma | C8267-500ML | |
| Coverslips (24 x 60 mm #1) | Thermo Fisher Scientific (Menzel) | 15747592 | |
| Cryostat Cryostar NX70 | Thermo Fisher Scientific | 957000H | |
| Dako Pen (Wax marker) | Agilent | S200230-2 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Invitrogen | D1306 | |
| Disposable microtome blade (MX35 Ultra) | Thermo Fisher Scientific | 705830 | |
| Fine Forceps (Dumont #5) | Fine Science Tools (FST) | 11254-20 | |
| Glass anti-roll plate | Histocom | M 449980 | |
| Glycerol | Sigma | G5516 | |
| LSM 800 Confocal | Zeiss | ||
| Mounting medium | 25 mg/mL DAPCO, 6 g Glycerol, 2.4 g Mowiol 4-88, 6 mL dH2O, 12 mL 0.2 M Tris-HCl (pH 8.5) | ||
| Mowiol 4-88 | Roth | 0713.2 | |
| Normal donkey serum | Innovative Research | IGDNSER100ML | |
| Paraformaldehyde | Sigma | 441244-1KG | |
| Peristaltic pump 323E/D 400RPM | Watson-Marlow | 036.3124.00A | |
| Sucrose | Sigma | S8501-5KG | |
| Superfrost plus glass slides | Thermo Fisher Scientific | J1800AMNT | |
| Tamoxifen | Sigma | T5648 | |
| Tissue Embedding mold T-12 (22mm square) | Polysciences Inc. | 18986-1 | |
| Tissue-Tek O.C.T | Sakura | 4583 | |
| Triton X-100 | Sigma | T8787-250ML | |
| Trizma hydrochloride | Sigma | 93363 | |
| Tween-20 | Sigma | P9416-100ML | |
| Software and Plugins: | |||
| Fiji | 1.52p | Fiji | |
| MultiStackReg | 1.45 | Download link | |
| TurboReg | EPFL Bioimaging | ||
| Zen Blue | 2.6 | Zeiss | |
| Experimental Models: Organisms/Strains: | |||
| Mouse: Emx1-CreER | The Jackson Laboratory | JAX:027784 | |
| Mouse: MADM-11-GT | The Jackson Laboratory | JAX:013749 | |
| Mouse: MADM-11-TG | The Jackson Laboratory | JAX:013751 | |
| Primary antibodies: | |||
| Chicken anti-GFP 1:500 | Aves Labs | GFP-1020 | |
| Goat anti-tdTomato 1:500 | Sicgen Antibodies | AB8181-200 | |
| Rabbit anti-RFP 1:500 | MBL | PM005 | |
| Secondary antibodies: | |||
| Donkey Anti-Chicken Alexa Fluor 488 1:500 | Jackson Immuno Research | 715-475-150 | |
| Donkey Anti-Goat Cy3 1:500 | Jackson Immuno Research | 705-165-147 | |
| Donkey Anti-Rabbit Cy3 1:500 | Jackson Immuno Research | 711-165-152 |
참고문헌
- Malatesta, P., et al. Neuronal or glial progeny: regional differences in radial glia fate. Neuron. 37 (5), 751-764 (2003).
- Miyata, T., Kawaguchi, A., Okano, H., Ogawa, M. Asymmetric inheritance of radial glial fibers by cortical neurons. Neuron. 31 (5), 727-741 (2001).
- Noctor, S. C., Flint, A. C., Weissman, T. A., Dammerman, R. S., Kriegstein, A. R. Neurons derived from radial glial cells establish radial units in neocortex. Nature. 409 (6821), 714-720 (2001).
- Taverna, E., Götz, M., Huttner, W. B. The Cell Biology of Neurogenesis: Toward an Understanding of the Development and Evolution of the Neocortex. Annual Review of Cell and Developmental Biology. 30 (1), 465-502 (2014).
- Desikan, R. S., Barkovich, A. J. Malformations of cortical development. Annals of Neurology. 80 (6), 797-810 (2016).
- Gao, R., Penzes, P. Common mechanisms of excitatory and inhibitory imbalance in schizophrenia and autism spectrum disorders. Current Molecular Medicine. 15 (2), 146-167 (2015).
- Beattie, R., et al. Mosaic Analysis with Double Markers Reveals Distinct Sequential Functions of Lgl1 in Neural Stem Cells. Neuron. 94 (3), 517-533 (2017).
- Hippenmeyer, S. Molecular pathways controlling the sequential steps of cortical projection neuron migration. Advances in Experimental Medicine and Biology. 800, 1-24 (2014).
- Lodato, S., Arlotta, P. Generating neuronal diversity in the mammalian cerebral cortex. Annual Review of Cell and Developmental Biology. 31, 699-720 (2015).
- Hansen, A. H., Duellberg, C., Mieck, C., Loose, M., Hippenmeyer, S. Cell Polarity in Cerebral Cortex Development-Cellular Architecture Shaped by Biochemical Networks. Frontiers in Cellular Neuroscience. 11, 176 (2017).
- Gao, P., et al. Deterministic progenitor behavior and unitary production of neurons in the neocortex. Cell. 159 (4), 775-788 (2014).
- Llorca, A., et al. A stochastic framework of neurogenesis underlies the assembly of neocortical cytoarchitecture. eLife. 8, e51381 (2019).
- Ma, J., Shen, Z., Yu, Y. C., Shi, S. H. Neural lineage tracing in the mammalian brain. Current Opinion in Neurobiology. 50, 7-16 (2018).
- Caviness, V., Takahashi, T., Nowakowski, R. Numbers, time and neocortical neuronogenesis: a general developmental and evolutionary model. Trends in Neurosciences. 18 (9), 379-383 (1995).
- Schmechel, D. E., Rakic, P. A Golgi study of radial glial cells in developing monkey telencephalon: morphogenesis and transformation into astrocytes. Anatomy and Embryology. 156 (2), 115-152 (1979).
- Kessaris, N., et al. Competing waves of oligodendrocytes in the forebrain and postnatal elimination of an embryonic lineage. Nature Neuroscience. 9 (2), 173-179 (2006).
- Magavi, S., Friedmann, D., Banks, G., Stolfi, A., Lois, C. Coincident generation of pyramidal neurons and protoplasmic astrocytes in neocortical columns. The Journal of Neuroscience. 32 (14), 4762-4772 (2012).
- Anthony, T. E., Klein, C., Fishell, G., Heintz, N. Radial glia serve as neuronal progenitors in all regions of the central nervous system. Neuron. 41 (6), 881-890 (2004).
- Voigt, T. Development of glial cells in the cerebral wall of ferrets: direct tracing of their transformation from radial glia into astrocytes. The Journal of Comparative Neurology. 289 (1), 74-88 (1989).
- Amberg, N., Laukoter, S., Hippenmeyer, S. Epigenetic cues modulating the generation of cell-type diversity in the cerebral cortex. Journal of Neurochemistry. 149 (1), 12-26 (2019).
- Beattie, R., Hippenmeyer, S. Mechanisms of Radial Glia Progenitor Cell Lineage Progression. FEBS letters. 591 (24), 3993-4008 (2017).
- Telley, L., et al. Temporal patterning of apical progenitors and their daughter neurons in the developing neocortex. Science. 364 (6440), eaav2522 (2019).
- Oberst, P., et al. Temporal plasticity of apical progenitors in the developing mouse neocortex. Nature. 573 (7774), 370-374 (2019).
- Telley, L., et al. Sequential transcriptional waves direct the differentiation of newborn neurons in the mouse neocortex. Science. 351 (6280), 1443 (2016).
- Deppe, U., et al. Cell lineages of the embryo of the nematode Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 75 (1), 376-380 (1978).
- Woodworth, M. B., Girskis, K. M., Walsh, C. A. Building a lineage from single cells: genetic techniques for cell lineage tracking. Nature Reviews Genetics. 18 (4), 230-244 (2017).
- Masuyama, N., Mori, H., Yachie, N. DNA barcodes evolve for high-resolution cell lineage tracing. Current Opinion in Chemical Biology. 52, 63-71 (2019).
- Legue, E., Joyner, A. L. Chapter Ten-Genetic Fate Mapping Using Site-Specific Recombinases. Methods in Enzymology. 477, 153-181 (2010).
- Postiglione, M. P., Hippenmeyer, S. Monitoring neurogenesis in the cerebral cortex: an update. Future Neurology. 9 (3), 323-340 (2014).
- Espinosa-Medina, I., Garcia-Marques, J., Cepko, C., Lee, T. High-throughput dense reconstruction of cell lineages. Open Biology. 9 (12), 190229 (2019).
- Hwang, B., et al. Lineage tracing using a Cas9-deaminase barcoding system targeting endogenous L1 elements. Nature Communications. 10 (1), 1234 (2019).
- Kalhor, R., et al. Developmental barcoding of whole mouse via homing CRISPR. Science. 361 (6405), eaat9804 (2018).
- García-Moreno, F., Vasistha, N. A., Begbie, J., Molnár, Z. CLoNe is a new method to target single progenitors and study their progeny in mouse and chick. Development. 141 (7), 1589-1598 (2014).
- Loulier, K., et al. Multiplex Cell and Lineage Tracking with Combinatorial Labels. Neuron. 81 (3), 505-520 (2014).
- Livet, J., et al. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-62 (2007).
- Snippert, H. J., et al. Intestinal Crypt Homeostasis Results from Neutral Competition between Symmetrically Dividing Lgr5 Stem Cells. Cell. 143 (1), 134-144 (2010).
- Amitai-Lange, A., et al. A method for lineage tracing of corneal cells using multi-color fluorescent reporter mice. Journal of Visualized Experiments. (106), e53370 (2015).
- Vasistha, N. A., et al. Cortical and Clonal Contribution of Tbr2 Expressing Progenitors in the Developing Mouse Brain. Cerebral Cortex. 25 (10), 3290-3302 (2015).
- Chen, F., LoTurco, J. A method for stable transgenesis of radial glia lineage in rat neocortex by piggyBac mediated transposition. Journal of Neuroscience Methods. 207 (2), 172-180 (2012).
- Siddiqi, F., et al. Fate mapping by piggyBac transposase reveals that neocortical GLAST+ progenitors generate more astrocytes than Nestin+ progenitors in rat neocortex. Cerebral Cortex. 24 (2), 508-520 (2014).
- Yoshida, A., et al. Simultaneous expression of different transgenes in neurons and glia by combining in utero electroporation with the Tol2 transposon-mediated gene transfer system. Genes to Cells. 15 (5), 501-512 (2010).
- García-Marqués, J., López-Mascaraque, L. Clonal Identity Determines Astrocyte Cortical Heterogeneity. Cerebral Cortex. 23 (6), 1463-1472 (2013).
- Clavreul, S., et al. Cortical astrocytes develop in a plastic manner at both clonal and cellular levels. Nature Communications. 10 (1), 4884 (2019).
- Kim, G. B., et al. Rapid Generation of Somatic Mouse Mosaics with Locus-Specific, Stably Integrated Transgenic Elements. Cell. 179 (1), 251-267 (2019).
- Pilz, G. A., et al. Live imaging of neurogenesis in the adult mouse hippocampus. Science. 359 (6376), 658 (2018).
- Hippenmeyer, S., et al. Genetic Mosaic Dissection of Lis1 and Ndel1 in Neuronal Migration. Neuron. 68 (4), 695-709 (2010).
- Zong, H., Espinosa, J. S., Su, H. H., Muzumdar, M. D., Luo, L. Mosaic analysis with double markers in mice. Cell. 121 (3), 479-492 (2005).
- Ramón y Cajal, S. . Histologie du système nerveux de l'homme et des vertébrés. , (1911).
- Cowan, W. M. The emergence of modern neuroanatomy and developmental neurobiology. Neuron. 20 (3), 413-426 (1998).
- Ali, S. R., et al. Existing cardiomyocytes generate cardiomyocytes at a low rate after birth in mice. Proceedings of the National Academy of Sciences of the United States of America. 111 (24), 8850-8855 (2014).
- Hippenmeyer, S., Johnson, R. L., Luo, L. Mosaic analysis with double markers reveals cell-type-specific paternal growth dominance. Cell Reports. 3 (3), 960-967 (2013).
- Riccio, P., Cebrian, C., Zong, H., Hippenmeyer, S., Costantini, F. Ret and Etv4 promote directed movements of progenitor cells during renal branching morphogenesis. PLoS Biology. 14 (2), e1002382 (2016).
- Bonaguidi, M. A., et al. In vivo clonal analysis reveals self-renewing and multipotent adult neural stem cell characteristics. Cell. 145 (7), 1142-1155 (2011).
- Mayer, C., et al. Clonally Related Forebrain Interneurons Disperse Broadly across Both Functional Areas and Structural Boundaries. Neuron. 87 (5), 989-998 (2015).
- Muzumdar, M. D., et al. Clonal dynamics following p53 loss of heterozygosity in Kras-driven cancers. Nature Communications. 7, 12685 (2016).
- Shi, W., et al. Ontogenetic establishment of order-specific nuclear organization in the mammalian thalamus. Nature Neuroscience. 20, 516 (2017).
- Wong, S. Z. H., et al. In vivo clonal analysis reveals spatiotemporal regulation of thalamic nucleogenesis. PLoS Biology. 16 (4), e2005211 (2018).
- Xu, H. T., et al. Distinct Lineage-Dependent Structural and Functional Organization of the Hippocampus. Cell. 157 (7), 1552-1564 (2014).
- Brennand, K., Huangfu, D., Melton, D. All β Cells Contribute Equally to Islet Growth and Maintenance. PLoS Biology. 5 (7), e163 (2007).
- Ortiz-Alvarez, G., et al. Adult neural stem cells and multiciliated ependymal cells share a common lineage regulated by the geminin family members. Neuron. 102 (1), 159-172 (2019).
- Kaplan, E. S., Ramos-Laguna, K. A., Mihalas, A. B., Daza, R. A. M., Hevner, R. F. Neocortical Sox9+ radial glia generate glutamatergic neurons for all layers, but lack discernible evidence of early laminar fate restriction. Neural Development. 12 (1), 14 (2017).
- Lv, X., et al. TBR2 coordinates neurogenesis expansion and precise microcircuit organization via Protocadherin 19 in the mammalian cortex. Nature Communications. 10 (1), 3946 (2019).
- Mihalas, A. B., Hevner, R. F. Clonal analysis reveals laminar fate multipotency and daughter cell apoptosis of mouse cortical intermediate progenitors. Development. 145 (17), dev164335 (2018).
- Picco, N., et al. A mathematical insight into cell labelling experiments for clonal analysis. Journal of Anatomy. 235 (3), 687-696 (2019).
- Johnson, C. A., Ghashghaei, H. T. Sp2 regulates late neurogenic but not early expansive divisions of neural stem cells underlying population growth in the mouse cortex. Development. , (2020).
- Espinosa, J. S., Luo, L. Timing Neurogenesis and Differentiation: Insights from Quantitative Clonal Analyses of Cerebellar Granule Cells. The Journal of Neuroscience. 28 (10), 2301 (2008).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Liu, Y., et al. Tamoxifen-independent recombination in the RIP-CreER mouse. PLoS One. 5 (10), e13533 (2010).
- Klingler, E., Jabaudon, D. Do progenitors play dice?. eLife. 9, e54042 (2020).
- Hippenmeyer, S. Dissection of gene function at clonal level using mosaic analysis with double markers. Frontiers in Biology. 8 (6), 557-568 (2013).
- Rulands, S., Simons, B. D. Tracing cellular dynamics in tissue development, maintenance and disease. Current Opinion in Cell Biology. 43, 38-45 (2016).
- Laukoter, S., et al. Imprinted Cdkn1c genomic locus cell-autonomously promotes cell survival in cerebral cortex development. Nature Communications. 11 (1), 195 (2020).
- Daigle, T. L., et al. A Suite of Transgenic Driver and Reporter Mouse Lines with Enhanced Brain-Cell-Type Targeting and Functionality. Cell. 174 (2), 465-480 (2018).
- He, M., et al. Strategies and Tools for Combinatorial Targeting of GABAergic Neurons in Mouse Cerebral Cortex. Neuron. 91 (6), 1228-1243 (2016).
- Yamamoto, M., et al. A multifunctional reporter mouse line for Cre- and FLP-dependent lineage analysis. Genesis. 47 (2), 107-114 (2009).
- Plummer, N. W., et al. Expanding the power of recombinase-based labeling to uncover cellular diversity. Development. 142 (24), 4385 (2015).
- Imayoshi, I., Ohtsuka, T., Metzger, D., Chambon, P., Kageyama, R. Temporal regulation of Cre recombinase activity in neural stem cells. Genesis. 44 (5), 233-238 (2006).
- Sasaki, S., et al. Complete loss of Ndel1 results in neuronal migration defects and early embryonic lethality. Molecular and Cellular Biology. 25 (17), 7812-7827 (2005).
- Acampora, D., et al. Epilepsy and brain abnormalities in mice lacking the Otx1 gene. Nature Genetics. 14 (2), 218-222 (1996).
- Soeda, T., et al. Sox9-expressing precursors are the cellular origin of the cruciate ligament of the knee joint and the limb tendons. Genesis. 48 (11), 635-644 (2010).
- Klezovitch, O., Fernandez, T. E., Tapscott, S. J., Vasioukhin, V. Loss of cell polarity causes severe brain dysplasia in Lgl1 knockout mice. Genes & Development. 18 (5), 559-571 (2004).
- Pimeisl, I. M., et al. Generation and characterization of a tamoxifen-inducible EomesCreER mouse line. Genesis. 51 (10), 725-733 (2013).
- Nakagawa, N., et al. Memo1-Mediated Tiling of Radial Glial Cells Facilitates Cerebral Cortical Development. Neuron. 103 (5), 836-852 (2019).
- Nowotschin, S., et al. The T-box transcription factor Eomesodermin is essential for AVE induction in the mouse embryo. Genes & Development. 27 (9), 997-1002 (2013).
- Balordi, F., Fishell, G. Mosaic removal of hedgehog signaling in the adult SVZ reveals that the residual wild-type stem cells have a limited capacity for self-renewal. Journal of Neuroscience. 27 (52), 14248-14259 (2007).
- Liang, H., et al. Neural development is dependent on the function of specificity protein 2 in cell cycle progression. Development. 140 (3), 552-561 (2013).
- Guo, C., Yang, W., Lobe, C. G. A Cre recombinase transgene with mosaic, widespread tamoxifen-inducible action. Genesis. 32 (1), 8-18 (2002).
- Ahn, S., Joyner, A. L. In vivo analysis of quiescent adult neural stem cells responding to Sonic hedgehog. Nature. 437 (7060), 894-897 (2005).
- Storm, R., et al. The bHLH transcription factor Olig3 marks the dorsal neuroepithelium of the hindbrain and is essential for the development of brainstem nuclei. Development. 136 (2), 295-305 (2009).
- Koundakjian, E. J., Appler, J. L., Goodrich, L. V. Auditory neurons make stereotyped wiring decisions before maturation of their targets. Journal of Neuroscience. 27 (51), 14078-14088 (2007).
- Dor, Y., Brown, J., Martinez, O. I., Melton, D. A. Adult pancreatic β-cells are formed by self-duplication rather than stem-cell differentiation. Nature. 429 (6987), 41-46 (2004).
- Sohal, D. S., et al. Temporally regulated and tissue-specific gene manipulations in the adult and embryonic heart using a tamoxifen-inducible Cre protein. Circulation Research. 89 (1), 20-25 (2001).
- Ventura, A., et al. Restoration of p53 function leads to tumour regression in vivo. Nature. 445 (7128), 661-665 (2007).
- Johnson, L., et al. Somatic activation of the K-ras oncogene causes early onset lung cancer in mice. Nature. 410 (6832), 1111-1116 (2001).
- Tasic, B., et al. Extensions of MADM (mosaic analysis with double markers) in mice. PLoS One. 7 (3), e33332 (2012).
- Yu, J., Carroll, T. J., McMahon, A. P. Sonic hedgehog regulates proliferation and differentiation of mesenchymal cells in the mouse metanephric kidney. Development. 129 (22), 5301-5312 (2002).
- Zhao, H., et al. Role of fibroblast growth factor receptors 1 and 2 in the ureteric bud. Developmental Biology. 276 (2), 403-415 (2004).
- Schuchardt, A., D'Agati, V., Larsson-Blomberg, L., Costantini, F., Pachnis, V. Defects in the kidney and enteric nervous system of mice lacking the tyrosine kinase receptor Ret. Nature. 367 (6461), 380-383 (1994).
- Livet, J., et al. ETS gene Pea3 controls the central position and terminal arborization of specific motor neuron pools. Neuron. 35 (5), 877-892 (2002).
- Volz, K. S., et al. Pericytes are progenitors for coronary artery smooth muscle. eLife. 4, e10036 (2015).
- Cai, C. L., et al. A myocardial lineage derives from Tbx18 epicardial cells. Nature. 454 (7200), 104-108 (2008).
- Lasrado, R., et al. Lineage-dependent spatial and functional organization of the mammalian enteric nervous system. Science. 356 (6339), 722-726 (2017).
- Matsuoka, T., et al. Neural crest origins of the neck and shoulder. Nature. 436 (7049), 347-355 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유