需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
小鼠自身免疫性糖尿病过继转移模型中移植物存活的生物发光监测
摘要
该协议描述了一种直接和微创的方法,用于在非肥胖糖尿病(NOD)严重联合免疫缺陷小鼠中移植和成像NIT-1细胞,这些小鼠受到从自发糖尿病NOD小鼠纯化的脾细胞的挑战。
摘要
1型糖尿病的特征是胰腺产生胰岛素的β细胞的自身免疫性破坏。这种疾病的有希望的治疗方法是移植干细胞衍生的β细胞。然而,为了保护移植的细胞免受持续的自身免疫,可能需要进行基因改造。糖尿病小鼠模型是初步评估保护移植细胞免受自身免疫攻击的策略的有用工具。这里描述的是一种在小鼠糖尿病过继转移模型中移植和成像细胞移植物的微创方法。在该协议中,来自表达萤火虫荧光素酶转基因 luc2 的鼠胰腺β细胞系NIT-1的细胞被皮下移植到免疫缺陷的非肥胖糖尿病(NOD)严重联合免疫缺陷(scid)小鼠中。同时向这些小鼠静脉注射来自自发糖尿病NOD小鼠的脾细胞以转移自身免疫。通过非侵入性生物发光成像 定期 对移植物进行成像,以监测细胞存活。将突变细胞的存活率与移植到同一只小鼠中的对照细胞的存活率进行比较。
引言
1型糖尿病(T1D)是由胰腺产生胰岛素的β细胞的自身免疫性破坏引起的。β细胞质量的损失导致胰岛素缺乏和高血糖。T1D 患者每天依赖多次注射外源性胰岛素,并终生经历严重高血糖和低血糖发作。与这些发作相关的并发症包括糖尿病视网膜病变、肾功能下降和神经病变1。
胰岛素注射是T1D的治疗方法,但不能治愈。然而,替换丢失的β细胞团有可能通过使患者产生自己的胰岛素来逆转疾病。然而,尸体供体胰岛的供应有限2。干细胞来源的胰岛(SC-胰岛)可以为移植提供几乎无限的β细胞供应。几个小组已经证明,人类胚胎干细胞(ESC)和诱导多能干细胞(iPSCs)可以分化以产生功能性β样细胞3,4,5。有希望的早期临床试验数据表明,这些细胞在移植后仍能维持其功能,并可能使患者成为胰岛素非依赖性6。然而,需要慢性免疫抑制,从而增加他们对癌症和感染的易感性。此外,免疫抑制剂长期可能对移植物具有细胞毒性7。为了消除免疫抑制的需要,可以对SC胰岛进行基因改造,以保护它们免受复发性自身免疫以及移植后的同种异体免疫。
干细胞研究对成本和劳动力的要求很高。小鼠细胞系和动物模型是用于初始鉴定和实验验证保护移植细胞免受自身免疫的策略的有用工具。NOD小鼠发展为自发性自身免疫性糖尿病,与人类T1D8有许多相似之处,NIT-1胰岛素瘤细胞系与该小鼠品系9共享遗传背景。糖尿病可以通过从NOD小鼠注射糖尿病脾细胞来过继转移到相关的免疫缺陷NOD-scid小鼠品系,以便在复制实验小鼠10中暂时同步糖尿病的发作。该模型可用于相对快速且廉价地识别遗传靶标,以便在SC胰岛中进行进一步验证。最近,该方法被用于鉴定和验证RNLS,RNLS是一种靶标,被发现可以保护原代人胰岛免受体内自身免疫和iPSC衍生胰岛免受体外β细胞应激的影响11。这里描述的是移植基因工程NIT-1细胞并在小鼠自身免疫性糖尿病的过继转移模型中非侵入性监测其存活率的简单方案。
Access restricted. Please log in or start a trial to view this content.
研究方案
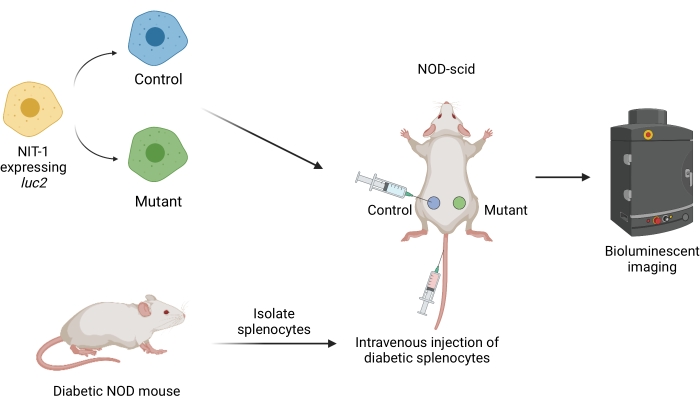
图 1:小鼠糖尿病过继转移模型中移植和成像移植物的工作流程。 表达萤火虫转基因荧光素酶(luc2)的NIT-1细胞皮下移植到NOD-scid小鼠中。同时向小鼠注射从自发糖尿病NOD小鼠分离的自身反应性脾细胞。通过非侵入性生物发光成像定期对移植物进行成像。BioRender.com 创建的图。缩写:NOD = 非肥胖糖尿病患者;SCID = 严重联合免疫缺陷。 请点击此处查看此图的大图。
所有动物护理和研究方案均由乔斯林糖尿病中心的机构动物护理和使用委员会(IACUC)批准并按照其执行。NOD和NOD-scid小鼠可以很容易地从商业来源获得。本研究中的所有小鼠均维持在哨兵监测设施中。有关此协议中使用的所有材料、动物、仪器和软件的详细信息,请参阅 材料表 。
1. NIT-1细胞系的工程与维护
- 在含有4.5%胎牛血清和1%青霉素/链霉素的DMEM中组织培养处理的培养皿中维持与NOD小鼠共享遗传背景的NIT-1细胞系和293FT细胞。
- 将293FT细胞生长至70%-80%汇合以进行转染。
- 每 10 cm 培养皿中的 293FT 细胞,在组成活性 EF1α 启动子的控制下,将表达萤火虫荧光素酶转基因 (luc2) 的 10 μg pLenti-荧光素酶-原始细胞(参见补充文件 1)、1 mL 无血清 DMEM 中混合 4 μg 包膜蛋白质粒 pCMV-VSV-G 和 60 μg 线性聚乙烯亚胺 (PEI)。根据要转染的细胞数量调整量。
- 将DNA,PEI和DMEM在室温(RT)下放置20分钟,然后将它们添加到293FT细胞中。
- 转染后48小时收集含有慢病毒颗粒的培养基。
- 以~80%汇合度转导NIT-1细胞,每106 个细胞与1mL含有慢病毒颗粒的培养基汇合48-72小时。
- 选择用5μg/ mL杀稻瘟菌素表达荧光素的细胞48小时。
- 进一步对表达荧光素酶的细胞进行基因修饰以适应实验问题。包括表达荧光素酶的野生型或非靶向对照细胞系进行比较。
注意:靶基因修饰的例子包括CRISPR敲除,CRISPRa / i,shRNA敲低和过表达。
2. 移植用NIT-1细胞的制备
- 培养表达荧光素酶的细胞,直到它们汇合80%-90%。
- 取出生长培养基并用磷酸盐缓冲盐水(PBS,10厘米培养皿5mL)洗涤细胞。
- 向每个培养皿中加入 1 mL 的 0.05% 胰蛋白酶-EDTA 2 分钟。
- 用 5 mL 生长培养基中和胰蛋白酶。
- 使用移液管将细胞从培养皿上洗掉并转移到锥形管中。
注意:来自同一细胞系的多个培养皿的细胞可以组合。 - 使用血细胞计数器手动使用台盼蓝等染色剂或自动细胞计数器自动计数细胞。
- 在室温下以250× g 离心5分钟,并用吸液管除去上清液。
- 将细胞沉淀重悬于PBS中,浓度为5×107 个细胞/ mL(每只小鼠每个细胞系107 个细胞将以200μL的体积移植)。
- 将细胞保持在冰上(长达3小时)直到移植。
3. 将NIT-1细胞移植到NOD-scid小鼠体内
- 通过在敲低室中吸入异氟醚来麻醉受体小鼠(与用于分离脾细胞的小鼠同性别的8-10周龄NOD-scid小鼠)。以 1.5 L/min 的流速和 9 L/min 的抽真空速率将 2.5% 异氟醚输送到腔室中。
- 用眼药膏润滑动物的眼睛以防止干燥。
- 使用带防护装置的电动剃须刀,从小鼠的背部(背侧)去除毛发以暴露皮肤。剃光的移植区域约为 1 英寸 x 2 英寸。将剃光的小鼠送回敲除室,直到移植。
- 用异氟醚鼻锥一次将小鼠转移到干净的表面上。轻轻地将鼠标的头部引导到鼻锥中。使用0.25 L/min的异氟醚流速在移植过程中维持麻醉。
- 用异丙醇准备垫擦拭移植区域,以去除松散的头发并对皮肤进行消毒。
- 在加载注射器之前,确保细胞完全重悬。用 26 G 针头将过量体积 (>300 μL) 的细胞吸入 1 mL 无菌注射器中。去除任何气泡;然后,将多余的细胞返回到管中,使 300 μL 细胞悬液留在注射器中。
- 使用一对用非惯用手握住的弯曲镊子,轻轻抬起小鼠背部一侧(左侧或右侧)的皮肤,以便更容易进入皮下空间。
- 使用惯用手将注射器平行于小鼠身体的冠状面和矢状面。将针头指向小鼠头部,将针头插入后躯附近的皮肤中,然后轻轻地将其引导到皮下空间。确保整个针头留在皮肤下,不会戳穿。
- 调整镊子以轻轻握住针根周围的皮肤。缓慢分配少量细胞悬液(<50μL),并确认注射部位的皮肤下形成一个小凸起。继续注射细胞悬液,直到将 200 μL 输送到皮下间隙。
- 将镊子固定到位并保持针头与小鼠身体平行,慢慢抽出针头。拔出针头后,用镊子闭合皮肤几秒钟,以防止细胞从穿刺伤口泄漏出来。
- 如果正在评估基因修饰,请使用不同的注射器在小鼠的另一侧重复移植,以便将突变细胞和对照细胞注射到每只小鼠中,左侧有一个细胞系,右侧是另一个细胞系。如果只移植一个细胞系,则仅在一侧注射细胞。
- 移植后,将每只小鼠转移到新鲜的笼子中。在将其他小鼠添加到笼子之前,让每只小鼠从麻醉中完全恢复。
注意:当小鼠恢复正常活动并且没有表现出嗜睡或运动受损的迹象时,它们会恢复。 - 在移植后的实验期间每天评估小鼠的健康状况。如果移植物形成大凸起或小鼠变得虚弱和昏昏欲睡,请测量其血糖并向所有低血糖 小鼠随意提供 10%(w / w)蔗糖水。遵循所有兽医建议,并根据机构指南对任何身体状况持续不佳的小鼠实施安乐死。在这项研究中,小鼠通过吸入CO2 然后颈椎脱位被安乐死。
4.自身反应性脾细胞的分离纯化
- 通过使用尿液(或血液)葡萄糖试纸鉴定最近发病(少于10天)糖尿病的10-16周龄雄性或雌性NOD小鼠。当NOD小鼠至少连续2天出现尿液/血糖≥250mg / dL时,它们被认为是糖尿病。
注意:对于每只NOD-scid小鼠,需要1000万个脾细胞;一个脾脏通常产生5000万至1.5亿个脾细胞。从饲养在哨点监测设施中的无病原体小鼠中分离出脾细胞。 - 对适当数量的糖尿病NOD小鼠实施安乐死。
注意:在这项研究中,小鼠通过吸入CO2 然后颈椎脱位来安乐死以确保死亡。 - 将鼠标放在背上,用手术剪刀在皮肤上做一个大约 2 英寸长的垂直切口。从研究人员的角度打开鼠标的右侧,找到鲜红色的脾脏。轻轻地将脾脏从粉红色胰腺上切开,并将其转移到含有5mL无菌PBS的无菌10cm培养皿中。根据需要用尽可能多的小鼠重复解剖。
注意:来自多只小鼠的脾脏可以组合在一个培养皿中。在无菌罩中使用无菌试剂和设备进行以下步骤。 - 用无菌注射器柱塞的平顶捣碎脾脏。
- 将 40 μm 或 70 μm 过滤器放入 50 mL 锥形管中,并用 5 mL PBS 清洗过滤器以将其灌注。将脾脏悬浮液转移到过滤器中,然后继续轻轻地捣碎过滤器。用 10 mL PBS 清洗培养皿,然后将洗液转移到过滤器中。继续捣碎,直到过滤器上的红色消失。
- 丢弃过滤器并在室温下以500× g 旋转管5分钟。 用吸液管除去上清液。
- 将细胞沉淀重悬于预热至室温的 5 mL(最多三个脾脏)ACK 裂解缓冲液中,并裂解红细胞 4 分钟。如果需要额外的脾脏,每脾增加 1-2 mL 的体积。
- 每 5 mL 裂解缓冲液中用 5 mL NIT-1 细胞培养基(如上所述)停止反应。将细胞悬液通过新鲜过滤器以去除团块。丢弃过滤器,并在室温下以500× g 旋转5分钟。
- 将细胞沉淀重悬于20mL PBS中,并计数细胞。在室温下以 500 × g 旋转 5 分钟。 将细胞重悬于无菌 PBS 中,浓度为 1 × 108 个细胞/mL(进样体积为 0.1 mL/小鼠)在 1.5 mL 安全锁定反应管中。
- 将细胞储存在冰上(不超过1小时)或将细胞保持在室温下,并立即进行尾静脉注射。
5. 经 侧尾静脉静脉注射糖尿病脾细胞
- 加热成年受体NOD-scid小鼠的身体(例如,通过使用加热灯~5-10分钟)以血管扩张静脉(这有助于可视化和注射到静脉中)。
注意:为避免鼠标过热,请勿超过此时间。始终监视运行状况。如果小鼠看起来筋疲力尽或无法移动,请立即关闭加热灯。 - 预热细胞悬液。用无菌针头(27-30 G,0.3 毫米/0.5 英寸或更小)准备无菌注射器 (0.3-1.0 mL),或使用带有 0.3 毫米(0.5 英寸)针头的无菌 0.5 mL 胰岛素注射器。始终保持针头无菌,如果注射器必须在注射之间放下,请使用无菌托盘。
- 每次注射前重悬脾细胞溶液。对于每只小鼠,将100μL预热和混合的脾细胞悬浮液吸入注射器中。确保注射器或悬浮液中没有气泡。
注意:在将鼠标放入约束装置之前,请确保准备好所有设备和用品(用于消毒的酒精湿巾、装有待注射脾细胞的注射器以及用于分离注射小鼠的新鲜笼子)。 - 将鼠标放在约束装置中。用非惯用手捕获尾巴,并找到两个侧尾脉之一。如果需要,轻轻旋转尾巴。用消毒湿巾(70%异丙醇)擦拭尾巴,以清洁皮肤并增加静脉的可见度。
- 用惯用手将针以锐角插入尾巴的中心区域。将针头的斜面朝上,将针头在皮肤上滑动几毫米。
注意:确保针头与静脉平行,并稍微放在皮肤下。准备好鼠标/尾巴在穿透皮肤/血管壁后直接突然移动。成功插入针头应该感觉像"平滑滑入"静脉。如果需要再次尝试,请将尾巴进一步向上移动,朝身体移动。 - 轻轻按压注射器以注射脾细胞悬浮液。注射时不要让针头进一步向内或向外移动。成功的注射是平稳的,在注射过程中不会感到任何背压,并且在注射后立即通过透明/白色血流来指示。
- 轻轻地将针头从静脉中释放出来,并用消毒湿巾轻轻按压尾部,直到出血停止。将鼠标从约束装置中松开,然后轻轻地将其转移到新鲜准备的笼子中。
注意:用脾细胞注射两到三只未接受NIT-1细胞移植的对照小鼠,以确认自身反应性脾细胞诱导糖尿病的潜力,这在注射后大约需要2-4周。
6. NIT-1移植物的 体内 生物发光成像
注意:每周对移植物进行一到两次成像。在移植当天,在移植后至少等待2小时,以使移植物沉降并确保稳定的荧光素酶表达。如果时间是一个限制因素,则可以在第 1 天进行初始测量。推荐的初始成像计划是注射后第 0 天或第 1 天、第 5 天、第 10 天、第 14 天、第 18 天和第 25 天。但是,根据生物发光信号丢失判断的自身免疫进展来调整时间表。
- 在杜尔贝克的PBS中制备15毫克/毫升的D-荧光素溶液。在室温下搅拌溶解,并无菌过滤器(0.22μm)。将1mL等分试样储存在-20°C,并根据需要解冻。
注意:等分试样可以重新冷冻。 - 在成像前至少5分钟,使用1mL注射器和26G针头与D-荧光素溶液以150mg / kg的剂量腹膜内注射小鼠。
注意:为每只鼠标使用新鲜的注射器和针头。 - 根据机构指南通过异氟醚吸入麻醉小鼠。推荐条件为 2.5% 异氟醚,流速为 1.5 L/min,进入敲除室,抽真空速率为 9 L/min。
- 用眼药膏润滑动物的眼睛以防止干燥。
- 打开与成像仪器关联的软件。 创建新用户 和/或 登录名。在右下角的 控制面板 上,选择 初始化 (图 2A)。若要 自动保存 图像数据,请在计算机上创建相应的 文件夹 ,然后选择 "采集 |自动保存到... (图2A)。仪器完成初始化后,将 曝光时间 设置为 1 分钟。
注意:完整的成像参数如图 2B所示。 - 将小鼠一次从敲低室转移到成像仪器。将鼠标放在肚子上,四肢张开,轻轻地将其头部引导到鼻锥中。通过鼻锥 输送 的 0.25 L/min 异氟烷流速适合在成像期间维持麻醉。用双手按压鼠标背部中心,然后将双手向外分开,轻轻地压平鼠标。
- 选择 "获取 "(图 2B)。在弹出窗口中记录实验的任何相关细节(图2C)。
注意:参见 图3A ,以获取在不同时间点移植两个移植物的三只8周龄雌性NOD-scid小鼠的代表性图像。
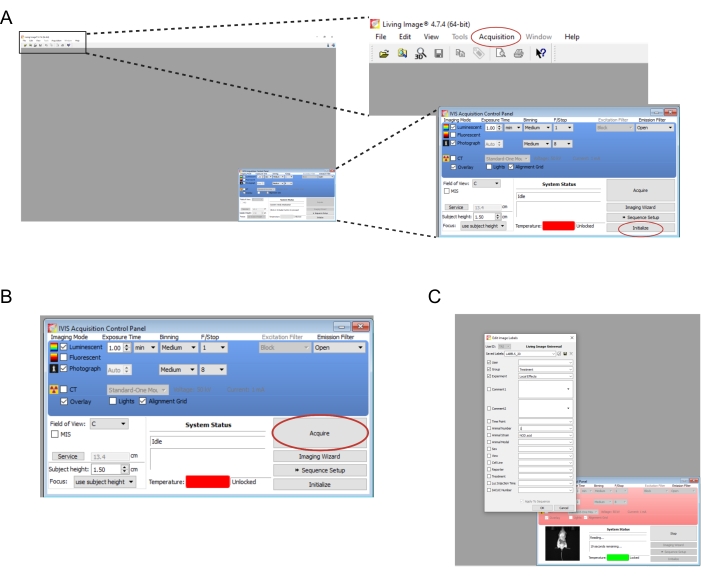
图 2:用于生物发光移植物成像的软件命令的屏幕截图 。 (A) 在成像之前,选择 初始化 以准备仪器。图像可以通过选择 "采集 "|" 自动保存到... (B)成像参数概述。将鼠标定位在仪器中后,选择 "获取"。(C) 成像过程中弹出的对话框的屏幕截图。可以在此处输入时间点和小鼠品系等详细信息。 请点击此处查看此图的大图。
7. 数据分析
- 成像后随时量化生物发光信号。打开与成像仪器关联的软件。选择 文件 |打开,然后选择与要分析的鼠标关联的 ClickInfo.txt 文件 。
- 在工具 选项板中,选择ROI 工具 (图3B,步骤1)。从 椭圆形 下拉菜单(图3B,步骤1,红色箭头)中,选择移植到小鼠中的移植物数量。
- 移动椭圆形,使其包含来自每个移植物的生物发光信号,然后选择 测量ROI (图3B,步骤2)。
- 记录每个移植物的总 计数 (图3B,步骤3)。
- 对于每个移植物,将在每个时间点测量的生物发光信号除以在第一个时间点测量的信号。将 移植物存活 率报告为残留生物发光信号相对于初始生物发光信号的比例或百分比。
注意:如果移植物在移植后扩大,移植物存活率或百分比将分别大于1%或100%。应监测所有接受移植的小鼠对健康的不良影响。
Access restricted. Please log in or start a trial to view this content.
结果
图 1 概述了该协议的概述。可以比较两个细胞系的存活率,例如突变体和非靶向对照,或者可以在多组小鼠中测量一个细胞系的存活率,例如药物治疗的小鼠与载体处理的对照。图3A显示了三只8周龄的雌性NOD-scid小鼠移植非靶向对照(左)和突变(右)细胞系。小鼠还静脉注射自身反应性脾细胞以转移糖尿病。
小鼠在注射后第0天?...
Access restricted. Please log in or start a trial to view this content.
讨论
T1D是一种毁灭性的疾病,目前尚无治愈方法。β细胞替代疗法为患有这种疾病的患者提供了一种有希望的治疗方法,但这种策略的关键障碍是针对移植的β细胞的复发性自身免疫攻击的可能性。SC-β细胞的基因工程以降低其免疫可见性或易感性是这个问题的一个潜在解决方案。这里描述的是用于对移植的β细胞进行非侵入性成像的方案,以测量它们在小鼠自身免疫性糖尿病的过继转移模型中的存活?...
Access restricted. Please log in or start a trial to view this content.
披露声明
提交人声明他们没有利益冲突。
致谢
我们感谢Erica P. Cai博士和Yuki Ishikawa博士开发本协议中描述的方法(见参考文献11)。S.K.和P.Y.实验室的研究得到了美国国立卫生研究院(NIH)(R01DK120445,P30DK036836),JDRF,哈佛干细胞研究所和Beatson基金会的资助。T.S.得到了国家糖尿病,消化和肾脏疾病研究所(NIDDK)(T32 DK007260-45)的博士后奖学金的支持,K.B.得到了Mary K. Iacocca基金会的部分奖学金支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin, 0.53 mM EDTA | Corning | 25-052-CI | |
| 293FT | Invitrogen | R70007 | Fast-growing, highly transfectable clonal isolate derived from human embryonal kidney cells transformed with the SV40 large T antigen |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| Alcohol prep pads, 70% Isopropyl alcohol | Amazon/Ever Ready First Aid | B08NWF31DX | |
| BD 5ml Syringe Luer-Lok Tip | BD | 309646 | |
| BD PrecisionGlide Needle 26G x 5/8 (0.45 mm x 16 mm) Sub-Q | BD | 305115 | |
| BD 1 mL TB Syringe Slip Tip | BD | 309659 | |
| Blasticidin S HCl | Corning | 30-100-RB | |
| Cell strainer premium SureStrain, 70 µm, sterile | Southern Labware | C4070 | Or use similar sterile strainer with 40-70um pore size |
| CellDrop automated cell counter | Denovix | CellDrop BF-PAYG | Or use similar cell counter device |
| Corning 100 mL Penicillin-Streptomycin Solution, 100x | Corning | 30-002-CI | |
| Disposable Aspirating Pipets, Polystyrene, Sterile, Capacity=2 mL | VWR | 414004-265 | Or use similar aspirating pipette |
| D-Luciferin, Potassium Salt , Molecular Biology Grade, Powder, >99% | Goldbio | LUCK-100 | |
| DMEM, high glucose, pyruvate, no glutamine | Gibco | 10313039 | |
| Falcon BD tubes, 50 mL | Fisher Scientific | 14-959-49A | |
| Fetal Bovine Serum | Gibco | 10437-028 | |
| Forceps premium for tissues, 1 x 2 teeth 5 in, German Steel | Fisher Scientific | 13-820-074 | |
| Glucose urine test strip | California Pet Pharmacy | u-tsg100 | Or use similar test strip for glucose measurments in urine/blood |
| GlutaMAX–1 (100x) | Gibco | 35050-061 | |
| Infrared heating lamp | Cole Parmer | 03057-00 | Or use similar infrared lamp |
| Insulin syringe 0.5 mL, U-100 29 G 0.5 in | Becton Dickinson | 309306 | |
| Isoflurane, USP | Piramal Critical Care | 6679401725 | |
| IVIS Spectrum in vivo imaging system | Perkin Elmer | 124262 | Instrument for non-invasively collecting bioluminescent images of transplanted cells |
| Living Image Analysis Software | Perkin Elmer | 128113 | Software for collecting and quantifying bioluminescent signal |
| Microcentrifuge tubes seal-rite, 1.5 mL | USA Scientific | 1615-5510 | Or use similar sterile microcentrifuge tubes |
| NIT-1 | ATCC | CRL-2055 | Pancreatic beta-celll line derived from NOD/Lt mice |
| NOD.Cg-Prkdcscid/J | The Jackson Laboratory | 001303 | Mice homozygous for the severe combined immune deficiency spontaneous mutation Prkdcscid, commonly referred to as scid, are characterized by an absence of functional T cells and B cells, lymphopenia, hypogammaglobulinemia, and a normal hematopoietic microenvironment. |
| NOD/ShiLtJ | The Jackson Laboratory | 001976 | The NOD/ShiLtJ strain of mice (commonly called NOD) is a polygenic model for autoimmune type 1 diabetes |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010031 | No calcium, no magnesium, no phenol red |
| pCMV-VSV-G | Addgene | 8454 | |
| pLenti-luciferase-blast | Made in-house | Plasmid available upon request | See Supplemental File 1 |
| pMD2.G | Addgene | 12259 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polyethylenimine, Linear, MW 25,000, Transfection Grade (PEI 25K) | Fisher Scientific | NC1014320 | |
| pRSV-Rev | Addgene | 12253 | |
| Restrainer for rodents, broome-style round 1 in | Fisher Scientific | 01-288-32A | |
| Scissors, sharp-pointed | Fisher Scientific | 08-940 | Or use other scissors made of surgical-grade stainless steel |
| Tissue-culture treated culture dishes | Millipore Sigma | CLS430167-20EA | Or use other sterile cell culture-treated Petri dishes |
| Tweezers/Forceps, fine precision medium tipped | Fisher Scientific | 12-000-157 |
参考文献
- Katsarou, A., et al. Type 1 diabetes mellitus. Nature Reviews Disease Primers. 3, 17016(2017).
- Shapiro, A. M., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews Endocrinology. 13 (5), 268-277 (2017).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Russ, H. A., et al. Controlled induction of human pancreatic progenitors produces functional beta-like cells in vitro. EMBO Journal. 34 (13), 1759-1772 (2015).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nature Biotechnology. 32 (11), 1121-1133 (2014).
- Vertex Announces Positive Day 90 Data for the First Patient in the Phase 1_2 Clinical Trial Dosed With VX-880, a Novel Investigational Stem Cell-Derived Therapy for the Treatment of Type 1 Diabetes. Businesswire. , Available from: https://www.businesswire.com/news/home/20211018005226/en/Vertex-Announces-Positive-Day-90-Data-for-the-First-Patient-in-the-Phase-12-Clinical-Trial-Dosed-With-VX-880-a-Novel-Investigational-Stem-Cell-Derived-Therapy-for-the-Treatment-of-Type-1-Diabetes (2021).
- Gamble, A., Pepper, A. R., Bruni, A., Shapiro, A. M. J. The journey of islet cell transplantation and future development. Islets. 10 (2), 80-94 (2018).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the Non Obese Diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Hamaguchi, K., Gaskins, R. H., Leiter, E. H. NIT-1, a pancreatic β-cell line established from a transgenic NOD/Lt mouse. Diabetes. 40 (7), 842-849 (1991).
- Christianson, S. W., Shultz, L. D., Leiter, E. D. Adoptive transfer of diabetes into immunodeficient NOD-scid/scid mice: Relative contribution of CD4+ and CD8+ T-cells from diabetogenic versus prediabetic NOD.NON-Thy1a donors. Diabetes. 42 (1), 44-55 (1993).
- Cai, E. P., et al. Genome-scale in vivo CRISPR screen identifies RNLS as a target for beta cell protection in type 1 diabetes. Nature Metabolism. 2 (9), 934-945 (2020).
- Parent, A. V., et al. Selective deletion of human leukocyte antigens protects stem cell-derived islets from immune rejection. Cell Reports. 36 (7), 109538(2021).
- Brehm, M. A., et al. Lack of acute xenogeneic graft-versus-host disease, but retention of T-cell function following engraftment of human peripheral blood mononuclear cells in NSG mice deficient in MHC class I and II expression. FASEB Journal. 33 (3), 3137-3151 (2019).
- Abdulreda, M. H., et al. In vivo imaging of type 1 diabetes immunopathology using eye-transplanted islets in NOD mice. Diabetologia. 62 (7), 1237-1250 (2019).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。