É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Monitoramento Bioluminescente da Sobrevida do Enxerto em Modelo de Transferência Adotiva de Diabetes Autoimune em Camundongos
Neste Artigo
Resumo
Este protocolo descreve um método simples e minimamente invasivo para transplante e obtenção de imagens de células NIT-1 em camundongos imunodeficientes combinados não-obesos diabéticos (NOD)-graves desafiados com esplenócitos purificados de camundongos NOD espontaneamente diabéticos.
Resumo
O diabetes tipo 1 é caracterizado pela destruição autoimune das células beta produtoras de insulina do pâncreas. Um tratamento promissor para essa doença é o transplante de células-tronco derivadas de células-tronco. Modificações genéticas, no entanto, podem ser necessárias para proteger as células transplantadas da autoimunidade persistente. Modelos de camundongos diabéticos são uma ferramenta útil para a avaliação preliminar de estratégias para proteger células transplantadas do ataque autoimune. Descrito aqui é um método minimamente invasivo para transplante e imagem de enxertos celulares em um modelo de transferência adotiva de diabetes em camundongos. Neste protocolo, células da linhagem beta pancreática murina NIT-1 expressando o transgene luciferase luciferase luc2 são transplantadas subcutaneamente em camundongos imunodeficientes diabéticos não obesos (NOD)-imunodeficientes combinados graves (scid). Esses camundongos são injetados simultaneamente por via intravenosa com esplenócitos de camundongos NOD espontaneamente diabéticos para transferir autoimunidade. Os enxertos são imageados em intervalos regulares por meio de imagens bioluminescentes não invasivas para monitorar a sobrevivência celular. A sobrevivência das células mutantes é comparada à das células controle transplantadas no mesmo camundongo.
Introdução
O diabetes tipo 1 (DM1) é causado pela destruição autoimune das células beta produtoras de insulina do pâncreas. A perda de massa da célula beta resulta em deficiência de insulina e hiperglicemia. Os pacientes com DM1 dependem de múltiplas injeções diárias de insulina exógena e experimentam episódios de hiperglicemia grave e hipoglicemia ao longo de suas vidas. As complicações relacionadas a esses episódios incluem retinopatia diabética, diminuição da função renal eneuropatia1.
As injeções de insulina são um tratamento, mas não uma cura para a DM1. A substituição da massa perdida de células beta, no entanto, tem o potencial de reverter a doença, permitindo que os pacientes produzam sua própria insulina. No entanto, a oferta de ilhotas doadoras cadáveres é limitada2. As ilhotas derivadas de células-tronco (ilhotas SC) podem fornecer um suprimento virtualmente ilimitado de células beta para transplante. Vários grupos têm demonstrado que células-tronco embrionárias humanas (CTEs) e células-tronco pluripotentes induzidas (iPSCs) podem ser diferenciadas para gerar células beta-like funcionais 3,4,5. Dados promissores de ensaios clínicos iniciais indicam que essas células mantêm sua função após o transplante e podem permitir que os pacientes se tornem independentes de insulina6. No entanto, a imunossupressão crônica é necessária, aumentando sua suscetibilidade ao câncer e à infecção. Além disso, agentes imunossupressores podem ser citotóxicos para enxertos em longo prazo7. Para eliminar a necessidade de imunossupressão, as ilhotas SC podem ser geneticamente modificadas para protegê-las da autoimunidade recorrente, bem como da aloimunidade após o transplante.
A pesquisa com células-tronco é altamente exigente em custos e mão de obra. Linhagens celulares de camundongos e modelos animais são ferramentas úteis para a identificação inicial e validação experimental de estratégias para proteger células transplantadas da autoimunidade. O camundongo NOD desenvolve diabetes autoimune espontâneo com muitas semelhanças com a DM1 humana8, e a linhagem celular insulinoma NIT-1 compartilha um background genético com essa linhagem de camundongo9. O diabetes pode ser transferido adotivamente para a linhagem de camundongos NOD-scid imunodeficiente relacionada através da injeção de esplenócitos diabéticos de camundongos NOD, a fim de sincronizar temporalmente o início do diabetes em camundongos experimentais replicados10. Este modelo pode ser usado para identificar alvos genéticos de forma relativamente rápida e barata para posterior validação em ilhotas SC. Recentemente, o método foi aplicado para identificar e validar RNLS, um alvo que foi encontrado para proteger ilhotas humanas primárias da autoimunidade in vivo e ilhotas derivadas de iPSC do estresse da célula beta in vitro11. Descrito aqui é um protocolo simples para transplantar células NIT-1 geneticamente modificadas e monitorar de forma não invasiva sua sobrevivência em um modelo de transferência adotivo de diabetes autoimune em camundongos.
Protocolo
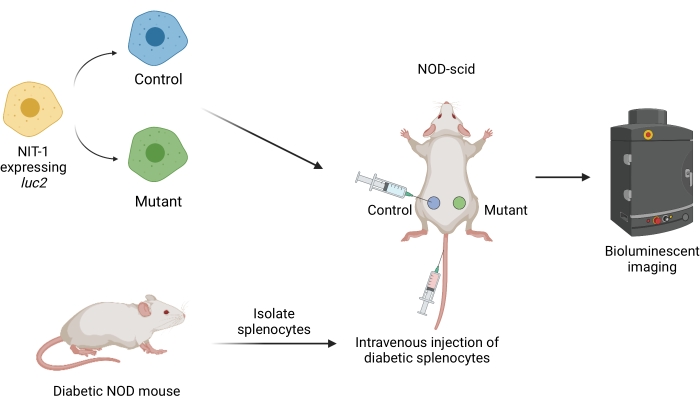
Figura 1: O fluxo de trabalho para transplante e imagem de enxertos em um modelo de transferência adotiva de diabetes em camundongos. Células NIT-1 expressando o transgene vagalume luciferase (luc2) são transplantadas subcutaneamente em camundongos NOD-scid. Os camundongos são injetados simultaneamente com esplenócitos autorreativos isolados de um camundongo NOD espontaneamente diabético. Os enxertos são imageados em intervalos regulares por imagens bioluminescentes não invasivas. Figura criada por BioRender.com. Abreviações: NOD = diabéticos não obesos; SCID = imunodeficiência combinada grave. Clique aqui para ver uma versão maior desta figura.
Todos os protocolos de cuidados e estudos com animais foram aprovados e realizados de acordo com o Comitê Institucional de Cuidados e Uso de Animais (IACUC) no Joslin Diabetes Center. Camundongos NOD e NOD-scid podem ser facilmente obtidos de fontes comerciais. Todos os camundongos deste estudo são mantidos em uma instalação monitorada sentinalmente. Consulte a Tabela de Materiais para obter detalhes relacionados a todos os materiais, animais, instrumentos e softwares usados neste protocolo.
1. Engenharia e manutenção de linhagens celulares NIT-1
- Manter linhagens de células NIT-1, que compartilham um background genético com camundongos NOD, e células de 293FT em placas tratadas com cultura de tecidos em DMEM contendo 4,5 g/L de glicose suplementada com 10% de soro fetal bovino e 1% de penicilina/estreptomicina em uma incubadora a 37 °C com 5% de CO2.
- Cultivar as células de 293FT até 70%-80% de confluência para transfecção.
- Por prato de 10 cm de células de 293FT, combinar 10 μg de pLenti-luciferase-blast (ver Arquivo Suplementar 1), que expressa o transgene da luciferase do vagalume (luc2) sob o controle do promotor constitutivamente ativo EF1α, 2 μg de cada um dos plasmídeos de embalagem pMD2.G, pMDLg/pRRE e pRSV-Rev, 4 μg do plasmídeo plasmidial da proteína do envelope pCMV-VSV-G e 60 μg de polietilenimina linear (PEI) em 1 mL de DMEM livre de soro. Ajuste as quantidades com base no número de células a serem transfectadas.
- Deixe o DNA, PEI e DMEM à temperatura ambiente (RT) por 20 minutos e, em seguida, adicione-os às células de 293FT.
- Coletar o meio contendo as partículas lentivirais 48 h após a transfecção.
- Transduzir as células NIT-1 em ~80% de confluência com 1 mL de meio contendo partículas lentivirais por 10a 6 células por 48-72 h.
- Selecionar as células que expressam luciferase com 5 μg/mL de blasticidina por 48 h.
- Modificar geneticamente as células que expressam luciferase para se adequar à questão experimental. Inclua uma linha celular de controle do tipo selvagem ou não direcionada que expresse luciferase para comparação.
NOTA: Exemplos de modificações do gene alvo incluem knockout CRISPR, CRISPRa/i, knockdown de shRNA e superexpressão.
2. Preparação de células NIT-1 para transplante
- Crescer as células que expressam luciferase até que sejam 80%-90% confluentes.
- Retire o meio de crescimento e lave as células com solução salina tamponada com fosfato (PBS, 5 mL para uma placa de 10 cm).
- Adicionar 1 mL de tripsina-EDTA a 0,05% a cada prato por 2 min.
- Neutralizar a tripsina com 5 mL de meio de cultura.
- Use uma pipeta para lavar as células do prato e transferi-las para um tubo cônico.
Observação : células de vários pratos da mesma linha celular podem ser combinadas. - Conte as células usando uma coloração como azul de tripano manualmente com um hemocitômetro ou automaticamente com um contador automático de células.
- Centrifugar a 250 × g durante 5 min no RT e retirar o sobrenadante com uma pipeta aspiradora.
- Ressuspender o pellet celular em PBS na concentração de 5 × 10 7 células/mL (10a 7 células por linhagem celular por camundongo serão transplantadas em um volume de 200 μL).
- Manter as células no gelo (por até 3 h) até o transplante.
3. Transplante de células NIT-1 em camundongos NOD-scid
- Anestesiar os camundongos receptores (camundongos NOD-scid de 8-10 semanas de idade do mesmo sexo dos camundongos usados para isolar os esplenócitos) por inalação de isoflurano em uma câmara knockdown. Entregar isoflurano a 2,5% na câmara a uma taxa de fluxo de 1,5 L/min e uma taxa de evacuação de 9 L/min.
- Lubrifique os olhos do animal com pomada oftálmica para evitar o ressecamento.
- Usando um barbeador elétrico com um protetor, remova o cabelo das costas (lado dorsal) dos ratos para expor a pele. A área de transplante raspada será de aproximadamente 1 em x 2 pol. Retorne os camundongos raspados para a câmara de knockdown até o transplante.
- Transfira os camundongos, um de cada vez, para uma superfície limpa com um cone nasal de isoflurano. Guie suavemente a cabeça do rato para dentro do cone do nariz. Utilizar fluxo de isoflurano de 0,25 L/min para manter a anestesia durante o transplante.
- Limpe a área de transplante com uma almofada de preparação de álcool isopropílico para remover os pelos soltos e desinfetar a pele.
- Certifique-se de que as células estão totalmente ressuspensas antes de carregar a seringa. Extrair um volume excessivo (>300 μL) de células para uma seringa estéril de 1 ml com uma agulha de 26 G. Remova quaisquer bolhas; em seguida, devolva o excesso de células ao tubo para que 300 μL de suspensão celular permaneça na seringa.
- Usando um par de pinças curvas seguradas na mão não dominante, levante suavemente a pele de um lado (esquerdo ou direito) das costas do mouse para permitir um acesso mais fácil ao espaço subcutâneo.
- Com a mão dominante, posicione a seringa paralelamente aos planos coronal e sagital do corpo do rato. Com a agulha apontada para a cabeça do rato, introduza a agulha na pele perto dos quartos traseiros e guie-a suavemente para o espaço subcutâneo. Certifique-se de que toda a agulha permaneça sob a pele e não perfure.
- Ajuste a pinça para segurar suavemente a pele ao redor da base da agulha. Dispense lentamente uma pequena quantidade de suspensão celular (<50 μL) e confirme que uma pequena protuberância se forma sob a pele no local da injeção. Continuar injetando a suspensão celular até que 200 μL tenham sido liberados no espaço subcutâneo.
- Segurando a pinça no lugar e mantendo a agulha paralela ao corpo do rato, retire lentamente a agulha. Depois que a agulha for removida, segure a pele fechada com pinça por alguns segundos para evitar que as células vazem para fora da ferida de punção.
- Se uma modificação genética estiver sendo avaliada, repita o transplante no lado oposto do camundongo usando uma seringa diferente para que as células mutantes e de controle sejam injetadas em cada camundongo, com uma linha celular à esquerda e outra à direita. Se apenas uma linhagem celular estiver sendo transplantada, injete as células de um lado só.
- Após o transplante, transfira cada camundongo para uma nova gaiola. Permita que cada rato se recupere totalmente da anestesia antes de adicionar ratos adicionais à gaiola.
NOTA: Os ratos são recuperados quando retomam as atividades normais e não mostram sinais de letargia ou movimento prejudicado. - Avaliar o estado de saúde dos ratos diariamente durante a duração do experimento após o transplante. Se os enxertos formarem uma grande protuberância ou os camundongos ficarem fracos e letárgicos, meça sua glicemia e forneça 10% (p/p) de água de sacarose ad libitum a todos os camundongos hipoglicêmicos. Siga todas as recomendações veterinárias e eutanasie todos os ratos com má condição corporal contínua de acordo com as diretrizes institucionais. Neste estudo, camundongos foram eutanasiados por inalação de CO2 seguido de deslocamento cervical.
4. Isolamento e purificação de esplenócitos auto-reativos
- Identifique camundongos NOD machos ou fêmeas de 10 a 16 semanas de idade com diabetes de início recente (menos de 10 dias) usando tiras de teste de glicose na urina (ou no sangue). Camundongos NOD são considerados diabéticos quando apresentam urina/glicemia ≥250 mg/dL em pelo menos 2 dias consecutivos.
NOTA: Para cada camundongo NOD-scid são necessários 10 milhões de esplenócitos; Um baço normalmente produz de 50 milhões a 150 milhões de esplenócitos. Os esplenócitos foram isolados de camundongos livres de patógenos alojados em uma instalação monitorada sentinalmente. - Eutanasiar o número adequado de camundongos diabéticos NOD.
NOTA: Neste estudo, os camundongos foram eutanasiados por inalação de CO2 seguido de deslocamento cervical para garantir a morte. - Com o mouse nas costas, faça uma incisão vertical de aproximadamente 2 centímetros de comprimento na pele com tesoura cirúrgica. Abra o lado direito do mouse do ponto de vista do pesquisador e localize o baço vermelho brilhante. Corte suavemente o baço longe do pâncreas rosa e transfira-o para uma placa de Petri estéril de 10 cm contendo 5 mL de PBS estéril. Repita a dissecação com quantos ratos forem necessários.
NOTA: Baços de vários ratos podem ser combinados em um prato. Execute as etapas a seguir usando reagentes e equipamentos estéreis em uma capa estéril. - Amasse o(s) baço(s) com a parte superior plana de um êmbolo de seringa estéril.
- Coloque um filtro de 40 μm ou 70 μm em um tubo cônico de 50 mL e lave o filtro com 5 mL de PBS para prime-lo. Transfira a(s) suspensão(ões) do(s) baço(s) para o filtro e continue a amassar suavemente o filtro. Lave o prato com 10 mL de PBS e transfira a lavagem para o coador. Continue amassando até que a cor vermelha desapareça do coador.
- Descarte o filtro e gire o tubo a 500 × g por 5 min no RT. Retire o sobrenadante com uma pipeta aspiradora.
- Ressuspender o pellet de células em 5 mL (para até três baços) de tampão de lise ACK pré-aquecido a RT e lisar as hemácias por 4 min. Aumentar o volume em 1-2 mL por baço se baços adicionais forem necessários.
- Interromper a reação com 5 mL de meio celular NIT-1 (descrito acima) por 5 mL de tampão de lise. Passe a suspensão celular através de um filtro fresco para remover aglomerações. Descarte o coador e gire a 500 × g por 5 min no TR.
- Ressuspender o pellet de células em 20 mL de PBS e contar as células. Gire a 500 × g por 5 min na RT. Ressuspenda as células em PBS estéril em uma concentração de 1 × 108 células/mL (o volume de injeção é de 0,1 mL/camundongo) em um tubo de reação de bloqueio seguro de 1,5 mL.
- Armazenar as células no gelo (por não mais de 1 h) ou manter as células em RT, e proceder à injeção da veia da cauda imediatamente.
5. Injeção intravenosa de esplenócitos diabéticos através da veia lateral da cauda
- Aqueça o corpo dos camundongos adultos receptores NOD-scid (por exemplo, usando uma lâmpada de calor por ~5-10 min) para vasodilatar as veias (isso ajuda na visualização e injeção na veia).
NOTA: Para evitar o superaquecimento dos ratos, não exceda esse tempo. Monitore sempre o estado de saúde. Se os ratos parecerem exaustos ou imóveis, desligue a lâmpada de calor imediatamente. - Aqueça a suspensão celular. Prepare uma seringa estéril (0,3-1,0 mL) com uma agulha estéril (27-30 G, 0,3 mm/0,5 pol ou menor), ou use uma seringa de insulina estéril de 0,5 mL com uma agulha de 0,3 mm (0,5 pol). Mantenha sempre a agulha estéril e utilize uma bandeja estéril se a seringa tiver de ser colocada entre as injeções.
- Ressuspenda a solução de esplenócito antes de cada injeção. Para cada rato, introduza 100 μL da suspensão de esplenócito pré-aquecido e misturado na seringa. Certifique-se de que não existem bolhas de ar na seringa ou na suspensão.
NOTA: Certifique-se de ter todos os equipamentos e suprimentos preparados (lenços umedecidos com álcool para desinfecção, uma seringa carregada com os esplenócitos a serem injetados e uma gaiola fresca para separar os camundongos injetados) antes de colocar o mouse no dispositivo de retenção. - Coloque o mouse no dispositivo de retenção. Capture a cauda com a mão não dominante e localize uma das duas veias laterais da cauda. Gire suavemente a cauda, se necessário. Limpe a cauda com um lenço de desinfecção (álcool isopropílico a 70%) para limpar a pele e aumentar a visibilidade da veia.
- Insira a agulha em um ângulo agudo na região central da cauda com a mão dominante. Com o bisel da agulha virado para cima, deslize a agulha alguns milímetros através da pele.
NOTA: Certifique-se de que a agulha está paralela à veia e colocada ligeiramente sob a pele. Esteja preparado para movimentos bruscos do rato/cauda diretamente após penetrar na parede da pele/vaso. Uma inserção bem-sucedida da agulha deve parecer uma "lâmina suave" na veia. Se outra tentativa for necessária, mova-se mais para cima da cauda em direção ao corpo. - Aplique uma pressão suave na seringa para injetar a suspensão de esplenócitos. Não permita que a agulha se mova mais para dentro ou para fora durante a injeção. As injeções bem-sucedidas são suaves sem sentir qualquer contrapressão durante a injeção e são indicadas por um fluxo sanguíneo transparente/branco imediatamente após a injeção.
- Solte suavemente a agulha para fora da veia e aplique uma leve pressão na cauda com um lenço de desinfecção até que o sangramento pare. Solte o mouse do dispositivo de retenção e transfira-o suavemente para uma gaiola recém-preparada.
NOTA: Injetar dois a três camundongos controle que não recebem um transplante de células NIT-1 com esplenócitos para confirmar o potencial dos esplenócitos auto-reativos para induzir diabetes, o que leva aproximadamente 2-4 semanas após a injeção.
6. Imagem bioluminescente in vivo de enxertos NIT-1
OBS: Imagem dos enxertos uma a duas vezes por semana. No dia do transplante, aguardar pelo menos 2 h após o transplante para permitir que os enxertos se estabeleçam e garantam uma expressão estável da luciferase. Se o tempo for um fator limitante, a medição inicial pode ser feita no Dia 1. Um esquema de imagem inicial recomendado é Dia 0 ou Dia 1 após a injeção, Dia 5, Dia 10, Dia 14, Dia 18 e Dia 25. Ajuste o cronograma, no entanto, com base no progresso da autoimunidade como julgado pela perda de sinal bioluminescente.
- Preparar uma solução de D-luciferina a 15 mg/ml em PBS de Dulbecco. Agitar em RT para dissolver e filtro estéril (0,22 μm). Conservar alíquotas de 1 ml a -20 °C e descongelar conforme necessário.
NOTA: As alíquotas podem ser congeladas. - Pelo menos 5 minutos antes da aquisição de imagens, injetar os ratos por via intraperitoneal utilizando uma seringa de 1 ml e uma agulha de 26 G com solução de D-luciferina na dose de 150 mg/kg.
NOTA: Use uma seringa e uma agulha novas para cada mouse. - Anestesiar os camundongos por inalação de isoflurano de acordo com as diretrizes institucionais. As condições recomendadas são isoflurano a 2,5% com fluxo de 1,5 L/min para a câmara knockdown e evacuação de 9 L/min.
- Lubrifique os olhos do animal com pomada oftálmica para evitar o ressecamento.
- Abra o software associado ao instrumento de imagem. Crie um novo usuário e/ou faça login. No painel de controle no canto inferior direito, selecione Initialize (Figura 2A). Para salvar automaticamente os dados de imagem, crie as pastas apropriadas no computador e selecione Aquisição | Salvar automaticamente em... (Figura 2A). Quando o instrumento terminar de inicializar, defina o tempo de exposição para 1 min.
NOTA: Os parâmetros completos de imagem são mostrados na Figura 2B. - Transfira os camundongos, um de cada vez, da câmara de knockdown para o instrumento de imagem. Coloque o rato de bruços com os membros jogados e guie suavemente a cabeça para dentro do cone do nariz. Um fluxo de isoflurano de 0,25 L/min administrado através de um cone nasal é apropriado para manter a anestesia durante os exames de imagem. Achate suavemente o mouse pressionando o centro de suas costas com as duas mãos e, em seguida, espalhe-as para fora e afastadas.
- Selecione Adquirir (Figura 2B). Registre todos os detalhes relevantes do experimento na janela pop-up (Figura 2C).
NOTA: Consulte a Figura 3A para obter imagens representativas de três camundongos NOD-scid fêmeas de 8 semanas transplantados com dois enxertos em vários momentos.
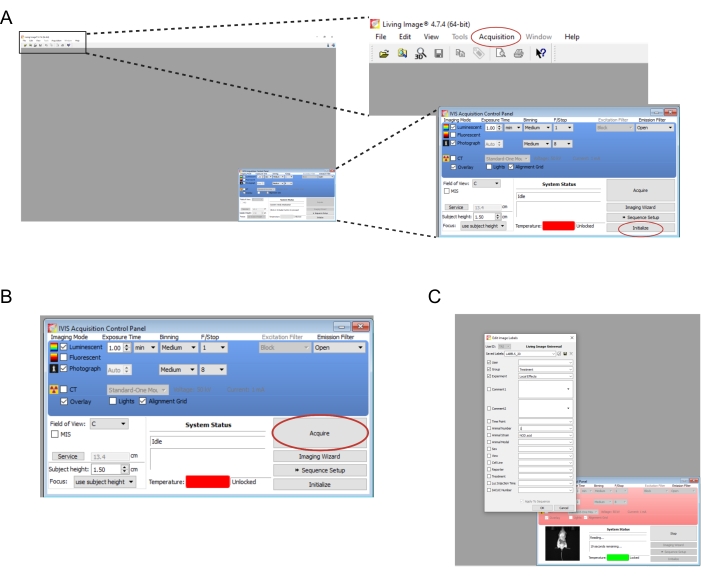
Figura 2: Capturas de tela dos comandos do software para obtenção de imagens de enxertos bioluminescentes . (A) Antes da geração de imagens, selecione Inicializar para preparar o instrumento. As imagens podem ser salvas automaticamente em uma pasta de sua escolha selecionando Aquisição | Salvar automaticamente em... (B) Visão geral dos parâmetros de imagem. Depois que o mouse tiver sido posicionado no instrumento, selecione Adquirir. (C) Captura de tela da caixa de diálogo que aparece durante a geração de imagens. Detalhes como o ponto de tempo e a tensão do mouse podem ser inseridos aqui. Clique aqui para ver uma versão maior desta figura.
7. Análise dos dados
- Quantifique o sinal bioluminescente a qualquer momento após a aquisição de imagens. Abra o software associado ao instrumento de imagem. Selecione Arquivo | Abra e selecione o arquivo ClickInfo.txt associado ao mouse a ser analisado.
- Na Paleta de ferramentas, selecione Ferramentas de ROI (Figura 3B, Etapa 1). No menu suspenso oval (Figura 3B, Passo 1, seta vermelha), selecione o número de enxertos que foram transplantados para o mouse.
- Mova as ovais de modo que contenham o sinal bioluminescente de cada enxerto e selecione Medir ROIs (Figura 3B, Passo 2).
- Registre a contagem total de cada enxerto (Figura 3B, Passo 3).
- Para cada enxerto, divida o sinal bioluminescente medido em cada ponto de tempo pelo sinal medido no primeiro ponto de tempo. Relate a sobrevida do enxerto como a proporção ou porcentagem do sinal bioluminescente residual em relação ao sinal bioluminescente inicial.
OBS: Se os enxertos expandirem após o transplante, a proporção ou porcentagem de sobrevida do enxerto será maior que 1 ou 100%, respectivamente. Todos os camundongos que recebem transplantes devem ser monitorados quanto a efeitos adversos à saúde.
Resultados
Uma visão geral do protocolo é descrita na Figura 1. A sobrevivência de duas linhagens celulares, como um mutante e um controle não-alvo, pode ser comparada, ou a sobrevivência de uma linhagem celular pode ser medida em vários grupos de camundongos, como camundongos tratados com drogas versus controles tratados com veículo. A Figura 3A mostra três camundongos NOD-scid fêmeas de 8 semanas de idade transplantados com uma linhagem celular não-alvo (esquer...
Discussão
A DM1 é uma doença devastadora para a qual não existe cura atualmente. A terapia de reposição de células beta oferece um tratamento promissor para pacientes com essa doença, mas a barreira crítica a essa estratégia é o potencial de ataque autoimune recorrente contra as células beta transplantadas. A engenharia genética de células SC-beta para reduzir sua visibilidade imunológica ou suscetibilidade é uma solução potencial para este problema. Descrito aqui é um protocolo para imagens não invasivas de cé...
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Agradecemos à Dra. Erica P. Cai e ao Dr. Yuki Ishikawa pelo desenvolvimento do método descrito neste protocolo (ver ref. 11). A pesquisa nos laboratórios de S.K. e P.Y. é apoiada por subsídios dos Institutos Nacionais de Saúde (NIH) (R01DK120445, P30DK036836), JDRF, Instituto de Células-Tronco de Harvard e Fundação Beatson. T.S. foi apoiado por uma bolsa de pós-doutorado do Instituto Nacional de Diabetes e Doenças Digestivas e Renais (NIDDK) (T32 DK007260-45), e K.B. foi apoiado em parte por uma bolsa da Fundação Mary K. Iacocca.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin, 0.53 mM EDTA | Corning | 25-052-CI | |
| 293FT | Invitrogen | R70007 | Fast-growing, highly transfectable clonal isolate derived from human embryonal kidney cells transformed with the SV40 large T antigen |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| Alcohol prep pads, 70% Isopropyl alcohol | Amazon/Ever Ready First Aid | B08NWF31DX | |
| BD 5ml Syringe Luer-Lok Tip | BD | 309646 | |
| BD PrecisionGlide Needle 26G x 5/8 (0.45 mm x 16 mm) Sub-Q | BD | 305115 | |
| BD 1 mL TB Syringe Slip Tip | BD | 309659 | |
| Blasticidin S HCl | Corning | 30-100-RB | |
| Cell strainer premium SureStrain, 70 µm, sterile | Southern Labware | C4070 | Or use similar sterile strainer with 40-70um pore size |
| CellDrop automated cell counter | Denovix | CellDrop BF-PAYG | Or use similar cell counter device |
| Corning 100 mL Penicillin-Streptomycin Solution, 100x | Corning | 30-002-CI | |
| Disposable Aspirating Pipets, Polystyrene, Sterile, Capacity=2 mL | VWR | 414004-265 | Or use similar aspirating pipette |
| D-Luciferin, Potassium Salt , Molecular Biology Grade, Powder, >99% | Goldbio | LUCK-100 | |
| DMEM, high glucose, pyruvate, no glutamine | Gibco | 10313039 | |
| Falcon BD tubes, 50 mL | Fisher Scientific | 14-959-49A | |
| Fetal Bovine Serum | Gibco | 10437-028 | |
| Forceps premium for tissues, 1 x 2 teeth 5 in, German Steel | Fisher Scientific | 13-820-074 | |
| Glucose urine test strip | California Pet Pharmacy | u-tsg100 | Or use similar test strip for glucose measurments in urine/blood |
| GlutaMAX–1 (100x) | Gibco | 35050-061 | |
| Infrared heating lamp | Cole Parmer | 03057-00 | Or use similar infrared lamp |
| Insulin syringe 0.5 mL, U-100 29 G 0.5 in | Becton Dickinson | 309306 | |
| Isoflurane, USP | Piramal Critical Care | 6679401725 | |
| IVIS Spectrum in vivo imaging system | Perkin Elmer | 124262 | Instrument for non-invasively collecting bioluminescent images of transplanted cells |
| Living Image Analysis Software | Perkin Elmer | 128113 | Software for collecting and quantifying bioluminescent signal |
| Microcentrifuge tubes seal-rite, 1.5 mL | USA Scientific | 1615-5510 | Or use similar sterile microcentrifuge tubes |
| NIT-1 | ATCC | CRL-2055 | Pancreatic beta-celll line derived from NOD/Lt mice |
| NOD.Cg-Prkdcscid/J | The Jackson Laboratory | 001303 | Mice homozygous for the severe combined immune deficiency spontaneous mutation Prkdcscid, commonly referred to as scid, are characterized by an absence of functional T cells and B cells, lymphopenia, hypogammaglobulinemia, and a normal hematopoietic microenvironment. |
| NOD/ShiLtJ | The Jackson Laboratory | 001976 | The NOD/ShiLtJ strain of mice (commonly called NOD) is a polygenic model for autoimmune type 1 diabetes |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010031 | No calcium, no magnesium, no phenol red |
| pCMV-VSV-G | Addgene | 8454 | |
| pLenti-luciferase-blast | Made in-house | Plasmid available upon request | See Supplemental File 1 |
| pMD2.G | Addgene | 12259 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polyethylenimine, Linear, MW 25,000, Transfection Grade (PEI 25K) | Fisher Scientific | NC1014320 | |
| pRSV-Rev | Addgene | 12253 | |
| Restrainer for rodents, broome-style round 1 in | Fisher Scientific | 01-288-32A | |
| Scissors, sharp-pointed | Fisher Scientific | 08-940 | Or use other scissors made of surgical-grade stainless steel |
| Tissue-culture treated culture dishes | Millipore Sigma | CLS430167-20EA | Or use other sterile cell culture-treated Petri dishes |
| Tweezers/Forceps, fine precision medium tipped | Fisher Scientific | 12-000-157 |
Referências
- Katsarou, A., et al. Type 1 diabetes mellitus. Nature Reviews Disease Primers. 3, 17016 (2017).
- Shapiro, A. M., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews Endocrinology. 13 (5), 268-277 (2017).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Russ, H. A., et al. Controlled induction of human pancreatic progenitors produces functional beta-like cells in vitro. EMBO Journal. 34 (13), 1759-1772 (2015).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nature Biotechnology. 32 (11), 1121-1133 (2014).
- Vertex Announces Positive Day 90 Data for the First Patient in the Phase 1_2 Clinical Trial Dosed With VX-880, a Novel Investigational Stem Cell-Derived Therapy for the Treatment of Type 1 Diabetes. Businesswire Available from: https://www.businesswire.com/news/home/20211018005226/en/Vertex-Announces-Positive-Day-90-Data-for-the-First-Patient-in-the-Phase-12-Clinical-Trial-Dosed-With-VX-880-a-Novel-Investigational-Stem-Cell-Derived-Therapy-for-the-Treatment-of-Type-1-Diabetes (2021)
- Gamble, A., Pepper, A. R., Bruni, A., Shapiro, A. M. J. The journey of islet cell transplantation and future development. Islets. 10 (2), 80-94 (2018).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the Non Obese Diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Hamaguchi, K., Gaskins, R. H., Leiter, E. H. NIT-1, a pancreatic β-cell line established from a transgenic NOD/Lt mouse. Diabetes. 40 (7), 842-849 (1991).
- Christianson, S. W., Shultz, L. D., Leiter, E. D. Adoptive transfer of diabetes into immunodeficient NOD-scid/scid mice: Relative contribution of CD4+ and CD8+ T-cells from diabetogenic versus prediabetic NOD.NON-Thy1a donors. Diabetes. 42 (1), 44-55 (1993).
- Cai, E. P., et al. Genome-scale in vivo CRISPR screen identifies RNLS as a target for beta cell protection in type 1 diabetes. Nature Metabolism. 2 (9), 934-945 (2020).
- Parent, A. V., et al. Selective deletion of human leukocyte antigens protects stem cell-derived islets from immune rejection. Cell Reports. 36 (7), 109538 (2021).
- Brehm, M. A., et al. Lack of acute xenogeneic graft-versus-host disease, but retention of T-cell function following engraftment of human peripheral blood mononuclear cells in NSG mice deficient in MHC class I and II expression. FASEB Journal. 33 (3), 3137-3151 (2019).
- Abdulreda, M. H., et al. In vivo imaging of type 1 diabetes immunopathology using eye-transplanted islets in NOD mice. Diabetologia. 62 (7), 1237-1250 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados