È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Monitoraggio bioluminescente della sopravvivenza del trapianto in un modello di trasferimento adottivo del diabete autoimmune nei topi
In questo articolo
Riepilogo
Questo protocollo descrive un metodo semplice e minimamente invasivo per il trapianto e l'imaging delle cellule NIT-1 in topi immunodeficienti diabetici non obesi (NOD) gravi sfidati con splenociti purificati da topi NOD spontaneamente diabetici.
Abstract
Il diabete di tipo 1 è caratterizzato dalla distruzione autoimmune delle cellule beta produttrici di insulina del pancreas. Un trattamento promettente per questa malattia è il trapianto di cellule beta derivate da cellule staminali. Le modificazioni genetiche, tuttavia, possono essere necessarie per proteggere le cellule trapiantate dall'autoimmunità persistente. I modelli murini diabetici sono uno strumento utile per la valutazione preliminare delle strategie per proteggere le cellule trapiantate dall'attacco autoimmune. Descritto qui è un metodo minimamente invasivo per il trapianto e l'imaging di innesti cellulari in un modello di trasferimento adottivo del diabete nei topi. In questo protocollo, le cellule della linea cellulare beta pancreatica murina NIT-1 che esprime il transgene luciferasi luc2 della lucciola vengono trapiantate per via sottocutanea in topi immunodeficienti diabetici non obesi (NOD)-gravi immunodeficienti combinati (SCID). Questi topi vengono iniettati simultaneamente per via endovenosa con splenociti da topi NOD spontaneamente diabetici per trasferire l'autoimmunità. Gli innesti vengono ripresi a intervalli regolari tramite imaging bioluminescente non invasivo per monitorare la sopravvivenza cellulare. La sopravvivenza delle cellule mutanti è paragonata a quella delle cellule di controllo trapiantate nello stesso topo.
Introduzione
Il diabete di tipo 1 (T1D) è causato dalla distruzione autoimmune delle cellule beta produttrici di insulina del pancreas. La perdita di massa delle cellule beta provoca carenza di insulina e iperglicemia. I pazienti T1D si affidano a più iniezioni giornaliere di insulina esogena e sperimentano episodi di grave iperglicemia e ipoglicemia per tutta la vita. Le complicanze correlate a questi episodi includono retinopatia diabetica, diminuzione della funzionalità renale e neuropatia1.
Le iniezioni di insulina sono un trattamento ma non una cura per il T1D. La sostituzione della massa delle cellule beta persa, tuttavia, ha il potenziale per invertire la malattia consentendo ai pazienti di produrre la propria insulina. Tuttavia, la fornitura di isole donatrici cadaveriche è limitata2. Le isole derivate dalle cellule staminali (isole SC) possono fornire una fornitura virtualmente illimitata di cellule beta per il trapianto. Diversi gruppi hanno dimostrato che le cellule staminali embrionali umane (ESC) e le cellule staminali pluripotenti indotte (iPSC) possono essere differenziate per generare cellule beta-simili funzionali 3,4,5. I promettenti dati dei primi studi clinici indicano che queste cellule mantengono la loro funzione dopo il trapianto e possono consentire ai pazienti di diventare insulino-indipendenti6. L'immunosoppressione cronica è necessaria, tuttavia, aumentando così la loro suscettibilità al cancro e alle infezioni. Inoltre, gli agenti immunosoppressori possono essere citotossici per gli innesti a lungo termine7. Per eliminare la necessità di immunosoppressione, le isole SC possono essere geneticamente modificate per proteggerle dall'autoimmunità ricorrente e dall'alloimmunità dopo il trapianto.
La ricerca sulle cellule staminali è molto impegnativa in termini di costi e manodopera. Le linee cellulari di topo e i modelli animali sono strumenti utili per l'identificazione iniziale e la validazione sperimentale di strategie per proteggere le cellule trapiantate dall'autoimmunità. Il topo NOD sviluppa diabete autoimmune spontaneo con molte somiglianze con ilT1D 8 umano e la linea cellulare di insulinoma NIT-1 condivide un background genetico con questo ceppo di topo9. Il diabete può essere trasferito in modo adottivo al ceppo murino NOD-scid immunodeficiente correlato tramite l'iniezione di splenociti diabetici da topi NOD al fine di sincronizzare temporalmente l'insorgenza del diabete in topi sperimentali replicati10. Questo modello può essere utilizzato per identificare bersagli genetici in modo relativamente rapido ed economico per un'ulteriore convalida nelle isole SC. Recentemente, il metodo è stato applicato per identificare e convalidare RNLS, un bersaglio che è stato trovato per proteggere le isole umane primarie dall'autoimmunità in vivo e le isole derivate da iPSC dallo stress delle cellule beta in vitro11. Descritto qui è un semplice protocollo per trapiantare cellule NIT-1 geneticamente modificate e monitorare in modo non invasivo la loro sopravvivenza in un modello di trasferimento adottivo del diabete autoimmune nei topi.
Access restricted. Please log in or start a trial to view this content.
Protocollo
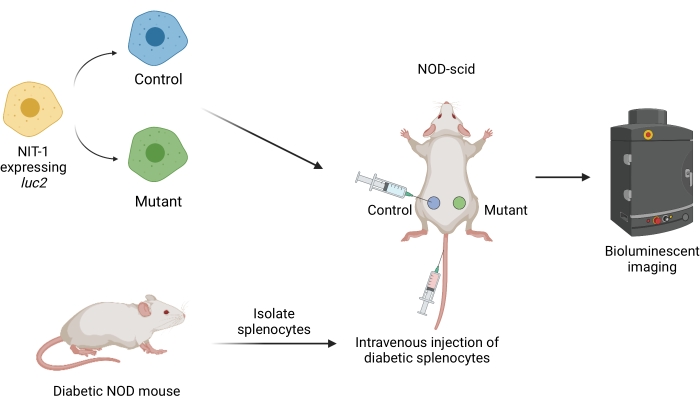
Figura 1: Il flusso di lavoro per il trapianto e l'imaging degli innesti in un modello di trasferimento adottivo del diabete nei topi. Le cellule NIT-1 che esprimono il transgene luciferasi della lucciola (luc2) vengono trapiantate per via sottocutanea in topi NOD-scid. I topi vengono iniettati simultaneamente con splenociti autoreattivi isolati da un topo NOD spontaneamente diabetico. Gli innesti vengono ripresi a intervalli regolari mediante imaging bioluminescente non invasivo. Figura creata da BioRender.com. Abbreviazioni: NOD = diabetico non obeso; SCID = immunodeficiente combinato grave. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Tutti i protocolli di cura e studio degli animali sono stati approvati ed eseguiti in conformità con l'Institutional Animal Care and Use Committee (IACUC) presso il Joslin Diabetes Center. I topi NOD e NOD-scid possono essere facilmente ottenuti da fonti commerciali. Tutti i topi in questo studio sono mantenuti in una struttura monitorata sentinella. Vedere la tabella dei materiali per i dettagli relativi a tutti i materiali, animali, strumenti e software utilizzati in questo protocollo.
1. Ingegneria e manutenzione di linee cellulari NIT-1
- Mantenere linee cellulari NIT-1, che condividono un background genetico con topi NOD, e cellule 293FT in piatti trattati con colture tissutali in DMEM contenenti 4,5 g / L di glucosio integrato con il 10% di siero bovino fetale e l'1% di penicillina / streptomicina in un incubatore a 37 ° C con 5% di CO2.
- Far crescere le cellule 293FT al 70% -80% di confluenza per la trasfezione.
- Per ogni piatto di 10 cm di cellule 293FT, combinare 10 μg di pLenti-luciferasi-blasto (vedere il file supplementare 1), che esprime il transgene della luciferasi della lucciola (luc2) sotto il controllo del promotore EF1α costitutivamente attivo, 2 μg ciascuno dei plasmidi di imballaggio pMD2.G, pMDLg/pRRE e pRSV-Rev, 4 μg del plasmide della proteina dell'involucro pCMV-VSV-G e 60 μg di polietilenimina lineare (PEI) in 1 mL di DMEM privo di siero. Regolare le quantità in base al numero di celle da trasfettare.
- Lasciare il DNA, PEI e DMEM a temperatura ambiente (RT) per 20 minuti, quindi aggiungerli alle cellule 293FT.
- Raccogliere il mezzo contenente le particelle lentivirali 48 ore dopo la trasfezione.
- Trasduci le cellule NIT-1 a ~80% di confluenza con 1 mL di mezzo contenente particelle lentivirali per 106 cellule per 48-72 ore.
- Selezionare le cellule che esprimono luciferasi con 5 μg/mL di blasticidina per 48 ore.
- Modificare ulteriormente geneticamente le cellule che esprimono la luciferasi per adattarle alla domanda sperimentale. Includere una linea cellulare di controllo wild-type o non mirata che esprime luciferasi per il confronto.
NOTA: Esempi di modificazioni del gene bersaglio includono CRISPR knockout, CRISPRa / i, knockdown di shRNA e sovraespressione.
2. Preparazione delle cellule NIT-1 per il trapianto
- Far crescere le cellule che esprimono luciferasi fino a quando non sono confluenti all'80% -90%.
- Rimuovere il terreno di coltura e lavare le cellule con soluzione salina tamponata con fosfato (PBS, 5 ml per un piatto da 10 cm).
- Aggiungere 1 mL di tripsina-EDTA allo 0,05% a ciascun piatto per 2 minuti.
- Neutralizzare la tripsina con 5 ml di terreno di coltura.
- Utilizzare una pipetta per lavare le celle dal piatto e trasferirle in un tubo conico.
NOTA: Le celle di più piatti della stessa linea cellulare possono essere combinate. - Contare le cellule usando una macchia come il blu di tripano manualmente con un emocitometro o automaticamente con un contatore automatico delle cellule.
- Centrifugare a 250 × g per 5 minuti a RT e rimuovere il surnatante con una pipetta aspirante.
- Risospendere il pellet cellulare in PBS ad una concentrazione di 5 × 10 7 cellule/ml (107 cellule per linea cellulare per topo saranno trapiantate in un volume di 200 μL).
- Mantenere le cellule sul ghiaccio (fino a 3 ore) fino al trapianto.
3. Trapianto di cellule NIT-1 in topi NOD-scid
- Anestetizzare i topi riceventi (topi NOD-scid di 8-10 settimane dello stesso sesso dei topi usati per isolare gli splenociti) mediante inalazione di isoflurano in una camera di abbattimento. Immettere isoflurano al 2,5% nella camera con una portata di 1,5 L/min e una velocità di evacuazione di 9 L/min.
- Lubrificare gli occhi dell'animale con unguento oftalmico per prevenire l'essiccazione.
- Utilizzando un rasoio elettrico con una protezione, rimuovere i peli dalla parte posteriore (lato dorsale) dei topi per esporre la pelle. L'area di trapianto rasata sarà di circa 1 in x 2 in. Riportare i topi rasati nella camera di abbattimento fino al trapianto.
- Trasferire i topi uno alla volta su una superficie pulita con un cono naso di isoflurano. Guida delicatamente la testa del topo nel cono del naso. Utilizzare una velocità di flusso di isoflurano di 0,25 L / min per mantenere l'anestesia durante il trapianto.
- Pulire l'area del trapianto con un tampone di preparazione all'alcool isopropilico per rimuovere i peli sciolti e disinfettare la pelle.
- Assicurarsi che le cellule siano completamente risospese prima di caricare la siringa. Aspirare un volume in eccesso (>300 μL) di cellule in una siringa sterile da 1 mL con un ago da 26 G. Rimuovere eventuali bolle; quindi, riportare le cellule in eccesso nel tubo in modo che 300 μL di sospensione cellulare rimangano nella siringa.
- Utilizzando un paio di pinze curve tenute nella mano non dominante, sollevare delicatamente la pelle su un lato (sinistro o destro) della schiena del topo per consentire un accesso più facile allo spazio sottocutaneo.
- Usando la mano dominante, posizionare la siringa parallelamente ai piani coronale e sagittale del corpo del topo. Con l'ago puntato verso la testa del topo, inserire l'ago nella pelle vicino ai quarti posteriori e guidarlo delicatamente nello spazio sottocutaneo. Assicurarsi che l'intero ago rimanga sotto la pelle e non penetri.
- Regolare la pinza per tenere delicatamente la pelle intorno alla base dell'ago. Erogare lentamente una piccola quantità di sospensione cellulare (<50 μL) e confermare che si forma un piccolo rigonfiamento sotto la pelle nel sito dell'iniezione. Continuare a iniettare la sospensione cellulare fino a quando 200 μL sono stati erogati nello spazio sottocutaneo.
- Tenendo la pinza in posizione e mantenendo l'ago parallelo al corpo del topo, ritirare lentamente l'ago. Dopo che l'ago è stato rimosso, tenere la pelle chiusa con una pinza per alcuni secondi per evitare che le cellule fuoriescano dalla ferita da puntura.
- Se si sta valutando una modificazione genetica, ripetere il trapianto sul lato opposto del topo usando una siringa diversa in modo che sia le cellule mutanti che quelle di controllo vengano iniettate in ciascun topo, con una linea cellulare a sinistra e l'altra a destra. Se viene trapiantata una sola linea cellulare, iniettare le cellule su un solo lato.
- Dopo il trapianto, trasferire ogni topo in una gabbia fresca. Consentire a ciascun topo di riprendersi completamente dall'anestesia prima di aggiungere altri topi alla gabbia.
NOTA: I topi vengono recuperati quando riprendono le normali attività e non mostrano segni di letargia o movimento alterato. - Valutare quotidianamente lo stato di salute dei topi per la durata dell'esperimento dopo il trapianto. Se gli innesti formano un grande rigonfiamento o i topi diventano deboli e letargici, misurare la glicemia e fornire il 10% (p / p) di acqua di saccarosio ad libitum a tutti i topi ipoglicemici. Seguire tutte le raccomandazioni veterinarie e l'eutanasia di tutti i topi con condizioni corporee persistenti secondo le linee guida istituzionali. In questo studio, i topi sono stati eutanizzati per inalazione di CO2 seguita da lussazione cervicale.
4. Isolamento e purificazione degli splenociti autoreattivi
- Identificare topi NOD maschi o femmine di 10-16 settimane con diabete ad esordio recente (meno di 10 giorni) utilizzando strisce reattive per la glicemia urinaria (o sangue). I topi NOD sono considerati diabetici quando hanno urina / glucosio nel sangue ≥ 250 mg / dL per almeno 2 giorni consecutivi.
NOTA: Per ogni topo NOD-scid sono necessari 10 milioni di splenociti; Una milza produce tipicamente da 50 milioni a 150 milioni di splenociti. Gli splenociti sono stati isolati da topi privi di agenti patogeni ospitati in una struttura monitorata sentinella. - Eutanasia il numero appropriato di topi NOD diabetici.
NOTA: In questo studio, i topi sono stati eutanizzati per inalazione di CO2 seguita da dislocazione cervicale per garantire la morte. - Con il mouse sul dorso, praticare un'incisione verticale di circa 2 pollici di lunghezza nella pelle con le forbici chirurgiche. Apri il lato destro del mouse dal punto di vista del ricercatore e individua la milza rosso vivo. Tagliare delicatamente la milza dal pancreas rosa e trasferirla in una capsula di Petri sterile da 10 cm contenente 5 ml di PBS sterile. Ripetere la dissezione con tutti i topi necessari.
NOTA: Le milze di più topi possono essere combinate in un unico piatto. Eseguire i seguenti passaggi utilizzando reagenti e attrezzature sterili in una cappa sterile. - Schiacciare la(e) milza(e) con la parte superiore piatta di uno stantuffo sterile della siringa.
- Posizionare un filtro da 40 μm o 70 μm in un tubo conico da 50 mL e lavare il filtro con 5 mL di PBS per innescarlo. Trasferire la sospensione della milza nel filtro e continuare a schiacciare delicatamente attraverso il colino. Lavare il piatto con 10 mL di PBS e trasferire il lavaggio sul colino. Continuare a schiacciare fino a quando il colore rosso è scomparso dal colino.
- Eliminare il filtro e ruotare il tubo a 500 × g per 5 minuti a RT. Rimuovere il surnatante con una pipetta aspirante.
- Risospendere il pellet cellulare in 5 ml (per un massimo di tre milze) di tampone di lisi ACK preriscaldato a RT e lisare i globuli rossi per 4 minuti. Aumentare il volume di 1-2 ml per milza se sono necessarie milze aggiuntive.
- Interrompere la reazione con 5 mL di terreno cellulare NIT-1 (descritto sopra) per 5 mL di tampone di lisi. Passare la sospensione cellulare attraverso un colino fresco per rimuovere i grumi. Scartare il colino e ruotare a 500 × g per 5 minuti a RT.
- Risospendere il pellet cellulare in 20 ml di PBS e contare le cellule. Centrifugare a 500 × g per 5 minuti a RT. Risospendere le cellule in PBS sterile ad una concentrazione di 1 × 108 cellule/ml (il volume di iniezione è 0,1 ml/topo) in una provetta di reazione safe-lock da 1,5 ml.
- Conservare le cellule sul ghiaccio (per non più di 1 ora) o mantenere le cellule a RT e procedere immediatamente all'iniezione della vena caudale.
5. Iniezione endovenosa di splenociti diabetici attraverso la vena laterale della coda
- Riscaldare il corpo dei topi NOD-scid riceventi adulti (ad esempio, utilizzando una lampada di calore per ~ 5-10 minuti) per vasodilatare le vene (questo aiuta per la visualizzazione e l'iniezione nella vena).
NOTA: Per evitare il surriscaldamento dei topi, non superare questo tempo. Monitorare sempre lo stato di salute. Se i topi appaiono esausti o immobili, spegnere immediatamente la lampada di calore. - Riscaldare la sospensione cellulare. Preparare una siringa sterile (0,3-1,0 ml) con un ago sterile (27-30 G, 0,3 mm/0,5 pollici o inferiore) o utilizzare una siringa da insulina sterile da 0,5 ml con un ago da 0,3 mm (0,5 pollici). Tenere sempre l'ago sterile e utilizzare un vassoio sterile se la siringa deve essere posata tra le iniezioni.
- Risospendere la soluzione di splenociti prima di ogni iniezione. Per ciascun topo, aspirare 100 μL della sospensione di splenociti preriscaldata e mista nella siringa. Assicurarsi che non siano presenti bolle d'aria nella siringa o nella sospensione.
NOTA: Assicurarsi di avere tutte le attrezzature e le forniture preparate (salviette imbevute di alcool per la disinfezione, una siringa caricata con gli splenociti da iniettare e una gabbia fresca per separare i topi iniettati) prima di posizionare il mouse nel dispositivo di ritenuta. - Posizionare il mouse nel dispositivo di ritenuta. Cattura la coda con la mano non dominante e individua una delle due vene laterali della coda. Ruotare delicatamente la coda se necessario. Pulire la coda con una salvietta disinfettante (alcool isopropilico al 70%) per pulire la pelle e aumentare la visibilità della vena.
- Inserire l'ago ad angolo acuto nella regione centrale della coda con la mano dominante. Con la smussatura dell'ago rivolta verso l'alto, far scorrere l'ago di alcuni millimetri attraverso la pelle.
NOTA: Assicurarsi che l'ago sia parallelo alla vena e posizionato leggermente sotto la pelle. Essere preparati a movimenti improvvisi del topo / coda direttamente dopo aver penetrato la pelle / parete del vaso. Un inserimento riuscito dell'ago dovrebbe sembrare una "scivolata liscia" nella vena. Se è necessario un altro tentativo, spostati più in alto sulla coda verso il corpo. - Applicare una leggera pressione sulla siringa per iniettare la sospensione di splenociti. Non lasciare che l'ago si muova ulteriormente dentro o fuori durante l'iniezione. Le iniezioni riuscite sono lisce senza sentire alcuna contropressione durante l'iniezione e sono indicate da un flusso sanguigno trasparente/bianco immediatamente dopo l'iniezione.
- Rilasciare delicatamente l'ago dalla vena e applicare una leggera pressione sulla coda con una salvietta disinfettante fino a quando l'emorragia si ferma. Rilasciare il mouse dal dispositivo di ritenuta e trasferirlo delicatamente in una gabbia appena preparata.
NOTA: Iniettare da due a tre topi di controllo che non ricevono un trapianto di cellule NIT-1 con splenociti per confermare il potenziale degli splenociti autoreattivi di indurre il diabete, che richiede circa 2-4 settimane dopo l'iniezione.
6. Imaging bioluminescente in vivo di innesti NIT-1
NOTA: Immagine degli innesti una o due volte alla settimana. Il giorno del trapianto, attendere almeno 2 ore dopo il trapianto per consentire agli innesti di depositarsi e garantire un'espressione stabile della luciferasi. Se il tempo è un fattore limitante, la misurazione iniziale può essere effettuata il giorno 1. Un programma di imaging iniziale raccomandato è il giorno 0 o il giorno 1 dopo l'iniezione, il giorno 5, il giorno 10, il giorno 14, il giorno 18 e il giorno 25. Regolare il programma, tuttavia, in base al progresso dell'autoimmunità come giudicato dalla perdita di segnale bioluminescente.
- Preparare una soluzione di D-luciferina 15 mg/mL nel PBS di Dulbecco. Agitare a RT per dissolvere e filtrare sterile (0,22 μm). Conservare 1 mL di aliquote a -20 °C e scongelare secondo necessità.
NOTA: Le aliquote possono essere ricongelate. - Almeno 5 minuti prima dell'imaging, iniettare i topi per via intraperitoneale usando una siringa da 1 mL e un ago da 26 G con soluzione di D-luciferina alla dose di 150 mg/kg.
NOTA: Utilizzare una siringa e un ago nuovi per ogni topo. - Anestetizzare i topi mediante inalazione di isoflurano secondo le linee guida istituzionali. Le condizioni raccomandate sono isoflurano al 2,5% con una portata di 1,5 L/min nella camera di abbattimento e una velocità di evacuazione di 9 L/min.
- Lubrificare gli occhi dell'animale con unguento oftalmico per prevenire l'essiccazione.
- Aprire il software associato allo strumento di imaging. Crea un nuovo utente e/o accedi. Nel pannello di controllo in basso a destra, selezionare Inizializza (Figura 2A). Per salvare automaticamente i dati di imaging, creare le cartelle appropriate nel computer e quindi selezionare Acquisizione | Salvataggio automatico in... (Figura 2A). Una volta terminata l'inizializzazione dello strumento, impostare il tempo di esposizione su 1 min.
NOTA: i parametri di imaging completi sono illustrati nella Figura 2B. - Trasferire i topi uno alla volta dalla camera di abbattimento allo strumento di imaging. Metti il topo sullo stomaco con gli arti divaricati e guida delicatamente la testa nel cono del naso. Una portata di isoflurano di 0,25 L/min erogata attraverso un cono nasale è appropriata per mantenere l'anestesia durante l'imaging. Appiattire delicatamente il mouse premendo il centro della schiena con entrambe le mani e quindi allargando le mani verso l'esterno e divaricate.
- Selezionare Acquisisci (Figura 2B). Registrare tutti i dettagli rilevanti dell'esperimento nella finestra popup (Figura 2C).
NOTA: Vedere la Figura 3A per le immagini rappresentative di tre topi femmina NOD-scid di 8 settimane trapiantati con due innesti in vari punti temporali.
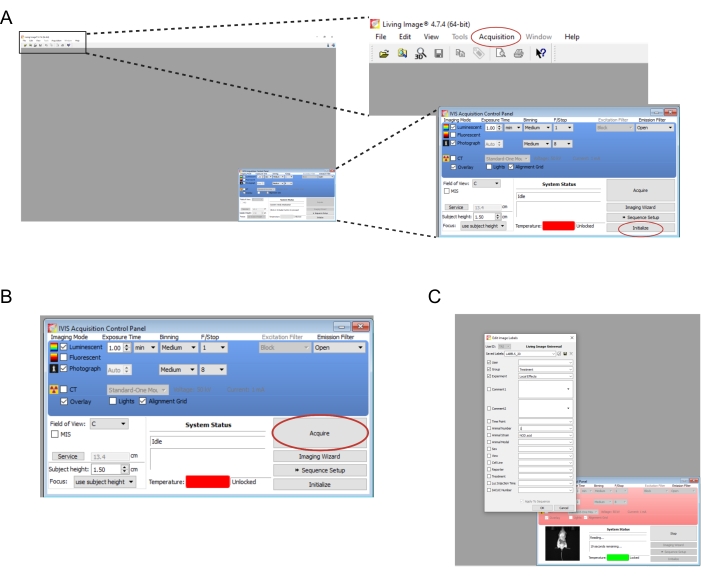
Figura 2: Schermate dei comandi software per l'imaging di innesti bioluminescenti . (A) Prima dell'imaging, selezionare Inizializza per preparare lo strumento. Le immagini possono essere salvate automaticamente in una cartella a scelta selezionando Acquisizione | Salvataggio automatico in... (B) Panoramica dei parametri di imaging. Una volta posizionato il mouse nello strumento, selezionare Acquisisci. (C) Screenshot della finestra di dialogo che viene visualizzata durante l'imaging. Qui è possibile inserire dettagli come il punto temporale e lo sforzo del mouse. Fare clic qui per visualizzare una versione ingrandita di questa figura.
7. Analisi dei dati
- Quantificare il segnale bioluminescente in qualsiasi momento dopo l'imaging. Aprire il software associato allo strumento di imaging. Seleziona File | Aprire e selezionare il file ClickInfo.txt associato al mouse da analizzare.
- Nella tavolozza degli strumenti, selezionare Strumenti ROI (Figura 3B, Passaggio 1). Dal menu a discesa ovale (Figura 3B, Passo 1, freccia rossa), selezionare il numero di innesti che sono stati trapiantati nel mouse.
- Spostare gli ovali in modo che contengano il segnale bioluminescente di ciascun innesto e selezionare Misura ROI (Figura 3B, Passo 2).
- Registrare il conteggio totale per ciascun innesto (Figura 3B, Passo 3).
- Per ogni innesto, dividere il segnale bioluminescente misurato in ogni punto temporale per il segnale misurato al primo punto temporale. Riportare la sopravvivenza del trapianto come la proporzione o la percentuale di segnale bioluminescente residuo rispetto al segnale bioluminescente iniziale.
NOTA: Se gli innesti si espandono dopo il trapianto, il rapporto o la percentuale di sopravvivenza del trapianto sarà superiore all'1 o al 100%, rispettivamente. Tutti i topi che ricevono trapianti devono essere monitorati per gli effetti avversi sulla salute.
Access restricted. Please log in or start a trial to view this content.
Risultati
Una panoramica del protocollo è descritta nella Figura 1. La sopravvivenza di due linee cellulari, come un mutante e un controllo non mirato, può essere confrontata, o la sopravvivenza di una linea cellulare può essere misurata in più gruppi di topi, come topi trattati con farmaci rispetto a controlli trattati con veicolo. La Figura 3A mostra tre topi NOD-scid femmina di 8 settimane trapiantati con un controllo non mirato (a sinistra) e una linea cellulare m...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il T1D è una malattia devastante per la quale attualmente non esiste una cura. La terapia sostitutiva delle cellule beta offre un trattamento promettente per i pazienti con questa malattia, ma la barriera critica a questa strategia è il potenziale di attacchi autoimmuni ricorrenti contro le cellule beta trapiantate. L'ingegneria genetica delle cellule SC-beta per ridurre la loro visibilità o suscettibilità immunitaria è una potenziale soluzione a questo problema. Descritto qui è un protocollo per l'imaging non inva...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Ringraziamo la Dott.ssa Erica P. Cai e la Dott.ssa Yuki Ishikawa per aver sviluppato il metodo descritto in questo protocollo (vedi rif. 11). La ricerca nei laboratori di SK e P.Y. è supportata da sovvenzioni del National Institutes of Health (NIH) (R01DK120445, P30DK036836), JDRF, Harvard Stem Cell Institute e Beatson Foundation. T.S. è stato sostenuto da una borsa di studio post-dottorato del National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK) (T32 DK007260-45), e K.B. è stato supportato in parte da una borsa di studio della Mary K. Iacocca Foundation.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin, 0.53 mM EDTA | Corning | 25-052-CI | |
| 293FT | Invitrogen | R70007 | Fast-growing, highly transfectable clonal isolate derived from human embryonal kidney cells transformed with the SV40 large T antigen |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| Alcohol prep pads, 70% Isopropyl alcohol | Amazon/Ever Ready First Aid | B08NWF31DX | |
| BD 5ml Syringe Luer-Lok Tip | BD | 309646 | |
| BD PrecisionGlide Needle 26G x 5/8 (0.45 mm x 16 mm) Sub-Q | BD | 305115 | |
| BD 1 mL TB Syringe Slip Tip | BD | 309659 | |
| Blasticidin S HCl | Corning | 30-100-RB | |
| Cell strainer premium SureStrain, 70 µm, sterile | Southern Labware | C4070 | Or use similar sterile strainer with 40-70um pore size |
| CellDrop automated cell counter | Denovix | CellDrop BF-PAYG | Or use similar cell counter device |
| Corning 100 mL Penicillin-Streptomycin Solution, 100x | Corning | 30-002-CI | |
| Disposable Aspirating Pipets, Polystyrene, Sterile, Capacity=2 mL | VWR | 414004-265 | Or use similar aspirating pipette |
| D-Luciferin, Potassium Salt , Molecular Biology Grade, Powder, >99% | Goldbio | LUCK-100 | |
| DMEM, high glucose, pyruvate, no glutamine | Gibco | 10313039 | |
| Falcon BD tubes, 50 mL | Fisher Scientific | 14-959-49A | |
| Fetal Bovine Serum | Gibco | 10437-028 | |
| Forceps premium for tissues, 1 x 2 teeth 5 in, German Steel | Fisher Scientific | 13-820-074 | |
| Glucose urine test strip | California Pet Pharmacy | u-tsg100 | Or use similar test strip for glucose measurments in urine/blood |
| GlutaMAX–1 (100x) | Gibco | 35050-061 | |
| Infrared heating lamp | Cole Parmer | 03057-00 | Or use similar infrared lamp |
| Insulin syringe 0.5 mL, U-100 29 G 0.5 in | Becton Dickinson | 309306 | |
| Isoflurane, USP | Piramal Critical Care | 6679401725 | |
| IVIS Spectrum in vivo imaging system | Perkin Elmer | 124262 | Instrument for non-invasively collecting bioluminescent images of transplanted cells |
| Living Image Analysis Software | Perkin Elmer | 128113 | Software for collecting and quantifying bioluminescent signal |
| Microcentrifuge tubes seal-rite, 1.5 mL | USA Scientific | 1615-5510 | Or use similar sterile microcentrifuge tubes |
| NIT-1 | ATCC | CRL-2055 | Pancreatic beta-celll line derived from NOD/Lt mice |
| NOD.Cg-Prkdcscid/J | The Jackson Laboratory | 001303 | Mice homozygous for the severe combined immune deficiency spontaneous mutation Prkdcscid, commonly referred to as scid, are characterized by an absence of functional T cells and B cells, lymphopenia, hypogammaglobulinemia, and a normal hematopoietic microenvironment. |
| NOD/ShiLtJ | The Jackson Laboratory | 001976 | The NOD/ShiLtJ strain of mice (commonly called NOD) is a polygenic model for autoimmune type 1 diabetes |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010031 | No calcium, no magnesium, no phenol red |
| pCMV-VSV-G | Addgene | 8454 | |
| pLenti-luciferase-blast | Made in-house | Plasmid available upon request | See Supplemental File 1 |
| pMD2.G | Addgene | 12259 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polyethylenimine, Linear, MW 25,000, Transfection Grade (PEI 25K) | Fisher Scientific | NC1014320 | |
| pRSV-Rev | Addgene | 12253 | |
| Restrainer for rodents, broome-style round 1 in | Fisher Scientific | 01-288-32A | |
| Scissors, sharp-pointed | Fisher Scientific | 08-940 | Or use other scissors made of surgical-grade stainless steel |
| Tissue-culture treated culture dishes | Millipore Sigma | CLS430167-20EA | Or use other sterile cell culture-treated Petri dishes |
| Tweezers/Forceps, fine precision medium tipped | Fisher Scientific | 12-000-157 |
Riferimenti
- Katsarou, A., et al. Type 1 diabetes mellitus. Nature Reviews Disease Primers. 3, 17016(2017).
- Shapiro, A. M., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews Endocrinology. 13 (5), 268-277 (2017).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Russ, H. A., et al. Controlled induction of human pancreatic progenitors produces functional beta-like cells in vitro. EMBO Journal. 34 (13), 1759-1772 (2015).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nature Biotechnology. 32 (11), 1121-1133 (2014).
- Vertex Announces Positive Day 90 Data for the First Patient in the Phase 1_2 Clinical Trial Dosed With VX-880, a Novel Investigational Stem Cell-Derived Therapy for the Treatment of Type 1 Diabetes. Businesswire. , Available from: https://www.businesswire.com/news/home/20211018005226/en/Vertex-Announces-Positive-Day-90-Data-for-the-First-Patient-in-the-Phase-12-Clinical-Trial-Dosed-With-VX-880-a-Novel-Investigational-Stem-Cell-Derived-Therapy-for-the-Treatment-of-Type-1-Diabetes (2021).
- Gamble, A., Pepper, A. R., Bruni, A., Shapiro, A. M. J. The journey of islet cell transplantation and future development. Islets. 10 (2), 80-94 (2018).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the Non Obese Diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Hamaguchi, K., Gaskins, R. H., Leiter, E. H. NIT-1, a pancreatic β-cell line established from a transgenic NOD/Lt mouse. Diabetes. 40 (7), 842-849 (1991).
- Christianson, S. W., Shultz, L. D., Leiter, E. D. Adoptive transfer of diabetes into immunodeficient NOD-scid/scid mice: Relative contribution of CD4+ and CD8+ T-cells from diabetogenic versus prediabetic NOD.NON-Thy1a donors. Diabetes. 42 (1), 44-55 (1993).
- Cai, E. P., et al. Genome-scale in vivo CRISPR screen identifies RNLS as a target for beta cell protection in type 1 diabetes. Nature Metabolism. 2 (9), 934-945 (2020).
- Parent, A. V., et al. Selective deletion of human leukocyte antigens protects stem cell-derived islets from immune rejection. Cell Reports. 36 (7), 109538(2021).
- Brehm, M. A., et al. Lack of acute xenogeneic graft-versus-host disease, but retention of T-cell function following engraftment of human peripheral blood mononuclear cells in NSG mice deficient in MHC class I and II expression. FASEB Journal. 33 (3), 3137-3151 (2019).
- Abdulreda, M. H., et al. In vivo imaging of type 1 diabetes immunopathology using eye-transplanted islets in NOD mice. Diabetologia. 62 (7), 1237-1250 (2019).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon