Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Biolumineszentes Monitoring des Transplantatüberlebens in einem adoptiven Transfermodell des Autoimmundiabetes bei Mäusen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine unkomplizierte und minimalinvasive Methode zur Transplantation und Bildgebung von NIT-1-Zellen in nicht-adipösen diabetischen (NOD)-schweren kombinierten immundefizienten Mäusen, die mit Splenozyten konfrontiert wurden, die von spontan diabetischen NOD-Mäusen gereinigt wurden.
Zusammenfassung
Typ-1-Diabetes ist gekennzeichnet durch die autoimmune Zerstörung der insulinproduzierenden Betazellen der Bauchspeicheldrüse. Eine vielversprechende Behandlung für diese Krankheit ist die Transplantation von Betazellen aus Stammzellen. Genetische Veränderungen können jedoch notwendig sein, um die transplantierten Zellen vor anhaltender Autoimmunität zu schützen. Diabetische Mausmodelle sind ein nützliches Werkzeug für die vorläufige Evaluierung von Strategien zum Schutz transplantierter Zellen vor Autoimmunangriffen. Hier wird ein minimalinvasives Verfahren zur Transplantation und Bildgebung von Zelltransplantaten in einem adoptiven Transfermodell von Diabetes in Mäusen beschrieben. In diesem Protokoll werden Zellen aus der murinen Pankreas-Betazelllinie NIT-1, die das Glühwürmchen-Luciferase-Transgen luc2 exprimieren, subkutan in immundefizige, nicht-adipöse diabetische (NOD)-schwere kombinierte immundefiziente (scid) Mäuse transplantiert. Diesen Mäusen werden gleichzeitig Splenozyten von spontandiabetischen NOD-Mäusen intravenös injiziert, um Autoimmunität zu übertragen. Die Transplantate werden in regelmäßigen Abständen mittels nicht-invasiver biolumineszenter Bildgebung abgebildet, um das Überleben der Zellen zu überwachen. Das Überleben von mutierten Zellen wird mit dem von Kontrollzellen verglichen, die in dieselbe Maus transplantiert wurden.
Einleitung
Typ-1-Diabetes (T1D) wird durch die autoimmune Zerstörung der insulinproduzierenden Betazellen der Bauchspeicheldrüse verursacht. Der Verlust von Betazellmasse führt zu Insulinmangel und Hyperglykämie. T1D-Patienten sind auf mehrere tägliche Injektionen von exogenem Insulin angewiesen und leiden im Laufe ihres Lebens unter Episoden schwerer Hyperglykämie und Hypoglykämie. Zu den Komplikationen, die mit diesen Episoden verbunden sind, gehören diabetische Retinopathie, verminderte Nierenfunktion und Neuropathie1.
Insulininjektionen sind eine Behandlung, aber keine Heilung für T1D. Der Ersatz der verlorenen Betazellmasse hat jedoch das Potenzial, die Krankheit rückgängig zu machen, indem die Patienten in die Lage versetzt werden, ihr eigenes Insulin zu produzieren. Das Angebot an Leichenspenderinseln ist jedoch begrenzt2. Aus Stammzellen gewonnene Inseln (SC-Inselchen) können einen praktisch unbegrenzten Vorrat an Betazellen für die Transplantation bieten. Mehrere Gruppen haben gezeigt, dass humane embryonale Stammzellen (ES-Zellen) und induzierte pluripotente Stammzellen (iPS-Zellen) differenziert werden können, um funktionelle beta-ähnliche Zellen zu erzeugen 3,4,5. Vielversprechende frühe klinische Studiendaten deuten darauf hin, dass diese Zellen ihre Funktion nach der Transplantation beibehalten und es den Patienten ermöglichen könnten, insulinunabhängig zu werden6. Es ist jedoch eine chronische Immunsuppression erforderlich, die ihre Anfälligkeit für Krebs und Infektionen erhöht. Darüber hinaus können Immunsuppressiva langfristig zytotoxisch für Transplantate sein7. Um die Notwendigkeit einer Immunsuppression zu eliminieren, können SC-Inseln genetisch verändert werden, um sie vor rezidivierender Autoimmunität sowie Alloimmunität nach der Transplantation zu schützen.
Die Stammzellforschung ist sehr kosten- und arbeitsintensiv. Mauszelllinien und Tiermodelle sind nützliche Werkzeuge für die erste Identifizierung und experimentelle Validierung von Strategien zum Schutz transplantierter Zellen vor Autoimmunität. Die NOD-Maus entwickelt einen spontanen Autoimmundiabetes mit vielen Ähnlichkeiten zu humanem T1D8, und die NIT-1-Insulinom-Zelllinie teilt einen genetischen Hintergrund mit diesem Mausstamm9. Diabetes kann durch die Injektion von diabetischen Milzzellen aus NOD-Mäusen adoptativ auf den verwandten immundefizienten NOD-scid-Mausstamm übertragen werden, um den Ausbruch des Diabetes in replizierten Versuchsmäusen zeitlich zu synchronisieren10. Mit diesem Modell lassen sich relativ schnell und kostengünstig genetische Zielstrukturen für die weitere Validierung in SC-Inseln identifizieren. Kürzlich wurde die Methode zur Identifizierung und Validierung von RNLS angewendet, einem Ziel, das primäre menschliche Inseln in vivo vor Autoimmunität und aus iPS-Zellen gewonnene Inseln vor Betazellstress in vitroschützt 11. Hier wird ein einfaches Protokoll beschrieben, um gentechnisch veränderte NIT-1-Zellen zu transplantieren und ihr Überleben nicht-invasiv in einem adoptiven Transfermodell für Autoimmundiabetes bei Mäusen zu überwachen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
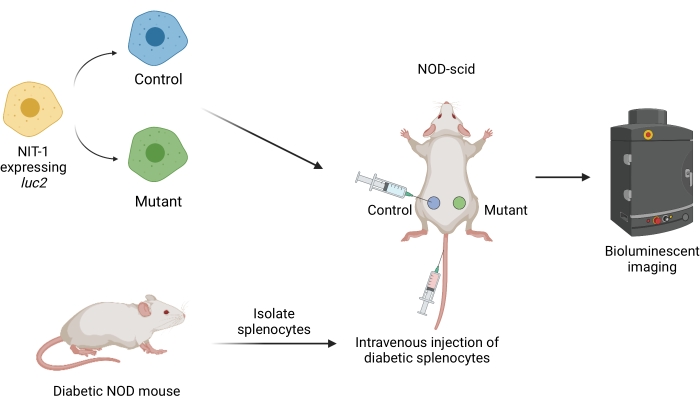
Abbildung 1: Der Arbeitsablauf für die Transplantation und Bildgebung von Transplantaten in einem adoptiven Transfermodell von Diabetes bei Mäusen. NIT-1-Zellen, die das Glühwürmchen-Transgen Luciferase (luc2) exprimieren, werden subkutan in NOD-scid-Mäuse transplantiert. Den Mäusen werden gleichzeitig autoreaktive Splenozyten injiziert, die aus einer spontan diabetischen NOD-Maus isoliert wurden. Die Transplantate werden in regelmäßigen Abständen mittels nicht-invasiver biolumineszenter Bildgebung abgebildet. Abbildung erstellt von BioRender.com. Abkürzungen: NOD = nicht-adipöser Diabetiker; SCID = schwere kombinierte Immundefiziente. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Alle Tierpflege- und Studienprotokolle wurden vom Institutional Animal Care and Use Committee (IACUC) des Joslin Diabetes Center genehmigt und in Übereinstimmung mit diesen durchgeführt. NOD- und NOD-scid-Mäuse können leicht aus kommerziellen Quellen bezogen werden. Alle Mäuse in dieser Studie werden in einer Sentinal-überwachten Einrichtung gehalten. In der Materialtabelle finden Sie Details zu allen Materialien, Tieren, Instrumenten und Software, die in diesem Protokoll verwendet werden.
1. Engineering und Wartung von NIT-1-Zelllinien
- NIT-1-Zelllinien, die einen genetischen Hintergrund mit NOD-Mäusen teilen, und 293FT-Zellen in Gewebekulturschalen in DMEM mit 4,5 g/l Glukose, ergänzt mit 10 % fötalem Kälberserum und 1 % Penicillin/Streptomycin, in einem 37 °C-Inkubator mit 5 % CO2 erhalten.
- Züchten Sie die 293FT-Zellen für die Transfektion auf eine Konfluenz von 70 % bis 80 %.
- Pro 10-cm-Schale mit 293FT-Zellen kombinieren Sie 10 μg pLenti-Luciferase-blast (siehe Supplemental File 1), das das Glühwürmchen-Luciferase-Transgen (luc2) unter der Kontrolle des konstitutiv aktiven EF1α-Promotors exprimiert, je 2 μg der Verpackungsplasmide pMD2.G, pMDLg/pRRE und pRSV-Rev, 4 μg des Hüllproteinplasmids pCMV-VSV-G und 60 μg lineares Polyethylenimin (PEI) in 1 ml serumfreiem DMEM. Passen Sie die Mengen basierend auf der Anzahl der zu transfizierenden Zellen an.
- Lassen Sie die DNA, PEI und DMEM 20 Minuten lang bei Raumtemperatur (RT) stehen und geben Sie sie dann zu den 293FT-Zellen.
- Sammeln Sie das Medium mit den lentiviralen Partikeln 48 Stunden nach der Transfektion.
- Transduzieren Sie die NIT-1-Zellen bei ~80% Konfluenz mit 1 ml Medium, das lentivirale Partikel pro 106 Zellen enthält , für 48-72 h.
- Wählen Sie die Luciferase-exprimierenden Zellen mit 5 μg/mL Blasticdin für 48 h aus.
- Die Luciferase-exprimierenden Zellen werden weiter genetisch verändert, um sie an die experimentelle Fragestellung anzupassen. Fügen Sie zum Vergleich eine Luciferase-exprimierende Wildtyp- oder Non-Targeting-Kontrollzelllinie hinzu.
HINWEIS: Beispiele für Zielgenmodifikationen sind CRISPR-Knockout, CRISPRa/i, shRNA-Knockdown und Überexpression.
2. Vorbereitung von NIT-1-Zellen für die Transplantation
- Züchten Sie die Luciferase-exprimierenden Zellen, bis sie zu 80%-90% konfluent sind.
- Entfernen Sie das Nährmedium und waschen Sie die Zellen mit phosphatgepufferter Kochsalzlösung (PBS, 5 ml für eine 10-cm-Schale).
- 1 ml 0,05%iges Trypsin-EDTA für 2 Minuten in jedes Gericht geben.
- Neutralisieren Sie das Trypsin mit 5 ml Nährmedium.
- Waschen Sie die Zellen mit einer Pipette von der Schale und geben Sie sie in ein konisches Röhrchen.
HINWEIS: Zellen aus mehreren Schalen derselben Zelllinie können kombiniert werden. - Zählen Sie die Zellen mit einer Färbung wie Trypanblau manuell mit einem Hämozytometer oder automatisch mit einem automatischen Zellzähler.
- Bei 250 × g für 5 min bei RT zentrifugieren und den Überstand mit einer Ansaugpipette entfernen.
- Resuspendieren Sie das Zellpellet in PBS in einer Konzentration von 5 × 10 7 Zellen/ml (107 Zellen pro Zelllinie und Maus werden in einem Volumen von 200 μl transplantiert).
- Halten Sie die Zellen bis zur Transplantation auf Eis (bis zu 3 Stunden).
3. Transplantation von NIT-1-Zellen in NOD-scid-Mäuse
- Anästhesieren Sie die Empfängermäuse (8-10 Wochen alte NOD-scid-Mäuse des gleichen Geschlechts wie die Mäuse, die zur Isolierung der Splenozyten verwendet wurden) durch Isofluran-Inhalation in einer Knockdown-Kammer. Geben Sie 2,5 % Isofluran mit einer Durchflussrate von 1,5 l/min und einer Evakuierungsrate von 9 l/min in die Kammer.
- Befeuchten Sie die Augen des Tieres mit Augensalbe, um ein Austrocknen zu verhindern.
- Entfernen Sie mit einem Elektrorasierer mit einem Schutz die Haare von der Rückseite (Rückenseite) der Mäuse, um die Haut freizulegen. Der rasierte Transplantationsbereich beträgt ungefähr 1 Zoll x 2 Zoll. Bringen Sie die rasierten Mäuse bis zur Transplantation in die Knockdown-Kammer zurück.
- Übertragen Sie die Mäuse nacheinander auf eine saubere Oberfläche mit einem Isofluran-Nasenkegel. Führen Sie den Kopf der Maus vorsichtig in den Nasenkegel. Verwenden Sie eine Isofluran-Flussrate von 0,25 l/min, um die Anästhesie während der Transplantation aufrechtzuerhalten.
- Wischen Sie den Transplantationsbereich mit einem Isopropylalkohol-Vorbereitungspad ab, um lose Haare zu entfernen und die Haut zu desinfizieren.
- Stellen Sie sicher, dass die Zellen vollständig resuspendiert sind, bevor Sie die Spritze laden. Ziehen Sie ein überschüssiges Zellvolumen (>300 μl) mit einer 26-g-Nadel in eine sterile 1-ml-Spritze. Entfernen Sie alle Blasen; Geben Sie dann überschüssige Zellen wieder in das Röhrchen, so dass 300 μl Zellsuspension in der Spritze verbleiben.
- Heben Sie mit einer gebogenen Pinzette, die in der nicht-dominanten Hand gehalten wird, die Haut auf einer Seite (links oder rechts) des Mausrückens sanft an, um einen leichteren Zugang zum Unterhautraum zu ermöglichen.
- Positionieren Sie die Spritze mit der dominanten Hand parallel zur koronalen und sagittalen Ebene des Mauskörpers. Führen Sie die Nadel mit der Nadel in Richtung des Kopfes der Maus in die Haut in der Nähe der Hinterhand ein und führen Sie sie vorsichtig in den Unterhautraum. Achten Sie darauf, dass die gesamte Nadel unter der Haut bleibt und nicht durchsticht.
- Stellen Sie die Pinzette so ein, dass sie die Haut sanft um die Nadelbasis hält. Geben Sie langsam eine kleine Menge Zellsuspension (<50 μl) ab und vergewissern Sie sich, dass sich an der Injektionsstelle eine kleine Wölbung unter der Haut bildet. Injizieren Sie die Zellsuspension so lange, bis 200 μl in den Unterhautraum abgegeben wurden.
- Halten Sie die Pinzette an Ort und Stelle und halten Sie die Nadel parallel zum Körper der Maus und ziehen Sie die Nadel langsam zurück. Nachdem die Nadel entfernt wurde, halten Sie die Haut einige Sekunden lang mit einer Pinzette geschlossen, um zu verhindern, dass die Zellen aus der Einstichwunde austreten.
- Wenn eine genetische Veränderung untersucht wird, wiederholen Sie die Transplantation auf der gegenüberliegenden Seite der Maus mit einer anderen Spritze, so dass sowohl mutierte als auch Kontrollzellen in jede Maus injiziert werden, wobei eine Zelllinie links und die andere rechts liegt. Wenn nur eine Zelllinie transplantiert wird, injizieren Sie die Zellen nur auf einer Seite.
- Nach der Transplantation wird jede Maus in einen neuen Käfig gebracht. Lassen Sie jede Maus sich vollständig von der Narkose erholen, bevor Sie weitere Mäuse in den Käfig setzen.
HINWEIS: Mäuse erholen sich, wenn sie ihre normalen Aktivitäten wieder aufnehmen und keine Anzeichen von Lethargie oder Bewegungseinschränkungen zeigen. - Bewerten Sie den Gesundheitszustand der Mäuse täglich für die Dauer des Experiments nach der Transplantation. Wenn die Transplantate eine große Ausbuchtung bilden oder die Mäuse schwach und lethargisch werden, messen Sie ihren Blutzucker und geben Sie 10% (w/w) Saccharosewasser ad libitum an alle hypoglykämischen Mäuse. Befolgen Sie alle tierärztlichen Empfehlungen und schläfern Sie alle Mäuse mit anhaltend schlechtem Körperzustand gemäß den institutionellen Richtlinien ein. In dieser Studie wurden Mäuse durch CO2 -Inhalation mit anschließender Zervixluxation eingeschläfert.
4. Isolierung und Aufreinigung autoreaktiver Splenozyten
- Identifizieren Sie 10-16 Wochen alte männliche oder weibliche NOD-Mäuse mit kürzlich aufgetretenem Diabetes (weniger als 10 Tage), indem Sie Urin- (oder Blut-)Blutzuckerteststreifen verwenden. NOD-Mäuse gelten als Diabetiker, wenn sie an mindestens 2 aufeinanderfolgenden Tagen einen Urin-/Blutzuckerspiegel von ≥250 mg/dl haben.
HINWEIS: Für jede NOD-scid-Maus werden 10 Millionen Splenozyten benötigt; Eine Milz liefert in der Regel 50 bis 150 Millionen Splenozyten. Die Splenozyten wurden aus pathogenfreien Mäusen isoliert, die in einer Sentinal-überwachten Einrichtung untergebracht waren. - Euthanasieren Sie die entsprechende Anzahl von diabetischen NOD-Mäusen.
HINWEIS: In dieser Studie wurden die Mäuse durch CO2 -Inhalation eingeschläfert, gefolgt von einer Zervixluxation, um den Tod zu sichern. - Machen Sie mit der Maus auf dem Rücken mit einer chirurgischen Schere einen vertikalen Schnitt von etwa 2 Zoll Länge in die Haut. Öffnen Sie die rechte Seite der Maus aus der Sicht des Forschers und lokalisieren Sie die leuchtend rote Milz. Schneiden Sie die Milz vorsichtig von der rosa Bauchspeicheldrüse ab und legen Sie sie in eine sterile 10-cm-Petrischale mit 5 ml sterilem PBS. Wiederholen Sie die Sektion mit so vielen Mäusen wie nötig.
HINWEIS: Milz von mehreren Mäusen kann in einer Schale kombiniert werden. Führen Sie die folgenden Schritte mit sterilen Reagenzien und Geräten in einer sterilen Haube durch. - Zerdrücken Sie die Milz(en) mit der flachen Oberseite eines sterilen Spritzenkolbens.
- Legen Sie ein 40-μm- oder 70-μm-Sieb in ein konisches 50-ml-Röhrchen und waschen Sie das Sieb mit 5 ml PBS, um es zu entleeren. Übertragen Sie die Milzsuspension in das Sieb und pürieren Sie weiter sanft durch das Sieb. Waschen Sie die Schüssel mit 10 ml PBS und geben Sie die Wäsche in das Sieb. Weiter pürieren, bis die rote Farbe aus dem Sieb verschwunden ist.
- Entsorgen Sie das Sieb und drehen Sie das Röhrchen bei 500 × g für 5 min bei RT. Entfernen Sie den Überstand mit einer Absaugpipette.
- Resuspendieren Sie das Zellpellet in 5 ml (für bis zu drei Milz) ACK-Lysepuffer, der auf RT vorgewärmt ist, und lysieren Sie die roten Blutkörperchen 4 Minuten lang. Erhöhen Sie das Volumen um 1-2 ml pro Milz, wenn zusätzliche Milz benötigt wird.
- Stoppen Sie die Reaktion mit 5 ml NIT-1-Zellmedien (oben beschrieben) pro 5 ml Lysepuffer. Führen Sie die Zellsuspension durch ein frisches Sieb, um Klumpen zu entfernen. Entsorgen Sie das Sieb und schleudern Sie es bei 500 × g für 5 Minuten bei RT.
- Resuspendieren Sie das Zellpellet in 20 ml PBS und zählen Sie die Zellen. Bei 500 × g für 5 min bei RT schleudern. Resuspendieren Sie die Zellen in sterilem PBS in einer Konzentration von 1 × 108 Zellen/ml (das Injektionsvolumen beträgt 0,1 ml/Maus) in einem 1,5-ml-Safe-Lock-Reaktionsgefäß.
- Lagern Sie die Zellen auf Eis (nicht länger als 1 Stunde) oder halten Sie die Zellen bei RT und fahren Sie sofort mit der Schwanzveneninjektion fort.
5. Intravenöse Injektion von diabetischen Splenozyten über die laterale Schwanzvene
- Erwärmen Sie den Körper der erwachsenen NOD-Scid-Mäuse (z. B. mit einer Wärmelampe für ~5-10 Minuten), um die Venen zu erweitern (dies hilft bei der Visualisierung und Injektion in die Vene).
Anmerkungen: Um eine Überhitzung der Mäuse zu vermeiden, überschreiten Sie diese Zeit nicht. Überwachen Sie immer den Integritätsstatus. Wenn die Mäuse erschöpft oder bewegungsunfähig erscheinen, schalten Sie die Wärmelampe sofort aus. - Erwärmen Sie die Zellsuspension. Bereiten Sie eine sterile Spritze (0,3-1,0 ml) mit einer sterilen Nadel (27-30 g, 0,3 mm/0,5 Zoll oder kleiner) vor oder verwenden Sie eine sterile 0,5-ml-Insulinspritze mit einer 0,3-mm-Nadel (0,5 Zoll). Halten Sie die Nadel immer steril und verwenden Sie ein steriles Tablett, wenn die Spritze zwischen den Injektionen abgelegt werden muss.
- Resuspendieren Sie die Splenozytenlösung vor jeder Injektion. Ziehen Sie für jede Maus 100 μL der vorgewärmten und gemischten Splenozytensuspension in die Spritze. Achten Sie darauf, dass sich keine Luftblasen in der Spritze oder in der Suspension befinden.
Anmerkungen: Stellen Sie sicher, dass Sie alle Geräte und Verbrauchsmaterialien vorbereitet haben (Alkoholtücher zur Desinfektion, eine Spritze mit den zu injizierenden Splenozyten und einen frischen Käfig zum Trennen der injizierten Mäuse), bevor Sie die Maus in die Rückhaltevorrichtung einsetzen. - Setzen Sie die Maus in die Rückhaltevorrichtung ein. Erfassen Sie den Schwanz mit der nicht-dominanten Hand und lokalisieren Sie eine der beiden seitlichen Schwanzadern. Drehen Sie den Schwanz bei Bedarf vorsichtig. Wischen Sie den Schwanz mit einem Desinfektionstuch (70% Isopropylalkohol) ab, um die Haut zu reinigen und die Sichtbarkeit der Vene zu erhöhen.
- Führen Sie die Nadel in einem spitzen Winkel mit der dominanten Hand in den mittleren Bereich des Schwanzes ein. Schieben Sie die Nadel mit der Abschrägung der Nadel nach oben einige Millimeter durch die Haut.
Anmerkungen: Stellen Sie sicher, dass die Nadel parallel zur Vene verläuft und nur leicht unter der Haut platziert wird. Seien Sie auf plötzliche Bewegungen der Maus/des Schwanzes direkt nach dem Eindringen in die Haut-/Gefäßwand vorbereitet. Ein erfolgreiches Einführen der Nadel sollte sich wie ein "sanftes Gleiten" in die Vene anfühlen. Wenn ein weiterer Versuch erforderlich ist, bewegen Sie den Schwanz weiter nach oben in Richtung Körper. - Üben Sie sanften Druck auf die Spritze aus, um die Splenozytensuspension zu injizieren. Achten Sie darauf, dass sich die Nadel beim Injizieren nicht weiter nach innen oder außen bewegt. Erfolgreiche Injektionen verlaufen reibungslos, ohne dass während der Injektion ein Gegendruck verspürt wird, und werden durch einen transparenten/weißen Blutfluss unmittelbar nach der Injektion angezeigt.
- Lösen Sie die Nadel vorsichtig aus der Vene und üben Sie mit einem Desinfektionstuch leichten Druck auf den Schwanz aus, bis die Blutung aufhört. Lösen Sie die Maus von der Rückhaltevorrichtung und legen Sie sie vorsichtig in einen frisch vorbereiteten Käfig.
HINWEIS: Injizieren Sie zwei bis drei Kontrollmäusen, die kein NIT-1-Zelltransplantat erhalten, Splenozyten, um das Potenzial der autoreaktiven Splenozyten zur Induktion von Diabetes zu bestätigen, was etwa 2-4 Wochen nach der Injektion dauert.
6. In-vivo-Biolumineszenz-Bildgebung von NIT-1-Transplantaten
HINWEIS: Nehmen Sie die Transplantate ein- bis zweimal pro Woche auf. Warten Sie am Tag der Transplantation mindestens 2 Stunden nach der Transplantation, damit sich die Transplantate absetzen und eine stabile Luciferase-Expression gewährleistet ist. Wenn die Zeit ein limitierender Faktor ist, kann die erste Messung stattdessen an Tag 1 durchgeführt werden. Ein empfohlener anfänglicher Bildgebungsplan ist Tag 0 oder Tag 1 nach der Injektion, Tag 5, Tag 10, Tag 14, Tag 18 und Tag 25. Passen Sie den Zeitplan jedoch auf der Grundlage des Fortschritts der Autoimmunität an, der anhand des Verlusts des biolumineszenten Signals beurteilt wird.
- Bereiten Sie eine 15 mg/ml D-Luciferin-Lösung in Dulbeccos PBS vor. Rühren Sie bei RT, um sich aufzulösen, und sterilisieren Sie es (0,22 μm). Lagern Sie 1 ml Aliquots bei −20 °C und tauen Sie sie nach Bedarf auf.
HINWEIS: Die Aliquots können wieder eingefroren werden. - Mindestens 5 Minuten vor der Bildgebung werden die Mäuse intraperitoneal mit einer 1-ml-Spritze und einer 26-g-Nadel mit D-Luciferin-Lösung in einer Dosis von 150 mg/kg injiziert.
Anmerkungen: Verwenden Sie für jede Maus eine frische Spritze und Nadel. - Betäubung der Mäuse durch Isofluran-Inhalation gemäß den institutionellen Richtlinien. Die empfohlenen Bedingungen sind 2,5 % Isofluran mit einer Durchflussrate von 1,5 l/min in die Knockdown-Kammer und einer Evakuierungsrate von 9 l/min.
- Befeuchten Sie die Augen des Tieres mit Augensalbe, um ein Austrocknen zu verhindern.
- Öffnen Sie die Software, die dem Bildgebungsgerät zugeordnet ist. Erstellen Sie einen neuen Benutzer und/oder melden Sie sich an. Wählen Sie auf dem Bedienfeld unten rechts die Option Initialisieren aus (Abbildung 2A). Um die Bilddaten automatisch zu speichern , erstellen Sie die entsprechenden Ordner auf dem Computer, und wählen Sie dann Erfassung | Automatisches Speichern unter... (Abbildung 2A). Sobald das Gerät mit der Initialisierung fertig ist, stellen Sie die Belichtungszeit auf 1 Minute ein.
HINWEIS: Die vollständigen Bildgebungsparameter sind in Abbildung 2B dargestellt. - Übertragen Sie die Mäuse nacheinander aus der Knockdown-Kammer in das Bildgebungsinstrument. Legen Sie die Maus mit gespreizten Gliedmaßen auf den Bauch und führen Sie ihren Kopf sanft in den Nasenkegel. Eine Isofluran-Flussrate von 0,25 l/min, die über einen Nasenkegel abgegeben wird, ist geeignet, um die Anästhesie während der Bildgebung aufrechtzuerhalten. Glätten Sie die Maus vorsichtig, indem Sie mit beiden Händen auf die Mitte ihres Rückens drücken und dann die Hände nach außen und auseinander spreizen.
- Wählen Sie " Abrufen" aus (Abbildung 2B). Notieren Sie alle relevanten Details des Experiments im Popup-Fenster (Abbildung 2C).
ANMERKUNG: In Abbildung 3A finden Sie repräsentative Bilder von drei 8 Wochen alten weiblichen NOD-scid-Mäusen, die zu verschiedenen Zeitpunkten mit zwei Transplantaten transplantiert wurden.
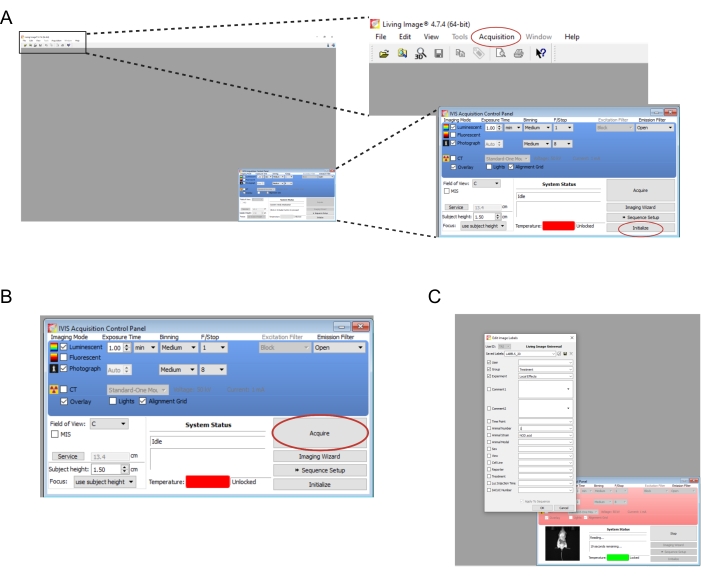
Abbildung 2: Screenshots der Softwarebefehle für die Bildgebung biolumineszenter Transplantate . (A) Wählen Sie vor der Bildgebung Initialisieren , um das Gerät vorzubereiten. Die Bilder können automatisch in einem Ordner Ihrer Wahl gespeichert werden, indem Sie Akquisition | Automatisches Speichern unter... (B) Überblick über die Bildgebungsparameter. Nachdem die Maus im Gerät positioniert wurde, wählen Sie Erfassen. (C) Screenshot des Dialogfelds, das während der Bildgebung angezeigt wird. Hier können Details wie Zeitpunkt und Mausstamm eingegeben werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
7. Datenanalyse
- Quantifizieren Sie das biolumineszente Signal jederzeit nach der Bildgebung. Öffnen Sie die Software, die dem Bildgebungsgerät zugeordnet ist. Wählen Sie Datei | Öffnen Sie die ClickInfo.txt Datei, die der zu analysierenden Maus zugeordnet ist, und wählen Sie sie aus.
- Wählen Sie in der Werkzeugpalette die Option ROI-Werkzeuge aus (Abbildung 3B, Schritt 1). Wählen Sie aus dem ovalen Dropdown-Menü (Abbildung 3B, Schritt 1, roter Pfeil) die Anzahl der Transplantate aus, die in die Maus transplantiert wurden.
- Verschieben Sie die Ovale so, dass sie das biolumineszente Signal von jedem Transplantat enthalten, und wählen Sie ROIs messen (Abbildung 3B, Schritt 2).
- Notieren Sie die Gesamtzahl für jedes Transplantat (Abbildung 3B, Schritt 3).
- Teilen Sie für jedes Transplantat das zu jedem Zeitpunkt gemessene biolumineszente Signal durch das Signal, das zum ersten Zeitpunkt gemessen wurde. Geben Sie das Überleben des Transplantats als Anteil oder Prozentsatz des verbleibenden biolumineszenten Signals im Verhältnis zum ursprünglichen biolumineszenten Signal an.
HINWEIS: Wenn sich die Transplantate nach der Transplantation ausdehnen, ist das Verhältnis oder der Prozentsatz des Transplantatüberlebens größer als 1 bzw. 100%. Alle Mäuse, die transplantiert werden, sollten auf gesundheitliche Beeinträchtigungen überwacht werden.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Eine Übersicht über das Protokoll ist in Abbildung 1 dargestellt. Das Überleben zweier Zelllinien, wie z.B. einer mutierten und einer nicht-zielgerichteten Kontrolle, kann verglichen werden, oder das Überleben einer Zelllinie kann in mehreren Gruppen von Mäusen gemessen werden, wie z. B. medikamentös behandelte Mäuse im Vergleich zu mit Vehikeln behandelten Kontrollen. Abbildung 3A zeigt drei 8 Wochen alte weibliche NOD-scid-Mäuse, die mit einer nicht-zi...
Access restricted. Please log in or start a trial to view this content.
Diskussion
T1D ist eine verheerende Krankheit, für die es derzeit keine Heilung gibt. Die Betazellersatztherapie bietet eine vielversprechende Behandlung für Patienten mit dieser Krankheit, aber das entscheidende Hindernis für diese Strategie ist das Potenzial für wiederkehrende Autoimmunangriffe gegen die transplantierten Betazellen. Eine mögliche Lösung für dieses Problem ist die gentechnische Veränderung von SC-beta-Zellen, um deren Immunsichtbarkeit oder -anfälligkeit zu verringern. Hier wird ein Protokoll für die nic...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Wir danken Dr. Erica P. Cai und Dr. Yuki Ishikawa für die Entwicklung der in diesem Protokoll beschriebenen Methode (siehe Ref. 11). Die Forschung in den Labors von S.K. und P.Y. wird durch Zuschüsse der National Institutes of Health (NIH) (R01DK120445, P30DK036836), JDRF, des Harvard Stem Cell Institute und der Beatson Foundation unterstützt. T.S. wurde durch ein Postdoc-Stipendium des National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK) (T32 DK007260-45) unterstützt, und K.B. wurde teilweise durch ein Stipendium der Mary K. Iacocca Foundation unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin, 0.53 mM EDTA | Corning | 25-052-CI | |
| 293FT | Invitrogen | R70007 | Fast-growing, highly transfectable clonal isolate derived from human embryonal kidney cells transformed with the SV40 large T antigen |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| Alcohol prep pads, 70% Isopropyl alcohol | Amazon/Ever Ready First Aid | B08NWF31DX | |
| BD 5ml Syringe Luer-Lok Tip | BD | 309646 | |
| BD PrecisionGlide Needle 26G x 5/8 (0.45 mm x 16 mm) Sub-Q | BD | 305115 | |
| BD 1 mL TB Syringe Slip Tip | BD | 309659 | |
| Blasticidin S HCl | Corning | 30-100-RB | |
| Cell strainer premium SureStrain, 70 µm, sterile | Southern Labware | C4070 | Or use similar sterile strainer with 40-70um pore size |
| CellDrop automated cell counter | Denovix | CellDrop BF-PAYG | Or use similar cell counter device |
| Corning 100 mL Penicillin-Streptomycin Solution, 100x | Corning | 30-002-CI | |
| Disposable Aspirating Pipets, Polystyrene, Sterile, Capacity=2 mL | VWR | 414004-265 | Or use similar aspirating pipette |
| D-Luciferin, Potassium Salt , Molecular Biology Grade, Powder, >99% | Goldbio | LUCK-100 | |
| DMEM, high glucose, pyruvate, no glutamine | Gibco | 10313039 | |
| Falcon BD tubes, 50 mL | Fisher Scientific | 14-959-49A | |
| Fetal Bovine Serum | Gibco | 10437-028 | |
| Forceps premium for tissues, 1 x 2 teeth 5 in, German Steel | Fisher Scientific | 13-820-074 | |
| Glucose urine test strip | California Pet Pharmacy | u-tsg100 | Or use similar test strip for glucose measurments in urine/blood |
| GlutaMAX–1 (100x) | Gibco | 35050-061 | |
| Infrared heating lamp | Cole Parmer | 03057-00 | Or use similar infrared lamp |
| Insulin syringe 0.5 mL, U-100 29 G 0.5 in | Becton Dickinson | 309306 | |
| Isoflurane, USP | Piramal Critical Care | 6679401725 | |
| IVIS Spectrum in vivo imaging system | Perkin Elmer | 124262 | Instrument for non-invasively collecting bioluminescent images of transplanted cells |
| Living Image Analysis Software | Perkin Elmer | 128113 | Software for collecting and quantifying bioluminescent signal |
| Microcentrifuge tubes seal-rite, 1.5 mL | USA Scientific | 1615-5510 | Or use similar sterile microcentrifuge tubes |
| NIT-1 | ATCC | CRL-2055 | Pancreatic beta-celll line derived from NOD/Lt mice |
| NOD.Cg-Prkdcscid/J | The Jackson Laboratory | 001303 | Mice homozygous for the severe combined immune deficiency spontaneous mutation Prkdcscid, commonly referred to as scid, are characterized by an absence of functional T cells and B cells, lymphopenia, hypogammaglobulinemia, and a normal hematopoietic microenvironment. |
| NOD/ShiLtJ | The Jackson Laboratory | 001976 | The NOD/ShiLtJ strain of mice (commonly called NOD) is a polygenic model for autoimmune type 1 diabetes |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010031 | No calcium, no magnesium, no phenol red |
| pCMV-VSV-G | Addgene | 8454 | |
| pLenti-luciferase-blast | Made in-house | Plasmid available upon request | See Supplemental File 1 |
| pMD2.G | Addgene | 12259 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polyethylenimine, Linear, MW 25,000, Transfection Grade (PEI 25K) | Fisher Scientific | NC1014320 | |
| pRSV-Rev | Addgene | 12253 | |
| Restrainer for rodents, broome-style round 1 in | Fisher Scientific | 01-288-32A | |
| Scissors, sharp-pointed | Fisher Scientific | 08-940 | Or use other scissors made of surgical-grade stainless steel |
| Tissue-culture treated culture dishes | Millipore Sigma | CLS430167-20EA | Or use other sterile cell culture-treated Petri dishes |
| Tweezers/Forceps, fine precision medium tipped | Fisher Scientific | 12-000-157 |
Referenzen
- Katsarou, A., et al. Type 1 diabetes mellitus. Nature Reviews Disease Primers. 3, 17016(2017).
- Shapiro, A. M., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews Endocrinology. 13 (5), 268-277 (2017).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Russ, H. A., et al. Controlled induction of human pancreatic progenitors produces functional beta-like cells in vitro. EMBO Journal. 34 (13), 1759-1772 (2015).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nature Biotechnology. 32 (11), 1121-1133 (2014).
- Vertex Announces Positive Day 90 Data for the First Patient in the Phase 1_2 Clinical Trial Dosed With VX-880, a Novel Investigational Stem Cell-Derived Therapy for the Treatment of Type 1 Diabetes. Businesswire. , Available from: https://www.businesswire.com/news/home/20211018005226/en/Vertex-Announces-Positive-Day-90-Data-for-the-First-Patient-in-the-Phase-12-Clinical-Trial-Dosed-With-VX-880-a-Novel-Investigational-Stem-Cell-Derived-Therapy-for-the-Treatment-of-Type-1-Diabetes (2021).
- Gamble, A., Pepper, A. R., Bruni, A., Shapiro, A. M. J. The journey of islet cell transplantation and future development. Islets. 10 (2), 80-94 (2018).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the Non Obese Diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Hamaguchi, K., Gaskins, R. H., Leiter, E. H. NIT-1, a pancreatic β-cell line established from a transgenic NOD/Lt mouse. Diabetes. 40 (7), 842-849 (1991).
- Christianson, S. W., Shultz, L. D., Leiter, E. D. Adoptive transfer of diabetes into immunodeficient NOD-scid/scid mice: Relative contribution of CD4+ and CD8+ T-cells from diabetogenic versus prediabetic NOD.NON-Thy1a donors. Diabetes. 42 (1), 44-55 (1993).
- Cai, E. P., et al. Genome-scale in vivo CRISPR screen identifies RNLS as a target for beta cell protection in type 1 diabetes. Nature Metabolism. 2 (9), 934-945 (2020).
- Parent, A. V., et al. Selective deletion of human leukocyte antigens protects stem cell-derived islets from immune rejection. Cell Reports. 36 (7), 109538(2021).
- Brehm, M. A., et al. Lack of acute xenogeneic graft-versus-host disease, but retention of T-cell function following engraftment of human peripheral blood mononuclear cells in NSG mice deficient in MHC class I and II expression. FASEB Journal. 33 (3), 3137-3151 (2019).
- Abdulreda, M. H., et al. In vivo imaging of type 1 diabetes immunopathology using eye-transplanted islets in NOD mice. Diabetologia. 62 (7), 1237-1250 (2019).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten