A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניטור ביולומינסנטי של הישרדות השתל במודל העברה מאומץ של סוכרת אוטואימונית בעכברים
In This Article
Summary
פרוטוקול זה מתאר שיטה פשוטה וזעיר פולשנית להשתלה והדמיה של תאי NIT-1 בעכברים סוכרתיים שאינם שמנים (NOD) - עכברים משולבים בעלי כשל חיסוני חמור המאותגרים בטחול מטוהר מעכברי NOD סוכרתיים ספונטניים.
Abstract
סוכרת מסוג 1 מאופיינת בהרס אוטואימוני של תאי בטא מייצרי אינסולין בלבלב. טיפול מבטיח למחלה זו הוא השתלת תאי בטא שמקורם בתאי גזע. שינויים גנטיים, עם זאת, עשויים להיות נחוצים כדי להגן על התאים המושתלים מפני אוטואימוניות מתמשכת. מודלים של עכברים סוכרתיים הם כלי שימושי להערכה ראשונית של אסטרטגיות להגנה על תאים מושתלים מפני התקפה אוטואימונית. מתוארת כאן שיטה זעיר פולשנית להשתלה והדמיה של שתלי תאים במודל העברה מאומץ של סוכרת בעכברים. בפרוטוקול זה, תאים מקו תאי הבטא של הלבלב NIT-1 המבטאים את הטרנסגן Luc2 של הגחלילית מושתלים תת עורית בעכברים סוכרתיים שאינם שמנים (NOD) - חמורים בעלי ליקוי חיסוני משולב חיסוני (SCID). עכברים אלה מוזרקים בו זמנית לווריד עם טחול מעכברי NOD סוכרתיים ספונטניים כדי להעביר אוטואימוניות. השתלים מצולמים במרווחי זמן קבועים באמצעות הדמיה ביולומינסנטית לא פולשנית כדי לעקוב אחר הישרדות התא. הישרדותם של תאים מוטנטיים מושווית לזו של תאי ביקורת המושתלים באותו עכבר.
Introduction
סוכרת מסוג 1 (T1D) נגרמת על ידי הרס אוטואימוני של תאי בטא מייצרי אינסולין של הלבלב. אובדן מסת תאי בטא גורם למחסור באינסולין ולהיפרגליקמיה. חולי סוכרת סוג 1 מסתמכים על זריקות יומיות מרובות של אינסולין אקסוגני וחווים אפיזודות של היפרגליקמיה חמורה והיפוגליקמיה לאורך חייהם. הסיבוכים הקשורים לפרקים אלה כוללים רטינופתיה סוכרתית, ירידה בתפקוד הכליות ונוירופתיה1.
זריקות אינסולין הן טיפול אך לא תרופה לסוכרת סוג 1. החלפת מסת תאי הבטא שאבדו, לעומת זאת, יש פוטנציאל להפוך את המחלה על ידי מתן אפשרות לחולים לייצר אינסולין משלהם. עם זאת, היצע האיים התורמים הגווארי מוגבל2. איים שמקורם בתאי גזע (SC-islets) עשויים לספק אספקה כמעט בלתי מוגבלת של תאי בטא להשתלה. מספר קבוצות הוכיחו כי תאי גזע עובריים אנושיים (ESC) ותאי גזע פלוריפוטנטיים מושרים (iPSCs) יכולים להיות ממוינים כדי ליצור תאים דמויי בטא פונקציונליים 3,4,5. נתונים מבטיחים מניסויים קליניים מוקדמים מצביעים על כך שתאים אלה שומרים על תפקודם לאחר ההשתלה ועשויים לאפשר לחולים להיות בלתי תלויים באינסולין6. עם זאת, נדרש דיכוי חיסוני כרוני, ובכך להגביר את רגישותם לסרטן ולזיהום. בנוסף, סוכני אימונוסופרסיביים עשויים להיות ציטוטוקסיים לשתלים בטווח הארוך7. כדי למנוע את הצורך בדיכוי חיסוני, איי SC עשויים להיות מהונדסים גנטית כדי להגן עליהם מפני אוטואימוניות חוזרת, כמו גם אלוחסינות לאחר ההשתלה.
מחקר תאי גזע הוא תובעני מאוד בעלויות ובעבודה. קווי תאים של עכברים ומודלים של בעלי חיים הם כלים שימושיים לזיהוי ראשוני ותיקוף ניסיוני של אסטרטגיות להגנה על תאים מושתלים מפני אוטואימוניות. עכבר NOD מפתח סוכרת אוטואימונית ספונטנית עם קווי דמיון רבים לסוכרת סוג1 8 אנושית, וקו תאי האינסולינומה NIT-1 חולק רקע גנטי עם זן עכברזה 9. סוכרת יכולה להיות מועברת באופן מאומץ לזן עכבר NOD-scid הקשור למערכת החיסון באמצעות הזרקה של טחול סוכרתי מעכברי NOD על מנת לסנכרן באופן זמני את הופעת הסוכרת בעכברי ניסוימשוכפלים 10. מודל זה יכול לשמש לזיהוי מטרות גנטיות במהירות ובזול יחסית לצורך אימות נוסף באיי SC. לאחרונה, השיטה יושמה כדי לזהות ולאמת RNLS, מטרה שנמצאה כמגנה על איים אנושיים ראשוניים מפני אוטואימוניות in vivo ואיים שמקורם ב- iPSC מלחץ תאי בטא במבחנה11. מתואר כאן פרוטוקול פשוט להשתלת תאי NIT-1 מהונדסים גנטית ולמעקב לא פולשני אחר הישרדותם במודל העברה מאומץ של סוכרת אוטואימונית בעכברים.
Access restricted. Please log in or start a trial to view this content.
Protocol
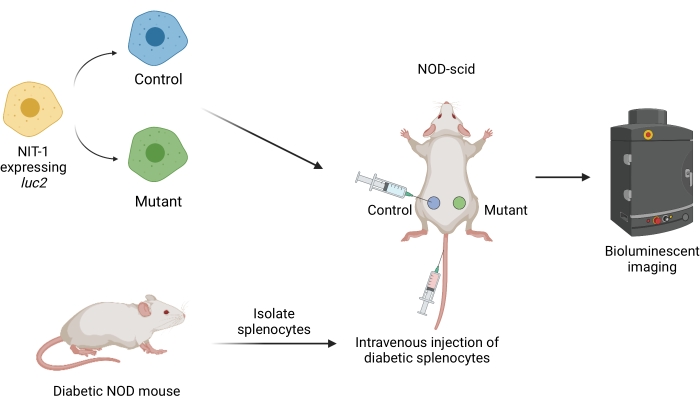
איור 1: תהליך העבודה להשתלה והדמיה של שתלים במודל העברה מאומצת של סוכרת בעכברים. תאי NIT-1 המבטאים את טרנסגן הגחלילית לוציפראז (luc2) מושתלים תת עורית בעכברי NOD-scid. העכברים מוזרקים בו זמנית עם splenocytes autoreactive מבודד עכבר NOD סוכרתי ספונטני. השתלים מצולמים במרווחי זמן קבועים על ידי הדמיה ביולומינסנטית לא פולשנית. איור שנוצר על ידי BioRender.com. קיצורים: NOD = סוכרת שאינה שמנה; SCID = מדוכא חיסוני משולב חמור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כל פרוטוקולי הטיפול והמחקר בבעלי חיים אושרו ובוצעו בהתאם לוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) במרכז ג'וסלין לסוכרת. עכברי NOD ו-NOD-scid ניתן להשיג בקלות ממקורות מסחריים. כל העכברים במחקר זה מוחזקים במתקן מנוטר זקיף. עיין בטבלת החומרים לקבלת פרטים הקשורים לכל החומרים, בעלי החיים, המכשירים והתוכנות המשמשים בפרוטוקול זה.
1. הנדסה ותחזוקה של קווי תאים NIT-1
- שמור על קווי תאים NIT-1, החולקים רקע גנטי עם עכברי NOD, ותאי 293FT בכלים שטופלו בתרבית רקמות ב- DMEM המכילים 4.5 גרם / ליטר גלוקוז בתוספת 10% נסיוב בקר עוברי ו -1% פניצילין/סטרפטומיצין באינקובטור של 37 מעלות צלזיוס עם 5% CO2.
- להגדיל את התאים 293FT למפגש 70%-80% עבור transfection.
- לכל צלחת של 10 ס"מ של תאי 293FT, ערבבו 10 מיקרוגרם של pLenti-luciferase-blast (ראה קובץ משלים 1), המבטא את טרנסגן הגחלילית luciferase (luc2) תחת שליטת פרומוטור EF1α הפעיל באופן קונסטיטוטיבי, 2 מיקרוגרם כל אחד מפלסמידים האריזה pMD2.G, pMDLg/pRRE ו-pRSV-Rev, 4 מיקרוגרם של פלסמיד חלבון המעטפת pCMV-VSV-G, ו-60 מיקרוגרם של פוליאתילנימין ליניארי (PEI) ב-1 מ"ל של DMEM ללא סרום. התאם את הכמויות בהתבסס על מספר התאים שיש להדביק.
- השאירו את הדנ"א, ה-PEI וה-DMEM בטמפרטורת החדר (RT) למשך 20 דקות, ולאחר מכן הוסיפו אותם לתאי 293FT.
- לאסוף את המדיום המכיל את החלקיקים lentiviral 48 שעות לאחר transfection.
- התמירו את תאי ה-NIT-1 במפגש ~80% עם 1 מ"ל של חלקיקים לנטי-ויראליים לכל 106 תאים למשך 48-72 שעות.
- בחר את התאים המבטאים לוציפראז עם 5 מיקרוגרם / מ"ל blasticidin במשך 48 שעות.
- שינוי גנטי נוסף של התאים המבטאים לוציפראז כך שיתאימו לשאלת הניסוי. כלול קו תאי בקרה מסוג פרא המבטא לוציפראז או שאינו ממוקד לצורך השוואה.
הערה: דוגמאות לשינויים בגני המטרה כוללות CRISPR knockout, CRISPRa/i, shRNA knockdown וביטוי יתר.
2. הכנת תאי NIT-1 להשתלה
- לגדל את התאים המבטאים luciferase עד שהם 80%-90% נפגשים.
- מוציאים את מצע הגידול ושוטפים את התאים במי מלח חוצצים פוספט (PBS, 5 מ"ל לצלחת של 10 ס"מ).
- הוסיפו 1 מ"ל של 0.05% טריפסין-EDTA לכל מנה למשך 2 דקות.
- לנטרל את טריפסין עם 5 מ"ל של מדיום צמיחה.
- השתמש פיפטה כדי לשטוף את התאים מן הצלחת ולהעביר אותם צינור חרוט.
הערה: ניתן לשלב תאים מכלים מרובים של אותו קו תא. - ספור את התאים באמצעות כתם כגון כחול טריפאן באופן ידני עם hemocytometer או באופן אוטומטי עם מונה תאים אוטומטי.
- צנטריפוגה ב 250 × גרם במשך 5 דקות ב RT ולהסיר את supernatant עם פיפטה שאיפה.
- להשהות מחדש את גלולת התא ב- PBS בריכוז של 5 × 10 7 תאים / מ"ל (107 תאים לכל קו תא לכל עכבר יושתלו בנפח של 200 μL).
- שמור את התאים על קרח (עד 3 שעות) עד ההשתלה.
3. השתלת תאי NIT-1 בעכברי NOD-scid
- הרדימו את העכברים המקבלים (עכברי NOD-scid בני 8-10 שבועות מאותו המין כמו העכברים המשמשים לבידוד הטחול) על ידי שאיפת איזופלורן בתא הפלה. לספק 2.5% איזופלורן לתוך התא בקצב זרימה של 1.5 ליטר לדקה וקצב פינוי של 9 ליטר לדקה.
- לשמן את העיניים של החיה עם משחה אופתלמית כדי למנוע התייבשות.
- בעזרת מכונת גילוח חשמלית עם מגן, הסירו את השיער מהגב (הצד הגבי) של העכברים כדי לחשוף את העור. שטח ההשתלה המגולח יהיה בערך 1 ל x 2 אינץ '. מחזירים את העכברים המגולחים לתא ההפלה עד להשתלה.
- מעבירים את העכברים אחד בכל פעם למשטח נקי עם חרוט אף איזופלורן. כוונו בעדינות את ראש העכבר לתוך חרוט האף. השתמש בקצב זרימת איזופלורן של 0.25 ליטר לדקה כדי לשמור על ההרדמה במהלך ההשתלה.
- נגבו את אזור ההשתלה עם פד להכנת אלכוהול איזופרופיל כדי להסיר שיער רפוי ולחטא את העור.
- ודא שהתאים מושהים מחדש במלואם לפני טעינת המזרק. צייר נפח עודף (>300 μL) של תאים לתוך מזרק סטרילי 1 מ"ל עם מחט 26 גרם. הסר בועות; לאחר מכן, להחזיר תאים עודפים לצינור, כך 300 μL של השעיית התא נשאר מזרק.
- בעזרת זוג מלקחיים מעוקלים המוחזקים ביד הלא דומיננטית, הרימו בעדינות את העור בצד אחד (שמאל או ימין) של גב העכבר כדי לאפשר גישה קלה יותר לחלל התת עורי.
- בעזרת היד הדומיננטית, מקמו את המזרק במקביל למישור העטרה והקשת בגוף העכבר. כאשר המחט מכוונת לכיוון ראש העכבר, הכנס את המחט לעור ליד החלק האחורי, והנחה אותה בעדינות לתוך החלל התת עורי. ודא כי המחט כולה נשארת מתחת לעור ולא לחטט דרכה.
- התאימו את המלקחיים כך שיחזיקו בעדינות את העור סביב בסיס המחט. שחררו באיטיות כמות קטנה של תרחיף תאים (<50 μL) ואשרו כי בליטה קטנה נוצרת מתחת לעור במקום ההזרקה. המשך הזרקת תרחיף התא עד 200 μL מועבר לחלל תת עורי.
- מחזיקים את המלקחיים במקום ושומרים על המחט מקבילה לגוף העכבר, מושכים לאט את המחט. לאחר הסרת המחט, החזיקו את העור סגור במלקחיים למשך מספר שניות כדי למנוע מהתאים לדלוף החוצה מפצע הניקוב.
- אם נבדק שינוי גנטי, חזור על ההשתלה בצד הנגדי של העכבר באמצעות מזרק אחר, כך שגם תאי מוטציה וגם תאי ביקורת מוזרקים לכל עכבר, כאשר קו תא אחד משמאל והשני מימין. אם מושתל רק קו תאים אחד, הזריקו את התאים בצד אחד בלבד.
- לאחר ההשתלה מעבירים כל עכבר לכלוב טרי. אפשר לכל עכבר להתאושש לחלוטין מההרדמה לפני הוספת עכברים נוספים לכלוב.
הערה: עכברים מתאוששים כאשר הם חוזרים לפעילות רגילה ואינם מראים סימני עייפות או תנועה לקויה. - להעריך את מצב הבריאות של העכברים מדי יום במשך הניסוי לאחר ההשתלה. אם השתלים יוצרים בליטה גדולה או שהעכברים נעשים חלשים ורדומים, מדדו את רמת הגלוקוז בדמם וספקו 10% (w/w) מי סוכרוז לכל העכברים הסובלים מהיפוגליקמיה. יש לעקוב אחר כל ההמלצות הווטרינריות ולהרדים עכברים עם המשך מצב גוף ירוד בהתאם להנחיות המוסדיות. במחקר זה, עכברים הומתו על ידי שאיפתCO2 ואחריה נקע צוואר הרחם.
4. בידוד וטיהור של טחול autoreactive
- זהה עכברי NOD זכר או נקבה בני 10-16 שבועות עם סוכרת לאחרונה (פחות מ -10 ימים) באמצעות רצועות בדיקת גלוקוז בשתן (או בדם). עכברי NOD נחשבים לסוכרתיים כאשר יש להם שתן / גלוקוז בדם ≥250 מ"ג / ד"ל לפחות יומיים רצופים.
הערה: עבור כל עכבר NOD-scid, 10 מיליון splenocytes נדרשים; טחול אחד מניב בדרך כלל 50 מיליון עד 150 מיליון טחול. הטחול בודד מעכברים נטולי פתוגן ששוכנו במתקן מנוטר זקיף. - להרדים את המספר המתאים של עכברי NOD סוכרתיים.
הערה: במחקר זה, העכברים הומתו על ידי שאיפת CO2 ואחריה נקע צוואר הרחם כדי להבטיח מוות. - עם העכבר על גבו, בצע חתך אנכי באורך של כ -2 אינץ 'בעור עם מספריים כירורגיים. פתח את הצד הימני של העכבר מנקודת מבטו של החוקר ואתר את הטחול האדום הבוהק. חותכים בעדינות את הטחול מהלבלב הוורוד ומעבירים אותו לצלחת פטרי סטרילית בקוטר 10 ס"מ המכילה 5 מ"ל PBS סטרילי. חזור על הדיסקציה עם עכברים רבים ככל שיידרש.
הערה: ניתן לשלב טחול ממספר עכברים בצלחת אחת. בצע את השלבים הבאים באמצעות ריאגנטים סטריליים וציוד במכסה מנוע סטרילי. - מועכים את הטחול עם החלק העליון השטוח של בוכנה מזרק סטרילי.
- הניחו מסננת של 40 מיקרומטר או 70 מיקרומטר בצינור חרוטי של 50 מ"ל ושטפו את המסננת עם 5 מ"ל PBS כדי להקדים אותה. מעבירים את מתלה הטחול לתוך המסננת וממשיכים למעוך עדין דרך המסננת. לשטוף את המנה עם 10 מ"ל של PBS ולהעביר את הכביסה למסננת. ממשיכים למעוך עד שהצבע האדום נעלם מהמסננת.
- השליכו את המסננת וסובבו את הצינור ב-500 × גרם למשך 5 דקות ב-RT. הוציאו את הסופרנאטנט עם פיפטה שואפת.
- יש להשהות מחדש את גלולת התא ב-5 מ"ל (עד שלושה טחולים) של חיץ ליזה ACK שחומם מראש ל-RT ולליזה את תאי הדם האדומים למשך 4 דקות. הגדל את הנפח ב 1-2 מ"ל לטחול אם יש צורך בטחול נוסף.
- עצור את התגובה עם 5 מ"ל של מדיה סלולרית NIT-1 (המתוארת לעיל) לכל 5 מ"ל של חיץ ליזיס. העבירו את מתלה התא דרך מסננת טרייה כדי להסיר גושים. השליכו את המסננת וסובבו ב-500 × גרם במשך 5 דקות ב-RT.
- להשהות מחדש את גלולת התא ב 20 מ"ל של PBS, ולספור את התאים. סחרור ב 500 × גרם במשך 5 דקות ב RT. להשעות מחדש את התאים PBS סטרילי בריכוז של 1 × 108 תאים / מ"ל (נפח ההזרקה הוא 0.1 מ"ל / עכבר) ב 1.5 מ"ל צינור תגובה נעילה בטוחה.
- אחסנו את התאים על קרח (לא יותר משעה אחת) או שמרו את התאים ב-RT, והמשיכו מיד להזרקת וריד הזנב.
5. הזרקה תוך ורידית של טחול סוכרתי דרך וריד הזנב לרוחב
- חממו את גופם של עכברי NOD-scid הבוגרים (למשל, על ידי שימוש במנורת חום למשך ~5-10 דקות) כדי להרחיב את הוורידים (זה עוזר להדמיה והזרקה לווריד).
הערה: כדי למנוע התחממות יתר של העכברים, אל תחרוג מהפעם. עקוב תמיד אחר מצב הבריאות. אם העכברים נראים מותשים או חסרי תנועה, כבו מיד את מנורת החום. - חממו את מתלה התא. הכינו מזרק סטרילי (0.3-1.0 מ"ל) עם מחט סטרילית (27-30 גרם, 0.3 מ"מ / 0.5 אינץ' או פחות), או השתמשו במזרק אינסולין סטרילי של 0.5 מ"ל עם מחט 0.3 מ"מ (0.5 אינץ'). הקפידו תמיד לשמור על המחט סטרילית ולהשתמש במגש סטרילי אם יש להניח את המזרק בין הזרקות.
- השהה מחדש את תמיסת הטחול לפני כל הזרקה. עבור כל עכבר, צייר 100 μL של תרחיף הטחול שחומם מראש ומעורב לתוך המזרק. יש לוודא שאין בועות אוויר במזרק או בתרחיף.
הערה: יש להקפיד להכין את כל הציוד והציוד (מגבוני אלכוהול לחיטוי, מזרק עמוס בטחול להזרקה, וכלוב טרי להפרדת עכברים מוזרקים) לפני הכנסת העכבר למכשיר הריסון. - מקם את העכבר בהתקן הריסון. לכדו את הזנב ביד הלא דומיננטית ואתרו את אחד משני ורידי הזנב הרוחביים. סובבו את הזנב בעדינות במידת הצורך. נגבו את הזנב במגבון חיטוי (70% אלכוהול איזופרופיל) כדי לנקות את העור ולהגביר את הנראות של הווריד.
- הכנס את המחט בזווית חדה לאזור המרכזי של הזנב עם היד הדומיננטית. כאשר שיפוע המחט פונה כלפי מעלה, החלק את המחט כמה מילימטרים דרך העור.
הערה: יש לוודא שהמחט מקבילה לווריד וממוקמת מעט מתחת לעור. היו מוכנים לתנועות פתאומיות של העכבר/זנב מיד לאחר החדירה לדופן העור/כלי הדם. החדרה מוצלחת של המחט צריכה להרגיש כמו "החלקה חלקה" לתוך הווריד. אם יש צורך בניסיון נוסף, התקדם הלאה במעלה הזנב לכיוון הגוף. - הפעל לחץ עדין על המזרק כדי להזריק את מתלה הטחול. אין לאפשר למחט לנוע פנימה או החוצה בעת ההזרקה. זריקות מוצלחות הן חלקות ללא תחושת לחץ גב במהלך ההזרקה ומסומנות על ידי זרימת דם שקופה/לבנה מיד לאחר ההזרקה.
- שחררו בעדינות את המחט מהווריד, והפעילו לחץ קל על הזנב עם מגבון חיטוי עד שהדימום ייפסק. שחררו את העכבר ממכשיר הריסון והעבירו אותו בעדינות לכלוב טרי.
הערה: הזריקו שניים עד שלושה עכברי ביקורת שאינם מקבלים השתלת תאי NIT-1 עם טחול כדי לאשר את הפוטנציאל של הטחול האוטו-תגובתי לגרום לסוכרת, אשר לוקח בערך 2-4 שבועות לאחר ההזרקה.
6. הדמיה ביולומינסנטית In vivo של שתלי NIT-1
הערה: צלם את השתלים פעם עד פעמיים בשבוע. ביום ההשתלה, המתן לפחות שעתיים לאחר ההשתלה כדי לאפשר לשתלים להתיישב ולהבטיח ביטוי יציב של לוציפראז. אם הזמן הוא גורם מגביל, ניתן לבצע את המדידה הראשונית ביום הראשון במקום. לוח זמנים מומלץ להדמיה ראשונית הוא יום 0 או יום 1 לאחר ההזרקה, יום 5, יום 10, יום 14, יום 18 ויום 25. התאם את לוח הזמנים, עם זאת, בהתבסס על התקדמות אוטואימוניות כפי שנשפט על ידי אובדן אות bioluminescent.
- הכינו תמיסת D-luciferin במינון 15 מ"ג/מ"ל ב-PBS של Dulbecco. יש להתסיס ב-RT כדי להתמוסס, ולסנן סטרילי (0.22 מיקרומטר). יש לאחסן 1 מ"ל aliquots ב -20 ° C, ולהפשיר לפי הצורך.
הערה: ניתן להקפיא מחדש את ה- aliquots. - לפחות 5 דקות לפני ההדמיה, הזריקו את העכברים תוך צפקית באמצעות מזרק 1 מ"ל ומחט 26 גרם עם תמיסת D-luciferin במינון של 150 מ"ג / ק"ג.
הערה: השתמש במזרק ומחט טריים עבור כל עכבר. - מרדימים את העכברים בשאיפת איזופלורן בהתאם להנחיות המוסדיות. התנאים המומלצים הם 2.5% איזופלורן עם קצב זרימה של 1.5 ליטר/דקה לתוך תא ההפלה, וקצב פינוי של 9 ליטר/דקה.
- לשמן את העיניים של החיה עם משחה אופתלמית כדי למנוע התייבשות.
- פתח את התוכנה המשויכת למכשיר ההדמיה. צור משתמש חדש ו/או התחבר. בלוח הבקרה בפינה השמאלית התחתונה, בחר Initialize (איור 2A). כדי לשמור באופן אוטומטי את נתוני ההדמיה, צור את התיקיות המתאימות במחשב ולאחר מכן בחר רכישה | שמירה אוטומטית ל... (איור 2A). לאחר סיום אתחול המכשיר, הגדר את זמן החשיפה לדקה.
הערה: פרמטרי ההדמיה המלאים מוצגים באיור 2B. - העבירו את העכברים בזה אחר זה מתא ההפלה למכשיר ההדמיה. הניחו את העכבר על בטנו כשגפיו משורבבות, וכיוונו בעדינות את ראשו לתוך חרוט האף. קצב זרימה איזופלורני של 0.25 ליטר/דקה המועבר דרך חרוט אף מתאים לשמירה על הרדמה במהלך ההדמיה. שטח את העכבר בעדינות על ידי לחיצה על מרכז גבו בשתי ידיו ולאחר מכן פיזר את הידיים החוצה ובנפרד.
- בחר רכוש (איור 2B). רשמו את כל הפרטים הרלוונטיים של הניסוי בחלון הנפתח (איור 2C).
הערה: ראו איור 3A לתמונות מייצגות של שלוש נקבות עכברי NOD-scid בנות 8 שבועות שהושתלו עם שני שתלים בנקודות זמן שונות.
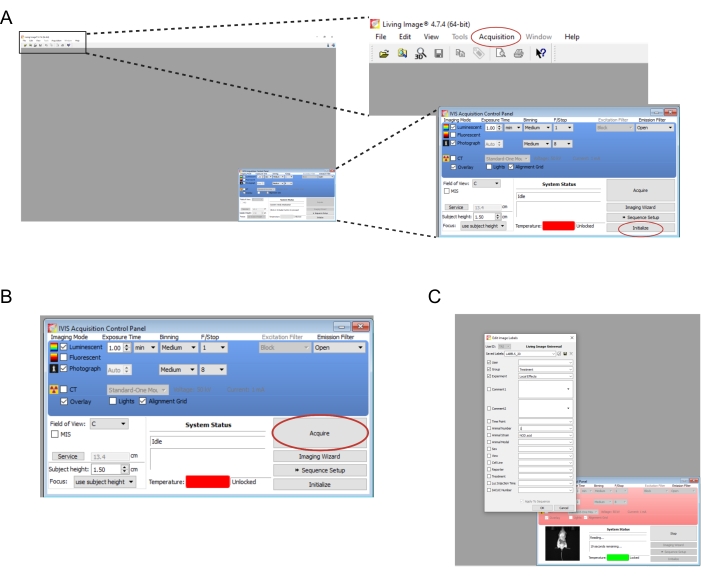
איור 2: צילומי מסך של פקודות התוכנה להדמיית שתלים ביולומינסנטיים . (A) לפני ההדמיה, בחר Initialize כדי להכין את המכשיר. ניתן לשמור את התמונות באופן אוטומטי בתיקיה לפי בחירה על-ידי בחירה באפשרות רכישה | שמירה אוטומטית ל... (B) סקירה כללית של פרמטרי ההדמיה. לאחר מיקום העכבר במכשיר, בחר רכישה. (C) צילום מסך של תיבת הדו-שיח המופיעה במהלך ההדמיה. פרטים כגון נקודת הזמן ומתח העכבר ניתן להזין כאן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
7. ניתוח נתונים
- כמת את האות הביו-לומינסנטי בכל עת לאחר ההדמיה. פתח את התוכנה המשויכת למכשיר ההדמיה. בחר קובץ | פתח ובחר את הקובץ ClickInfo.txt המשויך לעכבר לניתוח.
- בלוח הכלים, בחר כלי החזר השקעה (איור 3B, שלב 1). מהתפריט הנפתח הסגלגל (איור 3B, שלב 1, חץ אדום), בחר את מספר השתלים שהושתלו בעכבר.
- הזיזו את האליפסות כך שיכילו את האות הביו-לומינסנטי מכל שתל, ובחרו ' מדידת החזר השקעה' (איור 3B, שלב 2).
- רשום את הספירה הכוללת עבור כל שתל (איור 3B, שלב 3).
- עבור כל שתל, חלק את האות הביו-לומינסנטי שנמדד בכל נקודת זמן על ידי האות שנמדד בנקודת הזמן הראשונה. דווח על הישרדות השתל כשיעור או אחוז של אות ביולומינסנט שיורי ביחס לאות הביולומינסנטי הראשוני.
הערה: אם השתלים מתרחבים לאחר ההשתלה, היחס או אחוז הישרדות השתל יהיה גדול מ-1 או 100%, בהתאמה. כל העכברים שעוברים השתלות צריכים להיות במעקב אחר השפעות בריאותיות שליליות.
Access restricted. Please log in or start a trial to view this content.
תוצאות
סקירה כללית של הפרוטוקול מתוארת באיור 1. ניתן להשוות את הישרדותם של שני קווי תאים, כגון מוטציה ובקרה שאינה ממוקדת, או שניתן למדוד הישרדות של קו תאים אחד במספר קבוצות עכברים, כגון עכברים שטופלו בתרופות לעומת קבוצת ביקורת שטופלה ברכב. איור 3A מראה שלוש נקבות עכ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
סוכרת סוג 1 היא מחלה הרסנית שאין לה כיום תרופה. טיפול בתחליפי תאי בטא מציע טיפול מבטיח לחולים במחלה זו, אך המחסום הקריטי לאסטרטגיה זו הוא הפוטנציאל להתקפה אוטואימונית חוזרת ונשנית נגד תאי הבטא המושתלים. ההנדסה הגנטית של תאי SC-beta כדי להפחית את הנראות או הרגישות החיסונית שלהם היא פתרון אפשרי ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים כי אין להם ניגודי עניינים.
Acknowledgements
אנו מודים לד"ר אריקה פ. קאי ולד"ר יוקי אישיקאווה על פיתוח השיטה המתוארת בפרוטוקול זה (ראה הערה 11). המחקר במעבדות של ס.ק. ופ.י. נתמך על ידי מענקים מהמכונים הלאומיים לבריאות (NIH) (R01DK120445, P30DK036836), JDRF, מכון תאי הגזע של הרווארד וקרן ביטסון. ט.ס. נתמכה על ידי מלגת פוסט-דוקטורט מהמכון הלאומי לסוכרת ומחלות עיכול וכליות (NIDDK) (T32 DK007260-45), וק.ב. נתמכה בחלקה על ידי מלגה מקרן מרי ק. איאקוקה.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin, 0.53 mM EDTA | Corning | 25-052-CI | |
| 293FT | Invitrogen | R70007 | Fast-growing, highly transfectable clonal isolate derived from human embryonal kidney cells transformed with the SV40 large T antigen |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| Alcohol prep pads, 70% Isopropyl alcohol | Amazon/Ever Ready First Aid | B08NWF31DX | |
| BD 5ml Syringe Luer-Lok Tip | BD | 309646 | |
| BD PrecisionGlide Needle 26G x 5/8 (0.45 mm x 16 mm) Sub-Q | BD | 305115 | |
| BD 1 mL TB Syringe Slip Tip | BD | 309659 | |
| Blasticidin S HCl | Corning | 30-100-RB | |
| Cell strainer premium SureStrain, 70 µm, sterile | Southern Labware | C4070 | Or use similar sterile strainer with 40-70um pore size |
| CellDrop automated cell counter | Denovix | CellDrop BF-PAYG | Or use similar cell counter device |
| Corning 100 mL Penicillin-Streptomycin Solution, 100x | Corning | 30-002-CI | |
| Disposable Aspirating Pipets, Polystyrene, Sterile, Capacity=2 mL | VWR | 414004-265 | Or use similar aspirating pipette |
| D-Luciferin, Potassium Salt , Molecular Biology Grade, Powder, >99% | Goldbio | LUCK-100 | |
| DMEM, high glucose, pyruvate, no glutamine | Gibco | 10313039 | |
| Falcon BD tubes, 50 mL | Fisher Scientific | 14-959-49A | |
| Fetal Bovine Serum | Gibco | 10437-028 | |
| Forceps premium for tissues, 1 x 2 teeth 5 in, German Steel | Fisher Scientific | 13-820-074 | |
| Glucose urine test strip | California Pet Pharmacy | u-tsg100 | Or use similar test strip for glucose measurments in urine/blood |
| GlutaMAX–1 (100x) | Gibco | 35050-061 | |
| Infrared heating lamp | Cole Parmer | 03057-00 | Or use similar infrared lamp |
| Insulin syringe 0.5 mL, U-100 29 G 0.5 in | Becton Dickinson | 309306 | |
| Isoflurane, USP | Piramal Critical Care | 6679401725 | |
| IVIS Spectrum in vivo imaging system | Perkin Elmer | 124262 | Instrument for non-invasively collecting bioluminescent images of transplanted cells |
| Living Image Analysis Software | Perkin Elmer | 128113 | Software for collecting and quantifying bioluminescent signal |
| Microcentrifuge tubes seal-rite, 1.5 mL | USA Scientific | 1615-5510 | Or use similar sterile microcentrifuge tubes |
| NIT-1 | ATCC | CRL-2055 | Pancreatic beta-celll line derived from NOD/Lt mice |
| NOD.Cg-Prkdcscid/J | The Jackson Laboratory | 001303 | Mice homozygous for the severe combined immune deficiency spontaneous mutation Prkdcscid, commonly referred to as scid, are characterized by an absence of functional T cells and B cells, lymphopenia, hypogammaglobulinemia, and a normal hematopoietic microenvironment. |
| NOD/ShiLtJ | The Jackson Laboratory | 001976 | The NOD/ShiLtJ strain of mice (commonly called NOD) is a polygenic model for autoimmune type 1 diabetes |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010031 | No calcium, no magnesium, no phenol red |
| pCMV-VSV-G | Addgene | 8454 | |
| pLenti-luciferase-blast | Made in-house | Plasmid available upon request | See Supplemental File 1 |
| pMD2.G | Addgene | 12259 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polyethylenimine, Linear, MW 25,000, Transfection Grade (PEI 25K) | Fisher Scientific | NC1014320 | |
| pRSV-Rev | Addgene | 12253 | |
| Restrainer for rodents, broome-style round 1 in | Fisher Scientific | 01-288-32A | |
| Scissors, sharp-pointed | Fisher Scientific | 08-940 | Or use other scissors made of surgical-grade stainless steel |
| Tissue-culture treated culture dishes | Millipore Sigma | CLS430167-20EA | Or use other sterile cell culture-treated Petri dishes |
| Tweezers/Forceps, fine precision medium tipped | Fisher Scientific | 12-000-157 |
References
- Katsarou, A., et al. Type 1 diabetes mellitus. Nature Reviews Disease Primers. 3, 17016(2017).
- Shapiro, A. M., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews Endocrinology. 13 (5), 268-277 (2017).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Russ, H. A., et al. Controlled induction of human pancreatic progenitors produces functional beta-like cells in vitro. EMBO Journal. 34 (13), 1759-1772 (2015).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nature Biotechnology. 32 (11), 1121-1133 (2014).
- Vertex Announces Positive Day 90 Data for the First Patient in the Phase 1_2 Clinical Trial Dosed With VX-880, a Novel Investigational Stem Cell-Derived Therapy for the Treatment of Type 1 Diabetes. Businesswire. , Available from: https://www.businesswire.com/news/home/20211018005226/en/Vertex-Announces-Positive-Day-90-Data-for-the-First-Patient-in-the-Phase-12-Clinical-Trial-Dosed-With-VX-880-a-Novel-Investigational-Stem-Cell-Derived-Therapy-for-the-Treatment-of-Type-1-Diabetes (2021).
- Gamble, A., Pepper, A. R., Bruni, A., Shapiro, A. M. J. The journey of islet cell transplantation and future development. Islets. 10 (2), 80-94 (2018).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the Non Obese Diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Hamaguchi, K., Gaskins, R. H., Leiter, E. H. NIT-1, a pancreatic β-cell line established from a transgenic NOD/Lt mouse. Diabetes. 40 (7), 842-849 (1991).
- Christianson, S. W., Shultz, L. D., Leiter, E. D. Adoptive transfer of diabetes into immunodeficient NOD-scid/scid mice: Relative contribution of CD4+ and CD8+ T-cells from diabetogenic versus prediabetic NOD.NON-Thy1a donors. Diabetes. 42 (1), 44-55 (1993).
- Cai, E. P., et al. Genome-scale in vivo CRISPR screen identifies RNLS as a target for beta cell protection in type 1 diabetes. Nature Metabolism. 2 (9), 934-945 (2020).
- Parent, A. V., et al. Selective deletion of human leukocyte antigens protects stem cell-derived islets from immune rejection. Cell Reports. 36 (7), 109538(2021).
- Brehm, M. A., et al. Lack of acute xenogeneic graft-versus-host disease, but retention of T-cell function following engraftment of human peripheral blood mononuclear cells in NSG mice deficient in MHC class I and II expression. FASEB Journal. 33 (3), 3137-3151 (2019).
- Abdulreda, M. H., et al. In vivo imaging of type 1 diabetes immunopathology using eye-transplanted islets in NOD mice. Diabetologia. 62 (7), 1237-1250 (2019).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved