Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Биолюминесцентный мониторинг выживаемости трансплантата в адаптивной модели переноса аутоиммунного диабета у мышей
В этой статье
Резюме
Этот протокол описывает простой и минимально инвазивный метод трансплантации и визуализации клеток NIT-1 у мышей с комбинированным иммунодефицитом, не страдающих ожирением (NOD) и тяжелой формой иммунодефицита, которым подвергались воздействию спленоцитов, очищенных от мышей со спонтанным диабетом NOD.
Аннотация
Сахарный диабет 1 типа характеризуется аутоиммунным разрушением инсулин-продуцирующих бета-клеток поджелудочной железы. Перспективным методом лечения этого заболевания является трансплантация бета-клеток, полученных из стволовых клеток. Однако генетические модификации могут быть необходимы для защиты трансплантированных клеток от стойкого аутоиммунитета. Модели мышей с диабетом являются полезным инструментом для предварительной оценки стратегий защиты трансплантированных клеток от аутоиммунной атаки. Здесь описан минимально инвазивный метод трансплантации и визуализации клеточных трансплантатов в адаптивной модели переноса диабета у мышей. В этом протоколе клетки из линии бета-клеток поджелудочной железы мыши NIT-1, экспрессирующие трансген люциферазы светлячка luc2 , подкожно трансплантируются иммунодефицитным мышам с диабетом (NOD) и тяжелым комбинированным иммунодефицитом (scid) без ожирения. Этим мышам одновременно вводят внутривенно спленоциты от спонтанно диабетических мышей NOD для передачи аутоиммунитета. Трансплантаты визуализируются через регулярные промежутки времени с помощью неинвазивной биолюминесцентной визуализации для мониторинга выживаемости клеток. Выживание мутантных клеток сравнивается с выживанием контрольных клеток, трансплантированных той же мыши.
Введение
Диабет 1 типа (СД1) вызывается аутоиммунным разрушением инсулин-продуцирующих бета-клеток поджелудочной железы. Потеря бета-клеточной массы приводит к дефициту инсулина и гипергликемии. Пациенты с СД1 полагаются на многократные ежедневные инъекции экзогенного инсулина и испытывают эпизоды тяжелой гипергликемии и гипогликемии на протяжении всей своей жизни. Осложнения, связанные с этими эпизодами, включают диабетическую ретинопатию, снижение функции почек и невропатию1.
Инъекции инсулина являются лечением, но не лекарством от СД1. Однако замена потерянной бета-клеточной массы может обратить вспять болезнь, позволяя пациентам вырабатывать свой собственный инсулин. Тем не менее, предложение островков трупного донора ограничено2. Островки, полученные из стволовых клеток (SC-островки), могут обеспечить практически неограниченный запас бета-клеток для трансплантации. Несколько групп продемонстрировали, что эмбриональные стволовые клетки человека (ЭСК) и индуцированные плюрипотентные стволовые клетки (ИПСК) могут быть дифференцированы с образованием функциональных бета-подобных клеток 3,4,5. Многообещающие данные ранних клинических испытаний указывают на то, что эти клетки сохраняют свою функцию после трансплантации и могут позволить пациентам стать инсулинонезависимыми6. Однако требуется хроническая иммуносупрессия, что повышает их восприимчивость к раку и инфекциям. Кроме того, иммунодепрессанты могут быть цитотоксичными для трансплантатов в долгосрочной перспективе7. Чтобы устранить необходимость иммуносупрессии, SC-островки могут быть генетически модифицированы, чтобы защитить их от рецидивирующего аутоиммунитета, а также аллоиммунитета после трансплантации.
Исследования стволовых клеток очень требовательны к затратам и трудозатратам. Клеточные линии мышей и животные модели являются полезными инструментами для первоначальной идентификации и экспериментальной проверки стратегий защиты трансплантированных клеток от аутоиммунитета. У мыши NOD развивается спонтанный аутоиммунный диабет со многими сходствами с человеческим T1D8, а клеточная линия инсулиномы NIT-1 имеет общий генетический фон с этим мышиным штаммом9. Диабет может быть адоптивно перенесен на родственный иммунодефицитный штамм мыши NOD-scid посредством инъекции диабетических спленоцитов от мышей NOD с целью временной синхронизации начала диабета у реплицированных экспериментальных мышей10. Эта модель может быть использована для относительно быстрой и недорогой идентификации генетических мишеней для дальнейшей валидации в SC-островках. Недавно этот метод был применен для идентификации и проверки RNLS, мишени, которая, как было установлено, защищает первичные островки человека от аутоиммунитета in vivo и островки, полученные из iPSC, от стресса бета-клеток in vitro11. Здесь описан простой протокол трансплантации генетически модифицированных клеток NIT-1 и неинвазивного мониторинга их выживаемости в адаптивной модели переноса аутоиммунного диабета у мышей.
Access restricted. Please log in or start a trial to view this content.
протокол
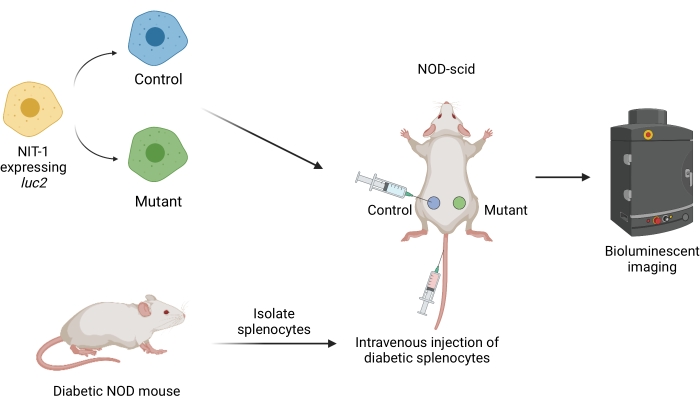
Рисунок 1: Рабочий процесс трансплантации и визуализации трансплантатов в адаптивной модели переноса диабета у мышей. Клетки NIT-1, экспрессирующие трансген светлячка люциферазу (luc2), пересаживают подкожно мышам NOD-scid. Мышам одновременно вводят аутореактивные спленоциты, выделенные у мыши со спонтанным диабетом NOD. Трансплантаты визуализируются через равные промежутки времени с помощью неинвазивной биолюминесцентной визуализации. Рисунок создан BioRender.com. Сокращения: NOD = диабетик без ожирения; SCID = тяжелый комбинированный иммунодефицит. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Все протоколы ухода за животными и исследований были одобрены и выполнены в соответствии с Институциональным комитетом по уходу за животными и их использованию (IACUC) в Диабетическом центре Джослина. Мыши NOD и NOD-scid могут быть легко получены из коммерческих источников. Все мыши, участвовавшие в этом исследовании, содержатся в учреждении под дозорным наблюдением. Подробную информацию обо всех материалах, животных, инструментах и программном обеспечении, используемых в этом протоколе, см. в таблице материалов .
1. Проектирование и обслуживание клеточных линий НИТ-1
- Поддерживайте клеточные линии NIT-1, которые имеют общий генетический фон с мышами NOD, и клетки 293FT в чашках, обработанных тканевой культурой, в DMEM, содержащих 4,5 г / л глюкозы с добавлением 10% эмбриональной бычьей сыворотки и 1% пенициллина / стрептомицина в инкубаторе 37 ° C с 5% CO2.
- Увеличьте количество клеток 293FT до слияния 70-80% для трансфекции.
- На 10-сантиметровую чашку из 293FT-клеток объедините 10 мкг бласта pLenti-люциферазы (см. Дополнительный файл 1), который экспрессирует трансген люциферазы светлячка (luc2) под контролем конститутивно активного промотора EF1α, по 2 мкг каждой из упаковочных плазмид pMD2.G, pMDLg/pRRE и pRSV-Rev, 4 мкг плазмиды белка оболочки pCMV-VSV-G и 60 мкг линейного полиэтиленимина (PEI) в 1 мл ДМЭМ без сыворотки. Отрегулируйте количество в зависимости от количества клеток, подлежащих трансфицированию.
- Оставьте ДНК, PEI и DMEM при комнатной температуре (RT) на 20 минут, а затем добавьте их в клетки 293FT.
- Собирают среду, содержащую лентивирусные частицы, через 48 ч после трансфекции.
- Трансдуцируют клетки NIT-1 при ~80% слиянии с 1 мл среды, содержащей лентивирусные частицы, на 106 клеток в течение 48-72 ч.
- Выберите клетки, экспрессирующие люциферазу, с 5 мкг / мл бластицидина в течение 48 часов.
- Далее генетически модифицировать клетки, экспрессирующие люциферазу, в соответствии с экспериментальным вопросом. Включите экспрессирующую люциферазу контрольную клеточную линию дикого типа или нецелевую контрольную клеточную линию для сравнения.
ПРИМЕЧАНИЕ: Примеры модификаций генов-мишеней включают нокаут CRISPR, CRISPRa/i, нокдаун шРНК и сверхэкспрессию.
2. Подготовка клеток NIT-1 к трансплантации
- Выращивайте клетки, экспрессирующие люциферазу, до тех пор, пока они не будут сливаться на 80-90%.
- Удалите питательную среду и промойте клетки фосфатно-буферным физиологическим раствором (PBS, 5 мл для 10-сантиметровой чашки).
- Добавляйте 1 мл 0,05% трипсина-ЭДТА в каждое блюдо в течение 2 минут.
- Нейтрализуют трипсин 5 мл питательной среды.
- С помощью пипетки смойте клетки с посуды и перенесите их в коническую трубку.
ПРИМЕЧАНИЕ: Ячейки из нескольких блюд одной и той же клеточной линии могут быть объединены. - Подсчитайте клетки с помощью окрашивания, такого как трипановый синий, вручную с помощью гемоцитометра или автоматически с помощью автоматического счетчика клеток.
- Центрифугу при 250 × г в течение 5 мин при RT и удалить надосадочную жидкость с помощью аспирационной пипетки.
- Ресуспендировать клеточную гранулу в PBS в концентрации 5 ×10 7 клеток/мл (107 клеток на клеточную линию на мышь будут пересажены в объеме 200 мкл).
- Держите клетки на льду (до 3 часов) до трансплантации.
3. Трансплантация клеток NIT-1 мышам NOD-scid
- Анестезируйте мышей-реципиентов (8-10-недельные мыши NOD-scid того же пола, что и мыши, используемые для выделения спленоцитов) путем ингаляции изофлурана в нокдаун-камере. Подайте 2,5% изофлурана в камеру при расходе 1,5 л/мин и скорости откачки 9 л/мин.
- Смазывайте глаза животного офтальмологической мазью, чтобы предотвратить пересыхание.
- Используя электробритву с защитным кожухом, удалите волосы со спины (спинной стороны) мышей, чтобы обнажить кожу. Выбритая область трансплантата будет примерно 1 х 2 дюйма. Верните бритых мышей в нокдаун-камеру до пересадки.
- Переносите мышей по одной на чистую поверхность с изофлурановым носовым конусом. Аккуратно направьте голову мыши в носовой конус. Используйте скорость потока изофлурана 0,25 л/мин для поддержания анестезии во время трансплантации.
- Протрите область пересадки изопропиловым спиртом, чтобы удалить выпавшие волосы и продезинфицировать кожу.
- Перед загрузкой шприца убедитесь, что клетки полностью ресуспендированы. Наберите избыточный объем (>300 мкл) клеток в стерильный шприц объемом 1 мл иглой 26 г. Удалите все пузырьки; затем верните лишние клетки в пробирку так, чтобы в шприце оставалось 300 мкл клеточной суспензии.
- Используя пару изогнутых щипцов, удерживаемых в недоминантной руке, осторожно приподнимите кожу с одной стороны (слева или справа) спины мыши, чтобы облегчить доступ к подкожному пространству.
- Используя доминирующую руку, расположите шприц параллельно корональной и сагиттальной плоскостям тела мыши. Направив иглу к голове мыши, вставьте иглу в кожу возле задних конечностей и осторожно направьте ее в подкожное пространство. Следите за тем, чтобы вся игла оставалась под кожей и не протыкалась насквозь.
- Отрегулируйте щипцы, чтобы аккуратно удерживать кожу вокруг основания иглы. Медленно дозируйте небольшое количество клеточной суспензии (<50 мкл) и убедитесь, что в месте инъекции под кожей образуется небольшая выпуклость. Продолжайте вводить клеточную суспензию до тех пор, пока 200 мкл не будет доставлено в подкожное пространство.
- Удерживая щипцы на месте и удерживая иглу параллельно телу мыши, медленно извлеките иглу. После того, как игла была удалена, держите кожу закрытой щипцами в течение нескольких секунд, чтобы предотвратить утечку клеток из колотой раны.
- Если оценивается генетическая модификация, повторите трансплантацию на противоположную сторону мыши, используя другой шприц, чтобы каждой мыши вводили как мутантные, так и контрольные клетки, причем одна клеточная линия слева, а другая справа. Если пересаживается только одна клеточная линия, вводите клетки только с одной стороны.
- После пересадки пересадите каждую мышь в свежую клетку. Дайте каждой мыши полностью оправиться от анестезии, прежде чем добавлять дополнительных мышей в клетку.
ПРИМЕЧАНИЕ: Мыши выздоравливают, когда они возобновляют нормальную деятельность и не проявляют признаков летаргии или нарушения движения. - Оценивайте состояние здоровья мышей ежедневно в течение всего эксперимента после трансплантации. Если трансплантаты образуют большую выпуклость или мыши становятся слабыми и вялыми, измерьте уровень глюкозы в крови и обеспечьте 10% (мас. / мас.) сахарозной воды ad libitum всем мышам с гипогликемией. Следуйте всем ветеринарным рекомендациям и усыпляйте всех мышей с продолжающимся плохим состоянием тела в соответствии с руководящими принципами учреждения. В этом исследовании мышей усыпляли путем вдыхания CO2 с последующим вывихом шейки матки.
4. Выделение и очистка аутореактивных спленоцитов
- Определите 10-16-недельных мышей мужского или женского пола NOD с недавним (менее 10 дней) диабетом с помощью тест-полосок на глюкозу в моче (или крови). Мыши NOD считаются диабетиками, если у них уровень глюкозы в моче / крови ≥250 мг / дл в течение как минимум 2 дней подряд.
ПРИМЕЧАНИЕ: Для каждой мыши NOD-scid необходимо 10 миллионов спленоцитов; Одна селезенка обычно дает от 50 до 150 миллионов спленоцитов. Спленоциты были выделены от мышей, свободных от патогенов, размещенных в учреждении под дозорным наблюдением. - Усыпьте соответствующее количество мышей NOD с диабетом.
ПРИМЕЧАНИЕ: В этом исследовании мышей усыпляли путем вдыхания CO2 с последующим вывихом шейки матки, чтобы обеспечить смерть. - Положив мышь на спину, сделайте хирургическими ножницами вертикальный разрез на коже длиной примерно 2 дюйма. Откройте правую сторону мыши с точки зрения исследователя и найдите ярко-красную селезенку. Аккуратно отрежьте селезенку от розовой поджелудочной железы и перенесите ее в стерильную 10-сантиметровую чашку Петри, содержащую 5 мл стерильного PBS. Повторите вскрытие с таким количеством мышей, какое необходимо.
ПРИМЕЧАНИЕ: Селезенку от нескольких мышей можно комбинировать в одной посуде. Выполните следующие действия, используя стерильные реагенты и оборудование в стерильном колпаке. - Разомните селезенку (селезенки) с помощью плоской верхней части стерильного поршня шприца.
- Поместите сетчатый фильтр 40 мкм или 70 мкм в коническую трубку объемом 50 мл и промойте сетчатый фильтр 5 мл PBS, чтобы заправить его. Перенесите суспензию селезенки (суспензий) в сетчатый фильтр и продолжайте осторожное разминание через сетчатое фильтро. Вымойте посуду 10 мл PBS и переложите средство на ситечко. Продолжайте растирать до тех пор, пока красный цвет не исчезнет из ситечка.
- Выбросьте ситечко и раскрутите пробирку при 500 × г в течение 5 мин при RT. Удалите надосадочную жидкость с помощью аспирационной пипетки.
- Ресуспендировать клеточную гранулу в 5 мл (до трех селезенок) буфера для лизиса ACK, предварительно нагретого до RT, и лизировать эритроциты в течение 4 мин. Увеличьте объем на 1-2 мл на селезенку, если необходимы дополнительные селезенки.
- Остановите реакцию с 5 мл клеточной среды NIT-1 (описанной выше) на 5 мл буфера для лизиса. Пропустите клеточную суспензию через свежее ситечко, чтобы удалить комки. Выбросьте ситечко и вращайте при 500 × г в течение 5 минут при RT.
- Ресуспендируйте клеточную гранулу в 20 мл PBS и подсчитайте клетки. Отжим при 500 × г в течение 5 мин при ЛТ. Ресуспендируют клетки в стерильном PBS в концентрации 1 × 108 клеток/мл (объем инъекции 0,1 мл/мышь) в реакционной пробирке с безопасным замком 1,5 мл.
- Храните клетки на льду (не более 1 часа) или держите клетки в состоянии RT и немедленно приступайте к инъекции в хвостовую вену.
5. Внутривенное введение диабетических спленоцитов через боковую хвостовую вену
- Разогрейте тело взрослых мышей-реципиентов NOD-scid (например, с помощью тепловой лампы в течение ~ 5-10 минут) для вазодилатации вен (это помогает для визуализации и инъекции в вену).
ПРИМЕЧАНИЕ: Чтобы избежать перегрева мышей, не превышайте это время. Всегда следите за состоянием здоровья. Если мыши кажутся истощенными или неподвижными, немедленно выключите нагревательную лампу. - Разогрейте клеточную суспензию. Подготовьте стерильный шприц (0,3–1,0 мл) со стерильной иглой (27–30 г, 0,3 мм/0,5 дюйма или меньше) или используйте стерильный инсулиновый шприц объемом 0,5 мл с иглой 0,3 мм (0,5 дюйма). Всегда держите иглу стерильной и используйте стерильный лоток, если шприц необходимо опустить между инъекциями.
- Ресуспендируйте раствор спленоцитов перед каждой инъекцией. Для каждой мыши наберите в шприц 100 мкл предварительно подогретой и смешанной суспензии спленоцитов. Убедитесь, что в шприце или в суспензии нет пузырьков воздуха.
ПРИМЕЧАНИЕ: Убедитесь, что все оборудование и расходные материалы подготовлены (спиртовые салфетки для дезинфекции, шприц, загруженный спленоцитами для инъекций, и свежая клетка для отделения инъецированных мышей), прежде чем помещать мышь в удерживающее устройство. - Поместите мышь в удерживающее устройство. Захватите хвост недоминантной рукой и найдите одну из двух боковых жилок хвоста. При необходимости аккуратно поверните хвост. Протрите хвост дезинфицирующей салфеткой (70% изопропиловый спирт), чтобы очистить кожу и увеличить видимость вены.
- Введите иглу под острым углом в центральную область хвоста доминирующей рукой. Скос иглы вверх проведите иглой на несколько миллиметров по коже.
ПРИМЕЧАНИЕ: Убедитесь, что игла параллельна вене и находится немного под кожей. Будьте готовы к резким движениям мыши/хвоста сразу после проникновения в кожу/стенку сосуда. Успешное введение иглы должно ощущаться как «плавное скольжение» в вену. Если необходима еще одна попытка, двигайтесь дальше вверх по хвосту к телу. - Слегка надавите на шприц, чтобы ввести суспензию спленоцитов. Не позволяйте игле двигаться дальше внутрь или наружу во время инъекции. Успешные инъекции проходят гладко, без ощущения противодавления во время инъекции и обозначаются прозрачным / белым кровотоком сразу после инъекции.
- Осторожно выпустите иглу из вены и слегка надавите на хвост дезинфицирующей салфеткой, пока кровотечение не остановится. Освободите мышь от удерживающего устройства и аккуратно перенесите ее в только что подготовленную клетку.
ПРИМЕЧАНИЕ: Введите две-три контрольным мышам, которые не получают трансплантацию клеток NIT-1, спленоциты, чтобы подтвердить способность аутореактивных спленоцитов вызывать диабет, что занимает примерно 2-4 недели после инъекции.
6. Биолюминесцентная визуализация трансплантатов NIT-1 in vivo
ПРИМЕЧАНИЕ: Визуализируйте трансплантаты один-два раза в неделю. В день трансплантации подождите не менее 2 ч после трансплантации, чтобы трансплантаты осядли и обеспечили стабильную экспрессию люциферазы. Если время является ограничивающим фактором, первоначальное измерение может быть проведено на 1-й день. Рекомендуемый начальный график визуализации: День 0 или День 1 после инъекции, День 5, День 10, День 14, День 18 и День 25. Однако скорректируйте график в зависимости от прогресса аутоиммунитета, если судить по потере биолюминесцентного сигнала.
- Приготовьте раствор D-люциферина 15 мг / мл в PBS Дульбекко. Перемешивают при ЛТ до растворения и стерильно фильтруют (0,22 мкм). Храните 1 мл аликвот при -20 ° C и размораживайте по мере необходимости.
ПРИМЕЧАНИЕ: Аликвоты могут быть повторно заморожены. - По крайней мере, за 5 минут до визуализации вводите мышам внутрибрюшинно с помощью шприца объемом 1 мл и иглы 26 г раствора D-люциферина в дозе 150 мг / кг.
ПРИМЕЧАНИЕ: Используйте свежий шприц и иглу для каждой мыши. - Анестезируйте мышей ингаляцией изофлурана в соответствии с руководящими принципами учреждения. Рекомендуемые условия - 2,5% изофлуран с расходом 1,5 л/мин в нокдаун-камеру и скоростью откачки 9 л/мин.
- Смазывайте глаза животного офтальмологической мазью, чтобы предотвратить пересыхание.
- Откройте программное обеспечение, связанное с прибором визуализации. Создайте нового пользователя и/или войдите в систему. На панели управления в правом нижнем углу выберите Initialize (рисунок 2A). Чтобы автоматически сохранить данные образа, создайте соответствующие папки на компьютере, а затем выберите Приобретение | Автосохранение в... (Рисунок 2А). После того, как прибор завершит инициализацию, установите время экспозиции на 1 минуту.
ПРИМЕЧАНИЕ: Полные параметры визуализации показаны на рисунке 2B. - Переносите мышей по одной из нокдаун-камеры в прибор визуализации. Положите мышь на живот с растопыренными конечностями и осторожно направьте ее голову в носовой конус. Скорость потока изофлурана 0,25 л/мин, доставляемая через носовой конус, подходит для поддержания анестезии во время визуализации. Аккуратно расплющите мышь, нажав обеими руками на центр ее спины, а затем раздвинув руки наружу и в стороны.
- Выберите Acquire (рисунок 2B). Запишите все соответствующие детали эксперимента во всплывающем окне (рис. 2C).
ПРИМЕЧАНИЕ: На рисунке 3A представлены репрезентативные изображения трех 8-недельных самок мышей NOD-scid, которым пересадили два трансплантата в разные моменты времени.
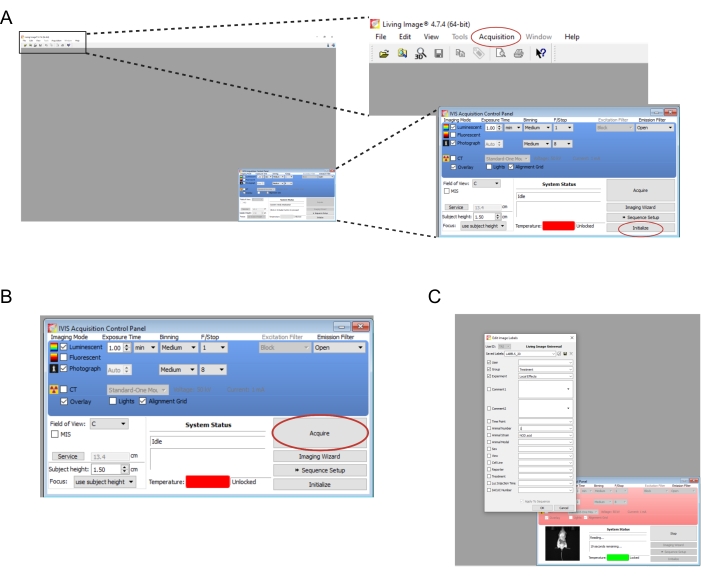
Рисунок 2: Скриншоты программных команд для визуализации биолюминесцентных трансплантатов. (A) Перед визуализацией выберите «Инициализировать », чтобы подготовить прибор. Изображения можно автоматически сохранить в выбранную папку, выбрав «Приобретение » | Автосохранение в... (B) Обзор параметров визуализации. После того, как мышь будет помещена в прибор, выберите «Приобрести». (C) Снимок экрана: диалоговое окно, всплывающее во время создания изображения. Здесь могут быть введены такие детали, как момент времени и напряжение мыши. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
7. Анализ данных
- Количественно оцените биолюминесцентный сигнал в любое время после получения изображения. Откройте программное обеспечение, связанное с прибором визуализации. Выберите Файл | Откройте и выберите файл ClickInfo.txt , связанный с анализируемой мышью.
- В палитре инструментов выберите ROI Tools (рисунок 3B, шаг 1). В выпадающем меню овального вида (рис. 3B, шаг 1, красная стрелка) выберите количество трансплантатов, которые были пересажены мыши.
- Переместите овалы так, чтобы они содержали биолюминесцентный сигнал от каждого трансплантата, и выберите «Измерить рентабельность инвестиций» (рис. 3B, шаг 2).
- Запишите общее количество для каждого трансплантата (рисунок 3B, шаг 3).
- Для каждого трансплантата разделите биолюминесцентный сигнал, измеренный в каждый момент времени, на сигнал, измеренный в первый момент времени. Сообщайте о выживаемости трансплантата как о доле или проценте остаточного биолюминесцентного сигнала по отношению к исходному биолюминесцентному сигналу.
ПРИМЕЧАНИЕ: Если трансплантаты расширяются после трансплантации, коэффициент или процент приживаемости трансплантата будет больше 1 или 100% соответственно. Все мыши, которые получают трансплантаты, должны контролироваться на предмет неблагоприятных последствий для здоровья.
Access restricted. Please log in or start a trial to view this content.
Результаты
Обзор протокола приведен на рисунке 1. Выживаемость двух клеточных линий, таких как мутантный и нецелевой контроль, может быть сравнена, или выживаемость одной клеточной линии может быть измерена в нескольких группах мышей, таких как мыши, обработанные лекарственными п?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
СД1 является разрушительным заболеванием, от которого в настоящее время не существует лекарства. Заместительная терапия бета-клетками предлагает многообещающее лечение для пациентов с этим заболеванием, но критическим препятствием для этой стратегии является возможность рецидивиру...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Мы благодарим д-ра Эрику. Кай и д-ра Юки Исикаву за разработку метода, описанного в этом протоколе (см. ссылку 11). Исследования в лабораториях S.K. и P.Y. поддерживаются грантами Национальных институтов здравоохранения (NIH) (R01DK120445, P30DK036836), JDRF, Гарвардского института стволовых клеток и Фонда Битсона. Т.С. был поддержан докторской стипендией Национального института диабета, болезней органов пищеварения и почек (NIDDK) (T32 DK007260-45), а К.Б. был частично поддержан стипендией Фонда Мэри К. Якокка.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin, 0.53 mM EDTA | Corning | 25-052-CI | |
| 293FT | Invitrogen | R70007 | Fast-growing, highly transfectable clonal isolate derived from human embryonal kidney cells transformed with the SV40 large T antigen |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| Alcohol prep pads, 70% Isopropyl alcohol | Amazon/Ever Ready First Aid | B08NWF31DX | |
| BD 5ml Syringe Luer-Lok Tip | BD | 309646 | |
| BD PrecisionGlide Needle 26G x 5/8 (0.45 mm x 16 mm) Sub-Q | BD | 305115 | |
| BD 1 mL TB Syringe Slip Tip | BD | 309659 | |
| Blasticidin S HCl | Corning | 30-100-RB | |
| Cell strainer premium SureStrain, 70 µm, sterile | Southern Labware | C4070 | Or use similar sterile strainer with 40-70um pore size |
| CellDrop automated cell counter | Denovix | CellDrop BF-PAYG | Or use similar cell counter device |
| Corning 100 mL Penicillin-Streptomycin Solution, 100x | Corning | 30-002-CI | |
| Disposable Aspirating Pipets, Polystyrene, Sterile, Capacity=2 mL | VWR | 414004-265 | Or use similar aspirating pipette |
| D-Luciferin, Potassium Salt , Molecular Biology Grade, Powder, >99% | Goldbio | LUCK-100 | |
| DMEM, high glucose, pyruvate, no glutamine | Gibco | 10313039 | |
| Falcon BD tubes, 50 mL | Fisher Scientific | 14-959-49A | |
| Fetal Bovine Serum | Gibco | 10437-028 | |
| Forceps premium for tissues, 1 x 2 teeth 5 in, German Steel | Fisher Scientific | 13-820-074 | |
| Glucose urine test strip | California Pet Pharmacy | u-tsg100 | Or use similar test strip for glucose measurments in urine/blood |
| GlutaMAX–1 (100x) | Gibco | 35050-061 | |
| Infrared heating lamp | Cole Parmer | 03057-00 | Or use similar infrared lamp |
| Insulin syringe 0.5 mL, U-100 29 G 0.5 in | Becton Dickinson | 309306 | |
| Isoflurane, USP | Piramal Critical Care | 6679401725 | |
| IVIS Spectrum in vivo imaging system | Perkin Elmer | 124262 | Instrument for non-invasively collecting bioluminescent images of transplanted cells |
| Living Image Analysis Software | Perkin Elmer | 128113 | Software for collecting and quantifying bioluminescent signal |
| Microcentrifuge tubes seal-rite, 1.5 mL | USA Scientific | 1615-5510 | Or use similar sterile microcentrifuge tubes |
| NIT-1 | ATCC | CRL-2055 | Pancreatic beta-celll line derived from NOD/Lt mice |
| NOD.Cg-Prkdcscid/J | The Jackson Laboratory | 001303 | Mice homozygous for the severe combined immune deficiency spontaneous mutation Prkdcscid, commonly referred to as scid, are characterized by an absence of functional T cells and B cells, lymphopenia, hypogammaglobulinemia, and a normal hematopoietic microenvironment. |
| NOD/ShiLtJ | The Jackson Laboratory | 001976 | The NOD/ShiLtJ strain of mice (commonly called NOD) is a polygenic model for autoimmune type 1 diabetes |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010031 | No calcium, no magnesium, no phenol red |
| pCMV-VSV-G | Addgene | 8454 | |
| pLenti-luciferase-blast | Made in-house | Plasmid available upon request | See Supplemental File 1 |
| pMD2.G | Addgene | 12259 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polyethylenimine, Linear, MW 25,000, Transfection Grade (PEI 25K) | Fisher Scientific | NC1014320 | |
| pRSV-Rev | Addgene | 12253 | |
| Restrainer for rodents, broome-style round 1 in | Fisher Scientific | 01-288-32A | |
| Scissors, sharp-pointed | Fisher Scientific | 08-940 | Or use other scissors made of surgical-grade stainless steel |
| Tissue-culture treated culture dishes | Millipore Sigma | CLS430167-20EA | Or use other sterile cell culture-treated Petri dishes |
| Tweezers/Forceps, fine precision medium tipped | Fisher Scientific | 12-000-157 |
Ссылки
- Katsarou, A., et al. Type 1 diabetes mellitus. Nature Reviews Disease Primers. 3, 17016(2017).
- Shapiro, A. M., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews Endocrinology. 13 (5), 268-277 (2017).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Russ, H. A., et al. Controlled induction of human pancreatic progenitors produces functional beta-like cells in vitro. EMBO Journal. 34 (13), 1759-1772 (2015).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nature Biotechnology. 32 (11), 1121-1133 (2014).
- Vertex Announces Positive Day 90 Data for the First Patient in the Phase 1_2 Clinical Trial Dosed With VX-880, a Novel Investigational Stem Cell-Derived Therapy for the Treatment of Type 1 Diabetes. Businesswire. , Available from: https://www.businesswire.com/news/home/20211018005226/en/Vertex-Announces-Positive-Day-90-Data-for-the-First-Patient-in-the-Phase-12-Clinical-Trial-Dosed-With-VX-880-a-Novel-Investigational-Stem-Cell-Derived-Therapy-for-the-Treatment-of-Type-1-Diabetes (2021).
- Gamble, A., Pepper, A. R., Bruni, A., Shapiro, A. M. J. The journey of islet cell transplantation and future development. Islets. 10 (2), 80-94 (2018).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the Non Obese Diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Hamaguchi, K., Gaskins, R. H., Leiter, E. H. NIT-1, a pancreatic β-cell line established from a transgenic NOD/Lt mouse. Diabetes. 40 (7), 842-849 (1991).
- Christianson, S. W., Shultz, L. D., Leiter, E. D. Adoptive transfer of diabetes into immunodeficient NOD-scid/scid mice: Relative contribution of CD4+ and CD8+ T-cells from diabetogenic versus prediabetic NOD.NON-Thy1a donors. Diabetes. 42 (1), 44-55 (1993).
- Cai, E. P., et al. Genome-scale in vivo CRISPR screen identifies RNLS as a target for beta cell protection in type 1 diabetes. Nature Metabolism. 2 (9), 934-945 (2020).
- Parent, A. V., et al. Selective deletion of human leukocyte antigens protects stem cell-derived islets from immune rejection. Cell Reports. 36 (7), 109538(2021).
- Brehm, M. A., et al. Lack of acute xenogeneic graft-versus-host disease, but retention of T-cell function following engraftment of human peripheral blood mononuclear cells in NSG mice deficient in MHC class I and II expression. FASEB Journal. 33 (3), 3137-3151 (2019).
- Abdulreda, M. H., et al. In vivo imaging of type 1 diabetes immunopathology using eye-transplanted islets in NOD mice. Diabetologia. 62 (7), 1237-1250 (2019).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены