Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Surveillance bioluminescente de la survie du greffon dans un modèle de transfert adoptif du diabète auto-immun chez la souris
Dans cet article
Résumé
Ce protocole décrit une méthode simple et peu invasive pour la transplantation et l’imagerie de cellules NIT-1 chez des souris immunodéficientes combinées diabétiques sévères non obèses (NOD) défiées avec des splénocytes purifiés à partir de souris NOD spontanément diabétiques.
Résumé
Le diabète de type 1 est caractérisé par la destruction auto-immune des cellules bêta productrices d’insuline du pancréas. Un traitement prometteur pour cette maladie est la transplantation de cellules bêta dérivées de cellules souches. Des modifications génétiques, cependant, peuvent être nécessaires pour protéger les cellules transplantées de l’auto-immunité persistante. Les modèles murins diabétiques sont un outil utile pour l’évaluation préliminaire des stratégies visant à protéger les cellules transplantées contre les attaques auto-immunes. Décrit ici est une méthode mini-invasive pour la transplantation et l’imagerie des greffes cellulaires dans un modèle de transfert adoptif du diabète chez la souris. Dans ce protocole, les cellules de la lignée cellulaire bêta pancréatique murine NIT-1 exprimant le transgène luciférase luciférase luc2 sont transplantées par voie sous-cutanée chez des souris immunodéficientes non obèses diabétiques (NOD) immunodéficientes combinées sévères (SCID). Ces souris sont injectées simultanément par voie intraveineuse avec des splénocytes de souris NOD spontanément diabétiques pour transférer l’auto-immunité. Les greffons sont imagés à intervalles réguliers via une imagerie bioluminescente non invasive pour surveiller la survie cellulaire. La survie des cellules mutantes est comparée à celle des cellules témoins transplantées dans la même souris.
Introduction
Le diabète de type 1 (DT1) est causé par la destruction auto-immune des cellules bêta productrices d’insuline du pancréas. La perte de masse des cellules bêta entraîne une carence en insuline et une hyperglycémie. Les patients atteints de DT1 dépendent de multiples injections quotidiennes d’insuline exogène et connaissent des épisodes d’hyperglycémie et d’hypoglycémie sévères tout au long de leur vie. Les complications liées à ces épisodes comprennent la rétinopathie diabétique, la diminution de la fonction rénale et la neuropathie1.
Les injections d’insuline sont un traitement, mais pas un remède contre le DT1. Le remplacement de la masse cellulaire bêta perdue, cependant, a le potentiel d’inverser la maladie en permettant aux patients de produire leur propre insuline. Cependant, l’offre d’îlots donneurs cadavériques est limitée2. Les îlots dérivés de cellules souches (îlots SC) peuvent fournir un approvisionnement pratiquement illimité de cellules bêta pour la transplantation. Plusieurs groupes ont démontré que les cellules souches embryonnaires humaines (CSE) et les cellules souches pluripotentes induites (CSPi) peuvent être différenciées pour générer des cellules fonctionnelles de type bêta 3,4,5. Des données prometteuses d’essais cliniques préliminaires indiquent que ces cellules conservent leur fonction après la greffe et peuvent permettre aux patients de devenir insulino-indépendants6. Une immunosuppression chronique est toutefois nécessaire, augmentant ainsi leur susceptibilité au cancer et à l’infection. De plus, les agents immunosuppresseurs peuvent être cytotoxiques pour les greffons à long terme7. Pour éliminer le besoin d’immunosuppression, les îlots SC peuvent être génétiquement modifiés pour les protéger de l’auto-immunité récurrente ainsi que de l’allo-immunité après la transplantation.
La recherche sur les cellules souches est très exigeante en termes de coûts et de main-d’œuvre. Les lignées cellulaires de souris et les modèles animaux sont des outils utiles pour l’identification initiale et la validation expérimentale de stratégies visant à protéger les cellules transplantées contre l’auto-immunité. La souris NOD développe un diabète auto-immun spontané avec de nombreuses similitudes avec le DT18 humain, et la lignée cellulaire d’insulinome NIT-1 partage un fond génétique avec cette souchede souris 9. Le diabète peut être transféré de manière adoptive à la souche de souris NOD-scid immunodéficiente apparentée par injection de splénocytes diabétiques de souris NOD afin de synchroniser temporellement l’apparition du diabète chez des souris expérimentales répliquées10. Ce modèle peut être utilisé pour identifier des cibles génétiques relativement rapidement et à peu de frais pour une validation ultérieure dans les îlots SC. Récemment, la méthode a été appliquée pour identifier et valider RNLS, une cible qui a été trouvée pour protéger les îlots humains primaires de l’auto-immunité in vivo et les îlots dérivés de l’iPSC du stress des cellules bêta in vitro11. Décrit ici est un protocole simple pour transplanter des cellules NIT-1 génétiquement modifiées et surveiller de manière non invasive leur survie dans un modèle de transfert adoptif du diabète auto-immun chez la souris.
Access restricted. Please log in or start a trial to view this content.
Protocole
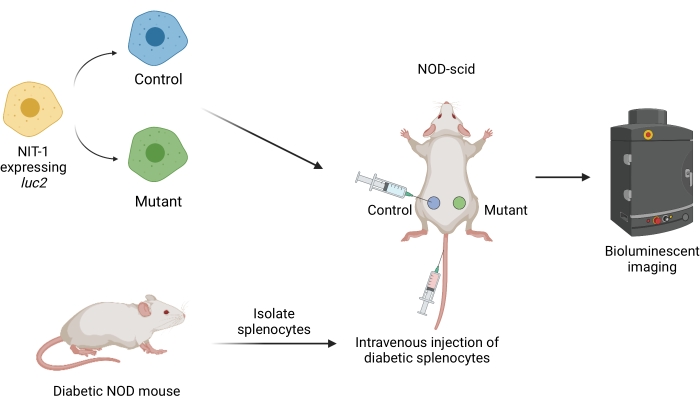
Figure 1 : Le flux de travail pour la transplantation et l’imagerie des greffes dans un modèle de transfert adoptif du diabète chez la souris. Les cellules NIT-1 exprimant la luciférase transgénique luciférase (luc2) sont transplantées par voie sous-cutanée chez des souris NOD-scid. Les souris reçoivent simultanément des injections de splénocytes autoréactifs isolés d’une souris NOD spontanément diabétique. Les greffons sont imagés à intervalles réguliers par imagerie bioluminescente non invasive. Figure créée par BioRender.com. Abréviations : NOD = diabétique non obèse; SCID = immunodéficient combiné sévère. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tous les protocoles de soins et d’étude des animaux ont été approuvés et exécutés conformément au Comité institutionnel de soin et d’utilisation des animaux (IACUC) du Joslin Diabetes Center. Les souris NOD et NOD-scid peuvent être facilement obtenues auprès de sources commerciales. Toutes les souris de cette étude sont maintenues dans une installation surveillée par sentinal. Voir le tableau des matériaux pour plus de détails sur tous les matériaux, animaux, instruments et logiciels utilisés dans ce protocole.
1. Ingénierie et maintenance des lignées cellulaires NIT-1
- Maintenir les lignées cellulaires NIT-1, qui partagent un bagage génétique avec les souris NOD, et les cellules 293FT dans des boîtes traitées par culture tissulaire dans du DMEM contenant 4,5 g / L de glucose complété par 10% de sérum bovin fœtal et 1% de pénicilline / streptomycine dans un incubateur à 37 ° C avec 5% de CO2.
- Cultivez les cellules 293FT à 70%-80% de confluence pour la transfection.
- Par boîte de 10 cm de cellules 293FT, combiner 10 μg de pLenti-luciférase-blast (voir le dossier supplémentaire 1), qui exprime le transgène luciférase luciférase (luc2) sous le contrôle du promoteur FE1α constitutifment actif, 2 μg chacun des plasmides d’emballage pMD2.G, pMDLg/pRRE et pRSV-Rev, 4 μg du plasmide de la protéine d’enveloppe pCMV-VSV-G et 60 μg de polyéthylènemine linéaire (PEI) dans 1 mL de DMEM sans sérum. Ajustez les quantités en fonction du nombre de cellules à transfecter.
- Laissez l’ADN, le PEI et le DMEM à température ambiante (RT) pendant 20 minutes, puis ajoutez-les aux cellules 293FT.
- Prélever le milieu contenant les particules lentivirales 48 h après la transfection.
- Transduire les cellules NIT-1 à ~80% de confluence avec 1 mL de milieu contenant des particules lentivirales pour 106 cellules pendant 48-72 h.
- Sélectionnez les cellules exprimant la luciférase avec 5 μg/mL de blasticidine pendant 48 h.
- Modifier génétiquement davantage les cellules exprimant la luciférase pour répondre à la question expérimentale. Inclure une lignée cellulaire de type sauvage ou non ciblée exprimant la luciférase à des fins de comparaison.
REMARQUE: Des exemples de modifications génétiques cibles incluent CRISPR knockout, CRISPRa / i, shRNA knockdown et surexpression.
2. Préparation des cellules NIT-1 pour la transplantation
- Cultiver les cellules exprimant la luciférase jusqu’à ce qu’elles soient confluentes à 80%-90%.
- Retirer le milieu de croissance et laver les cellules avec une solution saline tamponnée au phosphate (PBS, 5 mL pour une boîte de 10 cm).
- Ajouter 1 mL de trypsine-EDTA à 0,05 % à chaque plat pendant 2 min.
- Neutraliser la trypsine avec 5 mL de milieu de croissance.
- Utilisez une pipette pour laver les cellules de la capsule et les transférer dans un tube conique.
REMARQUE: Les cellules de plusieurs boîtes de la même lignée cellulaire peuvent être combinées. - Comptez les cellules à l’aide d’une coloration telle que le bleu de trypan manuellement avec un hémocytomètre ou automatiquement avec un compteur de cellules automatique.
- Centrifuger à 250 × g pendant 5 min à TA et retirer le surnageant à l’aide d’une pipette d’aspiration.
- Resuspendre la pastille cellulaire dans du PBS à une concentration de 5 × 107 cellules/ml (107 cellules par lignée cellulaire et par souris seront transplantées dans un volume de 200 μL).
- Gardez les cellules sur la glace (jusqu’à 3 h) jusqu’à la transplantation.
3. Transplantation de cellules NIT-1 chez des souris NOD-scid
- Anesthésier les souris receveuses (souris NOD-scid âgées de 8 à 10 semaines du même sexe que les souris utilisées pour isoler les splénocytes) par inhalation d’isoflurane dans une chambre de renversement. Délivrer de l’isoflurane à 2,5 % dans la chambre à un débit de 1,5 L/min et un taux d’évacuation de 9 L/min.
- Lubrifiez les yeux de l’animal avec une pommade ophtalmique pour éviter le dessèchement.
- À l’aide d’un rasoir électrique muni d’un protecteur, retirez les poils du dos (côté dorsal) des souris pour exposer la peau. La zone de transplantation rasée sera d’environ 1 po x 2 po. Remettre les souris rasées dans la chambre de démolition jusqu’à la transplantation.
- Transférer les souris une à la fois sur une surface propre avec un cône de nez isoflurane. Guidez doucement la tête de la souris dans le cône de nez. Utilisez un débit d’isoflurane de 0,25 L/min pour maintenir l’anesthésie pendant la greffe.
- Essuyez la zone de greffe avec un tampon de préparation à l’alcool isopropylique pour enlever les poils lâches et désinfecter la peau.
- Assurez-vous que les cellules sont complètement remises en suspension avant de charger la seringue. Prélever un volume excédentaire (>300 μL) de cellules dans une seringue stérile de 1 mL avec une aiguille de 26 G. Enlevez les bulles; Ensuite, remettez les cellules en excès dans le tube afin qu’il reste 300 μL de suspension cellulaire dans la seringue.
- À l’aide d’une paire de pinces incurvées tenues dans la main non dominante, soulevez doucement la peau d’un côté (gauche ou droit) du dos de la souris pour faciliter l’accès à l’espace sous-cutané.
- À l’aide de la main dominante, placez la seringue parallèlement aux plans coronal et sagittal du corps de la souris. Avec l’aiguille pointée vers la tête de la souris, insérez l’aiguille dans la peau près de l’arrière-train et guidez-la doucement dans l’espace sous-cutané. Assurez-vous que l’aiguille entière reste sous la peau et ne perce pas.
- Ajustez la pince pour maintenir doucement la peau autour de la base de l’aiguille. Distribuer lentement une petite quantité de suspension cellulaire (<50 μL) et confirmer qu’un petit renflement se forme sous la peau au site de l’injection. Continuez à injecter la suspension cellulaire jusqu’à ce que 200 μL aient été délivrés dans l’espace sous-cutané.
- En maintenant les pinces en place et en gardant l’aiguille parallèle au corps de la souris, retirez lentement l’aiguille. Une fois l’aiguille retirée, maintenez la peau fermée avec une pince pendant quelques secondes pour empêcher les cellules de s’échapper de la plaie perforante.
- Si une modification génétique est en cours d’évaluation, répétez la greffe du côté opposé de la souris à l’aide d’une seringue différente afin que les cellules mutantes et témoins soient injectées dans chaque souris, avec une lignée cellulaire à gauche et l’autre à droite. Si une seule lignée cellulaire est transplantée, injectez les cellules d’un seul côté.
- Après la greffe, transférez chaque souris dans une nouvelle cage. Laissez chaque souris se remettre complètement de l’anesthésie avant d’ajouter des souris supplémentaires à la cage.
NOTE: Les souris sont récupérées lorsqu’elles reprennent leurs activités normales et ne montrent aucun signe de léthargie ou de mouvement altéré. - Évaluer quotidiennement l’état de santé des souris pendant toute la durée de l’expérience suivant la greffe. Si les greffons forment un gros renflement ou si les souris deviennent faibles et léthargiques, mesurez leur glycémie et fournissez 10% (p/p) d’eau saccharose ad libitum à toutes les souris hypoglycémiques. Suivez toutes les recommandations vétérinaires et euthanasiez toutes les souris dont l’état corporel persiste selon les directives de l’établissement. Dans cette étude, les souris ont été euthanasiées par inhalation de CO2 suivie d’une luxation cervicale.
4. Isolement et purification des splénocytes autoréactifs
- Identifier les souris NOD mâles ou femelles âgées de 10 à 16 semaines atteintes de diabète d’apparition récente (moins de 10 jours) à l’aide de bandelettes de test glycémique urinaires (ou sanguines). Les souris NOD sont considérées comme diabétiques lorsqu’elles ont une glycémie de ≥250 mg / dL sur au moins 2 jours consécutifs.
REMARQUE: Pour chaque souris NOD-scid, 10 millions de splénocytes sont nécessaires; Une rate produit généralement 50 à 150 millions de splénocytes. Les splénocytes ont été isolés à partir de souris exemptes d’agents pathogènes logées dans une installation surveillée par sentinal. - Euthanasier le nombre approprié de souris NOD diabétiques.
NOTE: Dans cette étude, les souris ont été euthanasiées par inhalation de CO2 suivie d’une luxation cervicale pour assurer la mort. - Avec la souris sur le dos, faites une incision verticale d’environ 2 pouces de longueur dans la peau avec des ciseaux chirurgicaux. Ouvrez le côté droit de la souris du point de vue du chercheur et localisez la rate rouge vif. Coupez doucement la rate loin du pancréas rose et transférez-la dans une boîte de Petri stérile de 10 cm contenant 5 ml de PBS stérile. Répétez la dissection avec autant de souris que nécessaire.
REMARQUE: Les rates de plusieurs souris peuvent être combinées dans un seul plat. Effectuer les étapes suivantes en utilisant des réactifs et de l’équipement stériles dans une hotte stérile. - Écraser la ou les rates avec le dessus plat d’un piston de seringue stérile.
- Placez une crépine de 40 μm ou 70 μm dans un tube conique de 50 mL et lavez la passoire avec 5 mL de PBS pour l’amorcer. Transférer la ou les rates en suspension dans la crépine et continuer à écraser doucement à travers la crépine. Lavez le plat avec 10 ml de PBS et transférez le lavage dans la passoire. Continuez à écraser jusqu’à ce que la couleur rouge ait disparu de la passoire.
- Jeter la passoire et faire tourner le tube à 500 × g pendant 5 min à TA. Retirer le surnageant à l’aide d’une pipette d’aspiration.
- Remettez en suspension la pastille cellulaire dans 5 mL (jusqu’à trois rates) de tampon de lyse ACK préchauffé à RT et lyser les globules rouges pendant 4 min. Augmenter le volume de 1 à 2 mL par rate si des rates supplémentaires sont nécessaires.
- Arrêter la réaction avec 5 mL de milieu cellulaire NIT-1 (décrit ci-dessus) par 5 mL de tampon de lyse. Passez la suspension cellulaire à travers une passoire fraîche pour éliminer les touffes. Jeter la passoire et faire tourner à 500 × g pendant 5 min à TA.
- Remettez en suspension la pastille de cellule dans 20 mL de PBS et comptez les cellules. Faire tourner à 500 × g pendant 5 min à TA. Resuspendre les cellules dans du PBS stérile à une concentration de 1 × 108 cellules/mL (le volume d’injection est de 0,1 mL/souris) dans un tube de réaction à verrouillage sécuritaire de 1,5 mL.
- Entreposer les cellules sur de la glace (pas plus de 1 h) ou conserver les cellules à RT et procéder immédiatement à l’injection de la veine de la queue.
5. Injection intraveineuse de splénocytes diabétiques via la veine latérale de la queue
- Réchauffez le corps des souris NOD-scid adultes (par exemple, en utilisant une lampe chauffante pendant ~5-10 min) pour vasodiler les veines (cela aide à la visualisation et à l’injection dans la veine).
REMARQUE: Pour éviter la surchauffe des souris, ne pas dépasser ce temps. Surveillez toujours l’état de santé. Si les souris semblent épuisées ou immobiles, éteignez immédiatement la lampe chauffante. - Réchauffez la suspension cellulaire. Préparez une seringue stérile (0,3-1,0 mL) avec une aiguille stérile (27-30 G, 0,3 mm/0,5 po ou moins), ou utilisez une seringue à insuline stérile de 0,5 mL avec une aiguille de 0,3 mm (0,5 po). Gardez toujours l’aiguille stérile et utilisez un plateau stérile si la seringue doit être posée entre les injections.
- Remettez en suspension la solution splénocytaire avant chaque injection. Pour chaque souris, aspirer 100 μL de la suspension splénocytaire préchauffée et mixte dans la seringue. Assurez-vous qu’aucune bulle d’air n’est présente dans la seringue ou dans la suspension.
REMARQUE : Assurez-vous d’avoir tout l’équipement et les fournitures préparés (lingettes alcoolisées pour la désinfection, une seringue chargée des splénocytes à injecter et une nouvelle cage pour séparer les souris injectées) avant de placer la souris dans le dispositif de retenue. - Placez la souris dans le dispositif de retenue. Capturez la queue avec la main non dominante et localisez l’une des deux nervures latérales de la queue. Faites tourner doucement la queue si nécessaire. Essuyez la queue avec une lingette désinfectante (alcool isopropylique à 70%) pour nettoyer la peau et augmenter la visibilité de la veine.
- Insérez l’aiguille à un angle aigu dans la région centrale de la queue avec la main dominante. Avec le biseau de l’aiguille tourné vers le haut, faites glisser l’aiguille de quelques millimètres à travers la peau.
REMARQUE: Assurez-vous que l’aiguille est parallèle à la veine et placée juste légèrement sous la peau. Préparez-vous à des mouvements brusques de la souris ou de la queue directement après avoir pénétré dans la paroi de la peau ou du vaisseau. Une insertion réussie de l’aiguille devrait ressembler à un « glissement lisse » dans la veine. Si une autre tentative est nécessaire, déplacez-vous plus haut dans la queue vers le corps. - Appliquez une légère pression sur la seringue pour injecter la suspension splénocytes. Ne laissez pas l’aiguille entrer ou sortir plus loin lors de l’injection. Les injections réussies sont lisses sans sensation de contre-pression pendant l’injection et sont indiquées par un flux sanguin transparent / blanc immédiatement après l’injection.
- Relâchez doucement l’aiguille hors de la veine et appliquez une légère pression sur la queue avec une lingette désinfectante jusqu’à ce que le saignement cesse. Libérez la souris du dispositif de retenue et transférez-la doucement dans une cage fraîchement préparée.
REMARQUE: Injectez deux à trois souris témoins qui ne reçoivent pas de greffe de cellules NIT-1 avec des splénocytes pour confirmer le potentiel des splénocytes autoréactifs à induire le diabète, ce qui prend environ 2-4 semaines après l’injection.
6. Imagerie bioluminescente in vivo des greffes de NIT-1
REMARQUE: Imagez les greffons une à deux fois par semaine. Le jour de la greffe, attendre au moins 2 h après la greffe pour permettre aux greffons de s’installer et assurer une expression stable de la luciférase. Si le temps est un facteur limitant, la mesure initiale peut être prise le jour 1 à la place. Un calendrier d’imagerie initial recommandé est le jour 0 ou le jour 1 après l’injection, le jour 5, le jour 10, le jour 14, le jour 18 et le jour 25. Ajustez le calendrier, cependant, en fonction des progrès de l’auto-immunité à en juger par la perte de signal bioluminescent.
- Préparer une solution de D-luciférine à 15 mg/mL dans le PBS de Dulbecco. Agiter à TA pour se dissoudre, et filtre stérile (0,22 μm). Conservez 1 mL d’aliquotes à −20 °C et décongelez-les au besoin.
REMARQUE : Les aliquotes peuvent être recongelées. - Au moins 5 minutes avant l’imagerie, injecter les souris par voie intrapéritonéale à l’aide d’une seringue de 1 mL et d’une aiguille de 26 G avec une solution de D-luciférine à une dose de 150 mg / kg.
REMARQUE: Utilisez une seringue et une aiguille neuves pour chaque souris. - Anesthésier les souris par inhalation d’isoflurane conformément aux directives institutionnelles. Les conditions recommandées sont 2,5 % d’isoflurane avec un débit de 1,5 L/min dans la chambre de démontage et un taux d’évacuation de 9 L/min.
- Lubrifiez les yeux de l’animal avec une pommade ophtalmique pour éviter le dessèchement.
- Ouvrez le logiciel associé à l’instrument d’imagerie. Créez un nouvel utilisateur et/ou connectez-vous. Dans le panneau de commande en bas à droite, sélectionnez Initialiser (Figure 2A). Pour enregistrer automatiquement les données de création d’image, créez les dossiers appropriés sur l’ordinateur, puis sélectionnez Acquisition | Enregistrement automatique dans... (figure 2A). Une fois l’initialisation de l’instrument terminée, réglez le temps d’exposition sur 1 min.
REMARQUE : Les paramètres d’imagerie complets sont illustrés à la figure 2B. - Transférez les souris une à la fois de la chambre de démontage à l’instrument d’imagerie. Placez la souris sur le ventre avec ses membres écartés et guidez doucement sa tête dans le cône nasal. Un débit d’isoflurane de 0,25 L/min délivré par un cône nasal est approprié pour maintenir l’anesthésie pendant l’imagerie. Aplatissez doucement la souris en appuyant sur le centre de son dos avec les deux mains, puis en écartant les mains vers l’extérieur et à l’écart.
- Sélectionnez Acquérir (Figure 2B). Notez tous les détails pertinents de l’expérience dans la fenêtre contextuelle (Figure 2C).
REMARQUE : Voir la figure 3A pour des images représentatives de trois souris NOD-scid femelles âgées de 8 semaines transplantées avec deux greffons à différents moments.
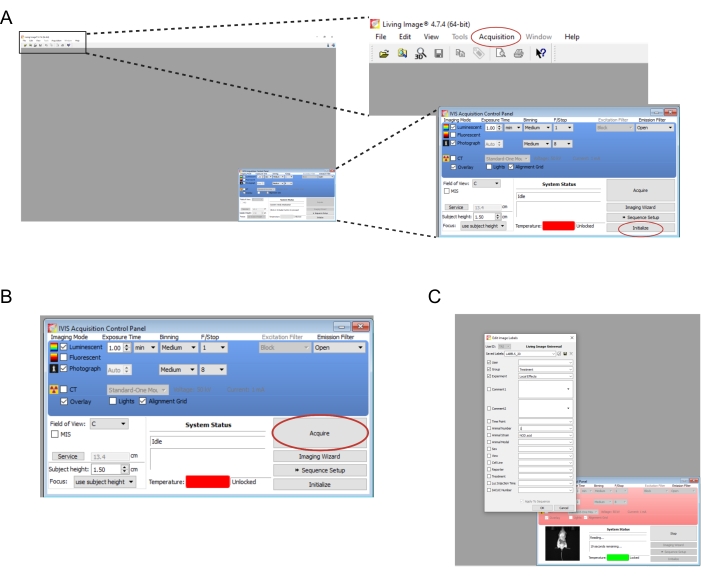
Figure 2 : Captures d’écran des commandes logicielles pour l’imagerie des greffes bioluminescentes. (A) Avant l’imagerie, sélectionnez Initialiser pour préparer l’instrument. Les images peuvent être enregistrées automatiquement dans un dossier de votre choix en sélectionnant Acquisition | Enregistrement automatique dans... (B) Vue d’ensemble des paramètres d’imagerie. Une fois la souris positionnée dans l’instrument, sélectionnez Acquérir. (C) Capture d’écran de la boîte de dialogue qui apparaît pendant l’imagerie. Des détails tels que le point temporel et la souche de la souris peuvent être saisis ici. Veuillez cliquer ici pour voir une version agrandie de cette figure.
7. Analyse des données
- Quantifier le signal bioluminescent à tout moment après l’imagerie. Ouvrez le logiciel associé à l’instrument d’imagerie. Sélectionnez Fichier | Ouvrez et sélectionnez le fichier ClickInfo.txt associé à la souris à analyser.
- Dans la palette d’outils, sélectionnez Outils ROI (Figure 3B, étape 1). Dans le menu déroulant ovale (Figure 3B, étape 1, flèche rouge), sélectionnez le nombre de greffons transplantés dans la souris.
- Déplacez les ovales afin qu’ils contiennent le signal bioluminescent de chaque greffe, puis sélectionnez Mesurer le retour sur investissement (Figure 3B, étape 2).
- Notez le nombre total de greffons (figure 3B, étape 3).
- Pour chaque greffon, diviser le signal bioluminescent mesuré à chaque point temporel par le signal mesuré au premier point temporel. Indiquez la survie du greffon comme la proportion ou le pourcentage de signal bioluminescent résiduel par rapport au signal bioluminescent initial.
REMARQUE: Si les greffons se dilatent après la transplantation, le rapport ou le pourcentage de survie du greffon sera supérieur à 1 ou 100%, respectivement. Toutes les souris qui reçoivent des greffes doivent être surveillées pour détecter les effets néfastes sur la santé.
Access restricted. Please log in or start a trial to view this content.
Résultats
La figure 1 donne un aperçu du protocole. La survie de deux lignées cellulaires, comme un mutant et un témoin non ciblé, peut être comparée, ou la survie d’une lignée cellulaire peut être mesurée dans plusieurs groupes de souris, comme les souris traitées par un médicament par rapport aux témoins traités par véhicule. La figure 3A montre trois souris NOD-scid femelles âgées de 8 semaines transplantées avec un témoin non ciblé (à gauche) et ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Le DT1 est une maladie dévastatrice pour laquelle il n’existe actuellement aucun remède. La thérapie de remplacement des cellules bêta offre un traitement prometteur pour les patients atteints de cette maladie, mais l’obstacle critique à cette stratégie est le potentiel d’attaque auto-immune récurrente contre les cellules bêta transplantées. Le génie génétique des cellules SC-bêta pour réduire leur visibilité immunitaire ou leur susceptibilité est une solution potentielle à ce problème. Décrit ic...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent n’avoir aucun conflit d’intérêts.
Remerciements
Nous remercions le Dr Erica P. Cai et le Dr Yuki Ishikawa d’avoir développé la méthode décrite dans ce protocole (voir réf. 11). La recherche dans les laboratoires de S.K. et de P.Y. est financée par des subventions des National Institutes of Health (NIH) (R01DK120445, P30DK036836), de FRDJ, du Harvard Stem Cell Institute et de la Fondation Beatson. T.S. a été soutenu par une bourse postdoctorale de l’Institut national du diabète et des maladies digestives et rénales (NIDDK) (T32 DK007260-45), et K.B. a été soutenu en partie par une bourse de la Fondation Mary K. Iacocca.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin, 0.53 mM EDTA | Corning | 25-052-CI | |
| 293FT | Invitrogen | R70007 | Fast-growing, highly transfectable clonal isolate derived from human embryonal kidney cells transformed with the SV40 large T antigen |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| Alcohol prep pads, 70% Isopropyl alcohol | Amazon/Ever Ready First Aid | B08NWF31DX | |
| BD 5ml Syringe Luer-Lok Tip | BD | 309646 | |
| BD PrecisionGlide Needle 26G x 5/8 (0.45 mm x 16 mm) Sub-Q | BD | 305115 | |
| BD 1 mL TB Syringe Slip Tip | BD | 309659 | |
| Blasticidin S HCl | Corning | 30-100-RB | |
| Cell strainer premium SureStrain, 70 µm, sterile | Southern Labware | C4070 | Or use similar sterile strainer with 40-70um pore size |
| CellDrop automated cell counter | Denovix | CellDrop BF-PAYG | Or use similar cell counter device |
| Corning 100 mL Penicillin-Streptomycin Solution, 100x | Corning | 30-002-CI | |
| Disposable Aspirating Pipets, Polystyrene, Sterile, Capacity=2 mL | VWR | 414004-265 | Or use similar aspirating pipette |
| D-Luciferin, Potassium Salt , Molecular Biology Grade, Powder, >99% | Goldbio | LUCK-100 | |
| DMEM, high glucose, pyruvate, no glutamine | Gibco | 10313039 | |
| Falcon BD tubes, 50 mL | Fisher Scientific | 14-959-49A | |
| Fetal Bovine Serum | Gibco | 10437-028 | |
| Forceps premium for tissues, 1 x 2 teeth 5 in, German Steel | Fisher Scientific | 13-820-074 | |
| Glucose urine test strip | California Pet Pharmacy | u-tsg100 | Or use similar test strip for glucose measurments in urine/blood |
| GlutaMAX–1 (100x) | Gibco | 35050-061 | |
| Infrared heating lamp | Cole Parmer | 03057-00 | Or use similar infrared lamp |
| Insulin syringe 0.5 mL, U-100 29 G 0.5 in | Becton Dickinson | 309306 | |
| Isoflurane, USP | Piramal Critical Care | 6679401725 | |
| IVIS Spectrum in vivo imaging system | Perkin Elmer | 124262 | Instrument for non-invasively collecting bioluminescent images of transplanted cells |
| Living Image Analysis Software | Perkin Elmer | 128113 | Software for collecting and quantifying bioluminescent signal |
| Microcentrifuge tubes seal-rite, 1.5 mL | USA Scientific | 1615-5510 | Or use similar sterile microcentrifuge tubes |
| NIT-1 | ATCC | CRL-2055 | Pancreatic beta-celll line derived from NOD/Lt mice |
| NOD.Cg-Prkdcscid/J | The Jackson Laboratory | 001303 | Mice homozygous for the severe combined immune deficiency spontaneous mutation Prkdcscid, commonly referred to as scid, are characterized by an absence of functional T cells and B cells, lymphopenia, hypogammaglobulinemia, and a normal hematopoietic microenvironment. |
| NOD/ShiLtJ | The Jackson Laboratory | 001976 | The NOD/ShiLtJ strain of mice (commonly called NOD) is a polygenic model for autoimmune type 1 diabetes |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010031 | No calcium, no magnesium, no phenol red |
| pCMV-VSV-G | Addgene | 8454 | |
| pLenti-luciferase-blast | Made in-house | Plasmid available upon request | See Supplemental File 1 |
| pMD2.G | Addgene | 12259 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polyethylenimine, Linear, MW 25,000, Transfection Grade (PEI 25K) | Fisher Scientific | NC1014320 | |
| pRSV-Rev | Addgene | 12253 | |
| Restrainer for rodents, broome-style round 1 in | Fisher Scientific | 01-288-32A | |
| Scissors, sharp-pointed | Fisher Scientific | 08-940 | Or use other scissors made of surgical-grade stainless steel |
| Tissue-culture treated culture dishes | Millipore Sigma | CLS430167-20EA | Or use other sterile cell culture-treated Petri dishes |
| Tweezers/Forceps, fine precision medium tipped | Fisher Scientific | 12-000-157 |
Références
- Katsarou, A., et al. Type 1 diabetes mellitus. Nature Reviews Disease Primers. 3, 17016(2017).
- Shapiro, A. M., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews Endocrinology. 13 (5), 268-277 (2017).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Russ, H. A., et al. Controlled induction of human pancreatic progenitors produces functional beta-like cells in vitro. EMBO Journal. 34 (13), 1759-1772 (2015).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nature Biotechnology. 32 (11), 1121-1133 (2014).
- Vertex Announces Positive Day 90 Data for the First Patient in the Phase 1_2 Clinical Trial Dosed With VX-880, a Novel Investigational Stem Cell-Derived Therapy for the Treatment of Type 1 Diabetes. Businesswire. , Available from: https://www.businesswire.com/news/home/20211018005226/en/Vertex-Announces-Positive-Day-90-Data-for-the-First-Patient-in-the-Phase-12-Clinical-Trial-Dosed-With-VX-880-a-Novel-Investigational-Stem-Cell-Derived-Therapy-for-the-Treatment-of-Type-1-Diabetes (2021).
- Gamble, A., Pepper, A. R., Bruni, A., Shapiro, A. M. J. The journey of islet cell transplantation and future development. Islets. 10 (2), 80-94 (2018).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the Non Obese Diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Hamaguchi, K., Gaskins, R. H., Leiter, E. H. NIT-1, a pancreatic β-cell line established from a transgenic NOD/Lt mouse. Diabetes. 40 (7), 842-849 (1991).
- Christianson, S. W., Shultz, L. D., Leiter, E. D. Adoptive transfer of diabetes into immunodeficient NOD-scid/scid mice: Relative contribution of CD4+ and CD8+ T-cells from diabetogenic versus prediabetic NOD.NON-Thy1a donors. Diabetes. 42 (1), 44-55 (1993).
- Cai, E. P., et al. Genome-scale in vivo CRISPR screen identifies RNLS as a target for beta cell protection in type 1 diabetes. Nature Metabolism. 2 (9), 934-945 (2020).
- Parent, A. V., et al. Selective deletion of human leukocyte antigens protects stem cell-derived islets from immune rejection. Cell Reports. 36 (7), 109538(2021).
- Brehm, M. A., et al. Lack of acute xenogeneic graft-versus-host disease, but retention of T-cell function following engraftment of human peripheral blood mononuclear cells in NSG mice deficient in MHC class I and II expression. FASEB Journal. 33 (3), 3137-3151 (2019).
- Abdulreda, M. H., et al. In vivo imaging of type 1 diabetes immunopathology using eye-transplanted islets in NOD mice. Diabetologia. 62 (7), 1237-1250 (2019).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon