このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスにおける自己免疫性糖尿病の養子移植モデルにおける移植片生存の生物発光モニタリング
要約
このプロトコルは、非肥満糖尿病(NOD)重症複合免疫不全マウスにNIT-1細胞を移植およびイメージングするための簡単で低侵襲な方法を説明しています。
要約
1型糖尿病は、膵臓のインスリン産生ベータ細胞の自己免疫破壊によって特徴付けられる。この病気の有望な治療法は、幹細胞由来のベータ細胞の移植です。しかし、移植された細胞を持続的な自己免疫から保護するために、遺伝子組み換えが必要な場合があります。糖尿病マウスモデルは、移植細胞を自己免疫攻撃から保護するための戦略の予備評価に有用なツールです。ここで説明するのは、マウスにおける糖尿病の養子移植モデルにおける細胞移植片を移植および画像化するための低侵襲的方法である。このプロトコルでは、ホタルルシフェラーゼ導入遺伝子 luc2 を発現するマウス膵臓ベータ細胞株NIT-1からの細胞を、免疫不全非肥満糖尿病(NOD)重症複合免疫不全(scid)マウスに皮下移植します。これらのマウスに、自己免疫を移すために自然糖尿病NODマウス由来の脾細胞を同時に静脈内注射する。移植片は、細胞の生存を監視するために、非侵襲的な生物発光イメージング を介して 一定の間隔でイメージングされます。変異細胞の生存率は、同じマウスに移植された対照細胞の生存率と比較されます。
概要
1型糖尿病(T1D)は、膵臓のインスリン産生ベータ細胞の自己免疫破壊によって引き起こされます。ベータ細胞塊の損失は、インスリン欠乏症および高血糖をもたらす。T1D患者は、外因性インスリンの毎日の複数回の注射に依存しており、生涯を通じて重度の高血糖および低血糖のエピソードを経験します。これらのエピソードに関連する合併症には、糖尿病性網膜症、腎機能の低下、および神経障害が含まれます1。
インスリン注射は治療法ですが、T1Dの治療法ではありません。しかし、失われたベータ細胞塊を置き換えることは、患者が自分のインスリンを産生できるようにすることで、病気を逆転させる可能性があります。ただし、死体ドナー島の供給は限られています2。幹細胞由来膵島(SC膵島)は、移植用のベータ細胞の事実上無制限の供給を提供し得る。いくつかのグループは、ヒト胚性幹細胞(ESC)および人工多能性幹細胞(iPSC)を分化させて機能的なベータ様細胞を生成できることを実証している3,4,5。有望な初期の臨床試験データは、これらの細胞が移植後も機能を維持し、患者がインスリン非依存性になることを可能にする可能性があることを示しています6。ただし、慢性免疫抑制が必要であり、癌や感染症に対する感受性が高まります。さらに、免疫抑制剤は、長期的に移植片に対して細胞毒性があり得る7。免疫抑制の必要性を排除するために、SC膵島を遺伝子組み換えして、移植後の再発性自己免疫および同種免疫から保護することができます。
幹細胞研究は、コストと労力が非常に厳しいものです。マウス細胞株と動物モデルは、移植細胞を自己免疫から保護するための戦略の初期同定と実験的検証に有用なツールです。NODマウスは、ヒトT1D8と多くの類似点を有する自然発生性自己免疫性糖尿病を発症し、NIT-1インスリノーマ細胞株はこのマウス系統9と遺伝的背景を共有している。糖尿病は、複製実験マウス10における糖尿病の発症を時間的に同期させるために、NODマウスからの糖尿病性脾細胞の注射を介して関連する免疫不全NOD-scidマウス系統に養子縁組に移され得る。このモデルは、SC島でのさらなる検証のために、遺伝的標的を比較的迅速かつ安価に特定するために使用できます。最近、この方法は、in vivoでの自己免疫から初代ヒト膵島を保護することが判明した標的であるRNLSおよびin vitroでのベータ細胞ストレスからのiPS細胞由来膵島を同定および検証するために適用されました11。ここでは、遺伝子操作されたNIT-1細胞を移植し、マウスの自己免疫性糖尿病の養子導入モデルでそれらの生存を非侵襲的に監視するための簡単なプロトコルについて説明します。
Access restricted. Please log in or start a trial to view this content.
プロトコル
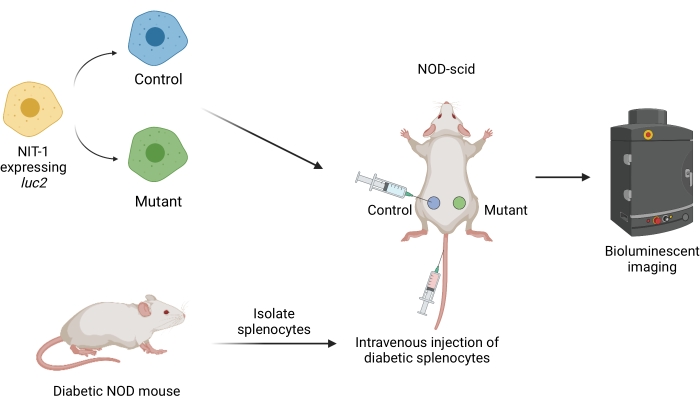
図1:マウスの糖尿病の養子移植モデルにおける移植片の移植とイメージングのワークフロー。 ホタル導入遺伝子ルシフェラーゼ(luc2)を発現するNIT-1細胞をNOD-scidマウスに皮下移植する。マウスには、自然糖尿病NODマウスから単離された自己反応性脾細胞を同時に注射する。移植片は、非侵襲的生物発光イメージングによって一定の間隔でイメージングされる。BioRender.com によって作成された図。略語:NOD =非肥満糖尿病患者。SCID =重度の複合免疫不全。 この図の拡大版を表示するには、ここをクリックしてください。
すべての動物の世話と研究のプロトコルは、ジョスリン糖尿病センターの施設動物管理および使用委員会(IACUC)によって承認され、それに従って実施されました。NODおよびNOD-scidマウスは、市販の供給源から容易に入手することができる。この研究のすべてのマウスは、センチナルモニター施設で維持されています。このプロトコルで使用されるすべての材料、動物、機器、およびソフトウェアに関連する詳細については、 材料の表 を参照してください。
1. NIT-1細胞株のエンジニアリングとメンテナンス
- NODマウスと遺伝的背景を共有するNIT-1細胞株、および4.5 g/Lグルコースを添加した4.5 g/Lグルコースを含むDMEMの組織培養処理皿中の293FT細胞を、5%CO2を含む37°Cのインキュベーター内で維持します。
- トランスフェクションのために、293FT細胞を70%〜80%のコンフルエントまで増殖させます。
- 293FT細胞の10 cmディッシュあたり、構成的に活性なEF1αプロモーターの制御下でホタルルシフェラーゼ導入遺伝子(luc2)を発現する10 μgのpLenti-ルシフェラーゼ-ブラスト(補足ファイル1を参照)、パッケージングプラスミドpMD2.G、pMDLg/pRRE、およびpRSV-Revのそれぞれ2 μg、エンベロープタンパク質プラスミドpCMV-VSV-Gの4 μg、および1 mLの無血清DMEM中の直鎖状ポリエチレンイミン(PEI)60 μgを組み合わせます。トランスフェクトする細胞の数に基づいて量を調整します。
- DNA、PEI、およびDMEMを室温(RT)で20分間放置してから、293FTセルに追加します。
- トランスフェクションの48時間後にレンチウイルス粒子を含む培地を回収します。
- NIT-1細胞を~80%のコンフルエンシーで、レンチウイルス粒子を含む培地106 細胞あたり48〜72時間形質導入します。
- ルシフェラーゼ発現細胞を5 μg/mLのブラストサイジンで48時間選択します。
- 実験的な質問に合うようにルシフェラーゼ発現細胞をさらに遺伝子組み換えする。比較のためにルシフェラーゼ発現野生型または非標的化対照細胞株を含める。
注:標的遺伝子改変の例には、CRISPRノックアウト、CRISPRa/i、shRNAノックダウン、および過剰発現が含まれます。
2. 移植用NIT-1細胞の調製
- ルシフェラーゼ発現細胞を80%〜90%コンフルエントになるまで増殖させます。
- 増殖培地を除去し、リン酸緩衝生理食塩水(PBS、10 cmディッシュの場合は5 mL)で細胞を洗浄します。
- 1 mLの0.05%トリプシン-EDTAを各皿に2分間加えます。
- 5 mLの増殖培地でトリプシンを中和します。
- ピペットを使用して細胞を皿から洗い流し、それらを円錐形のチューブに移します。
注:同じ細胞株の複数のディッシュからの細胞を組み合わせることができます。 - トリパンブルーなどの染色剤を使用して、血球計算盤で手動で、または自動セルカウンターを使用して自動的に細胞をカウントします。
- 250 × g でRTで5分間遠心分離し、吸引ピペットで上清を除去します。
- 細胞ペレットをPBSに5 × 107 細胞/ mLの濃度で再懸濁します(マウスあたり細胞株あたり107 細胞を200μLの容量で移植します)。
- 移植まで細胞を氷上に(最大3時間)保管してください。
3. NIT-1細胞のNOD-scidマウスへの移植
- レシピエントマウス(脾細胞を単離するために使用したマウスと同じ性別の8〜10週齢のNOD-scidマウス)をノックダウンチャンバーでのイソフルラン吸入によって麻酔する。2.5%イソフルランを1.5 L/minの流量と9 L/minの排気速度でチャンバーに供給します。
- 乾燥を防ぐために眼科用軟膏で動物の目を滑らかにします。
- ガード付きの電気シェーバーを使用して、マウスの背中(背側)から毛を取り除き、皮膚を露出させます。剃毛された移植領域は、約1インチx2インチになります。移植まで剃毛したマウスをノックダウンチャンバーに戻します。
- マウスを一度に1匹ずつイソフルランノーズコーンできれいな表面に移します。マウスの頭をノーズコーンにそっと導きます。0.25 L / minのイソフルラン流量を使用して、移植中の麻酔を維持します。
- イソプロピルアルコール準備パッドで移植領域を拭いて、抜け毛を取り除き、皮膚を消毒します。
- シリンジをロードする前に、細胞が完全に再懸濁されていることを確認してください。過剰容量(>300 μL)の細胞を、26 Gの針を備えた1 mLの滅菌シリンジに引き込みます。気泡を取り除きます。次に、余分な細胞をチューブに戻して、300 μLの細胞懸濁液がシリンジに残るようにします。
- 利き手ではない手に持った一対の湾曲した鉗子を使用して、マウスの背中の片側(左または右)の皮膚をそっと持ち上げて、皮下スペースにアクセスしやすくします。
- 利き手を使用して、シリンジをマウスの体の冠状面と矢状面に平行に配置します。針をマウスの頭に向けて、後肢近くの皮膚に針を挿入し、皮下空間にそっと導きます。針全体が皮膚の下に残り、突き出ていないことを確認してください。
- 鉗子を調整して、針の付け根の周りの皮膚をそっと保持します。少量の細胞懸濁液(<50μL)をゆっくりと分注し、注射部位の皮膚の下に小さな膨らみが形成されていることを確認します。200 μLが皮下空間に送達されるまで、細胞懸濁液を注入し続けます。
- 鉗子を所定の位置に保持し、針をマウスの体と平行に保ちながら、針をゆっくりと引き出します。針を外した後、細胞が穿刺創から漏れないように、鉗子で皮膚を数秒間閉じたままにします。
- 遺伝子改変を評価する場合は、別の注射器を使用してマウスの反対側で移植を繰り返し、変異細胞と対照細胞の両方が各マウスに注入され、一方の細胞株が左側に、もう一方の細胞株が右側に挿入されるようにします。細胞株を1つだけ移植する場合は、片側のみに細胞を注入します。
- 移植後、各マウスを新しいケージに移します。ケージにマウスを追加する前に、各マウスが麻酔から完全に回復するのを待ちます。
注:マウスは、通常の活動を再開したときに回復し、嗜眠や運動障害の兆候を示さない。 - 移植後の実験期間中、マウスの健康状態を毎日評価します。移植片が大きな膨らみを形成するか、マウスが弱くて無気力になった場合は、血糖値を測定し、すべての低血糖マウスに10%(w / w)のショ糖水を 自由に 供給します。すべての獣医の推奨事項に従い、施設のガイドラインに従って、体調不良が続くマウスを安楽死させます。この研究では、マウスをCO2 吸入とそれに続く頸部脱臼によって安楽死させた。
4. 自己反応性脾細胞の単離・精製
- 尿(または血液)グルコーステストストリップを使用して、最近発症した(10日未満)糖尿病の10〜16週齢の男性または女性のNODマウスを特定します。NODマウスは、少なくとも2日間連続して尿/血糖値≥250 mg / dLがある場合、糖尿病と見なされます。
注:NOD-scidマウスごとに、1,000万個の脾細胞が必要です。1つの脾臓は通常、5000万から1億5000万の脾細胞を生成します。脾細胞は、センチナルモニター施設に収容された病原体のないマウスから単離された。 - 適切な数の糖尿病性NODマウスを安楽死させる。
注:この研究では、マウスはCO2 吸入によって安楽死させられ、続いて子宮頸部脱臼が確実に死にました。 - マウスを背中に乗せて、外科用ハサミで皮膚の長さ約2インチの垂直切開を行います。研究者の視点からマウスの右側を開き、真っ赤な脾臓を見つけます。ピンク色の膵臓から脾臓をそっと切り取り、5 mLの滅菌PBSを含む滅菌10 cmのペトリ皿に移します。必要な数のマウスで解剖を繰り返します。
注:複数のマウスの脾臓を1つの皿にまとめることができます。滅菌フード内の滅菌試薬と機器を使用して、次の手順を実行してください。 - 滅菌注射器プランジャーの平らな上部で脾臓をマッシュします。
- 40 μmまたは70 μmのストレーナーを50 mLのコニカルチューブに入れ、5 mLのPBSでストレーナーを洗浄してプライミングします。脾臓懸濁液をストレーナーに移し、ストレーナーを通して穏やかにマッシングを続けます。10 mLのPBSで皿を洗い、洗浄液をストレーナーに移します。ストレーナーから赤い色がなくなるまでマッシュを続けます。
- ストレーナーを廃棄し、チューブを500 × g でRTで5分間回転させます。 吸引ピペットで上清を取り除きます。
- 細胞ペレットをRTに予熱した5 mL(最大3つの脾臓用)のACK溶解バッファーに再懸濁し、赤血球を4分間溶解します。追加の脾臓が必要な場合は、脾臓あたり1〜2 mLの容量を増やします。.
- 溶解バッファー 5 mL あたり 5 mL の NIT-1 細胞培地 (上記) で反応を停止します。細胞懸濁液を新しいストレーナーに通して塊を取り除きます。ストレーナーを廃棄し、500 × g でRTで5分間回転させます。
- 細胞ペレットを20mLのPBSに再懸濁し、細胞をカウントする。500 × g でRTで5分間スピンします。 細胞を1.5 mLのセーフロック反応チューブに1 × 108 細胞/mL(注入量は0.1 mL /マウス)の濃度で滅菌PBSに再懸濁します。
- 細胞を氷上(1時間以内)に保存するか、細胞をRTに保ち、すぐに尾静脈注射に進みます。
5.外側尾静脈 を介した 糖尿病性脾細胞の静脈内注射
- 成体レシピエントNOD-scidマウスの体を温め(例えば、ヒートランプを~5〜10分間使用して)、静脈を血管拡張します(これは、視覚化と静脈への注射に役立ちます)。
注意: マウスの過熱を避けるために、この時間を超えないようにしてください。正常性状態を常に監視します。マウスが疲れ果てているか動かないように見える場合は、すぐにヒートランプを止めてください。 - 細胞懸濁液を温めます。滅菌針(27〜30 G、0.3 mm / 0.5インチ以下)で滅菌注射器(0.3〜1.0 mL)を準備するか、0.3 mm(0.5インチ)針を備えた滅菌0.5 mLインスリン注射器を使用します。.注射の合間に注射器を下ろす必要がある場合は、常に針を無菌状態に保ち、滅菌トレイを使用してください。
- 各注射の前に脾細胞溶液を再懸濁します。マウスごとに、予熱および混合した脾細胞懸濁液100 μLをシリンジに引き込みます。シリンジまたは懸濁液に気泡がないことを確認してください。
注意: マウスを拘束装置に入れる前に、すべての機器と消耗品(消毒用のアルコールワイプ、注射する脾細胞を装填した注射器、注射したマウスを分離するための新しいケージ)を準備していることを確認してください。 - マウスを拘束装置に置きます。利き手ではない手で尾を捕らえ、2つの外側尾静脈の1つを見つけます。必要に応じて尾をゆっくりと回転させます。消毒用ワイプ(70%イソプロピルアルコール)で尾を拭いて、皮膚をきれいにし、静脈の視認性を高めます。
- 利き手で針を尾の中央領域に鋭角に挿入します。針の斜角を上に向けて、針を皮膚に数ミリメートルスライドさせます。
注意: 針が静脈と平行で、皮膚の少し下に置いていることを確認してください。皮膚/血管壁を貫通した直後のマウス/尾の突然の動きに備えてください。針の挿入が成功すると、静脈への「滑らかなスライド」のように感じるはずです。別の試みが必要な場合は、尾をさらに体に向かって上に移動します。 - シリンジに穏やかな圧力を加えて、脾細胞懸濁液を注入します。注射時に針をさらに出し入れしないでください。成功した注射は、注射中に背圧を感じることなく滑らかであり、注射直後の透明/白色の血流によって示されます。
- 針を静脈からそっと外し、出血が止まるまで消毒用ワイプで尾に軽い圧力をかけます。マウスを拘束装置から離し、準備したてのケージにそっと移します。
注:NIT-1細胞移植を受けていない2〜3匹のコントロールマウスに脾細胞を注射して、自己反応性脾細胞が糖尿病を誘発する可能性を確認します。
6. NIT-1移植片の 生体 内生物発光イメージング
注:移植片を週に1〜2回画像化します。移植当日は、移植後少なくとも2時間待って、移植片が落ち着いて安定したルシフェラーゼ発現を確保します。時間が制限要因である場合は、代わりに最初の測定を1日目に行うことができます。推奨される初期イメージングスケジュールは、注射後0日目または1日目、5日目、10日目、14日目、18日目、および25日目です。ただし、生物発光シグナルの喪失によって判断される自己免疫の進行に基づいてスケジュールを調整します。
- ダルベッコのPBSで15 mg / mLのD-ルシフェリン溶液を調製します。RTで攪拌して溶解し、滅菌フィルター(0.22 μm)します。1 mLアリコートを-20°Cで保存し、必要に応じて解凍します。
注:アリコートは再凍結することができます。 - イメージングの少なくとも5分前に、1 mLシリンジと26 G針を使用してマウスを腹腔内に注射し、D-ルシフェリン溶液を150 mg / kgの用量で注入します。.
注意: マウスごとに新しい注射器と針を使用してください。 - 施設内のガイドラインに従ってイソフルラン吸入によりマウスを麻酔する。推奨条件は、ノックダウンチャンバーへの流量1.5 L/min、排気速度9 L/minの2.5%イソフルランです。
- 乾燥を防ぐために眼科用軟膏で動物の目を滑らかにします。
- イメージング機器に関連付けられているソフトウェアを開きます。新しいユーザーやログインを作成します。右下のコントロールパネルで、[初期化]を選択します(図2A)。画像データを自動保存するには、コンピューター上に適切なフォルダーを作成し、[取得 |自動保存先...(図2A)。機器の初期化が完了したら、露光時間を1分に設定します。
メモ: 完全なイメージングパラメータを 図2Bに示します。 - マウスをノックダウンチャンバーからイメージング機器に一度に1つずつ移します。手足を広げた状態でマウスを胃の上に置き、頭をノーズコーンにそっと導きます。ノーズコーン を介して 供給される0.25 L/minのイソフルラン流量は、イメージング中に麻酔を維持するのに適しています。マウスの背中の中央を両手で押してから、手を外側に広げて離して、マウスをゆっくりと平らにします。
- [取得]を選択します(図2B)。実験の関連する詳細をポップアップウィンドウに記録します(図2C)。
注:さまざまな時点で2つの移植片を移植した3匹の8週齢の雌NOD-scidマウスの代表的な画像については 、図3A を参照してください。
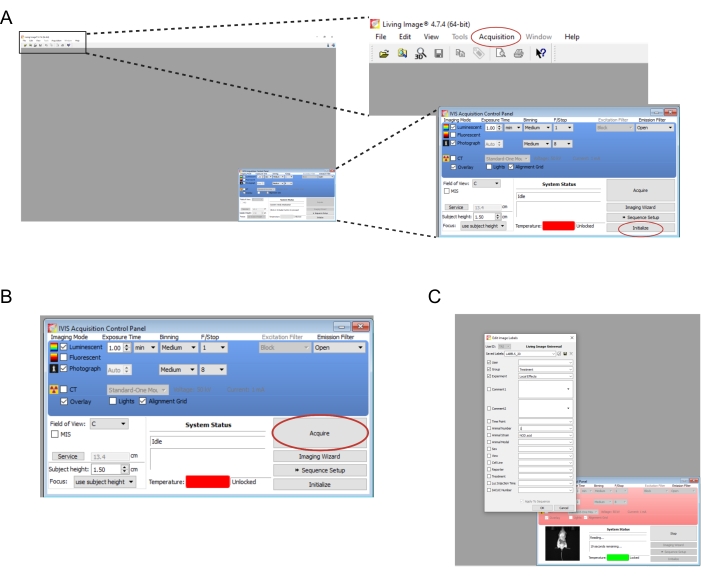
図2:生物発光移植片をイメージングするためのソフトウェアコマンドのスクリーンショット 。 (A)イメージングの前に、 初期化 を選択して機器を準備します。画像は、[ 取得] を選択することで、選択したフォルダに自動保存できます。 自動保存先... (B)イメージングパラメータの概要。マウスを機器に配置したら、 取得を選択します。(C) イメージング中にポップアップするダイアログボックスのスクリーンショット。時点やマウス系統などの詳細をここに入力できます。 この図の拡大版を表示するには、ここをクリックしてください。
7.データ分析
- イメージング後いつでも生物発光シグナルを定量化できます。イメージング機器に関連付けられているソフトウェアを開きます。 ファイルを選択 |分析するマウスに関連付けられている ClickInfo.txt ファイル を開き、選択します。
- ツール パレットで、[ ROI ツール ]を選択します(図 3B、ステップ 1)。 楕円形 のドロップダウンメニュー(図3B、ステップ1、赤い矢印)から、マウスに移植された移植片の数を選択します。
- 各移植片からの生物発光シグナルが含まれるように楕円を移動し、[ ROIの測定 ]を選択します(図3B、ステップ2)。
- 各移植片 の合計数を 記録します(図3B、ステップ3)。
- 各移植片について、各時点で測定された生物発光シグナルを、最初の時点で測定されたシグナルで割ります。 移植片の生存 を、初期生物発光シグナルに対する残留生物発光シグナルの割合またはパーセンテージとして報告する。
注:移植後に移植片が拡大する場合、移植片の生存率または割合はそれぞれ1または100%を超えます。移植を受けるすべてのマウスは、健康への悪影響について監視する必要があります。
Access restricted. Please log in or start a trial to view this content.
結果
プロトコルの概要を 図 1 に示します。変異体および非標的対照などの2つの細胞株の生存率を比較してもよいし、または1つの細胞株の生存を、薬物処理マウス対ビヒクル処理対照などの複数のマウス群で測定してもよい。 図3A は、非標的対照(左)および変異(右)細胞株を移植した3匹の8週齢の雌NOD-scidマウスを示す。マウスはまた、糖尿病を移すた?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
T1Dは現在治療法が存在しない壊滅的な病気です。ベータ細胞補充療法は、この病気の患者に有望な治療法を提供しますが、この戦略に対する重大な障壁は、移植されたベータ細胞に対する再発性自己免疫攻撃の可能性です。免疫の可視性または感受性を低下させるためのSC-β細胞の遺伝子工学は、この問題に対する1つの潜在的な解決策です。本明細書に記載されるのは、マウスにおける自己?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は、利益相反がないことを宣言します。
謝辞
このプロトコルに記載されている方法を開発したエリカ・P・カイ博士と石川祐樹博士に感謝します(参考文献11を参照)。S.K.とP.Y.の研究室での研究は、国立衛生研究所(NIH)(R01DK120445、P30DK036836)、JDRF、ハーバード幹細胞研究所、ビートソン財団からの助成金によってサポートされています。T.S.は国立糖尿病・消化器・腎臓病研究所(NIDDK)(T32 DK007260-45)のポスドクフェローシップによってサポートされ、K.B.はメアリーK.アイアコッカ財団からのフェローシップによって部分的にサポートされました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin, 0.53 mM EDTA | Corning | 25-052-CI | |
| 293FT | Invitrogen | R70007 | Fast-growing, highly transfectable clonal isolate derived from human embryonal kidney cells transformed with the SV40 large T antigen |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| Alcohol prep pads, 70% Isopropyl alcohol | Amazon/Ever Ready First Aid | B08NWF31DX | |
| BD 5ml Syringe Luer-Lok Tip | BD | 309646 | |
| BD PrecisionGlide Needle 26G x 5/8 (0.45 mm x 16 mm) Sub-Q | BD | 305115 | |
| BD 1 mL TB Syringe Slip Tip | BD | 309659 | |
| Blasticidin S HCl | Corning | 30-100-RB | |
| Cell strainer premium SureStrain, 70 µm, sterile | Southern Labware | C4070 | Or use similar sterile strainer with 40-70um pore size |
| CellDrop automated cell counter | Denovix | CellDrop BF-PAYG | Or use similar cell counter device |
| Corning 100 mL Penicillin-Streptomycin Solution, 100x | Corning | 30-002-CI | |
| Disposable Aspirating Pipets, Polystyrene, Sterile, Capacity=2 mL | VWR | 414004-265 | Or use similar aspirating pipette |
| D-Luciferin, Potassium Salt , Molecular Biology Grade, Powder, >99% | Goldbio | LUCK-100 | |
| DMEM, high glucose, pyruvate, no glutamine | Gibco | 10313039 | |
| Falcon BD tubes, 50 mL | Fisher Scientific | 14-959-49A | |
| Fetal Bovine Serum | Gibco | 10437-028 | |
| Forceps premium for tissues, 1 x 2 teeth 5 in, German Steel | Fisher Scientific | 13-820-074 | |
| Glucose urine test strip | California Pet Pharmacy | u-tsg100 | Or use similar test strip for glucose measurments in urine/blood |
| GlutaMAX–1 (100x) | Gibco | 35050-061 | |
| Infrared heating lamp | Cole Parmer | 03057-00 | Or use similar infrared lamp |
| Insulin syringe 0.5 mL, U-100 29 G 0.5 in | Becton Dickinson | 309306 | |
| Isoflurane, USP | Piramal Critical Care | 6679401725 | |
| IVIS Spectrum in vivo imaging system | Perkin Elmer | 124262 | Instrument for non-invasively collecting bioluminescent images of transplanted cells |
| Living Image Analysis Software | Perkin Elmer | 128113 | Software for collecting and quantifying bioluminescent signal |
| Microcentrifuge tubes seal-rite, 1.5 mL | USA Scientific | 1615-5510 | Or use similar sterile microcentrifuge tubes |
| NIT-1 | ATCC | CRL-2055 | Pancreatic beta-celll line derived from NOD/Lt mice |
| NOD.Cg-Prkdcscid/J | The Jackson Laboratory | 001303 | Mice homozygous for the severe combined immune deficiency spontaneous mutation Prkdcscid, commonly referred to as scid, are characterized by an absence of functional T cells and B cells, lymphopenia, hypogammaglobulinemia, and a normal hematopoietic microenvironment. |
| NOD/ShiLtJ | The Jackson Laboratory | 001976 | The NOD/ShiLtJ strain of mice (commonly called NOD) is a polygenic model for autoimmune type 1 diabetes |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010031 | No calcium, no magnesium, no phenol red |
| pCMV-VSV-G | Addgene | 8454 | |
| pLenti-luciferase-blast | Made in-house | Plasmid available upon request | See Supplemental File 1 |
| pMD2.G | Addgene | 12259 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polyethylenimine, Linear, MW 25,000, Transfection Grade (PEI 25K) | Fisher Scientific | NC1014320 | |
| pRSV-Rev | Addgene | 12253 | |
| Restrainer for rodents, broome-style round 1 in | Fisher Scientific | 01-288-32A | |
| Scissors, sharp-pointed | Fisher Scientific | 08-940 | Or use other scissors made of surgical-grade stainless steel |
| Tissue-culture treated culture dishes | Millipore Sigma | CLS430167-20EA | Or use other sterile cell culture-treated Petri dishes |
| Tweezers/Forceps, fine precision medium tipped | Fisher Scientific | 12-000-157 |
参考文献
- Katsarou, A., et al. Type 1 diabetes mellitus. Nature Reviews Disease Primers. 3, 17016(2017).
- Shapiro, A. M., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews Endocrinology. 13 (5), 268-277 (2017).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Russ, H. A., et al. Controlled induction of human pancreatic progenitors produces functional beta-like cells in vitro. EMBO Journal. 34 (13), 1759-1772 (2015).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nature Biotechnology. 32 (11), 1121-1133 (2014).
- Vertex Announces Positive Day 90 Data for the First Patient in the Phase 1_2 Clinical Trial Dosed With VX-880, a Novel Investigational Stem Cell-Derived Therapy for the Treatment of Type 1 Diabetes. Businesswire. , Available from: https://www.businesswire.com/news/home/20211018005226/en/Vertex-Announces-Positive-Day-90-Data-for-the-First-Patient-in-the-Phase-12-Clinical-Trial-Dosed-With-VX-880-a-Novel-Investigational-Stem-Cell-Derived-Therapy-for-the-Treatment-of-Type-1-Diabetes (2021).
- Gamble, A., Pepper, A. R., Bruni, A., Shapiro, A. M. J. The journey of islet cell transplantation and future development. Islets. 10 (2), 80-94 (2018).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the Non Obese Diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Hamaguchi, K., Gaskins, R. H., Leiter, E. H. NIT-1, a pancreatic β-cell line established from a transgenic NOD/Lt mouse. Diabetes. 40 (7), 842-849 (1991).
- Christianson, S. W., Shultz, L. D., Leiter, E. D. Adoptive transfer of diabetes into immunodeficient NOD-scid/scid mice: Relative contribution of CD4+ and CD8+ T-cells from diabetogenic versus prediabetic NOD.NON-Thy1a donors. Diabetes. 42 (1), 44-55 (1993).
- Cai, E. P., et al. Genome-scale in vivo CRISPR screen identifies RNLS as a target for beta cell protection in type 1 diabetes. Nature Metabolism. 2 (9), 934-945 (2020).
- Parent, A. V., et al. Selective deletion of human leukocyte antigens protects stem cell-derived islets from immune rejection. Cell Reports. 36 (7), 109538(2021).
- Brehm, M. A., et al. Lack of acute xenogeneic graft-versus-host disease, but retention of T-cell function following engraftment of human peripheral blood mononuclear cells in NSG mice deficient in MHC class I and II expression. FASEB Journal. 33 (3), 3137-3151 (2019).
- Abdulreda, M. H., et al. In vivo imaging of type 1 diabetes immunopathology using eye-transplanted islets in NOD mice. Diabetologia. 62 (7), 1237-1250 (2019).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved