Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Monitorización bioluminiscente de la supervivencia del injerto en un modelo de transferencia adoptiva de diabetes autoinmune en ratones
En este artículo
Resumen
Este protocolo describe un método sencillo y mínimamente invasivo para trasplantar e imágenes de células NIT-1 en ratones inmunodeficientes combinados diabéticos no obesos (NOD) graves desafiados con esplenocitos purificados de ratones NOD espontáneamente diabéticos.
Resumen
La diabetes tipo 1 se caracteriza por la destrucción autoinmune de las células beta productoras de insulina del páncreas. Un tratamiento prometedor para esta enfermedad es el trasplante de células beta derivadas de células madre. Sin embargo, las modificaciones genéticas pueden ser necesarias para proteger las células trasplantadas de la autoinmunidad persistente. Los modelos de ratón diabético son una herramienta útil para la evaluación preliminar de estrategias para proteger las células trasplantadas del ataque autoinmune. Aquí se describe un método mínimamente invasivo para trasplantar e imágenes de injertos celulares en un modelo de transferencia adoptiva de diabetes en ratones. En este protocolo, las células de la línea celular beta pancreática murina NIT-1 que expresan el transgén luciferasa luc2 se trasplantan por vía subcutánea en ratones inmunodeficientes diabéticos no obesos (NOD) inmunodeficientes combinados graves (scid). Estos ratones se inyectan simultáneamente por vía intravenosa con esplenocitos de ratones NOD espontáneamente diabéticos para transferir la autoinmunidad. Los injertos se visualizan a intervalos regulares a través de imágenes bioluminiscentes no invasivas para monitorear la supervivencia celular. La supervivencia de las células mutantes se compara con la de las células de control trasplantadas en el mismo ratón.
Introducción
La diabetes tipo 1 (DT1) es causada por la destrucción autoinmune de las células beta productoras de insulina del páncreas. La pérdida de masa de células beta resulta en deficiencia de insulina e hiperglucemia. Los pacientes con DT1 dependen de múltiples inyecciones diarias de insulina exógena y experimentan episodios de hiperglucemia e hipoglucemia graves a lo largo de sus vidas. Las complicaciones relacionadas con estos episodios incluyen retinopatía diabética, disminución de la función renal y neuropatía1.
Las inyecciones de insulina son un tratamiento, pero no una cura para la DT1. Sin embargo, reemplazar la masa de células beta perdidas tiene el potencial de revertir la enfermedad al permitir que los pacientes produzcan su propia insulina. Sin embargo, el suministro de islotes donantes cadavéricos es limitado2. Los islotes derivados de células madre (islotes SC) pueden proporcionar un suministro prácticamente ilimitado de células beta para trasplante. Varios grupos han demostrado que las células madre embrionarias humanas (ESC) y las células madre pluripotentes inducidas (iPSC) pueden diferenciarse para generar células similares a beta funcionales 3,4,5. Los datos prometedores de los primeros ensayos clínicos indican que estas células mantienen su función después del trasplante y pueden permitir que los pacientes se vuelvan independientes de la insulina6. Sin embargo, se requiere inmunosupresión crónica, lo que aumenta su susceptibilidad al cáncer y la infección. Además, los agentes inmunosupresores pueden ser citotóxicos para los injertos a largo plazo7. Para eliminar la necesidad de inmunosupresión, los islotes SC pueden modificarse genéticamente para protegerlos de la autoinmunidad recurrente, así como de la aloinmunidad después del trasplante.
La investigación con células madre es muy exigente en costos y mano de obra. Las líneas celulares de ratón y los modelos animales son herramientas útiles para la identificación inicial y validación experimental de estrategias para proteger las células trasplantadas de la autoinmunidad. El ratón NOD desarrolla diabetes autoinmune espontánea con muchas similitudes con la DT1 humana8, y la línea celular de insulinoma NIT-1 comparte un fondo genético con esta cepa de ratón9. La diabetes puede ser transferida adoptivamente a la cepa de ratón NOD-scid inmunodeficiente relacionada a través de la inyección de esplenocitos diabéticos de ratones NOD para sincronizar temporalmente el inicio de la diabetes en ratones experimentales replicados10. Este modelo se puede utilizar para identificar objetivos genéticos de forma relativamente rápida y económica para su posterior validación en islotes SC. Recientemente, el método se aplicó para identificar y validar RNLS, un objetivo que se encontró que protege los islotes humanos primarios de la autoinmunidad in vivo y los islotes derivados de iPSC del estrés de las células beta in vitro11. Aquí se describe un protocolo sencillo para trasplantar células NIT-1 genéticamente modificadas y monitorear de forma no invasiva su supervivencia en un modelo de transferencia adoptiva de diabetes autoinmune en ratones.
Access restricted. Please log in or start a trial to view this content.
Protocolo
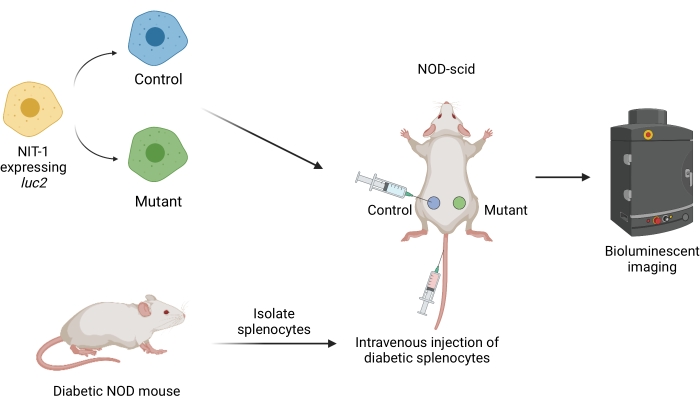
Figura 1: El flujo de trabajo para trasplantar e imágenes de injertos en un modelo de transferencia adoptiva de diabetes en ratones. Las células NIT-1 que expresan el transgén luciferasa luciferasa (luc2) se trasplantan por vía subcutánea en ratones NOD-scid. Los ratones son inyectados simultáneamente con esplenocitos autorreactivos aislados de un ratón NOD espontáneamente diabético. Los injertos se visualizan a intervalos regulares mediante imágenes bioluminiscentes no invasivas. Figura creada por BioRender.com. Abreviaturas: NOD = diabético no obeso; IDCG = inmunodeficiencia combinada grave. Haga clic aquí para ver una versión más grande de esta figura.
Todos los protocolos de cuidado y estudio de animales fueron aprobados y realizados de acuerdo con el Comité Institucional de Cuidado y Uso de Animales (IACUC) en el Centro de Diabetes Joslin. Los ratones NOD y NOD-scid se pueden obtener fácilmente de fuentes comerciales. Todos los ratones en este estudio se mantienen en una instalación monitoreada por centinelas. Consulte la Tabla de materiales para obtener detalles relacionados con todos los materiales, animales, instrumentos y software utilizados en este protocolo.
1. Ingeniería y mantenimiento de líneas celulares NIT-1
- Mantener líneas celulares NIT-1, que comparten un fondo genético con ratones NOD, y células 293FT en platos tratados con cultivo de tejidos en DMEM que contienen 4,5 g / L de glucosa suplementada con 10% de suero bovino fetal y 1% de penicilina/estreptomicina en una incubadora de 37 °C con 5% deCO2.
- Cultive las células 293FT a 70% -80% de confluencia para la transfección.
- Por plato de 10 cm de células 293FT, combine 10 μg de plente-luciferasa-blasto (ver Archivo suplementario 1), que expresa el transgén luciferasa luciérnaga (luc2) bajo el control del promotor EF1α constitutivamente activo, 2 μg cada uno de los plásmidos de empaquetamiento pMD2.G, pMDLg/pRRE y pRSV-Rev, 4 μg del plásmido proteico de la envoltura pCMV-VSV-G, y 60 μg de polietilenimina lineal (PEI) en 1 ml de DMEM libre de suero. Ajuste las cantidades en función del número de células a transaccionar.
- Deje el ADN, PEI y DMEM a temperatura ambiente (RT) durante 20 minutos y luego agréguelos a las celdas de 293FT.
- Recoger el medio que contiene las partículas lentivirales 48 h después de la transfección.
- Transducir las células NIT-1 a ~80% de confluencia con 1 ml de medio que contiene partículas lentivirales por 106 células durante 48-72 h.
- Seleccione las células que expresan luciferasa con 5 μg/ml de blasticidina durante 48 h.
- Modificar genéticamente las células que expresan luciferasa para adaptarse a la cuestión experimental. Incluya una línea celular de control de tipo salvaje que exprese luciferasa o no dirigida para la comparación.
NOTA: Ejemplos de modificaciones del gen objetivo incluyen CRISPR knockout, CRISPRa/i, shRNA knockdown y sobreexpresión.
2. Preparación de células NIT-1 para trasplante
- Cultive las células que expresan luciferasa hasta que sean 80% -90% confluentes.
- Retire el medio de crecimiento y lave las células con solución salina tamponada con fosfato (PBS, 5 ml para una placa de 10 cm).
- Agregue 1 ml de tripsina-EDTA al 0,05% a cada plato durante 2 minutos.
- Neutralizar la tripsina con 5 mL de medio de crecimiento.
- Use una pipeta para lavar las células del plato y transferirlas a un tubo cónico.
NOTA: Se pueden combinar células de varias placas de la misma línea celular. - Cuente las células usando una tinción como el azul de tripano manualmente con un hemocitómetro o automáticamente con un contador automático de células.
- Centrifugar a 250 × g durante 5 min a RT y retirar el sobrenadante con una pipeta aspiradora.
- Resuspender el pellet celular en PBS a una concentración de 5 × 10 7 células/ml (se trasplantarán 107 células por línea celular por ratón en un volumen de 200 μL).
- Mantenga las células en hielo (hasta 3 h) hasta el trasplante.
3. Trasplante de células NIT-1 en ratones NOD-scid
- Anestesiar a los ratones receptores (ratones NOD-scid de 8-10 semanas de edad del mismo sexo que los ratones utilizados para aislar los esplenocitos) por inhalación de isoflurano en una cámara de derribo. Suministrar isoflurano al 2,5% en la cámara a un caudal de 1,5 L/min y una velocidad de evacuación de 9 L/min.
- Lubrique los ojos del animal con ungüento oftálmico para evitar que se seque.
- Usando una afeitadora eléctrica con un protector, retire el pelo de la parte posterior (lado dorsal) de los ratones para exponer la piel. El área de trasplante afeitada será de aproximadamente 1 en x 2 pulgadas. Devuelva los ratones afeitados a la cámara de derribo hasta el trasplante.
- Transfiera los ratones uno a la vez a una superficie limpia con un cono nasal de isoflurano. Guíe suavemente la cabeza del ratón hacia el cono de la nariz. Utilice un caudal de isoflurano de 0,25 L/min para mantener la anestesia durante el trasplante.
- Limpie el área de trasplante con una almohadilla de preparación de alcohol isopropílico para eliminar el vello suelto y desinfectar la piel.
- Asegúrese de que las celdas estén completamente resuspendidas antes de cargar la jeringa. Extraiga un exceso de volumen (>300 μL) de células en una jeringa estéril de 1 ml con una aguja de 26 G. Retire cualquier burbuja; luego, devolver el exceso de células al tubo para que permanezcan 300 μL de suspensión celular en la jeringa.
- Con un par de pinzas curvas sostenidas en la mano no dominante, levante suavemente la piel de un lado (izquierdo o derecho) de la espalda del ratón para permitir un acceso más fácil al espacio subcutáneo.
- Con la mano dominante, coloque la jeringa paralela a los planos coronal y sagital del cuerpo del ratón. Con la aguja apuntando hacia la cabeza del ratón, inserte la aguja en la piel cerca de los cuartos traseros y guíela suavemente hacia el espacio subcutáneo. Asegúrese de que toda la aguja permanezca debajo de la piel y no sobresalga.
- Ajuste los fórceps para sujetar suavemente la piel alrededor de la base de la aguja. Dispense lentamente una pequeña cantidad de suspensión celular (<50 μL) y confirme que se forma una pequeña protuberancia debajo de la piel en el sitio de la inyección. Continuar inyectando la suspensión celular hasta que se hayan entregado 200 μL al espacio subcutáneo.
- Sosteniendo las pinzas en su lugar y manteniendo la aguja paralela al cuerpo del ratón, retire lentamente la aguja. Después de retirar la aguja, mantenga la piel cerrada con fórceps durante unos segundos para evitar que las células se escapen de la herida punzante.
- Si se está evaluando una modificación genética, repita el trasplante en el lado opuesto del ratón con una jeringa diferente para que se inyecten células mutantes y de control en cada ratón, con una línea celular a la izquierda y la otra a la derecha. Si solo se está trasplantando una línea celular, inyecte las células en un solo lado.
- Después del trasplante, transfiera cada ratón a una jaula nueva. Permita que cada ratón se recupere completamente de la anestesia antes de agregar ratones adicionales a la jaula.
NOTA: Los ratones se recuperan cuando reanudan sus actividades normales y no muestran signos de letargo o alteración del movimiento. - Evaluar el estado de salud de los ratones diariamente durante la duración del experimento después del trasplante. Si los injertos forman una protuberancia grande o los ratones se vuelven débiles y letárgicos, mida su glucosa en sangre y proporcione 10% (p/p) de agua de sacarosa ad libitum a todos los ratones hipoglucémicos. Siga todas las recomendaciones veterinarias y eutanasia a cualquier ratón con mala condición corporal continua según las pautas institucionales. En este estudio, los ratones fueron sacrificados por inhalación deCO2 seguida de dislocación cervical.
4. Aislamiento y purificación de esplenocitos autorreactivos
- Identifique ratones NOD machos o hembras de 10 a 16 semanas de edad con diabetes de inicio reciente (menos de 10 días) mediante el uso de tiras reactivas de glucosa en orina (o sangre). Los ratones NOD se consideran diabéticos cuando tienen orina / glucosa en sangre ≥ 250 mg / dL en al menos 2 días consecutivos.
NOTA: Para cada ratón NOD-scid, se necesitan 10 millones de esplenocitos; Un bazo típicamente produce de 50 millones a 150 millones de esplenocitos. Los esplenocitos se aislaron de ratones libres de patógenos alojados en una instalación monitoreada por centinelas. - Eutanasia el número apropiado de ratones diabéticos NOD.
NOTA: En este estudio, los ratones fueron sacrificados por inhalación deCO2 seguida de dislocación cervical para asegurar la muerte. - Con el ratón en su espalda, haga una incisión vertical de aproximadamente 2 pulgadas de largo en la piel con tijeras quirúrgicas. Abra el lado derecho del ratón desde el punto de vista del investigador y localice el bazo rojo brillante. Corte suavemente el bazo lejos del páncreas rosado y transfiéralo a una placa de Petri estéril de 10 cm que contenga 5 ml de PBS estéril. Repita la disección con tantos ratones como sea necesario.
NOTA: Los bazos de varios ratones se pueden combinar en un solo plato. Realice los siguientes pasos utilizando reactivos y equipos estériles en una campana estéril. - Triture el bazo (s) con la parte superior plana de un émbolo de jeringa estéril.
- Coloque un filtro de 40 μm o 70 μm en un tubo cónico de 50 ml y lave el colador con 5 ml de PBS para prepararlo. Transfiera la(s) suspensión(es) del bazo al colador y continúe triturando suavemente a través del colador. Lave el plato con 10 ml de PBS y transfiera el lavado al colador. Continúe machacando hasta que el color rojo haya desaparecido del colador.
- Deseche el colador y gire el tubo a 500 × g durante 5 min a RT. Retire el sobrenadante con una pipeta aspiradora.
- Resuspender el pellet celular en 5 ml (para hasta tres bazos) de tampón de lisis ACK precalentado a RT y lisar los glóbulos rojos durante 4 min. Aumente el volumen en 1-2 ml por bazo si se necesitan bazos adicionales.
- Detenga la reacción con 5 ml de medios celulares NIT-1 (descritos anteriormente) por 5 ml de tampón de lisis. Pase la suspensión celular a través de un colador nuevo para eliminar los grumos. Deseche el colador y gire a 500 × g durante 5 minutos a RT.
- Resuspender el pellet celular en 20 mL de PBS y contar las células. Girar a 500 × g durante 5 min a RT. Resuspender las células en PBS estéril a una concentración de 1 × 108 células/ml (el volumen de inyección es de 0,1 ml/ratón) en un tubo de reacción de bloqueo seguro de 1,5 ml.
- Almacene las células en hielo (durante no más de 1 h) o mantenga las células en RT, y proceda a la inyección de la vena de la cola inmediatamente.
5. Inyección intravenosa de esplenocitos diabéticos a través de la vena lateral de la cola
- Caliente el cuerpo de los ratones receptores adultos NOD-scid (por ejemplo, usando una lámpara de calor durante ~ 5-10 min) para vasodilatar las venas (esto ayuda a la visualización e inyección en la vena).
NOTA: Para evitar el sobrecalentamiento de los ratones, no exceda este tiempo. Siempre controle el estado de salud. Si los ratones parecen agotados o inmóviles, apague la lámpara de calor inmediatamente. - Calienta la suspensión celular. Prepare una jeringa estéril (0.3-1.0 ml) con una aguja estéril (27-30 G, 0.3 mm/0.5 pulgadas o menos), o use una jeringa estéril de insulina de 0.5 ml con una aguja de 0.3 mm (0.5 pulgadas). Mantenga siempre la aguja estéril y utilice una bandeja estéril si la jeringa debe colocarse entre inyecciones.
- Vuelva a suspender la solución de esplenocitos antes de cada inyección. Para cada ratón, extraer 100 μL de la suspensión de esplenocitos precalentada y mezclada en la jeringa. Asegúrese de que no haya burbujas de aire en la jeringa o en la suspensión.
NOTA: Asegúrese de tener todo el equipo y los suministros preparados (toallitas con alcohol para la desinfección, una jeringa cargada con los esplenocitos que se inyectarán y una jaula nueva para separar los ratones inyectados) antes de colocar el ratón en el dispositivo de sujeción. - Coloque el ratón en el dispositivo de sujeción. Captura la cola con la mano no dominante y localiza una de las dos venas laterales de la cola. Gire suavemente la cola si es necesario. Limpie la cola con una toallita desinfectante (alcohol isopropílico al 70%) para limpiar la piel y aumentar la visibilidad de la vena.
- Inserte la aguja en un ángulo agudo en la región central de la cola con la mano dominante. Con el bisel de la aguja hacia arriba, deslice la aguja unos milímetros a través de la piel.
NOTA: Asegúrese de que la aguja esté paralela a la vena y colocada ligeramente debajo de la piel. Esté preparado para movimientos bruscos del ratón / cola directamente después de penetrar la pared de la piel / vaso. Una inserción exitosa de la aguja debe sentirse como un "deslizamiento suave" en la vena. Si se necesita otro intento, muévase más arriba de la cola hacia el cuerpo. - Aplique una presión suave a la jeringa para inyectar la suspensión de esplenocitos. No permita que la aguja se mueva más hacia adentro o hacia afuera cuando se inyecta. Las inyecciones exitosas son suaves sin sentir ninguna contrapresión durante la inyección y están indicadas por un flujo sanguíneo transparente/blanco inmediatamente después de la inyección.
- Suelte suavemente la aguja fuera de la vena y aplique una ligera presión en la cola con una toallita desinfectante hasta que se detenga el sangrado. Suelte el ratón del dispositivo de sujeción y transfiéralo suavemente a una jaula recién preparada.
NOTA: Inyecte dos o tres ratones control que no reciben un trasplante de células NIT-1 con esplenocitos para confirmar el potencial de los esplenocitos autorreactivos para inducir diabetes, que tarda aproximadamente 2-4 semanas después de la inyección.
6. Imágenes bioluminiscentes in vivo de injertos NIT-1
NOTA: Imagen de los injertos una o dos veces por semana. El día del trasplante, espere al menos 2 h después del trasplante para permitir que los injertos se asienten y asegurar una expresión estable de luciferasa. Si el tiempo es un factor limitante, la medición inicial se puede tomar el día 1 en su lugar. Un programa de imágenes inicial recomendado es el Día 0 o el Día 1 después de la inyección, el Día 5, el Día 10, el Día 14, el Día 18 y el Día 25. Ajuste el cronograma, sin embargo, en función del progreso de la autoinmunidad a juzgar por la pérdida de señal bioluminiscente.
- Prepare una solución de D-luciferina de 15 mg/ml en PBS de Dulbecco. Agitar a RT para disolver, y filtro estéril (0,22 μm). Conservar 1 ml de alícuotas a −20 °C y descongelar según sea necesario.
NOTA: Las alícuotas se pueden volver a congelar. - Al menos 5 minutos antes de la toma de imágenes, inyecte los ratones por vía intraperitoneal con una jeringa de 1 ml y una aguja de 26 g con solución de D-luciferina a una dosis de 150 mg / kg.
NOTA: Utilice una jeringa y una aguja nuevas para cada ratón. - Anestesiar a los ratones por inhalación de isoflurano de acuerdo con las directrices institucionales. Las condiciones recomendadas son isoflurano al 2,5% con un caudal de 1,5 L/min en la cámara de desmontaje y una velocidad de evacuación de 9 L/min.
- Lubrique los ojos del animal con ungüento oftálmico para evitar que se seque.
- Abra el software asociado con el instrumento de imagen. Crear un nuevo usuario y/o inicio de sesión. En el panel de control de la parte inferior derecha, seleccione Inicializar (Figura 2A). Para guardar automáticamente los datos de imágenes, cree las carpetas adecuadas en el equipo y, a continuación, seleccione Adquisición | Guardar automáticamente en... (Figura 2A). Una vez que el instrumento haya terminado de inicializarse, ajuste el tiempo de exposición a 1 min.
NOTA: Los parámetros completos de imagen se muestran en la Figura 2B. - Transfiera los ratones uno a la vez desde la cámara de derribo al instrumento de imagen. Coloque el ratón sobre su estómago con sus extremidades extendidas y guíe suavemente su cabeza hacia el cono de la nariz. Un caudal de isoflurano de 0,25 L/min administrado a través de un cono nasal es apropiado para mantener la anestesia durante la obtención de imágenes. Aplana suavemente el ratón presionando el centro de su espalda con ambas manos y luego extendiendo las manos hacia afuera y separadas.
- Seleccione Adquirir (Figura 2B). Registre cualquier detalle relevante del experimento en la ventana emergente (Figura 2C).
NOTA: Consulte la Figura 3A para obtener imágenes representativas de tres ratones hembra NOD-scid hembra de 8 semanas de edad trasplantados con dos injertos en varios puntos temporales.
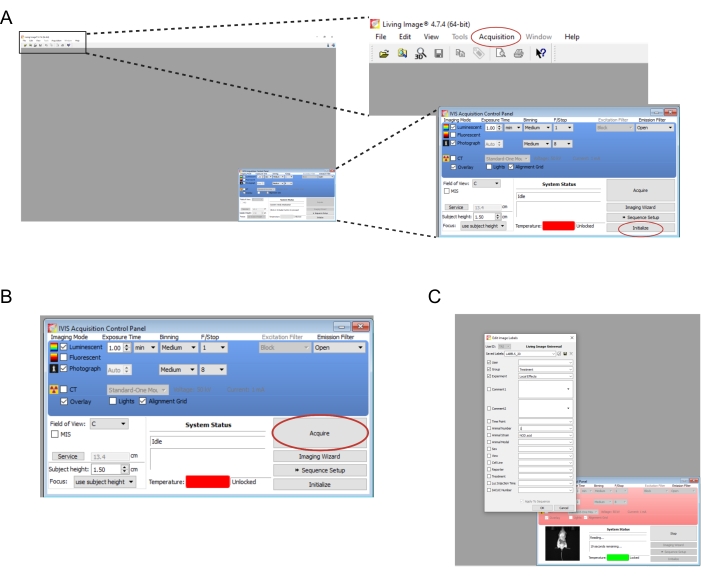
Figura 2: Capturas de pantalla de los comandos de software para obtener imágenes de injertos bioluminiscentes . (A) Antes de la toma de imágenes, seleccione Inicializar para preparar el instrumento. Las imágenes se pueden guardar automáticamente en una carpeta de su elección seleccionando Adquisición | Guardar automáticamente en... (B) Descripción general de los parámetros de imagen. Una vez colocado el ratón en el instrumento, seleccione Adquirir. (C) Captura de pantalla del cuadro de diálogo que aparece durante la creación de imágenes. Aquí se pueden introducir detalles como el punto de tiempo y la tensión del ratón. Haga clic aquí para ver una versión más grande de esta figura.
7. Análisis de datos
- Cuantificar la señal bioluminiscente en cualquier momento después de la obtención de imágenes. Abra el software asociado con el instrumento de imagen. Seleccionar archivo | Abra y seleccione el archivo ClickInfo.txt asociado con el mouse que desea analizar.
- En la paleta de herramientas, seleccione Herramientas de ROI (Figura 3B, Paso 1). En el menú desplegable ovalado (Figura 3B, Paso 1, flecha roja), seleccione el número de injertos que se trasplantaron al ratón.
- Mueva los óvalos de modo que contengan la señal bioluminiscente de cada injerto y seleccione Medir ROI (Figura 3B, Paso 2).
- Registre el recuento total para cada injerto (Figura 3B, Paso 3).
- Para cada injerto, divida la señal bioluminiscente medida en cada punto de tiempo por la señal medida en el primer punto de tiempo. Informar la supervivencia del injerto como la proporción o porcentaje de señal bioluminiscente residual en relación con la señal bioluminiscente inicial.
NOTA: Si los injertos se expanden después del trasplante, la razón o porcentaje de supervivencia del injerto será mayor que 1 o 100%, respectivamente. Todos los ratones que reciben trasplantes deben ser monitoreados para detectar efectos adversos para la salud.
Access restricted. Please log in or start a trial to view this content.
Resultados
En la figura 1 se describe una descripción general del protocolo. Se puede comparar la supervivencia de dos líneas celulares, como un mutante y un control no dirigido, o la supervivencia de una línea celular se puede medir en múltiples grupos de ratones, como los ratones tratados con medicamentos versus los controles tratados con vehículos. La Figura 3A muestra tres ratones hembra NOD-scid de 8 semanas de edad trasplantados con un control no dirigido (izqui...
Access restricted. Please log in or start a trial to view this content.
Discusión
La DT1 es una enfermedad devastadora para la que actualmente no existe cura. La terapia de reemplazo de células beta ofrece un tratamiento prometedor para los pacientes con esta enfermedad, pero la barrera crítica para esta estrategia es el potencial de ataque autoinmune recurrente contra las células beta trasplantadas. La ingeniería genética de las células SC-beta para reducir su visibilidad o susceptibilidad inmune es una posible solución a este problema. Aquí se describe un protocolo para obtener imágenes no ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores declaran que no tienen conflictos de intereses.
Agradecimientos
Agradecemos a la Dra. Erica P. Cai y al Dr. Yuki Ishikawa por desarrollar el método descrito en este protocolo (ver ref. 11). La investigación en los laboratorios de S.K. y P.Y. está respaldada por subvenciones de los Institutos Nacionales de Salud (NIH) (R01DK120445, P30DK036836), JDRF, el Instituto de Células Madre de Harvard y la Fundación Beatson. T.S. fue apoyado por una beca postdoctoral del Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales (NIDDK) (T32 DK007260-45), y K.B. fue apoyado en parte por una beca de la Fundación Mary K. Iacocca.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin, 0.53 mM EDTA | Corning | 25-052-CI | |
| 293FT | Invitrogen | R70007 | Fast-growing, highly transfectable clonal isolate derived from human embryonal kidney cells transformed with the SV40 large T antigen |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| Alcohol prep pads, 70% Isopropyl alcohol | Amazon/Ever Ready First Aid | B08NWF31DX | |
| BD 5ml Syringe Luer-Lok Tip | BD | 309646 | |
| BD PrecisionGlide Needle 26G x 5/8 (0.45 mm x 16 mm) Sub-Q | BD | 305115 | |
| BD 1 mL TB Syringe Slip Tip | BD | 309659 | |
| Blasticidin S HCl | Corning | 30-100-RB | |
| Cell strainer premium SureStrain, 70 µm, sterile | Southern Labware | C4070 | Or use similar sterile strainer with 40-70um pore size |
| CellDrop automated cell counter | Denovix | CellDrop BF-PAYG | Or use similar cell counter device |
| Corning 100 mL Penicillin-Streptomycin Solution, 100x | Corning | 30-002-CI | |
| Disposable Aspirating Pipets, Polystyrene, Sterile, Capacity=2 mL | VWR | 414004-265 | Or use similar aspirating pipette |
| D-Luciferin, Potassium Salt , Molecular Biology Grade, Powder, >99% | Goldbio | LUCK-100 | |
| DMEM, high glucose, pyruvate, no glutamine | Gibco | 10313039 | |
| Falcon BD tubes, 50 mL | Fisher Scientific | 14-959-49A | |
| Fetal Bovine Serum | Gibco | 10437-028 | |
| Forceps premium for tissues, 1 x 2 teeth 5 in, German Steel | Fisher Scientific | 13-820-074 | |
| Glucose urine test strip | California Pet Pharmacy | u-tsg100 | Or use similar test strip for glucose measurments in urine/blood |
| GlutaMAX–1 (100x) | Gibco | 35050-061 | |
| Infrared heating lamp | Cole Parmer | 03057-00 | Or use similar infrared lamp |
| Insulin syringe 0.5 mL, U-100 29 G 0.5 in | Becton Dickinson | 309306 | |
| Isoflurane, USP | Piramal Critical Care | 6679401725 | |
| IVIS Spectrum in vivo imaging system | Perkin Elmer | 124262 | Instrument for non-invasively collecting bioluminescent images of transplanted cells |
| Living Image Analysis Software | Perkin Elmer | 128113 | Software for collecting and quantifying bioluminescent signal |
| Microcentrifuge tubes seal-rite, 1.5 mL | USA Scientific | 1615-5510 | Or use similar sterile microcentrifuge tubes |
| NIT-1 | ATCC | CRL-2055 | Pancreatic beta-celll line derived from NOD/Lt mice |
| NOD.Cg-Prkdcscid/J | The Jackson Laboratory | 001303 | Mice homozygous for the severe combined immune deficiency spontaneous mutation Prkdcscid, commonly referred to as scid, are characterized by an absence of functional T cells and B cells, lymphopenia, hypogammaglobulinemia, and a normal hematopoietic microenvironment. |
| NOD/ShiLtJ | The Jackson Laboratory | 001976 | The NOD/ShiLtJ strain of mice (commonly called NOD) is a polygenic model for autoimmune type 1 diabetes |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010031 | No calcium, no magnesium, no phenol red |
| pCMV-VSV-G | Addgene | 8454 | |
| pLenti-luciferase-blast | Made in-house | Plasmid available upon request | See Supplemental File 1 |
| pMD2.G | Addgene | 12259 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polyethylenimine, Linear, MW 25,000, Transfection Grade (PEI 25K) | Fisher Scientific | NC1014320 | |
| pRSV-Rev | Addgene | 12253 | |
| Restrainer for rodents, broome-style round 1 in | Fisher Scientific | 01-288-32A | |
| Scissors, sharp-pointed | Fisher Scientific | 08-940 | Or use other scissors made of surgical-grade stainless steel |
| Tissue-culture treated culture dishes | Millipore Sigma | CLS430167-20EA | Or use other sterile cell culture-treated Petri dishes |
| Tweezers/Forceps, fine precision medium tipped | Fisher Scientific | 12-000-157 |
Referencias
- Katsarou, A., et al. Type 1 diabetes mellitus. Nature Reviews Disease Primers. 3, 17016(2017).
- Shapiro, A. M., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews Endocrinology. 13 (5), 268-277 (2017).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Russ, H. A., et al. Controlled induction of human pancreatic progenitors produces functional beta-like cells in vitro. EMBO Journal. 34 (13), 1759-1772 (2015).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nature Biotechnology. 32 (11), 1121-1133 (2014).
- Vertex Announces Positive Day 90 Data for the First Patient in the Phase 1_2 Clinical Trial Dosed With VX-880, a Novel Investigational Stem Cell-Derived Therapy for the Treatment of Type 1 Diabetes. Businesswire. , Available from: https://www.businesswire.com/news/home/20211018005226/en/Vertex-Announces-Positive-Day-90-Data-for-the-First-Patient-in-the-Phase-12-Clinical-Trial-Dosed-With-VX-880-a-Novel-Investigational-Stem-Cell-Derived-Therapy-for-the-Treatment-of-Type-1-Diabetes (2021).
- Gamble, A., Pepper, A. R., Bruni, A., Shapiro, A. M. J. The journey of islet cell transplantation and future development. Islets. 10 (2), 80-94 (2018).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the Non Obese Diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Hamaguchi, K., Gaskins, R. H., Leiter, E. H. NIT-1, a pancreatic β-cell line established from a transgenic NOD/Lt mouse. Diabetes. 40 (7), 842-849 (1991).
- Christianson, S. W., Shultz, L. D., Leiter, E. D. Adoptive transfer of diabetes into immunodeficient NOD-scid/scid mice: Relative contribution of CD4+ and CD8+ T-cells from diabetogenic versus prediabetic NOD.NON-Thy1a donors. Diabetes. 42 (1), 44-55 (1993).
- Cai, E. P., et al. Genome-scale in vivo CRISPR screen identifies RNLS as a target for beta cell protection in type 1 diabetes. Nature Metabolism. 2 (9), 934-945 (2020).
- Parent, A. V., et al. Selective deletion of human leukocyte antigens protects stem cell-derived islets from immune rejection. Cell Reports. 36 (7), 109538(2021).
- Brehm, M. A., et al. Lack of acute xenogeneic graft-versus-host disease, but retention of T-cell function following engraftment of human peripheral blood mononuclear cells in NSG mice deficient in MHC class I and II expression. FASEB Journal. 33 (3), 3137-3151 (2019).
- Abdulreda, M. H., et al. In vivo imaging of type 1 diabetes immunopathology using eye-transplanted islets in NOD mice. Diabetologia. 62 (7), 1237-1250 (2019).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados