Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Farelerde Otoimmün Diyabetin Evlat Edinilen Transfer Modelinde Greft Sağkalımının Biyolüminesan İzlenmesi
Bu Makalede
Özet
Bu protokol, spontan diyabetik NOD farelerinden saflaştırılmış splenositlerle mücadele eden obez olmayan diyabetik (NOD)-şiddetli kombine immün yetmezlikli farelerde NIT-1 hücrelerinin nakli ve görüntülenmesi için basit ve minimal invaziv bir yöntemi tanımlamaktadır.
Özet
Tip 1 diyabet, pankreasın insülin üreten beta hücrelerinin otoimmün yıkımı ile karakterizedir. Bu hastalık için umut verici bir tedavi, kök hücre kaynaklı beta hücrelerinin transplantasyonudur. Bununla birlikte, nakledilen hücreleri kalıcı otoimmüniteden korumak için genetik modifikasyonlar gerekli olabilir. Diyabetik fare modelleri, nakledilen hücreleri otoimmün saldırılardan korumak için stratejilerin ön değerlendirmesi için yararlı bir araçtır. Burada tarif edilen, farelerde diyabetin evlat edinilmiş bir transfer modelinde hücre greftlerinin nakli ve görüntülenmesi için minimal invaziv bir yöntemdir. Bu protokolde, ateşböceği lusiferaz transgen luc2'yi eksprese eden murin pankreatik beta hücre hattı NIT-1'den hücreler, immün yetmezlikli obez olmayan diyabetik (NOD)-şiddetli kombine immün yetmezlikli (scid) farelere deri altından nakledilir. Bu fareler, otoimmüniteyi aktarmak için spontan diyabetik NOD farelerinden splenositlerle eşzamanlı olarak intravenöz olarak enjekte edilir. Greftler, hücre sağkalımını izlemek için non-invaziv biyolüminesan görüntüleme yoluyla düzenli aralıklarla görüntülenir. Mutant hücrelerin hayatta kalması, aynı fareye nakledilen kontrol hücrelerininkiyle karşılaştırılır.
Giriş
Tip 1 diyabet (T1D), pankreasın insülin üreten beta hücrelerinin otoimmün yıkımından kaynaklanır. Beta hücre kütlesinin kaybı insülin eksikliği ve hiperglisemi ile sonuçlanır. T1D hastaları günlük birden fazla eksojen insülin enjeksiyonuna güvenir ve yaşamları boyunca ciddi hiperglisemi ve hipoglisemi atakları yaşarlar. Bu ataklara bağlı komplikasyonlar diyabetik retinopati, azalmış böbrek fonksiyonu ve nöropati1'dir.
İnsülin enjeksiyonları bir tedavidir, ancak T1D için bir tedavi değildir. Bununla birlikte, kaybedilen beta hücre kütlesinin değiştirilmesi, hastaların kendi insülinlerini üretmelerini sağlayarak hastalığı tersine çevirme potansiyeline sahiptir. Ancak kadavra donör adacıklarının arzı sınırlı2. Kök hücre kaynaklı adacıklar (SC-adacıkları), nakil için neredeyse sınırsız bir beta hücresi kaynağı sağlayabilir. Birkaç grup, insan embriyonik kök hücrelerinin (ESC'ler) ve indüklenmiş pluripotent kök hücrelerin (iPSC'ler) fonksiyonel beta benzeri hücreler üretmek için farklılaştırılabileceğini göstermiştir 3,4,5. Umut verici erken klinik çalışma verileri, bu hücrelerin nakil sonrası işlevlerini sürdürdüklerini ve hastaların insülinden bağımsız olmalarını sağlayabileceğini göstermektedir6. Bununla birlikte, kronik immünsüpresyon gereklidir, böylece kanser ve enfeksiyona duyarlılıkları artar. Ek olarak, immünsüpresif ajanlar uzun dönemde greftler için sitotoksik olabilir7. İmmünsüpresyon ihtiyacını ortadan kaldırmak için, SC-adacıkları, tekrarlayan otoimmüniteden ve nakil sonrası alloimmüniteden korumak için genetik olarak değiştirilebilir.
Kök hücre araştırması maliyet ve işçilik açısından oldukça talepkardır. Fare hücre çizgileri ve hayvan modelleri, nakledilen hücreleri otoimmüniteden korumak için stratejilerin ilk tanımlanması ve deneysel olarak doğrulanması için yararlı araçlardır. NOD faresi, insan T1D8 ile birçok benzerliğe sahip spontan otoimmün diyabet geliştirir ve NIT-1 insülinoma hücre hattı, bu fare suşu9 ile genetik bir arka planı paylaşır. Diyabet, replika deney farelerinde diyabetin başlangıcını geçici olarak senkronize etmek için NOD farelerinden diyabetik splenositlerin enjeksiyonu yoluyla ilgili immün yetmezlikli NOD-scid fare suşuna evlat edinilebilir10. Bu model, SC-adacıklarında daha fazla doğrulama için genetik hedefleri nispeten hızlı ve ucuz bir şekilde tanımlamak için kullanılabilir. Son zamanlarda, yöntem, birincil insan adacıklarını in vivo otoimmüniteden ve iPSC türevli adacıkları in vitro11 beta hücre stresinden koruduğu tespit edilen bir hedef olan RNLS'yi tanımlamak ve doğrulamak için uygulanmıştır. Burada tarif edilen, genetiği değiştirilmiş NIT-1 hücrelerini nakletmek ve farelerde otoimmün diyabetin evlat edinilmiş bir transfer modelinde hayatta kalmalarını invaziv olmayan bir şekilde izlemek için basit bir protokoldür.
Access restricted. Please log in or start a trial to view this content.
Protokol
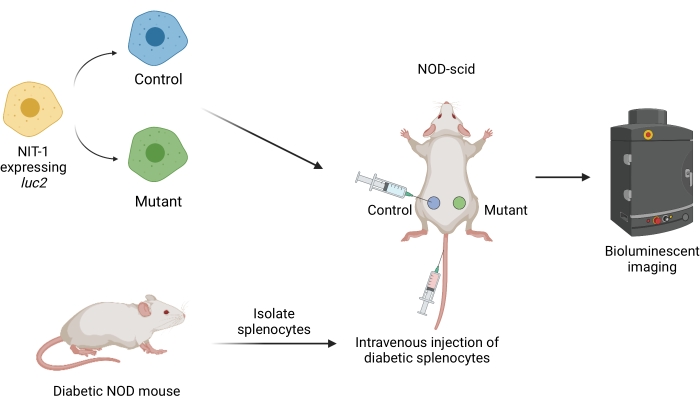
Şekil 1: Farelerde diyabetin evlat edinilmiş bir transfer modelinde greftlerin nakli ve görüntülenmesi için iş akışı. Ateşböceği transgen lusiferazı (luc2) eksprese eden NIT-1 hücreleri, NOD-scid farelere deri altından nakledilir. Farelere aynı anda kendiliğinden diyabetik bir NOD faresinden izole edilen otoreaktif splenositler enjekte edilir. Greftler non-invaziv biyolüminesan görüntüleme ile düzenli aralıklarla görüntülenir. Şekil BioRender.com tarafından oluşturulmuştur. Kısaltmalar: NOD = obez olmayan diyabetik; SCID = şiddetli kombine immün yetmezlik. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tüm hayvan bakım ve çalışma protokolleri, Joslin Diyabet Merkezi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylanmış ve bunlara uygun olarak gerçekleştirilmiştir. NOD ve NOD-scid fareleri ticari kaynaklardan kolayca elde edilebilir. Bu çalışmadaki tüm fareler, sentinal olarak izlenen bir tesiste tutulmaktadır. Bu protokolde kullanılan tüm malzemeler, hayvanlar, aletler ve yazılımlarla ilgili ayrıntılar için Malzeme Tablosuna bakın.
1. NIT-1 hücre hatlarının mühendisliği ve bakımı
- NOD fareleri ile genetik bir arka planı paylaşan NIT-1 hücre hatlarını ve DMEM'de% 10 fetal sığır serumu ve% 1 penisilin / streptomisin ile desteklenmiş% 10 fetal sığır serumu ve% 1 penisilin / streptomisin içeren doku kültürü ile muamele edilmiş tabaklarda 293FT hücrelerini% 5 CO2 ile 37 ° C'lik bir inkübatörde koruyun.
- Transfeksiyon için 293FT hücrelerini% 70-80 birleşime kadar büyütün.
- 293FT hücrelerin 10 cm'lik çanağı başına, yapısal olarak aktif EF1α promotorunun kontrolü altında ateşböceği lusiferaz transgenini (luc2), pMD2.G, pMDLg / pRRE ve pRSV-Rev ambalaj plazmidlerinin her birinin 2 μg'ı, zarf proteini plazmidi pCMV-VSV-G'nin 4 μg'sini ve 1 mL serumsuz DMEM'de 60 μg doğrusal polietilenimin (PEI) 'yi ifade eden 10 μg pLenti-lusiferaz-blast'ı (Ek Dosya 1'e bakınız) birleştirin. Miktarları, transfekte edilecek hücre sayısına göre ayarlayın.
- DNA, PEI ve DMEM'i oda sıcaklığında (RT) 20 dakika bekletin ve ardından 293FT hücrelerine ekleyin.
- Transfeksiyondan 48 saat sonra lentiviral parçacıkları içeren ortamı toplayın.
- NIT-1 hücrelerini, 48-72 saat boyunca 106 hücre başına 1 mL lentiviral parçacık içeren ortam ile ~% 80 akıcılıkta dönüştürün.
- 48 saat boyunca 5 μg / mL blasticidin içeren lusiferaz eksprese eden hücreleri seçin.
- Lusiferaz eksprese eden hücreleri deneysel soruya uyacak şekilde genetik olarak daha da değiştirin. Karşılaştırma için lusiferaz eksprese eden vahşi tip veya hedeflenmeyen bir kontrol hücresi çizgisi ekleyin.
NOT: Hedef gen modifikasyonlarına örnek olarak CRISPR nakavtı, CRISPRa / i, shRNA knockdown ve aşırı ekspresyon verilebilir.
2. Nakil için NIT-1 hücrelerinin hazırlanması
- Lusiferaz eksprese eden hücreleri% 80 -% 90 birleşene kadar büyütün.
- Büyüme ortamını çıkarın ve hücreleri fosfat tamponlu salin ile yıkayın (PBS, 10 cm'lik bir tabak için 5 mL).
- Her yemeğe 2 dakika boyunca 1 mL% 0.05 tripsin-EDTA ekleyin.
- Tripsini 5 mL büyüme ortamı ile nötralize edin.
- Hücreleri çanaktan yıkamak ve konik bir tüpe aktarmak için bir pipet kullanın.
NOT: Aynı hücre hattının birden fazla çanağındaki hücreler birleştirilebilir. - Tripan mavisi gibi bir leke kullanarak hücreleri hemositometre ile manuel olarak veya otomatik bir hücre sayacı ile otomatik olarak sayın.
- RT'de 5 dakika boyunca 250 × g'da santrifüj yapın ve süpernatantı aspire edici bir pipetle çıkarın.
- PBS'deki hücre peletini 5 × 10 7 hücre/mL konsantrasyonda yeniden askıya alın (fare başına hücre satırı başına 107 hücre, 200 μL'lik bir hacimde nakledilecektir).
- Nakil yapılana kadar hücreleri buz üzerinde (3 saate kadar) tutun.
3. NIT-1 hücrelerinin NOD-scid farelere nakli
- Alıcı fareleri (splenositleri izole etmek için kullanılan farelerle aynı cinsiyetten 8-10 haftalık NOD scid fareleri) bir nakavt odasında izofluran inhalasyonu ile uyuşturun. Odaya 1,5 L/dak akış hızında ve 9 L/dak tahliye hızında %2,5 izofluran verin.
- Kurumayı önlemek için hayvanın gözlerini oftalmik merhemle yağlayın.
- Korumalı bir elektrikli tıraş makinesi kullanarak, cildi açığa çıkarmak için saçları farelerin arkasından (sırt tarafından) çıkarın. Tıraş edilen nakil alanı yaklaşık 1 in x 2 in olacaktır. Tıraş edilmiş fareleri nakil yapılana kadar yıkma odasına geri döndürün.
- Fareleri birer birer izofluran burun konisi ile temiz bir yüzeye aktarın. Farenin kafasını nazikçe burun konisine yönlendirin. Nakil sırasında anesteziyi korumak için 0.25 L / dak'lık bir izofluran akış hızı kullanın.
- Gevşek tüyleri gidermek ve cildi dezenfekte etmek için nakil bölgesini izopropil alkol hazırlama pedi ile silin.
- Şırıngayı yüklemeden önce hücrelerin tamamen askıya alındığından emin olun. 26 G iğne ile 1 mL'lik steril bir şırıngaya fazla miktarda (>300 μL) hücre çekin. Herhangi bir kabarcığı çıkarın; daha sonra, fazla hücreleri tüpe geri döndürün, böylece şırıngada 300 μL hücre süspansiyonu kalır.
- Baskın olmayan elde tutulan bir çift kavisli forseps kullanarak, deri altı boşluğa daha kolay erişim sağlamak için farenin sırtının bir tarafındaki (sol veya sağ) cildi yavaşça kaldırın.
- Baskın eli kullanarak, şırıngayı farenin vücudunun koronal ve sagital düzlemlerine paralel olarak konumlandırın. İğne farenin kafasına doğru işaret ettiğinde, iğneyi arka kısımların yakınındaki cilde yerleştirin ve yavaşça deri altı boşluğuna yönlendirin. Tüm iğnenin cildin altında kaldığından ve dürtmediğinden emin olun.
- Forsepsleri, cildi iğnenin tabanının etrafında nazikçe tutacak şekilde ayarlayın. Yavaşça az miktarda hücre süspansiyonu (<50 μL) dağıtın ve enjeksiyon bölgesinde cildin altında küçük bir çıkıntı oluştuğunu doğrulayın. Hücre süspansiyonunu, deri altı boşluğuna 200 μL verilene kadar enjekte etmeye devam edin.
- Forsepsleri yerinde tutarak ve iğneyi farenin vücuduna paralel tutarak, iğneyi yavaşça geri çekin. İğne çıkarıldıktan sonra, hücrelerin delinme yarasından sızmasını önlemek için cildi birkaç saniye forseps ile kapalı tutun.
- Genetik bir modifikasyon değerlendiriliyorsa, nakli farenin karşı tarafında farklı bir şırınga kullanarak tekrarlayın, böylece hem mutant hem de kontrol hücreleri her fareye enjekte edilir, bir hücre çizgisi solda, diğeri sağda. Yalnızca bir hücre hattı naklediliyorsa, hücreleri yalnızca bir tarafa enjekte edin.
- Nakli takiben, her fareyi yeni bir kafese aktarın. Kafese ek fareler eklemeden önce her farenin anesteziden tamamen iyileşmesine izin verin.
NOT: Fareler normal aktivitelerine devam ettiklerinde ve uyuşukluk veya hareket bozukluğu belirtileri göstermediklerinde iyileşirler. - Nakil sonrası deney süresince farelerin sağlık durumunu günlük olarak değerlendirin. Greftler büyük bir çıkıntı oluşturursa veya fareler zayıf ve uyuşuk hale gelirse, kan şekerlerini ölçün ve tüm hipoglisemik farelere% 10 (w / w) sakkaroz suyu ad libitum sağlayın. Tüm veteriner tavsiyelerine uyun ve kurumsal yönergelere göre devam eden zayıf vücut durumuna sahip fareleri ötenazi yapın. Bu çalışmada, fareler CO2 inhalasyonu ve ardından servikal çıkık ile ötenazi yapıldı.
4. Otoreaktif splenositlerin izolasyonu ve saflaştırılması
- İdrar (veya kan) glikoz test şeritlerini kullanarak yeni başlayan (10 günden az) diyabetli 10-16 haftalık erkek veya dişi NOD farelerini tanımlayın. NOD fareleri, en az 2 ardışık günde idrar / kan şekeri ≥250 mg / dL) olduğunda diyabetik olarak kabul edilir.
NOT: Her NOD scid fare için 10 milyon splenosit gereklidir; Bir dalak tipik olarak 50 milyon ila 150 milyon splenosit verir. Splenositler, sentinal olarak izlenen bir tesiste barındırılan patojensiz farelerden izole edildi. - Uygun sayıda diyabetik NOD faresini ötenazi yapın.
NOT: Bu çalışmada, fareler ölümü sağlamak için CO2 inhalasyonu ve ardından servikal çıkık ile ötenazi yapıldı. - Fare sırtındayken, cerrahi makasla deride yaklaşık 2 inç uzunluğunda dikey bir kesi yapın. Farenin sağ tarafını araştırmacının bakış açısından açın ve parlak kırmızı dalağı bulun. Dalağı pembe pankreastan yavaşça kesin ve 5 mL steril PBS içeren steril 10 cm'lik bir Petri kabına aktarın. Diseksiyonu gerektiği kadar fareyle tekrarlayın.
NOT: Birden fazla fareden gelen dalaklar tek bir tabakta birleştirilebilir. Steril bir davlumbazda steril reaktifler ve ekipman kullanarak aşağıdaki adımları uygulayın. - Dalağı (dalağı) steril bir şırınga pistonunun düz üst kısmı ile ezin.
- 50 mL'lik bir konik tüpe 40 μm veya 70 μm'lik bir süzgeç yerleştirin ve süzgeci astarlamak için 5 mL PBS ile yıkayın. Dalak süspansiyonunu süzgecin içine aktarın ve süzgeçten nazikçe ezmeye devam edin. Bulaşığı 10 mL PBS ile yıkayın ve yıkamayı süzgecin üzerine aktarın. Kırmızı renk süzgeçten çıkana kadar ezmeye devam edin.
- Süzgeci atın ve tüpü RT'de 5 dakika boyunca 500 × g'da döndürün.
- Hücre peletini RT'ye önceden ısıtılmış ACK lizis tamponunun 5 mL'sinde (üç dalağa kadar) tekrar askıya alın ve kırmızı kan hücrelerini 4 dakika boyunca lize edin. Ek dalaklara ihtiyaç duyulursa, hacmi dalak başına 1-2 mL artırın.
- 5 mL lizis tamponu başına 5 mL NIT-1 hücre ortamı (yukarıda tarif edilmiştir) ile reaksiyonu durdurun. Kümeleri çıkarmak için hücre süspansiyonunu yeni bir süzgeçten geçirin. Süzgeci atın ve RT'de 5 dakika boyunca 500 × g'da döndürün.
- Hücre peletini 20 mL PBS'de yeniden askıya alın ve hücreleri sayın. RT'de 5 dakika boyunca 500 × g'da döndürün. steril PBS'deki hücreleri, 1.5 mL'lik bir güvenli kilit reaksiyon tüpünde 1 ×10 8 hücre / mL konsantrasyonda (enjeksiyon hacmi 0.1 mL / faredir) yeniden askıya alın.
- Hücreleri buz üzerinde saklayın (1 saatten fazla değil) veya hücreleri RT'de tutun ve hemen kuyruk damarı enjeksiyonuna devam edin.
5. Diyabetik splenositlerin lateral kuyruk veninden intravenöz enjeksiyonu
- Damarları vazodilate etmek için yetişkin alıcı NOD-scid farelerinin vücudunu ısıtın (örneğin, ~ 5-10 dakika boyunca bir ısı lambası kullanarak) (bu, görselleştirme ve damar içine enjeksiyon için yardımcı olur).
NOT: Farelerin aşırı ısınmasını önlemek için, bu süreyi aşmayın. Her zaman sistem durumunu izleyin. Fareler bitkin veya hareketsiz görünüyorsa, ısı lambasını hemen kapatın. - Hücre süspansiyonunu ısıtın. Steril bir iğne (27-30 G, 0,3 mm / 0,5 inç veya daha küçük) ile steril bir şırınga (0,3-1,0 mL) hazırlayın veya 0,3 mm (0,5 inç) iğne ile steril bir 0,5 mL insülin şırıngası kullanın. İğneyi daima steril tutun ve şırınganın enjeksiyonlar arasına konması gerekiyorsa steril bir tepsi kullanın.
- Her enjeksiyondan önce splenosit çözeltisini tekrar askıya alın. Her fare için, şırıngaya önceden ısıtılmış ve karıştırılmış splenosit süspansiyonundan 100 μL çekin. Şırıngada veya süspansiyonda hava kabarcığı bulunmadığından emin olun.
NOT: Fareyi kısıtlama cihazına yerleştirmeden önce tüm ekipman ve malzemelerin (dezenfeksiyon için alkollü mendiller, enjekte edilecek splenositlerle dolu bir şırınga ve enjekte edilen fareleri ayırmak için yeni bir kafes) hazır bulundurduğunuzdan emin olun. - Fareyi kısıtlama cihazına yerleştirin. Kuyruğu baskın olmayan elinizle yakalayın ve iki yanal kuyruk damarından birini bulun. Gerekirse kuyruğu yavaşça döndürün. Cildi temizlemek ve damarın görünürlüğünü artırmak için kuyruğu bir dezenfeksiyon mendili (% 70 izopropil alkol) ile silin.
- İğneyi baskın el ile kuyruğun orta bölgesine keskin bir açıyla yerleştirin. İğnenin eğimi yukarı bakacak şekilde, iğneyi cilt boyunca birkaç milimetre kaydırın.
NOT: İğnenin damara paralel olduğundan ve cildin biraz altına yerleştirildiğinden emin olun. Farenin/kuyruğun deri/damar duvarına nüfuz ettikten hemen sonra ani hareketlerine hazırlıklı olun. İğnenin başarılı bir şekilde sokulması, damar içine "pürüzsüz bir slayt" gibi hissetmelidir. Başka bir girişime ihtiyaç duyulursa, kuyruğu vücuda doğru daha da yukarı doğru hareket ettirin. - Splenosit süspansiyonunu enjekte etmek için şırıngaya hafif basınç uygulayın. Enjeksiyon sırasında iğnenin daha fazla içeri veya dışarı hareket etmesine izin vermeyin. Başarılı enjeksiyonlar, enjeksiyon sırasında herhangi bir geri basınç hissetmeden pürüzsüzdür ve enjeksiyondan hemen sonra şeffaf / beyaz kan akışı ile gösterilir.
- İğneyi yavaşça damardan çıkarın ve kanama durana kadar bir dezenfeksiyon mendili ile kuyruğa hafif basınç uygulayın. Fareyi kısıtlama cihazından serbest bırakın ve yavaşça yeni hazırlanmış bir kafese aktarın.
NOT: Otoreaktif splenositlerin enjeksiyondan yaklaşık 2-4 hafta sonra süren diyabeti indükleme potansiyelini doğrulamak için splenositlerle NIT-1 hücre nakli almayan iki ila üç kontrol faresine enjekte edin.
6. NIT-1 greftlerinin in vivo biyolüminesan görüntülemesi
NOT: Greftleri haftada bir ila iki kez görüntüleyin. Nakil gününde, greftlerin yerleşmesine ve stabil lusiferaz ekspresyonunu sağlamasına izin vermek için ekimden sonra en az 2 saat bekleyin. Zaman sınırlayıcı bir faktörse, ilk ölçüm bunun yerine 1. Günde alınabilir. Önerilen bir ilk görüntüleme programı, enjeksiyon sonrası Gün 0 veya Gün 1, Gün 5, Gün 10, Gün 14, Gün 18 ve Gün 25'tir. Bununla birlikte, programı, biyolüminesan sinyal kaybı ile değerlendirilen otoimmünitenin ilerlemesine dayanarak ayarlayın.
- Dulbecco'nun PBS'sinde 15 mg / mL D-lusiferin çözeltisi hazırlayın. RT'de çözünmesi için çalkalayın ve steril filtre (0,22 μm). 1 mL alikotları −20 ° C'de saklayın ve gerektiğinde çözün.
NOT: Aliquots yeniden dondurulabilir. - Görüntülemeden en az 5 dakika önce, 150 mg / kg'lık bir dozda 1 mL'lik bir şırınga ve D-lusiferin çözeltisi içeren 26 G'lik bir iğne kullanarak farelere intraperitoneal olarak enjekte edin.
NOT: Her fare için yeni bir şırınga ve iğne kullanın. - Fareleri, kurumsal kılavuzlara göre izofluran inhalasyonu ile uyuşturun. Önerilen koşullar, yıkma odasına 1,5 L / dak akış hızına ve 9 L / dak tahliye hızına sahip% 2,5 izoflurandır.
- Kurumayı önlemek için hayvanın gözlerini oftalmik merhemle yağlayın.
- Görüntüleme cihazıyla ilişkili yazılımı açın. Yeni bir kullanıcı ve/veya oturum açma oluşturun. Sağ alttaki kontrol panelinde , Başlat'ı seçin (Şekil 2A). Görüntüleme verilerini otomatik olarak kaydetmek için, bilgisayarda uygun klasörleri oluşturun ve ardından Edinme | Otomatik kaydetme... (Şekil 2A). Cihaz başlatmayı bitirdiğinde, pozlama süresini 1 dakikaya ayarlayın.
NOT: Tüm görüntüleme parametreleri Şekil 2B'de gösterilmiştir. - Fareleri birer birer yıkma odasından görüntüleme cihazına aktarın. Fareyi uzuvları oynak olacak şekilde karnına yerleştirin ve başını yavaşça burun konisine yönlendirin. Burun konisi yoluyla verilen 0.25 L/dak'lık izofluran akış hızı, görüntüleme sırasında anesteziyi sürdürmek için uygundur. Fareyi sırtının ortasına iki elinizle bastırarak ve ardından ellerinizi dışa ve birbirinden ayırarak yavaşça düzleştirin.
- Al'ı seçin (Şekil 2B). Denemenin ilgili ayrıntılarını açılır pencereye kaydedin (Şekil 2C).
NOT: Çeşitli zaman noktalarında iki greft ile nakledilen üç adet 8 haftalık dişi NOD-scid farenin temsili görüntüleri için Şekil 3A'ya bakınız.
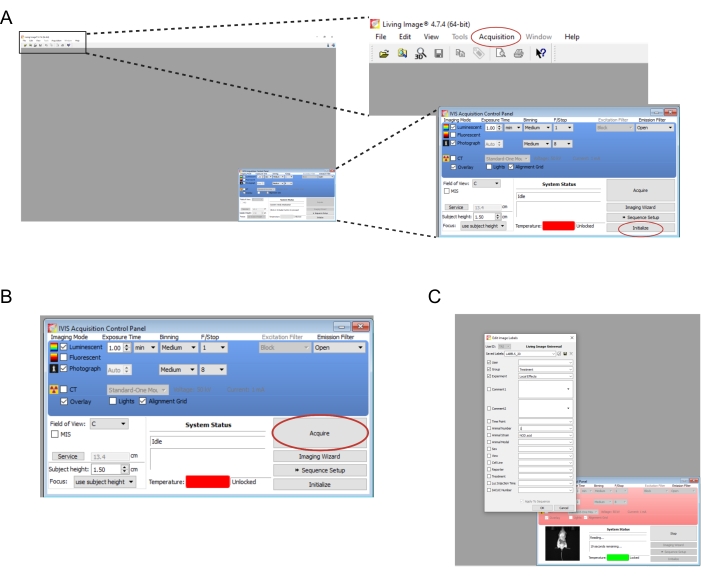
Şekil 2: Biyolüminesan greftleri görüntülemek için yazılım komutlarının ekran görüntüleri . (A) Görüntülemeden önce, cihazı hazırlamak için Başlat'ı seçin. Görüntüler, Edinme | Otomatik kaydetme... (B) Görüntüleme parametrelerine genel bakış. Fare cihaza yerleştirildikten sonra Al'ı seçin. (C) Görüntüleme sırasında açılan iletişim kutusunun ekran görüntüsü. Zaman noktası ve fare gerilimi gibi ayrıntılar buraya girilebilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
7. Veri analizi
- Görüntülemeden sonra herhangi bir zamanda biyolüminesan sinyali sayısallaştırın. Görüntüleme cihazıyla ilişkili yazılımı açın. Dosya Seç | Açın ve analiz edilecek fareyle ilişkili ClickInfo.txt dosyasını seçin.
- Araç Paleti'nde YG Araçları'nı seçin (Şekil 3B, Adım 1). Oval açılır menüden (Şekil 3B, Adım 1, kırmızı ok), fareye nakledilen greft sayısını seçin.
- Ovalleri, her greftten gelen biyolüminesan sinyali içerecek şekilde hareket ettirin ve YG'leri Ölç'ü seçin (Şekil 3B, Adım 2).
- Her greft için Toplam Sayıyı kaydedin (Şekil 3B, Adım 3).
- Her greft için, her zaman noktasında ölçülen biyolüminesan sinyali, ilk zaman noktasında ölçülen sinyale bölün. Greft sağkalımını , başlangıçtaki biyolüminesan sinyale göre kalıntı biyolüminesan sinyalinin oranı veya yüzdesi olarak rapor edin.
NOT: Greftler nakil sonrası genişlerse, greft sağkalım oranı veya yüzdesi sırasıyla% 1 veya% 100'den fazla olacaktır. Nakil alan tüm fareler olumsuz sağlık etkileri açısından izlenmelidir.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Protokole genel bir bakış Şekil 1'de özetlenmiştir. Bir mutant ve hedeflenmeyen bir kontrol gibi iki hücre hattının hayatta kalması karşılaştırılabilir veya bir hücre hattının hayatta kalması, ilaçla tedavi edilen farelere karşı araçla tedavi edilen kontroller gibi birden fazla fare grubunda ölçülebilir. Şekil 3A , hedeflenmeyen bir kontrol (solda) ve bir mutant (sağ) hücre hattı ile nakledilen üç adet 8 haftalık dişi NOD scid fa...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
T1D, şu anda tedavisi bulunmayan yıkıcı bir hastalıktır. Beta hücre replasman tedavisi, bu hastalığı olan hastalar için umut verici bir tedavi sunar, ancak bu stratejinin önündeki kritik engel, nakledilen beta hücrelerine karşı tekrarlayan otoimmün saldırı potansiyelidir. SC-beta hücrelerinin bağışıklık görünürlüklerini veya duyarlılıklarını azaltmak için genetik mühendisliği bu soruna potansiyel bir çözümdür. Burada tarif edilen, farelerde otoimmün diyabetin evlat edinilmiş bir ...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu protokolde açıklanan yöntemi geliştirdikleri için Dr. Erica P. Cai ve Dr. Yuki Ishikawa'ya teşekkür ederiz (bkz. ref. 11). SK ve P.Y.'nin laboratuvarlarındaki araştırmalar, Ulusal Sağlık Enstitüleri (NIH) (R01DK120445, P30DK036836), JDRF, Harvard Kök Hücre Enstitüsü ve Beatson Vakfı'ndan gelen hibelerle desteklenmektedir. TS, Ulusal Diyabet ve Sindirim ve Böbrek Hastalıkları Enstitüsü'nden (NIDDK) (T32 DK007260-45) doktora sonrası bir burs ile desteklendi ve KB, kısmen Mary K. Iacocca Vakfı'ndan bir burs ile desteklendi.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin, 0.53 mM EDTA | Corning | 25-052-CI | |
| 293FT | Invitrogen | R70007 | Fast-growing, highly transfectable clonal isolate derived from human embryonal kidney cells transformed with the SV40 large T antigen |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| Alcohol prep pads, 70% Isopropyl alcohol | Amazon/Ever Ready First Aid | B08NWF31DX | |
| BD 5ml Syringe Luer-Lok Tip | BD | 309646 | |
| BD PrecisionGlide Needle 26G x 5/8 (0.45 mm x 16 mm) Sub-Q | BD | 305115 | |
| BD 1 mL TB Syringe Slip Tip | BD | 309659 | |
| Blasticidin S HCl | Corning | 30-100-RB | |
| Cell strainer premium SureStrain, 70 µm, sterile | Southern Labware | C4070 | Or use similar sterile strainer with 40-70um pore size |
| CellDrop automated cell counter | Denovix | CellDrop BF-PAYG | Or use similar cell counter device |
| Corning 100 mL Penicillin-Streptomycin Solution, 100x | Corning | 30-002-CI | |
| Disposable Aspirating Pipets, Polystyrene, Sterile, Capacity=2 mL | VWR | 414004-265 | Or use similar aspirating pipette |
| D-Luciferin, Potassium Salt , Molecular Biology Grade, Powder, >99% | Goldbio | LUCK-100 | |
| DMEM, high glucose, pyruvate, no glutamine | Gibco | 10313039 | |
| Falcon BD tubes, 50 mL | Fisher Scientific | 14-959-49A | |
| Fetal Bovine Serum | Gibco | 10437-028 | |
| Forceps premium for tissues, 1 x 2 teeth 5 in, German Steel | Fisher Scientific | 13-820-074 | |
| Glucose urine test strip | California Pet Pharmacy | u-tsg100 | Or use similar test strip for glucose measurments in urine/blood |
| GlutaMAX–1 (100x) | Gibco | 35050-061 | |
| Infrared heating lamp | Cole Parmer | 03057-00 | Or use similar infrared lamp |
| Insulin syringe 0.5 mL, U-100 29 G 0.5 in | Becton Dickinson | 309306 | |
| Isoflurane, USP | Piramal Critical Care | 6679401725 | |
| IVIS Spectrum in vivo imaging system | Perkin Elmer | 124262 | Instrument for non-invasively collecting bioluminescent images of transplanted cells |
| Living Image Analysis Software | Perkin Elmer | 128113 | Software for collecting and quantifying bioluminescent signal |
| Microcentrifuge tubes seal-rite, 1.5 mL | USA Scientific | 1615-5510 | Or use similar sterile microcentrifuge tubes |
| NIT-1 | ATCC | CRL-2055 | Pancreatic beta-celll line derived from NOD/Lt mice |
| NOD.Cg-Prkdcscid/J | The Jackson Laboratory | 001303 | Mice homozygous for the severe combined immune deficiency spontaneous mutation Prkdcscid, commonly referred to as scid, are characterized by an absence of functional T cells and B cells, lymphopenia, hypogammaglobulinemia, and a normal hematopoietic microenvironment. |
| NOD/ShiLtJ | The Jackson Laboratory | 001976 | The NOD/ShiLtJ strain of mice (commonly called NOD) is a polygenic model for autoimmune type 1 diabetes |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010031 | No calcium, no magnesium, no phenol red |
| pCMV-VSV-G | Addgene | 8454 | |
| pLenti-luciferase-blast | Made in-house | Plasmid available upon request | See Supplemental File 1 |
| pMD2.G | Addgene | 12259 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polyethylenimine, Linear, MW 25,000, Transfection Grade (PEI 25K) | Fisher Scientific | NC1014320 | |
| pRSV-Rev | Addgene | 12253 | |
| Restrainer for rodents, broome-style round 1 in | Fisher Scientific | 01-288-32A | |
| Scissors, sharp-pointed | Fisher Scientific | 08-940 | Or use other scissors made of surgical-grade stainless steel |
| Tissue-culture treated culture dishes | Millipore Sigma | CLS430167-20EA | Or use other sterile cell culture-treated Petri dishes |
| Tweezers/Forceps, fine precision medium tipped | Fisher Scientific | 12-000-157 |
Referanslar
- Katsarou, A., et al. Type 1 diabetes mellitus. Nature Reviews Disease Primers. 3, 17016(2017).
- Shapiro, A. M., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews Endocrinology. 13 (5), 268-277 (2017).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Russ, H. A., et al. Controlled induction of human pancreatic progenitors produces functional beta-like cells in vitro. EMBO Journal. 34 (13), 1759-1772 (2015).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nature Biotechnology. 32 (11), 1121-1133 (2014).
- Vertex Announces Positive Day 90 Data for the First Patient in the Phase 1_2 Clinical Trial Dosed With VX-880, a Novel Investigational Stem Cell-Derived Therapy for the Treatment of Type 1 Diabetes. Businesswire. , Available from: https://www.businesswire.com/news/home/20211018005226/en/Vertex-Announces-Positive-Day-90-Data-for-the-First-Patient-in-the-Phase-12-Clinical-Trial-Dosed-With-VX-880-a-Novel-Investigational-Stem-Cell-Derived-Therapy-for-the-Treatment-of-Type-1-Diabetes (2021).
- Gamble, A., Pepper, A. R., Bruni, A., Shapiro, A. M. J. The journey of islet cell transplantation and future development. Islets. 10 (2), 80-94 (2018).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the Non Obese Diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Hamaguchi, K., Gaskins, R. H., Leiter, E. H. NIT-1, a pancreatic β-cell line established from a transgenic NOD/Lt mouse. Diabetes. 40 (7), 842-849 (1991).
- Christianson, S. W., Shultz, L. D., Leiter, E. D. Adoptive transfer of diabetes into immunodeficient NOD-scid/scid mice: Relative contribution of CD4+ and CD8+ T-cells from diabetogenic versus prediabetic NOD.NON-Thy1a donors. Diabetes. 42 (1), 44-55 (1993).
- Cai, E. P., et al. Genome-scale in vivo CRISPR screen identifies RNLS as a target for beta cell protection in type 1 diabetes. Nature Metabolism. 2 (9), 934-945 (2020).
- Parent, A. V., et al. Selective deletion of human leukocyte antigens protects stem cell-derived islets from immune rejection. Cell Reports. 36 (7), 109538(2021).
- Brehm, M. A., et al. Lack of acute xenogeneic graft-versus-host disease, but retention of T-cell function following engraftment of human peripheral blood mononuclear cells in NSG mice deficient in MHC class I and II expression. FASEB Journal. 33 (3), 3137-3151 (2019).
- Abdulreda, M. H., et al. In vivo imaging of type 1 diabetes immunopathology using eye-transplanted islets in NOD mice. Diabetologia. 62 (7), 1237-1250 (2019).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır