JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
생쥐에서 자가면역 당뇨병의 입양 이식 모델에서 이식편 생존의 생물발광 모니터링
요약
이 프로토콜은 자발적 당뇨병 NOD 마우스에서 정제된 비장 세포로 도전받은 비만 당뇨병(NOD) 중증 복합 면역 결핍 마우스에서 NIT-1 세포를 이식하고 이미징하기 위한 간단하고 최소 침습적인 방법을 설명합니다.
초록
제 1 형 당뇨병은 췌장의 인슐린 생산 베타 세포의자가 면역 파괴를 특징으로합니다. 이 질병에 대한 유망한 치료법은 줄기 세포 유래 베타 세포의 이식입니다. 그러나 이식된 세포를 지속적인 자가면역으로부터 보호하기 위해 유전자 변형이 필요할 수 있습니다. 당뇨병 마우스 모델은 자가면역 공격으로부터 이식된 세포를 보호하기 위한 전략의 예비 평가에 유용한 도구입니다. 여기에 기술된 것은 마우스에서 당뇨병의 입양 이식 모델에서 세포 이식편을 이식하고 이미징하기 위한 최소 침습적 방법이다. 이 프로토콜에서, 반딧불이 루시페라아제 이식유전자 luc2 를 발현하는 쥐 췌장 베타 세포주 NIT-1의 세포를 면역결핍성 비비만 당뇨병(NOD)-중증 복합 면역결핍(scid) 마우스에 피하 이식합니다. 이 마우스는 자가면역을 전달하기 위해 자발적 당뇨병 NOD 마우스의 비장 세포를 동시에 정맥 주사합니다. 이식편은 세포 생존을 모니터링하기 위해 비침습적 생물발광 이미징을 통해 일정한 간격으로 이미지화됩니다. 돌연변이 세포의 생존은 동일한 마우스에 이식된 대조군 세포의 생존율과 비교됩니다.
서문
제1형 당뇨병(T1D)은 췌장의 인슐린 생산 베타 세포의 자가면역 파괴로 인해 발생합니다. 베타 세포 질량의 손실은 인슐린 결핍과 고혈당을 초래합니다. T1D 환자는 외인성 인슐린을 매일 여러 번 주사하고 평생 동안 심각한 고혈당증 및 저혈당증 에피소드를 경험합니다. 이러한 에피소드와 관련된 합병증으로는 당뇨병성 망막병증, 신장 기능 저하, 신경병증등이 있다 1.
인슐린 주사는 T1D의 치료법이지만 치료법은 아닙니다. 그러나 손실된 베타 세포 덩어리를 대체하면 환자가 자신의 인슐린을 생산할 수 있게 하여 질병을 역전시킬 수 있습니다. 그러나 사체기증자의 공급은 제한되어 있다2. 줄기 세포 유래 췌도(SC-islets)는 이식을 위한 베타 세포의 사실상 무제한 공급을 제공할 수 있다. 몇몇 그룹은 인간 배아 줄기 세포 (ESCs)와 유도 만능 줄기 세포 (iPSCs)가 기능적 베타 유사 세포를 생성하기 위해 분화 될 수 있음을 입증했다 3,4,5. 유망한 초기 임상 시험 데이터에 따르면 이 세포는 이식 후에도 기능을 유지하며 환자가 인슐린 의존성을 갖도록 할 수 있다6. 그러나 만성 면역 억제가 필요하므로 암과 감염에 대한 감수성이 증가합니다. 또한, 면역억제제는 장기적으로 이식편에 세포독성을 나타낼 수 있다7. 면역억제의 필요성을 없애기 위해, SC-섬은 이식 후 동종면역뿐만 아니라 재발성 자가면역으로부터 보호하기 위해 유전자 변형될 수 있다.
줄기 세포 연구는 비용과 노동력이 매우 까다롭습니다. 마우스 세포주 및 동물 모델은 이식된 세포를 자가면역으로부터 보호하기 위한 전략의 초기 식별 및 실험적 검증에 유용한 도구입니다. NOD 마우스는 인간 T1D8와 많은 유사성을 가진 자발성 자가면역 당뇨병을 앓고 있으며, NIT-1 인슐린종 세포주는 이 마우스 균주와 유전적 배경을 공유한다9. 당뇨병은 복제 실험 마우스에서 당뇨병의 발병을 시간적으로 동기화하기 위해 NOD 마우스로부터 당뇨병성 비장세포의 주입을 통해 관련 면역결핍 NOD-scid 마우스 균주에 입양적으로 전달될 수 있다10. 이 모델은 SC 섬에서 추가 검증을 위해 유전자 표적을 비교적 빠르고 저렴하게 식별하는 데 사용할 수 있습니다. 최근에, 이 방법은 생체 내 자가면역으로부터 일차 인간 섬을 보호하고 시험관 내 베타 세포 스트레스로부터 iPSC 유래 섬을 보호하는 것으로 밝혀진 표적인 RNLS를 식별하고 검증하기 위해 적용되었습니다 11. 여기에 설명된 것은 유전자 조작된 NIT-1 세포를 이식하고 마우스에서 자가면역 당뇨병의 입양 이식 모델에서 이들의 생존을 비침습적으로 모니터링하는 간단한 프로토콜입니다.
프로토콜
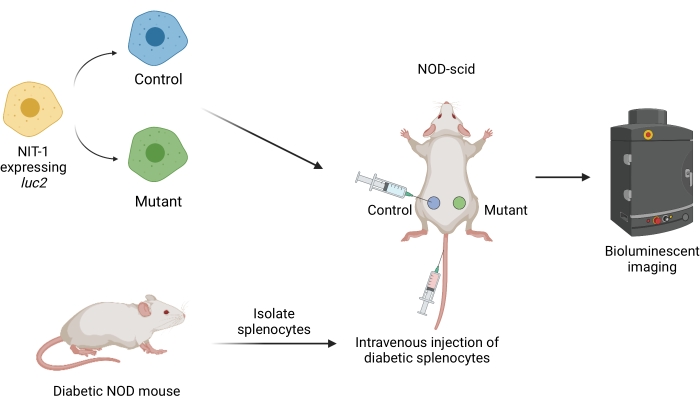
그림 1: 생쥐에서 당뇨병의 입양 이식 모델에서 이식편을 이식하고 이미징하기 위한 워크플로. 반딧불이 이식유전자 루시페라아제(luc2)를 발현하는 NIT-1 세포를 NOD-scid 마우스에 피하 이식합니다. 마우스에는 자발적 당뇨병 NOD 마우스에서 분리된 자가반응성 비장세포가 동시에 주입됩니다. 이식편은 비침습적 생물발광 이미징에 의해 일정한 간격으로 이미징됩니다. BioRender.com 가 만든 그림. 약어: NOD = 비만하지 않은 당뇨병; SCID = 중증 복합 면역 결핍. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
모든 동물 관리 및 연구 프로토콜은 Joslin Diabetes Center의 IACUC(Institutional Animal Care and Use Committee)에 의해 승인되고 수행되었습니다. NOD 및 NOD-scid 마우스는 상업적 공급원으로부터 쉽게 입수할 수 있다. 이 연구의 모든 마우스는 지각 모니터링 시설에서 유지됩니다. 이 프로토콜에 사용된 모든 재료, 동물, 도구 및 소프트웨어와 관련된 자세한 내용은 재료 표를 참조하십시오.
1. NIT-1 세포주의 엔지니어링 및 유지 관리
- NOD 마우스와 유전적 배경을 공유하는 NIT-1 세포주와 293FT 세포를 5%CO2가 포함된 37°C 인큐베이터에서 10% 소 태아 혈청과 1% 페니실린/스트렙토마이신이 보충된 4.5g/L 포도당이 포함된 DMEM에서 조직 배양 처리된 접시에 보관합니다.
- 트랜스펙션을 위해 293FT 세포를 70%-80% 합류점으로 성장시킵니다.
- 293FT 세포의 10cm 접시 당, 구성적으로 활성인 EF1α 프로모터의 제어 하에 반딧불이 루시페라아제 이식유전자(luc2)를 발현하는 pLenti-luciferase-blast 10μg(보충 파일 1 참조), 포장 플라스미드 pMD2.G, pMDLg/pRRE 및 pRSV-Rev 각각 2μg, 외피 단백질 플라스미드 pCMV-VSV-G 4μg 및 선형 폴리에틸렌이민(PEI) 60μg을 1mL의 무혈청 DMEM에 결합합니다. 형질주입할 세포의 수에 따라 양을 조정합니다.
- DNA, PEI 및 DMEM을 실온(RT)에서 20분 동안 방치한 다음 293FT 셀에 추가합니다.
- 렌티바이러스 입자가 포함된 배지를 형질감염 후 48시간 후에 수집합니다.
- NIT-1 세포를 48-72시간 동안 10 6개 세포당 렌티바이러스 입자를 포함하는 배지 1mL로 ~80% 밀도로 형질도입합니다.
- 48시간 동안 5μg/mL 블라스티시딘으로 루시페라아제 발현 세포를 선택합니다.
- 실험 질문에 맞게 루시페라아제 발현 세포를 추가로 유전적으로 변형합니다. 비교를 위해 루시페라아제 발현 야생형 또는 비표적화 대조군 세포주를 포함합니다.
참고: 표적 유전자 변형의 예로는 CRISPR knockout, CRISPRa/i, shRNA knockdown 및 overexpression이 있습니다.
2. 이식용 NIT-1 세포의 제조
- 루시페라아제 발현 세포가 80%-90% 합류할 때까지 성장시킵니다.
- 성장 배지를 제거하고, 세포를 인산염 완충 식염수(PBS, 10 cm 디쉬에 대해 5 mL)로 세척하였다.
- 0.05% 트립신-EDTA 1mL를 각 접시에 2분 동안 추가합니다.
- 트립신을 5mL의 성장 배지로 중화합니다.
- 피펫을 사용하여 접시에서 세포를 씻어 내고 원추형 튜브로 옮깁니다.
참고: 동일한 세포주의 여러 접시에서 추출한 세포를 결합할 수 있습니다. - 트리판 블루와 같은 염색을 사용하여 혈구계를 사용하여 수동으로 또는 자동 세포 계수기를 사용하여 자동으로 세포 수를 계산합니다.
- RT에서 5분 동안 250× g 에서 원심분리하고 흡인 피펫으로 상층액을 제거합니다.
- PBS에 세포 펠릿을 5 × 10 7 cells/mL의 농도로 재현탁합니다(마우스당 세포주당 107 세포는 200μL 부피로 이식됨).
- 이식 할 때까지 세포를 얼음 위에 보관하십시오 (최대 3 시간 동안).
3. NOD-scid 마우스에 NIT-1 세포 이식
- 수용자 마우스(비장세포를 분리하기 위해 사용된 마우스와 동일한 성별의 8-10주령 NOD-scid 마우스)를 녹다운 챔버에서 이소플루란 흡입에 의해 마취시킨다. 2.5% 이소플루란을 1.5L/min의 유속과 9L/min의 배출 속도로 챔버 내로 전달합니다.
- 건조를 방지하기 위해 안과 용 연고로 동물의 눈을 윤활하십시오.
- 가드가 있는 전기 면도기를 사용하여 생쥐의 등쪽(등쪽)에서 털을 제거하여 피부를 노출시킵니다. 면도한 이식 부위는 약 1인치 x 2인치입니다. 이식 할 때까지 면도 한 마우스를 녹다운 챔버로 되돌립니다.
- 마우스를 한 번에 하나씩 isoflurane 코 콘으로 깨끗한 표면으로 옮깁니다. 마우스의 머리를 노즈 콘으로 부드럽게 안내합니다. 이식 중 마취를 유지하기 위해 0.25L/min의 이소플루란 유속을 사용하십시오.
- 이소프로필 알코올 프렙 패드로 이식 부위를 닦아 느슨한 모발을 제거하고 피부를 소독합니다.
- 주사기를 넣기 전에 세포가 완전히 다시 부유되었는지 확인하십시오. 초과 부피(>300μL)의 세포를 26G 바늘이 있는 1mL 멸균 주사기에 넣습니다. 거품을 제거하십시오. 그런 다음 300μL의 세포 현탁액이 주사기에 남아 있도록 초과 세포를 튜브로 되돌립니다.
- 주로 사용하지 않는 손에 잡은 한 쌍의 구부러진 집게를 사용하여 마우스 등의 한쪽(왼쪽 또는 오른쪽)에 있는 피부를 부드럽게 들어 올려 피하 공간에 더 쉽게 접근할 수 있도록 합니다.
- 주로 사용하는 손을 사용하여 주사기를 마우스 몸의 관상 동맥 및 시상면과 평행하게 배치합니다. 바늘이 쥐의 머리를 향하게 하여 바늘을 뒷부분 근처의 피부에 삽입하고 부드럽게 피하 공간으로 안내합니다. 전체 바늘이 피부 아래에 남아 있고 찌르지 않는지 확인하십시오.
- 집게를 조정하여 바늘 바닥 주위의 피부를 부드럽게 잡습니다. 소량의 세포 현탁액(<50μL)을 천천히 분주하고 주사 부위의 피부 아래에 작은 돌출부가 형성되는지 확인합니다. 200 μL가 피하 공간으로 전달될 때까지 세포 현탁액을 계속 주입합니다.
- 집게를 제자리에 잡고 바늘을 마우스의 몸과 평행하게 유지하면서 천천히 바늘을 빼냅니다. 바늘을 제거한 후 집게로 피부를 닫은 채로 몇 초 동안 유지하여 찔린 상처에서 세포가 새어 나오지 않도록합니다.
- 유전자 변형을 평가하는 경우 다른 주사기를 사용하여 마우스의 반대쪽에 이식을 반복하여 돌연변이 세포와 대조 세포가 모두 각 마우스에 주입되도록 하고 한 세포주는 왼쪽에, 다른 세포주는 오른쪽에 주입합니다. 하나의 세포주만 이식하는 경우 한쪽에만 세포를 주입합니다.
- 이식 후 각 마우스를 신선한 케이지로 옮깁니다. 케이지에 마우스를 추가하기 전에 각 마우스가 마취에서 완전히 회복되도록하십시오.
참고: 마우스는 정상적인 활동을 재개하고 무기력이나 운동 장애의 징후를 보이지 않을 때 회복됩니다. - 이식 후 실험 기간 동안 매일 마우스의 건강 상태를 평가합니다. 이식편이 큰 돌출부를 형성하거나 생쥐가 약해지고 무기력해지면 혈당을 측정하고 모든 저혈당 생쥐에게 10%(w/w) 자당 물을 임 의 로 제공합니다. 모든 수의사의 권장 사항을 따르고 기관 지침에 따라 신체 상태가 계속 좋지 않은 모든 마우스를 안락사시키십시오. 이 연구에서, 마우스는CO2 흡입에 의해 안락사시킨 후 자궁 경부 탈구되었다.
4. 자가반응성 비장세포의 분리 및 정제
- 소변(또는 혈액) 포도당 테스트 스트립을 사용하여 최근 발병(10일 미만) 당뇨병이 있는 10-16주령 수컷 또는 암컷 NOD 마우스를 식별합니다. NOD 마우스는 최소 연속 2일 동안 소변/혈당≥250mg/dL이 있을 때 당뇨병으로 간주됩니다.
참고: 각 NOD-scid 마우스에 대해 1,000만 개의 비장세포가 필요합니다. 하나의 비장은 일반적으로 5 천만에서 1 억 5 천만 개의 비장 세포를 산출합니다. 비장 세포는 지각 모니터링 시설에 수용된 병원체가 없는 마우스에서 분리되었습니다. - 적절한 수의 당뇨병 NOD 마우스를 안락사시킵니다.
참고: 이 연구에서, 마우스는 CO2 흡입에 의해 안락사된 후 경추 탈구에 의해 사망을 보장하였다. - 마우스를 등에 대고 수술용 가위로 피부에 약 2인치 길이의 수직 절개를 합니다. 연구원의 관점에서 마우스의 오른쪽을 열고 밝은 빨간색 비장을 찾습니다. 분홍색 췌장에서 비장을 부드럽게 잘라내어 멸균 PBS 5mL가 들어있는 멸균 10cm 페트리 접시에 옮깁니다. 필요한만큼의 마우스로 해부를 반복하십시오.
참고: 여러 생쥐의 비장을 한 접시에 결합할 수 있습니다. 멸균 후드에 멸균 시약과 장비를 사용하여 다음 단계를 수행하십시오. - 멸균 주사기 플런저의 평평한 상단으로 비장을 으깬다.
- 40μm 또는 70μm 스트레이너를 50mL 원뿔형 튜브에 넣고 5mL의 PBS로 스트레이너를 세척하여 프라이밍합니다. 비장 현탁액을 여과기로 옮기고 여과기를 통해 부드럽게 으깨십시오. PBS 10mL로 접시를 씻고 세척액을 여과기로 옮깁니다. 여과기에서 붉은 색이 사라질 때까지 계속 으깬다.
- 스트레이너를 버리고 RT에서 500 × g 에서 5 분 동안 튜브를 회전시킵니다.
- RT로 예열된 ACK 용해 완충액 5mL(최대 3개의 비장에 대해)에 세포 펠릿을 재현탁하고 적혈구를 4분 동안 용해합니다. 추가 비장이 필요한 경우 비장 당 1-2mL 부피를 늘리십시오.
- 용해 완충액 5 mL 당 5 mL의 NIT-1 세포 배지 (상기 설명)로 반응을 중지시킨다. 덩어리를 제거하기 위해 새로운 여과기를 통해 세포 현탁액을 통과시킵니다. 스트레이너를 버리고 RT에서 500 × g 에서 5 분 동안 회전시킵니다.
- 세포 펠릿을 20mL의 PBS에 재현탁하고 세포 계수를 합니다. RT에서 5분 동안 500× g 으로 회전합니다. 1.5mL 안전 잠금 반응 튜브에서 1 ×10 8 cells/mL(주입 부피는 0.1mL/마우스)의 농도로 멸균 PBS에 세포를 재현탁합니다.
- 세포를 얼음 위에 보관하거나(1시간 이하) 세포를 RT에 보관하고 즉시 꼬리 정맥 주사를 진행합니다.
5. 측면 꼬리 정맥을 통한 당뇨병 성 비장 세포의 정맥 주사
- 성체 수용자 NOD-scid 마우스의 몸을 따뜻하게 하여(예: ~5-10분 동안 열 램프를 사용하여) 정맥을 혈관 확장시킵니다(시각화 및 정맥 주입에 도움이 됨).
알림: 마우스의 과열을 방지하려면 이 시간을 초과하지 마십시오. 항상 상태를 모니터링합니다. 생쥐가 지치거나 움직이지 않는 것처럼 보이면 열을 끄십시오.amp 즉시. - 세포 현탁액을 예열하십시오. 멸균 바늘(27-30G, 0.3mm/0.5인치 이하)이 있는 멸균 주사기(0.3-1.0mL)를 준비하거나 0.3mm(0.5인치) 바늘이 있는 멸균 0.5mL 인슐린 주사기를 사용합니다. 주사 바늘을 항상 멸균 상태로 유지하고 주사기를 주사 사이에 내려놓아야 하는 경우 멸균 트레이를 사용하십시오.
- 각 주사 전에 비장 세포 용액을 다시 일시 중지하십시오. 각 마우스에 대해 예열 및 혼합된 비장세포 현탁액 100μL를 주사기에 넣습니다. 주사기 또는 현탁액에 기포가 없는지 확인하십시오.
참고: 마우스를 구속 장치에 넣기 전에 모든 장비와 용품(소독용 알코올 물티슈, 주사할 비장세포가 담긴 주사기, 주입된 마우스를 분리하기 위한 새 케이지)을 준비해야 합니다. - 고정 장치에 마우스를 놓습니다. 지배적이지 않은 손으로 꼬리를 잡고 두 개의 측면 꼬리 정맥 중 하나를 찾습니다. 필요한 경우 꼬리를 부드럽게 돌립니다. 소독 물티슈 (70 % 이소 프로필 알코올)로 꼬리를 닦아 피부를 깨끗하게하고 정맥의 가시성을 높입니다.
- 주로 사용하는 손으로 꼬리의 중앙 영역에 바늘을 예각으로 삽입하십시오. 바늘의 경사가 위를 향하도록 하여 바늘을 피부를 통해 몇 밀리미터 밀어 넣습니다.
알림: 바늘이 정맥과 평행하고 피부 약간 아래에 위치하는지 확인하십시오. 피부/혈관벽을 관통한 직후 마우스/꼬리의 갑작스러운 움직임에 대비하십시오. 바늘을 성공적으로 삽입하면 정맥에 "부드러운 슬라이드"처럼 느껴져야 합니다. 다른 시도가 필요한 경우 꼬리를 몸쪽으로 더 위로 움직입니다. - 비장 세포 현탁액을 주입하기 위해 주사기에 부드러운 압력을 가하십시오. 주입할 때 바늘이 더 이상 안팎으로 움직이지 않도록 하십시오. 성공적인 주사는 주사 중 배압을 느끼지 않고 매끄럽고 주사 직후 투명/백색 혈류로 표시됩니다.
- 바늘을 정맥에서 부드럽게 풀고 출혈이 멈출 때까지 소독 물티슈로 꼬리에 가벼운 압력을 가하십시오. 구속 장치에서 마우스를 풀고 새로 준비된 케이지로 부드럽게 옮깁니다.
참고: NIT-1 세포 이식을 받지 않은 대조군 마우스에 비장세포를 주사하여 자가반응성 비장세포가 당뇨병을 유발할 가능성을 확인하며, 주사 후 약 2-4주가 소요됩니다.
6. NIT-1 이식편의 생체 내 생체 발광 이미징
참고: 이식편을 일주일에 1-2회 이미지화합니다. 이식 당일, 이식편이 안정되고 안정적인 루시페라아제 발현을 보장하기 위해 이식 후 최소 2시간을 기다리십시오. 시간이 제한 요소인 경우 초기 측정은 대신 1일에 수행될 수 있습니다. 권장되는 초기 이미징 일정은 주사 후 0일 또는 1일, 5일, 10일, 14일, 18일 및 25일입니다. 그러나 생체 발광 신호의 손실로 판단되는 자가면역의 진행 상황에 따라 일정을 조정합니다.
- Dulbecco의 PBS에서 15mg/mL D-luciferin 용액을 준비합니다. RT에서 교반하여 용해시키고, 멸균 필터(0.22 μm)를 제균한다. 1mL 분취량을 -20°C에서 보관하고 필요에 따라 해동합니다.
참고: 부분 표본은 다시 얼 수 있습니다. - 이미징 최소 5분 전에 1mL 주사기와 26G 바늘에 150mg/kg 용량의 D-루시페린 용액을 사용하여 마우스를 복강 주사합니다.
알림: 각 마우스에 새 주사기와 바늘을 사용하십시오. - 기관 지침에 따라 isoflurane 흡입으로 마우스를 마취합니다. 권장 조건은 녹다운 챔버로의 유속이 1.5L/min이고 배출 속도가 9L/min인 2.5% 이소플루란입니다.
- 건조를 방지하기 위해 안과 용 연고로 동물의 눈을 윤활하십시오.
- 이미징 기기와 연결된 소프트웨어를 엽니다. 새 사용자 및/또는 로그인을 만듭니다. 오른쪽 아래의 제어판 에서 초기화 를 선택합니다(그림 2A). 이미징 데이터를 자동으로 저장 하려면 컴퓨터에 적절한 폴더를 만든 다음 획득 | 자동 저장 위치... (그림 2A). 기기 초기화가 완료되면 노출 시간을 1분으로 설정합니다.
알림: 전체 이미징 매개변수는 그림 2B에 나와 있습니다. - 마우스를 한 번에 하나씩 녹다운 챔버에서 이미징 기기로 옮깁니다. 팔다리를 벌린 채 마우스를 뱃속에 놓고 머리를 코 콘으로 부드럽게 안내합니다. 노즈 콘을 통해 전달되는 0.25L/min의 이소플루란 유속은 이미징 중 마취를 유지하는 데 적합합니다. 양손으로 등 중앙을 누른 다음 손을 바깥쪽으로 벌려 마우스를 부드럽게 평평하게 만듭니다.
- Acquire(획득)를 선택합니다(그림 2B). 팝업 창에 실험의 관련 세부 정보를 기록합니다(그림 2C).
참고: 다양한 시점에서 2개의 이식편을 이식한 3개의 8주령 암컷 NOD-scid 마우스의 대표 이미지는 그림 3A 를 참조하십시오.
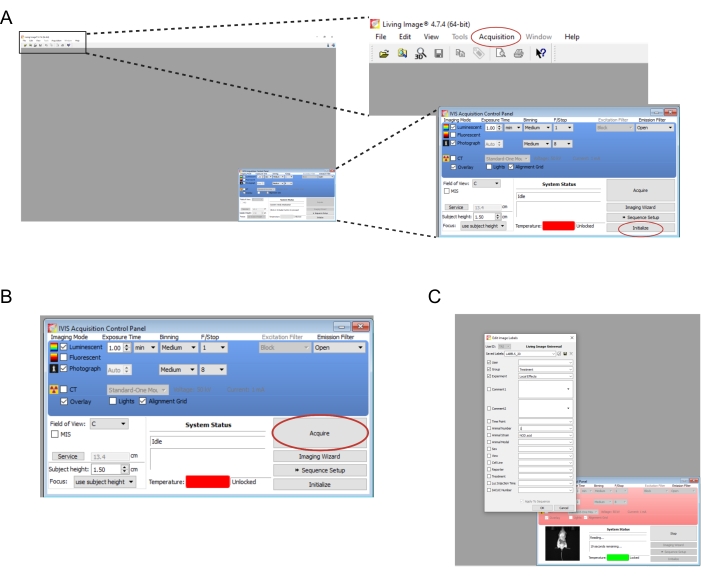
그림 2: 생체발광 이식편 이미징을 위한 소프트웨어 명령의 스크린샷 . (A) 이미징하기 전에 Initialize 를 선택하여 기기를 준비합니다. 이미지는 Acquisition | 자동 저장 위치... (B) 이미징 매개변수의 개요. 마우스를 기기에 배치하면 Acquire를 선택합니다. (C) 이미징 중에 팝업되는 대화 상자의 스크린샷입니다. 시점 및 마우스 변형과 같은 세부 정보를 여기에 입력할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
7. 데이터 분석
- 이미징 후 언제든지 생체발광 신호를 정량화할 수 있습니다. 이미징 기기와 연결된 소프트웨어를 엽니다. 파일 선택 | 열고 분석할 마우스와 연결된 ClickInfo.txt 파일을 선택합니다.
- 도구 팔레트에서 ROI 도구를 선택합니다(그림 3B, 1단계). 타원형 드롭다운 메뉴(그림 3B, 1단계, 빨간색 화살표)에서 마우스에 이식된 이식편 수를 선택합니다.
- 각 이식편의 생물발광 신호가 포함되도록 타원을 이동하고 ROI 측정을 선택합니다(그림 3B, 2단계).
- 각 이식편에 대한 총 개수 를 기록합니다(그림 3B, 3단계).
- 각 이식편에 대해, 모든 시점에서 측정된 생체발광 신호를 제1 시점에서 측정된 신호로 나눕니다. 이식편 생존 을 초기 생체발광 신호에 대한 잔류 생체발광 신호의 비율 또는 백분율로 보고합니다.
참고: 이식편이 이식 후 확장되면 이식편 생존율 또는 백분율은 각각 1 또는 100%보다 큽니다. 이식을 받는 모든 생쥐는 건강에 악영향을 미치는지 모니터링해야 합니다.
결과
프로토콜에 대한 개요는 그림 1에 요약되어 있습니다. 2개의 세포주, 예컨대 돌연변이체 및 비표적화 대조군의 생존을 비교하거나, 하나의 세포주의 생존을 다수의 마우스 그룹, 예컨대 약물-처리된 마우스 대 비히클-처리된 대조군에서 측정할 수 있다. 도 3A 는 비표적 대조군(왼쪽)과 돌연변이(오른쪽) 세포주를 이식한 8주령의 암컷 NOD-scid 마우스 3마?...
토론
T1D는 현재 치료법이 존재하지 않는 치명적인 질병입니다. 베타 세포 대체 요법은 이 질환을 앓고 있는 환자에게 유망한 치료법을 제공하지만 이 전략의 중요한 장벽은 이식된 베타 세포에 대한 반복적인 자가면역 공격의 가능성입니다. SC-베타 세포의 면역 가시성이나 감수성을 줄이기 위한 유전 공학은 이 문제에 대한 잠재적인 해결책 중 하나입니다. 여기에 기술된 것은 마우스에서 자가면역 당...
공개
저자는 이해 상충이 없다고 선언합니다.
감사의 말
이 프로토콜에 설명된 방법을 개발한 Erica P. Cai 박사와 Yuki Ishikawa 박사에게 감사드립니다(참조 11 참조). S.K.와 P.Y.의 실험실에서의 연구는 미국 국립보건원(NIH)(R01DK120445, P30DK036836), JDRF, 하버드 줄기세포 연구소 및 비트슨 재단의 보조금으로 지원됩니다. T.S.는 국립 당뇨병 및 소화기 및 신장 질환 연구소 (NIDDK) (T32 DK007260-45)의 박사후 연구원의 지원을 받았으며 K.B.는 Mary K. Iacocca Foundation의 펠로우 십에 의해 부분적으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin, 0.53 mM EDTA | Corning | 25-052-CI | |
| 293FT | Invitrogen | R70007 | Fast-growing, highly transfectable clonal isolate derived from human embryonal kidney cells transformed with the SV40 large T antigen |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| Alcohol prep pads, 70% Isopropyl alcohol | Amazon/Ever Ready First Aid | B08NWF31DX | |
| BD 5ml Syringe Luer-Lok Tip | BD | 309646 | |
| BD PrecisionGlide Needle 26G x 5/8 (0.45 mm x 16 mm) Sub-Q | BD | 305115 | |
| BD 1 mL TB Syringe Slip Tip | BD | 309659 | |
| Blasticidin S HCl | Corning | 30-100-RB | |
| Cell strainer premium SureStrain, 70 µm, sterile | Southern Labware | C4070 | Or use similar sterile strainer with 40-70um pore size |
| CellDrop automated cell counter | Denovix | CellDrop BF-PAYG | Or use similar cell counter device |
| Corning 100 mL Penicillin-Streptomycin Solution, 100x | Corning | 30-002-CI | |
| Disposable Aspirating Pipets, Polystyrene, Sterile, Capacity=2 mL | VWR | 414004-265 | Or use similar aspirating pipette |
| D-Luciferin, Potassium Salt , Molecular Biology Grade, Powder, >99% | Goldbio | LUCK-100 | |
| DMEM, high glucose, pyruvate, no glutamine | Gibco | 10313039 | |
| Falcon BD tubes, 50 mL | Fisher Scientific | 14-959-49A | |
| Fetal Bovine Serum | Gibco | 10437-028 | |
| Forceps premium for tissues, 1 x 2 teeth 5 in, German Steel | Fisher Scientific | 13-820-074 | |
| Glucose urine test strip | California Pet Pharmacy | u-tsg100 | Or use similar test strip for glucose measurments in urine/blood |
| GlutaMAX–1 (100x) | Gibco | 35050-061 | |
| Infrared heating lamp | Cole Parmer | 03057-00 | Or use similar infrared lamp |
| Insulin syringe 0.5 mL, U-100 29 G 0.5 in | Becton Dickinson | 309306 | |
| Isoflurane, USP | Piramal Critical Care | 6679401725 | |
| IVIS Spectrum in vivo imaging system | Perkin Elmer | 124262 | Instrument for non-invasively collecting bioluminescent images of transplanted cells |
| Living Image Analysis Software | Perkin Elmer | 128113 | Software for collecting and quantifying bioluminescent signal |
| Microcentrifuge tubes seal-rite, 1.5 mL | USA Scientific | 1615-5510 | Or use similar sterile microcentrifuge tubes |
| NIT-1 | ATCC | CRL-2055 | Pancreatic beta-celll line derived from NOD/Lt mice |
| NOD.Cg-Prkdcscid/J | The Jackson Laboratory | 001303 | Mice homozygous for the severe combined immune deficiency spontaneous mutation Prkdcscid, commonly referred to as scid, are characterized by an absence of functional T cells and B cells, lymphopenia, hypogammaglobulinemia, and a normal hematopoietic microenvironment. |
| NOD/ShiLtJ | The Jackson Laboratory | 001976 | The NOD/ShiLtJ strain of mice (commonly called NOD) is a polygenic model for autoimmune type 1 diabetes |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010031 | No calcium, no magnesium, no phenol red |
| pCMV-VSV-G | Addgene | 8454 | |
| pLenti-luciferase-blast | Made in-house | Plasmid available upon request | See Supplemental File 1 |
| pMD2.G | Addgene | 12259 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polyethylenimine, Linear, MW 25,000, Transfection Grade (PEI 25K) | Fisher Scientific | NC1014320 | |
| pRSV-Rev | Addgene | 12253 | |
| Restrainer for rodents, broome-style round 1 in | Fisher Scientific | 01-288-32A | |
| Scissors, sharp-pointed | Fisher Scientific | 08-940 | Or use other scissors made of surgical-grade stainless steel |
| Tissue-culture treated culture dishes | Millipore Sigma | CLS430167-20EA | Or use other sterile cell culture-treated Petri dishes |
| Tweezers/Forceps, fine precision medium tipped | Fisher Scientific | 12-000-157 |
참고문헌
- Katsarou, A., et al. Type 1 diabetes mellitus. Nature Reviews Disease Primers. 3, 17016 (2017).
- Shapiro, A. M., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews Endocrinology. 13 (5), 268-277 (2017).
- Pagliuca, F. W., et al. Generation of functional human pancreatic beta cells in vitro. Cell. 159 (2), 428-439 (2014).
- Russ, H. A., et al. Controlled induction of human pancreatic progenitors produces functional beta-like cells in vitro. EMBO Journal. 34 (13), 1759-1772 (2015).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nature Biotechnology. 32 (11), 1121-1133 (2014).
- Vertex Announces Positive Day 90 Data for the First Patient in the Phase 1_2 Clinical Trial Dosed With VX-880, a Novel Investigational Stem Cell-Derived Therapy for the Treatment of Type 1 Diabetes. Businesswire Available from: https://www.businesswire.com/news/home/20211018005226/en/Vertex-Announces-Positive-Day-90-Data-for-the-First-Patient-in-the-Phase-12-Clinical-Trial-Dosed-With-VX-880-a-Novel-Investigational-Stem-Cell-Derived-Therapy-for-the-Treatment-of-Type-1-Diabetes (2021)
- Gamble, A., Pepper, A. R., Bruni, A., Shapiro, A. M. J. The journey of islet cell transplantation and future development. Islets. 10 (2), 80-94 (2018).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the Non Obese Diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Hamaguchi, K., Gaskins, R. H., Leiter, E. H. NIT-1, a pancreatic β-cell line established from a transgenic NOD/Lt mouse. Diabetes. 40 (7), 842-849 (1991).
- Christianson, S. W., Shultz, L. D., Leiter, E. D. Adoptive transfer of diabetes into immunodeficient NOD-scid/scid mice: Relative contribution of CD4+ and CD8+ T-cells from diabetogenic versus prediabetic NOD.NON-Thy1a donors. Diabetes. 42 (1), 44-55 (1993).
- Cai, E. P., et al. Genome-scale in vivo CRISPR screen identifies RNLS as a target for beta cell protection in type 1 diabetes. Nature Metabolism. 2 (9), 934-945 (2020).
- Parent, A. V., et al. Selective deletion of human leukocyte antigens protects stem cell-derived islets from immune rejection. Cell Reports. 36 (7), 109538 (2021).
- Brehm, M. A., et al. Lack of acute xenogeneic graft-versus-host disease, but retention of T-cell function following engraftment of human peripheral blood mononuclear cells in NSG mice deficient in MHC class I and II expression. FASEB Journal. 33 (3), 3137-3151 (2019).
- Abdulreda, M. H., et al. In vivo imaging of type 1 diabetes immunopathology using eye-transplanted islets in NOD mice. Diabetologia. 62 (7), 1237-1250 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유