需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
压力超负荷诱导的肺干束带右心室肥厚和衰竭的小鼠模型
摘要
我们描述了由肺干带诱导的右心室压力超负荷的小鼠模型。论文中包括了插管、手术和超声心动图表型分析的详细方案。定制器械用于插管和手术,可以快速且廉价地复制模型。
摘要
压力超负荷引起的右心室 (RV) 衰竭与许多心血管和肺部疾病的发病率和死亡率密切相关。右心室衰竭的发病机制很复杂,目前尚不清楚。为了确定治疗 RV 衰竭的新治疗策略,稳健且可重复的动物模型至关重要。肺干带 (PTB) 模型越来越受欢迎,因为 RV 功能可以独立于肺血管系统的变化进行评估。
在本文中,我们提出了 PTB 诱导的 5 周龄小鼠 RV 压力超负荷的小鼠模型。该模型可用于诱导不同程度的 RV 病理,范围从轻度 RV 肥大到失代偿性 RV 衰竭。论文中包括插管、PTB 手术和超声心动图表型分析的详细方案。此外,还给出了定制插管和 PTB 手术器械的说明,从而能够快速且廉价地复制 PTB 模型。
使用钛结扎夹来收缩肺干,确保肺干收缩程度高度可重复且独立于操作者。使用不同的内结扎夹直径 (轻度:450 μm 和重度:250 μm) 对 PTB 的严重程度进行分级。这导致 RV 病理学范围从保留 RV 功能的肥大到伴有心输出量和心外表现减少的失代偿性 RV 衰竭。术后 1 周和 3 周通过超声心动图评估 RV 功能。此处提供了超声心动图图像和结果的示例。此外,还显示了右心导管插入术和心脏组织组织学分析的结果。
引言
右心室 (RV) 衰竭是一种临床综合征,表现为心力衰竭症状和 RV 功能障碍引起的全身充血体征1。右心室功能障碍与许多心血管和肺部疾病的发病率和死亡率密切相关2。右心室功能障碍的病因很复杂,其潜在的信号通路和调节仍未充分阐明。
当前疗法的观察表明,右心室功能的改善与后负荷的减少密切相关,表明肺血管系统是主要治疗目标3。这表明目前的疗法对 RV 功能的直接影响很小,即使在肺血管阻力改善后也可能恶化3。因此,非常需要进一步研究独立于后负荷降低来改善 RV 功能。
稳健且可重复的动物模型对于寻找新的治疗剂至关重要。在大多数慢性 RV 衰竭模型中,根本原因是由肺血管系统结构改变引起的肺动脉高压 4,5,6。特征明确的模型包括慢性缺氧模型 7,8、Sugen-hypoxia 模型 9,10,11 和野百合碱模型 12,13。由于在这些模型中 RV 衰竭继发于肺动脉高压,因此无法区分干预对肺血管系统的影响和对 RV6 的直接影响。
为了独立于肺血管系统研究 RV,肺干带 (PTB) 模型已经流行起来,并已在多种动物物种中得到描述,包括小鼠、大鼠、兔子、狗、羊和猪 6,14,15,16,17,18,19,20,21,22,23, 24,25,26,27。在 PTB 模型中,肺干的收缩是通过手术实现的,导致 RV 压力增加6。存在不同的 PTB 应用方法,包括用结扎线或金属结扎夹收缩血管18,28。在使用结扎线的模型中,肺干系在针头上,针头缩回,使结扎线留在原位。这导致血管收缩,这取决于针的大小和结的张力18,29。在使用金属结扎夹的模型中,肺干收缩的程度可能更具可重复性。修改后的连接夹涂抹器用于将连接夹闭合为预定义的恒定直径。这使得该方法独立于操作员,并减少了疾病表型 15,27,28 中与 PTB 相关的变异性。
小鼠 PTB 模型已被证明可诱导 RV 肥大和衰竭18,28。使用 PTB 模型时的一个主要挑战是选择合适的 PTB 直径以达到所需的 RV 病理程度。在尝试对失代偿 RV 故障进行建模时,这尤其具有挑战性。为此,收缩需要足够紧密以诱发慢性 RV 衰竭,而不会导致急性 RV 衰竭和手术后不久死亡6。解决这一挑战的一种方法是使用断奶仔猪或幼年动物 6,15。PTB 模型已成功用于使用 Wistar 大鼠断奶15,30 研究 RV 衰竭的不同阶段。为了实现这一目标,具有剩余生长潜力的幼年大鼠接受了应用钛结扎夹的 PTB 手术。当大鼠长大时,肺动脉瓣狭窄逐渐变得更加严重,并导致 RV 肥大或慢性 RV 衰竭,具体取决于 PTB的严重程度 15,30。受该模型的启发,我们假设可以在使用幼年小鼠的小鼠 PTB 模型中产生 RV 病理的不同阶段。研究从轻度到重度疾病的广泛 RV 病理学可能有助于阐明我们对疾病进展以及从 RV 肥大到 RV 衰竭的转变的理解。
在这里,我们提出了 PTB 在幼年小鼠中诱导的 RV 压力超负荷的小鼠模型。使用该模型,可以产生不同程度的 RV 病理,从 RV 肥大到失代偿性 RV 衰竭。本研究包括插管、PTB 手术和超声心动图表型的详细方案。
研究方案
该研究已获得丹麦动物实验检查局(授权号:2021-15-0201-00928)的批准,并根据国家实验动物立法进行。本研究使用 5 周龄雄性 C57BL/6N 小鼠。
1. 插管和手术器械的定制(图 1)
注意:本节详细介绍了使用廉价且现成的材料准备用于插管和 PTB 手术的定制器械的最重要步骤。
- 准备气管插管(图 1A)。
普通静脉 (IV) 导管可用于小鼠的插管和通气。- 选择与小鼠大小相对应的适当尺寸的血管内导管。建议 22 周龄小鼠 (17-20 g) 使用 20G 导管,对于较大的小鼠 (>20 g) 使用 23G 导管。
- 拔出针并拆下锁定机构。将针头插回导管中,以 45° 角切割针尖,距离导管尖端约 2 毫米。
- 使用砂纸钝化尖端,以防止损伤小鼠的声带。
- 切掉导管的一个翼,以便在插管过程中获得更好的视野。
- 准备胸牵开器(图 1B)。
- 使用持针器将一根约 10 厘米长的柔性金属丝从中间弯曲 30°。
- 使用持针器小心地在电线的两端创建 5 毫米宽的无创钩。
- 准备插管架(图 1C)。
注意:使用插管架可以在插管期间通过鼻管连续输送麻醉剂。这允许在视觉引导下进行受控和安全的插管,从而降低声带和气管受伤的风险以及管子在食管中错位的风险。任何金属或塑料框架都可以用作插管架的框架。本研究中使用了一个略微弯曲的厨房角色持有者。- 剪下一根适合小鼠鼻子的 3 厘米橡胶管,并将其连接到 IV 导管阀。吸入麻醉可以在插管前通过阀门连接。
- 使用距离管口约 5 毫米的 1-0 编织缝合线制作一个环。这将用于将小鼠鼻子固定在管中。
- 在柔性塑料板顶部附近切一个孔,然后将管子放入孔中。该片材用于支撑插管架中的鼠标。
- 使用胶带将各个部件固定在一起,如图 1C 所示。
- 准备引导套管(图 1D、E)。
- 将 6-0 单丝缝合线穿过钝的 27G 套管,并在缝合线上打一个结。稍后使用此结在 PTB 手术期间抓住缝合线。
- 使用持针器将套管尖端弯曲成 80° 角。
- 准备连接夹涂抹器。
注意:带有斜口的连接夹涂抹器使用可调节的停止机构进行修改(图 1F),当钳口彼此之间处于精确预定的距离时,它会停止压缩连接夹。改进的结扎夹涂抹器用于在肺干上应用钛结扎夹。- 用两个螺钉将一块定制切割的黄铜固定在连接夹涂抹器的手柄上。在中心安装一个可调节螺钉(图 1F,白色箭头),该螺钉确定连接夹涂抹器压缩手柄之间的精确距离,这对应于钳口之间的精确距离。

图 1:插管和 PTB 手术器械。 (A) 由 IV 导管制成的气管插管。(B) 胸牵开器。(C) 插管架和放置在插管架上的小鼠在鼻管上接受麻醉。(D) 用于 PTB 手术的手术器械和改进的结扎夹涂抹器。(E) 引导套管。(F) 定制的可调节止动机构。 请单击此处查看此图的较大版本。
2. 调整结扎夹涂抹器
- 根据所需的 RV 故障严重性选择连接夹的内径。对于 5 周龄雄性 C57BL/6N 小鼠 (17-20 g),对于严重使用 250 μm 的夹子直径,对于轻度 RV 压力超负荷使用 450 μm。使用中间夹径来诱导中度压力过载。
- 使用金属丝或针头调整结扎夹涂抹器。确保导线的直径与所需的夹子直径相对应。
- 用连接夹装入夹子上,并将调节丝放在连接夹的中心。在压缩夹子涂抹器时,转动螺钉,直到夹子的钳口紧紧地贴合电线。松开夹子应用器后,确保夹子保持在调节线上。
- 调整夹子涂抹器后,将另一个连接夹放在调节线上以验证设定的直径。
3. 手术准备
- 在诱导室中使用 7% 七氟烷在 0.6 L/min 100% 氧气中诱导麻醉。插管前通过脚趾捏确认麻醉充分。
注意:也可以使用异氟醚。请注意,应使用不同的浓度。 - 用 22G IV 导管给小鼠插管。在视觉引导下使用手术显微镜和插管架进行插管,允许正确对齐以观察声带并在鼻管上连续输送吸入麻醉剂(图 1C)。
- 以 175 次冲程/分钟和 300 μL/冲程的潮气量为小鼠通风。
注意:还建议潮气量为 8-10 μL/g,理想的潮气量取决于通风系统中可能的泄漏和死腔。 - 将插管的鼠标放在有盖的加热垫 (37 °C) 上,并在小鼠的眼睛上涂抹保湿软膏。
- 维持麻醉(3.5% 七氟烷在 0.6 L/min 100% 氧气中)并皮下注射 0.1 mg/kg 丁丙诺啡和 5 mg/kg 卡洛芬用于围手术期镇痛。使用脱毛霜去除胸部的所有毛发,并用消毒湿巾对皮肤进行消毒。
4. PTB 手术
- 在第二肋间隙上方的皮肤上从胸骨角到左腋前线切开 10 毫米。通过钝器解剖劈开胸大肌和小胸肌。
- 切开第二肋间隙的肋间肌,钝剖开胸腺,露出心脏、肺干和主动脉。在肋间隙放置胸牵开器,以保持手术区域可及。
注意:切割肋间肌时必须非常小心,因为左乳内动脉在胸骨外侧仅 1-2 毫米。该动脉损伤可能导致大量失血。 - 使用显微镊子钝性去除血管之间的结缔组织,将肺干与升主动脉分开。通过旋转鼠标的下半身(左腿在右腿上),进一步改善肺干的暴露。
- 将引导套管穿过肺干后部的横心包窦。用镊子抓住引导套管尖端的结,然后将缝合线拉过引导套管。小心地取下引导套管,同时缝合线保持在肺干周围。
- 装入结扎夹应用器并使用缝合线将肺干引导到结扎夹的钳口中并压缩夹。放置夹子后立即松开缝合线,观察肺干的填充情况。
注意:在使用结扎夹后的最初几秒钟内可能会观察到心动过缓。 - 在第二和第三肋周围放置一根 6-0 单丝可吸收缝合线,并关闭肋间隙。在收紧缝合线的同时,轻轻按压胸部,尽可能多地从胸腔中排出空气。
- 最后,用 6-0 单丝可吸收缝合线缝合皮肤。
- 在假手术期间执行相同的程序,除了放置结扎夹(步骤 4.5)外。
5. 超声心动图
- 在诱导室中麻醉诱导后(1-2 分钟,6% 七氟烷在 100% 氧气中),使用鼻管(3.5% 七氟烷在 100% 氧气中)维持麻醉。使用脱毛膏去除胸部和腹部的所有毛发,然后将鼠标放在加热垫上。在眼睛上涂抹保湿软膏,在小鼠的胸部涂抹超声凝胶。
注:调整 2D 增益、聚焦深度和 图像深度 ,以提高所有超声心动图测量的图像质量。 - 调整超声探头以找到胸骨旁长轴 (PLAX) 视图(图 2)。在 PLAX 中,测量肺干中的肺干内径和速度时间积分 (VTI)。
- 选择 B 模式 并小心地在 x、y 和 z 轴上移动加热垫,以识别图像中心的肺干。使用 颜色 来识别最大的肺干直径。使用 cine store 捕获用于测量肺干直径的序列。
- 选择 彩色 和 脉搏波 (PW) 多普勒 ,并将光标置于肺干的中心。调整 PW 角度 ,直到虚线与血管中的血流平行。
- 按 cine store 测量 VTI。将光标放在肺干的两壁附近,然后再次按 cine store 以获取血管壁附近的流量。
注意:右心室 (RV) 内径和 RV 游离壁厚也可以在 PLAX 视图中进行评估。
- 找到胸骨旁短轴 (PSAX) 视图(图 3)以测量左心室 (LV) 内径,可用于评估间隔膨出(D 型)。
- 选择 B 模式 并将探头逆时针旋转 90°。将探头横向倾斜 20-30 度以避免胸骨遮挡 RV,并将探头颅骨倾斜 20-30 度,直到左心室尽可能圆。然后,沿颅尾方向滑动探头,以确定心室直径最大的肌水平,并按 电影商店。
注意:中部水平的 PSAX 也可用于评估 RV 分数面积变化。主动脉瓣水平的 PSAX 可用于测量 RV 分数缩短或 RV 游离壁厚度。
- 选择 B 模式 并将探头逆时针旋转 90°。将探头横向倾斜 20-30 度以避免胸骨遮挡 RV,并将探头颅骨倾斜 20-30 度,直到左心室尽可能圆。然后,沿颅尾方向滑动探头,以确定心室直径最大的肌水平,并按 电影商店。
- 使用根尖 4 腔 (A4CH) 视图(图 4)测量三尖瓣环平面收缩偏移 (TAPSE) 并评估三尖瓣反流。
- 如图 4 所示放置探头。一旦确定了心脏,只需使用手腕和手指对探头进行小幅调整,以识别心脏的所有四个腔室和三尖瓣。
- 识别和保持良好的 A4CH 视图具有挑战性。让探头操作的手放在加热垫上以保持稳定。滑动、倾斜并轻轻转动探头,直到找到合适的图像。
- 一次只能在一个维度上移动探头:例如,滑动颅尾以找到心脏,然后倾斜探头以识别所有四个腔室,最后转动探头,直到所有四个腔室和三尖瓣都在框架中。如有必要,重复所有三个步骤几次,以获得理想的图像。
- 确定三尖瓣后,选择 M 模式 并将虚线放置在游离壁的三尖瓣环中。按 cine store 保存测量值。
- 选择 颜色 以评估三尖瓣是否出现反流。如果存在反流,将在收缩期看到从 RV 逆流到右心房 (RA) 的喷射(图 5)。
注:在 A4CH 视图中,还可以测量 RV 游离壁中的组织多普勒和 RV 流入速度。
- 如图 4 所示放置探头。一旦确定了心脏,只需使用手腕和手指对探头进行小幅调整,以识别心脏的所有四个腔室和三尖瓣。
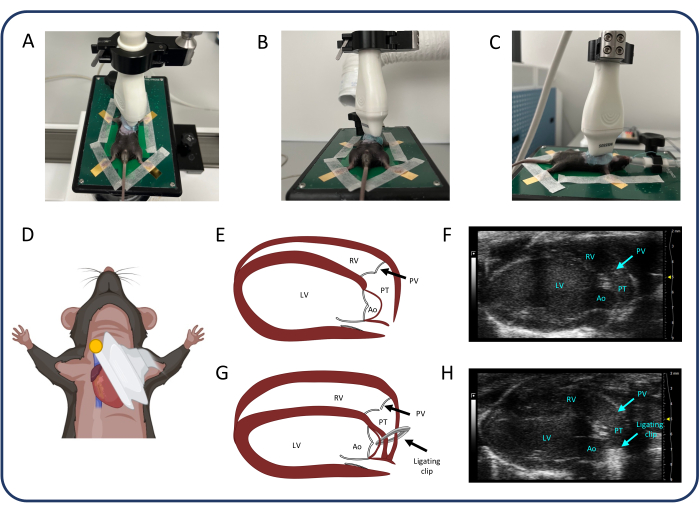
图 2:胸骨旁长轴视图 (PLAX)。(A-D) 超声探头的定位。(E, F) PLAX 中的正常鼠心。(G、H)PTB 后 RV 扩张和肥大。缩写: LV: 左心室, RV: 右心室, PV: 肺动脉, PT: 肺干, Ao: 主动脉。请单击此处查看此图的较大版本。
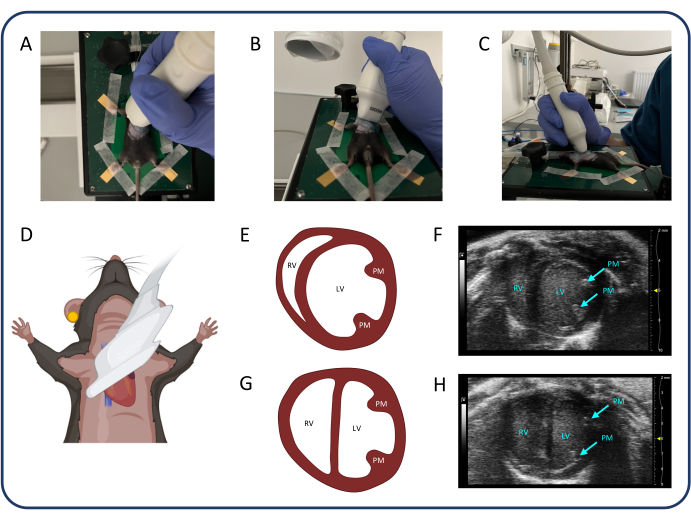
图 3:胸骨旁短轴视图 (PSAX)。(A-D) 超声探头的定位。(E, F)PSAX 中的正常鼠心。(G、H)PTB 后的 PSAX。缩写: LV: 左心室, RV: 右心室, PM:肌。请单击此处查看此图的较大版本。
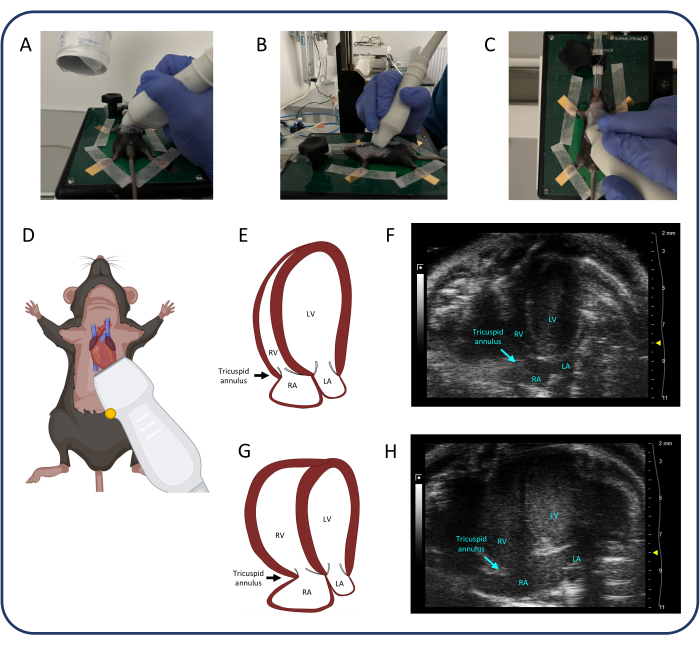
图 4:顶端 4 腔视图 (A4CH)。(A-D) 超声探头的定位。(E, F) A4CH 视图中的正常鼠心。(G、H)PTB 后 RV 和 RA 扩张。缩写:LV:左心室,RV:右心室,RA:右心房,LA:左心房。请单击此处查看此图的较大版本。
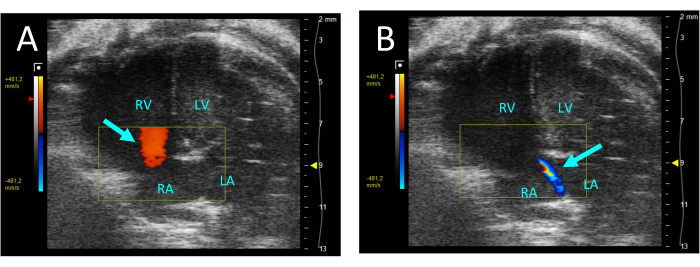
图 5:在 A4CH 视图中通过彩色多普勒可视化的三尖瓣反流。 (A) 在舒张期,观察到从 RA 到 RV 的血流(箭头)。(B) 在收缩期,可以看到从 RV 到 RA 的细流射流(箭头)。缩写:LV:左心室,RV:右心室,RA:右心房,LA:左心房。 请单击此处查看此图的较大版本。
6. 数据分析
- 在 PLAX 中测量三个心动周期中的肺干直径,并使用平均肺干直径进行进一步的数据分析。在 PLAX 中测量三个存储的电影环(在肺干中心和血管壁附近)中每个心动周期中的 VTI。使用所有 VTI 测量值的平均 VTI 进行进一步分析。使用以下公式计算 CO:
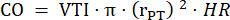
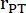 :肺干半径,HR:心率
:肺干半径,HR:心率 - 在中部水平测量 PSAX 中的 LVEI。使用测量工具测量从隔膜中部到自由壁的最大 LV 内径 (LVid1)。然后,测量与第一次测量 (LVid2) 正交的 LV 内径。在 3 个心动周期中重复这些测量,并使用平均 LV 内径和以下公式计算 LVEI:
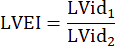
- 在 A4CH 视图中测量三个心动周期中的 TAPSE,并使用平均 TAPSE 进行进一步的数据分析。
7. 右心导管插入术
- PTB 手术后 3 周,用 1.4F 微尖导管插入右心导管测量右心室 (RV) 压力和容量。
- 如步骤 3.1-3.4 中所述麻醉和插管小鼠。将鼠标放在有盖的加热垫 (37 °C) 上并保持麻醉(3.5% 七氟烷在 0.6 L/min 100% 氧气中)。
- 施用 2000 IU 肝素(肌内注射 [i.m.])和 0.5 mL NaCl(皮下注射 [s.c.])。
- 使用手术剪刀,在剑突的尾部切开腹壁,并沿着胸壁切口小心地切割横膈膜,从而进入胸腔。切开横膈膜和肋骨,直到获得足够的心脏通路。
- 在下腔静脉周围放置结扎线。使用它来封闭容器以减少预载荷,以便稍后在方案中记录压力-体积测量值。
- 使用 26G 针头小心地在 RV 上戳一个小孔。确保它尽可能靠近心尖,并且针头不会完全穿透心室,而只是作为插入电导导管的导向。如果发生出血,请用小棉签轻轻按压,以尽量减少失血。
- 识别心室壁上的小孔,并通过穿透组织插入导管。
注意:插入导管时,注意不要损坏心室内壁。 - 插入导管后几分钟内通常会观察到右心室压力 (RVP) 的变化。等到 RVP 稳定下来,以获得具有代表性的稳态测量值。
- 要获得压力容积环,请使用先前放置在下腔静脉周围的结扎线。小心地拉动结扎线以封闭血管,从而逐渐减少预负荷。
- 一旦记录了具有代表性的压力 - 体积环,提取导管,并通过切除心脏对小鼠实施安乐死。此时,采集血液和组织样本进行进一步分析。
结果
将 C57BL/6N 小鼠 (雄性,5 周龄,17-20 g) 随机分配到重度 PTB (sPTB, 250 μm, n = 12) 、轻度 PTB (mPTB, 450 μm, n = 9) 或假手术 (假手术, n = 15)。术后 1 周和 3 周通过超声心动图评估心功能。术后 3 周进行右心导管插入术和随后的安乐死。称量器官,并准备心脏组织进行组织学分析。
术后 1 周超声心动图显示,与 mPTB 和假手术组相比,sPTB 有 RV 压力升高和 RV 功能障碍的?...
讨论
在本文中,我们提出了一个压力超负荷诱导的 RV 肥大和衰竭的小鼠模型。我们证明:(i) 幼年小鼠的 PTB 可以诱导不同程度的 RV 病理,范围从轻度 RV 肥大到伴有心外失代偿体征和组织学证实的 RV 纤维化的 RV 衰竭。(ii) 在 PTB 手术后 1 周和 3 周,可以通过超声心动图观察和量化 RV 功能障碍的迹象。(iii) RV 肥大的程度与 PTB 的严重程度和由此产生的 RV 压力增加成正比。该模型可能有助于阐明?...
披露声明
作者没有什么可披露的。
致谢
这项工作得到了 Snedkermester Sophus Jacobsen og Hustru Astrid Jacobsens Fond, Helge Peetz og Verner Peetz og hustru Vilma Peetz Legat, Grosserer A.V. Lykfeldt og Hustrus Legat 的支持。此外,作者要感谢奥胡斯大学临床医学系动物设施的工作人员在实验工作执行过程中提供的支持。
材料
| Name | Company | Catalog Number | Comments |
| Biosyn 6-0, monofilament, absorbable suture | Covidien | UM-986 | |
| Blunt cannula, 27G 0.4x0.25, | Sterican | 292832 | |
| Bupaq Multidose vet 0,3 mg/ml (Buprenorphinum) | Salfarm Danmark | VNR 472318 | |
| C57BL/6NTac mice | Taconic Biosciences | C57BL/6NTac | |
| Dagrofil 1, braided, non-absorbable suture | B Braun | C0842273 | |
| Depilatory cream | Veet | 3132000 | |
| Disinfection Swabs (82% Ethanol + 0.5% Chlorhexidine) | Mediq | 3340122 | |
| Disposable scalpels, size 11 | Swann-Morton | 11708353 | |
| Dräger Vapor 2000 Sevoflurane | Dräger | M35054 | |
| Eye oinment neutral, "Ophta" | Actavis | MTnr.: 07586 Vnr: 53 96 68 | |
| Horizon ligating clips | Teleflex Medical | 5200 (IPN914931) | |
| Horizon Open Ligating Clips applier, curved, 6" (15 cm) | Teleflex Medical | 537061 | |
| Kitchen roll holder | n.a. | n.a. | |
| Metal wire of different thickness | n.a. | n.a. | |
| Microsurgical instruments set | Thompson | n.a. | |
| MiniVent Ventilator | Hugo Sachs | Type 845 | |
| MS505S transducer | Visual sonics | n.a. | |
| Rimadyl Bovis vet. 50 mg/ml (Carprofen) | Zoetis | MTnr: 34547, Vnr: 10 27 99, | |
| Sevoflurane Baxter 100 % | Baxter Medical | MTnr: 35015 | |
| Silicone tubing | n.a. | n.a. | |
| Soft plastic sheet | n.a. | n.a. | |
| Stereomicroscope, "Opmi Pico" | Carl Zeiss Surgicals GmbH | n.a. | |
| Ultrasonic probe holder/rail | Visual Sonics | 11277 | |
| Varming plate | Visual sonics | 11437 | |
| Venflon ProSafety, 22G, 0,9 x 25mm | Becton Dickinson | 393222 |
参考文献
- Voelkel, N. F., et al. Right ventricular function and failure: Report of a national heart, lung, and blood institute working group on cellular and molecular mechanisms of right heart failure. Circulation. 114 (17), 1883-1891 (2006).
- Haddad, F., Doyle, R., Murphy, D. J., Hunt, S. A. Right ventricular function in cardiovascular disease, part ii: Pathophysiology, clinical importance, and management of right ventricular failure. Circulation. 117 (13), 1717-1731 (2008).
- Van De Veerdonk, M. C., et al. Progressive right ventricular dysfunction in patients with pulmonary arterial hypertension responding to therapy. J Am Coll Cardiol. 58 (24), 2511-2519 (2011).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: Problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: The evolution of animal models in pulmonary hypertension research; are we there yet. Pulm Circ. 3 (4), 739-756 (2013).
- Andersen, A., et al. Animal models of right heart failure. Cardiovasc Diagn Ther. 10 (5), 1561-1579 (2020).
- Voelkel, N. F., Tuder, R. M. Hypoxia-induced pulmonary vascular remodeling: A model for what human disease. J Clin Invest. 106 (6), 733-738 (2000).
- Rabinovitch, M., Gamble, W., Nadas, A. S., Miettinen, O. S., Reid, L. Rat pulmonary circulation after chronic hypoxia: Hemodynamic and structural features. Am J Physiol. 236 (6), H818-H827 (1979).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. Faseb j. 15 (2), 427-438 (2001).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. Am J Respir Crit Care Med. 184 (10), 1171-1182 (2011).
- Nicolls, M. R., et al. New models of pulmonary hypertension based on VEGF receptor blockade-induced endothelial cell apoptosis. Pulm Circ. 2 (4), 434-442 (2012).
- Hessel, M. H., Steendijk, P., Den Adel, B., Schutte, C. I., Van Der Laarse, A. Characterization of right ventricular function after monocrotaline-induced pulmonary hypertension in the intact rat. Am J Physiol Heart Circ Physiol. 291 (5), H2424-H2430 (2006).
- Gomez-Arroyo, J. G., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Janssen, W., et al. 5-ht2b receptor antagonists inhibit fibrosis and protect from RV heart failure. Biomed Res Int. 2015, 438403 (2015).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050 (2018).
- Axelsen, J. B., et al. Effects of 6-mercaptopurine in pressure overload induced right heart failure. PLoS One. 14 (11), e0225122 (2019).
- Egemnazarov, B., et al. Pressure overload creates right ventricular diastolic dysfunction in a mouse model: Assessment by echocardiography. J Am Soc Echocardiogr. 28 (7), 828-843 (2015).
- Wang, Q., et al. Induction of right ventricular failure by pulmonary artery constriction and evaluation of right ventricular function in mice. J Vis Exp. (147), e59431 (2019).
- Kojonazarov, B., et al. The peroxisome proliferator-activated receptor β/δ agonist gw0742 has direct protective effects on right heart hypertrophy. Pulm Circ. 3 (4), 926-935 (2013).
- Kojonazarov, B., et al. P38 MAPK inhibition improves heart function in pressure-loaded right ventricular hypertrophy. Am J Respir Cell Mol Biol. 57 (5), 603-614 (2017).
- Rai, N., et al. Effect of Riociguat and Sildenafil on right heart remodeling and function in pressure overload induced model of pulmonary arterial banding. Biomed Res Int. 2018, 3293584 (2018).
- Sydykov, A., et al. Genetic deficiency and pharmacological stabilization of mast cells ameliorate pressure overload-induced maladaptive right ventricular remodeling in mice. Int J Mol Sci. 21 (23), 9099 (2020).
- Andersen, S., et al. Effects of combined angiotensin ii receptor antagonism and neprilysin inhibition in experimental pulmonary hypertension and right ventricular failure. Int J Cardiol. 293, 203-210 (2019).
- Andersen, S., et al. Pressure overload induced right ventricular remodeling is not attenuated by the anti-fibrotic agent pirfenidone. Pulm Circ. 9 (2), 2045894019848659 (2019).
- Labazi, H., et al. Sex-dependent changes in right ventricular gene expression in response to pressure overload in a rat model of pulmonary trunk banding. Biomedicines. 8 (10), 430 (2020).
- Sun, X. Q., et al. Increased mao-a activity promotes progression of pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 64 (3), 331-343 (2021).
- Axelsen, J. S., et al. Effects of Empagliflozin on right ventricular adaptation to pressure overload. Front Cardiovasc Med. 10, 1302265 (2023).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660 (2023).
- Boehm, M., et al. Delineating the molecular and histological events that govern right ventricular recovery using a novel mouse model of pulmonary artery de-banding. Cardiovasc Res. 116 (10), 1700-1709 (2020).
- Andersen, S., et al. Effects of bisoprolol and losartan treatment in the hypertrophic and failing right heart. J Card Fail. 20 (11), 864-873 (2014).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210 (2015).
- Vildbrad, M. D., et al. Limitations and pitfalls in measurements of right ventricular stroke volume in an animal model of right heart failure. Physiol Meas. 36 (5), 925-937 (2015).
- Boehm, M., et al. Maintained right ventricular pressure overload induces ventricular-arterial decoupling in mice. Exp Physiol. 102 (2), 180-189 (2017).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041 (2014).
- Luitel, H., et al. Pressure overload leads to an increased accumulation and activity of mast cells in the right ventricle. Physiol Rep. 5 (6), e13146 (2017).
- Mamazhakypov, A., et al. Novel therapeutic targets for the treatment of right ventricular remodeling: Insights from the pulmonary artery banding model. Int J Environ Res Public Health. 18 (16), 8297 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。