Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un modèle murin d’hypertrophie ventriculaire droite induite par une surcharge de pression et d’échec par bande du tronc pulmonaire
Dans cet article
Résumé
Nous décrivons un modèle murin de surcharge de pression ventriculaire droite induite par l’anneau du tronc pulmonaire. Des protocoles détaillés pour l’intubation, la chirurgie et le phénotypage par échocardiographie sont inclus dans l’article. Des instruments sur mesure sont utilisés pour l’intubation et la chirurgie, ce qui permet une reproduction rapide et peu coûteuse du modèle.
Résumé
L’insuffisance ventriculaire droite (VD) causée par une surcharge de pression est fortement associée à la morbidité et à la mortalité dans un certain nombre de maladies cardiovasculaires et pulmonaires. La pathogenèse de l’échec du rotavirus est complexe et reste mal comprise. Pour identifier de nouvelles stratégies thérapeutiques pour le traitement de l’échec du rotavirus, des modèles animaux robustes et reproductibles sont essentiels. Les modèles de cerclage du tronc pulmonaire (PTB) ont gagné en popularité, car la fonction du VD peut être évaluée indépendamment des changements dans le système vasculaire pulmonaire.
Dans cet article, nous présentons un modèle murin de surcharge de pression du VD induite par la PTB chez des souris âgées de 5 semaines. Le modèle peut être utilisé pour induire différents degrés de pathologie du rotavirus, allant d’une légère hypertrophie du rotavirus à une défaillance décompensée du rotavirus. Des protocoles détaillés pour l’intubation, la chirurgie PTB et le phénotypage par échocardiographie sont inclus dans l’article. De plus, des instructions pour personnaliser les instruments d’intubation et de chirurgie PTB sont données, ce qui permet une reproduction rapide et peu coûteuse du modèle PTB.
Des clips de ligature en titane ont été utilisés pour resserrer le tronc pulmonaire, assurant un degré de constriction du tronc pulmonaire hautement reproductible et indépendant de l’opérateur. La gravité de la PTB a été évaluée à l’aide de différents diamètres de clips de ligature intérieurs (légère : 450 μm et sévère : 250 μm). Cela a entraîné une pathologie du rotavirus allant de l’hypertrophie avec fonction du rotavirus préservée à l’échec décompensé du rotavirus avec réduction du débit cardiaque et manifestations extracardiaques. La fonction du rotavirus a été évaluée par échocardiographie à 1 semaine et 3 semaines après la chirurgie. Des exemples d’images et de résultats échocardiographiques sont présentés ici. De plus, les résultats du cathétérisme cardiaque droit et des analyses histologiques du tissu cardiaque sont présentés.
Introduction
L’insuffisance ventriculaire droite (VD) est un syndrome clinique avec des symptômes d’insuffisance cardiaque et des signes de congestion systémique résultant d’un dysfonctionnement du VD1. Le dysfonctionnement du rotavirus est fortement associé à la morbidité et à la mortalité dans un certain nombre de maladies cardiovasculaires et pulmonaires2. L’étiologie du dysfonctionnement du rotavirus est complexe, et ses voies de signalisation et sa régulation sous-jacentes restent insuffisamment élucidées.
Les observations des thérapies actuelles montrent que l’amélioration de la fonction VD est étroitement corrélée à la réduction de la postcharge, suggérant que le système vasculaire pulmonaire est la cible principale du traitement3. Cela indique que les thérapies actuelles n’ont qu’un effet direct minime sur la fonction du rotavirus, qui peut se détériorer même après l’amélioration de la résistance vasculaire pulmonaire3. Des recherches supplémentaires sur l’amélioration de la fonction du VR indépendamment de la réduction de la postcharge sont donc hautement nécessaires.
Des modèles animaux robustes et reproductibles sont essentiels dans la recherche de nouveaux agents thérapeutiques. Dans la plupart des modèles d’échec chronique du rotavirus, la cause sous-jacente est l’hypertension pulmonaire induite par une altération structurelle du système vasculaire pulmonaire 4,5,6. Les modèles bien caractérisés comprennent le modèle d’hypoxie chronique 7,8, le modèle d’hypoxie de Sugen 9,10,11 et le modèle monocrotaline12,13. Étant donné que l’échec du VD est secondaire à l’hypertension pulmonaire dans ces modèles, il est impossible de différencier les effets des interventions sur le système vasculaire pulmonaire des effets directs sur le VD6.
Pour étudier le VD indépendamment du système vasculaire pulmonaire, le modèle de bande du tronc pulmonaire (PTB) a gagné en popularité et a été décrit chez plusieurs espèces animales, notamment les souris, les rats, les lapins, les chiens, les moutons et les porcs 6,14,15,16,17,18,19,20,21,22,23, 24,25,26,27. Dans les modèles PTB, la constriction du tronc pulmonaire est réalisée chirurgicalement, provoquant une augmentation de la pression RV6. Il existe différentes approches de l’application du PTB, y compris la constriction du vaisseau avec une ligature ou avec une pince de ligature métallique18,28. Dans les modèles utilisant des ligatures, le tronc pulmonaire est attaché à une aiguille et l’aiguille est rétractée, laissant la ligature en place. Il en résulte une constriction du vaisseau qui dépend de la taille de l’aiguille et de la tension du nœud 18,29. Dans les modèles utilisant des clips de ligature métalliques, le degré de constriction du tronc pulmonaire peut être plus reproductible. Des applicateurs de clips de ligature modifiés sont utilisés pour fermer les clips de ligature à un diamètre prédéfini et constant. Cela rend la méthode indépendante de l’opérateur et réduit la variabilité liée à la PTB dans le phénotype 15,27,28 de la maladie.
Il a été démontré que les modèles murins de PTB induisent une hypertrophie et une défaillance du rotavirus18,28. L’un des principaux défis de l’utilisation du modèle PTB est de choisir le diamètre PTB approprié pour atteindre le degré souhaité de pathologie du rotavirus. Ceci est particulièrement difficile lorsque l’on tente de modéliser une défaillance décompensée du VR. Pour cela, la constriction doit être suffisamment serrée pour induire une insuffisance chronique du rotavirus sans entraîner une défaillance aiguë du rotavirus et la mort peu de temps après la chirurgie6. Une approche pour résoudre ce problème consiste à utiliser des animaux sevrés ou juvéniles 6,15. Un modèle PTB a été utilisé avec succès pour étudier différents stades de défaillance du VD en utilisant des rats sevrés Wistar15,30. Pour y parvenir, des rats juvéniles ayant un potentiel de croissance restant ont subi une chirurgie PTB avec l’application de clips de ligature en titane. Lorsque les rats ont grandi, la sténose pulmonaire s’est progressivement aggravée et a entraîné une hypertrophie du rotavirus ou une insuffisance chronique du rotavirus, en fonction de la gravité de la PTB15,30. Inspirés par ce modèle, nous avons émis l’hypothèse que différents stades de la pathologie du rotavirus pourraient être produits dans un modèle murin de PTB utilisant des souris juvéniles. L’étude d’un large éventail de pathologies du rotavirus, allant d’une maladie légère à une maladie grave, pourrait aider à mieux comprendre la progression de la maladie et la transition de l’hypertrophie du rotavirus à l’échec du rotavirus.
Ici, nous présentons un modèle murin de surcharge de pression VD induite par la PTB chez des souris juvéniles. Avec ce modèle, différents degrés de pathologie du rotavirus peuvent être produits, allant de l’hypertrophie du rotavirus à l’échec décompensé du rotavirus. Cette étude comprend des protocoles détaillés pour l’intubation, la chirurgie PTB et le phénotypage par échocardiographie.
Protocole
L’étude a été approuvée par l’Inspection danoise de l’expérimentation animale (numéro d’autorisation : 2021-15-0201-00928) et a été réalisée conformément à la législation nationale sur les animaux de laboratoire. Cette étude a utilisé des souris C57BL/6N mâles âgées de 5 semaines.
1. Personnalisation des instruments pour l’intubation et la chirurgie (Figure 1)
REMARQUE : Cette section détaille les étapes les plus importantes dans la préparation d’instruments sur mesure pour l’intubation et la chirurgie PTB à partir de matériaux peu coûteux et facilement disponibles.
- Préparez la sonde endotrachéale (Figure 1A).
Les cathéters intraveineux (IV) courants peuvent être utilisés pour l’intubation et la ventilation des souris.- Choisissez la taille appropriée du cathéter intravasculaire correspondant à la taille des souris. Un cathéter 22G est recommandé pour les souris de 5 semaines (17-20 g) et un cathéter 23G pour les souris plus grosses (>20 g).
- Retirez l’aiguille et détachez le mécanisme de verrouillage. Réinsérez l’aiguille dans le cathéter et coupez la pointe de l’aiguille à un angle de 45°, à environ 2 mm de la pointe du cathéter.
- Utilisez du papier de verre pour émousser la pointe afin d’éviter de blesser les cordes vocales des souris.
- Coupez une aile du cathéter pour une meilleure vue pendant l’intubation.
- Préparez l’écarteur thoracique (Figure 1B).
- À l’aide d’un porte-aiguille, pliez un morceau de fil métallique flexible d’environ 10 cm au milieu à un angle de 30°.
- Utilisez le porte-aiguille pour créer avec soin des crochets atraumatiques de 5 mm de large aux deux extrémités du fil.
- Préparez le support d’intubation (Figure 1C).
REMARQUE : L’utilisation d’un support d’intubation permet une administration continue de l’anesthésie via un tube nasal pendant l’intubation. Cela permet une intubation contrôlée et sûre sous guidage visuel, ce qui réduit le risque de blessure aux cordes vocales et à la trachée ainsi que le risque de mauvais positionnement du tube dans l’œsophage. N’importe quel cadre en métal ou en plastique peut être utilisé comme cadre pour le support d’intubation. Un porte-rôle de cuisine légèrement courbé a été utilisé dans cette étude.- Découpez un morceau de tube en caoutchouc de 3 cm qui s’adapte au museau d’une souris et connectez-le à une valve de cathéter IV. L’anesthésie par inhalation peut être connectée via la valve avant l’intubation.
- Faites une boucle à l’aide d’une suture tressée 1-0 à environ 5 mm de l’ouverture du tube. Cela sera utilisé pour fixer le museau de la souris dans le tube.
- Découpez un trou près du haut d’une feuille de plastique flexible et placez le tube dans le trou. La feuille sert à soutenir la souris dans le support d’intubation.
- Utilisez du ruban adhésif pour maintenir les différentes pièces ensemble, comme illustré à la Figure 1C.
- Préparez la canule de guidage (Figure 1D, E).
- Tirez une suture monofilament 6-0 à travers une canule émoussée de 27G et faites un nœud sur la suture. Utilisez ce nœud plus tard pour saisir la suture lors de la chirurgie PTB.
- À l’aide d’un porte-aiguille, pliez l’extrémité de la canule à un angle de 80°.
- Préparez l’applicateur de clip de ligature.
REMARQUE : Un applicateur de clip de ligature avec des mâchoires inclinées est modifié à l’aide d’un mécanisme d’arrêt réglable (Figure 1F), qui arrête la compression du clip de ligature lorsque les mâchoires se trouvent à une distance prédéterminée avec précision les unes des autres. L’applicateur de clip de ligature modifié est utilisé pour l’application de clips de ligature en titane sur le tronc pulmonaire.- Fixez un morceau de laiton coupé sur mesure aux poignées de l’applicateur de clip de ligature à l’aide de deux vis. Montez une vis réglable au centre (Figure 1F, flèche blanche) qui détermine la distance exacte entre les poignées compressées de l’applicateur de clip de ligature, qui correspond à une distance précise entre les mâchoires.

Figure 1 : Instruments pour l’intubation et la chirurgie de la TBP. (A) Sonde endotrachéale fabriquée à partir d’un cathéter IV. (B) Écarteur thoracique. (C) Support d’intubation et souris placée dans le support d’intubation recevant une anesthésie sur un tube nasal. (D) Instruments chirurgicaux et applicateur de clip de ligature modifié utilisés pour la chirurgie PTB. (E) Canule de guidage. (F) Mécanisme d’arrêt réglable sur mesure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Réglage de l’applicateur de clip de ligature
- Choisissez le diamètre interne du clip de ligature en fonction de la gravité souhaitée de la défaillance du VD. Pour les souris mâles C57BL/6N de 5 semaines (17-20 g), utilisez un diamètre de clip de 250 μm pour les surcharges sévères et de 450 μm pour les surcharges de pression RV légères. Utilisez des diamètres de clip intermédiaires pour induire une surcharge de pression modérée.
- Utilisez du fil métallique ou des aiguilles pour ajuster l’applicateur de clip de ligature. Assurez-vous que le diamètre du fil correspond au diamètre de clip souhaité.
- Chargez l’applicateur de clip avec un clip de ligature et placez le fil de réglage au centre du clip de ligature. Tout en comprimant l’applicateur de clip, tournez la vis jusqu’à ce que les mâchoires du clip s’emboîtent fermement autour du fil. Assurez-vous que le clip reste en place sur le fil de réglage une fois que l’applicateur de clip est relâché.
- Avec l’applicateur de clip ajusté, placez un autre clip de ligature sur le fil de réglage pour valider le diamètre réglé.
3. Préparations à la chirurgie
- Induire l’anesthésie dans une chambre d’induction en utilisant du sévoflurane à 7 % dans 0,6 L/min 100 % d’oxygène. Confirmez une anesthésie suffisante par pincement des orteils avant l’intubation.
REMARQUE : L’isoflurane peut également être utilisé. Sachez que des concentrations différentes doivent être utilisées. - Intubez la souris avec un cathéter IV 22G. Effectuer l’intubation sous guidage visuel, à l’aide d’un microscope chirurgical et d’un support d’intubation, permettant un alignement correct pour la visualisation des cordes vocales et l’administration continue d’anesthésiques inhalés sur un tube nasal (figure 1C).
- Aérer la souris à 175 coups/min et un volume courant de 300 μL/coup.
REMARQUE : Des volumes courants de 8 à 10 μL/g sont également recommandés, et le volume courant idéal dépend des fuites possibles et de l’espace mort dans le système de ventilation. - Placez la souris intubée sur un coussin chauffant couvert (37 °C) et appliquez une pommade hydratante sur les yeux de la souris.
- Maintenir l’anesthésie (3,5 % de sévoflurane dans 0,6 L/min, 100 % d’oxygène) et administrer 0,1 mg/kg de buprénorphine et 5 mg/kg de carprofène par voie sous-cutanée pour l’analgésie périopératoire. Retirez tous les poils de la poitrine à l’aide d’une crème dépilatoire et désinfectez la peau avec des lingettes désinfectantes.
4. Chirurgie PTB
- Faites une incision de 10 mm dans la peau au-dessus du deuxième espace intercostal entre l’angle sternal et la ligne axillaire antérieure gauche. Fendre les muscles pectoraux majeurs et mineurs par dissection contondante.
- Coupez les muscles intercostaux dans le deuxième espace intercostal et disséquez carrément le thymus pour exposer le cœur, le tronc pulmonaire et l’aorte. Placez un écarteur thoracique dans l’espace intercostal pour garder le champ opératoire accessible.
REMARQUE : Une grande prudence doit être utilisée lors de la coupe des muscles intercostaux, car l’artère mammaire interne gauche ne passe que de 1 à 2 mm latéralement du sternum. Une blessure à cette artère peut entraîner une perte de sang importante. - Séparez le tronc pulmonaire de l’aorte ascendante en retirant brutalement le tissu conjonctif entre les vaisseaux à l’aide d’une pince microscopique. Améliorez davantage l’exposition du tronc pulmonaire en faisant pivoter le bas du corps de la souris (jambe gauche sur jambe droite).
- Passez la canule de guidage à travers le sinus péricardique transversal postérieurement au tronc pulmonaire. À l’aide d’une pince, saisissez le nœud à l’extrémité de la canule de guidage et tirez la suture à travers la canule de guidage. Retirez soigneusement la canule de guidage pendant que la suture reste en place autour du tronc pulmonaire.
- Chargez l’applicateur de clip de ligature et utilisez la suture pour guider le tronc pulmonaire dans les mâchoires du clip de ligature et comprimez le clip. Relâchez la suture immédiatement après la mise en place du clip et observez le remplissage du tronc pulmonaire.
REMARQUE : Une bradycardie peut être observée dans les premières secondes après l’application du clip de ligature. - Placez une suture résorbable monofilament 6-0 autour des deuxième et troisième costae et fermez l’espace intercostal. Évacuez le plus d’air possible de la cavité thoracique en appliquant une légère pression sur la poitrine tout en resserrant la suture.
- Enfin, suturez la peau avec une suture résorbable en monofilament 6-0.
- Effectuez la même procédure, à l’exception de la mise en place du clip de ligature (étape 4.5), lors d’une chirurgie simulée.
5. Échocardiographie
- Après l’induction de l’anesthésie dans une chambre d’induction (1 à 2 min, 6 % de sévoflurane dans 100 % d’oxygène), maintenez l’anesthésie à l’aide d’un tube nasal (3,5 % de sévoflurane dans 100 % d’oxygène). Retirez tous les poils de la poitrine et de l’abdomen à l’aide d’une crème dépilatoire et placez la souris sur un coussin chauffant. Appliquez une pommade hydratante sur les yeux et un gel à ultrasons sur la poitrine de la souris.
REMARQUE : Ajustez le gain 2D, la profondeur de mise au point et la profondeur d’image pour améliorer la qualité de l’image dans toutes les mesures échocardiographiques. - Ajustez la sonde à ultrasons pour trouver la vue du grand axe parasternal (PLAX) (Figure 2). Dans PLAX, mesurez le diamètre intérieur du tronc pulmonaire et l’intégrale de vitesse dans le tronc pulmonaire.
- Sélectionnez le mode B et déplacez avec précaution le coussin chauffant sur les axes x, y et z pour identifier le tronc pulmonaire au centre de l’image. Utilisez la couleur pour identifier le plus grand diamètre du tronc pulmonaire. Utilisez cine store pour capturer une séquence de mesure du diamètre du tronc pulmonaire.
- Sélectionnez le Doppler de couleur et d’onde de pouls (PW) et placez le curseur au centre du tronc pulmonaire. Ajustez l’angle PW jusqu’à ce que les lignes pointillées soient parallèles au flux sanguin dans le vaisseau.
- Appuyez sur cine store pour mesurer le VTI. Placez le curseur près des deux parois du tronc pulmonaire et appuyez à nouveau sur cine store pour obtenir un écoulement près de la paroi du vaisseau.
REMARQUE : Le diamètre intérieur du ventricule droit (RV) et l’épaisseur de la paroi libre RV peuvent également être évalués dans la vue PLAX.
- Trouvez la vue parasternale sur l’axe court (PSAX) (Figure 3) pour mesurer les diamètres internes du ventricule gauche (VG), ce qui peut être utilisé pour évaluer le renflement septal (configuration D).
- Sélectionnez le mode B et tournez la sonde de 90° dans le sens inverse des aiguilles d’une montre. Inclinez la sonde de 20 à 30 degrés latéralement pour éviter l’ombre du RV par le sternum, et inclinez la sonde de 20 à 30 degrés vers le niveau crânien jusqu’à ce que le ventricule gauche soit aussi rond que possible. Ensuite, faites glisser la sonde dans la direction craniocaudale pour identifier le niveau des muscles papillaires avec les plus grands diamètres ventriculaires et appuyez sur cine store.
REMARQUE : Le PSAX au niveau papillaire moyen peut également être utilisé pour évaluer la variation de la surface fractionnée du VD. Le PSAX au niveau de la valve aortique peut être utilisé pour mesurer le raccourcissement fractionné du RV ou l’épaisseur de la paroi libre du VD.
- Sélectionnez le mode B et tournez la sonde de 90° dans le sens inverse des aiguilles d’une montre. Inclinez la sonde de 20 à 30 degrés latéralement pour éviter l’ombre du RV par le sternum, et inclinez la sonde de 20 à 30 degrés vers le niveau crânien jusqu’à ce que le ventricule gauche soit aussi rond que possible. Ensuite, faites glisser la sonde dans la direction craniocaudale pour identifier le niveau des muscles papillaires avec les plus grands diamètres ventriculaires et appuyez sur cine store.
- Utilisez la vue apicale à 4 chambres (A4CH) (Figure 4) pour mesurer l’excursion systolique du plan annulaire tricuspide (TAPSE) et évaluer la régurgitation tricuspide.
- Positionnez la sonde comme illustré à la Figure 4. Une fois le cœur identifié, faites de petits ajustements à la sonde en utilisant uniquement le poignet et les doigts pour identifier les quatre cavités du cœur et la valve tricuspide.
- Identifier et maintenir une bonne vue A4CH est un défi. Laissez la main qui actionne la sonde reposer sur le coussin chauffant pour plus de stabilité. Faites glisser, inclinez et tournez légèrement la sonde jusqu’à ce que l’image appropriée soit trouvée.
- Ne déplacez la sonde que d’une dimension à la fois : par exemple, faites glisser la sonde craniocaudale pour trouver le cœur, puis inclinez la sonde pour identifier les quatre cavités et enfin tournez la sonde jusqu’à ce que les quatre cavités et la valve tricuspide soient dans le cadre. Si nécessaire, répétez les trois étapes plusieurs fois avant d’obtenir l’image idéale.
- Une fois la valve tricuspide identifiée, sélectionnez le mode M et placez la ligne pointillée dans l’anneau tricuspide de la paroi libre. Appuyez sur cine store pour enregistrer les mesures.
- Sélectionnez la couleur pour évaluer la régurgitation de la valve tricuspide. En cas de régurgitation, un jet de flux rétrograde du VD vers l’oreillette droite (AR) sera observé dans la systole (Figure 5).
REMARQUE : Dans la vue A4CH, le Doppler tissulaire dans la paroi libre du RV et la vitesse d’entrée du RV peuvent également être mesurés.
- Positionnez la sonde comme illustré à la Figure 4. Une fois le cœur identifié, faites de petits ajustements à la sonde en utilisant uniquement le poignet et les doigts pour identifier les quatre cavités du cœur et la valve tricuspide.
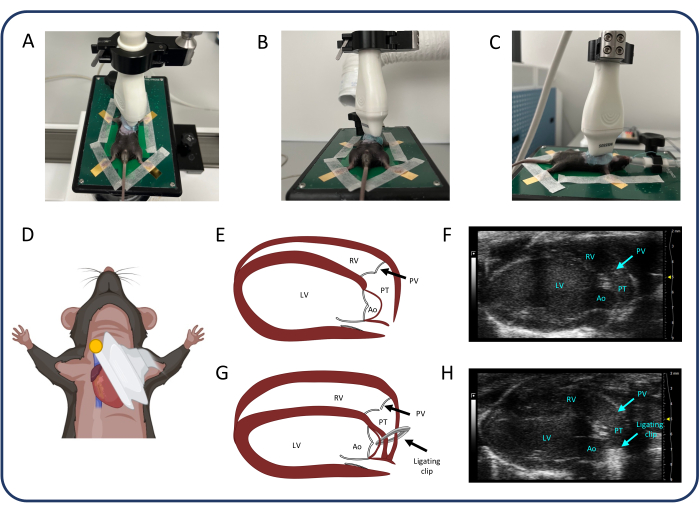
Figure 2 : Vue parasternale grand axe (PLAX). (A-D) Positionnement de la sonde à ultrasons. (E, F) Le cœur murin normal dans PLAX. (G, H) Dilatation et hypertrophie du VD après PTB. Abréviations : LV : ventricule gauche, RV : ventricule droit, PV : valve pulmonaire, PT : tronc pulmonaire, Ao : aorte. Veuillez cliquer ici pour voir une version agrandie de cette figure.
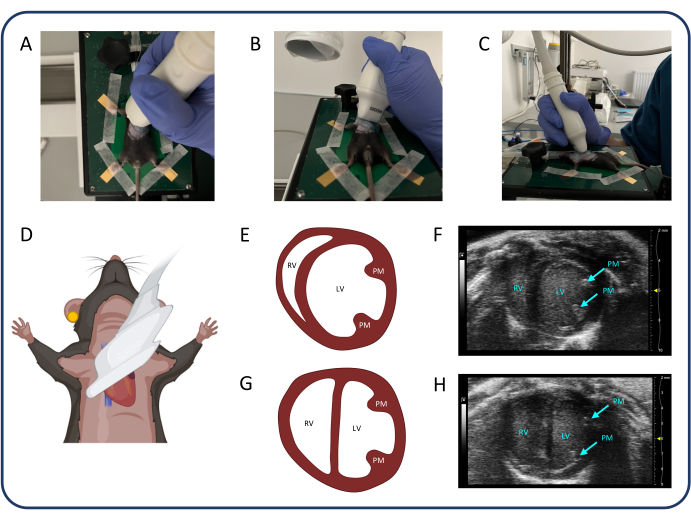
Figure 3 : Vue parasternale sur un petit axe (PSAX). (A-D) Positionnement de la sonde à ultrasons. (E, F) Le cœur murin normal dans PSAX. (G, H) PSAX après PTB. Abréviations : LV : ventricule gauche, RV : ventricule droit, PM : muscle papillaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
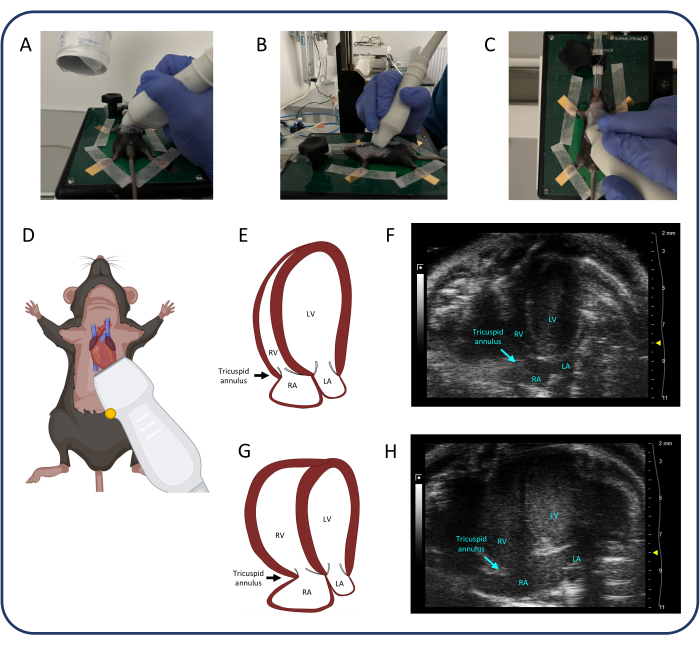
Figure 4 : Vue apicale à 4 chambres (A4CH). (A-D) Positionnement de la sonde à ultrasons. (E, F) Le cœur murin normal dans la vue A4CH. (G, H) Dilatation du VD et de la RA après PTB. Abréviations : VG : ventricule gauche, RV : ventricule droit, RA : oreillette droite, LA : oreillette gauche. Veuillez cliquer ici pour voir une version agrandie de cette figure.
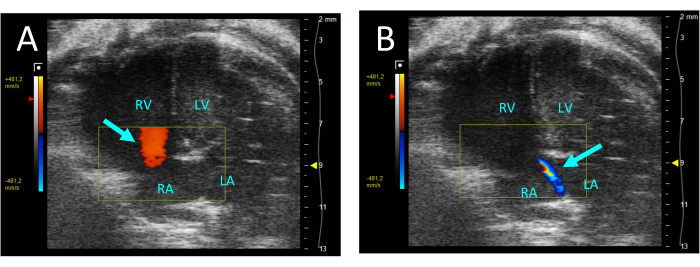
Figure 5 : Régurgitation tricuspide visualisée par Doppler couleur dans la vue A4CH. (A) En diastole, l’écoulement du RA vers le RV est observé (flèche). (B) Pendant la systole, un mince jet d’écoulement du VD vers le RA est visible (flèche). Abréviations : VG : ventricule gauche, RV : ventricule droit, RA : oreillette droite, LA : oreillette gauche. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Analyses de données
- Mesurez le diamètre du tronc pulmonaire en trois cycles cardiaques dans PLAX et utilisez le diamètre moyen du tronc pulmonaire pour d’autres analyses de données. Mesurez l’ITV en trois cycles cardiaques dans PLAX pour chacune des trois boucles ciné stockées (au centre du tronc pulmonaire et près des parois du vaisseau). Utilisez la moyenne VTI de toutes les mesures VTI pour une analyse plus approfondie. Utilisez la formule suivante pour calculer le CO :
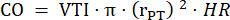
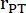 : rayon du tronc pulmonaire, FC : fréquence cardiaque
: rayon du tronc pulmonaire, FC : fréquence cardiaque - Mesurer l’EIVG dans le PSAX au niveau mi-papillaire. À l’aide d’un outil de mesure, mesurez le plus grand diamètre intérieur du VG (LVid1) du milieu du septum à la paroi libre. Ensuite, mesurez le diamètre intérieur du VG orthogonal à la première mesure (LVid2). Répétez ces mesures sur trois cycles cardiaques et calculez l’EIVG à l’aide des diamètres intérieurs moyens du VG et de la formule suivante :
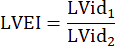
- Mesurez le TAPSE en trois cycles cardiaques dans la vue A4CH et utilisez le TAPSE moyen pour des analyses de données plus approfondies.
7. Cathétérisme du cœur droit
- Mesurez la pression et le volume ventriculaires droits (VD) par cathétérisme cardiaque droit avec un cathéter à micro-embout 1,4F 3 semaines après la chirurgie PTB.
- Anesthésie et intrope la souris comme décrit aux étapes 3.1 à 3.4. Placez la souris sur un coussin chauffant couvert (37 °C) et maintenez l’anesthésie (3,5 % de sévoflurane dans 0,6 L/min, 100 % d’oxygène).
- Administrer 2000 UI d’héparine (intramusculaire [i.m.]) et 0,5 mL de NaCl (sous-cutané [s.c.]).
- À l’aide de ciseaux chirurgicaux, coupez la paroi abdominale juste caudalement à l’apophyse xiphoïde et accédez à la cavité thoracique en coupant soigneusement le diaphragme le long de son incision dans la paroi thoracique. Coupez le diaphragme et les côtes jusqu’à ce qu’un accès suffisant au cœur ait été obtenu.
- Placez une ligature autour de la veine cave inférieure. Utilisez-le pour occlure le récipient afin de réduire la précharge pour l’enregistrement des mesures pression-volume plus tard dans le protocole.
- Utilisez une aiguille 26G pour percer soigneusement un petit trou dans le VD. Assurez-vous qu’il est aussi près que possible de l’apex et que l’aiguille ne pénètre pas entièrement dans le ventricule, mais sert simplement de guide pour l’insertion du cathéter de conductance. En cas de saignement, appliquez une légère pression avec un petit coton-tige pour minimiser la perte de sang.
- Identifiez le petit trou dans la paroi ventriculaire et insérez le cathéter en pénétrant dans le tissu.
REMARQUE : Lors de l’insertion du cathéter, veillez à ne pas endommager la paroi ventriculaire interne. - Des changements de la pression ventriculaire droite (RVP) sont souvent observés pendant plusieurs minutes après l’insertion du cathéter. Attendez que la RVP se stabilise pour obtenir des mesures représentatives à l’état d’équilibre.
- Pour obtenir des boucles pression-volume, utilisez la ligature préalablement placée autour de la veine cave inférieure. Tirez avec précaution sur la ligature pour obstruer le vaisseau, réduisant ainsi progressivement la précharge.
- Une fois que les anses représentatives pression-volume ont été enregistrées, extrayez le cathéter et euthanasiez la souris par excision du cœur. À ce moment, prélevez des échantillons de sang et de tissus pour une analyse plus approfondie.
Résultats
Des souris C57BL/6N (mâles, âgés de 5 semaines, 17-20 g) ont été randomisées pour recevoir soit une TBP sévère (sPTB, 250 μm, n = 12), soit une TBP légère (MBTm, 450 μm, n = 9), soit une chirurgie simulée (TBm, n = 15). L’évaluation de la fonction cardiaque a été réalisée par échocardiographie 1 semaine et 3 semaines après l’intervention. Un cathétérisme cardiaque droit suivi d’une euthanasie a été effectué 3 semaines après l’opération. Les organes ont été pesés et les tissus cardiaq...
Discussion
Dans cet article, nous présentons un modèle murin d’hypertrophie et d’échec du VD induit par une surcharge de pression. Nous démontrons que : (i) la PTB chez les souris juvéniles peut induire divers degrés de pathologie du rotavirus, allant d’une légère hypertrophie du rotavirus à une défaillance du rotavirus avec des signes extracardiaques de décompensation et une fibrose du rotavirus histologiquement confirmée. (ii) Les signes de dysfonctionnement du VD peuvent être observés et quantifiés par écho...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par Snedkermester, Sophus Jacobsen og Hustru, Astrid Jacobsens Fond, Helge Peetz og Verner, Peetz og hustru, Vilma Peetz Legat, Grosserer A.V. Lykfeldt og Hustrus Legat. En outre, les auteurs tiennent à remercier le personnel des animaleries du Département de médecine clinique de l’Université d’Aarhus pour leur soutien lors de l’exécution des travaux expérimentaux.
matériels
| Name | Company | Catalog Number | Comments |
| Biosyn 6-0, monofilament, absorbable suture | Covidien | UM-986 | |
| Blunt cannula, 27G 0.4x0.25, | Sterican | 292832 | |
| Bupaq Multidose vet 0,3 mg/ml (Buprenorphinum) | Salfarm Danmark | VNR 472318 | |
| C57BL/6NTac mice | Taconic Biosciences | C57BL/6NTac | |
| Dagrofil 1, braided, non-absorbable suture | B Braun | C0842273 | |
| Depilatory cream | Veet | 3132000 | |
| Disinfection Swabs (82% Ethanol + 0.5% Chlorhexidine) | Mediq | 3340122 | |
| Disposable scalpels, size 11 | Swann-Morton | 11708353 | |
| Dräger Vapor 2000 Sevoflurane | Dräger | M35054 | |
| Eye oinment neutral, "Ophta" | Actavis | MTnr.: 07586 Vnr: 53 96 68 | |
| Horizon ligating clips | Teleflex Medical | 5200 (IPN914931) | |
| Horizon Open Ligating Clips applier, curved, 6" (15 cm) | Teleflex Medical | 537061 | |
| Kitchen roll holder | n.a. | n.a. | |
| Metal wire of different thickness | n.a. | n.a. | |
| Microsurgical instruments set | Thompson | n.a. | |
| MiniVent Ventilator | Hugo Sachs | Type 845 | |
| MS505S transducer | Visual sonics | n.a. | |
| Rimadyl Bovis vet. 50 mg/ml (Carprofen) | Zoetis | MTnr: 34547, Vnr: 10 27 99, | |
| Sevoflurane Baxter 100 % | Baxter Medical | MTnr: 35015 | |
| Silicone tubing | n.a. | n.a. | |
| Soft plastic sheet | n.a. | n.a. | |
| Stereomicroscope, "Opmi Pico" | Carl Zeiss Surgicals GmbH | n.a. | |
| Ultrasonic probe holder/rail | Visual Sonics | 11277 | |
| Varming plate | Visual sonics | 11437 | |
| Venflon ProSafety, 22G, 0,9 x 25mm | Becton Dickinson | 393222 |
Références
- Voelkel, N. F., et al. Right ventricular function and failure: Report of a national heart, lung, and blood institute working group on cellular and molecular mechanisms of right heart failure. Circulation. 114 (17), 1883-1891 (2006).
- Haddad, F., Doyle, R., Murphy, D. J., Hunt, S. A. Right ventricular function in cardiovascular disease, part ii: Pathophysiology, clinical importance, and management of right ventricular failure. Circulation. 117 (13), 1717-1731 (2008).
- Van De Veerdonk, M. C., et al. Progressive right ventricular dysfunction in patients with pulmonary arterial hypertension responding to therapy. J Am Coll Cardiol. 58 (24), 2511-2519 (2011).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: Problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: The evolution of animal models in pulmonary hypertension research; are we there yet. Pulm Circ. 3 (4), 739-756 (2013).
- Andersen, A., et al. Animal models of right heart failure. Cardiovasc Diagn Ther. 10 (5), 1561-1579 (2020).
- Voelkel, N. F., Tuder, R. M. Hypoxia-induced pulmonary vascular remodeling: A model for what human disease. J Clin Invest. 106 (6), 733-738 (2000).
- Rabinovitch, M., Gamble, W., Nadas, A. S., Miettinen, O. S., Reid, L. Rat pulmonary circulation after chronic hypoxia: Hemodynamic and structural features. Am J Physiol. 236 (6), H818-H827 (1979).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. Faseb j. 15 (2), 427-438 (2001).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. Am J Respir Crit Care Med. 184 (10), 1171-1182 (2011).
- Nicolls, M. R., et al. New models of pulmonary hypertension based on VEGF receptor blockade-induced endothelial cell apoptosis. Pulm Circ. 2 (4), 434-442 (2012).
- Hessel, M. H., Steendijk, P., Den Adel, B., Schutte, C. I., Van Der Laarse, A. Characterization of right ventricular function after monocrotaline-induced pulmonary hypertension in the intact rat. Am J Physiol Heart Circ Physiol. 291 (5), H2424-H2430 (2006).
- Gomez-Arroyo, J. G., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Janssen, W., et al. 5-ht2b receptor antagonists inhibit fibrosis and protect from RV heart failure. Biomed Res Int. 2015, 438403 (2015).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050 (2018).
- Axelsen, J. B., et al. Effects of 6-mercaptopurine in pressure overload induced right heart failure. PLoS One. 14 (11), e0225122 (2019).
- Egemnazarov, B., et al. Pressure overload creates right ventricular diastolic dysfunction in a mouse model: Assessment by echocardiography. J Am Soc Echocardiogr. 28 (7), 828-843 (2015).
- Wang, Q., et al. Induction of right ventricular failure by pulmonary artery constriction and evaluation of right ventricular function in mice. J Vis Exp. (147), e59431 (2019).
- Kojonazarov, B., et al. The peroxisome proliferator-activated receptor β/δ agonist gw0742 has direct protective effects on right heart hypertrophy. Pulm Circ. 3 (4), 926-935 (2013).
- Kojonazarov, B., et al. P38 MAPK inhibition improves heart function in pressure-loaded right ventricular hypertrophy. Am J Respir Cell Mol Biol. 57 (5), 603-614 (2017).
- Rai, N., et al. Effect of Riociguat and Sildenafil on right heart remodeling and function in pressure overload induced model of pulmonary arterial banding. Biomed Res Int. 2018, 3293584 (2018).
- Sydykov, A., et al. Genetic deficiency and pharmacological stabilization of mast cells ameliorate pressure overload-induced maladaptive right ventricular remodeling in mice. Int J Mol Sci. 21 (23), 9099 (2020).
- Andersen, S., et al. Effects of combined angiotensin ii receptor antagonism and neprilysin inhibition in experimental pulmonary hypertension and right ventricular failure. Int J Cardiol. 293, 203-210 (2019).
- Andersen, S., et al. Pressure overload induced right ventricular remodeling is not attenuated by the anti-fibrotic agent pirfenidone. Pulm Circ. 9 (2), 2045894019848659 (2019).
- Labazi, H., et al. Sex-dependent changes in right ventricular gene expression in response to pressure overload in a rat model of pulmonary trunk banding. Biomedicines. 8 (10), 430 (2020).
- Sun, X. Q., et al. Increased mao-a activity promotes progression of pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 64 (3), 331-343 (2021).
- Axelsen, J. S., et al. Effects of Empagliflozin on right ventricular adaptation to pressure overload. Front Cardiovasc Med. 10, 1302265 (2023).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660 (2023).
- Boehm, M., et al. Delineating the molecular and histological events that govern right ventricular recovery using a novel mouse model of pulmonary artery de-banding. Cardiovasc Res. 116 (10), 1700-1709 (2020).
- Andersen, S., et al. Effects of bisoprolol and losartan treatment in the hypertrophic and failing right heart. J Card Fail. 20 (11), 864-873 (2014).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210 (2015).
- Vildbrad, M. D., et al. Limitations and pitfalls in measurements of right ventricular stroke volume in an animal model of right heart failure. Physiol Meas. 36 (5), 925-937 (2015).
- Boehm, M., et al. Maintained right ventricular pressure overload induces ventricular-arterial decoupling in mice. Exp Physiol. 102 (2), 180-189 (2017).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041 (2014).
- Luitel, H., et al. Pressure overload leads to an increased accumulation and activity of mast cells in the right ventricle. Physiol Rep. 5 (6), e13146 (2017).
- Mamazhakypov, A., et al. Novel therapeutic targets for the treatment of right ventricular remodeling: Insights from the pulmonary artery banding model. Int J Environ Res Public Health. 18 (16), 8297 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon