É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um modelo murino de hipertrofia ventricular direita induzida por sobrecarga de pressão e falha por bandagem do tronco pulmonar
Neste Artigo
Resumo
Descrevemos um modelo murino de sobrecarga de pressão do ventrículo direito induzida por bandagem do tronco pulmonar. Protocolos detalhados para intubação, cirurgia e fenotipagem por ecocardiografia estão incluídos no artigo. Instrumentos feitos sob medida são usados para intubação e cirurgia, permitindo uma reprodução rápida e barata do modelo.
Resumo
A insuficiência ventricular direita (VD) causada por sobrecarga pressórica está fortemente associada à morbidade e mortalidade em várias doenças cardiovasculares e pulmonares. A patogênese da falha do VD é complexa e permanece inadequadamente compreendida. Para identificar novas estratégias terapêuticas para o tratamento da falência do VD, modelos animais robustos e reprodutíveis são essenciais. Modelos de bandagem do tronco pulmonar (TBP) ganharam popularidade, pois a função do VD pode ser avaliada independentemente de alterações na vasculatura pulmonar.
Neste artigo, apresentamos um modelo murino de sobrecarga de pressão do VD induzida por TBP em camundongos de 5 semanas de idade. O modelo pode ser usado para induzir diferentes graus de patologia do VD, variando de hipertrofia leve do VD a insuficiência descompensada do VD. Protocolos detalhados para intubação, cirurgia de TBP e fenotipagem por ecocardiografia estão incluídos no artigo. Além disso, são fornecidas instruções para personalização de instrumentos para intubação e cirurgia de TBP, permitindo a reprodução rápida e barata do modelo de TBP.
Clipes de ligação de titânio foram usados para contrair o tronco pulmonar, garantindo um grau de constrição do tronco pulmonar altamente reprodutível e independente do operador. A gravidade da TBP foi graduada usando diferentes diâmetros de clipe de ligação interna (leve: 450 μm e grave: 250 μm). Isso resultou em patologia do VD variando de hipertrofia com função preservada do VD a insuficiência descompensada do VD com débito cardíaco reduzido e manifestações extracardíacas. A função do VD foi avaliada por ecocardiografia 1 semana e 3 semanas após a cirurgia. Exemplos de imagens e resultados ecocardiográficos são apresentados aqui. Além disso, são mostrados resultados de cateterismo cardíaco direito e análises histológicas do tecido cardíaco.
Introdução
A insuficiência ventricular direita (VD) é uma síndrome clínica com sintomas de insuficiência cardíaca e sinais de congestão sistêmica decorrentes da disfunção do VD1. A disfunção do VD está fortemente associada à morbidade e mortalidade em várias doenças cardiovasculares e pulmonares2. A etiologia da disfunção do VE é complexa e suas vias de sinalização e regulação subjacentes permanecem inadequadamente elucidadas.
Observações das terapias atuais mostram que a melhora da função do VD se correlaciona intimamente com a redução da pós-carga, sugerindo a vasculatura pulmonar como o principal alvodo tratamento 3. Isso indica que as terapias atuais têm apenas um efeito direto mínimo na função do VD, que pode se deteriorar mesmo após a melhora da resistência vascular pulmonar3. Mais pesquisas sobre como melhorar a função do VD independentemente da redução da pós-carga são, portanto, altamente necessárias.
Modelos animais robustos e reprodutíveis são essenciais na busca de novos agentes terapêuticos. Na maioria dos modelos de insuficiência crônica do VD, a causa básica é a hipertensão pulmonar induzida por alteração estrutural da vasculatura pulmonar 4,5,6. Modelos bem caracterizados incluem o modelo de hipóxia crônica 7,8, o modelo de hipóxia de Sugen 9,10,11 e o modelo de monocrotalina 12,13. Como a falha do VD é secundária à hipertensão pulmonar nesses modelos, é impossível diferenciar os efeitos das intervenções sobre a vasculatura pulmonar dos efeitos diretos sobre oVD6.
Para estudar o VD independentemente da vasculatura pulmonar, o modelo de bandagem do tronco pulmonar (TBP) ganhou popularidade e foi descrito em várias espécies animais, incluindo camundongos, ratos, coelhos, cães, ovelhas e porcos 6,14,15,16,17,18,19,20,21,22,23, 24,25,26,27. Nos modelos de TBP, a constrição do tronco pulmonar é obtida cirurgicamente, causando um aumento na pressão do VD6. Existem diferentes abordagens para a aplicação da TBP, incluindo a constrição do vaso com uma ligadura ou com um clipe de ligação metálica 18,28. Nos modelos que utilizam ligaduras, o tronco pulmonar é amarrado a uma agulha e a agulha é retraída, deixando a ligadura no lugar. Isso resulta em uma constrição do vaso que depende do tamanho da agulha e da tensão do nó18,29. Em modelos que empregam clipes de ligação metálica, o grau de constrição do tronco pulmonar pode ser mais reprodutível. Os aplicadores de clipe de ligação modificados são usados para fechar os clipes de ligação para um diâmetro predefinido e constante. Isso torna o método independente do operador e reduz a variabilidade relacionada à TBP no fenótipo da doença 15,27,28.
Modelos murinos de TBP demonstraram induzir hipertrofia e falha do VD18,28. Um grande desafio ao usar o modelo PTB é escolher o diâmetro adequado do PTB para atingir o grau desejado de patologia do VD. Isso é especialmente desafiador ao tentar modelar a falha descompensada do VD. Para isso, a constrição precisa ser apertada o suficiente para induzir a insuficiência crônica do VD sem levar à insuficiência aguda do VD e morte logo após a cirurgia6. Uma abordagem para resolver esse desafio é usar animais desmamados ou juvenis 6,15. Um modelo de TBP tem sido usado com sucesso para estudar diferentes estágios de falha do VD usando ratos Wistar desmamados 15,30. Para isso, ratos juvenis com potencial de crescimento remanescente foram submetidos à cirurgia de TBP com aplicação de clipes de ligação de titânio. Quando os ratos cresceram, a estenose pulmonar tornou-se gradualmente mais grave e resultou em hipertrofia do VD ou insuficiência crônica do VD, dependendo da gravidade da TBP15,30. Inspirados por este modelo, levantamos a hipótese de que diferentes estágios da patologia do RV poderiam ser produzidos em um modelo murino de PTB usando camundongos juvenis. O estudo de um amplo espectro de patologia do VD da doença leve à grave pode ajudar a elucidar nossa compreensão da progressão da doença e da transição da hipertrofia do VD para a falha do VD.
Aqui, apresentamos um modelo murino de sobrecarga de pressão do VD induzida por PTB em camundongos juvenis. Com esse modelo, diferentes graus de patologia do VD podem ser produzidos, variando de hipertrofia do VD a insuficiência descompensada do VD. Este estudo inclui protocolos detalhados para intubação, cirurgia de TBP e fenotipagem por ecocardiografia.
Protocolo
O estudo foi aprovado pela Inspeção Dinamarquesa de Experimentos com Animais (número de autorização: 2021-15-0201-00928) e foi realizado de acordo com a legislação nacional de animais de laboratório. Este estudo utilizou camundongos C57BL/6N machos de 5 semanas de idade.
1. Customização de instrumentais para intubação e cirurgia (Figura 1)
NOTA: Esta seção detalha as etapas mais importantes na preparação de instrumentos feitos sob medida para intubação e cirurgia de TBP a partir de materiais baratos e prontamente disponíveis.
- Prepare o tubo endotraqueal (Figura 1A).
Cateteres intravenosos (IV) comuns podem ser usados para intubação e ventilação de camundongos.- Escolha o tamanho apropriado do cateter intravascular correspondente ao tamanho dos camundongos. Um cateter 22G é recomendado para camundongos com 5 semanas de idade (17-20 g) e um cateter 23G para camundongos maiores (>20 g).
- Puxe a agulha e solte o mecanismo de travamento. Insira a agulha de volta no cateter e corte a ponta da agulha em um ângulo de 45°, aproximadamente 2 mm da ponta do cateter.
- Use uma lixa para embotar a ponta para evitar lesões nas cordas vocais dos ratos.
- Corte uma asa do cateter para uma melhor visualização durante a intubação.
- Preparar o afastador torácico (Figura 1B).
- Use um porta-agulha para dobrar um pedaço de fio de metal flexível de aproximadamente 10 cm no meio em um ângulo de 30°.
- Use o porta-agulha para criar cuidadosamente ganchos atraumáticos de 5 mm de largura em ambas as extremidades do fio.
- Prepare o suporte de intubação (Figura 1C).
NOTA: O uso de um suporte de intubação permite a administração contínua de anestesia por meio de um tubo nasal durante a intubação. Isso permite uma intubação controlada e segura sob orientação visual, o que reduz o risco de lesões nas cordas vocais e na traqueia, bem como o risco de deslocamento incorreto do tubo no esôfago. Qualquer estrutura de metal ou plástico pode ser usada como estrutura para o suporte de intubação. Um suporte de papel de cozinha ligeiramente dobrado foi usado neste estudo.- Corte um pedaço de tubo de borracha de 3 cm que se encaixe no focinho de um mouse e conecte-o a uma válvula de cateter intravenoso. A anestesia inalante pode ser conectada através da válvula antes da intubação.
- Faça um laço usando uma sutura trançada 1-0 a aproximadamente 5 mm da abertura do tubo. Isso será usado para prender o focinho murino no tubo.
- Faça um furo perto do topo de uma folha de plástico flexível e coloque o tubo no furo. A folha é usada para apoiar o mouse no suporte de intubação.
- Use fita adesiva para manter as peças individuais juntas, conforme mostrado na Figura 1C.
- Prepare a cânula de orientação (Figura 1D, E).
- Puxe uma sutura de monofilamento 6-0 através de uma cânula 27G romba e dê um nó na sutura. Use este nó mais tarde para agarrar a sutura durante a cirurgia de TBP.
- Use um porta-agulha para dobrar a ponta da cânula em um ângulo de 80°.
- Prepare o aplicador de clipe de ligação.
NOTA: Um aplicador de clipe de ligação com garras angulares é modificado com um mecanismo de parada ajustável (Figura 1F), que interrompe a compressão do clipe de ligação quando as garras estão a uma distância precisamente predeterminada uma da outra. O aplicador de clipe de ligadura modificado é usado para a aplicação de clipes de ligação de titânio no tronco pulmonar.- Fixe um pedaço de latão cortado sob medida nas alças do aplicador de clipe de ligação com dois parafusos. Monte um parafuso ajustável no centro (Figura 1F, seta branca) que determina a distância exata entre as alças comprimidas do aplicador do clipe de ligação, que corresponde a uma distância precisa entre as garras.

Figura 1: Instrumentos para intubação e cirurgia de TBP. (A) Tubo endotraqueal confeccionado a partir de cateter intravenoso. (B) Afastador torácico. (C) Suporte de intubação e camundongo colocado no suporte de intubação recebendo anestesia em um tubo nasal. (D) Instrumentos cirúrgicos e aplicador de clipe de ligadura modificado usados para cirurgia de TBP. (E) Cânula de orientação. (F) Mecanismo de parada ajustável feito sob medida. Clique aqui para ver uma versão maior desta figura.
2. Ajuste do aplicador de clipe de ligação
- Escolha o diâmetro interno do clipe de ligação com base na gravidade desejada da falha do VD. Para camundongos C57BL / 6N machos de 5 semanas de idade (17-20 g), use um diâmetro de clipe de 250 μm para sobrecarga de pressão severa e 450 μm para sobrecarga leve de pressão do VD. Use diâmetros intermediários do clipe para induzir sobrecarga de pressão moderada.
- Use fio de metal ou agulhas para ajustar o aplicador do clipe de ligação. Certifique-se de que o diâmetro do fio corresponda ao diâmetro do clipe desejado.
- Carregue o aplicador de clipe com um clipe de ligação e coloque o fio de ajuste no centro do clipe de ligação. Ao comprimir o aplicador do clipe, gire o parafuso até que as garras do clipe se encaixem firmemente ao redor do fio. Certifique-se de que o clipe permaneça no lugar no fio de ajuste assim que o aplicador do clipe for liberado.
- Com o aplicador de clipe ajustado, coloque outro clipe de ligação no fio de ajuste para validar o diâmetro definido.
3. Preparativos para cirurgia
- Induzir a anestesia em uma câmara de indução usando sevoflurano a 7% em oxigênio a 0,6 L/min a 100%. Confirme a anestesia suficiente com a pinça do dedo do pé antes da intubação.
NOTA: O isoflurano também pode ser usado. Esteja ciente de que diferentes concentrações devem ser usadas. - Intubar o rato com um cateter IV 22G. Realizar a intubação sob orientação visual, utilizando microscópio cirúrgico e suporte de intubação, permitindo o alinhamento adequado para visualização das pregas vocais e administração contínua de anestésicos inalantes em tubo nasal (Figura 1C).
- Ventile o mouse a 175 golpes/min e um volume corrente de 300 μL/curso.
NOTA: Volumes correntes de 8-10 μL/g também são recomendados, e o volume corrente ideal depende de possíveis vazamentos e espaço morto no sistema de ventilação. - Coloque o rato intubado numa almofada de aquecimento coberta (37 °C) e aplique pomada hidratante nos olhos do rato.
- Manter a anestesia (sevoflurano a 3,5% em 0,6 L/min de oxigênio a 100%) e administrar 0,1 mg/kg de buprenorfina e 5 mg/kg de carprofeno por via subcutânea para analgesia perioperatória. Remova todos os pelos do peito com creme depilatório e desinfete a pele com lenços desinfetantes.
4. Cirurgia de TBP
- Faça uma incisão de 10 mm na pele acima do segundo espaço intercostal do ângulo esternal até a linha axilar anterior esquerda. Divida os músculos peitorais maiores e menores por dissecção romba.
- Corte os músculos intercostais no segundo espaço intercostal e disseque o timo sem corte para expor o coração, o tronco pulmonar e a aorta. Coloque um afastador torácico no espaço intercostal para manter o campo cirúrgico acessível.
NOTA: Deve-se ter muito cuidado ao cortar os músculos intercostais, pois a artéria mamária interna esquerda corre apenas 1-2 mm lateralmente ao esterno. A lesão desta artéria pode resultar em perda significativa de sangue. - Separe o tronco pulmonar da aorta ascendente removendo sem rodeios o tecido conjuntivo entre os vasos usando uma pinça microscópica. Melhore ainda mais a exposição do tronco pulmonar girando a parte inferior do corpo do camundongo (perna esquerda sobre a perna direita).
- Passe a cânula guia pelo seio pericárdico transverso posteriormente ao tronco pulmonar. Use uma pinça para segurar o nó na ponta da cânula de orientação e puxe a sutura através da cânula de guia. Remova cuidadosamente a cânula de orientação enquanto a sutura permanece no lugar ao redor do tronco pulmonar.
- Carregue o aplicador do clipe de ligadura e use a sutura para guiar o tronco pulmonar para as mandíbulas do clipe de ligação e comprima o clipe. Solte a sutura imediatamente após a colocação do clipe e observe o enchimento do tronco pulmonar.
NOTA: A bradicardia pode ser observada nos primeiros segundos após a aplicação do clipe de ligadura. - Coloque uma sutura absorvível de monofilamento 6-0 ao redor da segunda e terceira costas e feche o espaço intercostal. Evacue o máximo de ar possível da cavidade torácica aplicando uma leve pressão no tórax enquanto aperta a sutura.
- Por fim, suture a pele com uma sutura absorvível de monofilamento 6-0.
- Realize o mesmo procedimento, exceto para colocar o clipe de ligadura (etapa 4.5), durante a cirurgia simulada.
5. Ecocardiografia
- Após a indução da anestesia em uma câmara de indução (1-2 min, sevoflurano a 6% em oxigênio a 100%), mantenha a anestesia com tubo nasal (sevoflurano a 3,5% em oxigênio a 100%). Remova todos os pelos do peito e do abdômen com creme depilatório e coloque o mouse em uma almofada de aquecimento. Aplique pomada hidratante nos olhos e gel de ultrassom no peito do camundongo.
NOTA: Ajuste o ganho 2D, a profundidade do foco e a profundidade da imagem para melhorar a qualidade da imagem em todas as medições ecocardiográficas. - Ajuste a sonda ultrassônica para encontrar a visão do eixo longo paraesternal (PLAX) (Figura 2). No PLAX, meça o diâmetro interno do tronco pulmonar e a integral velocidade-tempo (VTI) no tronco pulmonar.
- Selecione o modo B e mova cuidadosamente a almofada de aquecimento nos eixos x, y e z para identificar o tronco pulmonar no centro da imagem. Use cores para identificar o maior diâmetro do tronco pulmonar. Use cine store para capturar uma sequência para medição do diâmetro do tronco pulmonar.
- Selecione o Doppler de cor e onda de pulso (PW) e coloque o cursor no centro do tronco pulmonar. Ajuste o ângulo PW até que as linhas pontilhadas fiquem paralelas ao fluxo sanguíneo no vaso.
- Pressione cine store para medir o VTI. Coloque o cursor próximo a ambas as paredes do tronco pulmonar e pressione cine store novamente para adquirir fluxo próximo à parede do vaso.
NOTA: O diâmetro interno do ventrículo direito (VD) e a espessura da parede livre do VD também podem ser avaliados na incidência PLAX.
- Encontre a incidência do eixo curto paraesternal (PSAX) (Figura 3) para medir os diâmetros internos do ventrículo esquerdo (VE), que pode ser usada para avaliar o abaulamento septal (configuração D).
- Selecione o modo B e gire a sonda 90° no sentido anti-horário. Incline a sonda 20-30 graus lateralmente para evitar o sombreamento do VD pelo esterno e incline a sonda 20-30 graus cranialmente até que o ventrículo esquerdo seja o mais redondo possível. Em seguida, deslize a sonda no sentido craniocaudal para identificar o nível dos músculos papilares com os maiores diâmetros ventriculares e pressione o armazenamento de cine.
NOTA: A PSAX no nível da papilar média também pode ser usada para avaliar a alteração da área fracionária do VD. A PSAX no nível da valva aórtica pode ser usada para medir o encurtamento fracionário do VD ou a espessura da parede livre do VD.
- Selecione o modo B e gire a sonda 90° no sentido anti-horário. Incline a sonda 20-30 graus lateralmente para evitar o sombreamento do VD pelo esterno e incline a sonda 20-30 graus cranialmente até que o ventrículo esquerdo seja o mais redondo possível. Em seguida, deslize a sonda no sentido craniocaudal para identificar o nível dos músculos papilares com os maiores diâmetros ventriculares e pressione o armazenamento de cine.
- Use a incidência apical de 4 câmaras (A4CH) (Figura 4) para medir a excursão sistólica do plano do anel tricúspide (TAPSE) e avaliar a regurgitação tricúspide.
- Posicione a sonda conforme mostrado na Figura 4. Uma vez identificado o coração, faça pequenos ajustes na sonda usando apenas o punho e os dedos para identificar todas as quatro câmaras do coração e a válvula tricúspide.
- Identificar e manter uma boa visão A4CH é um desafio. Deixe a mão que opera a sonda descansar na almofada de aquecimento para estabilidade. Deslize, incline e gire a sonda levemente até que a imagem apropriada seja encontrada.
- Mova a sonda apenas em uma dimensão de cada vez: por exemplo, deslize craniocaudal para encontrar o coração, incline a sonda para identificar todas as quatro câmaras e, finalmente, gire a sonda até que todas as quatro câmaras e a válvula tricúspide estejam na estrutura. Se necessário, repita várias vezes os três passos antes de obter a imagem ideal.
- Uma vez identificada a válvula tricúspide, selecione o modo M e coloque a linha pontilhada no anel tricúspide da parede livre. Pressione cine store para salvar as medições.
- Selecione a cor para avaliar a regurgitação da valva tricúspide. Se houver regurgitação, um jato de fluxo retrógrado do VD para o átrio direito (AD) será visto na sístole (Figura 5).
NOTA: Na visão A4CH, o Doppler tecidual na parede livre do VD e a velocidade de entrada do VD também podem ser medidos.
- Posicione a sonda conforme mostrado na Figura 4. Uma vez identificado o coração, faça pequenos ajustes na sonda usando apenas o punho e os dedos para identificar todas as quatro câmaras do coração e a válvula tricúspide.
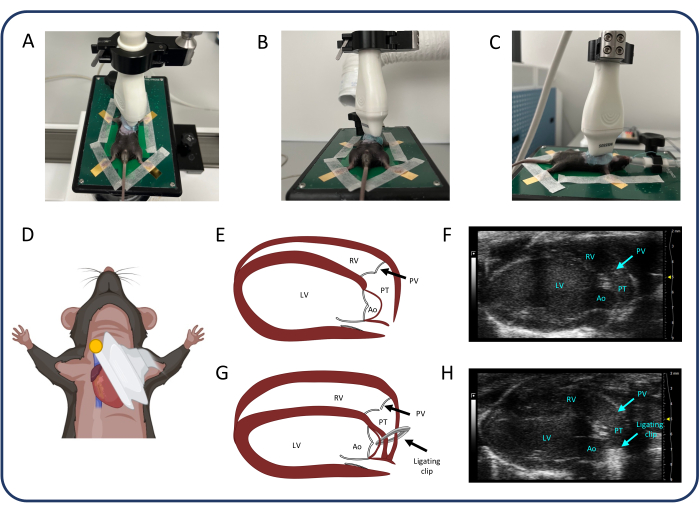
Figura 2: Visão do eixo longo paraesternal (PLAX). (A-D) Posicionamento da sonda ultrassônica. (E, F) O coração murino normal em PLAX. (G, H) Dilatação e hipertrofia do VD após TBP. Abreviaturas: VE: ventrículo esquerdo, VD: ventrículo direito, VP: valva pulmonar, TP: tronco pulmonar, Ao: aorta. Clique aqui para ver uma versão maior desta figura.
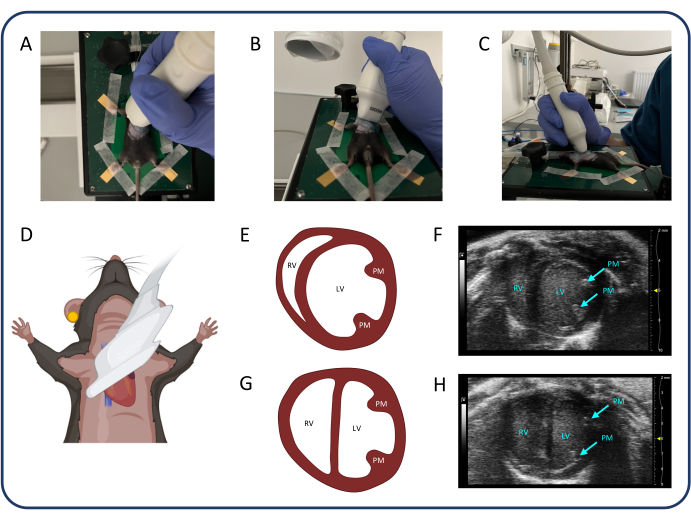
Figura 3: Visão do eixo curto paraesternal (PSAX). (A-D) Posicionamento da sonda ultrassônica. (E, F) O coração murino normal em PSAX. (G, H) PSAX após TBP. Abreviaturas: VE: ventrículo esquerdo, VD: ventrículo direito, PM: músculo papilar. Clique aqui para ver uma versão maior desta figura.
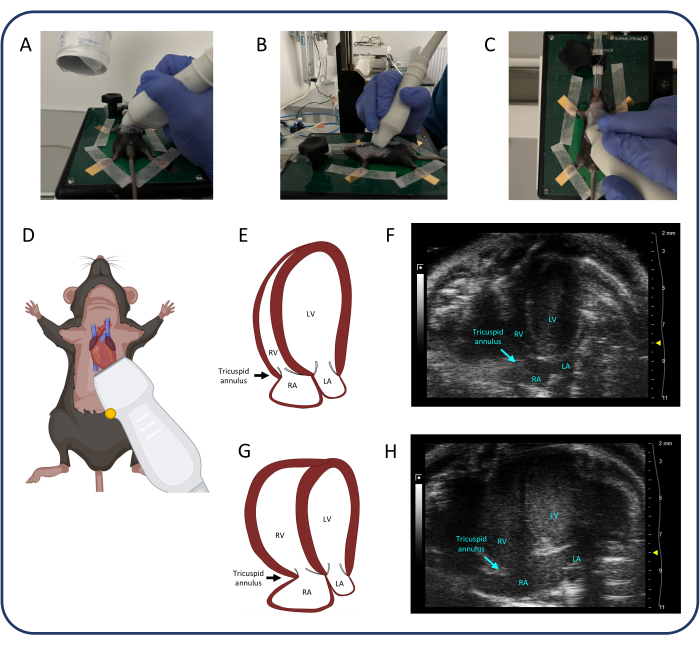
Figura 4: Vista apical de 4 câmaras (A4CH). (A-D) Posicionamento da sonda ultrassônica. (E, F) O coração murino normal na visão A4CH. (G, H) Dilatação do VD e AR após TBP. Abreviaturas: VE: ventrículo esquerdo, VD: ventrículo direito, AD: átrio direito, AE: átrio esquerdo. Clique aqui para ver uma versão maior desta figura.
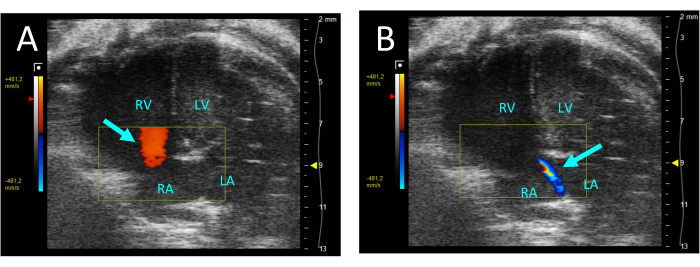
Figura 5: Regurgitação tricúspide visualizada pelo Doppler colorido na incidência A4CH. (A) Na diástole, observa-se fluxo do AD para o VD (seta). (B) Durante a sístole, um fino jato de fluxo do VD para o AD é visível (seta). Abreviaturas: VE: ventrículo esquerdo, VD: ventrículo direito, AD: átrio direito, AE: átrio esquerdo. Clique aqui para ver uma versão maior desta figura.
6. Análise dos dados
- Meça o diâmetro do tronco pulmonar em três ciclos cardíacos em PLAX e use o diâmetro médio do tronco pulmonar para análises de dados adicionais. Meça o VTI em três ciclos cardíacos em PLAX para cada um dos três cine loops armazenados (no centro do tronco pulmonar e próximo às paredes do vaso). Use o VTI médio de todas as medições de VTI para análise posterior. Use a seguinte fórmula para calcular o CO:
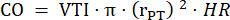
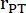 : raio do tronco pulmonar, FC: frequência cardíaca
: raio do tronco pulmonar, FC: frequência cardíaca - Meça o IEVE na PSAX no nível médio-papilar. Use uma ferramenta de medição para medir o maior diâmetro interno do VE (LVid1) do meio do septo até a parede livre. Em seguida, medir o diâmetro interno do VE ortogonal à primeira medida (LVid2). Repita essas medições em três ciclos cardíacos e calcule o IEVE usando os diâmetros internos médios do VE e a seguinte fórmula:
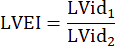
- Meça o TAPSE em três ciclos cardíacos na visualização A4CH e use o TAPSE médio para análises de dados adicionais.
7. Cateterismo cardíaco direito
- Meça a pressão e o volume do ventrículo direito (VD) por cateterismo cardíaco direito com um cateter de microponta 1.4F 3 semanas após a cirurgia de TBP.
- Anestesiar e intubar o rato conforme descrito nos passos 3.1-3.4. Coloque o mouse em uma almofada de aquecimento coberta (37 ° C) e mantenha a anestesia (sevoflurano a 3,5% em 0,6 L / min 100% de oxigênio).
- Administre 2000 UI de heparina (intramuscular [i.m.]) e 0,5 mL de NaCl (subcutâneo [s.c.]).
- Usando uma tesoura cirúrgica, corte a parede abdominal caudalmente ao processo xifóide e obtenha acesso à cavidade torácica cortando cuidadosamente o diafragma ao longo de sua incisão na parede torácica. Corte o diafragma e as costas até que o acesso suficiente ao coração tenha sido obtido.
- Coloque uma ligadura ao redor da veia cava inferior. Use isso para ocluir o vaso para reduzir a pré-carga para o registro de medições de pressão-volume posteriormente no protocolo.
- Use uma agulha 26G para fazer um pequeno orifício no VD com cuidado. Certifique-se de que esteja o mais próximo possível do ápice e que a agulha não penetre totalmente no ventrículo, mas apenas atue como um guia para a inserção do cateter de condutância. Se ocorrer sangramento, aplique uma leve pressão com um pequeno cotonete para minimizar a perda de sangue.
- Identifique o pequeno orifício na parede ventricular e insira o cateter penetrando no tecido.
NOTA: Ao inserir o cateter, tome cuidado para não danificar a parede ventricular interna. - Alterações na pressão ventricular direita (PVD) são frequentemente observadas por vários minutos após a inserção do cateter. Aguarde até que o RVP se estabilize para obter medições representativas do estado estacionário.
- Para obter alças de pressão-volume, use a ligadura previamente colocada ao redor da veia cava inferior. Puxe cuidadosamente a ligadura para ocluir o recipiente, reduzindo gradualmente a pré-carga.
- Uma vez que os loops representativos de pressão-volume tenham sido registrados, extraia o cateter e eutanasiar o camundongo por excisão do coração. Neste momento, colete amostras de sangue e tecido para análise posterior.
Resultados
Camundongos C57BL / 6N (machos, 5 semanas de idade, 17-20 g) foram randomizados para PTB grave (sPTB, 250 μm, n = 12), PTB leve (mPTB, 450 μm, n = 9) ou cirurgia simulada (simulada, n = 15). A avaliação da função cardíaca foi realizada por ecocardiografia 1 semana e 3 semanas após a cirurgia. O cateterismo cardíaco direito com posterior eutanásia foi realizado 3 semanas após a cirurgia. Os órgãos foram pesados e o tecido cardíaco foi preparado para análises histológicas.
A ecoc...
Discussão
Neste artigo, apresentamos um modelo murino de hipertrofia e falha do VD induzida por sobrecarga de pressão. Demonstramos que: (i) a TBP em camundongos juvenis pode induzir graus variados de patologia do VD, variando de hipertrofia leve do VD a insuficiência do VD com sinais extracardíacos de descompensação e fibrose do VD confirmada histologicamente. (ii) Sinais de disfunção do VD podem ser observados e quantificados por ecocardiografia em 1 e 3 semanas após a cirurgia de TBP. (iii) O grau de hipertrofia do VD ?...
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado por Snedkermester Sophus Jacobsen og Hustru Astrid Jacobsens Fond, Helge Peetz og Verner Peetz og hustru Vilma Peetz Legat, Grosserer A.V. Lykfeldt og Hustrus Legat. Além disso, os autores gostariam de agradecer à equipe das instalações de animais do Departamento de Medicina Clínica da Universidade de Aarhus, por seu apoio durante a execução do trabalho experimental.
Materiais
| Name | Company | Catalog Number | Comments |
| Biosyn 6-0, monofilament, absorbable suture | Covidien | UM-986 | |
| Blunt cannula, 27G 0.4x0.25, | Sterican | 292832 | |
| Bupaq Multidose vet 0,3 mg/ml (Buprenorphinum) | Salfarm Danmark | VNR 472318 | |
| C57BL/6NTac mice | Taconic Biosciences | C57BL/6NTac | |
| Dagrofil 1, braided, non-absorbable suture | B Braun | C0842273 | |
| Depilatory cream | Veet | 3132000 | |
| Disinfection Swabs (82% Ethanol + 0.5% Chlorhexidine) | Mediq | 3340122 | |
| Disposable scalpels, size 11 | Swann-Morton | 11708353 | |
| Dräger Vapor 2000 Sevoflurane | Dräger | M35054 | |
| Eye oinment neutral, "Ophta" | Actavis | MTnr.: 07586 Vnr: 53 96 68 | |
| Horizon ligating clips | Teleflex Medical | 5200 (IPN914931) | |
| Horizon Open Ligating Clips applier, curved, 6" (15 cm) | Teleflex Medical | 537061 | |
| Kitchen roll holder | n.a. | n.a. | |
| Metal wire of different thickness | n.a. | n.a. | |
| Microsurgical instruments set | Thompson | n.a. | |
| MiniVent Ventilator | Hugo Sachs | Type 845 | |
| MS505S transducer | Visual sonics | n.a. | |
| Rimadyl Bovis vet. 50 mg/ml (Carprofen) | Zoetis | MTnr: 34547, Vnr: 10 27 99, | |
| Sevoflurane Baxter 100 % | Baxter Medical | MTnr: 35015 | |
| Silicone tubing | n.a. | n.a. | |
| Soft plastic sheet | n.a. | n.a. | |
| Stereomicroscope, "Opmi Pico" | Carl Zeiss Surgicals GmbH | n.a. | |
| Ultrasonic probe holder/rail | Visual Sonics | 11277 | |
| Varming plate | Visual sonics | 11437 | |
| Venflon ProSafety, 22G, 0,9 x 25mm | Becton Dickinson | 393222 |
Referências
- Voelkel, N. F., et al. Right ventricular function and failure: Report of a national heart, lung, and blood institute working group on cellular and molecular mechanisms of right heart failure. Circulation. 114 (17), 1883-1891 (2006).
- Haddad, F., Doyle, R., Murphy, D. J., Hunt, S. A. Right ventricular function in cardiovascular disease, part ii: Pathophysiology, clinical importance, and management of right ventricular failure. Circulation. 117 (13), 1717-1731 (2008).
- Van De Veerdonk, M. C., et al. Progressive right ventricular dysfunction in patients with pulmonary arterial hypertension responding to therapy. J Am Coll Cardiol. 58 (24), 2511-2519 (2011).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: Problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: The evolution of animal models in pulmonary hypertension research; are we there yet. Pulm Circ. 3 (4), 739-756 (2013).
- Andersen, A., et al. Animal models of right heart failure. Cardiovasc Diagn Ther. 10 (5), 1561-1579 (2020).
- Voelkel, N. F., Tuder, R. M. Hypoxia-induced pulmonary vascular remodeling: A model for what human disease. J Clin Invest. 106 (6), 733-738 (2000).
- Rabinovitch, M., Gamble, W., Nadas, A. S., Miettinen, O. S., Reid, L. Rat pulmonary circulation after chronic hypoxia: Hemodynamic and structural features. Am J Physiol. 236 (6), H818-H827 (1979).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. Faseb j. 15 (2), 427-438 (2001).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. Am J Respir Crit Care Med. 184 (10), 1171-1182 (2011).
- Nicolls, M. R., et al. New models of pulmonary hypertension based on VEGF receptor blockade-induced endothelial cell apoptosis. Pulm Circ. 2 (4), 434-442 (2012).
- Hessel, M. H., Steendijk, P., Den Adel, B., Schutte, C. I., Van Der Laarse, A. Characterization of right ventricular function after monocrotaline-induced pulmonary hypertension in the intact rat. Am J Physiol Heart Circ Physiol. 291 (5), H2424-H2430 (2006).
- Gomez-Arroyo, J. G., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Janssen, W., et al. 5-ht2b receptor antagonists inhibit fibrosis and protect from RV heart failure. Biomed Res Int. 2015, 438403 (2015).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050 (2018).
- Axelsen, J. B., et al. Effects of 6-mercaptopurine in pressure overload induced right heart failure. PLoS One. 14 (11), e0225122 (2019).
- Egemnazarov, B., et al. Pressure overload creates right ventricular diastolic dysfunction in a mouse model: Assessment by echocardiography. J Am Soc Echocardiogr. 28 (7), 828-843 (2015).
- Wang, Q., et al. Induction of right ventricular failure by pulmonary artery constriction and evaluation of right ventricular function in mice. J Vis Exp. (147), e59431 (2019).
- Kojonazarov, B., et al. The peroxisome proliferator-activated receptor β/δ agonist gw0742 has direct protective effects on right heart hypertrophy. Pulm Circ. 3 (4), 926-935 (2013).
- Kojonazarov, B., et al. P38 MAPK inhibition improves heart function in pressure-loaded right ventricular hypertrophy. Am J Respir Cell Mol Biol. 57 (5), 603-614 (2017).
- Rai, N., et al. Effect of Riociguat and Sildenafil on right heart remodeling and function in pressure overload induced model of pulmonary arterial banding. Biomed Res Int. 2018, 3293584 (2018).
- Sydykov, A., et al. Genetic deficiency and pharmacological stabilization of mast cells ameliorate pressure overload-induced maladaptive right ventricular remodeling in mice. Int J Mol Sci. 21 (23), 9099 (2020).
- Andersen, S., et al. Effects of combined angiotensin ii receptor antagonism and neprilysin inhibition in experimental pulmonary hypertension and right ventricular failure. Int J Cardiol. 293, 203-210 (2019).
- Andersen, S., et al. Pressure overload induced right ventricular remodeling is not attenuated by the anti-fibrotic agent pirfenidone. Pulm Circ. 9 (2), 2045894019848659 (2019).
- Labazi, H., et al. Sex-dependent changes in right ventricular gene expression in response to pressure overload in a rat model of pulmonary trunk banding. Biomedicines. 8 (10), 430 (2020).
- Sun, X. Q., et al. Increased mao-a activity promotes progression of pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 64 (3), 331-343 (2021).
- Axelsen, J. S., et al. Effects of Empagliflozin on right ventricular adaptation to pressure overload. Front Cardiovasc Med. 10, 1302265 (2023).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660 (2023).
- Boehm, M., et al. Delineating the molecular and histological events that govern right ventricular recovery using a novel mouse model of pulmonary artery de-banding. Cardiovasc Res. 116 (10), 1700-1709 (2020).
- Andersen, S., et al. Effects of bisoprolol and losartan treatment in the hypertrophic and failing right heart. J Card Fail. 20 (11), 864-873 (2014).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210 (2015).
- Vildbrad, M. D., et al. Limitations and pitfalls in measurements of right ventricular stroke volume in an animal model of right heart failure. Physiol Meas. 36 (5), 925-937 (2015).
- Boehm, M., et al. Maintained right ventricular pressure overload induces ventricular-arterial decoupling in mice. Exp Physiol. 102 (2), 180-189 (2017).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041 (2014).
- Luitel, H., et al. Pressure overload leads to an increased accumulation and activity of mast cells in the right ventricle. Physiol Rep. 5 (6), e13146 (2017).
- Mamazhakypov, A., et al. Novel therapeutic targets for the treatment of right ventricular remodeling: Insights from the pulmonary artery banding model. Int J Environ Res Public Health. 18 (16), 8297 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados