Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein Mausmodell der durch Drucküberlastung induzierten rechtsventrikulären Hypertrophie und des Versagens durch pulmonales Rumpfbanding
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir beschreiben ein Mausmodell der rechtsventrikulären Drucküberlastung, die durch pulmonales Rumpfbanding induziert wird. Detaillierte Protokolle für Intubation, Operation und Phänotypisierung durch Echokardiographie sind in der Arbeit enthalten. Für die Intubation und Chirurgie werden maßgefertigte Instrumente verwendet, die eine schnelle und kostengünstige Reproduktion des Modells ermöglichen.
Zusammenfassung
Die durch Drucküberlastung verursachte rechtsventrikuläre Insuffizienz (RV) ist bei einer Reihe von Herz-Kreislauf- und Lungenerkrankungen stark mit Morbidität und Mortalität verbunden. Die Pathogenese des RV-Versagens ist komplex und nach wie vor unzureichend verstanden. Um neue therapeutische Strategien für die Behandlung des RV-Versagens zu identifizieren, sind robuste und reproduzierbare Tiermodelle unerlässlich. Modelle des pulmonalen Rumpfbandes (PTB) haben an Popularität gewonnen, da die Funktion des RV unabhängig von Veränderungen des Lungengefäßsystems beurteilt werden kann.
In dieser Arbeit stellen wir ein Mausmodell der durch PTB induzierten RV-Drucküberlastung bei 5 Wochen alten Mäusen vor. Das Modell kann verwendet werden, um verschiedene Grade der RV-Pathologie zu induzieren, die von einer leichten RV-Hypertrophie bis hin zu einem dekompensierten RV-Versagen reichen. Detaillierte Protokolle für die Intubation, die PTB-Operation und die Phänotypisierung durch Echokardiographie sind in der Arbeit enthalten. Darüber hinaus werden Anleitungen zur Anpassung von Instrumenten für die Intubation und PTB-Chirurgie gegeben, die eine schnelle und kostengünstige Reproduktion des PTB-Modells ermöglichen.
Zur Verengung des Lungenstamms wurden Titan-Ligaturclips verwendet, die einen hochgradig reproduzierbaren und bedienerunabhängigen Grad der Lungenstammverengung gewährleisteten. Der Schweregrad der PTB wurde anhand unterschiedlicher innerer Ligationsclipdurchmesser (mild: 450 μm und schwer: 250 μm) eingestuft. Dies führte zu einer RV-Pathologie, die von Hypertrophie mit erhaltener RV-Funktion bis hin zu dekompensiertem RV-Versagen mit reduziertem Herzzeitvolumen und extrakardialen Manifestationen reichte. Die RV-Funktion wurde 1 Woche und 3 Wochen nach der Operation durch Echokardiographie beurteilt. Beispiele für echokardiographische Bilder und Ergebnisse werden hier vorgestellt. Des Weiteren werden Ergebnisse der Rechtsherzkatheteruntersuchung und histologische Analysen des Herzgewebes gezeigt.
Einleitung
Die rechtsventrikuläre Insuffizienz (RV) ist ein klinisches Syndrom mit Symptomen einer Herzinsuffizienz und Anzeichen einer systemischen Stauung, die auf eine RV-Dysfunktion zurückzuführen ist1. RV-Dysfunktion ist bei einer Reihe von Herz-Kreislauf- und Lungenerkrankungen stark mit Morbidität und Mortalität assoziiert2. Die Ätiologie der RV-Dysfunktion ist komplex, und die zugrundeliegenden Signalwege und die Regulation sind nach wie vor unzureichend geklärt.
Beobachtungen aus aktuellen Therapien zeigen, dass eine verbesserte RV-Funktion eng mit der Nachlastreduktion korreliert, was darauf hindeutet, dass das Lungengefäßsystem das primäre Behandlungszielist 3. Dies deutet darauf hin, dass die derzeitigen Therapien nur einen minimalen direkten Einfluss auf die RV-Funktion haben, die sich auch nach der Verbesserung des pulmonalen Gefäßwiderstands verschlechtern kann3. Weitere Forschung zur Verbesserung der RV-Funktion unabhängig von der Nachlastreduzierung ist daher dringend erforderlich.
Robuste und reproduzierbare Tiermodelle sind bei der Suche nach neuen Therapeutika unerlässlich. In den meisten Modellen des chronischen RV-Versagens ist die zugrunde liegende Ursache die pulmonale Hypertonie, die durch eine strukturelle Veränderung des Lungengefäßsystems induziert wird 4,5,6. Zu den gut charakterisierten Modellen gehören das chronische Hypoxie-Modell 7,8, das Sugen-Hypoxie-Modell 9,10,11 und das Monocrotalin-Modell 12,13. Da das RV-Versagen in diesen Modellen sekundär zur pulmonalen Hypertonie ist, ist es unmöglich, die Auswirkungen von Eingriffen auf das pulmonale Gefäßsystem von den direkten Auswirkungen auf das RVzu unterscheiden 6.
Um das RV unabhängig vom Lungengefäßsystem zu untersuchen, hat das Modell des pulmonalen Rumpfbandes (PTB) an Popularität gewonnen und wurde bei mehreren Tierarten beschrieben, darunter Mäuse, Ratten, Kaninchen, Hunde, Schafe und Schweine 6,14,15,16,17,18,19,20,21,22,23, 24,25,26,27. In den PTB-Modellen wird die Verengung des Lungenstamms operativ erreicht, was zu einem Anstieg des RV-Drucks führt6. Es gibt verschiedene Ansätze für die Anwendung der PTB, einschließlich der Verengung des Gefäßes mit einer Ligatur oder mit einem Metallligatsclip18,28. Bei Modellen mit Ligaturen wird der Lungenstamm an eine Nadel gebunden und die Nadel zurückgezogen, wobei die Ligatur an Ort und Stelle bleibt. Daraus ergibt sich eine Verengung des Gefäßes, die von der Nadelstärke und der Spannung des Knotens abhängt18,29. Bei Modellen, die Metallligatenclips verwenden, kann der Grad der Lungenstammverengung reproduzierbarer sein. Modifizierte Ligating-Clip-Applier werden verwendet, um die Ligating-Clips auf einen vordefinierten und konstanten Durchmesser zu schließen. Dies macht die Methode anwenderunabhängig und reduziert die PTB-bedingte Variabilität im Krankheitsphänotyp 15,27,28.
Es wurde gezeigt, dass murine PTB-Modelle Hypertrophie und Versagen von Wohnmobilen induzieren18,28. Eine große Herausforderung bei der Verwendung des PTB-Modells ist die Wahl des geeigneten PTB-Durchmessers, um den gewünschten Grad der RV-Pathologie zu erreichen. Dies ist besonders schwierig, wenn versucht wird, den Ausfall eines dekompensierten Wohnmobils zu modellieren. Dazu muss die Verengung eng genug sein, um ein chronisches RV-Versagen zu induzieren, ohne dass es kurz nach der Operation zu einem akuten RV-Versagen und zum Tod kommt6. Ein Ansatz, um diese Herausforderung zu lösen, ist der Einsatz von Absetzern oder Jungtieren 6,15. Ein PTB-Modell wurde erfolgreich eingesetzt, um verschiedene Stadien des Versagens von Wohnmobilen mit Hilfe von Wistar-Rattenentwöhnungen zu untersuchen15,30. Um dies zu erreichen, wurden junge Ratten mit verbleibendem Wachstumspotenzial einer PTB-Operation unterzogen, bei der Titan-Ligatur-Clips angelegt wurden. Als die Ratten wuchsen, wurde die Lungenstenose allmählich schwerer und führte je nach Schweregrad der PTB15,30 zu einer RV-Hypertrophie oder einem chronischen RV-Versagen. Angeregt durch dieses Modell stellten wir die Hypothese auf, dass verschiedene Stadien der RV-Pathologie in einem murinen PTB-Modell mit juvenilen Mäusen erzeugt werden könnten. Die Untersuchung eines breiten Spektrums der RV-Pathologie von leichten bis schweren Erkrankungen kann dazu beitragen, unser Verständnis des Krankheitsverlaufs und des Übergangs von der RV-Hypertrophie zum RV-Versagen zu klären.
In dieser Arbeit präsentieren wir ein Mausmodell der durch PTB induzierten RV-Drucküberlastung bei juvenilen Mäusen. Mit diesem Modell können verschiedene Grade der RV-Pathologie erzeugt werden, die von RV-Hypertrophie bis hin zu dekompensiertem RV-Versagen reichen. Diese Studie umfasst detaillierte Protokolle für die Intubation, die PTB-Operation und die Phänotypisierung durch Echokardiographie.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Die Studie wurde von der dänischen Tierversuchsinspektion genehmigt (Zulassungsnummer: 2021-15-0201-00928) und wurde in Übereinstimmung mit der nationalen Gesetzgebung für Versuchstiere durchgeführt. In dieser Studie wurden 5 Wochen alte männliche C57BL/6N-Mäuse verwendet.
1. Anpassung von Instrumenten für Intubation und Chirurgie (Abbildung 1)
HINWEIS: In diesem Abschnitt werden die wichtigsten Schritte bei der Herstellung von maßgefertigten Instrumenten für die Intubation und PTB-Chirurgie aus kostengünstigen und leicht verfügbaren Materialien beschrieben.
- Bereiten Sie den Endotrachealtubus vor (Abbildung 1A).
Gängige intravenöse (IV) Katheter können für die Intubation und Beatmung von Mäusen verwendet werden.- Wählen Sie die geeignete Größe des intravaskulären Katheters, die der Größe der Mäuse entspricht. Für 5 Wochen alte Mäuse (17-20 g) wird ein 22G-Katheter und für größere Mäuse (>20 g) ein 23G-Katheter empfohlen.
- Ziehen Sie die Nadel heraus und lösen Sie den Verriegelungsmechanismus. Führen Sie die Nadel wieder in den Katheter ein und schneiden Sie die Spitze der Nadel in einem Winkel von 45° ab, ca. 2 mm von der Spitze des Katheters entfernt.
- Verwenden Sie Schleifpapier, um die Spitze abzustumpfen, um Verletzungen der Stimmbänder der Mäuse zu vermeiden.
- Schneiden Sie einen Flügel des Katheters ab, um während der Intubation eine bessere Sicht zu haben.
- Bereiten Sie den Thorax-Retraktor vor (Abbildung 1B).
- Biegen Sie mit einem Nadelhalter ein ca. 10 cm langes Stück flexiblen Metalldraht in der Mitte im 30°-Winkel.
- Verwenden Sie den Nadelhalter, um an beiden Enden des Drahtes vorsichtig atraumatische Haken von 5 mm Breite zu erzeugen.
- Bereiten Sie den Intubationsständer vor (Abbildung 1C).
HINWEIS: Die Verwendung eines Intubationsständers ermöglicht die kontinuierliche Verabreichung der Anästhesie über einen Nasenschlauch während der Intubation. Dies ermöglicht eine kontrollierte und sichere Intubation unter visueller Kontrolle, was das Risiko einer Verletzung der Stimmbänder und der Luftröhre sowie das Risiko einer Fehlplatzierung des Schlauches in der Speiseröhre reduziert. Jeder Metall- oder Kunststoffrahmen kann als Rahmen für den Intubationsständer verwendet werden. In dieser Studie wurde ein leicht gebogener Küchenrollenhalter verwendet.- Schneiden Sie ein 3 cm langes Stück Gummischlauch ab, das in die Schnauze einer Maus passt, und verbinden Sie es mit einem IV-Katheterventil. Die Inhalationsanästhesie kann über das Ventil vor der Intubation angeschlossen werden.
- Machen Sie eine Schlaufe mit einer 1-0 geflochtenen Naht etwa 5 mm von der Öffnung des Schlauches entfernt. Dies wird verwendet, um die murine Schnauze in der Röhre zu sichern.
- Schneide ein Loch in der Nähe der Oberseite einer flexiblen Plastikfolie und stecke den Schlauch in das Loch. Das Blatt dient zur Unterstützung der Maus im Intubationsständer.
- Halten Sie die einzelnen Teile mit Klebeband zusammen, wie in Abbildung 1C gezeigt.
- Bereiten Sie die Führungskanüle vor (Abbildung 1D, E).
- Ziehen Sie eine monofile 6-0-Naht durch eine stumpfe 27G-Kanüle und binden Sie einen Knoten auf die Naht. Verwenden Sie diesen Knoten später, um die Naht während der PTB-Operation zu greifen.
- Biegen Sie die Spitze der Kanüle mit einem Nadelhalter in einen Winkel von 80°.
- Bereiten Sie den ligativen Clip-Applier vor.
HINWEIS: Ein ligativer Clip-Applierer mit abgewinkelten Backen wird mit einem einstellbaren Stoppmechanismus modifiziert (Abbildung 1F), der die Kompression des ligierenden Clips stoppt, wenn sich die Backen in einem genau festgelegten Abstand voneinander befinden. Der modifizierte Ligatur-Clip-Applier wird für das Anlegen von Titan-Ligatur-Clips am Lungenstamm verwendet.- Befestigen Sie ein individuell zugeschnittenes Stück Messing mit zwei Schrauben an den Griffen des Ligatur-Clip-Apptierers. Montieren Sie in der Mitte eine verstellbare Schraube (Abbildung 1F, weißer Pfeil), die den genauen Abstand zwischen den zusammengedrückten Griffen des ligativen Clipapptierers bestimmt, der einem genauen Abstand zwischen den Backen entspricht.

Abbildung 1: Instrumente für die Intubation und PTB-Chirurgie. (A) Endotrachealtubus aus einem IV-Katheter. (B) Thorax-Retraktor. (C) Intubationsständer und Maus in einem Intubationsständer, die über einen Nasenschlauch anästhesiert werden. (D) Chirurgische Instrumente und modifizierte Ligatur-Clip-Applierer, die für die PTB-Chirurgie verwendet werden. (E) Führungskanüle. (F) Individuell angefertigter einstellbarer Stoppmechanismus. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Einstellung des ligativen Clip-Appliers
- Wählen Sie den Innendurchmesser des ligierenden Clips basierend auf dem gewünschten Schweregrad des RV-Versagens. Verwenden Sie für 5 Wochen alte männliche C57BL/6N-Mäuse (17-20 g) einen Clipdurchmesser von 250 μm für schwere und 450 μm für leichte RV-Drucküberlastung. Verwenden Sie Zwischenclipdurchmesser, um eine moderate Drucküberlastung zu induzieren.
- Verwenden Sie Metalldraht oder Nadeln, um den Ligatur-Clip-Applierer einzustellen. Stellen Sie sicher, dass der Durchmesser des Drahtes dem gewünschten Clipdurchmesser entspricht.
- Bestücken Sie den Clip-Applier mit einem Ligaturclip und platzieren Sie den Einstelldraht in der Mitte des Ligaturclips. Während Sie den Clip-Applizator zusammendrücken, drehen Sie die Schraube, bis die Backen des Clips fest um den Draht herum liegen. Stellen Sie sicher, dass der Clip auf dem Einstelldraht an Ort und Stelle bleibt, sobald der Clip-Applierer losgelassen wird.
- Wenn der Clip-Applierer eingestellt ist, platzieren Sie einen weiteren ligativen Clip auf dem Einstelldraht, um den eingestellten Durchmesser zu validieren.
3. Vorbereitungen für die Operation
- Induzieren Sie die Anästhesie in einer Induktionskammer mit 7 % Sevofluran in 0,6 l/min und 100 % Sauerstoff. Bestätigen Sie eine ausreichende Anästhesie durch Zehenkneifen vor der Intubation.
HINWEIS: Isofluran kann ebenfalls verwendet werden. Beachten Sie, dass unterschiedliche Konzentrationen verwendet werden sollten. - Intubieren Sie die Maus mit einem 22G IV-Katheter. Führen Sie die Intubation unter visueller Anleitung mit einem Operationsmikroskop und einem Intubationsständer durch, um eine korrekte Ausrichtung für die Visualisierung der Stimmbänder und eine kontinuierliche Verabreichung von Inhalationsanästhetika über einen Nasenschlauch zu ermöglichen (Abbildung 1C).
- Belüften Sie die Maus mit 175 Hüben/min und einem Atemzugvolumen von 300 μL/Hub.
HINWEIS: Es werden auch Atemzugvolumina von 8-10 μL/g empfohlen, und das ideale Atemzugvolumen hängt von möglichen Leckagen und Toträumen im Lüftungssystem ab. - Legen Sie die intubierte Maus auf ein abgedecktes Heizkissen (37 °C) und tragen Sie eine Feuchtigkeitssalbe auf die Augen der Maus auf.
- Halten Sie die Anästhesie aufrecht (3,5 % Sevofluran in 0,6 l/min, 100 % Sauerstoff) und verabreichen Sie 0,1 mg/kg Buprenorphin und 5 mg/kg Carprofen subkutan für die perioperative Analgesie. Entfernen Sie alle Haare von der Brust mit Enthaarungscreme und desinfizieren Sie die Haut mit Desinfektionstüchern.
4. PTB-Chirurgie
- Machen Sie einen 10 mm großen Schnitt in der Haut oberhalb des zweiten Interkostalraums vom Sternumwinkel bis zur linken vorderen Achsellinie. Spaltung der großen und kleinen Brustmuskulatur durch stumpfe Dissektion.
- Schneiden Sie die Interkostalmuskulatur im zweiten Interkostalraum ab und präparieren Sie den Thymus stumpf, um das Herz, den Lungenstamm und die Aorta freizulegen. Platzieren Sie einen Thorax-Retraktor im Interkostalraum, um das Operationsfeld zugänglich zu halten.
HINWEIS: Beim Durchtrennen der Interkostalmuskulatur ist große Vorsicht geboten, da die linke Brustarterie interna nur 1-2 mm lateral des Brustbeins verläuft. Eine Verletzung dieser Arterie kann zu einem erheblichen Blutverlust führen. - Trennen Sie den Lungenstamm von der aufsteigenden Aorta, indem Sie das Bindegewebe zwischen den Gefäßen mit einer mikroskopisch kleinen Pinzette stumpf entfernen. Verbessern Sie die Belichtung des Lungenstamms weiter, indem Sie den Unterkörper der Maus drehen (linkes Bein über rechtes Bein).
- Führen Sie die Führungskanüle durch den Perikardsinus transversal posterior des Lungenstamms. Fassen Sie mit einer Pinzette den Knoten an der Spitze der Führungskanüle und ziehen Sie die Naht durch die Führungskanüle. Entfernen Sie vorsichtig die Führungskanüle, während die Naht um den Lungenstamm an Ort und Stelle bleibt.
- Laden Sie den Ligatur-Clip-Applierer und führen Sie den Lungenstamm mit der Naht in die Kiefer des Ligatur-Clips und drücken Sie den Clip zusammen. Lösen Sie die Naht sofort nach dem Setzen des Clips und beobachten Sie die Füllung des Lungenstamms.
HINWEIS: In den ersten Sekunden nach dem Anlegen des Ligaturclips kann eine Bradykardie beobachtet werden. - Legen Sie eine monofile resorbierbare Naht 6-0 um die zweite und dritte Costa und schließen Sie den Interkostalraum. Evakuieren Sie so viel Luft wie möglich aus der Brusthöhle, indem Sie sanften Druck auf die Brust ausüben, während Sie die Naht festziehen.
- Zum Schluss vernähen Sie die Haut mit einem resorbierbaren 6-0-Monofilament-Nahtmaterial.
- Führen Sie das gleiche Verfahren durch, mit Ausnahme des Platzierens des Ligaturclips (Schritt 4.5), während einer Scheinoperation.
5. Echokardiographie
- Nach Einleitung der Anästhesie in einer Induktionskammer (1-2 min, 6 % Sevofluran in 100 % Sauerstoff) halten Sie die Anästhesie mit einer Nasensonde (3,5 % Sevofluran in 100 % Sauerstoff) aufrecht. Entfernen Sie alle Haare von Brust und Bauch mit Enthaarungscreme und legen Sie die Maus auf ein Heizkissen. Tragen Sie feuchtigkeitsspendende Salbe auf die Augen und Ultraschallgel auf die Brust der Maus auf.
HINWEIS: Passen Sie die 2D-Verstärkung, die Fokustiefe und die Bildtiefe an, um die Bildqualität bei allen echokardiographischen Messungen zu verbessern. - Stellen Sie die Ultraschallsonde so ein, dass sie die Ansicht der parasternalen langen Achse (PLAX) findet (Abbildung 2). Messen Sie in PLAX den Innendurchmesser des Lungenstamms und das Geschwindigkeits-Zeit-Integral (VTI) im Lungenstamm.
- Wählen Sie den B-Modus und bewegen Sie das Heizkissen vorsichtig auf der x-, y- und z-Achse, um den Lungenstamm in der Bildmitte zu identifizieren. Verwenden Sie die Farbe , um den größten Durchmesser des Lungenstamms zu identifizieren. Verwenden Sie cine store , um eine Sequenz zur Messung des Durchmessers des Lungenstamms aufzunehmen.
- Wählen Sie Farbe und Pulswellendoppler (PW) und platzieren Sie den Cursor in der Mitte des Lungenstamms. Stellen Sie den PW-Winkel ein, bis die gestrichelten Linien parallel zum Blutfluss im Gefäß verlaufen.
- Drücken Sie auf cine store , um VTI zu messen. Platzieren Sie den Cursor in der Nähe beider Wände des Lungenstamms und drücken Sie erneut auf cine store , um die Strömung in der Nähe der Gefäßwand zu erfassen.
HINWEIS: Der Innendurchmesser des Rechtsventrikels (RV) und die RV-freie Wandstärke können ebenfalls in der PLAX-Ansicht beurteilt werden.
- Suchen Sie die Ansicht der parasternalen Kurzachse (PSAX) (Abbildung 3) zur Messung des linksventrikulären (LV) Innendurchmessers, die zur Beurteilung der Septumvorwölbung (D-Konfiguration) verwendet werden kann.
- Wählen Sie den B-Modus und drehen Sie den Fühler um 90° gegen den Uhrzeigersinn. Winkeln Sie die Sonde um 20-30 Grad seitlich, um eine Abschattung des RV durch das Brustbein zu vermeiden, und neigen Sie die Sonde um 20-30 Grad nach vorne, bis der linke Ventrikel so rund wie möglich ist. Schieben Sie dann die Sonde in kraniokaudaler Richtung, um die Höhe der Papillenmuskulatur mit den größten ventrikulären Durchmessern zu identifizieren, und drücken Sie auf cine store.
HINWEIS: Der PSAX auf der midpapillären Ebene kann auch zur Beurteilung der fraktionierten Flächenänderung des RV verwendet werden. PSAX auf Höhe der Aortenklappe kann verwendet werden, um die fraktionierte RV-Verkürzung oder die RV-freie Wandstärke zu messen.
- Wählen Sie den B-Modus und drehen Sie den Fühler um 90° gegen den Uhrzeigersinn. Winkeln Sie die Sonde um 20-30 Grad seitlich, um eine Abschattung des RV durch das Brustbein zu vermeiden, und neigen Sie die Sonde um 20-30 Grad nach vorne, bis der linke Ventrikel so rund wie möglich ist. Schieben Sie dann die Sonde in kraniokaudaler Richtung, um die Höhe der Papillenmuskulatur mit den größten ventrikulären Durchmessern zu identifizieren, und drücken Sie auf cine store.
- Verwenden Sie die apikale 4-Kammer-Ansicht (A4CH) (Abbildung 4), um die systolische Exkursion der Trikuspidalringebene (TAPSE) zu messen und die Trikuspidalinsuffizienz zu beurteilen.
- Positionieren Sie die Sonde wie in Abbildung 4 gezeigt. Sobald das Herz identifiziert ist, nehmen Sie kleine Anpassungen an der Sonde vor, indem Sie nur das Handgelenk und die Finger verwenden, um alle vier Kammern des Herzens und die Trikuspidalklappe zu identifizieren.
- Eine gute A4CH-Ansicht zu identifizieren und zu pflegen, ist eine Herausforderung. Lassen Sie die Hand mit der Sonde auf dem Heizkissen ruhen, um Stabilität zu gewährleisten. Schieben, neigen und drehen Sie die Sonde leicht, bis das entsprechende Bild gefunden wird.
- Bewegen Sie die Sonde jeweils nur in einer Dimension: Schieben Sie z. B. kraniokaudal, um das Herz zu finden, neigen Sie dann die Sonde, um alle vier Kammern zu identifizieren, und drehen Sie schließlich die Sonde, bis sich alle vier Kammern und die Trikuspidalklappe im Rahmen befinden. Wiederholen Sie bei Bedarf alle drei Schritte mehrmals, bevor Sie das Idealbild erhalten.
- Sobald die Trikuspidalklappe identifiziert ist, wählen Sie den M-Modus und platzieren Sie die gestrichelte Linie im Trikuspidalring der freien Wand. Drücken Sie auf cine store , um die Messungen zu speichern.
- Wählen Sie die Farbe aus, um die Trikuspidalklappe auf Regurgitation zu beurteilen. Wenn eine Regurgitation vorliegt, ist in der Systole ein Strahl retrograder Strömung vom RV zum rechten Vorhof (RA) zu sehen (Abbildung 5).
HINWEIS: In der A4CH-Ansicht können auch der Gewebedoppler in der RV-Freiwand und die RV-Einströmgeschwindigkeit gemessen werden.
- Positionieren Sie die Sonde wie in Abbildung 4 gezeigt. Sobald das Herz identifiziert ist, nehmen Sie kleine Anpassungen an der Sonde vor, indem Sie nur das Handgelenk und die Finger verwenden, um alle vier Kammern des Herzens und die Trikuspidalklappe zu identifizieren.
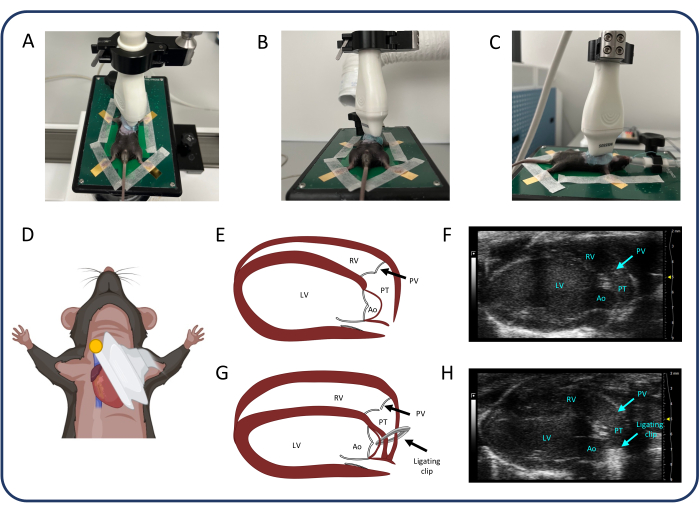
Abbildung 2: Parasternale Längsachsenansicht (PLAX). (A-D) Positionierung der Ultraschallsonde. (E, F) Das normale Mausherz in PLAX. (G, H) RV-Dilatation und Hypertrophie nach PTB. Abkürzungen: LV: linker Ventrikel, RV: rechter Ventrikel, PV: Pulmonalklappe, PT: Pulmonaltrunk, Ao: Aorta. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
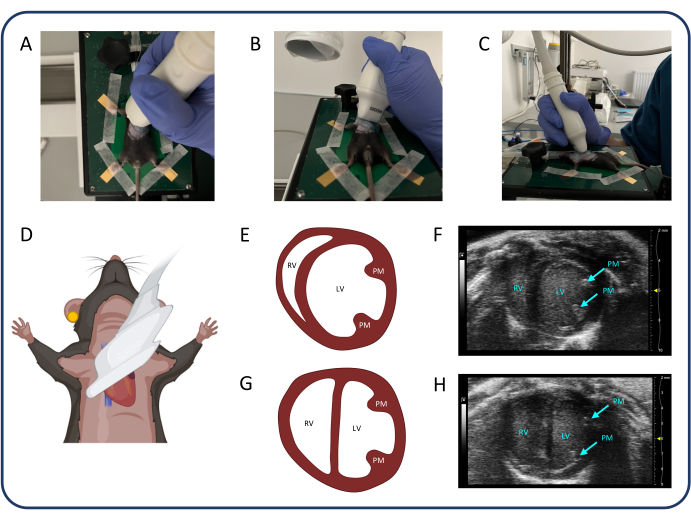
Abbildung 3: Parasternale Kurzachsenansicht (PSAX). (A-D) Positionierung der Ultraschallsonde. (E, F) Das normale Mausherz im PSAX. (G, H) PSAX nach PTB. Abkürzungen: LV: linker Ventrikel, RV: rechter Ventrikel, PM: Papillarmuskel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
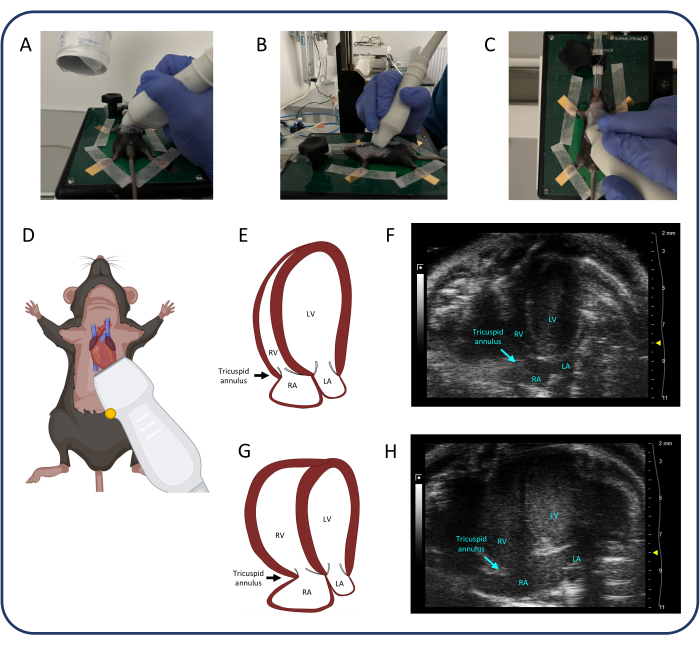
Abbildung 4: Apikale 4-Kammer-Ansicht (A4CH). (A-D) Positionierung der Ultraschallsonde. (E, F) Das normale Mausherz in der A4CH-Ansicht. (G, H) RV- und RA-Dilatation nach PTB. Abkürzungen: LV: linker Ventrikel, RV: rechter Ventrikel, RA: rechter Vorhof, LA: linker Vorhof. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
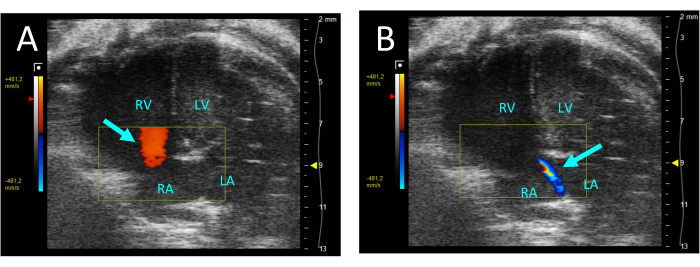
Abbildung 5: Trikuspidalinsuffizienz dargestellt durch Farbdoppler in der A4CH-Ansicht. (A) In der Diastole ist die Strömung von der RA zum RV zu beobachten (Pfeil). (B) Während der Systole ist ein dünner Strömungsstrahl vom RV zur RA sichtbar (Pfeil). Abkürzungen: LV: linker Ventrikel, RV: rechter Ventrikel, RA: rechter Vorhof, LA: linker Vorhof. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
6. Datenanalysen
- Messen Sie in PLAX den Durchmesser des Lungenstamms in drei Herzzyklen und verwenden Sie den mittleren Durchmesser des Lungenstamms für weitere Datenanalysen. Messen Sie die VTI in drei Herzzyklen in PLAX für jeden der drei gespeicherten Cine-Schleifen (in der Mitte des Lungenstamms und in der Nähe der Gefäßwände). Verwenden Sie den mittleren VTI aller VTI-Messungen für die weitere Analyse. Verwenden Sie die folgende Formel, um CO zu berechnen:
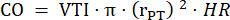
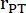 : Radius des Lungenstamms, HF: Herzfrequenz
: Radius des Lungenstamms, HF: Herzfrequenz - Messen Sie die LVEI im PSAX auf midpapillärer Ebene. Verwenden Sie ein Messgerät, um den größten LV-Innendurchmesser (LVid1) von der Mitte des Septums bis zur freien Wand zu messen. Messen Sie dann den LV-Innendurchmesser orthogonal zur ersten Messung (LVid2). Wiederholen Sie diese Messungen in drei Herzzyklen und berechnen Sie die LVEI unter Verwendung des mittleren LV-Innendurchmessers und der folgenden Formel:
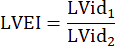
- Messen Sie die TAPSE in drei Herzzyklen in der A4CH-Ansicht und verwenden Sie die mittlere TAPSE für weitere Datenanalysen.
7. Rechtsherzkatheterisierung
- Messen Sie den rechtsventrikulären Druck und das Volumen 3 Wochen nach der PTB-Operation durch Rechtsherzkatheteruntersuchung mit einem 1,4F-Mikrospitzenkatheter.
- Anästhesieren und intubieren Sie die Maus wie in den Schritten 3.1-3.4 beschrieben. Legen Sie die Maus auf ein abgedecktes Heizkissen (37 °C) und halten Sie die Narkose aufrecht (3,5 % Sevofluran in 0,6 L/min, 100 % Sauerstoff).
- Verabreichen Sie 2000 IE Heparin (intramuskulär [i.m.]) und 0,5 ml NaCl (subkutan [s.c.]).
- Schneiden Sie mit einer chirurgischen Schere die Bauchdecke nur kaudal zum Processus xiphoideus und verschaffen Sie sich Zugang zur Brusthöhle, indem Sie das Zwerchfell vorsichtig entlang seines Schnitts in der Brustwand durchtrennen. Das Zwerchfell und die Nasennebenhöhlen durchtrennen, bis ein ausreichender Zugang zum Herzen erreicht ist.
- Lege eine Ligatur um die untere Hohlvene. Verwenden Sie diese Option zum Verschließen des Behälters, um die Vorspannung für die Aufzeichnung von Druck-Volumen-Messungen später im Protokoll zu reduzieren.
- Stechen Sie vorsichtig mit einer 26G-Nadel ein kleines Loch in den RV. Stellen Sie sicher, dass dies so nah wie möglich an der Spitze liegt und die Nadel nicht vollständig in den Ventrikel eindringt, sondern lediglich als Führung für das Einführen des Leitfähigkeitskatheters dient. Wenn Blutungen auftreten, üben Sie mit einem kleinen Wattestäbchen sanften Druck aus, um den Blutverlust zu minimieren.
- Identifizieren Sie das kleine Loch in der Ventrikelwand und führen Sie den Katheter ein, indem Sie in das Gewebe eindringen.
HINWEIS: Achten Sie beim Einführen des Katheters darauf, die innere Ventrikelwand nicht zu beschädigen. - Veränderungen des rechtsventrikulären Drucks (RVP) werden oft mehrere Minuten nach dem Einführen des Katheters beobachtet. Warten Sie, bis sich der RVP stabilisiert hat, um repräsentative stationäre Messungen zu erhalten.
- Um Druck-Volumen-Schleifen zu erhalten, verwenden Sie die Ligatur, die zuvor um die untere Hohlvene gelegt wurde. Ziehen Sie vorsichtig an der Ligatur, um das Gefäß zu verschließen, und verringern Sie so allmählich die Vorlast.
- Sobald repräsentative Druck-Volumen-Schleifen aufgezeichnet wurden, extrahieren Sie den Katheter und euthanasieren Sie die Maus durch Exzision des Herzens. Entnehmen Sie zu diesem Zeitpunkt Blut- und Gewebeproben für die weitere Analyse.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
C57BL/6N-Mäuse (männlich, 5 Wochen alt, 17-20 g) wurden randomisiert entweder auf schwere PTB (sPTB, 250 μm, n = 12), leichte PTB (mPTB, 450 μm, n = 9) oder Scheinoperation (Schein, n = 15) eingeteilt. Die Beurteilung der Herzfunktion erfolgte 1 Woche und 3 Wochen nach der Operation durch Echokardiographie. Die Rechtsherzkatheteruntersuchung mit anschließender Euthanasie wurde 3 Wochen nach der Operation durchgeführt. Organe wurden gewogen und Herzgewebe für histologische Analysen vorbereitet.
Access restricted. Please log in or start a trial to view this content.
Diskussion
In diesem Artikel stellen wir ein Mausmodell der durch Drucküberlastung induzierten RV-Hypertrophie und des Versagens vor. Wir zeigen, dass: (i) PTB in juvenilen Mäusen unterschiedliche Grade der RV-Pathologie induzieren kann, die von milder RV-Hypertrophie bis hin zu RV-Versagen mit extrakardialen Anzeichen von Dekompensation und histologisch bestätigter RV-Fibrose reichen. (ii) Anzeichen einer RV-Dysfunktion können 1 und 3 Wochen nach der PTB-Operation durch Echokardiographie beobachtet und quantifiziert werden. (i...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde unterstützt von Snedkermester Sophus Jacobsen og Hustru Astrid Jacobsens Fond, Helge Peetz og Verner Peetz og hustru Vilma Peetz Legat, Grosserer A.V. Lykfeldt og Hustrus Legat. Darüber hinaus möchten sich die Autoren bei den Mitarbeitern der Tierkliniken am Department of Clinical Medicine der Universität Aarhus für ihre Unterstützung bei der Durchführung der experimentellen Arbeiten bedanken.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Biosyn 6-0, monofilament, absorbable suture | Covidien | UM-986 | |
| Blunt cannula, 27G 0.4x0.25, | Sterican | 292832 | |
| Bupaq Multidose vet 0,3 mg/ml (Buprenorphinum) | Salfarm Danmark | VNR 472318 | |
| C57BL/6NTac mice | Taconic Biosciences | C57BL/6NTac | |
| Dagrofil 1, braided, non-absorbable suture | B Braun | C0842273 | |
| Depilatory cream | Veet | 3132000 | |
| Disinfection Swabs (82% Ethanol + 0.5% Chlorhexidine) | Mediq | 3340122 | |
| Disposable scalpels, size 11 | Swann-Morton | 11708353 | |
| Dräger Vapor 2000 Sevoflurane | Dräger | M35054 | |
| Eye oinment neutral, "Ophta" | Actavis | MTnr.: 07586 Vnr: 53 96 68 | |
| Horizon ligating clips | Teleflex Medical | 5200 (IPN914931) | |
| Horizon Open Ligating Clips applier, curved, 6" (15 cm) | Teleflex Medical | 537061 | |
| Kitchen roll holder | n.a. | n.a. | |
| Metal wire of different thickness | n.a. | n.a. | |
| Microsurgical instruments set | Thompson | n.a. | |
| MiniVent Ventilator | Hugo Sachs | Type 845 | |
| MS505S transducer | Visual sonics | n.a. | |
| Rimadyl Bovis vet. 50 mg/ml (Carprofen) | Zoetis | MTnr: 34547, Vnr: 10 27 99, | |
| Sevoflurane Baxter 100 % | Baxter Medical | MTnr: 35015 | |
| Silicone tubing | n.a. | n.a. | |
| Soft plastic sheet | n.a. | n.a. | |
| Stereomicroscope, "Opmi Pico" | Carl Zeiss Surgicals GmbH | n.a. | |
| Ultrasonic probe holder/rail | Visual Sonics | 11277 | |
| Varming plate | Visual sonics | 11437 | |
| Venflon ProSafety, 22G, 0,9 x 25mm | Becton Dickinson | 393222 |
Referenzen
- Voelkel, N. F., et al. Right ventricular function and failure: Report of a national heart, lung, and blood institute working group on cellular and molecular mechanisms of right heart failure. Circulation. 114 (17), 1883-1891 (2006).
- Haddad, F., Doyle, R., Murphy, D. J., Hunt, S. A. Right ventricular function in cardiovascular disease, part ii: Pathophysiology, clinical importance, and management of right ventricular failure. Circulation. 117 (13), 1717-1731 (2008).
- Van De Veerdonk, M. C., et al. Progressive right ventricular dysfunction in patients with pulmonary arterial hypertension responding to therapy. J Am Coll Cardiol. 58 (24), 2511-2519 (2011).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: Problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: The evolution of animal models in pulmonary hypertension research; are we there yet. Pulm Circ. 3 (4), 739-756 (2013).
- Andersen, A., et al. Animal models of right heart failure. Cardiovasc Diagn Ther. 10 (5), 1561-1579 (2020).
- Voelkel, N. F., Tuder, R. M. Hypoxia-induced pulmonary vascular remodeling: A model for what human disease. J Clin Invest. 106 (6), 733-738 (2000).
- Rabinovitch, M., Gamble, W., Nadas, A. S., Miettinen, O. S., Reid, L. Rat pulmonary circulation after chronic hypoxia: Hemodynamic and structural features. Am J Physiol. 236 (6), H818-H827 (1979).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. Faseb j. 15 (2), 427-438 (2001).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. Am J Respir Crit Care Med. 184 (10), 1171-1182 (2011).
- Nicolls, M. R., et al. New models of pulmonary hypertension based on VEGF receptor blockade-induced endothelial cell apoptosis. Pulm Circ. 2 (4), 434-442 (2012).
- Hessel, M. H., Steendijk, P., Den Adel, B., Schutte, C. I., Van Der Laarse, A. Characterization of right ventricular function after monocrotaline-induced pulmonary hypertension in the intact rat. Am J Physiol Heart Circ Physiol. 291 (5), H2424-H2430 (2006).
- Gomez-Arroyo, J. G., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Janssen, W., et al. 5-ht2b receptor antagonists inhibit fibrosis and protect from RV heart failure. Biomed Res Int. 2015, 438403(2015).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050(2018).
- Axelsen, J. B., et al. Effects of 6-mercaptopurine in pressure overload induced right heart failure. PLoS One. 14 (11), e0225122(2019).
- Egemnazarov, B., et al. Pressure overload creates right ventricular diastolic dysfunction in a mouse model: Assessment by echocardiography. J Am Soc Echocardiogr. 28 (7), 828-843 (2015).
- Wang, Q., et al. Induction of right ventricular failure by pulmonary artery constriction and evaluation of right ventricular function in mice. J Vis Exp. (147), e59431(2019).
- Kojonazarov, B., et al. The peroxisome proliferator-activated receptor β/δ agonist gw0742 has direct protective effects on right heart hypertrophy. Pulm Circ. 3 (4), 926-935 (2013).
- Kojonazarov, B., et al. P38 MAPK inhibition improves heart function in pressure-loaded right ventricular hypertrophy. Am J Respir Cell Mol Biol. 57 (5), 603-614 (2017).
- Rai, N., et al. Effect of Riociguat and Sildenafil on right heart remodeling and function in pressure overload induced model of pulmonary arterial banding. Biomed Res Int. 2018, 3293584(2018).
- Sydykov, A., et al. Genetic deficiency and pharmacological stabilization of mast cells ameliorate pressure overload-induced maladaptive right ventricular remodeling in mice. Int J Mol Sci. 21 (23), 9099(2020).
- Andersen, S., et al. Effects of combined angiotensin ii receptor antagonism and neprilysin inhibition in experimental pulmonary hypertension and right ventricular failure. Int J Cardiol. 293, 203-210 (2019).
- Andersen, S., et al. Pressure overload induced right ventricular remodeling is not attenuated by the anti-fibrotic agent pirfenidone. Pulm Circ. 9 (2), 2045894019848659(2019).
- Labazi, H., et al. Sex-dependent changes in right ventricular gene expression in response to pressure overload in a rat model of pulmonary trunk banding. Biomedicines. 8 (10), 430(2020).
- Sun, X. Q., et al. Increased mao-a activity promotes progression of pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 64 (3), 331-343 (2021).
- Axelsen, J. S., et al. Effects of Empagliflozin on right ventricular adaptation to pressure overload. Front Cardiovasc Med. 10, 1302265(2023).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660(2023).
- Boehm, M., et al. Delineating the molecular and histological events that govern right ventricular recovery using a novel mouse model of pulmonary artery de-banding. Cardiovasc Res. 116 (10), 1700-1709 (2020).
- Andersen, S., et al. Effects of bisoprolol and losartan treatment in the hypertrophic and failing right heart. J Card Fail. 20 (11), 864-873 (2014).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210(2015).
- Vildbrad, M. D., et al. Limitations and pitfalls in measurements of right ventricular stroke volume in an animal model of right heart failure. Physiol Meas. 36 (5), 925-937 (2015).
- Boehm, M., et al. Maintained right ventricular pressure overload induces ventricular-arterial decoupling in mice. Exp Physiol. 102 (2), 180-189 (2017).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041(2014).
- Luitel, H., et al. Pressure overload leads to an increased accumulation and activity of mast cells in the right ventricle. Physiol Rep. 5 (6), e13146(2017).
- Mamazhakypov, A., et al. Novel therapeutic targets for the treatment of right ventricular remodeling: Insights from the pulmonary artery banding model. Int J Environ Res Public Health. 18 (16), 8297(2021).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten