Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Мышиная модель гипертрофии правого желудочка, вызванной перегрузкой давлением, и неудачи из-за бандажирования легочного ствола
В этой статье
Резюме
Мы описываем мышиную модель перегрузки давления в правом желудочке, вызванной бандажированием легочного ствола. В статью включены подробные протоколы интубации, хирургического вмешательства и фенотипирования методом эхокардиографии. Для интубации и хирургии используются изготовленные на заказ инструменты, что позволяет быстро и недорого воспроизвести модель.
Аннотация
Недостаточность правого желудочка (ПЖ), вызванная перегрузкой давлением, тесно связана с заболеваемостью и смертностью при ряде сердечно-сосудистых и легочных заболеваний. Патогенез неудачи ПЖ сложен и остается недостаточно изученным. Для определения новых терапевтических стратегий лечения неудачи ПЖ необходимы надежные и воспроизводимые животные модели. Модели бандажирования легочного ствола (ПТБ) завоевали популярность, так как функция ПЖ может быть оценена независимо от изменений в легочной сосудистой сети.
В данной работе мы представляем мышиную модель перегрузки давлением ПЖ, вызванной ПТБ у 5-недельных мышей. Модель может быть использована для индуцирования патологии ПЖ различной степени, начиная от легкой гипертрофии ПЖ и заканчивая декомпенсированной неудачей ПЖ. В статью включены подробные протоколы интубации, хирургии ПТБ и фенотипирования методом эхокардиографии. Кроме того, даны инструкции по настройке инструментов для интубации и хирургии PTB, что позволяет быстро и недорого воспроизвести модель PTB.
Титановые лигирующие клипсы были использованы для сужения легочного ствола, обеспечивая высокую воспроизводимую и независимую от оператора степень сужения легочного ствола. Степень тяжести ПТБ оценивали с помощью различных диаметров внутренних лигирующих зажимов (легкий: 450 мкм и тяжелый: 250 мкм). Это приводило к патологии ПЖ от гипертрофии с сохраненной функцией ПЖ до декомпенсированной недостаточности ПЖ со сниженным сердечным выбросом и экстракардиальными проявлениями. Функция ПЖ оценивалась с помощью эхокардиографии через 1 неделю и 3 недели после операции. Примеры эхокардиографических изображений и результаты представлены здесь. Кроме того, представлены результаты катетеризации правых отделов сердца и гистологических анализов сердечной ткани.
Введение
Правожелудочковая недостаточность (ПЖ) — клинический синдром с симптомами сердечной недостаточности и признаками системного застоя, возникающего в результате дисфункции ПЖ1. Дисфункция ПЖ тесно связана с заболеваемостью и смертностью при ряде сердечно-сосудистых и легочных заболеваний2. Этиология дисфункции ПЖ сложна, и лежащие в ее основе сигнальные пути и регуляция остаются недостаточно выясненными.
Наблюдения, полученные в ходе современных методов лечения, показывают, что улучшение функции ПЖ тесно коррелирует со снижением постнагрузки, что позволяет предположить, что легочная сосудистая сеть является основной целью лечения3. Это указывает на то, что современные методы лечения оказывают лишь минимальное прямое влияние на функцию ПЖ, которая может ухудшиться даже после улучшения легочногососудистого сопротивления. Таким образом, крайне необходимы дальнейшие исследования по улучшению функции дома на колесах независимо от снижения последующей нагрузки.
Надежные и воспроизводимые животные модели имеют важное значение при поиске новых терапевтических агентов. В большинстве моделей хронической недостаточности ПЖ основной причиной является легочная гипертензия, вызванная структурными изменениями легочной сосудистой сети 4,5,6. Хорошо охарактеризованные модели включают модель хронической гипоксии 7,8, модель гипоксииСугэна 9,10,11 и модель монокроталина12,13. Поскольку неудача ПЖ является вторичной по отношению к легочной гипертензии в этих моделях, невозможно дифференцировать влияние вмешательств на легочную сосудистую сеть от прямого воздействия на ПЖ6.
Для изучения ПЖ независимо от легочной сосудистой сети модель бандажирования легочного ствола (ПТБ) приобрела популярность и была описана на нескольких видах животных, включая мышей, крыс, кроликов, собак, овец и свиней 6,14,15,16,17,18,19,20,21,22,23, 24,25,26,27. В моделях ПТБ сужение легочного ствола достигается хирургическим путем, что приводит к повышению давления ПЖ6. Существуют различные подходы к применению ПТБ, в том числе сужение сосуда лигатурой или металлическим лигирующим зажимом18,28. В моделях, использующих лигатуры, легочный ствол привязывают к игле, а иглу отводят назад, оставляя лигатуру на месте. Это приводит к сужению сосуда, которое зависит от размера иглы и натяжения узла18,29. В моделях с металлическими лигирующими зажимами степень сужения легочного ствола может быть более воспроизводимой. Модифицированные аппликаторы лигирующих зажимов используются для закрытия лигирующих зажимов до заданного и постоянного диаметра. Это делает метод независимым от оператора и снижает вариабельность, связанную с ПТБ, в фенотипезаболевания 15,27,28.
Было показано, что мышиные модели PTB индуцируют гипертрофию и неудачу ПЖ18,28. Одной из основных проблем при использовании модели ПТБ является выбор подходящего диаметра ПТБ для достижения желаемой степени патологии ПЖ. Это особенно сложно при попытке смоделировать декомпенсированный отказ автофургона. Для этого сужение должно быть достаточно плотным, чтобы вызвать хроническую недостаточность ПЖ, не приводя к острой недостаточности ПЖ и смерти вскоре после операции6. Одним из подходов к решению этой проблемы является использование отъемышей или молодых животных 6,15. Модель PTB была успешно использована для изучения различных стадий отказа ПЖ с использованием отъемышей крыс Wistar15,30. Для этого молодым крысам с остаточным потенциалом роста проводили операцию ПТБ с применением титановых лигирующих клипс. По мере роста крыс стеноз легочной артерии постепенно становился более тяжелым и приводил к гипертрофии ПЖ или хронической недостаточности ПЖ, в зависимости от тяжести ПТБ15,30. Вдохновленные этой моделью, мы предположили, что различные стадии патологии ПЖ могут быть продуцированы в мышиной модели ПТБ с использованием молодых мышей. Изучение широкого спектра патологии ПЖ от легкого до тяжелого заболевания может помочь пролить свет на наше понимание прогрессирования заболевания и перехода от гипертрофии ПЖ к недостаточности ПЖ.
В данной работе мы представляем мышиную модель перегрузки давлением ПЖ, вызванной ПТБ у молодых мышей. С помощью этой модели можно продуцировать патологию ПЖ различной степени, начиная от гипертрофии ПЖ и заканчивая декомпенсированной неудачей ПЖ. Это исследование включает в себя подробные протоколы интубации, хирургии ПТБ и фенотипирования с помощью эхокардиографии.
протокол
Исследование было одобрено Датской инспекцией по экспериментам на животных (номер разрешения: 2021-15-0201-00928) и проводилось в соответствии с национальным законодательством о лабораторных животных. В этом исследовании участвовали 5-недельные самцы мышей C57BL/6N.
1. Кастомизация инструментов для интубации и хирургии (Рисунок 1)
ПРИМЕЧАНИЕ: В этом разделе подробно описаны наиболее важные этапы подготовки индивидуальных инструментов для интубации и хирургии ПТБ из недорогих и легкодоступных материалов.
- Подготовьте эндотрахеальную трубку (рисунок 1A).
Для интубации и вентиляции мышей можно использовать обычные внутривенные (ВВ) катетеры.- Выберите подходящий размер внутрисосудистого катетера, соответствующий размеру мышей. Катетер 22G рекомендуется для мышей в возрасте 5 недель (17-20 г) и катетер 23G для более крупных мышей (>20 г).
- Вытащите иглу и отсоедините стопорный механизм. Введите иглу обратно в катетер и разрежьте кончик иглы под углом 45°, примерно в 2 мм от кончика катетера.
- Используйте наждачную бумагу, чтобы затупить кончик, чтобы предотвратить травмирование голосовых связок мышей.
- Отрежьте одно крыло катетера для лучшего обзора во время интубации.
- Подготовьте грудной ретрактор (рисунок 1B).
- С помощью иглодержателя согните кусок гибкой металлической проволоки размером примерно 10 см посередине под углом 30°.
- С помощью иглодержателя аккуратно создайте атравматичные крючки шириной 5 мм на обоих концах проволоки.
- Подготовьте стойку для интубации (рисунок 1В).
ПРИМЕЧАНИЕ: Использование интубационного стенда обеспечивает непрерывную доставку анестезии через носовую трубку во время интубации. Это позволяет проводить контролируемую и безопасную интубацию под визуальным контролем, что снижает риск травмирования голосовых связок и трахеи, а также риск неправильного размещения трубки в пищеводе. В качестве каркаса для стенда для интубации можно использовать любую металлическую или пластиковую раму. В этом исследовании использовался слегка изогнутый кухонный держатель.- Отрежьте кусок резиновой трубки длиной 3 см, который подходит к морде мыши, и подсоедините его к клапану внутривенного катетера. Ингалянтная анестезия может быть подключена через клапан до интубации.
- Сделайте петлю с помощью плетеного шва 1-0 примерно в 5 мм от отверстия трубки. Это будет использоваться для закрепления мышиной морды в трубке.
- Вырежьте отверстие в верхней части гибкого пластикового листа и поместите трубку в отверстие. Лист используется для поддержки мыши в стойке для интубации.
- Используйте ленту, чтобы скрепить отдельные детали вместе, как показано на рисунке 1C.
- Подготовьте направляющую канюлю (рис. 1D, E).
- Протяните монофиламентный шов 6-0 через тупую канюлю 27G и завяжите узел на шве. Используйте этот узел позже, чтобы захватить шов во время операции PTB.
- С помощью иглодержателя согнуть кончик канюли под углом 80°.
- Подготовьте аппликатор для лигирующего зажима.
ПРИМЕЧАНИЕ: Аппликатор лигирующего зажима с наклонными губками модифицирован с помощью регулируемого стопорного механизма (Рисунок 1F), который останавливает сжатие лигирующего зажима, когда губки находятся на точно заданном расстоянии друг от друга. Модифицированный аппликатор лигирующих клипс используется для наложения титановых лигирующих клипс на легочный ствол.- Прикрепите специально вырезанный кусок латуни к ручкам аппликатора лигирующего зажима с помощью двух винтов. Установите в центр регулируемый винт (Рисунок 1F, белая стрелка), который определяет точное расстояние между сжатыми ручками аппликатора лигирующего зажима, которое соответствует точному расстоянию между губками.

Рисунок 1: Инструменты для интубации и хирургии ПТБ. (A) Эндотрахеальная трубка, изготовленная из внутривенного катетера. (B) Грудной ретрактор. (C) Стойка для интубации и мышь, помещенные в стойку для интубации, получают анестезию через носовую трубку. (D) Хирургические инструменты и модифицированный аппликатор лигирующего зажима, используемые для хирургии ПТБ. (E) Направляющая канюля. (F) Изготовленный на заказ регулируемый стопорный механизм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Регулировка аппликатора лигирующего зажима
- Выбирайте внутренний диаметр лигирующего зажима в зависимости от желаемой степени повреждения ПЖ. Для 5-недельных самцов мышей C57BL/6N (17-20 г) используйте диаметр зажима 250 мкм для тяжелой и 450 мкм для легкой перегрузки давлением ПЖ. Используйте промежуточные диаметры зажимов, чтобы вызвать умеренную перегрузку давлением.
- С помощью металлической проволоки или игл отрегулируйте аппликатор лигирующего зажима. Убедитесь, что диаметр провода соответствует нужному диаметру зажима.
- Загрузите аппликатор зажима лигирующим зажимом и поместите регулировочную проволоку в центр лигирующего зажима. Сжимая аппликатор клипсы, поворачивайте винт до тех пор, пока губки клипсы плотно не прилегают к проволоке. Убедитесь, что зажим остается на месте на регулировочном проводе после того, как аппликатор зажима будет отпущен.
- Отрегулировав аппликатор зажимов, поместите еще один лигирующий зажим на регулировочную проволоку, чтобы проверить заданный диаметр.
3. Подготовка к операции
- Индуцировать анестезию в индукционной камере с использованием 7% севофлурана в дозе 0,6 л/мин 100% кислорода. Перед интубацией подтвердите достаточную анестезию, ущипнув палец ноги.
ПРИМЕЧАНИЕ: Также можно использовать изофлуран. Имейте в виду, что следует использовать разные концентрации. - Интубируйте мышь с помощью внутривенного катетера 22G. Выполняйте интубацию под визуальным контролем с использованием хирургического микроскопа и интубационной стойки, обеспечивающей правильное выравнивание для визуализации голосовых связок и непрерывной доставки ингаляционных анестетиков через носовую трубку (Рисунок 1C).
- Проветрите мышь со скоростью 175 движений/мин и дыхательным объемом 300 мкл/ход.
ПРИМЕЧАНИЕ: Также рекомендуется дыхательный объем 8-10 μл/г, а идеальный дыхательный объем зависит от возможной утечки и мертвого пространства в системе вентиляции. - Поместите интубированную мышь на закрытую грелку (37 °C) и нанесите увлажняющую мазь на глаза мыши.
- Поддерживайте анестезию (3,5% севофлуран в дозе 0,6 л/мин 100% кислорода) и вводите 0,1 мг/кг бупренорфина и 5 мг/кг карпрофена подкожно для периоперационной анальгезии. Удалите все волосы с груди с помощью крема для депиляции и продезинфицируйте кожу дезинфицирующими салфетками.
4. Хирургия ПТБ
- Сделайте разрез 10 мм на коже над вторым межреберьем от грудного угла до левой передней подмышечной линии. Расщепите большую и малую грудные мышцы путем тупого рассечения.
- Разрежьте межреберные мышцы во втором межреберье и тупо рассеките тимус, чтобы обнажить сердце, легочный ствол и аорту. Поместите грудной ретрактор в межреберье, чтобы обеспечить доступность операционного поля.
ПРИМЕЧАНИЕ: При разрезании межреберных мышц необходимо соблюдать большую осторожность, так как левая внутренняя молочная артерия проходит всего в 1-2 мм латерально от грудины. Повреждение этой артерии может привести к значительной кровопотере. - Отделите легочный ствол от восходящей аорты, тупым путем удалив соединительную ткань между сосудами с помощью микроскопических щипцов. Улучшите обнажение легочного ствола еще больше, вращая нижнюю часть тела мыши (левая нога над правой ногой).
- Пропустите направляющую канюлю через поперечный перикардиальный синус сзади легочного ствола. С помощью щипцов захватите узел на кончике направляющей канюли и протяните шов через направляющую канюлю. Осторожно удалите направляющую канюлю, пока шов остается на месте вокруг легочного ствола.
- Загрузите аппликатор лигирующего зажима и с помощью шва направьте легочный ствол в губки лигирующего зажима и сожмите зажим. Сразу после установки клипсы снимите шов и наблюдайте за наполнением легочного ствола.
ПРИМЕЧАНИЕ: Брадикардия может наблюдаться в первые несколько секунд после наложения лигирующего клипсы. - Наложите рассасывающийся шов из мононити 6-0 вокруг второй и третьей костей и закройте межреберье. Удалите как можно больше воздуха из грудной полости, оказывая легкое давление на грудную клетку при затягивании шва.
- Наконец, зашите кожу рассасывающимся швом из мононити 6-0.
- Выполните ту же процедуру, за исключением установки лигирующего зажима (шаг 4.5), во время фиктивной операции.
5. Эхокардиография
- После индукции анестезии в индукционной камере (1-2 мин, 6% севофлуран в 100% кислороде) поддерживают анестезию с помощью носовой трубки (3,5% севофлуран в 100% кислороде). Удалите все волосы с груди и живота с помощью крема для депиляции и поместите мышь на грелку. Нанесите увлажняющую мазь на глаза и ультразвуковой гель на грудь мыши.
ПРИМЕЧАНИЕ: Отрегулируйте 2D-усиление, глубину фокусировки и глубину изображения для улучшения качества изображения во всех эхокардиографических измерениях. - Отрегулируйте ультразвуковой датчик, чтобы найти вид по парастернальной длинной оси (PLAX) (Рисунок 2). При использовании PLAX измерьте внутренний диаметр легочного ствола и интеграл скорости по времени (VTI) в легочном стволе.
- Выберите B-режим и осторожно переместите грелку по осям X, Y и Z, чтобы определить легочный ствол в центре изображения. Используйте цвет для определения наибольшего диаметра легочного ствола. Используйте киномагазин , чтобы зафиксировать последовательность измерения диаметра легочного ствола.
- Выберите цвет и пульсовую волну (ПВ) допплера и поместите курсор в центр легочного ствола. Регулируйте угол PW до тех пор, пока пунктирные линии не станут параллельны кровотоку в сосуде.
- Нажмите на кино для измерения ВТИ. Поместите курсор рядом с обеими стенками легочного ствола и снова нажмите на кинохранилище , чтобы получить поток у стенки сосуда.
ПРИМЕЧАНИЕ: Внутренний диаметр правого желудочка (ПЖ) и толщина свободной стенки ПЖ также могут быть оценены в виде PLAX.
- Найдите изображение парастернальной короткой оси (PSAX) (рис. 3) для измерения внутренних диаметров левого желудочка (ЛЖ), которое можно использовать для оценки выпячивания перегородки (D-конфигурация).
- Выберите B-режим и поверните щуп на 90° против часовой стрелки. Наклоните зонд на 20-30 градусов в сторону, чтобы избежать затенения RV грудиной, и наклоните зонд на 20-30 градусов краниально, пока левый желудочек не станет максимально круглым. Затем сдвиньте зонд в краниокаудальном направлении, чтобы определить уровень папиллярных мышц с наибольшим диаметром желудочков и нажмите на кинохранилище.
ПРИМЕЧАНИЕ: PSAX на среднепапиллярном уровне также может быть использован для оценки изменения фракционной площади ПЖ. PSAX на уровне аортального клапана может быть использован для измерения фракционного укорочения ПЖ или толщины свободной стенки ПЖ.
- Выберите B-режим и поверните щуп на 90° против часовой стрелки. Наклоните зонд на 20-30 градусов в сторону, чтобы избежать затенения RV грудиной, и наклоните зонд на 20-30 градусов краниально, пока левый желудочек не станет максимально круглым. Затем сдвиньте зонд в краниокаудальном направлении, чтобы определить уровень папиллярных мышц с наибольшим диаметром желудочков и нажмите на кинохранилище.
- Используйте апикальный 4-камерный (A4CH) вид (рис. 4) для измерения систолической экскурсии в трикуспидальной кольцевой плоскости (TAPSE) и оценки трикуспидальной регургитации.
- Расположите щуп, как показано на рисунке 4. После того, как сердце будет определено, внесите небольшие коррективы в зонд, используя только запястье и пальцы, чтобы определить все четыре камеры сердца и трехстворчатый клапан.
- Определение и поддержание хорошего обзора A4CH является сложной задачей. Для устойчивости положите руку с зондом на грелку. Сдвиньте, наклоните и слегка поверните щуп, пока не будет найдено подходящее изображение.
- Перемещайте зонд только в одном измерении за раз: например, скользите краниокаудально, чтобы найти сердце, затем наклоните зонд, чтобы определить все четыре камеры, и, наконец, поворачивайте зонд до тех пор, пока все четыре камеры и трехстворчатый клапан не окажутся в кадре. При необходимости повторите все три шага несколько раз до получения идеального изображения.
- После того, как трикуспидальный клапан будет идентифицирован, выберите М-режим и поместите пунктирную линию в трикуспидальное кольцо свободной стенки. Нажмите кнопку cine store , чтобы сохранить измерения.
- Выберите цвет для оценки трикуспидального клапана на предмет регургитации. Если присутствует регургитация, в систоле будет наблюдаться струя ретроградного потока из ПЖ в правое предсердие (РА) (рис. 5).
ПРИМЕЧАНИЕ: В представлении A4CH также можно измерить тканевый допплер в свободной стенке RV и скорость притока RV.
- Расположите щуп, как показано на рисунке 4. После того, как сердце будет определено, внесите небольшие коррективы в зонд, используя только запястье и пальцы, чтобы определить все четыре камеры сердца и трехстворчатый клапан.
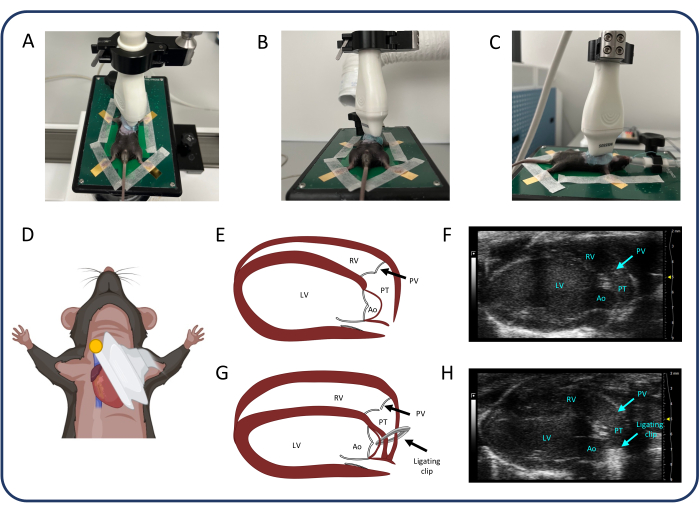
Иллюстрация 2: Парастернальный вид по длинной оси (PLAX). (A-D) Позиционирование ультразвукового датчика. (Д, Е) Нормальное мышиное сердце у ПЛАКС. (Г, Ч) Дилатация и гипертрофия ПЖ после ПТБ. Сокращения: ЛЖ: левый желудочек, ПЖ: правый желудочек, ПВ: легочный клапан, ПТ: легочный ствол, Ао: аорта. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
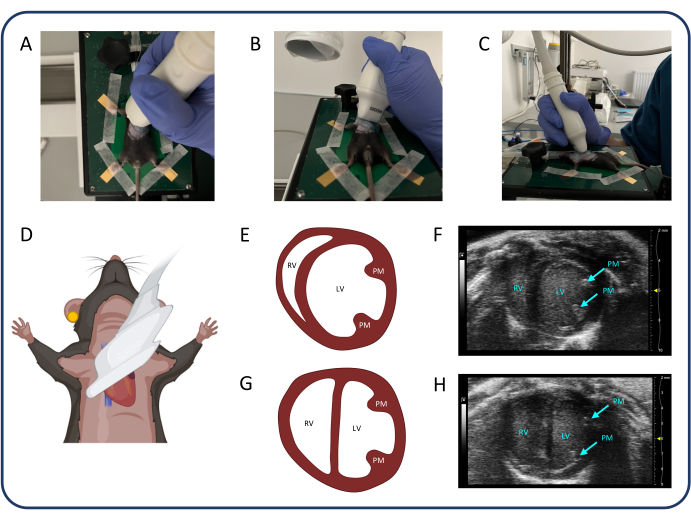
Рисунок 3: Парастернальный вид по короткой оси (PSAX). (A-D) Позиционирование ультразвукового датчика. (Е, Ж) Нормальное мышиное сердце у PSAX. (Г, Ч) PSAX после ПТБ. Сокращения: ЛЖ: левый желудочек, ПЖ: правый желудочек, ПМ: сосочковая мышца. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
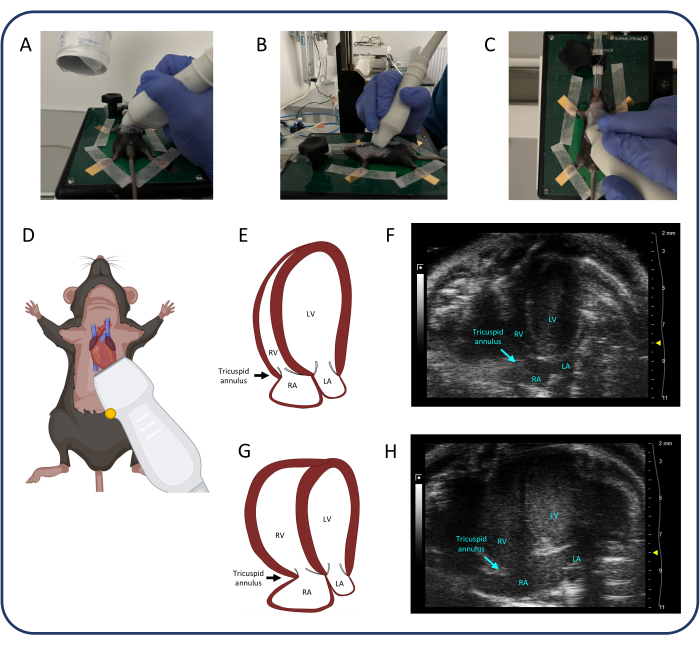
Рисунок 4: Апикальный 4-камерный вид (A4CH). (A-D) Позиционирование ультразвукового зонда. (Д, F) Нормальное мышиное сердце в проекции A4CH. (Г, Ч) Дилатация ПЖ и РА после ПТБ. Сокращения: ЛЖ: левый желудочек, ПЖ: правый желудочек, РА: правое предсердие, ЛА: левое предсердие. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
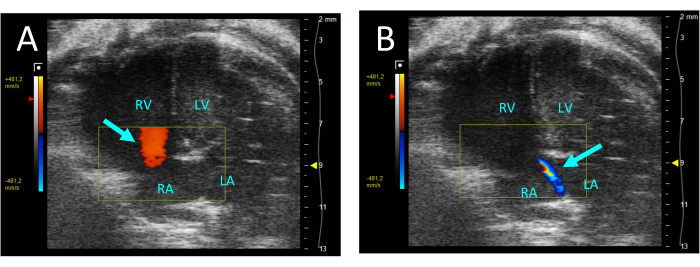
Рисунок 5: Трикуспидальная регургитация, визуализированная с помощью цветного допплера в проекции A4CH. (A) При диастоле наблюдается поток от РА к ПЖ (стрелка). (В) Во время систолы видна тонкая струя потока от ПЖ к РА (стрелка). Сокращения: ЛЖ: левый желудочек, ПЖ: правый желудочек, РА: правое предсердие, ЛА: левое предсердие. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
6. Анализ данных
- Измерьте диаметр легочного ствола в течение трех сердечных циклов при PLAX и используйте средний диаметр легочного ствола для дальнейшего анализа данных. Измерьте VTI в трех сердечных циклах в PLAX для каждой из трех сохраненных кинопетель (в центре легочного ствола и возле стенок сосуда). Для дальнейшего анализа используйте среднее значение VTI для всех измерений VTI. Используйте следующую формулу для расчета CO:
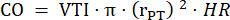
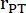 : лучевая кость легочного ствола, HR: частота сердечных сокращений
: лучевая кость легочного ствола, HR: частота сердечных сокращений - Измерьте LVEI при PSAX на среднепапиллярном уровне. С помощью измерительного прибора измерьте наибольший внутренний диаметр LV (LVid1) от середины перегородки до свободной стенки. Затем измерьте внутренний диаметр LV ортогонально первому измерению (LVid2). Повторите эти измерения в трех сердечных циклах и рассчитайте ИМЖ, используя средние внутренние диаметры ЛЖ и следующую формулу:
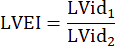
- Измерьте TAPSE в трех сердечных циклах в представлении A4CH и используйте среднее значение TAPSE для дальнейшего анализа данных.
7. Катетеризация правых отделов сердца
- Измерьте давление и объем правого желудочка (ПЖ) с помощью катетеризации правых отделов сердца с помощью катетера с микронаконечником 1,4F через 3 недели после операции ПТБ.
- Обезболите и интубируйте мышь, как описано в шагах 3.1-3.4. Поместите мышь на крытую грелку (37 °C) и поддерживайте анестезию (3,5% севофлуран в 0,6 л/мин 100% кислорода).
- Введите 2000 МЕ гепарина (внутримышечно [в/м]) и 0,5 мл NaCl (подкожно [подкожно]).
- С помощью хирургических ножниц разрежьте брюшную стенку как раз каудально к мечевидному отростку и получите доступ к грудной полости, аккуратно разрезав диафрагму по ее разрезу в грудной стенке. Разрежьте диафрагму и косты до тех пор, пока не будет получен достаточный доступ к сердцу.
- Наложите лигатуру вокруг нижней полой вены. Используйте его для окклюзии сосуда, чтобы уменьшить предварительную нагрузку для записи измерений давления и объема позже в протоколе.
- С помощью иглы 26G осторожно проткните небольшое отверстие в доме на колесах. Убедитесь, что оно находится как можно ближе к вершине, и игла не проникает в желудочек полностью, а просто действует как направляющая для введения проводящего катетера. Если произошло кровотечение, слегка надавите на него небольшим ватным тампоном, чтобы свести к минимуму кровопотерю.
- Определите небольшое отверстие в стенке желудочка и введите катетер, проникнув в ткани.
ПРИМЕЧАНИЕ: При установке катетера будьте осторожны, чтобы не повредить внутреннюю стенку желудочка. - Изменения давления в правом желудочке (ПВД) часто наблюдаются в течение нескольких минут после введения катетера. Подождите, пока RVP стабилизируется, чтобы получить репрезентативные измерения в стационарном режиме.
- Чтобы получить петли давления-объема, используйте лигатуру, предварительно размещенную вокруг нижней полой вены. Осторожно потяните за лигатуру, чтобы окклюзировать сосуд, тем самым постепенно снижая преднагрузку.
- После того, как будут записаны репрезентативные петли давления-объема, извлеките катетер и усыпьте мышь путем иссечения сердца. В это время собирают образцы крови и тканей для дальнейшего анализа.
Результаты
Мыши C57BL/6N (самцы, 5 недель, 17-20 г) были рандомизированы либо для тяжелой формы ТЧБ (sPTB, 250 μm, n = 12), либо для легкой формы PTB (mPTB, 450 μm, n = 9) или фиктивной хирургии (smock, n = 15). Оценка сердечной функции проводилась методом эхокардиографии через 1 неделю и 3 недели после операции. Катетеризация правых...
Обсуждение
В данной работе мы представляем мышиную модель гипертрофии и отказа ПЖ, вызванной перегрузкой давлением. Мы демонстрируем, что: (i) ПТБ у молодых мышей может вызывать различные степени патологии ПЖ, начиная от легкой гипертрофии ПЖ до недостаточности ПЖ с экстракардиальными признаками ?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Snedkermester Sophus Jacobsen og Hustru Astrid Jacobsens Fond, Helge Peetz og Verner Peetz og hustru Vilma Peetz Legat, Grosserer A.V. Lykfeldt og Hustrus Legat. Кроме того, авторы хотели бы выразить признательность персоналу животноводческих помещений на факультете клинической медицины Орхусского университета за их поддержку во время выполнения экспериментальной работы.
Материалы
| Name | Company | Catalog Number | Comments |
| Biosyn 6-0, monofilament, absorbable suture | Covidien | UM-986 | |
| Blunt cannula, 27G 0.4x0.25, | Sterican | 292832 | |
| Bupaq Multidose vet 0,3 mg/ml (Buprenorphinum) | Salfarm Danmark | VNR 472318 | |
| C57BL/6NTac mice | Taconic Biosciences | C57BL/6NTac | |
| Dagrofil 1, braided, non-absorbable suture | B Braun | C0842273 | |
| Depilatory cream | Veet | 3132000 | |
| Disinfection Swabs (82% Ethanol + 0.5% Chlorhexidine) | Mediq | 3340122 | |
| Disposable scalpels, size 11 | Swann-Morton | 11708353 | |
| Dräger Vapor 2000 Sevoflurane | Dräger | M35054 | |
| Eye oinment neutral, "Ophta" | Actavis | MTnr.: 07586 Vnr: 53 96 68 | |
| Horizon ligating clips | Teleflex Medical | 5200 (IPN914931) | |
| Horizon Open Ligating Clips applier, curved, 6" (15 cm) | Teleflex Medical | 537061 | |
| Kitchen roll holder | n.a. | n.a. | |
| Metal wire of different thickness | n.a. | n.a. | |
| Microsurgical instruments set | Thompson | n.a. | |
| MiniVent Ventilator | Hugo Sachs | Type 845 | |
| MS505S transducer | Visual sonics | n.a. | |
| Rimadyl Bovis vet. 50 mg/ml (Carprofen) | Zoetis | MTnr: 34547, Vnr: 10 27 99, | |
| Sevoflurane Baxter 100 % | Baxter Medical | MTnr: 35015 | |
| Silicone tubing | n.a. | n.a. | |
| Soft plastic sheet | n.a. | n.a. | |
| Stereomicroscope, "Opmi Pico" | Carl Zeiss Surgicals GmbH | n.a. | |
| Ultrasonic probe holder/rail | Visual Sonics | 11277 | |
| Varming plate | Visual sonics | 11437 | |
| Venflon ProSafety, 22G, 0,9 x 25mm | Becton Dickinson | 393222 |
Ссылки
- Voelkel, N. F., et al. Right ventricular function and failure: Report of a national heart, lung, and blood institute working group on cellular and molecular mechanisms of right heart failure. Circulation. 114 (17), 1883-1891 (2006).
- Haddad, F., Doyle, R., Murphy, D. J., Hunt, S. A. Right ventricular function in cardiovascular disease, part ii: Pathophysiology, clinical importance, and management of right ventricular failure. Circulation. 117 (13), 1717-1731 (2008).
- Van De Veerdonk, M. C., et al. Progressive right ventricular dysfunction in patients with pulmonary arterial hypertension responding to therapy. J Am Coll Cardiol. 58 (24), 2511-2519 (2011).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: Problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: The evolution of animal models in pulmonary hypertension research; are we there yet. Pulm Circ. 3 (4), 739-756 (2013).
- Andersen, A., et al. Animal models of right heart failure. Cardiovasc Diagn Ther. 10 (5), 1561-1579 (2020).
- Voelkel, N. F., Tuder, R. M. Hypoxia-induced pulmonary vascular remodeling: A model for what human disease. J Clin Invest. 106 (6), 733-738 (2000).
- Rabinovitch, M., Gamble, W., Nadas, A. S., Miettinen, O. S., Reid, L. Rat pulmonary circulation after chronic hypoxia: Hemodynamic and structural features. Am J Physiol. 236 (6), H818-H827 (1979).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. Faseb j. 15 (2), 427-438 (2001).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. Am J Respir Crit Care Med. 184 (10), 1171-1182 (2011).
- Nicolls, M. R., et al. New models of pulmonary hypertension based on VEGF receptor blockade-induced endothelial cell apoptosis. Pulm Circ. 2 (4), 434-442 (2012).
- Hessel, M. H., Steendijk, P., Den Adel, B., Schutte, C. I., Van Der Laarse, A. Characterization of right ventricular function after monocrotaline-induced pulmonary hypertension in the intact rat. Am J Physiol Heart Circ Physiol. 291 (5), H2424-H2430 (2006).
- Gomez-Arroyo, J. G., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Janssen, W., et al. 5-ht2b receptor antagonists inhibit fibrosis and protect from RV heart failure. Biomed Res Int. 2015, 438403 (2015).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050 (2018).
- Axelsen, J. B., et al. Effects of 6-mercaptopurine in pressure overload induced right heart failure. PLoS One. 14 (11), e0225122 (2019).
- Egemnazarov, B., et al. Pressure overload creates right ventricular diastolic dysfunction in a mouse model: Assessment by echocardiography. J Am Soc Echocardiogr. 28 (7), 828-843 (2015).
- Wang, Q., et al. Induction of right ventricular failure by pulmonary artery constriction and evaluation of right ventricular function in mice. J Vis Exp. (147), e59431 (2019).
- Kojonazarov, B., et al. The peroxisome proliferator-activated receptor β/δ agonist gw0742 has direct protective effects on right heart hypertrophy. Pulm Circ. 3 (4), 926-935 (2013).
- Kojonazarov, B., et al. P38 MAPK inhibition improves heart function in pressure-loaded right ventricular hypertrophy. Am J Respir Cell Mol Biol. 57 (5), 603-614 (2017).
- Rai, N., et al. Effect of Riociguat and Sildenafil on right heart remodeling and function in pressure overload induced model of pulmonary arterial banding. Biomed Res Int. 2018, 3293584 (2018).
- Sydykov, A., et al. Genetic deficiency and pharmacological stabilization of mast cells ameliorate pressure overload-induced maladaptive right ventricular remodeling in mice. Int J Mol Sci. 21 (23), 9099 (2020).
- Andersen, S., et al. Effects of combined angiotensin ii receptor antagonism and neprilysin inhibition in experimental pulmonary hypertension and right ventricular failure. Int J Cardiol. 293, 203-210 (2019).
- Andersen, S., et al. Pressure overload induced right ventricular remodeling is not attenuated by the anti-fibrotic agent pirfenidone. Pulm Circ. 9 (2), 2045894019848659 (2019).
- Labazi, H., et al. Sex-dependent changes in right ventricular gene expression in response to pressure overload in a rat model of pulmonary trunk banding. Biomedicines. 8 (10), 430 (2020).
- Sun, X. Q., et al. Increased mao-a activity promotes progression of pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 64 (3), 331-343 (2021).
- Axelsen, J. S., et al. Effects of Empagliflozin on right ventricular adaptation to pressure overload. Front Cardiovasc Med. 10, 1302265 (2023).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660 (2023).
- Boehm, M., et al. Delineating the molecular and histological events that govern right ventricular recovery using a novel mouse model of pulmonary artery de-banding. Cardiovasc Res. 116 (10), 1700-1709 (2020).
- Andersen, S., et al. Effects of bisoprolol and losartan treatment in the hypertrophic and failing right heart. J Card Fail. 20 (11), 864-873 (2014).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210 (2015).
- Vildbrad, M. D., et al. Limitations and pitfalls in measurements of right ventricular stroke volume in an animal model of right heart failure. Physiol Meas. 36 (5), 925-937 (2015).
- Boehm, M., et al. Maintained right ventricular pressure overload induces ventricular-arterial decoupling in mice. Exp Physiol. 102 (2), 180-189 (2017).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041 (2014).
- Luitel, H., et al. Pressure overload leads to an increased accumulation and activity of mast cells in the right ventricle. Physiol Rep. 5 (6), e13146 (2017).
- Mamazhakypov, A., et al. Novel therapeutic targets for the treatment of right ventricular remodeling: Insights from the pulmonary artery banding model. Int J Environ Res Public Health. 18 (16), 8297 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены