JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
압력 과부하로 인한 우심실 비대와 폐동맥 밴딩에 의한 실패의 Murine 모델
요약
우리는 폐동맥 밴딩에 의해 유발된 우심실 압력 과부하의 쥐 모델을 설명합니다. 삽관, 수술 및 심장 초음파에 의한 표현형에 대한 자세한 프로토콜이 논문에 포함되어 있습니다. 삽관 및 수술에는 맞춤형 기구가 사용되어 모델을 빠르고 저렴하게 복제할 수 있습니다.
초록
압력 과부하로 인한 우심실(RV) 부전은 여러 심혈관 및 폐 질환의 이환율 및 사망률과 밀접한 관련이 있습니다. RV 고장의 발병 기전은 복잡하며 충분히 이해되지 않고 있습니다. RV 고장 치료를 위한 새로운 치료 전략을 식별하려면 견고하고 재현 가능한 동물 모델이 필수적입니다. 폐동맥 밴딩(PTB) 모델은 RV 기능이 폐 혈관의 변화와 독립적으로 평가될 수 있기 때문에 인기를 얻고 있습니다.
이 논문에서는 5주 된 마우스에서 PTB에 의해 유도된 RV 압력 과부하의 쥐 모델을 제시합니다. 이 모델은 경미한 RV 비대에서 비보상 RV 고장에 이르기까지 다양한 수준의 RV 병리를 유도하는 데 사용할 수 있습니다. 삽관, PTB 수술 및 심장 초음파에 의한 표현형에 대한 자세한 프로토콜이 논문에 포함되어 있습니다. 또한 삽관 및 PTB 수술을 위한 기구를 맞춤화하는 방법에 대한 지침이 제공되어 PTB 모델을 빠르고 저렴하게 복제할 수 있습니다.
티타늄 결찰 클립을 사용하여 폐 줄기를 수축시켜 재현성이 높고 작업자와 무관한 폐 줄기 수축 정도를 보장했습니다. PTB의 중증도는 다양한 내부 결찰 클립 직경(경증: 450μm 및 중증: 250μm)을 사용하여 등급을 매겼습니다. 그 결과 RV 기능이 보존된 비대부터 심박출량 감소 및 심외 증상을 동반한 비대상성 RV 실패에 이르기까지 다양한 RV 병리학이 발생했습니다. RV 기능은 수술 후 1주 및 3주에 심장 초음파로 평가되었습니다. 심장 초음파 이미지 및 결과의 예가 여기에 나와 있습니다. 또한 우측 심장 카테터 삽입 및 심장 조직의 조직학적 분석 결과를 보여줍니다.
서문
우심실(RV) 부전은 심부전의 증상과 RV 기능 장애로 인한 전신 울혈의 징후를 가진 임상 증후군입니다 1. RV 기능 장애는 여러 심혈관 및 폐 질환의 이환율 및 사망률과 밀접한 관련이 있습니다2. RV 기능 장애의 원인은 복잡하며, 근본적인 신호 전달 경로와 조절은 여전히 충분히 밝혀지지 않았습니다.
현재 치료법의 관찰에 따르면 RV 기능 개선은 후부하 감소와 밀접한 관련이 있으며, 이는 폐혈관 구조를 주요 치료 목표로 제시한다3. 이는 현재의 치료법이 RV 기능에 미치는 직접적인 영향은 미미하며, 폐혈관 저항이 개선된 후에도 악화될 수 있음을 시사한다3. 따라서 후하중 감소와 무관하게 RV 기능을 개선하기 위한 추가 연구가 매우 필요합니다.
견고하고 재현 가능한 동물 모델은 새로운 치료제를 찾는 데 필수적입니다. 대부분의 만성 RV 부전 모델에서 근본적인 원인은 폐 혈관 구조의 구조적 변화에 의해 유발된 폐 고혈압입니다 4,5,6. 잘 특성화 된 모델에는 만성 저산소증 모델 7,8, Sugen-저산소증 모델 9,10,11 및 모노크로탈린 모델12,13이 포함됩니다. 이러한 모델에서 RV 실패는 폐고혈압에 이차적으로 발생하기 때문에 폐혈관 조직에 대한 중재의 효과를 RV6에 대한 직접적인 영향과 구별하는 것은 불가능하다.
RV를 폐혈관구조와 독립적으로 연구하기 위해, 폐간간선딩(PTB) 모델이 인기를 얻고 있으며, 마우스, 랫트, 토끼, 개, 양, 및 돼지를 포함한 여러 동물 종에서 설명되었다 6,14,15,16,17,18,19,20,21,22,23, 24,25,26,27. PTB 모델에서는 폐 줄기의 수축이 외과적으로 이루어지며 RV 압력이 증가합니다6. PTB의 적용에 대한 다양한 접근 방식이 존재하며, 여기에는 합자 또는 금속 결찰 클립18,28을 사용한 용기의 수축이 포함됩니다. 합자를 사용하는 모델에서는 폐 줄기가 바늘에 묶여 있고 바늘이 수축되어 합자가 제자리에 남아 있습니다. 이로 인해 바늘 크기와 매듭18,29의 장력에 따라 혈관이 수축됩니다. 금속 결찰 클립을 사용하는 모델에서는 폐 몸통 수축 정도가 더 재현 가능할 수 있습니다. 수정된 결찰 클립 애플리어는 결찰 클립을 사전 정의되고 일정한 직경으로 닫는 데 사용됩니다. 이는 분석법을 운영자에 독립적으로 만들고 질병 표현형 15,27,28에서 PTB 관련 변동성을 줄입니다.
Murine PTB 모델은 RV 비대 및 고장을 유발하는 것으로 나타났습니다18,28. PTB 모델을 사용할 때 한 가지 주요 과제는 원하는 RV 병리학 정도를 달성하기 위해 적절한 PTB 직경을 선택하는 것입니다. 이는 비보상 RV 고장을 모델링하려고 할 때 특히 까다롭습니다. 이를 위해서는 수술 직후 급성 RV 고장 및 사망으로 이어지지 않으면서 만성 RV 고장을 유발할 수 있을 만큼 수축력이 충분히 단단해야 한다6. 이 문제를 해결하기 위한 한 가지 접근법은 젖을 뗀 새끼 또는 어린 동물을 사용하는 것이다 6,15. PTB 모델은 Wistar rat weanlings15,30을 사용하여 RV 실패의 여러 단계를 연구하는 데 성공적으로 사용되었습니다. 이를 위해 성장 잠재력이 남아 있는 어린 쥐는 티타늄 결찰 클립을 적용하여 PTB 수술을 받았습니다. 쥐가 성장함에 따라 폐 협착증은 점차 심해졌고 PTB15,30의 중증도에 따라 RV 비대 또는 만성 RV 실패를 초래했습니다. 이 모델에서 영감을 얻어 우리는 어린 쥐를 사용하여 쥐 PTB 모델에서 RV 병리학의 다양한 단계를 생성할 수 있다는 가설을 세웠습니다. 경증에서 중증 질환에 이르기까지 광범위한 RV 병리학을 연구하면 질병 진행과 RV 비대에서 RV 실패로의 전환에 대한 이해를 이해하는 데 도움이 될 수 있습니다.
여기에서는 어린 마우스에서 PTB에 의해 유도된 RV 압력 과부하의 쥐 모델을 제시합니다. 이 모델을 사용하면 RV 비대에서 비보상 RV 고장에 이르기까지 다양한 수준의 RV 병리학을 생성할 수 있습니다. 이 연구에는 삽관, PTB 수술 및 심장 초음파에 의한 표현형에 대한 자세한 프로토콜이 포함되어 있습니다.
프로토콜
이 연구는 덴마크 동물실험검사관(승인번호: 2021-15-0201-00928)의 승인을 받았으며 국가 실험동물법규에 따라 수행되었습니다. 이 연구는 5주 된 수컷 C57BL/6N 마우스를 사용했습니다.
1. 삽관 및 수술을 위한 기구의 맞춤화(그림 1)
참고: 이 섹션에서는 저렴하고 쉽게 구할 수 있는 재료로 삽관 및 PTB 수술을 위한 맞춤형 기구를 준비하는 가장 중요한 단계에 대해 자세히 설명합니다.
- 기관내관을 준비합니다(그림 1A).
일반적인 정맥 주사(IV) 카테터는 마우스의 삽관 및 환기에 사용할 수 있습니다.- 마우스의 크기에 맞는 적절한 크기의 혈관 내 카테터를 선택하십시오. 22G 카테터는 5주령 마우스(17-20g)에는 권장되며 23G 카테터는 더 큰 마우스(>20g)에 권장됩니다.
- 바늘을 빼내고 잠금 장치를 분리합니다. 바늘을 카테터에 다시 삽입하고 바늘 끝을 카테터 끝에서 약 45mm 떨어진 2° 각도로 자릅니다.
- 생쥐의 성대가 다치는 것을 방지하기 위해 사포를 사용하여 팁을 무디게 하십시오.
- 삽관 중 더 잘 볼 수 있도록 카테터의 한쪽 날개를 잘라냅니다.
- 흉부 견인기를 준비합니다(그림 1B).
- 바늘 홀더를 사용하여 가운데에 약 10cm의 유연한 금속 와이어 조각을 30° 각도로 구부립니다.
- 바늘 홀더를 사용하여 와이어의 양쪽 끝에 5mm 너비의 비외상성 고리를 조심스럽게 만듭니다.
- 삽관 스탠드를 준비합니다(그림 1C).
참고: 삽관 스탠드를 사용하면 삽관 중 비강관을 통해 마취를 지속적으로 전달할 수 있습니다. 이를 통해 육안 지도 하에 통제되고 안전한 삽관이 가능하여 성대와 기관의 부상 위험과 식도에 튜브가 잘못 배치될 위험을 줄일 수 있습니다. 모든 금속 또는 플라스틱 프레임을 삽관 스탠드의 프레임으로 사용할 수 있습니다. 이 연구에서는 약간 구부러진 주방 역할 홀더를 사용했습니다.- 쥐의 주둥이에 맞는 3cm 길이의 고무 튜브를 잘라 IV 카테터 밸브에 연결합니다. 흡입제 마취는 삽관 전에 밸브를 통해 연결할 수 있습니다.
- 튜브 입구에서 약 1mm 떨어진 곳에서 약 5mm 떨어진 곳에 1-0 꼰 봉합사를 사용하여 고리를 만듭니다. 이것은 튜브에 쥐 주둥이를 고정하는 데 사용됩니다.
- 유연한 플라스틱 시트의 상단 근처에 구멍을 뚫고 튜브를 구멍에 넣습니다. 시트는 삽관 스탠드에서 마우스를 지지하는 데 사용됩니다.
- 테이프를 사용하여 그림 1C와 같이 개별 부품을 함께 고정합니다.
- 가이드 캐뉼라를 준비합니다(그림 1D, E).
- 뭉툭한 6G 캐뉼라를 통해 0-27 모노필라멘트 봉합사를 당기고 봉합사에 매듭을 묶습니다. 나중에 PTB 수술 중 봉합사를 잡기 위해 이 매듭을 사용하십시오.
- 바늘 홀더를 사용하여 캐뉼라의 끝을 80° 각도로 구부립니다.
- 결찰 클립 애플리어를 준비합니다.
알림: 각진 턱이 있는 결찰 클립 애플리어는 조정 가능한 정지 메커니즘(그림 1F)으로 수정되어 턱이 서로 정확히 미리 결정된 거리에 있을 때 결찰 클립의 압축을 중지합니다. 수정된 결찰 클립 애플리어는 폐 몸통에 티타늄 결찰 클립을 적용하는 데 사용됩니다.- 두 개의 나사로 맞춤 절단된 황동 조각을 결찰 클립 애플리어의 손잡이에 고정합니다. 턱 사이의 정확한 거리에 해당하는 결찰 클립 애플리어의 압축 핸들 사이의 정확한 거리를 결정하는 조정 가능한 나사(그림 1F, 흰색 화살표)를 중앙에 장착합니다.

그림 1: 삽관 및 PTB 수술을 위한 기구. (A) IV 카테터로 만든 기관내관. (B) 흉부 견인기. (C) 삽관 스탠드와 삽관 스탠드에 놓인 마우스가 비강관에서 마취를 받고 있습니다. (D) PTB 수술에 사용되는 수술 기구 및 수정된 결찰 클립 부착기. (E) 안내 캐뉼라. (F) 맞춤형 조정 가능한 정지 메커니즘. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 결찰 클립 부착자의 조정
- 원하는 RV 고장 심각도에 따라 결찰 클립의 내경을 선택합니다. 5주 된 수컷 C57BL/6N 마우스(17-20g)의 경우 심한 경우 250μm, 경미한 RV 압력 과부하의 경우 450μm의 클립 직경을 사용합니다. 중간 클립 직경을 사용하여 적당한 압력 과부하를 유도하십시오.
- 금속 와이어나 바늘을 사용하여 결찰 클립 애플리어를 조정합니다. 와이어의 지름이 원하는 클립 지름과 일치하는지 확인하십시오.
- 클립 애플리어에 결찰 클립을 끼우고 조정 와이어를 결찰 클립의 중앙에 놓습니다. 클립 애플리어를 압축하는 동안 클립의 턱이 와이어 주위에 단단히 맞을 때까지 나사를 돌립니다. 클립 애플리어가 해제되면 클립이 조정 와이어의 제자리에 고정되어 있는지 확인합니다.
- 클립 애플리어를 조정한 상태에서 조정 와이어에 다른 결찰 클립을 놓아 설정 직경을 확인합니다.
3. 수술 준비
- 0.6L/min 100% 산소에 7% 세보플루란을 사용하여 유도 챔버에서 마취를 유도합니다. 삽관 전에 발가락을 꼬집어 충분한 마취를 확인하십시오.
참고: 이소플루란도 사용할 수 있습니다. 다른 농도를 사용해야 합니다. - 22G IV 카테터로 마우스를 삽관합니다. 수술용 현미경과 삽관 스탠드를 사용하여 육안 지도 하에 삽관을 수행하여 성대를 시각화하고 비강관에 흡입 마취제를 지속적으로 전달하기 위해 적절하게 정렬할 수 있습니다(그림 1C).
- 175 스트로크 / 분과 300 μL / 스트로크의 일회 호흡량으로 마우스를 환기시킵니다.
알림: 8-10 μL/g의 일회 호흡량도 권장되며 이상적인 일회 호흡량은 환기 시스템의 가능한 누출 및 사각 공간에 따라 다릅니다. - 삽관된 마우스를 덮개가 있는 가열 패드(37°C)에 놓고 마우스의 눈에 보습 연고를 바릅니다.
- 마취를 유지하고(0.6L/min 100% 산소에 3.5% 세보플루란) 수술 전후 진통을 위해 0.1mg/kg 부프레노르핀과 5mg/kg 카프로펜을 피하로 투여합니다. 제모 크림을 사용하여 가슴의 모든 머리카락을 제거하고 소독 물티슈로 피부를 소독합니다.
4. PTB 수술
- 흉골 각도에서 좌측 전방 겨드랑이 선까지 두 번째 늑간 공간 위의 피부를 10mm 절개합니다. 주요 가슴 근육과 작은 가슴 근육을 둔한 절개로 나눕니다.
- 두 번째 늑간 공간의 늑간 근육을 자르고 흉선을 뭉툭하게 절개하여 심장, 폐간, 대동맥을 노출시킵니다. 수술 부위에 접근할 수 있도록 늑간 공간에 흉부 견인기를 배치합니다.
참고: 늑간근을 절단할 때는 좌측 내유선동맥이 흉골에서 측면으로 1-2mm만 뻗어 있으므로 각별한 주의를 기울여야 합니다. 이 동맥을 손상시키면 상당한 출혈이 발생할 수 있습니다. - 미세한 집게를 사용하여 혈관 사이의 결합 조직을 뭉툭하게 제거하여 폐 줄기와 상행 대동맥을 분리합니다. 마우스의 하체(왼쪽 다리를 오른쪽 다리 위로)를 회전시켜 폐 줄기의 노출을 더욱 개선합니다.
- 유도 캐뉼라를 폐동맥 뒤쪽의 횡방향 심낭동을 통해 통과시킵니다. 겸자를 사용하여 안내 캐뉼라 끝의 매듭을 잡고 안내 캐뉼라를 통해 봉합사를 당깁니다. 봉합사가 폐 줄기 주위의 제자리에 유지되는 동안 유도 캐뉼라를 조심스럽게 제거합니다.
- 결찰 클립 애플리어를 장착하고 봉합사를 사용하여 폐 줄기를 결찰 클립의 턱으로 안내하고 클립을 압박합니다. 클립을 배치한 후 즉시 봉합사를 해제하고 폐 줄기가 채워지는 것을 관찰합니다.
알림: 서맥은 결찰 클립을 적용한 후 처음 몇 초 동안 관찰될 수 있습니다. - 두 번째와 세 번째 늑골 주위에 6-0 모노필라멘트 흡수성 봉합사를 놓고 늑간 공간을 닫습니다. 봉합사를 조이는 동안 가슴에 부드러운 압력을 가하여 흉강에서 가능한 한 많은 공기를 배출합니다.
- 마지막으로 6-0 모노필라멘트 흡수성 봉합사로 피부를 봉합합니다.
- 가짜 수술 중에 결찰 클립을 삽입하는 경우(4.5단계)를 제외하고 동일한 절차를 수행합니다.
5. 심장 초음파
- 유도 챔버에서 마취를 유도한 후(1-2분, 100% 산소에서 6% 세보플루란), 비강(100% 산소에서 3.5% 세보플루란)을 사용하여 마취를 유지합니다. 제모 크림을 사용하여 가슴과 복부의 모든 털을 제거하고 마우스를 가열 패드에 놓습니다. 눈에 보습 연고를 바르고 쥐의 가슴에 초음파 젤을 바릅니다.
알림: 2D 게인, 초점 심도 및 이미지 심도를 조정하여 모든 심초음파 측정에서 이미지 품질을 향상시킵니다. - 초음파 프로브를 조정하여 PLAX(parasternal long axis) 보기를 찾습니다(그림 2). PLAX에서 폐 줄기의 폐 줄기 내경과 VTI(Velocity Time Integral)를 측정합니다.
- B 모드를 선택하고 히팅 패드를 x, y, z축으로 조심스럽게 움직여 이미지 중앙의 폐 줄기를 식별합니다. 색상을 사용하여 가장 큰 폐 줄기 직경을 식별합니다. cine store를 사용하여 폐 줄기 직경을 측정하기 위한 시퀀스를 캡처합니다.
- 색상과 맥파(PW) 도플러를 선택하고 커서를 폐 몸통의 중앙에 놓습니다. 점선이 혈관의 혈류와 평행이 될 때까지 PW 각도를 조정합니다.
- cine store를 눌러 VTI를 측정합니다. 폐 몸통의 양쪽 벽 근처에 커서를 놓고 cine store를 다시 눌러 혈관 벽 근처의 흐름을 얻습니다.
참고: 우심실(RV) 내경 및 RV가 없는 벽 두께도 PLAX 보기에서 평가할 수 있습니다.
- 중격 돌출(D-configuration)을 평가하는 데 사용할 수 있는 좌심실(LV) 내경을 측정하기 위해 흉골 주위 단축(PSAX) 보기(그림 3)를 찾으십시오.
- B 모드를 선택하고 프로브를 시계 반대 방향으로 90° 돌립니다. 흉골에 의한 RV의 그림자를 피하기 위해 프로브를 측면으로 20-30도 각도를 맞추고 좌심실이 가능한 한 둥글게 될 때까지 프로브를 두개골로 20-30도 기울입니다. 그런 다음 프로브를 두개골 방향으로 밀어 심실 직경이 가장 큰 유두근의 높이를 확인하고 시네 스토어를 누릅니다.
참고: 유두 중앙의 PSAX는 RV 분수 면적 변화를 평가하는 데에도 사용할 수 있습니다. 대동맥 판막 수준의 PSAX는 RV 분수 단축 또는 RV 자유 벽 두께를 측정하는 데 사용할 수 있습니다.
- B 모드를 선택하고 프로브를 시계 반대 방향으로 90° 돌립니다. 흉골에 의한 RV의 그림자를 피하기 위해 프로브를 측면으로 20-30도 각도를 맞추고 좌심실이 가능한 한 둥글게 될 때까지 프로브를 두개골로 20-30도 기울입니다. 그런 다음 프로브를 두개골 방향으로 밀어 심실 직경이 가장 큰 유두근의 높이를 확인하고 시네 스토어를 누릅니다.
- 정점 4-챔버(A4CH) 보기(그림 4)를 사용하여 삼첨판 환형 평면 수축기 이탈(TAPSE)을 측정하고 삼첨판 역류를 평가합니다.
- 그림 4와 같이 프로브를 배치합니다. 심장이 확인되면 손목과 손가락만 사용하여 프로브를 약간 조정하여 심장의 4개 방과 삼첨판막을 모두 식별합니다.
- 좋은 A4CH 뷰를 식별하고 유지하는 것은 어려운 일입니다. 안정성을 위해 프로브 작동 손을 가열 패드에 올려 놓으십시오. 적절한 이미지를 찾을 때까지 프로브를 밀고, 기울이고, 약간 돌립니다.
- 프로브를 한 번에 한 차원으로만 움직입니다: 예를 들어, 두개골을 밀어 심장을 찾은 다음 프로브를 기울여 4개의 챔버를 모두 식별하고 마지막으로 4개의 챔버와 삼첨판막이 모두 프레임에 올 때까지 프로브를 돌립니다. 필요한 경우 이상적인 이미지를 얻기 전에 세 단계를 모두 여러 번 반복하십시오.
- 삼첨판막이 확인되면 M-모드를 선택하고 자유벽의 삼첨판 고리에 점선을 놓습니다. cine store 를 눌러 측정값을 저장합니다.
- 역류에 대한 삼첨판막을 평가하기 위해 색상을 선택합니다. 역류가 있는 경우 RV에서 우심방(RA)으로의 역행 흐름 제트가 수축기에서 볼 수 있습니다(그림 5).
참고: A4CH 보기에서 RV 자유 벽의 조직 도플러 및 RV 유입 속도도 측정할 수 있습니다.
- 그림 4와 같이 프로브를 배치합니다. 심장이 확인되면 손목과 손가락만 사용하여 프로브를 약간 조정하여 심장의 4개 방과 삼첨판막을 모두 식별합니다.
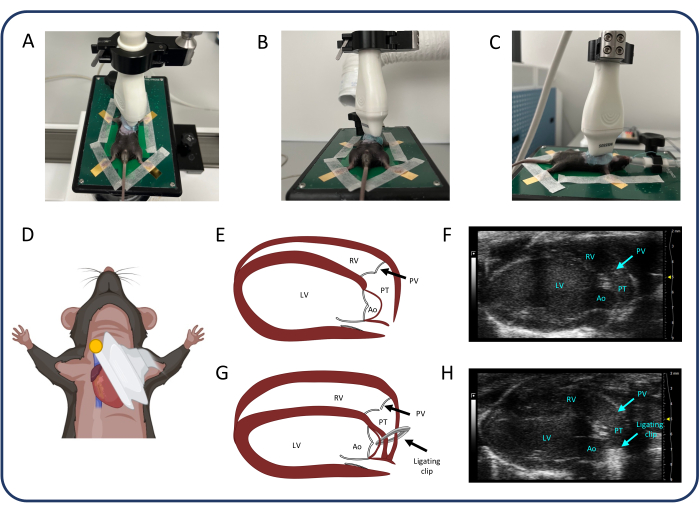
그림 2: Parasternal 장축 보기(PLAX). (A-D) 초음파 프로브의 위치. (E, F) PLAX의 정상적인 쥐 심장. (지, H) PTB 후 RV 확장 및 비대. 약어: LV: 좌심실, RV: 우심실, PV: 폐동맥 판막, PT: 폐동맥 간선, AO: 대동맥. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
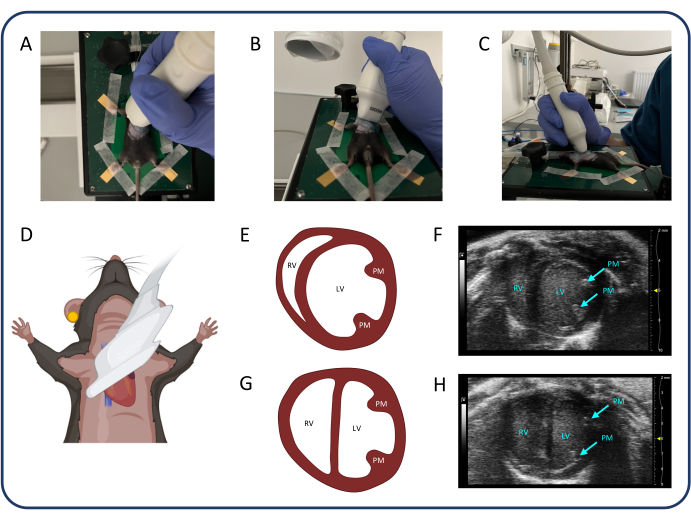
그림 3: Parasternal short axis view(PSAX). (A-D) 초음파 프로브의 위치. (E, F) PSAX의 정상적인 쥐 심장. (지, H) PTB 이후의 PSAX. 약어: LV: 좌심실, RV: 우심실, PM: 유두근. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
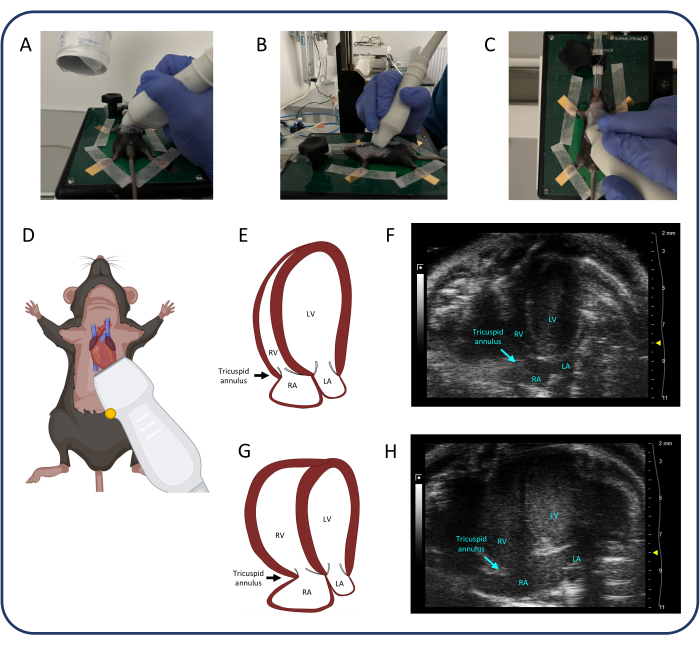
그림 4: 정점 4-챔버 보기(A4CH). (A-D) 초음파 프로브의 위치. (E, F) A4CH 보기의 정상적인 쥐 심장. (지, H) PTB 후 RV 및 RA 확장. 약어: LV: 좌심실, RV: 우심실, RA: 우심방, LA: 좌심방. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
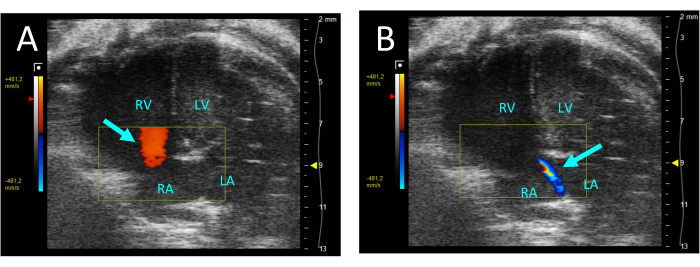
그림 5: A4CH 뷰에서 컬러 도플러로 시각화된 삼첨판 역류 . (A) 이완기에서는 RA에서 RV로의 흐름이 관찰됩니다(화살표). (B) 수축기 중에는 RV에서 RA로의 얇은 흐름 제트가 보입니다(화살표). 약어: LV: 좌심실, RV: 우심실, RA: 우심방, LA: 좌심방. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 데이터 분석
- PLAX에서 3개의 심장 주기에서 폐 줄기 직경을 측정하고 추가 데이터 분석을 위해 평균 폐 줄기 직경을 사용합니다. 저장된 3개의 cine 루프(폐 줄기 중앙 및 혈관 벽 근처) 각각에 대해 PLAX에서 3개의 심장 주기로 VTI를 측정합니다. 추가 분석을 위해 모든 VTI 측정의 평균 VTI를 사용합니다. 다음 공식을 사용하여 CO를 계산합니다.
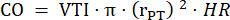
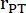 : 폐 줄기의 반경, HR: 심박수
: 폐 줄기의 반경, HR: 심박수 - 유두 중간 수준에서 PSAX의 LVEI를 측정합니다. 측정 도구를 사용하여 중격에서 자유벽까지 가장 큰 LV 내경(LVid1)을 측정합니다. 그런 다음 첫 번째 측정(LVid2)과 직교하는 LV 내경을 측정합니다. 세 번의 심장 주기에서 이러한 측정을 반복하고 평균 LV 내경과 다음 공식을 사용하여 LVEI를 계산합니다.
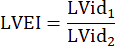
- A4CH 보기에서 3개의 심장 주기로 TAPSE를 측정하고 추가 데이터 분석을 위해 평균 TAPSE를 사용합니다.
7. 우심 카테터 삽입
- PTB 수술 3주 후 1.4F 마이크로 팁 카테터로 우심실(RV) 압력과 부피를 측정합니다.
- 3.1-3.4단계에 설명된 대로 마우스를 마취하고 삽관합니다. 덮개가 있는 가열 패드(37°C)에 마우스를 놓고 마취를 유지합니다(0.6L/min에서 3.5% 세보플루란 100% 산소).
- 2000IU의 헤파린(근육 주사[i.m.])과 0.5mL의 NaCl(피하[s.c.])을 투여합니다.
- 수술용 가위를 사용하여 복벽을 시포이드 돌기까지 꼬리 모양으로 자르고 흉벽의 절개 부분을 따라 횡격막을 조심스럽게 절단하여 흉강에 접근할 수 있도록 합니다. 심장에 충분히 접근할 수 있을 때까지 횡격막과 늑골을 자릅니다.
- 하대정맥(inferior vena cava) 주위에 합자를 놓습니다. 나중에 프로토콜에서 압력-부피 측정 기록을 위한 예압을 줄이기 위해 용기를 폐색하는 데 이 기능을 사용합니다.
- 26G 바늘을 사용하여 RV의 작은 구멍을 조심스럽게 찔러 넣습니다. 이것이 가능한 한 정점에 가깝고 바늘이 심실을 완전히 관통하지 않고 전도도 카테터 삽입을 위한 가이드 역할만 하는지 확인하십시오. 출혈이 발생하면 출혈을 최소화하기 위해 작은 면봉으로 부드러운 압력을 가합니다.
- 심실 벽의 작은 구멍을 확인하고 조직을 관통하여 카테터를 삽입합니다.
알림: 카테터를 삽입할 때 내심실 벽이 손상되지 않도록 주의하십시오. - 우심실 압력(RVP)의 변화는 카테터 삽입 후 몇 분 동안 관찰되는 경우가 많습니다. RVP가 안정화될 때까지 기다렸다가 대표적인 정상 상태 측정값을 얻습니다.
- 압력-부피 루프를 얻으려면 이전에 하대정맥 주위에 배치된 합자를 사용하십시오. 합자를 조심스럽게 당겨 혈관을 폐색하여 점차적으로 예압을 줄입니다.
- 대표적인 압력-부피 루프가 기록되면 카테터를 추출하고 심장을 절제하여 쥐를 안락사시킵니다. 이때 추가 분석을 위해 혈액 및 조직 샘플을 채취합니다.
결과
C57BL/6N 마우스(수컷, 5주령, 17-20g)는 중증 PTB(sPTB, 250μm, n=12), 경증 PTB(mPTB, 450μm, n=9) 또는 가짜 수술(가짜, n=15)로 무작위 배정되었습니다. 심장 기능 평가는 수술 1주일 후와 3주 후에 심장 초음파로 수행했습니다. 우측 심장 카테터 삽입과 후속 안락사는 수술 3주 후에 수행되었습니다. 장기의 무게를 측정하고 조직학적 분석을 위해 심장 조직을 준비했습니다.
수술 1주일 후 심?...
토론
이 논문에서는 압력 과부하로 인한 RV 비대 및 고장의 쥐 모델을 제시합니다. 우리는 다음을 입증합니다: (i) 어린 마우스의 PTB는 경미한 RV 비대에서 심외 보상 부전 징후 및 조직학적으로 확인된 RV 섬유증을 동반한 RV 실패에 이르기까지 다양한 정도의 RV 병리를 유발할 수 있습니다. (ii) RV 기능 장애의 징후는 PTB 수술 후 1주 및 3주에 심장 초음파로 관찰하고 정량화할 수 있습니다. (iii) RV 비대의 정...
공개
저자는 밝힐 것이 없습니다.
감사의 말
이 작업은 Snedkermester Sophus Jacobsen og Hustru Astrid Jacobsens Fond, Helge Peetz og Verner Peetz og hustru Vilma Peetz Legat, Grosserer A.V. Lykfeldt og Hustrus Legat의 지원을 받았습니다. 또한, 저자들은 실험 작업을 수행하는 동안 도움을 준 오르후스 대학교 임상 의학과의 동물 시설 직원들에게 감사를 표하고자 합니다.
자료
| Name | Company | Catalog Number | Comments |
| Biosyn 6-0, monofilament, absorbable suture | Covidien | UM-986 | |
| Blunt cannula, 27G 0.4x0.25, | Sterican | 292832 | |
| Bupaq Multidose vet 0,3 mg/ml (Buprenorphinum) | Salfarm Danmark | VNR 472318 | |
| C57BL/6NTac mice | Taconic Biosciences | C57BL/6NTac | |
| Dagrofil 1, braided, non-absorbable suture | B Braun | C0842273 | |
| Depilatory cream | Veet | 3132000 | |
| Disinfection Swabs (82% Ethanol + 0.5% Chlorhexidine) | Mediq | 3340122 | |
| Disposable scalpels, size 11 | Swann-Morton | 11708353 | |
| Dräger Vapor 2000 Sevoflurane | Dräger | M35054 | |
| Eye oinment neutral, "Ophta" | Actavis | MTnr.: 07586 Vnr: 53 96 68 | |
| Horizon ligating clips | Teleflex Medical | 5200 (IPN914931) | |
| Horizon Open Ligating Clips applier, curved, 6" (15 cm) | Teleflex Medical | 537061 | |
| Kitchen roll holder | n.a. | n.a. | |
| Metal wire of different thickness | n.a. | n.a. | |
| Microsurgical instruments set | Thompson | n.a. | |
| MiniVent Ventilator | Hugo Sachs | Type 845 | |
| MS505S transducer | Visual sonics | n.a. | |
| Rimadyl Bovis vet. 50 mg/ml (Carprofen) | Zoetis | MTnr: 34547, Vnr: 10 27 99, | |
| Sevoflurane Baxter 100 % | Baxter Medical | MTnr: 35015 | |
| Silicone tubing | n.a. | n.a. | |
| Soft plastic sheet | n.a. | n.a. | |
| Stereomicroscope, "Opmi Pico" | Carl Zeiss Surgicals GmbH | n.a. | |
| Ultrasonic probe holder/rail | Visual Sonics | 11277 | |
| Varming plate | Visual sonics | 11437 | |
| Venflon ProSafety, 22G, 0,9 x 25mm | Becton Dickinson | 393222 |
참고문헌
- Voelkel, N. F., et al. Right ventricular function and failure: Report of a national heart, lung, and blood institute working group on cellular and molecular mechanisms of right heart failure. Circulation. 114 (17), 1883-1891 (2006).
- Haddad, F., Doyle, R., Murphy, D. J., Hunt, S. A. Right ventricular function in cardiovascular disease, part ii: Pathophysiology, clinical importance, and management of right ventricular failure. Circulation. 117 (13), 1717-1731 (2008).
- Van De Veerdonk, M. C., et al. Progressive right ventricular dysfunction in patients with pulmonary arterial hypertension responding to therapy. J Am Coll Cardiol. 58 (24), 2511-2519 (2011).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: Problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: The evolution of animal models in pulmonary hypertension research; are we there yet. Pulm Circ. 3 (4), 739-756 (2013).
- Andersen, A., et al. Animal models of right heart failure. Cardiovasc Diagn Ther. 10 (5), 1561-1579 (2020).
- Voelkel, N. F., Tuder, R. M. Hypoxia-induced pulmonary vascular remodeling: A model for what human disease. J Clin Invest. 106 (6), 733-738 (2000).
- Rabinovitch, M., Gamble, W., Nadas, A. S., Miettinen, O. S., Reid, L. Rat pulmonary circulation after chronic hypoxia: Hemodynamic and structural features. Am J Physiol. 236 (6), H818-H827 (1979).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. Faseb j. 15 (2), 427-438 (2001).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. Am J Respir Crit Care Med. 184 (10), 1171-1182 (2011).
- Nicolls, M. R., et al. New models of pulmonary hypertension based on VEGF receptor blockade-induced endothelial cell apoptosis. Pulm Circ. 2 (4), 434-442 (2012).
- Hessel, M. H., Steendijk, P., Den Adel, B., Schutte, C. I., Van Der Laarse, A. Characterization of right ventricular function after monocrotaline-induced pulmonary hypertension in the intact rat. Am J Physiol Heart Circ Physiol. 291 (5), H2424-H2430 (2006).
- Gomez-Arroyo, J. G., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Janssen, W., et al. 5-ht2b receptor antagonists inhibit fibrosis and protect from RV heart failure. Biomed Res Int. 2015, 438403 (2015).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050 (2018).
- Axelsen, J. B., et al. Effects of 6-mercaptopurine in pressure overload induced right heart failure. PLoS One. 14 (11), e0225122 (2019).
- Egemnazarov, B., et al. Pressure overload creates right ventricular diastolic dysfunction in a mouse model: Assessment by echocardiography. J Am Soc Echocardiogr. 28 (7), 828-843 (2015).
- Wang, Q., et al. Induction of right ventricular failure by pulmonary artery constriction and evaluation of right ventricular function in mice. J Vis Exp. (147), e59431 (2019).
- Kojonazarov, B., et al. The peroxisome proliferator-activated receptor β/δ agonist gw0742 has direct protective effects on right heart hypertrophy. Pulm Circ. 3 (4), 926-935 (2013).
- Kojonazarov, B., et al. P38 MAPK inhibition improves heart function in pressure-loaded right ventricular hypertrophy. Am J Respir Cell Mol Biol. 57 (5), 603-614 (2017).
- Rai, N., et al. Effect of Riociguat and Sildenafil on right heart remodeling and function in pressure overload induced model of pulmonary arterial banding. Biomed Res Int. 2018, 3293584 (2018).
- Sydykov, A., et al. Genetic deficiency and pharmacological stabilization of mast cells ameliorate pressure overload-induced maladaptive right ventricular remodeling in mice. Int J Mol Sci. 21 (23), 9099 (2020).
- Andersen, S., et al. Effects of combined angiotensin ii receptor antagonism and neprilysin inhibition in experimental pulmonary hypertension and right ventricular failure. Int J Cardiol. 293, 203-210 (2019).
- Andersen, S., et al. Pressure overload induced right ventricular remodeling is not attenuated by the anti-fibrotic agent pirfenidone. Pulm Circ. 9 (2), 2045894019848659 (2019).
- Labazi, H., et al. Sex-dependent changes in right ventricular gene expression in response to pressure overload in a rat model of pulmonary trunk banding. Biomedicines. 8 (10), 430 (2020).
- Sun, X. Q., et al. Increased mao-a activity promotes progression of pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 64 (3), 331-343 (2021).
- Axelsen, J. S., et al. Effects of Empagliflozin on right ventricular adaptation to pressure overload. Front Cardiovasc Med. 10, 1302265 (2023).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660 (2023).
- Boehm, M., et al. Delineating the molecular and histological events that govern right ventricular recovery using a novel mouse model of pulmonary artery de-banding. Cardiovasc Res. 116 (10), 1700-1709 (2020).
- Andersen, S., et al. Effects of bisoprolol and losartan treatment in the hypertrophic and failing right heart. J Card Fail. 20 (11), 864-873 (2014).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210 (2015).
- Vildbrad, M. D., et al. Limitations and pitfalls in measurements of right ventricular stroke volume in an animal model of right heart failure. Physiol Meas. 36 (5), 925-937 (2015).
- Boehm, M., et al. Maintained right ventricular pressure overload induces ventricular-arterial decoupling in mice. Exp Physiol. 102 (2), 180-189 (2017).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041 (2014).
- Luitel, H., et al. Pressure overload leads to an increased accumulation and activity of mast cells in the right ventricle. Physiol Rep. 5 (6), e13146 (2017).
- Mamazhakypov, A., et al. Novel therapeutic targets for the treatment of right ventricular remodeling: Insights from the pulmonary artery banding model. Int J Environ Res Public Health. 18 (16), 8297 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유