A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מודל מורין של היפרטרופיה של חדר ימין הנגרמת על ידי עומס יתר וכישלון על ידי רצועות גזע ריאתי
In This Article
Summary
אנו מתארים מודל מוריני של עומס יתר על לחץ החדר הימני המושרה על ידי רצועות גזע ריאתי. פרוטוקולים מפורטים לאינטובציה, ניתוח ופנוטיפ על ידי אקוקרדיוגרפיה כלולים במאמר. מכשירים בהתאמה אישית משמשים לאינטובציה וניתוח, המאפשרים שכפול מהיר וזול של הדגם.
Abstract
כשל בחדר ימין (RV) הנגרם כתוצאה מעומס יתר קשור קשר הדוק לתחלואה ותמותה במספר מחלות לב וכלי דם וריאות. הפתוגנזה של כשל RV היא מורכבת ואינה מובנת כראוי. כדי לזהות אסטרטגיות טיפוליות חדשות לטיפול בכשל קרוואנים, מודלים חזקים וניתנים לשחזור של בעלי חיים הם חיוניים. מודלים של רצועת גזע ריאתי (PTB) צברו פופולריות, שכן ניתן להעריך את תפקוד RV ללא תלות בשינויים בכלי הדם הריאתיים.
במאמר זה, אנו מציגים מודל מורין של עומס יתר בלחץ RV המושרה על ידי PTB בעכברים בני 5 שבועות. ניתן להשתמש במודל כדי לגרום לדרגות שונות של פתולוגיה של RV, החל מהיפרטרופיה קלה של RV ועד לכישלון RV מפוצל. פרוטוקולים מפורטים עבור אינטובציה, ניתוח PTB ופנוטיפ על ידי אקוקרדיוגרפיה כלולים במאמר. כמו כן, ניתנות הוראות להתאמה אישית של מכשירים לאינטובציה ולניתוחי PTB, המאפשרים שכפול מהיר וזול של מודל ה-PTB.
אטבי קשירת טיטניום שימשו כדי לכווץ את תא המטען הריאתי, מה שהבטיח רמה מאוד ניתנת לשחזור ובלתי תלויה במפעיל של התכווצות גזע ריאתי. חומרת ה-PTB דורגה על ידי שימוש בקטרים שונים של קליפס קשירה פנימי (קל: 450 מיקרומטר וחמור: 250 מיקרומטר). זה הביא לפתולוגיה של RV החל מהיפרטרופיה עם תפקוד RV שמור ועד כשל RV מפוצל עם תפוקת לב מופחתת וביטויים חוץ-לבביים. תפקוד RV הוערך על ידי אקוקרדיוגרפיה שבוע ושלושה שבועות לאחר הניתוח. דוגמאות לתמונות ותוצאות אקוקרדיוגרפיות מוצגות כאן. כמו כן, מוצגות תוצאות של צנתור לב ימין וניתוחים היסטולוגיים של רקמת הלב.
Introduction
אי ספיקת חדר ימין (RV) היא תסמונת קלינית עם תסמינים של אי ספיקת לב וסימנים של גודש מערכתי כתוצאה מתפקוד לקוי של RV1. תפקוד לקוי של RV קשור קשר הדוק לתחלואה ותמותה במספר מחלות לב וכלי דם וריאות2. האטיולוגיה של תפקוד לקוי של RV היא מורכבת, ומסלולי האיתות והוויסות הבסיסיים שלה עדיין לא הובהרו כראוי.
תצפיות מהטיפולים הנוכחיים מראות כי תפקוד RV משופר נמצא בקורלציה קרובה להפחתת עומס לאחר מכן, מה שמרמז על כלי דם ריאתיים כיעד הטיפול העיקרי3. זה מצביע על כך שלטיפולים הנוכחיים יש רק השפעה ישירה מינימלית על תפקוד RV, אשר יכול להידרדר גם לאחר שיפור בהתנגדות כלי הדם הריאתיים3. לפיכך, יש צורך רב במחקר נוסף לשיפור תפקוד הקרוואנים ללא תלות בהפחתת עומס לאחר מכן.
מודלים חזקים וניתנים לשחזור של בעלי חיים חיוניים בחיפוש אחר סוכנים טיפוליים חדשים. ברוב המודלים של אי ספיקת RV כרונית, הסיבה הבסיסית היא יתר לחץ דם ריאתי המושרה על ידי שינוי מבני של כלי הדם הריאתיים 4,5,6. מודלים מאופיינים היטב כוללים את מודל ההיפוקסיה הכרונית 7,8, מודל Sugen-hypoxia 9,10,11, ואת מודל monocrotaline 12,13. מכיוון שכשל RV הוא משני ליתר לחץ דם ריאתי במודלים אלה, לא ניתן להבדיל בין ההשפעות של התערבויות על כלי הדם הריאתיים לבין ההשפעות הישירות על RV6.
כדי לחקור את ה-RV באופן עצמאי מכלי הדם הריאתיים, מודל פס תא המטען הריאתי (PTB) צבר פופולריות ותואר במספר מיני בעלי חיים, כולל עכברים, חולדות, ארנבות, כלבים, כבשים וחזירים 6,14,15,16,17,18,19,20,21,22,23, 24,25,26,27. במודלים של PTB, התכווצות של תא המטען הריאתי מושגת בניתוח, מה שגורם לעלייה בלחץ RV6. קיימות גישות שונות ליישום PTB, כולל כיווץ של הכלי עם ליגטורה או עם קליפס קשירת מתכת18,28. במודלים המשתמשים בליגטורות, תא המטען הריאתי קשור למחט, והמחט נסוגה, ומשאירה את הרצועה במקומה. התוצאה היא התכווצות של כלי הדם התלויה בגודל המחט ובמתח הקשר18,29. בדגמים המשתמשים בתפסי קשירת מתכת, מידת התכווצות תא המטען הריאתי עשויה להיות ניתנת לשחזור יותר. תוספות קשירה שהשתנו משמשות לסגירת תפסי הקשירה לקוטר מוגדר מראש וקבוע. זה הופך את השיטה לבלתי תלויה במפעיל ומפחית את השונות הקשורה ל- PTB בפנוטיפ המחלה 15,27,28.
דגמי Murine PTB הוכחו כגורמים להיפרטרופיה של RV וכישלון18,28. אחד האתגרים העיקריים בעת שימוש במודל PTB הוא בחירת קוטר PTB המתאים כדי להשיג את הדרגה הרצויה של פתולוגיית RV. זה מאתגר במיוחד כאשר מנסים למדל כשל RV מפוצל. לשם כך, ההתכווצות צריכה להיות הדוקה מספיק כדי לגרום לכשל RV כרוני מבלי להוביל לכשל RV חריף ומוות זמן קצר לאחר ניתוח6. גישה אחת לפתרון אתגר זה היא להשתמש בגמילה או בבעלי חיים צעירים 6,15. מודל PTB שימש בהצלחה לחקר שלבים שונים של כשל RV באמצעות גמילהמחולדות Wistar 15,30. כדי להשיג זאת, חולדות צעירות עם פוטנציאל גדילה שנותר עברו ניתוח PTB עם יישום של קליפסים קשירת טיטניום. כאשר החולדות גדלו, היצרות הריאות החמירה בהדרגה וגרמה להיפרטרופיה של RV או לאי ספיקת RV כרונית, בהתאם לחומרת PTB15,30. בהשראת מודל זה, שיערנו כי שלבים שונים של פתולוגיית RV יכולים להיווצר במודל PTB מורין באמצעות עכברים צעירים. חקר ספקטרום רחב של פתולוגיה של RV ממחלה קלה למחלה קשה עשוי לעזור להבהיר את הבנתנו את התקדמות המחלה ואת המעבר מהיפרטרופיה של RV לכשל RV.
כאן, אנו מציגים מודל מורין של עומס יתר בלחץ RV המושרה על ידי PTB בעכברים צעירים. עם מודל זה, דרגות שונות של פתולוגיה RV ניתן לייצר, החל היפרטרופיה RV כדי כישלון RV מפוצל. מחקר זה כולל פרוטוקולים מפורטים לאינטובציה, ניתוחי PTB ופנוטיפ באמצעות אקוקרדיוגרפיה.
Protocol
המחקר אושר על ידי המפקח הדני על ניסויים בבעלי חיים (מספר הרשאה: 2021-15-0201-00928) ובוצע בהתאם לחקיקה הלאומית בנושא חיות מעבדה. במחקר זה נעשה שימוש בעכברי C57BL/6N זכרים בני 5 שבועות.
1. התאמה אישית של מכשירים לאינטובציה ולניתוח (איור 1)
הערה: סעיף זה מפרט את השלבים החשובים ביותר בהכנת מכשירים בהתאמה אישית לאינטובציה וניתוחי PTB מחומרים זולים וזמינים.
- הכינו את הצינור האנדוטרכאלי (איור 1A).
ניתן להשתמש בצנתרים תוך-ורידיים נפוצים (IV) לאינטובציה ואוורור של עכברים.- בחר את הגודל המתאים של קטטר תוך כלי המתאים לגודל העכברים. צנתר 22G מומלץ לעכברים בני 5 שבועות (17-20 גרם) וצנתר 23G לעכברים גדולים יותר (>20 גרם).
- משוך את המחט ונתק את מנגנון הנעילה. מחזירים את המחט לצנתר וחותכים את קצה המחט בזווית של 45°, כ-2 מ"מ מקצה הצנתר.
- השתמשו בנייר זכוכית כדי להקהות את הקצה כדי למנוע פגיעה במיתרי הקול של העכברים.
- חתכו כנף אחת של הצנתר לראייה טובה יותר במהלך האינטובציה.
- הכינו את מסיר בית החזה (איור 1B).
- השתמש במחזיק מחט כדי לכופף חתיכת חוט מתכת גמיש באורך של כ-10 ס"מ באמצע בזווית של 30°.
- השתמש במחזיק המחט כדי ליצור בזהירות ווים א-טראומטיים ברוחב 5 מ"מ בשני קצוות החוט.
- הכינו את מעמד האינטובציה (איור 1C).
הערה: השימוש בעמדת אינטובציה מאפשר אספקה רציפה של הרדמה דרך צינור האף במהלך אינטובציה. זה מאפשר אינטובציה מבוקרת ובטוחה תחת הנחיה חזותית, אשר מפחיתה את הסיכון לפגיעה במיתרי הקול וקנה הנשימה, כמו גם את הסיכון של מיקום שגוי של הצינור בוושט. כל מסגרת מתכת או פלסטיק יכולה לשמש כמסגרת למעמד האינטובציה. במחקר זה נעשה שימוש במחזיק תפקידים מעט כפוף במטבח.- חותכים חתיכת צינור גומי בקוטר 3 ס"מ המתאים לחוטם של עכבר ומחברים אותו לשסתום צנתר IV. ניתן לחבר הרדמה ממסים נדיפים דרך המסתם לפני אינטובציה.
- בצע לולאה באמצעות תפר קלוע 1-0 כ 5 מ"מ מפתח הצינור. זה ישמש כדי לאבטח את חוטם murine בצינור.
- חותכים חור ליד החלק העליון של יריעת פלסטיק גמישה ומניחים את הצינור בתוך החור. הסדין משמש לתמיכה בעכבר במעמד האינטובציה.
- השתמשו בסרט הדבקה כדי להחזיק את החלקים הבודדים יחד כפי שמוצג באיור 1C.
- הכינו את צינורית ההנחיה (איור 1D, E).
- משוך תפר מונופילמנט 6-0 דרך צינורית 27G קהה וקשר קשר על התפר. השתמש בקשר זה מאוחר יותר כדי לתפוס את התפר במהלך ניתוח PTB.
- השתמש במחזיק מחט כדי לכופף את קצה הצינורית לזווית של 80 מעלות.
- הכינו את יישום תפס הקשירה.
הערה: יישום תפס קשירה עם לסתות זוויות משתנה באמצעות מנגנון עצירה מתכוונן (איור 1F), אשר עוצר את דחיסת תפס הקשירה כאשר הלסתות נמצאות במרחק מדויק שנקבע מראש זו מזו. יישום קליפ הקשירה שונה משמש ליישום קליפסים קשירת טיטניום על תא המטען הריאתי.- קבע חתיכת פליז חתוכה בהתאמה אישית לידיות של יישום תפס הקשירה באמצעות שני ברגים. הרכיבו בורג מתכוונן במרכז (איור 1F, חץ לבן) שקובע את המרחק המדויק בין הידיות הדחוסות של יישום תפס הקשירה, המתאים למרחק מדויק בין הלסתות.

איור 1: מכשירים לאינטובציה ולניתוחי PTB. (A) צינור אנדוטרכאלי העשוי מצנתר בעירוי. (B) מסיר בית החזה. (ג) מעמד אינטובציה ועכבר שהונחו בעמדת אינטובציה וקיבלו הרדמה על צינור אף. (D) כלי ניתוח ותפס קשירה מותאם המשמש לניתוח PTB. (ה) צינורית הנחיה. (F) מנגנון עצירה מתכוונן בהתאמה אישית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. התאמת יישום תפס הקשירה
- בחר את הקוטר הפנימי של תפס הקשירה בהתבסס על חומרת הכשל הרצויה של RV. עבור עכברים זכרים בני 5 שבועות C57BL/6N (17-20 גרם), השתמש בקוטר קליפס של 250 מיקרומטר עבור חמור ו 450 מיקרומטר עבור עומס לחץ RV קל. השתמש בקטרים של קליפס ביניים כדי לגרום לעומס יתר בלחץ מתון.
- השתמש בחוט מתכת או במחטים כדי לכוונן את יישום תפס הקשירה. ודא שקוטר החוט תואם לקוטר הקליפ הרצוי.
- טען את יישום התפס עם תפס קשירה והנח את חוט ההתאמה במרכז תפס הקשירה. בעת דחיסת יישום התפס, סובב את הבורג עד שהלסתות של האטב ייכנסו בחוזקה סביב החוט. ודא שהתפס נשאר במקומו על חוט הכוונון לאחר שחרור יישום התפס.
- כאשר יישום התפס מותאם, הנח תפס קשירה נוסף על חוט ההתאמה כדי לאמת את הקוטר שנקבע.
3. הכנות לניתוח
- יש להשרות הרדמה בתא זירוז באמצעות 7% סבופלורן ב-0.6 ליטר/דקה 100% חמצן. יש לוודא הרדמה מספקת על ידי צביטת בוהן לפני האינטובציה.
הערה: ניתן להשתמש גם באיזופלורן. שימו לב שיש להשתמש בריכוזים שונים. - הכנס את העכבר עם צנתר IV 22G. בצעו אינטובציה בהנחיה חזותית, באמצעות מיקרוסקופ כירורגי ומעמד אינטובציה, המאפשרים יישור נכון להדמיית מיתרי הקול ואספקה רציפה של חומרי הרדמה ממסים נדיפים על צינור האף (איור 1C).
- אוורר את העכבר במהירות של 175 פעימות לדקה ונפח גאות של 300 μL/stroke.
הערה: מומלץ גם נפחי גאות ושפל של 8-10 מיקרוליטר/גרם, ונפח הגאות האידיאלי תלוי בדליפה אפשרית ובחלל מת במערכת האוורור. - הניחו את העכבר המובנה על כרית חימום מכוסה (37°C) ומרחו משחת לחות על עיני העכבר.
- יש לשמור על הרדמה (3.5% סבופלורן ב-0.6 ליטר/דקה, 100% חמצן) ולתת 0.1 מ"ג/ק"ג בופרנורפין ו-5 מ"ג/ק"ג קרפרופן תת עורית לשיכוך כאבים פריאופרטיבי. יש להסיר את כל השיער מהחזה באמצעות קרם אפילציה ולחטא את העור במגבוני חיטוי.
4. ניתוח PTB
- בצע חתך של 10 מ"מ בעור מעל החלל הבין-קוסטלי השני מזווית עצם החזה לקו בית השחי הקדמי השמאלי. פיצול שרירי החזה הגדולים והקטנים על ידי דיסקציה קהה.
- חתכו את השרירים הבין-קוסטליים בחלל הבין-קוסטלי השני ונתחו בבוטות את בלוטת התימוס כדי לחשוף את הלב, תא המטען הריאתי ואבי העורקים. מקם מסיר חזה בחלל הבין-קוסטלי כדי לשמור על שדה הניתוח נגיש.
הערה: יש לנקוט בזהירות רבה בעת חיתוך השרירים הבין-קוסטליים, שכן עורק החלב הפנימי השמאלי פועל רק 1-2 מ"מ לרוחב עצם החזה. פגיעה בעורק זה עלולה לגרום לאיבוד דם משמעותי. - הפרידו את גזע הריאה מאבי העורקים העולה על ידי הסרה בוטה של רקמת החיבור בין כלי הדם באמצעות מלקחיים מיקרוסקופיים. שפר את החשיפה של תא המטען הריאתי עוד יותר על ידי סיבוב פלג הגוף התחתון של העכבר (רגל שמאל על רגל ימין).
- מעבירים את צינורית ההנחיה דרך הסינוס הרוחבי של קרום הלב האחורי של תא המטען הריאתי. השתמש במלקחיים כדי לתפוס את הקשר בקצה צינורית ההנחיה ומשוך את התפר דרך צינורית ההנחיה. הסר בזהירות את צינורית ההנחיה בזמן שהתפר נשאר במקומו סביב תא המטען הריאתי.
- טען את יישום תפס הקשירה והשתמש בתפר כדי להנחות את גזע הריאה לתוך הלסתות של תפס הקשירה ולדחוס את האטב. שחררו את התפר מיד לאחר מיקום הקליפ והתבוננו במילוי תא המטען הריאתי.
הערה: ניתן להבחין בברדיקרדיה בשניות הראשונות לאחר מריחת קליפ הקשירה. - מניחים תפר נספג מונופילמנט 6-0 סביב הקוסטאה השנייה והשלישית וסוגרים את החלל הבין-קוסטלי. לפנות כמה שיותר אוויר מחלל בית החזה על ידי הפעלת לחץ עדין על החזה תוך הידוק התפר.
- לבסוף, תפרו את העור בתפר 6-0 מונופילמנט נספג.
- בצע את אותו ההליך, למעט הנחת תפס הקשירה (שלב 4.5), במהלך ניתוח דמה.
5. אקוקרדיוגרפיה
- לאחר השראת הרדמה בתא זירוז (1-2 דקות, 6% סבופלורן ב-100% חמצן), יש להמשיך בהרדמה באמצעות צינור אף (3.5% סבופלורן ב-100% חמצן). הסר את כל השיער מהחזה והבטן באמצעות קרם depilatory והנח את העכבר על כרית חימום. יש למרוח משחת לחות על העיניים וג'ל אולטרסאונד על חזהו של העכבר.
הערה: התאם רווח דו-ממדי, עומק מיקוד ועומק תמונה כדי לשפר את איכות התמונה בכל מדידות האקו לב. - התאימו את הגשושית העל-קולית כדי למצוא את תצוגת הציר הארוך (PLAX) (איור 2). ב- PLAX, למדוד את הקוטר הפנימי של תא המטען הריאתי ואת אינטגרל זמן המהירות (VTI) בתא המטען הריאתי.
- בחר במצב B והזז בזהירות את כרית החימום בציר x, y ו- z כדי לזהות את תא המטען הריאתי במרכז התמונה. השתמש בצבע כדי לזהות את קוטר תא המטען הריאתי הגדול ביותר. השתמש בחנות cine כדי ללכוד רצף למדידת קוטר תא המטען הריאתי.
- בחר דופלר צבע וגל דופק (PW) והצב את הסמן במרכז תא המטען הריאתי. התאם את זווית PW עד שהקווים המקווקוים מקבילים לזרימת הדם בכלי השיט.
- לחץ על cine store כדי למדוד VTI. מקם את הסמן ליד שני קירות תא המטען הריאתי ולחץ שוב על חנות cine כדי לרכוש זרימה ליד קיר כלי השיט.
הערה: ניתן להעריך גם את הקוטר הפנימי של החדר הימני (RV) ואת עובי הדופן ללא RV בתצוגת PLAX.
- מצא את תצוגת הציר הקצר הפרסטרנלי (PSAX) (איור 3) כדי למדוד את הקטרים הפנימיים של החדר השמאלי (LV), אשר יכולים לשמש להערכת בליטת מחיצה (תצורת D).
- בחר במצב B וסובב את הגשושית 90° נגד כיוון השעון. זווית הבדיקה 20-30 מעלות לרוחב כדי למנוע הצללה של RV על ידי עצם החזה, והטה את הבדיקה 20-30 מעלות גולגולת עד החדר השמאלי הוא עגול ככל האפשר. לאחר מכן, החלק את הבדיקה בכיוון הגולגולתי כדי לזהות את רמת השרירים הפפילריים עם קוטר החדר הגדול ביותר ולחץ על חנות cine.
הערה: PSAX ברמה המידפפילרית עשוי לשמש גם להערכת שינוי שטח חלקי RV. PSAX ברמה של שסתום אבי העורקים עשוי לשמש למדידת קיצור חלקי RV או עובי דופן ללא RV.
- בחר במצב B וסובב את הגשושית 90° נגד כיוון השעון. זווית הבדיקה 20-30 מעלות לרוחב כדי למנוע הצללה של RV על ידי עצם החזה, והטה את הבדיקה 20-30 מעלות גולגולת עד החדר השמאלי הוא עגול ככל האפשר. לאחר מכן, החלק את הבדיקה בכיוון הגולגולתי כדי לזהות את רמת השרירים הפפילריים עם קוטר החדר הגדול ביותר ולחץ על חנות cine.
- השתמשו בתצוגה אפיקלית בת 4 תאים (A4CH) (איור 4) כדי למדוד את הטיול הסיסטולי של המישור הטבעתי הטריקוספיד (TAPSE) ולהעריך רגורגיטציה טריקוספידית.
- מקם את הגשושית כפי שמוצג באיור 4. לאחר זיהוי הלב, בצע התאמות קטנות לבדיקה באמצעות פרק כף היד והאצבעות בלבד כדי לזהות את כל ארבעת חדרי הלב והמסתם הטריקוספיד.
- זיהוי ושמירה על תצוגת A4CH טובה היא מאתגרת. הניחו את היד המפעילה את הגשושית על כרית החימום ליציבות. החלק מעט, הטה וסובב מעט את הבדיקה עד למציאת התמונה המתאימה.
- הזיזו את הגשושית רק בממד אחד בכל פעם: למשל, החליקו גולגולת כדי למצוא את הלב, ואז הטו את הגשושית כדי לזהות את כל ארבעת החדרים ולבסוף סובבו את הגשושית עד שכל ארבעת החדרים והשסתום הטריקוספיד נמצאים במסגרת. במידת הצורך, חזור על כל שלושת השלבים מספר פעמים לפני קבלת התמונה האידיאלית.
- לאחר זיהוי המסתם הטריקוספיד, בחר במצב M ומקם את הקו המקווקו בטבעת הטריקוספידית של הקיר החופשי. לחץ על cine store כדי לשמור את המידות.
- בחר צבע כדי להעריך את המסתם tricuspid עבור regurgitation. אם קיימת רגורגיטציה, סילון של זרימה נסוגה מה-RV לאטריום הימני (RA) ייראה בסיסטולה (איור 5).
הערה: בתצוגת A4CH, ניתן למדוד גם דופלר רקמות בדופן החופשית של RV ומהירות זרימת RV.
- מקם את הגשושית כפי שמוצג באיור 4. לאחר זיהוי הלב, בצע התאמות קטנות לבדיקה באמצעות פרק כף היד והאצבעות בלבד כדי לזהות את כל ארבעת חדרי הלב והמסתם הטריקוספיד.
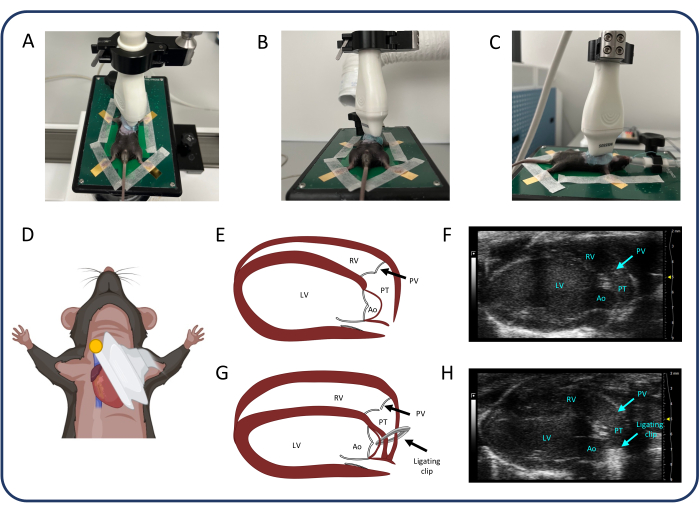
איור 2: מבט על ציר ארוך פאראסטרנלי (PLAX). (A-D) מיקום של הבדיקה העל-קולית. (ה, F) הלב המורין הרגיל ב- PLAX. (ז, ח) התרחבות RV והיפרטרופיה לאחר PTB. קיצורים: LV: חדר שמאל, RV: חדר ימני, PV: מסתם ריאתי, PT: גזע ריאתי, Ao: אבי העורקים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
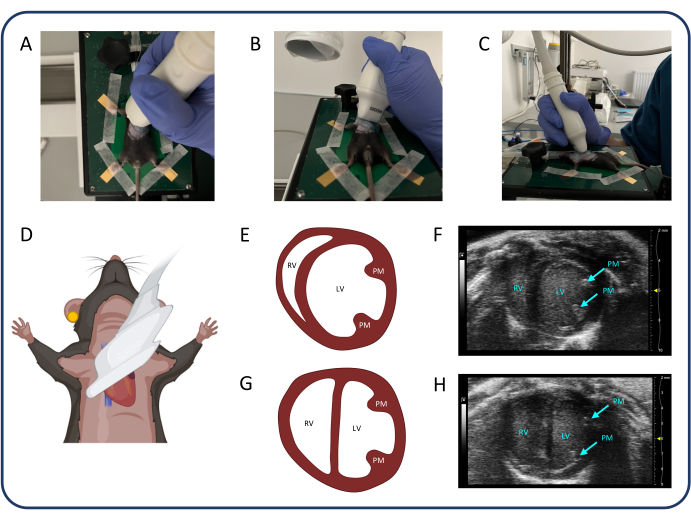
איור 3: מבט על ציר קצר פרסטרנלי (PSAX). (A-D) מיקום הבדיקה העל-קולית. (ה, ו) הלב המורין הרגיל ב- PSAX. (ז, ח) PSAX לאחר PTB. קיצורים: LV: חדר שמאל, RV: חדר ימני, PM: שריר פפילרי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
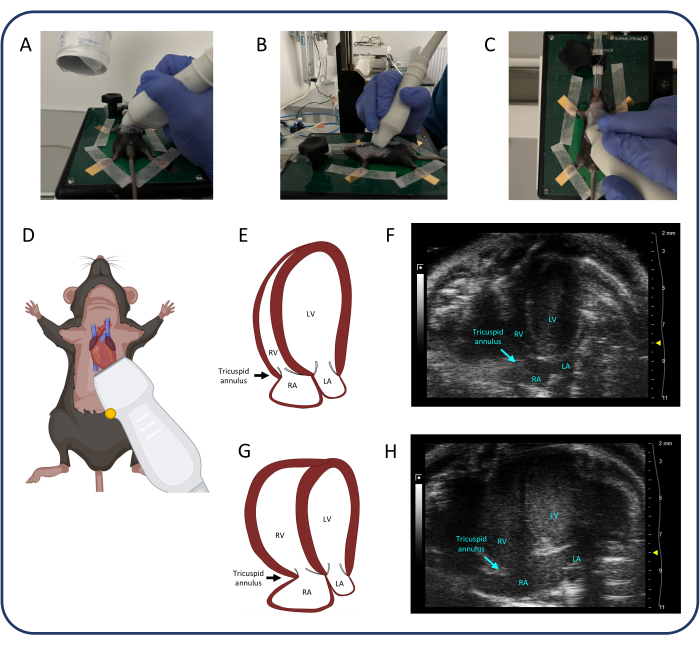
איור 4: מבט אפי בן 4 תאים (A4CH). (A-D) מיקום של הבדיקה העל-קולית. (ה, F) הלב המורין הרגיל בתצוגת A4CH. (ז, ח) הרחבת RV ו- RA לאחר PTB. קיצורים: LV: חדר שמאלי, RV: חדר ימני, RA: אטריום ימני, LA: אטריום שמאלי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
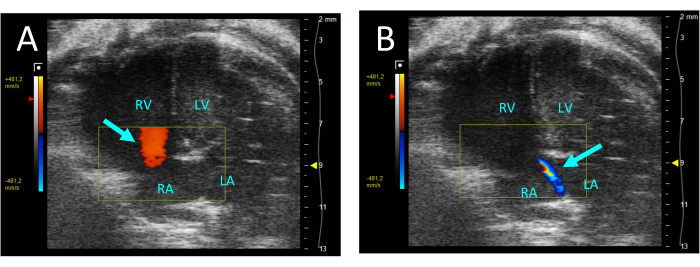
איור 5: רגורגיטציה טריקוספידית המומחשת על-ידי דופלר צבע בתצוגת A4CH. (A) בדיאסטולה, נצפתה זרימה מה-RA ל-RV (חץ). (B) במהלך סיסטולה, סילון דק של זרימה מה-RV ל-RA נראה לעין (חץ). קיצורים: LV: חדר שמאלי, RV: חדר ימני, RA: אטריום ימני, LA: אטריום שמאלי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
6. ניתוח נתונים
- מדוד את קוטר תא המטען הריאתי בשלושה מחזורי לב ב- PLAX והשתמש בקוטר תא המטען הריאתי הממוצע לניתוח נתונים נוספים. יש למדוד VTI בשלושה מחזורי לב ב-PLAX עבור כל אחת משלוש לולאות ה-cine המאוחסנות (במרכז תא המטען הריאתי וליד דפנות כלי השיט). השתמש בממוצע VTI של כל מדידות VTI לניתוח נוסף. השתמש בנוסחה הבאה כדי לחשב CO:
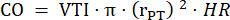
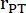 רדיוס תא המטען הריאתי, HR: קצב הלב:
רדיוס תא המטען הריאתי, HR: קצב הלב: - למדוד LVEI ב PSAX ברמה midpapillary. השתמש בכלי מדידה כדי למדוד את הקוטר הפנימי הגדול ביותר של LV (LVid1) מאמצע המחיצה ועד לקיר החופשי. לאחר מכן, מדדו את הקוטר הפנימי של LV אורתוגונלי למדידה הראשונה (LVid 2). חזור על מדידות אלה בשלושה מחזורי לב וחשב LVEI באמצעות הקטרים הפנימיים הממוצעים של LV והנוסחה הבאה:
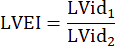
- מדוד TAPSE בשלושה מחזורי לב בתצוגת A4CH והשתמש ב- TAPSE ממוצע לניתוחי נתונים נוספים.
7. צנתור לב ימין
- למדוד את הלחץ והנפח של החדר הימני (RV) על ידי צנתור לב ימין עם צנתר מיקרו-קצה 1.4F 3 שבועות לאחר ניתוח PTB.
- להרדים ולבצע אינטובציה לעכבר כמתואר בשלבים 3.1-3.4. הניחו את העכבר על כרית חימום מכוסה (37°C) ושמרו על הרדמה (3.5% sevoflurane ב-0.6 ליטר/דקה 100% חמצן).
- מתן 2000 IU של הפרין (תוך שרירי [i.m.]) ו 0.5 מ"ל של NaCl (תת עורית [s.c.]).
- באמצעות מספריים כירורגיים, לחתוך את דופן הבטן רק caudally לתהליך xiphoid ולקבל גישה לחלל החזה על ידי חיתוך בזהירות את הסרעפת לאורך החתך שלה בקיר החזה. חותכים את הסרעפת ואת costae עד גישה מספקת ללב.
- מניחים רצועה סביב הווריד הנבוב התחתון. השתמש באפשרות זו לחסימת כלי השיט כדי להפחית עומס מראש להקלטת מדידות נפח לחץ בהמשך הפרוטוקול.
- השתמש במחט 26G כדי לדקור בזהירות חור קטן בקרוואנים. יש לוודא שהמחט קרובה ככל האפשר לקודקוד והמחט אינה חודרת את החדר לחלוטין אלא רק משמשת כמדריך להחדרת צנתר ההולכה. אם מתרחש דימום, יש להפעיל לחץ עדין עם צמר גפן קטן כדי למזער את איבוד הדם.
- זהה את החור הקטן בדופן החדר והכנס את הצנתר על ידי חדירה לרקמה.
הערה: בעת החדרת הצנתר, יש להיזהר שלא לפגוע בדופן החדר הפנימי. - שינויים בלחץ החדר הימני (RVP) נצפים לעתים קרובות במשך מספר דקות לאחר החדרת הצנתר. המתן עד ש- RVP יתייצב כדי לקבל מדידות מייצגות של מצב יציב.
- כדי להשיג לולאות נפח לחץ, השתמש ברצועה שמוקמה בעבר סביב הווריד הנבוב התחתון. בזהירות למשוך את ligature כדי להסתיר את כלי השיט, ובכך בהדרגה להפחית preload.
- לאחר רישום לולאות נפח לחץ מייצגות, לחלץ את הצנתר, ולהרדים את העכבר על ידי כריתה של הלב. בשלב זה, לאסוף דגימות דם ורקמות לניתוח נוסף.
תוצאות
עכברי C57BL/6N (זכר, בני 5 שבועות, 17-20 גרם) חולקו באקראי ל-PTB חמור (sPTB, 250 מיקרומטר, n = 12), PTB קל (mPTB, 450 מיקרומטר, n = 9), או ניתוח דמה (דמה, n = 15). הערכת תפקוד הלב בוצעה על ידי אקוקרדיוגרפיה שבוע ושלושה שבועות לאחר הניתוח. צנתור לב ימין עם המתת חסד לאחר מכן בוצע 3 שבועות לאחר הניתוח. איברים נשקלו, ורקמת לב הוכנ...
Discussion
במאמר זה, אנו מציגים מודל מורין של היפרטרופיה וכישלון של RV הנגרמים על ידי עומס יתר. אנו מראים כי: (i) PTB בעכברים צעירים יכול לגרום לדרגות שונות של פתולוגיה של RV, החל מהיפרטרופיה קלה של RV ועד כשל RV עם סימנים חוץ-לבביים של פירוק ופיברוזיס RV מאושר היסטולוגית. (ii) סימנים של תפקוד לקוי של RV ניתן לראות...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי Snedkermester Sophus Jacobsen og Hustru Astrid Jacobsens Fond, Helge Peetz og Verner Peetz og hustru Vilma Peetz Legat, Grosserer A.V. Lykfeldt og Hustrus Legat. יתר על כן, המחברים מבקשים להודות לצוות מתקני בעלי החיים במחלקה לרפואה קלינית, אוניברסיטת ארהוס, על תמיכתם במהלך ביצוע העבודה הניסויית.
Materials
| Name | Company | Catalog Number | Comments |
| Biosyn 6-0, monofilament, absorbable suture | Covidien | UM-986 | |
| Blunt cannula, 27G 0.4x0.25, | Sterican | 292832 | |
| Bupaq Multidose vet 0,3 mg/ml (Buprenorphinum) | Salfarm Danmark | VNR 472318 | |
| C57BL/6NTac mice | Taconic Biosciences | C57BL/6NTac | |
| Dagrofil 1, braided, non-absorbable suture | B Braun | C0842273 | |
| Depilatory cream | Veet | 3132000 | |
| Disinfection Swabs (82% Ethanol + 0.5% Chlorhexidine) | Mediq | 3340122 | |
| Disposable scalpels, size 11 | Swann-Morton | 11708353 | |
| Dräger Vapor 2000 Sevoflurane | Dräger | M35054 | |
| Eye oinment neutral, "Ophta" | Actavis | MTnr.: 07586 Vnr: 53 96 68 | |
| Horizon ligating clips | Teleflex Medical | 5200 (IPN914931) | |
| Horizon Open Ligating Clips applier, curved, 6" (15 cm) | Teleflex Medical | 537061 | |
| Kitchen roll holder | n.a. | n.a. | |
| Metal wire of different thickness | n.a. | n.a. | |
| Microsurgical instruments set | Thompson | n.a. | |
| MiniVent Ventilator | Hugo Sachs | Type 845 | |
| MS505S transducer | Visual sonics | n.a. | |
| Rimadyl Bovis vet. 50 mg/ml (Carprofen) | Zoetis | MTnr: 34547, Vnr: 10 27 99, | |
| Sevoflurane Baxter 100 % | Baxter Medical | MTnr: 35015 | |
| Silicone tubing | n.a. | n.a. | |
| Soft plastic sheet | n.a. | n.a. | |
| Stereomicroscope, "Opmi Pico" | Carl Zeiss Surgicals GmbH | n.a. | |
| Ultrasonic probe holder/rail | Visual Sonics | 11277 | |
| Varming plate | Visual sonics | 11437 | |
| Venflon ProSafety, 22G, 0,9 x 25mm | Becton Dickinson | 393222 |
References
- Voelkel, N. F., et al. Right ventricular function and failure: Report of a national heart, lung, and blood institute working group on cellular and molecular mechanisms of right heart failure. Circulation. 114 (17), 1883-1891 (2006).
- Haddad, F., Doyle, R., Murphy, D. J., Hunt, S. A. Right ventricular function in cardiovascular disease, part ii: Pathophysiology, clinical importance, and management of right ventricular failure. Circulation. 117 (13), 1717-1731 (2008).
- Van De Veerdonk, M. C., et al. Progressive right ventricular dysfunction in patients with pulmonary arterial hypertension responding to therapy. J Am Coll Cardiol. 58 (24), 2511-2519 (2011).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: Problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: The evolution of animal models in pulmonary hypertension research; are we there yet. Pulm Circ. 3 (4), 739-756 (2013).
- Andersen, A., et al. Animal models of right heart failure. Cardiovasc Diagn Ther. 10 (5), 1561-1579 (2020).
- Voelkel, N. F., Tuder, R. M. Hypoxia-induced pulmonary vascular remodeling: A model for what human disease. J Clin Invest. 106 (6), 733-738 (2000).
- Rabinovitch, M., Gamble, W., Nadas, A. S., Miettinen, O. S., Reid, L. Rat pulmonary circulation after chronic hypoxia: Hemodynamic and structural features. Am J Physiol. 236 (6), H818-H827 (1979).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. Faseb j. 15 (2), 427-438 (2001).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. Am J Respir Crit Care Med. 184 (10), 1171-1182 (2011).
- Nicolls, M. R., et al. New models of pulmonary hypertension based on VEGF receptor blockade-induced endothelial cell apoptosis. Pulm Circ. 2 (4), 434-442 (2012).
- Hessel, M. H., Steendijk, P., Den Adel, B., Schutte, C. I., Van Der Laarse, A. Characterization of right ventricular function after monocrotaline-induced pulmonary hypertension in the intact rat. Am J Physiol Heart Circ Physiol. 291 (5), H2424-H2430 (2006).
- Gomez-Arroyo, J. G., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Janssen, W., et al. 5-ht2b receptor antagonists inhibit fibrosis and protect from RV heart failure. Biomed Res Int. 2015, 438403 (2015).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050 (2018).
- Axelsen, J. B., et al. Effects of 6-mercaptopurine in pressure overload induced right heart failure. PLoS One. 14 (11), e0225122 (2019).
- Egemnazarov, B., et al. Pressure overload creates right ventricular diastolic dysfunction in a mouse model: Assessment by echocardiography. J Am Soc Echocardiogr. 28 (7), 828-843 (2015).
- Wang, Q., et al. Induction of right ventricular failure by pulmonary artery constriction and evaluation of right ventricular function in mice. J Vis Exp. (147), e59431 (2019).
- Kojonazarov, B., et al. The peroxisome proliferator-activated receptor β/δ agonist gw0742 has direct protective effects on right heart hypertrophy. Pulm Circ. 3 (4), 926-935 (2013).
- Kojonazarov, B., et al. P38 MAPK inhibition improves heart function in pressure-loaded right ventricular hypertrophy. Am J Respir Cell Mol Biol. 57 (5), 603-614 (2017).
- Rai, N., et al. Effect of Riociguat and Sildenafil on right heart remodeling and function in pressure overload induced model of pulmonary arterial banding. Biomed Res Int. 2018, 3293584 (2018).
- Sydykov, A., et al. Genetic deficiency and pharmacological stabilization of mast cells ameliorate pressure overload-induced maladaptive right ventricular remodeling in mice. Int J Mol Sci. 21 (23), 9099 (2020).
- Andersen, S., et al. Effects of combined angiotensin ii receptor antagonism and neprilysin inhibition in experimental pulmonary hypertension and right ventricular failure. Int J Cardiol. 293, 203-210 (2019).
- Andersen, S., et al. Pressure overload induced right ventricular remodeling is not attenuated by the anti-fibrotic agent pirfenidone. Pulm Circ. 9 (2), 2045894019848659 (2019).
- Labazi, H., et al. Sex-dependent changes in right ventricular gene expression in response to pressure overload in a rat model of pulmonary trunk banding. Biomedicines. 8 (10), 430 (2020).
- Sun, X. Q., et al. Increased mao-a activity promotes progression of pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 64 (3), 331-343 (2021).
- Axelsen, J. S., et al. Effects of Empagliflozin on right ventricular adaptation to pressure overload. Front Cardiovasc Med. 10, 1302265 (2023).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660 (2023).
- Boehm, M., et al. Delineating the molecular and histological events that govern right ventricular recovery using a novel mouse model of pulmonary artery de-banding. Cardiovasc Res. 116 (10), 1700-1709 (2020).
- Andersen, S., et al. Effects of bisoprolol and losartan treatment in the hypertrophic and failing right heart. J Card Fail. 20 (11), 864-873 (2014).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210 (2015).
- Vildbrad, M. D., et al. Limitations and pitfalls in measurements of right ventricular stroke volume in an animal model of right heart failure. Physiol Meas. 36 (5), 925-937 (2015).
- Boehm, M., et al. Maintained right ventricular pressure overload induces ventricular-arterial decoupling in mice. Exp Physiol. 102 (2), 180-189 (2017).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041 (2014).
- Luitel, H., et al. Pressure overload leads to an increased accumulation and activity of mast cells in the right ventricle. Physiol Rep. 5 (6), e13146 (2017).
- Mamazhakypov, A., et al. Novel therapeutic targets for the treatment of right ventricular remodeling: Insights from the pulmonary artery banding model. Int J Environ Res Public Health. 18 (16), 8297 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved