È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un modello murino di ipertrofia ventricolare destra indotta da sovraccarico di pressione e insufficienza mediante bande del tronco polmonare
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Descriviamo un modello murino di sovraccarico di pressione ventricolare destra indotto dal banding polmonare del tronco. Nel documento sono inclusi protocolli dettagliati per l'intubazione, la chirurgia e la fenotipizzazione mediante ecocardiografia. Per l'intubazione e la chirurgia vengono utilizzati strumenti su misura, che consentono una riproduzione rapida ed economica del modello.
Abstract
L'insufficienza ventricolare destra (RV) causata da un sovraccarico di pressione è fortemente associata a morbilità e mortalità in una serie di malattie cardiovascolari e polmonari. La patogenesi dell'insufficienza ventricolare sinistra è complessa e rimane inadeguatamente compresa. Per identificare nuove strategie terapeutiche per il trattamento dell'insufficienza ventricolare destra, sono essenziali modelli animali robusti e riproducibili. I modelli di bendaggio del tronco polmonare (PTB) hanno guadagnato popolarità, poiché la funzione del ventricolo destro può essere valutata indipendentemente dai cambiamenti nella vascolarizzazione polmonare.
In questo articolo, presentiamo un modello murino di sovraccarico di pressione del ventricolo destro indotto da PTB in topi di 5 settimane. Il modello può essere utilizzato per indurre diversi gradi di patologia del ventricolo destro, che vanno dalla lieve ipertrofia del ventricolo destro al fallimento del ventricolo destro scompensato. Nel documento sono inclusi protocolli dettagliati per l'intubazione, la chirurgia PTB e la fenotipizzazione mediante ecocardiografia. Inoltre, vengono fornite le istruzioni per la personalizzazione degli strumenti per l'intubazione e la chirurgia PTB, consentendo una riproduzione rapida ed economica del modello PTB.
Sono state utilizzate clip di legatura in titanio per restringere il tronco polmonare, garantendo un grado di costrizione del tronco polmonare altamente riproducibile e indipendente dall'operatore. La gravità del PTB è stata classificata utilizzando diversi diametri della clip di legatura interna (lieve: 450 μm e grave: 250 μm). Ciò ha portato a una patologia del ventricolo destro che va dall'ipertrofia con funzione del ventricolo destro conservata all'insufficienza del ventricolo destro scompensata con ridotta gittata cardiaca e manifestazioni extracardiache. La funzione del ventricolo destro è stata valutata mediante ecocardiografia a 1 settimana e 3 settimane dopo l'intervento chirurgico. Esempi di immagini ecocardiografiche e risultati sono presentati qui. Inoltre, vengono mostrati i risultati del cateterismo cardiaco destro e le analisi istologiche del tessuto cardiaco.
Introduzione
L'insufficienza ventricolare destra (RV) è una sindrome clinica con sintomi di insufficienza cardiaca e segni di congestione sistemica derivanti da disfunzione RV1. La disfunzione del ventricolo destro è fortemente associata alla morbilità e alla mortalità in un certo numero di malattie cardiovascolari e polmonari2. L'eziologia della disfunzione del ventricolo destro è complessa e le sue vie di segnalazione e regolazione sottostanti rimangono inadeguatamente chiarite.
Le osservazioni delle terapie attuali mostrano che il miglioramento della funzione del ventricolo destro è strettamente correlato alla riduzione del postcarico, suggerendo che la vascolarizzazione polmonare sia l'obiettivo primariodel trattamento 3. Ciò indica che le terapie attuali hanno solo un effetto diretto minimo sulla funzione del ventricolo destro, che può deteriorarsi anche dopo il miglioramento della resistenza vascolare polmonare3. Sono quindi estremamente necessarie ulteriori ricerche per migliorare la funzione del ventricolo destro indipendentemente dalla riduzione del postcarico.
Modelli animali robusti e riproducibili sono essenziali nella ricerca di nuovi agenti terapeutici. Nella maggior parte dei modelli di insufficienza cronica del ventricolo destro, la causa sottostante è l'ipertensione polmonare indotta da un'alterazione strutturale del sistema vascolarepolmonare 4,5,6. Modelli ben caratterizzati includono il modello di ipossia cronica 7,8, il modello di ipossia di Sugen 9,10,11 e il modello monocrotalina 12,13. Poiché in questi modelli l'insufficienza del ventricolo destro è secondaria all'ipertensione polmonare, è impossibile differenziare gli effetti degli interventi sul sistema vascolare polmonare dagli effetti diretti sul ventricolodestro 6.
Per studiare il RV indipendentemente dalla vascolarizzazione polmonare, il modello di banding del tronco polmonare (PTB) ha guadagnato popolarità ed è stato descritto in diverse specie animali, tra cui topi, ratti, conigli, cani, pecore e maiali 6,14,15,16,17,18,19,20,21,22,23, 24,25,26,27. Nei modelli PTB, la costrizione del tronco polmonare si ottiene chirurgicamente, causando un aumento della pressione del ventricolo destro6. Esistono diversi approcci all'applicazione del PTB, tra cui la costrizione del vaso con una legatura o con una clip di legatura metallica18,28. Nei modelli che utilizzano legature, il tronco polmonare è legato a un ago e l'ago viene retratto, lasciando la legatura in posizione. Ciò si traduce in una costrizione del vaso che dipende dalla dimensione dell'ago e dalla tensione del nodo18,29. Nei modelli che utilizzano clip di legatura metalliche, il grado di costrizione del tronco polmonare può essere più riproducibile. Gli applicatori di clip di legatura modificati vengono utilizzati per chiudere le clip di legatura a un diametro predefinito e costante. Ciò rende il metodo indipendente dall'operatore e riduce la variabilità correlata al PTB nel fenotipo della malattia 15,27,28.
È stato dimostrato che i modelli di PTB murino inducono ipertrofia e fallimento del ventricolo destro18,28. Una delle principali sfide quando si utilizza il modello PTB è la scelta del diametro PTB appropriato per ottenere il grado desiderato di patologia del ventricolo destro. Ciò è particolarmente impegnativo quando si tenta di modellare il guasto di un camper scompensato. Per questo, la costrizione deve essere abbastanza stretta da indurre l'insufficienza cronica del ventricolo destro senza portare all'insufficienza acuta del ventricolo destro e alla morte poco dopo l'intervento chirurgico6. Un approccio per risolvere questa sfida consiste nell'utilizzare animali svezzati o giovani 6,15. Un modello PTB è stato utilizzato con successo per studiare diversi stadi di cedimento del RV utilizzando svezzati di ratto Wistar15,30. Per raggiungere questo obiettivo, i ratti giovani con potenziale di crescita residuo sono stati sottoposti a chirurgia PTB con l'applicazione di clip di legatura in titanio. Quando i ratti sono cresciuti, la stenosi polmonare è diventata gradualmente più grave e ha provocato ipertrofia del ventricolo destro o insufficienza cronica del ventricolo destro, a seconda della gravità del PTB15,30. Ispirati da questo modello, abbiamo ipotizzato che diversi stadi della patologia del ventricolo destro potessero essere prodotti in un modello di PTB murino utilizzando topi giovani. Lo studio di un ampio spettro di patologie del ventricolo destro, dalla malattia lieve a quella grave, può aiutare a chiarire la nostra comprensione della progressione della malattia e la transizione dall'ipertrofia del ventricolo destro al fallimento del ventricolo destro.
Qui, presentiamo un modello murino di sovraccarico di pressione RV indotto da PTB in topi giovani. Con questo modello è possibile produrre diversi gradi di patologia del ventricolo destro, che vanno dall'ipertrofia del ventricolo destro al fallimento del ventricolo destro scompensato. Questo studio include protocolli dettagliati per l'intubazione, la chirurgia PTB e la fenotipizzazione mediante ecocardiografia.
Protocollo
Lo studio è stato approvato dall'Ispettorato danese per gli esperimenti sugli animali (numero di autorizzazione: 2021-15-0201-00928) ed è stato eseguito in conformità con la legislazione nazionale sugli animali da laboratorio. Questo studio ha utilizzato topi maschi C57BL/6N di 5 settimane.
1. Personalizzazione degli strumenti per l'intubazione e la chirurgia (Figura 1)
NOTA: Questa sezione descrive in dettaglio le fasi più importanti nella preparazione di strumenti su misura per l'intubazione e la chirurgia PTB con materiali economici e facilmente reperibili.
- Preparare il tubo endotracheale (Figura 1A).
I comuni cateteri endovenosi (IV) possono essere utilizzati per l'intubazione e la ventilazione dei topi.- Scegliere la dimensione appropriata del catetere intravascolare corrispondente alle dimensioni dei topi. Si consiglia un catetere da 22 G per i topi di 5 settimane (17-20 g) e un catetere da 23 G per i topi più grandi (>20 g).
- Estrarre l'ago e staccare il meccanismo di bloccaggio. Reinserire l'ago nel catetere e tagliare la punta dell'ago con un angolo di 45°, a circa 2 mm dalla punta del catetere.
- Usa la carta vetrata per smussare la punta per evitare lesioni alle corde vocali dei topi.
- Tagliare un'ala del catetere per una migliore visuale durante l'intubazione.
- Preparare il divaricatore toracico (Figura 1B).
- Utilizzare un portaaghi per piegare un pezzo di filo metallico flessibile di circa 10 cm al centro con un angolo di 30°.
- Utilizzare il portaaghi per creare con cura ganci atraumatici di 5 mm di larghezza su entrambe le estremità del filo.
- Preparare il supporto per intubazione (Figura 1C).
NOTA: L'uso di un supporto per intubazione consente l'erogazione continua dell'anestesia tramite un tubo nasale durante l'intubazione. Ciò consente un'intubazione controllata e sicura sotto guida visiva, riducendo il rischio di lesioni alle corde vocali e alla trachea, nonché il rischio di posizionamento errato del tubo nell'esofago. Qualsiasi telaio in metallo o plastica può essere utilizzato come telaio per il supporto per intubazione. In questo studio è stato utilizzato un titolare del ruolo di cucina leggermente piegato.- Taglia un pezzo di tubo di gomma di 3 cm che si adatti al muso di un topo e collegalo a una valvola del catetere IV. L'anestesia inalante può essere collegata tramite la valvola prima dell'intubazione.
- Realizzare un cappio utilizzando una sutura intrecciata 1-0 a circa 5 mm dall'apertura del tubo. Questo verrà utilizzato per fissare il muso murino nel tubo.
- Praticare un foro vicino alla parte superiore di un foglio di plastica flessibile e posizionare il tubo nel foro. Il foglio viene utilizzato per sostenere il topo nel supporto per intubazione.
- Utilizzare del nastro adesivo per tenere insieme le singole parti come mostrato nella Figura 1C.
- Preparare la cannula di guida (Figura 1D, E).
- Tirare una sutura monofilamento 6-0 attraverso una cannula smussata da 27G e fare un nodo sulla sutura. Utilizzare questo nodo in seguito per afferrare la sutura durante l'intervento chirurgico PTB.
- Utilizzare un portaaghi per piegare la punta della cannula a un angolo di 80°.
- Prepara l'applicatore di clip per legatura.
NOTA: Un applicatore di clip di legatura con ganasce angolate viene modificato con un meccanismo di arresto regolabile (Figura 1F), che interrompe la compressione della clip di legatura quando le ganasce si trovano a una distanza predeterminata con precisione l'una dall'altra. L'applicatore di clip di legatura modificato viene utilizzato per l'applicazione di clip di legatura in titanio sul tronco polmonare.- Fissare un pezzo di ottone tagliato su misura alle maniglie dell'applicatore di clip per legatura con due viti. Montare una vite regolabile al centro (Figura 1F, freccia bianca) che determina la distanza esatta tra le impugnature compresse dell'applicatore di clip di legatura, che corrisponde a una distanza precisa tra le ganasce.

Figura 1: Strumenti per l'intubazione e la chirurgia PTB. (A) Tubo endotracheale costituito da un catetere IV. (B) Divaricatore toracico. (C) Supporto per intubazione e topo posizionato nel supporto per intubazione che riceve anestesia su un tubo nasale. (D) Strumenti chirurgici e applicatore di clip di legatura modificato utilizzati per la chirurgia PTB. (E) Cannula di guida. (F) Meccanismo di arresto regolabile su misura. Clicca qui per visualizzare una versione più grande di questa figura.
2. Regolazione dell'applicatore di clip di legatura
- Scegliere il diametro interno della clip di legatura in base alla gravità desiderata del guasto del ventricolo destro. Per i topi maschi C57BL/6N di 5 settimane (17-20 g), utilizzare un diametro della clip di 250 μm per i carichi gravi e di 450 μm per i sovraccarichi di pressione ventricolare ventricolare sinistra. Utilizzare diametri di clip intermedi per indurre un moderato sovraccarico di pressione.
- Utilizzare filo metallico o aghi per regolare l'applicatore di clip per legatura. Assicurarsi che il diametro del filo corrisponda al diametro della clip desiderato.
- Caricare l'applicatore di clip con una clip di legatura e posizionare il filo di regolazione al centro della clip di legatura. Mentre si comprime l'applicatore di clip, ruotare la vite finché le ganasce della clip non si adattano perfettamente al filo. Assicurarsi che la clip rimanga in posizione sul cavo di regolazione una volta rilasciato l'applicatore di clip.
- Con l'applicatore di clip regolato, posizionare un'altra clip di legatura sul filo di regolazione per convalidare il diametro impostato.
3. Preparativi per l'intervento chirurgico
- Indurre l'anestesia in una camera di induzione utilizzando il 7% di sevoflurano in 0,6 L/min di ossigeno al 100%. Confermare un'anestesia sufficiente pizzicando le dita dei piedi prima dell'intubazione.
NOTA: Può essere utilizzato anche l'isoflurano. Tenere presente che è necessario utilizzare concentrazioni diverse. - Intubare il topo con un catetere IV 22G. Eseguire l'intubazione sotto guida visiva, utilizzando un microscopio operatorio e un supporto per intubazione, consentendo un corretto allineamento per la visualizzazione delle corde vocali e l'erogazione continua di anestetici inalanti su un tubo nasale (Figura 1C).
- Ventilare il mouse a 175 colpi/min e un volume corrente di 300 μL/corsa.
NOTA: Si raccomandano anche volumi correnti di 8-10 μL/g e il volume corrente ideale dipende da possibili perdite e spazi morti nel sistema di ventilazione. - Posizionare il mouse intubato su un termoforo coperto (37 °C) e applicare un unguento idratante sugli occhi del topo.
- Mantenere l'anestesia (3,5% di sevoflurano in 0,6 L/min di ossigeno al 100%) e somministrare 0,1 mg/kg di buprenorfina e 5 mg/kg di carprofene per via sottocutanea per l'analgesia perioperatoria. Rimuovere tutti i peli dal torace utilizzando una crema depilatoria e disinfettare la pelle con salviette disinfettanti.
4. Chirurgia PTB
- Praticare un'incisione di 10 mm nella pelle sopra il secondo spazio intercostale dall'angolo sternale alla linea ascellare anteriore sinistra. Dividere i muscoli pettorali maggiori e minori mediante dissezione smussata.
- Tagliare i muscoli intercostali nel secondo spazio intercostale e sezionare senza mezzi termini il timo per esporre il cuore, il tronco polmonare e l'aorta. Posizionare un divaricatore toracico nello spazio intercostale per mantenere accessibile il campo operatorio.
NOTA: È necessario prestare molta attenzione quando si tagliano i muscoli intercostali, poiché l'arteria mammaria interna sinistra corre solo 1-2 mm lateralmente rispetto allo sterno. La lesione di questa arteria può causare una significativa perdita di sangue. - Separare il tronco polmonare dall'aorta ascendente rimuovendo senza mezzi termini il tessuto connettivo tra i vasi utilizzando una pinza microscopica. Migliora ulteriormente l'esposizione del tronco polmonare ruotando la parte inferiore del corpo del topo (gamba sinistra su gamba destra).
- Far passare la cannula di guida attraverso il seno pericardico trasverso posteriormente al tronco polmonare. Usa una pinza per afferrare il nodo sulla punta della cannula di guida e tirare la sutura attraverso la cannula di guida. Rimuovere con cautela la cannula di guida mentre la sutura rimane in posizione attorno al tronco polmonare.
- Caricare l'applicatore della clip di legatura e utilizzare la sutura per guidare il tronco polmonare nelle ganasce della clip di legatura e comprimere la clip. Rilasciare la sutura immediatamente dopo il posizionamento della clip e osservare il riempimento del tronco polmonare.
NOTA: La bradicardia può essere osservata nei primi secondi dopo l'applicazione della clip di legatura. - Posizionare una sutura assorbibile in monofilamento 6-0 attorno alla seconda e alla terza costa e chiudere lo spazio intercostale. Evacuare quanta più aria possibile dalla cavità toracica esercitando una leggera pressione sul torace mentre si stringe la sutura.
- Infine, sutura la pelle con una sutura assorbibile in monofilamento 6-0.
- Eseguire la stessa procedura, ad eccezione del posizionamento della clip di legatura (passaggio 4.5), durante l'intervento chirurgico fittizio.
5. Ecocardiografia
- Dopo l'induzione dell'anestesia in una camera di induzione (1-2 minuti, 6% di sevoflurano in ossigeno al 100%), mantenere l'anestesia utilizzando un tubo nasale (3,5% di sevoflurano in ossigeno al 100%). Rimuovere tutti i peli dal torace e dall'addome utilizzando una crema depilatoria e posizionare il mouse su un termoforo. Applicare un unguento idratante sugli occhi e un gel per ultrasuoni sul petto del topo.
NOTA: Regola il guadagno 2D, la profondità di messa a fuoco e la profondità dell'immagine per migliorare la qualità dell'immagine in tutte le misurazioni ecocardiografiche. - Regolare la sonda a ultrasuoni per trovare la vista dell'asse lungo parasternale (PLAX) (Figura 2). In PLAX, misurare il diametro interno del tronco polmonare e l'integrale velocità-tempo (VTI) nel tronco polmonare.
- Selezionare la modalità B e spostare con cautela il termoforo sugli assi x, y e z per identificare il tronco polmonare al centro dell'immagine. Usa il colore per identificare il diametro del tronco polmonare più grande. Utilizzare cine store per acquisire una sequenza per la misurazione del diametro del tronco polmonare.
- Selezionare il colore e l'onda del polso (PW) Doppler e posizionare il cursore al centro del tronco polmonare. Regolare l'angolo PW fino a quando le linee tratteggiate sono parallele al flusso sanguigno nel vaso.
- Premere cine store per misurare il VTI. Posizionare il cursore vicino a entrambe le pareti del tronco polmonare e premere nuovamente cine store per acquisire il flusso vicino alla parete del vaso.
NOTA: Il diametro interno del ventricolo destro (RV) e lo spessore della parete libera RV possono essere valutati anche nella vista PLAX.
- Trova la vista dell'asse corto parasternale (PSAX) (Figura 3) per misurare i diametri interni del ventricolo sinistro (LV), che può essere utilizzato per valutare il rigonfiamento del setto nasale (configurazione D).
- Selezionare la modalità B e ruotare la sonda di 90° in senso antiorario. Inclinare la sonda di 20-30 gradi lateralmente per evitare l'ombreggiamento del ventricolo destro da parte dello sterno e inclinare la sonda di 20-30 gradi cranialmente fino a quando il ventricolo sinistro è il più rotondo possibile. Quindi, far scorrere la sonda in direzione cranio-caudale per identificare il livello dei muscoli papillari con i diametri ventricolari più grandi e premere cine store.
NOTA: PSAX a livello mediopapillare può essere utilizzato anche per valutare la variazione dell'area frazionaria del ventricolo destro. Il PSAX a livello della valvola aortica può essere utilizzato per misurare l'accorciamento frazionato del ventricolo destro o lo spessore della parete libera del ventricolo destro.
- Selezionare la modalità B e ruotare la sonda di 90° in senso antiorario. Inclinare la sonda di 20-30 gradi lateralmente per evitare l'ombreggiamento del ventricolo destro da parte dello sterno e inclinare la sonda di 20-30 gradi cranialmente fino a quando il ventricolo sinistro è il più rotondo possibile. Quindi, far scorrere la sonda in direzione cranio-caudale per identificare il livello dei muscoli papillari con i diametri ventricolari più grandi e premere cine store.
- Utilizzare la vista apicale a 4 camere (A4CH) (Figura 4) per misurare l'escursione sistolica del piano anulare tricuspidale (TAPSE) e valutare il rigurgito tricuspidale.
- Posizionare la sonda come mostrato nella Figura 4. Una volta identificato il cuore, apportare piccole modifiche alla sonda utilizzando solo il polso e le dita per identificare tutte e quattro le camere del cuore e la valvola tricuspide.
- Identificare e mantenere una buona visuale A4CH è una sfida. Lasciare che la mano che aziona la sonda poggi sul termoforo per stabilità. Far scorrere, inclinare e ruotare leggermente la sonda fino a trovare l'immagine appropriata.
- Muovi la sonda solo in una dimensione alla volta: ad esempio, fai scorrere il cranio-caudale per trovare il cuore, quindi inclina la sonda per identificare tutte e quattro le camere e infine ruota la sonda fino a quando tutte e quattro le camere e la valvola tricuspide sono nel telaio. Se necessario, ripetere più volte tutti e tre i passaggi prima di ottenere l'immagine ideale.
- Una volta identificata la valvola tricuspide, selezionare la modalità M e posizionare la linea tratteggiata nell'anulus tricuspidale della parete libera. Premere cine store per salvare le misurazioni.
- Selezionare il colore per valutare la valvola tricuspide per il rigurgito. Se è presente rigurgito, in sistole si vedrà un getto di flusso retrogrado dal ventricolo destro all'atrio destro (RA) (Figura 5).
NOTA: Nella vista A4CH, possono essere misurati anche il Doppler tissutale nella parete libera del ventricolo destro e la velocità di afflusso del ventricolo destro.
- Posizionare la sonda come mostrato nella Figura 4. Una volta identificato il cuore, apportare piccole modifiche alla sonda utilizzando solo il polso e le dita per identificare tutte e quattro le camere del cuore e la valvola tricuspide.
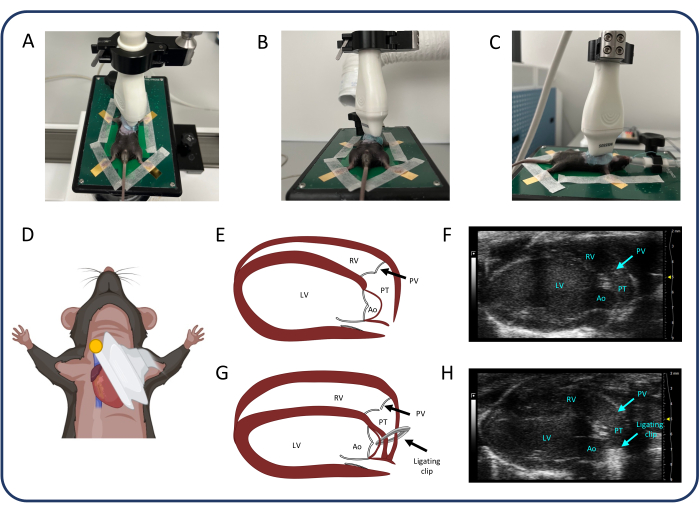
Figura 2: Vista parasternale dell'asse lungo (PLAX). (A-D) Posizionamento della sonda ad ultrasuoni. (E, F) Il cuore murino normale in PLAX. (G, H) Dilatazione e ipertrofia del ventricolo destro dopo PTB. Abbreviazioni: LV: ventricolo sinistro, RV: ventricolo destro, PV: valvola polmonare, PT: tronco polmonare, Ao: aorta. Clicca qui per visualizzare una versione più grande di questa figura.
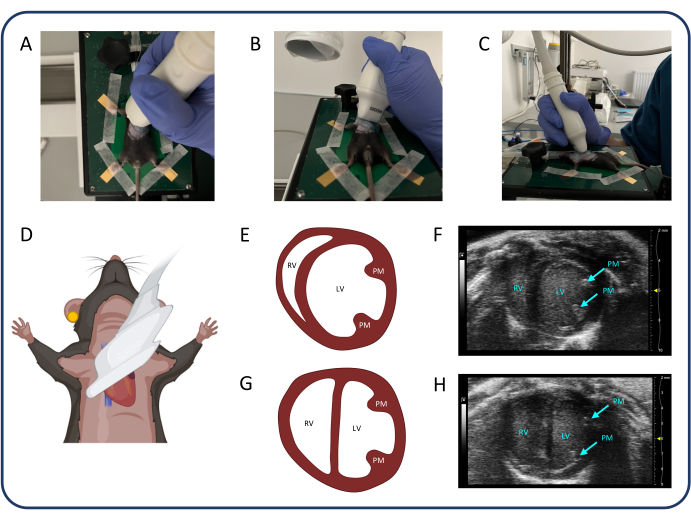
Figura 3: Vista dell'asse corto parasternale (PSAX). (A-D) Posizionamento della sonda ad ultrasuoni. (E, F) Il normale cuore murino in PSAX. (G, H) PSAX dopo PTB. Abbreviazioni: LV: ventricolo sinistro, RV: ventricolo destro, PM: muscolo papillare. Clicca qui per visualizzare una versione più grande di questa figura.
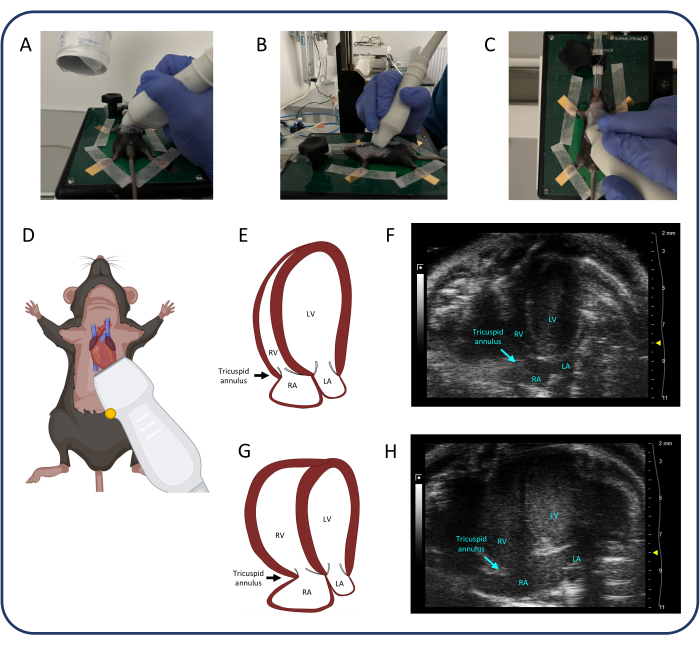
Figura 4: Vista apicale a 4 camere (A4CH). (A-D) Posizionamento della sonda a ultrasuoni. (E, F) Il normale cuore murino nella vista A4CH. (G, H) Dilatazione del ventricolo destro e dell'artrite reumatoide dopo PTB. Abbreviazioni: LV: ventricolo sinistro, RV: ventricolo destro, RA: atrio destro, LA: atrio sinistro. Clicca qui per visualizzare una versione più grande di questa figura.
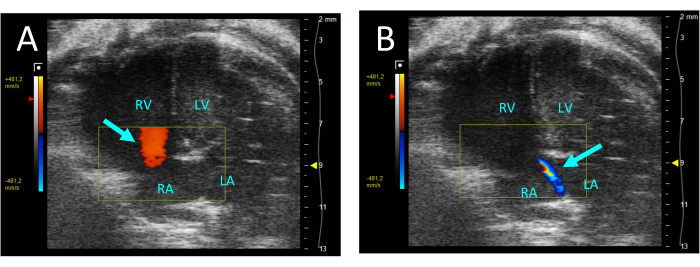
Figura 5: Rigurgito tricuspidale visualizzato dal color Doppler nella vista A4CH. (A) Nella diastole, si osserva il flusso dall'AR al ventricolo destro (freccia). (B) Durante la sistole, è visibile un sottile getto di flusso dal ventricolo destro all'artrite reumatoide (freccia). Abbreviazioni: LV: ventricolo sinistro, RV: ventricolo destro, RA: atrio destro, LA: atrio sinistro. Clicca qui per visualizzare una versione più grande di questa figura.
6. Analisi dei dati
- Misurare il diametro del tronco polmonare in tre cicli cardiaci in PLAX e utilizzare il diametro medio del tronco polmonare per ulteriori analisi dei dati. Misurare il VTI in tre cicli cardiaci in PLAX per ciascuno dei tre cine loop memorizzati (al centro del tronco polmonare e vicino alle pareti del vaso). Utilizzare il VTI medio di tutte le misurazioni VTI per ulteriori analisi. Utilizzare la seguente formula per calcolare il CO:
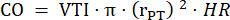
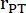 : radio del tronco polmonare, FC: frequenza cardiaca
: radio del tronco polmonare, FC: frequenza cardiaca - Misurare LVEI in PSAX a livello mediopapillare. Utilizzare uno strumento di misurazione per misurare il diametro interno del ventricolo sinistro più grande (LVid1) dalla metà del setto alla parete libera. Quindi, misurare il diametro interno del ventricolo sinistro ortogonale alla prima misurazione (LVid2). Ripetere queste misurazioni in tre cicli cardiaci e calcolare il LVEI utilizzando i diametri interni medi del ventricolo sinistro e la seguente formula:
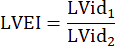
- Misura TAPSE in tre cicli cardiaci nella vista A4CH e utilizza TAPSE medio per ulteriori analisi dei dati.
7. Cateterismo cardiaco destro
- Misurare la pressione e il volume del ventricolo destro (RV) mediante cateterismo cardiaco destro con un catetere a micropunta da 1,4 F 3 settimane dopo l'intervento chirurgico PTB.
- Anestetizzare e intubare il topo come descritto nei passaggi 3.1-3.4. Posizionare il mouse su un termoforo coperto (37 °C) e mantenere l'anestesia (3,5% di sevoflurano in 0,6 L/min 100% di ossigeno).
- Somministrare 2000 UI di eparina (intramuscolare [i.m.]) e 0,5 mL di NaCl (sottocutaneo [s.c.]).
- Usando le forbici chirurgiche, tagliare la parete addominale appena caudalmente al processo xifoideo e ottenere l'accesso alla cavità toracica tagliando con cura il diaframma lungo la sua incisione nella parete toracica. Tagliare il diaframma e le coste fino a ottenere un accesso sufficiente al cuore.
- Posizionare una legatura attorno alla vena cava inferiore. Utilizzare questa opzione per occludere il recipiente per ridurre il precarico per la registrazione delle misure di pressione-volume più avanti nel protocollo.
- Utilizzare un ago da 26 G per praticare con cautela un piccolo foro nel ventricolare. Assicurarsi che sia il più vicino possibile all'apice e che l'ago non penetri completamente nel ventricolo, ma funga semplicemente da guida per l'inserimento del catetere di conduttanza. In caso di sanguinamento, applicare una leggera pressione con un piccolo batuffolo di cotone per ridurre al minimo la perdita di sangue.
- Identificare il piccolo foro nella parete ventricolare e inserire il catetere penetrando nel tessuto.
NOTA: Quando si inserisce il catetere, fare attenzione a non danneggiare la parete ventricolare interna. - Le variazioni della pressione ventricolare destra (RVP) si osservano spesso per diversi minuti dopo l'inserimento del catetere. Attendere che RVP si stabilizzi per ottenere misurazioni rappresentative allo stato stazionario.
- Per ottenere anse pressione-volume, utilizzare la legatura precedentemente posizionata intorno alla vena cava inferiore. Tirare con cautela la legatura per occludere il vaso, riducendo così gradualmente il precarico.
- Una volta registrati i loop rappresentativi di pressione-volume, estrarre il catetere e sopprimere il topo mediante escissione del cuore. A questo punto, raccogliere campioni di sangue e tessuti per ulteriori analisi.
Risultati
I topi C57BL/6N (maschi, 5 settimane, 17-20 g) sono stati randomizzati a PTB grave (sPTB, 250 μm, n = 12), PTB lieve (mPTB, 450 μm, n = 9) o chirurgia fittizia (sham, n = 15). La valutazione della funzione cardiaca è stata eseguita mediante ecocardiografia 1 settimana e 3 settimane dopo l'intervento chirurgico. Il cateterismo cardiaco destro con successiva eutanasia è stato eseguito 3 settimane dopo l'intervento. Gli organi sono stati pesati e il tessuto cardiaco è stato preparato per le analisi istologiche.
Discussione
In questo articolo, presentiamo un modello murino di ipertrofia e fallimento del ventricolo destro indotto da sovraccarico di pressione. Dimostriamo che: (i) il PTB nei topi giovani può indurre vari gradi di patologia del ventricolo destro, che vanno da una lieve ipertrofia del ventricolo destro all'insufficienza del ventricolo destro con segni extracardiaci di scompenso e fibrosi del ventricolo destro istologicamente confermata. (ii) I segni di disfunzione del ventricolo destro possono essere osservati e quantificati m...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da Snedkermester Sophus Jacobsen og Hustru Astrid Jacobsens Fond, Helge Peetz og Verner Peetz og hustru Vilma Peetz Legat, Grosserer A.V. Lykfeldt og Hustrus Legat. Inoltre, gli autori desiderano ringraziare il personale delle strutture per animali presso il Dipartimento di Medicina Clinica dell'Università di Aarhus, per il loro supporto durante l'esecuzione del lavoro sperimentale.
Materiali
| Name | Company | Catalog Number | Comments |
| Biosyn 6-0, monofilament, absorbable suture | Covidien | UM-986 | |
| Blunt cannula, 27G 0.4x0.25, | Sterican | 292832 | |
| Bupaq Multidose vet 0,3 mg/ml (Buprenorphinum) | Salfarm Danmark | VNR 472318 | |
| C57BL/6NTac mice | Taconic Biosciences | C57BL/6NTac | |
| Dagrofil 1, braided, non-absorbable suture | B Braun | C0842273 | |
| Depilatory cream | Veet | 3132000 | |
| Disinfection Swabs (82% Ethanol + 0.5% Chlorhexidine) | Mediq | 3340122 | |
| Disposable scalpels, size 11 | Swann-Morton | 11708353 | |
| Dräger Vapor 2000 Sevoflurane | Dräger | M35054 | |
| Eye oinment neutral, "Ophta" | Actavis | MTnr.: 07586 Vnr: 53 96 68 | |
| Horizon ligating clips | Teleflex Medical | 5200 (IPN914931) | |
| Horizon Open Ligating Clips applier, curved, 6" (15 cm) | Teleflex Medical | 537061 | |
| Kitchen roll holder | n.a. | n.a. | |
| Metal wire of different thickness | n.a. | n.a. | |
| Microsurgical instruments set | Thompson | n.a. | |
| MiniVent Ventilator | Hugo Sachs | Type 845 | |
| MS505S transducer | Visual sonics | n.a. | |
| Rimadyl Bovis vet. 50 mg/ml (Carprofen) | Zoetis | MTnr: 34547, Vnr: 10 27 99, | |
| Sevoflurane Baxter 100 % | Baxter Medical | MTnr: 35015 | |
| Silicone tubing | n.a. | n.a. | |
| Soft plastic sheet | n.a. | n.a. | |
| Stereomicroscope, "Opmi Pico" | Carl Zeiss Surgicals GmbH | n.a. | |
| Ultrasonic probe holder/rail | Visual Sonics | 11277 | |
| Varming plate | Visual sonics | 11437 | |
| Venflon ProSafety, 22G, 0,9 x 25mm | Becton Dickinson | 393222 |
Riferimenti
- Voelkel, N. F., et al. Right ventricular function and failure: Report of a national heart, lung, and blood institute working group on cellular and molecular mechanisms of right heart failure. Circulation. 114 (17), 1883-1891 (2006).
- Haddad, F., Doyle, R., Murphy, D. J., Hunt, S. A. Right ventricular function in cardiovascular disease, part ii: Pathophysiology, clinical importance, and management of right ventricular failure. Circulation. 117 (13), 1717-1731 (2008).
- Van De Veerdonk, M. C., et al. Progressive right ventricular dysfunction in patients with pulmonary arterial hypertension responding to therapy. J Am Coll Cardiol. 58 (24), 2511-2519 (2011).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: Problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: The evolution of animal models in pulmonary hypertension research; are we there yet. Pulm Circ. 3 (4), 739-756 (2013).
- Andersen, A., et al. Animal models of right heart failure. Cardiovasc Diagn Ther. 10 (5), 1561-1579 (2020).
- Voelkel, N. F., Tuder, R. M. Hypoxia-induced pulmonary vascular remodeling: A model for what human disease. J Clin Invest. 106 (6), 733-738 (2000).
- Rabinovitch, M., Gamble, W., Nadas, A. S., Miettinen, O. S., Reid, L. Rat pulmonary circulation after chronic hypoxia: Hemodynamic and structural features. Am J Physiol. 236 (6), H818-H827 (1979).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. Faseb j. 15 (2), 427-438 (2001).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. Am J Respir Crit Care Med. 184 (10), 1171-1182 (2011).
- Nicolls, M. R., et al. New models of pulmonary hypertension based on VEGF receptor blockade-induced endothelial cell apoptosis. Pulm Circ. 2 (4), 434-442 (2012).
- Hessel, M. H., Steendijk, P., Den Adel, B., Schutte, C. I., Van Der Laarse, A. Characterization of right ventricular function after monocrotaline-induced pulmonary hypertension in the intact rat. Am J Physiol Heart Circ Physiol. 291 (5), H2424-H2430 (2006).
- Gomez-Arroyo, J. G., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Janssen, W., et al. 5-ht2b receptor antagonists inhibit fibrosis and protect from RV heart failure. Biomed Res Int. 2015, 438403 (2015).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050 (2018).
- Axelsen, J. B., et al. Effects of 6-mercaptopurine in pressure overload induced right heart failure. PLoS One. 14 (11), e0225122 (2019).
- Egemnazarov, B., et al. Pressure overload creates right ventricular diastolic dysfunction in a mouse model: Assessment by echocardiography. J Am Soc Echocardiogr. 28 (7), 828-843 (2015).
- Wang, Q., et al. Induction of right ventricular failure by pulmonary artery constriction and evaluation of right ventricular function in mice. J Vis Exp. (147), e59431 (2019).
- Kojonazarov, B., et al. The peroxisome proliferator-activated receptor β/δ agonist gw0742 has direct protective effects on right heart hypertrophy. Pulm Circ. 3 (4), 926-935 (2013).
- Kojonazarov, B., et al. P38 MAPK inhibition improves heart function in pressure-loaded right ventricular hypertrophy. Am J Respir Cell Mol Biol. 57 (5), 603-614 (2017).
- Rai, N., et al. Effect of Riociguat and Sildenafil on right heart remodeling and function in pressure overload induced model of pulmonary arterial banding. Biomed Res Int. 2018, 3293584 (2018).
- Sydykov, A., et al. Genetic deficiency and pharmacological stabilization of mast cells ameliorate pressure overload-induced maladaptive right ventricular remodeling in mice. Int J Mol Sci. 21 (23), 9099 (2020).
- Andersen, S., et al. Effects of combined angiotensin ii receptor antagonism and neprilysin inhibition in experimental pulmonary hypertension and right ventricular failure. Int J Cardiol. 293, 203-210 (2019).
- Andersen, S., et al. Pressure overload induced right ventricular remodeling is not attenuated by the anti-fibrotic agent pirfenidone. Pulm Circ. 9 (2), 2045894019848659 (2019).
- Labazi, H., et al. Sex-dependent changes in right ventricular gene expression in response to pressure overload in a rat model of pulmonary trunk banding. Biomedicines. 8 (10), 430 (2020).
- Sun, X. Q., et al. Increased mao-a activity promotes progression of pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 64 (3), 331-343 (2021).
- Axelsen, J. S., et al. Effects of Empagliflozin on right ventricular adaptation to pressure overload. Front Cardiovasc Med. 10, 1302265 (2023).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660 (2023).
- Boehm, M., et al. Delineating the molecular and histological events that govern right ventricular recovery using a novel mouse model of pulmonary artery de-banding. Cardiovasc Res. 116 (10), 1700-1709 (2020).
- Andersen, S., et al. Effects of bisoprolol and losartan treatment in the hypertrophic and failing right heart. J Card Fail. 20 (11), 864-873 (2014).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210 (2015).
- Vildbrad, M. D., et al. Limitations and pitfalls in measurements of right ventricular stroke volume in an animal model of right heart failure. Physiol Meas. 36 (5), 925-937 (2015).
- Boehm, M., et al. Maintained right ventricular pressure overload induces ventricular-arterial decoupling in mice. Exp Physiol. 102 (2), 180-189 (2017).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041 (2014).
- Luitel, H., et al. Pressure overload leads to an increased accumulation and activity of mast cells in the right ventricle. Physiol Rep. 5 (6), e13146 (2017).
- Mamazhakypov, A., et al. Novel therapeutic targets for the treatment of right ventricular remodeling: Insights from the pulmonary artery banding model. Int J Environ Res Public Health. 18 (16), 8297 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon