Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Prostatectomie radicale assistée par robot épargnant Retzius
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La prostatectomie radicale Retzius assistée par robot est une technique qui permet de préserver la continence urinaire ou facilite la récupération de la continence urinaire chez la majorité des patients. Les patients doivent être informés du risque d’une marge chirurgicale positive.
Résumé
La technique de prostatectomie radicale assistée par robot épargnant Retzius (RS-RARP) et l’expérience initiale avec celle-ci dans un seul centre sont fournies. La technique est décrite étape par étape et illustrée par une vidéo pour améliorer la reproductibilité. Les premiers résultats oncologiques et fonctionnels ont été évalués. Au total, 77 patients ont été inclus avec un suivi médian de 11 mois (intervalle : 3-21 mois). Cinquante et un pour cent des patients avaient un cancer de la prostate local à haut risque ou localement avancé. Il n’y a pas eu de complications peropératoires et toutes les complications de haut grade (2,6 %) étaient liées au curage ganglionnaire pelvien réalisé en concomitance avec le RS-RARP. La durée médiane de l’opération était de 160 min (plage : 122-265 min) et la durée médiane d’hospitalisation était de 3 (plage : 3-8) jours. Une marge chirurgicale positive a été rapportée dans 42,9 % des cas. La survie sans récidive biochimique à un an était de 90,1 %. Après 6 mois, tous les patients étaient socialement continentaux et après 1 an, 94,3% étaient entièrement continentaux. Parmi les patients sexuellement actifs qui ont subi au moins une épargne nerveuse unilatérale, 43,3% ont pu avoir des rapports sexuels. Cette série souligne la sécurité chirurgicale de la réalisation de RS-RARP par une technique standardisée et confirme l’effet bénéfique sur le retour précoce de la continence. Le patient doit être informé du risque d’une marge chirurgicale positive.
Introduction
Pour guérir les cas localisés et sélectionnés de cancer de la prostate localement avancé, la prostatectomie radicale est l’une des options de traitement recommandées1. Les techniques mini-invasives (laparoscopie conventionnelle et laparoscopie assistée par robot) ont l’avantage de réduire la perte de sang, la douleur postopératoire et la durée d’hospitalisation par rapport à la prostatectomie radicale ouverte 2,3. Parmi les techniques mini-invasives, la chirurgie assistée par robot combine les avantages de la chirurgie mini-invasive avec une dextérité accrue et une liberté de mouvement des instruments chirurgicaux et une vision périopératoire en 3 dimensions. Dans les pays disposant de ressources suffisantes, la prostatectomie radicale assistée par robot (RARP) est devenue le mode prédominant pour effectuer une prostatectomie radicale4.
L’incontinence urinaire, temporaire ou définitive, est un effet secondaire fréquent de la prostatectomie radicale, quel que soit le mode par lequel elle a été réalisée5. Avec la PRAR antérieure ouverte (abdominale), laparoscopique et « standard » (SA-RARP), la prostatectomie radicale est réalisée par une approche antérieure dans laquelle l’espace rétropubis (Retzius) est ouvert6. Grâce à la dextérité accrue associée au RARP, une approche anatomique alternative est possible dans laquelle la prostate est réséquée à travers la poche rectovésique ou la poche de Douglas, comme décrit pour la première fois par Galfano et al.7. Cette approche postérieure laisse intact l’espace de Retzius (« Retzius-sparing RARP »; RS-RARP). Le principal avantage de RS-RARP semble être une récupération plus élevée et plus rapide de la continence urinaire8. Cette étude vise à décrire en détail (comme suggéré par le groupe de consensus de Pasadena9) les étapes de RS-RARP soutenues par du matériel audiovisuel et à rendre compte des premiers résultats fonctionnels et oncologiques des premiers cas dans un seul centre.
Protocole
Cette étude a été soumise au comité d’éthique local de l’hôpital universitaire de Gand et l’approbation institutionnelle a été accordée (CE UZG 2019/1506). L’étude a été enregistrée dans le registre belge des études sous la référence B670201941650. Tous les patients ont donné leur consentement éclairé par écrit.
1. Préparation et positionnement du patient
- Préparation
- Suivez les lignes directrices contemporaines internationalement acceptées pour diagnostiquer le cancer de la prostate et définir l’indication de la prostatectomie radicale1. Utilisez l’IRM multiparamétrique pour la stadification locale, car elle fournit des informations importantes sur le volume de la prostate, l’élargissement concomitant de la prostate et le lobe médian, ainsi que la localisation et l’extension de la tumeur. Cela aidera à décider s’il faut épargner les nerfs et / ou épargner le col de la vessie10. Assurez-vous que cette imagerie est disponible au moment de l’opération.
- Offrir RS-RARP aux patients atteints d’un cancer de la prostate local ou localement avancé et d’une espérance de vie de >10 ans. Discuter d’autres options de traitement telles que la surveillance active, d’autres modalités de prostatectomie radicale et l’irradiation, le cas échéant. Ne pas proposer RS-RARP aux patients atteints d’un cancer de la prostate métastatique.
- Exclure les conditions médicales qui sont une contre-indication à la chirurgie robotique en position raide de Trendelenburg par un examen anesthésiologique préopératoire. Si ces conditions médicales sont présentes, traitez-les d’abord (si possible) ou discutez d’un traitement alternatif avec le patient. Inclure le type et le dépistage du sang du patient dans l’évaluation préopératoire dans les rares cas où une transfusion sanguine sera nécessaire.
- Administrer le clysma natriumlaurylsulfoacétate-sorbitol-natriumcitratedihydrate 4-8 h avant l’opération pour nettoyer le rectum. Laisser reposer l’apport alimentaire et l’apport de liquides clairs jusqu’à 6 h et 4 h avant l’induction, respectivement.
- Effectuer une anesthésie générale avec intubation endotrachéale. Administrer une injection prophylactique unique de céfazoline 2g à l’induction.
- Insérer une ligne intraveineuse périphérique de gros calibre et une ligne artérielle pour assurer l’accès et la surveillance du système circulatoire. Utilisez la pulsoxymétrie et la surveillance cardiaque à 4 dérivations pendant toute la procédure.
- Positionnement
- Placez le patient en décubitus dorsal. Placez et fixez les bras le long du corps du patient et fixez les jambes par une sangle au niveau des genoux. Sécurisez tous les points de compression avec des tampons de gel.
REMARQUE: Le patient porte des bas dissuasifs thrombo-embolus. - Appliquez des supports d’épaule pour éviter de se déplacer en raison de la position raide de Trendelenburg. Fixez le thorax du patient à la table avec du ruban adhésif (largeur de 7,5 cm) pour éviter tout déplacement ultérieur. Couvrez le patient avec une couverture chauffante thoracique.
- Désinfecter le champ chirurgical par une solution alcoolique povidone-iodée ou, alternativement, par de la chlorhexidine en cas d’allergie à l’iode. Inclure l’abdomen antérieur, les aines et les organes génitaux dans le champ chirurgical. Fixez des champs stériles aux bords du champ après la désinfection.
- Placez un cathéter transurétral en latex recouvert d’hydrogel 16 F pour assurer le drainage urinaire et la vidange de la vessie au moment de l’insertion du trocart. Assurez-vous d’avoir un accès facile au cathéter transurétral, car il aidera à l’identification de l’urètre plus tard au cours de la procédure.
- Placez le patient en décubitus dorsal. Placez et fixez les bras le long du corps du patient et fixez les jambes par une sangle au niveau des genoux. Sécurisez tous les points de compression avec des tampons de gel.
2. Amarrage du système robotique
- Couvrez les bras robotiques du chariot du patient avec des champs stériles car ils seront plus tard en contact avec le champ chirurgical. Utilisez une caméra à 30°.
REMARQUE : le système Da Vinci Xi est utilisé pour cette opération (Figure 1). Ce système se compose de trois parties de base: une console de chirurgien qui est placée à une distance de la table d’opération; un chariot patient avec quatre bras robotiques qui seront amarrés aux trocarts et un chariot de vision avec le moniteur pour l’infirmière et l’assistant de gommage, le système d’électrocautérisation et l’insufflateur de CO2 placé à côté du patient. - Insertion de trocart
- Insertion d’un trocart de caméra
- Faites une incision cutanée longitudinale sur 2-2,5 cm environ 1 cm au-dessus de l’ombilic. Disséquez le tissu adipeux sous-cutané sans ménagement jusqu’à ce que le fascia droit soit identifié.
- Inciser le fascia droit longitudinalement et placer des sutures de séjour en polyglactine 1 résorbables au niveau du fascia des deux côtés.
- Ouvrez le péritoine avec des ciseaux. Assurez-vous par palpation digitale avec l’index qu’il n’y a pas de contact de l’intestin à cette ouverture.
- Insérez un trocart de caméra robotisée de 8 mm avec cône Hasson dans la cavité péritonéale. Fixez les pinces des cônes aux sutures de hauban au niveau du fascia.
- Fixez le trocart de la caméra à l’insufflateur de CO2 et gonflez-le à une pression de 12-15 mmHg. Amenez le patient dans la position Trendelenburg à 30-35° pour libérer le bassin mineur de l’intestin grêle. Assurez-vous qu’il n’y a pas de déplacement de la carrosserie pendant le positionnement raide de Trendelenburg.
- Placez au niveau horizontal du trocart de caméra, deux et un trocart de 8 mm pour les instruments robotiques, respectivement, sur les côtés gauche et droit du trocart de la caméra avec une distance de 6 à 8 cm entre les trocarts robotiques. Placez tous les trocarts en vision directe avec la caméra. Utilisez l’obturateur à pointe émoussée pour placer les trocarts.
- Placez un trocart assistant de 5 mm à 5 cm crâniens à la ligne médiane entre le trocart de caméra et le trocart robotique droit. Placer un trocart assistant de 12 mm à 3 cm au-dessus du spina iliaca antérieur supérieur droit.
REMARQUE : L’assistant est du côté droit du patient tandis que l’infirmière de gommage est du côté gauche du patient. - Déconnectez le câble d’insufflation au trocart de la caméra et connectez-le au trocart assistant 12 mm.
- Insertion d’un trocart de caméra
- Amarrage du chariot patient et insertion d’instruments robotiques
- Déplacez le chariot du patient vers le côté droit du patient jusqu’à ce que le troisième bras puisse être connecté au trocart de la caméra. Optimisez davantage le positionnement du chariot patient à l’aide de l’application automatique du système. Connectez les trois autres trocarts de 8 mm avec une distance d’au moins 10 cm entre les bras pour éviter les collisions pendant les mouvements opératoires.
- Utilisez comme instruments robotiques, un ciseau incurvé monopolaire, une pince bipolaire fenêtrée, une pince Cadiere et un grand tourne-aiguille. Au début de l’opération, placez le ciseau monopolaire dans le trocart robotique droit, la pince fenêtrée bipolaire dans le trocart robotique gauche médian et la pince Cadiere dans le trocart robotique latéral gauche.
- Contrôler l’insertion des instruments robotiques par une vision directe pour éviter la perforation des viscères, des adhérences omentales ou des structures vasculaires.
- Comme instruments d’assistance, utilisez un dispositif d’aspiration-irrigation laparoscopique placé dans le trocart assistant de 5 mm et un préhenseur laparoscopique placé dans le trocart assistant de 12 mm. Prenez place à la console du chirurgien pour commencer la partie de l’opération assistée par robot.
REMARQUE: Ces instruments laparoscopiques sont manipulés par l’assistant et ne sont pas connectés à des bras robotiques.
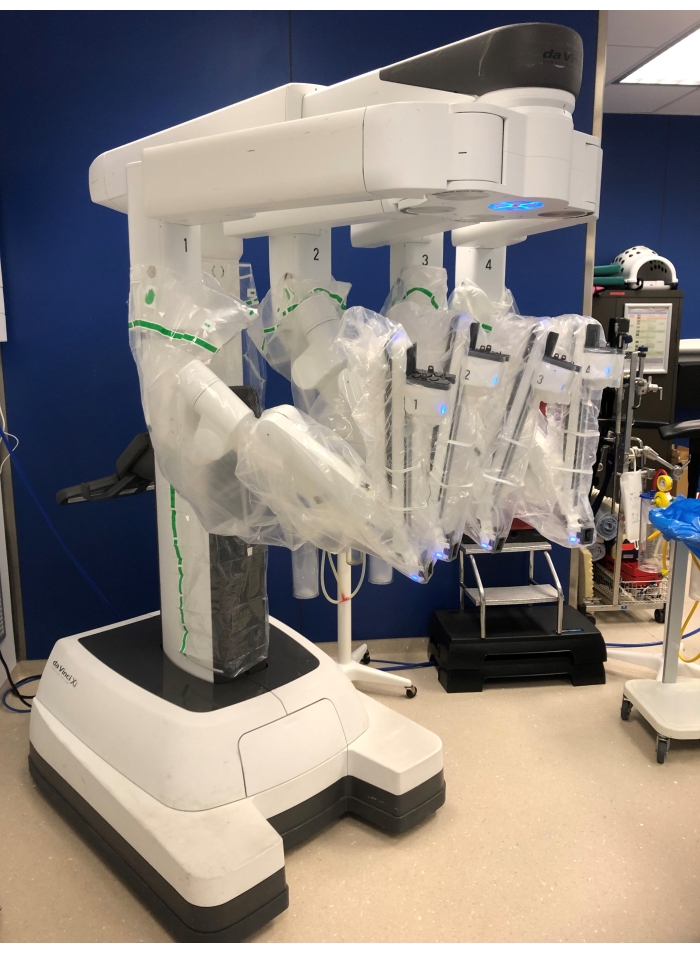
Figure 1: Le chariot du patient avec 4 bras robotiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Dissection des vésicules séminales
- Accès au bassin mineur
- Effectuer l’adhésiolyse en libérant toutes les adhérences qui entravent l’accès facile au bassin mineur et à la poche rectovésique. Effectuez cette adhésiolyse avec la lentille tournée de 30° vers le bas.
- Faciliter l’accès à la poche rectovésique (ou Douglas) en poussant la vessie vers le haut avec la pince Cadiere et en poussant le rectum vers le bas avec le dispositif d’aspiration-irrigation.
- Accès aux vésicules séminales
- Inciser le péritoine sur le canal déférent des deux côtés et continuer médialement jusqu’à ce que ces incisions se rejoignent.
NOTE: Le canal déférent est plus facilement identifiable lorsqu’il traverse les vaisseaux iliaques externes, en particulier chez les hommes obèses. - Au bord latéral de l’incision, disséquez le canal déférent de manière circonférentielle et transectez-le. Disséquer le canal déférent médialement jusqu’à ce que l’extrémité de la vésicale séminale soit atteinte.
- Inciser le péritoine sur le canal déférent des deux côtés et continuer médialement jusqu’à ce que ces incisions se rejoignent.
- Dissection des vésicules séminales
- Décollez médialement le fascia de Denonvilliers du canal déférent au cas où il n’y aurait aucune preuve d’invasion séminale des vésicules. En cas de suspicion d’invasion de vésicules séminales, inciser le fascia de Denonvilliers à 1-2 mm sous le bord inférieur de la vésicule séminale pour assurer une marge chirurgicale sûre.
- Fixez les vaisseaux où ils pénètrent à l’extrémité et à la surface latérale de la vésicule séminale par hémostase bipolaire ou avec des clips métalliques de 5 mm et transectez-les. Continuez ce curage jusqu’à ce que la base de la prostate soit atteinte. Effectuez la même procédure du côté opposé.
REMARQUE: Les nerfs érectiles sont proches de la pointe et de la surface latérale des vésicules séminales et la coagulation monopolaire doit être évitée au cas où une épargne nerveuse serait tentée.
4. Dissection postérolatérale de la prostate
- Dissection latérale de la prostate
- Rétracter médialement la vésicule séminale par la pince de Cadiere pour le côté droit et par la préhension laparoscopique assistante pour le côté gauche. Cela permet de visualiser le tissu adipeux à un triangle entre la base de la vésicule séminale et la région latérale à la base de la prostate.
REMARQUE: Ce triangle est juste au-dessus des nerfs érectiles et du pédicule prostatique. - Effectuer une dissection contondante dans ce tissu adipeux le long de la surface latérale de la prostate jusqu’à ce que la réflexion du fascia endopelvien soit rencontrée. Effectuer l’hémostase par la pince bipolaire car le courant monopolaire pourrait endommager les nerfs érectiles.
- Rétracter médialement la vésicule séminale par la pince de Cadiere pour le côté droit et par la préhension laparoscopique assistante pour le côté gauche. Cela permet de visualiser le tissu adipeux à un triangle entre la base de la vésicule séminale et la région latérale à la base de la prostate.
- Suspension du péritoine
- Faciliter l’accès à la prostate et au col de la vessie par deux sutures de suspension à travers la partie supérieure de l’incision péritonéale.
- Insérez le gros pilote d’aiguille dans le bras robotique droit. Placez une aiguille droite avec une suture non résorbable à travers la paroi abdominale à 2-3 cm au-dessus de l’os pubien juste médialement du ligament ombilical médial.
- Perforer la partie supérieure de l’incision péritonéale et le tissu adipeux sous-jacent avec l’aiguille droite. Ramenez l’aiguille à l’extérieur du corps près du tractus d’insertion. Gardez ce point de suspension sous tension à l’aide d’une pince anti-moustique à l’extérieur de l’abdomen. Faites de même du côté controlatéral.
- Dissection postérieure de la prostate
- Retirez le pilote de l’aiguille et ramenez les ciseaux incurvés dans le bras robotique droit. Rétractez les vésicules séminales vers le haut et légèrement latéralement avec la pince de Cadiere et la pince laparoscopique auxiliaire pour les côtés gauche et droit, respectivement, pour mettre le fascia de Denonvilliers sous tension.
- Manipulation des nerfs érectiles.
- Approche bilatérale d’épargne nerveuse : Développer un plan par dissection contondante entre le fascia prostatique et le fascia de Denonvilliers jusqu’à l’apex de la prostate et latéralement jusqu’à ce que les vaisseaux prostatiques soient rencontrés.
- Approche non économe nerveuse : Inciser le fascia de Denonvilliers à 1-2 mm sous la base de la prostate. Disséquer la surface antérieure du rectum et plus latéralement dans le tissu adipeux périrectal.
- Approche unilatérale d’épargne nerveuse : Effectuer l’étape 4.3.2.1 au site de préservation nerveuse et l’étape 4.3.2.2 au site de préservation non nerveuse. Inciser le fascia des Denonvilliers à la ligne médiane au-dessus de la paroi rectale.
- Hémostase du pédicule prostatique et dissection du faisceau neurovasculaire
- Accès au côté droit: Saisissez la base de la prostate avec la pince de Cadiere juste sous la fixation de la vésicule séminale ipsilatérale. Rétractez la base de la prostate médialement et légèrement vers le haut pour amener le pédicule prostatique sous tension.
- Faites une fenêtre avec les ciseaux monopolaires dans le pédicule prostatique et fixez cette partie du pédicule à l’aide d’un grand clip de verrouillage en polymère qui est appliqué à travers les trocarts assistants de 12 mm. Transectez cette partie du pédicule du côté prostatique du clip.
- Répétez 4.4.2 (généralement 2-3 fois) jusqu’à ce que tout le pédicule prostatique soit fixé. Maintenez la tension sur le pédicule prostatique après chaque transectation d’une partie du pédicule.
- Répétez l’étape 4.4.2 jusqu’à ce que l’apex de la prostate soit atteint. Gardez une distance sécuritaire de la surface prostatique chaque fois qu’une fenêtre est faite.
REMARQUE: Cela sacrifiera le faisceau neurovasculaire contenant les nerfs érectiles. - Décollez le faisceau neurovasculaire du fascia prostatique par dissection contondante et en maintenant le faisceau sous une légère tension à l’aide d’une rétraction médiale progressive et ascendante avec la pince de Cadiere.
- Fixez les petits vaisseaux attachés à la prostate par des clips métalliques de 5 mm et transectez-les avec des ciseaux. Continuez jusqu’à ce que l’apex de la prostate soit atteint. Assurez l’aspiration et l’irrigation par l’assistant à travers le trocart de 5 mm chaque fois que nécessaire.
- Accès au côté gauche : Basculez la pince Cadiere sur le trocart gauche médian et la pince bipolaire fenêtrée sur le trocart latéral gauche. Rétractez la base de la prostate médialement et vers le haut. Utilisez l’endopoignet de l’instrument pour créer un angle de 90° vers le bas sous lequel l’assistant a un accès facile pour placer les clips. Répétez la procédure sur le côté gauche comme décrit ci-dessus (étapes 4.4.2 à 4.4.6).
5. Dissection du col de la vessie
- Saisissez les vésicules séminales par la pince de Cadiere et rétractez-les vers le bas pour créer une tension entre le col de la vessie et la base de la prostate.
- Développer le plan entre le col de la vessie et la base de la prostate en utilisant une combinaison d’incisions monopolaires avec les ciseaux et la dissection contondante. Préserver les fibres musculaires circulaires du col de la vessie en cas d’épargne du col de la vessie. Déplacez les vésicules séminales plus latéralement pour faciliter la dissection latérale du col de la vessie.
- Ouverture du col de la vessie
- Inciser la muqueuse à la face postérieure du col de la vessie sur 1 cm. Visualisez le cathéter urétral.
- Placez une suture polyglactin 3-0 résorbable sur la face postérieure du col de la vessie. Dégonflez le ballonnet du cathéter et rétractez le cathéter.
- Saisissez la suture du hauban avec la pince bipolaire fenêtrée et déplacez-vous vers le haut jusqu’à ce que la partie antérieure du col de la vessie devienne visible. Incisez davantage la muqueuse et libérez le col de la vessie de la base de la prostate.
- Placez une deuxième suture de hauban à la face antérieure du col de la vessie avec suture polyglactin 3-0 résorbable juste avant que le col de la vessie ne soit complètement libéré.
REMARQUE: Ces sutures de séjour faciliteront l’identification ultérieure du col de la vessie pour l’anastomose vésico-urétrale.
6. Dissection apex antérieure et prostatique
- Dissection antérieure
- Continuez une légère tension ascendante à la suture du hauban sur la face postérieure de la vessie avec la pince bipolaire fenêtrée. Placez la pince de Cadiere dans l’urètre prostatique et appliquez une traction vers le bas pour créer une tension à la surface antérieure de la prostate.
- Suivez la surface antérieure de la prostate en utilisant une combinaison de dissection contondante et d’incision monopolaire épargnant le plexus de Santorin, les ligaments puboprostatiques et l’espace de Retzius. Déplacez la pince de Cadiere latéralement pour faciliter la dissection antérolatérale.
- Dissection apex prostatique
- Identifier l’urètre membraneux en saisissant le cathéter urétral avec la pince de Cadiere.
- Inciser les fibres circulaires de l’urètre de 1 à 2 mm caudale jusqu’à l’apex de la prostate. Poussez les fibres circulaires vers l’apex de la prostate pour exposer la couche longitudinale interne de l’urètre (le soi-disant lissosphincter). Transectez cette couche interne le plus près possible de la prostate pour préserver au maximum le lissosphincter.
- Inciser toute attache dorsale à l’urètre membraneux jusqu’à ce que la prostate soit complètement libérée des tissus environnants. Insérez un endobag à travers le trocart assistant de 12 mm à insérer dans la prostate (et les vésicules séminales). Fermez l’endobag et laissez-le fermé dans la fosse iliaque droite.
7. Anastomose vésico-urétrale
- Placez le grand tournevis à aiguille dans le trocart robotique droit et les pinces Cadiere et les pinces bipolaires fenêtrées, respectivement, dans le trocart robotique gauche médial et latéral. Utilisez la pince bipolaire fenestrée pour pousser doucement la vessie vers l’urètre afin de réduire la tension au niveau de l’anastomose.
- Suture de l’anastomose vésico-urétrale
- Placez la première suture du premier fil barbelé résorbable (3-0, 23 cm de longueur) à l’extérieur, juste latéralement à droite de la position de 12 heures sur le col de la vessie. Tirez sur la suture antérieure qui a été placée à l’étape 5.3.4 pour identifier le col de la vessie et la muqueuse de la vessie.
- Placez la suture à l’envers sur l’urètre, également légèrement latérale à droite de la position 12 heures. Identifiez l’urètre en déplaçant l’extrémité du cathéter urétral dans l’urètre membraneux.
- Placez la première suture du deuxième fil barbelé résorbable (3-0, 23 cm de longueur) à l’extérieur - juste latéralement à gauche de la position de 12 heures sur le col de la vessie et à l’envers sur l’urètre à la même position.
- Pour la suture postérieure du côté gauche, approximez la muqueuse de la vessie contre la muqueuse urétrale par traction progressive aux deux extrémités des barbelés. Répétez la suture avec le deuxième fil barbelé à l’extérieur sur le col de la vessie et à l’envers sur l’urètre deux fois à quel moment la position 9 heures est atteinte. Approximez la muqueuse de la vessie contre la muqueuse urétrale après chaque suture.
- Pour la suture du côté droit, effectuez la suture avec le premier fil barbelé à l’extérieur sur le col de la vessie et à l’envers sur l’urètre, jusqu’à ce que la position 6 heures soit atteinte. Ne pas encore approximer la dernière suture afin de laisser de l’espace pour finaliser le côté gauche de l’anastomose.
- Pour la suture antérieure du côté gauche, continuer l’anastomose du côté gauche en allant de 9 heures à 6 heures. Ne vous approchez pas encore de la dernière suture pour permettre à l’extrémité du cathéter de passer entre les fils barbelés gauche et droit.
- Saisissez l’extrémité du cathéter et placez-la dans la vessie. Insuffler le ballon.
- Serrez les dernières sutures sur les côtés gauche et droit jusqu’à ce que la vessie et la muqueuse urétrale soient rapprochées. Vérifiez l’étanchéité de l’anastomose par instillation de 120 mL d’eau dans la vessie (test d’étanchéité).
- Placez la première suture du premier fil barbelé résorbable (3-0, 23 cm de longueur) à l’extérieur, juste latéralement à droite de la position de 12 heures sur le col de la vessie. Tirez sur la suture antérieure qui a été placée à l’étape 5.3.4 pour identifier le col de la vessie et la muqueuse de la vessie.
- Retirez les sutures de suspension dans la partie supérieure de l’incision péritonéale. Utilisez les restes des barbelés pour fermer l’incision péritonéale de la médiale à la latérale des deux côtés. Effectuer un curage ganglionnaire pelvien bilatéral si les lignes directrices contemporaines reconnues à l’échelle internationalel’indiquent 1.
REMARQUE: Aucun drain chirurgical n’est laissé dans le cas où le curage ganglionnaire pelvien n’a pas été effectué.
8. Extraction de la prostate et fermeture des incisions
- Transférez le fil d’extraction de l’endobag du trocart robotique droit au trocart de caméra en vision directe.
- Dégonfler l’abdomen et retirer les pantalons en vision directe. Changez la position de Trendelenburg en position couchée neutre. Inciser davantage l’incision cutanée supra-ombilicale et l’incision du fascia pour permettre une extraction facile de la prostate.
REMARQUE: La taille de cette incision dépend de la taille de la prostate. - Fermez le fascia droit avec une suture résorbable en polyglactine 1. Fermez le tissu sous-cutané au niveau du trocart de caméra et du trocart assistant de 12 mm avec suture polyglactine résorbable 3-0. Fermez toutes les incisions cutanées avec des agrafeuses.
9. Soins postopératoires
- Transférez le patient à l’unité de soins postopératoires et surveillez pendant 2-3 heures. Transférer le patient à l’unité d’hospitalisation après approbation de l’anesthésiste et du chirurgien.
- Permettre au patient de reprendre la consommation de liquides clairs. Permettre la consommation d’aliments solides et stimuler à se promener pendant la première journée postopératoire. Retirez le cathéter urétral au troisième jour postopératoire et mesurez le volume de miction et le volume résiduel de la vessie. Remplacez le cathéter en cas de volume résiduel important et retirez-le à la polyclinique 1 semaine plus tard.
- Quitter le patient le troisième jour postopératoire. Retirez les agrafeuses entre le 10et le 14ème jour postopératoire par le médecin généraliste. Administrer de l’héparine de bas poids moléculaire par voie sous-cutanée jusqu’au 20ejour postopératoire par une infirmière à domicile ou par le patient lui-même.
Résultats
Tous les patients atteints d’un cancer de la prostate local ou localement avancé avec une espérance de vie de >10 ans et sans contre-indications anesthésiques se sont vu proposer le RS-RARP comme l’une des options de traitement de leur maladie. Les patients subissant une prostatectomie radicale cytoréductrice pour un cancer de la prostate métastatique dans le cadre d’un essai clinique ou d’une prostatectomie radicale de rattrapage ne se sont pas vu proposer de RS-RARP, et les patients atteints de tumeurs ant...
Discussion
Au cours de RS-RARP, toute la procédure est effectuée en approchant la vessie par l’extrémité postérieure. Par conséquent, la principale différence avec SA-RARP est la préservation de l’espace de Retzius. La préservation de l’espace de Retzius présente plusieurs avantages anatomiques7 : Premièrement, la vessie n’est pas détachée de la paroi abdominale et les ligaments ombilicaux ne sont pas transectés. Par conséquent, la vessie reste dans sa position anatomique. Deuxièmemen...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts.
Remerciements
Aucun financement n’a été obtenu pour cette recherche.
matériels
| Name | Company | Catalog Number | Comments |
| adhesive tape | BSNmedical | 15200028 | Tensoplast |
| assistant trocar 5mm | Aesculap | EKO17R | reusable trocar |
| assistant trocar 12mm | Conmed | iAS12-120LPi | AirSeal trocar |
| barbed wire | Covidien | VLOCM0024 | for vesico-urethral anastomosis |
| Cadiere forceps | Intuitive | 470049 | robotic instrument, grasper |
| camera 30° | Intuitive | 470027 | endoscope |
| cefazolin | Sandoz | BE217296 | Belgian farmaceutical registration |
| CO2-insufflator | Conmed | AS-iFS2 | AirSeal insufflator |
| Da Vinci Xi system | Intuitive | 600062 | robotic system |
| endobag | Covidien | 173050G | Endo Catch 10mm |
| endoscopic hem-o-lok applier | Teleflex | 544995T | to apply the locking clips |
| fenestrated bipolar forceps | Intuitive | 470205 | robotic instrument, bipolar forceps |
| Hasson cone 8mm trocar | Intuitive | 470398 | only at the camera trocar |
| heparin, low molecular weight (enoxaparin) | Sanofi | BE144347 | Belgian farmaceutical registration |
| hydrogel coated latex transurethral catheter | Bard | D226416 | Biocath |
| insufflation cable | Conmed | ASM-EVAC1 | AirSeal Tri-lumen filtered tube set |
| laparoscopic grasper | Aesculap | PO235R | Atraumatic wave grasper, double action |
| large needle driver | Intuitive | 470006 | roboic instrument, needle driver |
| locking clip | Grena | 5-13mm | Click'aVplus |
| metallic clips 5mm | Aesculap | PL453SU | for vessel ligation |
| monopolar curved scissor | Intuitive | 470179 | robotic instrument, hot shears |
| mosquito clamp | Innovia Medical | MQC2025-D | to secure bladder suspension stitch |
| natriumlaurylsulfoacetate-sorbitol-natriumcitratedihydrate clysma | Johnson & Johnson Consumer BV | RVG 05069 | Belgian farmaceutical registration |
| polyglactin 3.0 suture | Ethicon | V442H | stay suture bladder neck, subcutaneous sutures |
| polyglactin 1 suture | Ethicon | D9708 | stay suture fascia and fascia closurie |
| povidone-iodine alcoholic solution | Mylan | BE230736 | Belgian farmaceutical registration |
| robotic trocar 8mm | Intuitive | 470002 | standard length |
| Skin stapler | Covidien | 8886803712 | skin closure |
| sterile drapes robotic arms | Intuitive | 470015 | draping system robotic arms |
| suction-irrigation device | Geyi | GYSL-5X330 | laparoscopic use by assitant |
| suspension sutures | Ethicon | 628H | Ethilon 2-0 nylon suture |
| thrombo-embolus deterrent stockings | Covidien | 7203 | T.E.D. stockings |
| warming blanket device | 3M | 54200 | Bear Hugger |
Références
- Mottet, N., et al. EAU-EANM-ESTRO-ESUR-SIOG Guidelines on Prostate Cancer-2020 Update. Part 1: Screening, Diagnosis, and Local Treatment with Curative Intent. European Urology. 79 (2), 243-262 (2021).
- Ilic, D., et al. Laparoscopic and robotic-assisted versus open radical prostatectomy for the treatment of localised prostate cancer. The Cochrane Database of Systematic Reviews. 9 (9), (2017).
- Ab del Raheem, A., et al. Retzius-sparing robot-assisted radical prostatectomy versus open retropubic radical prostatectomy: a prospective comparative study with 19-month follow-up. Minerva Urologica e Nefrologica: The Italian Journal of Urology and Nephrology. 72 (5), 586-594 (2020).
- Gandaglia, G., et al. Comparative effectiveness of robot-assisted and open radical prostatectomy in the postdissemination era. Journal of Clinical Oncology : Official Journal of the American Society of Clinical Oncology. 32 (14), 1419-1426 (2014).
- Ficarra, V., et al. Systematic review and meta-analysis of studies reporting urinary continence recovery after robot-assisted radical prostatectomy. European Urology. 62 (3), 405-417 (2012).
- Martini, A., et al. Contemporary techniques of prostate dissection for robot-assisted prostatectomy. European Urology. 78 (4), 583-591 (2020).
- Galfano, A., et al. A new anatomic approach for robot-assisted laparoscopic prostatectomy: a feasibility study for completely intrafascial surgery. European Urology. 58 (3), 457-461 (2010).
- Checcucci, E., et al. Retzius-sparing robot-assisted radical prostatectomy vs the standard approach: a systematic review and analysis of comparative outcomes. BJU International. 125 (1), 8-16 (2020).
- Montorsi, F., et al. Best practices in robot-assisted radical prostatectomy: recommendations of the Pasadena Consensus Panel. European Urology. 62 (3), 368-381 (2012).
- Stabile, A., et al. Multiparametric MRI for prostate cancer diagnosis: current status and future directions. Nature Reviews. Urology. 17 (1), 41-61 (2020).
- Dindo, D., Demartines, N., Clavien, P. A. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Annals of Surgery. 240 (2), 205-213 (2004).
- Xylinas, E., et al. Evaluation of combined oncological and functional outcomes after radical prostatectomy: trifecta rate of achieving continence, potency and cancer control--a literature review. Urology. 76 (5), 1194-1198 (2010).
- Walz, J., et al. A critical analysis of the current knowledge of surgical anatomy related to optimization of cancer control and preservation of continence and erection in candidates for radical prostatectomy. European Urology. 57 (2), 179-192 (2010).
- Walz, J., et al. A critical analysis of the current knowledge of surgical anatomy of the prostate related to optimisation of cancer control and preservation of continence and erection in candidates for radical prostatectomy: An update. European Urology. 70 (2), 301-311 (2016).
- Albisinni, S., et al. Systematic review comparing Anterior vs Retzius-sparing robotic assisted radical prostatectomy: can the approach really make a difference. Minerva Urology and Nephrology. , (2021).
- Menon, M., et al. Functional recovery, oncologic outcomes and postoperative complications after robot-assisted radical prostatectomy: An evidence-based analysis comparing the Retzius sparing and standard approaches. The Journal of Urology. 199 (5), 1210-1217 (2018).
- Olivero, A., et al. Retzius-sparing robotic radical prostatectomy for surgeons in the learning curve: A propensity score-matching analysis. European Urology Focus. 7 (4), 772-778 (2021).
- Galfano, A., et al. Retzius-sparing robot-assisted radical prostatectomy: early learning curve experience in three continents. BJU International. 127 (4), 412-417 (2021).
- Galfano, A., et al. Beyond the learning curve of the Retzius-sparing approach for robot-assisted laparoscopic radical prostatectomy: oncologic and functional results of the first 200 patients with >/= 1 year of follow-up. European Urology. 64 (6), 974-980 (2013).
- Hoffman, K. E., et al. Patient-reported outcomes through 5 years for active surveillance, surgery, brachytherapy, or external beam radiation with or without androgen deprivation therapy for localized prostate cancer. JAMA. 323 (2), 149-163 (2020).
- Dalela, D., et al. A pragmatic randomized controlled trial examining the impact of the Retzius-sparing approach on early urinary continence recovery after robot-assisted radical prostatectomy. European Urology. 72 (5), 677-685 (2017).
- Yossepowitch, O., et al. Positive surgical margins after radical prostatectomy: a systematic review and contemporary update. European Urology. 65 (2), 303-313 (2014).
- Vale, C. L., et al. Adjuvant or early salvage radiotherapy for the treatment of localised and locally advanced prostate cancer: a prospectively planned systematic review and meta-analysis of aggregate data. Lancet. 396 (10260), 1422-1431 (2020).
- Lumen, N., et al. Safe introduction of robot-assisted radical prostatectomy after a training program in a high-volume robotic centre. Urologia Internationalis. 91 (2), 145-152 (2013).
- Galfano, A., Secco, S., Bocciardi, A. M. Mottrie A. Retzius-sparing robot-assisted laparoscopic radical prostatectomy: An international survey on surgical details and worldwide diffusion. European Urology Focus. 6 (5), 1021-1023 (2020).
- Checcucci, E., et al. Precision prostate cancer surgery: an overview of new technologies and techniques. Minerva Urologica e Nefrologica: The Italian Journal of Urology and Nephrology. 71 (5), 487-501 (2019).
- Grasso, A. A., et al. Posterior musculofascial reconstruction after radical prostatectomy: an updated systematic review and a meta-analysis. BJU International. 118 (1), 20-34 (2016).
- Manfredi, M., et al. Total anatomical reconstruction during robot-assisted radical prostatectomy: focus on urinary continence recovery and related complications after 1000 procedures. BJU international. 124 (3), 477-486 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon