Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Retzius-schonende robotergestützte radikale Prostatektomie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die roboterassistierte Retzius-schonende radikale Prostatektomie ist eine Technik, die es ermöglicht, die Harnkontinenz zu erhalten oder die Wiederherstellung der Harnkontinenz bei der Mehrheit der Patienten zu erleichtern. Die Patienten müssen über das Risiko einer positiven Operationsmarge aufgeklärt werden.
Zusammenfassung
Die Technik der Retzius-schonenden roboterassistierten radikalen Prostatektomie (RS-RARP) und erste Erfahrungen damit an einem einzigen Zentrum werden vermittelt. Die Technik wird Schritt für Schritt beschrieben und durch ein Video weiter veranschaulicht, um die Reproduzierbarkeit zu verbessern. Frühe onkologische und funktionelle Ergebnisse wurden ausgewertet. Insgesamt wurden 77 Patienten mit einer medianen Nachbeobachtungszeit von 11 Monaten eingeschlossen (Bereich: 3-21 Monate). Einundfünfzig Prozent der Patienten hatten lokalen Hochrisiko- oder lokal fortgeschrittenen Prostatakrebs. Es gab keine intraoperativen Komplikationen, und alle hochgradigen Komplikationen (2,6%) standen im Zusammenhang mit einer Beckenlymphknotendissektion, die gleichzeitig mit RS-RARP durchgeführt wurde. Die mediane Operationszeit betrug 160 min (Bereich: 122-265 min) und der mediane Krankenhausaufenthalt 3 (Bereich: 3-8) Tage. Eine positive chirurgische Marge wurde bei 42,9% berichtet. Das einjährige biochemische rezidivfreie Überleben betrug 90,1%. Nach 6 Monaten waren alle Patienten sozial kontinent und nach 1 Jahr waren 94,3% vollständig kontinent. Von sexuell aktiven Patienten, die sich zumindest einseitig nervenschonend unterzogen, konnten 43,3% Geschlechtsverkehr haben. Diese Serie unterstreicht die chirurgische Sicherheit der Durchführung von RS-RARP durch eine standardisierte Technik und bestätigt den positiven Effekt auf die frühe Rückkehr der Kontinenz. Der Patient muss über das Risiko einer positiven Operationsmarge informiert werden.
Einleitung
Um lokalisierte und ausgewählte Fälle von lokal fortgeschrittenem Prostatakrebs zu heilen, ist die radikale Prostatektomie eine der empfohlenen Behandlungsoptionen1. Minimalinvasive Techniken (konventionelle Laparoskopie und roboterassistierte Laparoskopie) haben den Vorteil, Blutverlust, postoperative Schmerzen und Dauer des Krankenhausaufenthalts im Vergleich zur offenen radikalen Prostatektomie zu senken 2,3. Unter den minimalinvasiven Techniken kombiniert die roboterassistierte Chirurgie die Vorteile der minimal-invasiven Chirurgie mit erhöhter Geschicklichkeit und Bewegungsfreiheit der chirurgischen Instrumente und mit 3-dimensionalem perioperativem Sehen. In gut ausgestatteten Ländern ist die robotergestützte radikale Prostatektomie (RARP) zum vorherrschenden Modus für die Durchführung einer radikalen Prostatektomiegeworden 4.
Harninkontinenz, vorübergehend oder endgültig, ist eine häufige Nebenwirkung der radikalen Prostatektomie, unabhängig von der Art und Weise, in der sie durchgeführt wurde5. Bei offenem (abdominalem), laparoskopischem und "Standard" anteriorem RARP (SA-RARP) wird die radikale Prostatektomie durch einen anterioren Zugang durchgeführt, bei dem der retropubische (Retzius') Raum geöffnet wird6. Dank der erhöhten Geschicklichkeit, die mit RARP verbunden ist, ist ein alternativer anatomischer Ansatz möglich, bei dem die Prostata durch den rektovesikalen Beutel oder Douglas-Beutel reseziert wird, wie erstmals von Galfano et al.7 beschrieben. Dieser posteriore Ansatz lässt den Retzius-Raum intakt ("Retzius-sparing RARP"; RS-RARP). Der Hauptvorteil von RS-RARP scheint eine höhere und schnellere Erholung der Harnkontinenzzu sein 8. Diese Studie zielt darauf ab, detailliert (wie vom Pasadena-Konsensgremium9 vorgeschlagen) die Schritte von RS-RARP zu beschreiben, die durch audiovisuelles Material unterstützt werden, und über die frühen funktionellen und onkologischen Ergebnisse der ersten Fälle in einem einzigen Zentrum zu berichten.
Protokoll
Diese Studie wurde der lokalen Ethikkommission des Universitätsklinikums Gent vorgelegt und die institutionelle Genehmigung erteilt (EC UZG 2019/1506). Die Studie wurde im belgischen Studienregister unter der Referenznummer B670201941650 registriert. Alle Patienten gaben eine schriftliche Einwilligungserklärung.
1. Patientenvorbereitung und -lagerung
- Präparat
- Befolgen Sie die zeitgenössischen international anerkannten Richtlinien, um Prostatakrebs zu diagnostizieren und die Indikation für eine radikale Prostatektomie1 zu setzen. Verwenden Sie die multiparametrische MRT für das lokale Staging, da dies wichtige Informationen über das Prostatavolumen, die begleitende Prostatavergrößerung und den Medianlappen sowie die Lage und Ausdehnung des Tumors liefert. Dies hilft bei der Entscheidung, ob nervenschonend und/oder blasenhalsschonend10 durchgeführt werden soll. Stellen Sie sicher, dass diese Bildgebung zum Zeitpunkt der Operation verfügbar ist.
- Bieten Sie RS-RARP Patienten mit lokalem oder lokal fortgeschrittenem Prostatakrebs und einer Lebenserwartung >10 Jahren an. Besprechen Sie alternative Behandlungsmöglichkeiten wie aktive Überwachung, andere Modalitäten der radikalen Prostatektomie und gegebenenfalls Bestrahlung. Bieten Sie Patienten mit metastasierendem Prostatakrebs keine RS-RARP an.
- Schließen Sie Erkrankungen, die eine Kontraindikation für die Roboterchirurgie in steiler Trendelenburg-Position sind, durch präoperative anästhesiologische Untersuchung aus. Wenn diese medizinischen Bedingungen vorliegen, behandeln Sie sie zuerst (wenn möglich) oder besprechen Sie eine alternative Behandlung mit dem Patienten. Beziehen Sie die Art und das Screening des Blutes des Patienten in die präoperative Beurteilung ein, falls in seltenen Fällen eine Bluttransfusion erforderlich ist.
- Natriumlaurylsulfoacetat-Sorbitol-Natriumcitratedihydrat-Clysma 4-8 h vor der Operation verabreichen, um das Rektum zu reinigen. Lassen Sie die Nahrungsaufnahme und die Aufnahme von klaren Flüssigkeiten bis 6 h bzw. 4 h vor der Induktion zu.
- Führen Sie eine Vollnarkose mit endotrachealer Intubation durch. Verabreichen Sie eine prophylaktische Einzelaufnahme von Cefazolin 2g bei der Induktion.
- Führen Sie eine großkalibrige periphere intravenöse Leitung und eine arterielle Leitung ein, um den Zugang und die Überwachung des Kreislaufsystems zu gewährleisten. Verwenden Sie Pulsoxymetrie und 4-Kanal-Herzüberwachung während des gesamten Verfahrens.
- Positionierung
- Legen Sie den Patienten in Rückenlage. Platzieren und sichern Sie die Arme entlang des Körpers des Patienten und sichern Sie die Beine durch einen Gurt auf Höhe der Knie. Sichern Sie alle Kompressionspunkte mit Gelpads.
HINWEIS: Der Patient trägt abschreckende Thromboembolienstrümpfe. - Tragen Sie Schulterstützen an, um ein Verschieben aufgrund der steilen Trendelenburg-Position zu vermeiden. Befestigen Sie den Brustkorb des Patienten mit Klebeband (7,5 cm Breite) am Tisch, um eine weitere Verschiebung zu verhindern. Decken Sie den Patienten mit einer Brustwärmedecke ab.
- Desinfizieren Sie das Operationsfeld mit povidon-jodalkoholischer Lösung oder alternativ mit Chlorhexidin bei Jodallergie. Schließen Sie den vorderen Bauch, die Leisten und die Genitalien in das chirurgische Feld ein. Befestigen Sie nach der Desinfektion sterile Vorhänge an den Feldrändern.
- Legen Sie einen 16 F Hydrogel-beschichteten transurethralen Latexkatheter ein, um die Harndrainage und Blasenentleerung zum Zeitpunkt des Trokareinführens sicherzustellen. Stellen Sie sicher, dass Sie einen einfachen Zugang zum transurethralen Katheter haben, da er später während des Eingriffs bei der Identifizierung der Harnröhre hilft.
- Legen Sie den Patienten in Rückenlage. Platzieren und sichern Sie die Arme entlang des Körpers des Patienten und sichern Sie die Beine durch einen Gurt auf Höhe der Knie. Sichern Sie alle Kompressionspunkte mit Gelpads.
2. Andocken des Robotersystems
- Decken Sie die Roboterarme des Patientenwagens mit sterilen Abdecktüchern ab, da sie später mit dem Operationsfeld in Kontakt kommen. Verwenden Sie eine 30°-Kamera.
HINWEIS: Für diesen Vorgang wird das Da Vinci Xi-System verwendet (Abbildung 1). Dieses System besteht aus drei grundlegenden Teilen: einer Chirurgenkonsole, die in einiger Entfernung vom Operationstisch platziert wird; ein Patientenwagen mit vier Roboterarmen, die an die Trokare angedockt werden, und ein Sichtwagen mit dem Monitor für die Schrubbkrankenschwester und -assistentin, dem Elektrokautersystem und dem CO 2-Insufflator neben dem Patienten. - Trokareinsatz
- Einsetzen des Kameratrokars
- Machen Sie einen Hautschnitt längs über 2-2,5 cm ca. 1 cm über dem Nabel. Sezieren Sie das Unterhautfettgewebe stumpf, bis die Rektusfaszie identifiziert ist.
- Die Rektusfaszie längs einschneiden und resorbierbare Polyglactin-1-Stay-Nähte an der Faszie beidseitig platzieren.
- Öffnen Sie das Bauchfell mit einer Schere. Stellen Sie durch digitale Palpation mit dem Zeigefinger sicher, dass kein Kontakt des Darms zu dieser Öffnung kommt.
- Führen Sie einen 8-mm-Roboterkameratrokar mit Hasson-Kegel in die Peritonealhöhle ein. Befestigen Sie die Klemmen der Zapfen an den Stütznähten an der Faszie.
- Befestigen Sie den Kameratrokar am CO2 Insufflator und blasen Sie ihn auf 12-15 mmHg Druck auf. Bringen Sie den Patienten in die 30-35° Trendelenburg-Position, um das kleine Becken aus dem Dünndarm zu befreien. Stellen Sie sicher, dass es bei der steilen Trendelenburg-Positionierung zu keiner Verschiebung des Körpers kommt.
- Platzieren Sie auf der horizontalen Ebene des Kameratrokars zwei bzw. einen 8-mm-Trokar für die Roboterinstrumente auf der linken und rechten Seite des Kameratrokars mit 6-8 cm Abstand zwischen den Robotertrokaren. Stellen Sie alle Trokare mit der Kamera unter direkte Sicht. Verwenden Sie den stumpfen Spitzenobturator, um die Trokare zu platzieren.
- Platzieren Sie einen 5-mm-Assistenztrokar 5 cm kranial zur Mittellinie zwischen dem Kameratrokar und dem rechten Robotertrokar. Platzieren Sie einen 12-mm-Assistenztrokar 3 cm über der rechten Spina iliaca anterior superior.
HINWEIS: Der Assistent befindet sich auf der rechten Seite des Patienten, während die Peeling-Schwester auf der linken Seite des Patienten ist. - Trennen Sie das Insufflationskabel am Kameratrokar und verbinden Sie es mit dem 12-mm-Hilfstrokar.
- Einsetzen des Kameratrokars
- Andocken des Patientenwagens und Einsetzen von Roboterinstrumenten
- Bewegen Sie den Patientenwagen auf die rechte Seite des Patienten, bis der dritte Arm mit dem Kameratrokar verbunden werden kann. Optimieren Sie die Positionierung des Patientenwagens weiter durch die automatische Anwendung des Systems. Verbinden Sie die drei anderen 8-mm-Trokare mit mindestens 10 cm Abstand zwischen den Armen, um Kollisionen bei operativen Bewegungen zu vermeiden.
- Verwenden Sie als Roboterinstrumente eine monopolar gebogene Schere, eine fenestrierte bipolare Pinzette, eine Cadiere-Pinzette und einen großen Nadeltreiber. Platzieren Sie zu Beginn der Operation die monopolare Schere im rechten Robotertrokar, die bipolare fenestrierte Pinzette im medialen linken Robotertrokar und die Cadière-Pinzette im seitlichen linken Robotertrokar.
- Kontrollieren Sie das Einführen von Roboterinstrumenten durch eine direkte Sicht, um Perforationen von Eingeweiden, omentalen Adhäsionen oder vaskulären Strukturen zu vermeiden.
- Verwenden Sie als Hilfsinstrumente eine laparoskopische Saug-Bewässerungsvorrichtung im 5-mm-Assistenztrokar und einen laparoskopischen Greifer im 12-mm-Hilfstrokar. Nehmen Sie an der Chirurgenkonsole Platz, um den robotergestützten Teil der Operation zu starten.
HINWEIS: Diese laparoskopischen Instrumente werden vom Assistenten gehandhabt und sind nicht mit Roboterarmen verbunden.
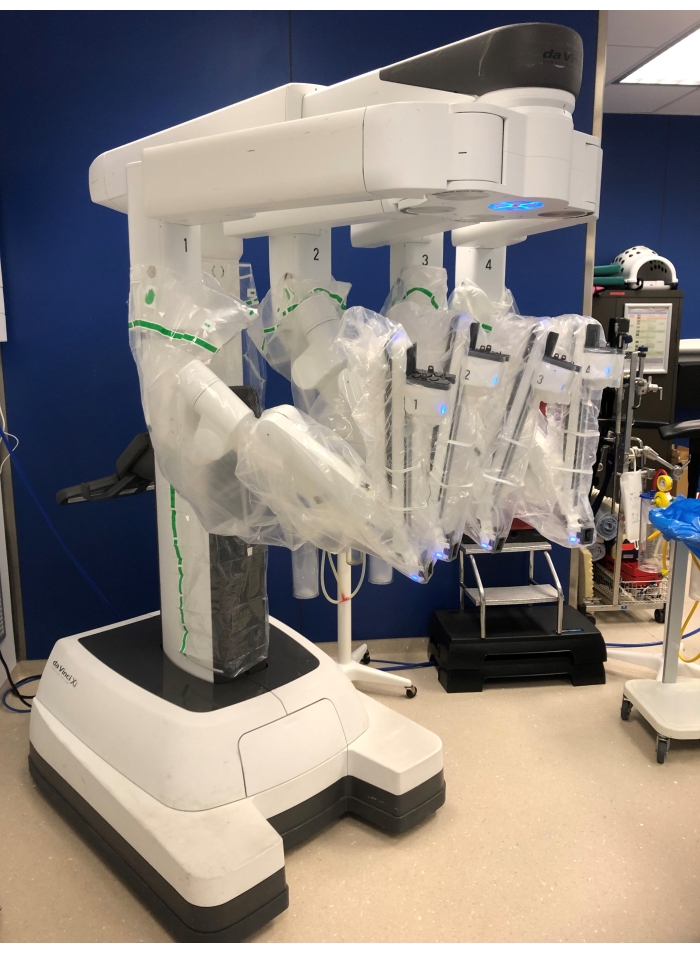
Abbildung 1: Der Patientenwagen mit 4 Roboterarmen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Dissektion der Samenbläschen
- Zugang zum kleinen Becken
- Führen Sie eine Adhäsiolyse durch, indem Sie alle Adhäsionen lösen, die den einfachen Zugang zum kleinen Becken und zum rektovesikalen Beutel behindern. Führen Sie diese Adhäsiolyse durch, wenn die Linse um 30° nach unten gedreht ist.
- Erleichtern Sie den Zugang zum rektovesikaalen Beutel (oder Douglas'), indem Sie die Blase mit der Cadière-Pinzette nach oben drücken und das Rektum mit der Saugspülvorrichtung nach unten drücken.
- Zugang zu den Samenbläschen
- Schneiden Sie das Peritoneum über dem Vas deferens auf beiden Seiten ein und setzen Sie medial fort, bis diese Einschnitte einander erreichen.
HINWEIS: Der Vas deferens ist am leichtesten zu identifizieren, wenn er die äußeren Beckengefäße kreuzt, insbesondere bei übergewichtigen Männern. - Am seitlichen Rand des Einschnitts den Samenleiter umlaufend sezieren und durchqueren. Sezieren Sie den Vas deferens medial, bis die Spitze des Samenbläschens erreicht ist.
- Schneiden Sie das Peritoneum über dem Vas deferens auf beiden Seiten ein und setzen Sie medial fort, bis diese Einschnitte einander erreichen.
- Dissektion der Samenbläschen
- Ziehen Sie die Faszie der Denonvilliers medial vom Samenleiter ab, falls es keine Hinweise auf eine Samenbläscheninvasion gibt. Bei Verdacht auf Samenbläscheninvasion schneiden Sie die Faszie der Denonvilliers 1-2 mm unter dem unteren Rand des Samenbläschens ein, um einen sicheren chirurgischen Rand zu gewährleisten.
- Sichern Sie die Gefäße, in die sie an der Spitze und der lateralen Oberfläche des Samenbläschens eintreten, durch bipolare Blutstillung oder mit 5 mm Metallclips und transektieren Sie sie. Setzen Sie diese Dissektion fort, bis die Basis der Prostata erreicht ist. Führen Sie das gleiche Verfahren auf der gegenüberliegenden Seite durch.
HINWEIS: Die erektilen Nerven befinden sich nahe der Spitze und der lateralen Oberfläche der Samenbläschen und eine monopolare Koagulation sollte vermieden werden, falls eine nervenschonende Behandlung versucht wird.
4. Posterolaterale Dissektion der Prostata
- Laterale Dissektion der Prostata
- Ziehen Sie das Samenbläschen medial medial mit der Cadière-Pinzette für die rechte Seite und mit dem laparoskopischen Greifer für die linke Seite zurück. Dies ermöglicht die Visualisierung des Fettgewebes in einem Dreieck zwischen der Basis des Samenbläschens und der Region seitlich zur Basis der Prostata.
HINWEIS: Dieses Dreieck befindet sich direkt über den erektilen Nerven und dem Prostatastiel. - Führen Sie eine stumpfe Dissektion in diesem Fettgewebe entlang der lateralen Oberfläche der Prostata durch, bis die Reflexion der endopelvinen Faszie auftritt. Führen Sie die Blutstillung durch die bipolare Pinzette durch, da der monopolare Strom die erektilen Nerven schädigen könnte.
- Ziehen Sie das Samenbläschen medial medial mit der Cadière-Pinzette für die rechte Seite und mit dem laparoskopischen Greifer für die linke Seite zurück. Dies ermöglicht die Visualisierung des Fettgewebes in einem Dreieck zwischen der Basis des Samenbläschens und der Region seitlich zur Basis der Prostata.
- Suspension des Peritoneums
- Erleichtern Sie den Zugang zur Prostata und zum Blasenhals durch zwei Aufhängungsnähte durch den oberen Teil des Peritonealschnitts.
- Führen Sie den großen Nadeltreiber in den rechten Roboterarm ein. Platzieren Sie eine gerade Nadel mit einer nicht resorbierbaren Naht durch die Bauchdecke 2-3 cm über dem Schambein direkt medial vom medialen Nabelband.
- Perforieren Sie den oberen Teil des Peritonealschnitts und das darunter liegende Fettgewebe mit der geraden Nadel. Bringen Sie die Nadel wieder außerhalb des Körpers in die Nähe des Einführungstraktes. Halten Sie diesen Aufhängestich mit einer Moskitoklemme außerhalb des Bauches unter Spannung. Machen Sie dasselbe auf der kontralateralen Seite.
- Hintere Dissektion der Prostata
- Entfernen Sie den Nadeltreiber und bringen Sie die gebogene Schere im rechten Roboterarm zurück. Ziehen Sie die Samenbläschen mit der Cadière-Pinzette und dem laparoskopischen Assistenzgreifer für die linke bzw. rechte Seite nach oben und leicht seitlich zurück, um die Faszie der Denonvilliers unter Spannung zu bringen.
- Umgang mit erektilen Nerven.
- Bilateraler nervenschonender Ansatz: Entwickeln Sie eine Ebene durch stumpfe Dissektion zwischen der Prostatafaszie und der Denonvilliers-Faszie bis zur Spitze der Prostata und lateral, bis die Prostatagefäße angetroffen werden.
- Nicht-nervenschonender Ansatz: Schneiden Sie die Faszie der Denonvilliers 1-2 mm unterhalb der Prostatabasis. Sezieren Sie die vordere Oberfläche des Rektums und lateral im perirektalen Fettgewebe.
- Einseitiger nervenschonender Ansatz: Schritt 4.3.2.1 an der Stelle der Nervenschonung und Schritt 4.3.2.2 an der Stelle der Nicht-Nervenschonung durchführen. Schneiden Sie die Faszie der Denonvilliers an der Mittellinie über der Rektalwand.
- Hämostase des Prostatastiels und Dissektion des neurovaskulären Bündels
- Zugang zur rechten Seite: Fassen Sie die Prostatabasis mit der Cadière-Pinzette direkt unter der Befestigung des ipsilateralen Samenbläschens. Ziehen Sie die Prostatabasis medial und leicht nach oben zurück, um den Prostatastiel unter Spannung zu bringen.
- Machen Sie ein Fenster mit der monopolaren Schere im Prostatastiel und sichern Sie diesen Teil des Stiels mit einem großen Polymer-Verriegelungsclip, der durch die 12-mm-Hilfstrokare appliziert wird. Transektieren Sie diesen Teil des Stiels an der Prostataseite des Clips.
- Wiederholen Sie 4.4.2 (normalerweise 2-3 mal), bis der gesamte Prostatastiel gesichert ist. Halten Sie die Spannung auf dem Prostatastiel nach jedem Mal, wenn ein Teil des Pedikels transeziert wird.
- Wiederholen Sie Schritt 4.4.2, bis die Spitze der Prostata erreicht ist. Halten Sie bei jeder Fensterherstellung einen Sicherheitsabstand von der Prostataoberfläche.
HINWEIS: Dadurch wird das neurovaskuläre Bündel mit den erektilen Nerven geopfert. - Ziehen Sie das neurovaskuläre Bündel von der Prostatafaszie durch stumpfe Dissektion ab und halten Sie das Bündel unter leichter Spannung mit einer progressiven medialen und nach oben gerichteten Retraktion mit der Cadière-Pinzette.
- Sichern Sie kleine Gefäße, die mit 5 mm Metallclips an der Prostata befestigt sind, und transezieren Sie sie mit einer Schere. Fahren Sie fort, bis die Spitze der Prostata erreicht ist. Stellen Sie sicher, dass der Assistent bei Bedarf durch den 5-mm-Trokar saugt und bewässert.
- Zugang zur linken Seite: Schalten Sie die Cadière-Pinzette auf den medialen linksseitigen Trokar und die fenestrierte Bipolarzange auf den seitlichen linksseitigen Trokar. Ziehen Sie die Prostatabasis medial und nach oben zurück. Verwenden Sie das Endowrist des Instruments, um einen 90°-Winkel nach unten zu erzeugen, unter dem der Assistent leicht Zugang hat, um die Clips zu platzieren. Wiederholen Sie den Vorgang auf der linken Seite wie oben beschrieben (Schritte 4.4.2 bis 4.4.6).
5. Dissektion des Blasenhalses
- Fassen Sie die Samenbläschen mit der Cadière-Pinzette und ziehen Sie sie nach unten zurück, um eine Spannung zwischen dem Blasenhals und der Prostatabasis zu erzeugen.
- Entwickeln Sie die Ebene zwischen Blasenhals und Prostatabasis mit einer Kombination aus monopolaren Schnitten mit der Schere und stumpfer Dissektion. Bewahren Sie die kreisförmigen Muskelfasern des Blasenhalses im Falle einer Blasenhalsschonung. Bewegen Sie die Samenbläschen seitlicher, um die laterale Dissektion des Blasenhalses zu erleichtern.
- Öffnung des Blasenhalses
- Schneiden Sie die Schleimhaut am hinteren Aspekt des Blasenhalses über 1 cm. Visualisieren Sie den Harnröhrenkatheter.
- Platzieren Sie eine resorbierbare Polyglactin 3-0-Naht am hinteren Aspekt des Blasenhalses. Entleeren Sie den Ballon des Katheters und ziehen Sie den Katheter zurück.
- Fassen Sie die Fixnaht mit der fenestrierten bipolaren Pinzette und bewegen Sie sich nach oben, bis der vordere Teil des Blasenhalses sichtbar wird. Schneiden Sie die Schleimhaut weiter ein und lösen Sie den Blasenhals von der Basis der Prostata.
- Platzieren Sie eine zweite Aufenthaltsnaht am vorderen Aspekt des Blasenhalses mit resorbierbarer Polyglactin 3-0-Naht, kurz bevor der Blasenhals vollständig gelöst ist.
HINWEIS: Diese Aufenthaltsnähte erleichtern die spätere Identifizierung des Blasenhalses für die vesico-urethrale Anastomose.
6. Dissektion der vorderen und Prostataspitze
- Frontale Dissektion
- Setzen Sie die leichte Aufwärtsspannung an der Bleibnaht am hinteren Aspekt der Blase mit der fenestrierten bipolaren Pinzette fort. Setzen Sie die Cadière-Pinzette in die Prostata-Harnröhre und wenden Sie eine Traktion nach unten an, um eine Spannung an der vorderen Oberfläche der Prostata zu erzeugen.
- Folgen Sie der vorderen Oberfläche der Prostata mit einer Kombination aus stumpfer Dissektion und monopolarer Inzision, die den Santorini-Plexus, die puboprostatischen Bänder und den Retzius-Raum schont. Bewegen Sie die Cadière-Pinzette seitlich, um die anterolaterale Dissektion zu erleichtern.
- Prostata-Apex-Dissektion
- Identifizieren Sie die membranöse Harnröhre, indem Sie den Harnröhrenkatheter mit der Cadiere-Pinzette greifen.
- Schneiden Sie die kreisförmigen Fasern der Harnröhre 1-2 mm kaudal bis zur Spitze der Prostata. Drücken Sie die kreisförmigen Fasern in Richtung der Spitze der Prostata, um die innere Längsschicht der Harnröhre (den sogenannten Lissosphinkter) freizulegen. Transektieren Sie diese innere Schicht so nah wie möglich an der Prostata, um den Lisosphinkter maximal zu erhalten.
- Schneiden Sie alle Anhaftungen dorsal an die membranöse Harnröhre, bis die Prostata vollständig vom umgebenden Gewebe befreit ist. Führen Sie einen Endobeutel durch den 12-mm-Assistenztrokar ein, um die Prostata (und Samenbläschen) einzusetzen. Schließen Sie den Endobag und lassen Sie ihn geschlossen in der rechten Fossa iliaca liegen.
7. Vesico-urethrale Anastomose
- Platzieren Sie den großen Nadeltreiber im rechten Robotertrokar und die Cadière-Pinzette bzw. die fenestierte bipolare Pinzette im medialen und lateralen linken Robotertrokar. Verwenden Sie die fenestrierte bipolare Pinzette, um die Blase sanft in Richtung Harnröhre zu drücken, um die Spannung an der Anastomose zu reduzieren.
- Vernähen der vesico-urethralen Anastomose
- Platzieren Sie die erste Naht des ersten resorbierbaren Stacheldrahtes (3-0, 23 cm lang) außerhalb rechts von der 12-Uhr-Position am Blasenhals. Ziehen Sie an der vorderen Strebennaht, die in Schritt 5.3.4 platziert wurde, um den Blasenhals und die Schleimhaut der Blase zu identifizieren.
- Legen Sie die Naht von innen nach außen auf die Harnröhre, ebenfalls leicht seitlich rechts von der 12-Uhr-Position. Identifizieren Sie die Harnröhre, indem Sie die Spitze des Harnröhrenkatheters in die membranöse Harnröhre bewegen.
- Platzieren Sie die erste Naht des zweiten resorbierbaren Stacheldrahtes (3-0, 23 cm lang) außerhalb links von der 12-Uhr-Position am Blasenhals und von innen nach außen auf der Harnröhre an der gleichen Position.
- Für die hintere Naht auf der linken Seite nähert sich die Blasenschleimhaut gegen die Harnröhrenschleimhaut durch progressive Traktion an beiden Enden der Stacheldrähte an. Wiederholen Sie die Naht mit dem zweiten Stacheldraht nach außen - nach innen am Blasenhals und von innen nach außen an der Harnröhre zweimal, wobei die 9-Uhr-Position erreicht ist. Nähern Sie die Blasenschleimhaut nach jeder Naht gegen die Harnröhrenschleimhaut an.
- Für das Nähen auf der rechten Seite führen Sie das Nähen mit dem ersten Stacheldraht aussen-innen am Blasenhals und von innen nach außen an der Harnröhre durch, bis die 6-Uhr-Position erreicht ist. Nähern Sie sich noch nicht der letzten Naht an, um Platz für die Fertigstellung der linkshändigen Seite der Anastomose zu schaffen.
- Für die vordere Naht auf der linken Seite setzen Sie die Anastomose auf der linken Seite von 9 Uhr bis 6 Uhr fort. Nähern Sie sich noch nicht der letzten Naht an, damit die Spitze des Katheters zwischen dem linken und rechten Stacheldraht passieren kann.
- Fassen Sie die Spitze des Katheters und legen Sie sie in die Blase. Den Ballon insuffieren.
- Ziehen Sie die letzten Nähte auf der linken und rechten Seite an, bis die Blase und die Harnröhrenschleimhaut angenähert sind. Überprüfen Sie die Wasserdichtigkeit der Anastomose durch Einträufeln von 120 ml Wasser in die Blase (Dichtheitsprüfung).
- Platzieren Sie die erste Naht des ersten resorbierbaren Stacheldrahtes (3-0, 23 cm lang) außerhalb rechts von der 12-Uhr-Position am Blasenhals. Ziehen Sie an der vorderen Strebennaht, die in Schritt 5.3.4 platziert wurde, um den Blasenhals und die Schleimhaut der Blase zu identifizieren.
- Entfernen Sie die Aufhängungsnähte am oberen Teil des Peritonealschnitts. Verwenden Sie die Überreste der Stacheldrähte, um den Peritonealschnitt von medial nach lateral auf beiden Seiten zu schließen. Führen Sie eine bilaterale Beckenlymphknotendissektion durch, wenn dies in den zeitgenössischen international anerkannten Richtlinien angezeigtist 1.
HINWEIS: Es verbleibt keine chirurgische Drainage, falls keine Beckenlymphknotendissektion durchgeführt wurde.
8. Extraktion der Prostata und Verschluss der Schnitte
- Übertragen Sie den Absaugdraht des Endobags vom rechten Robotertrokar zum Kameratrokar unter direkter Sicht.
- Entleeren Sie den Bauch und entfernen Sie die Trokare unter direkter Sicht. Ändern Sie die Trendelenburg-Position in die neutrale Rückenlage. Schneiden Sie den supra-Nabelschnur-Hautschnitt und den Faszienschnitt weiter ein, um eine einfache Extraktion der Prostata zu ermöglichen.
HINWEIS: Die Größe dieses Einschnitts hängt von der Größe der Prostata ab. - Verschließen Sie die Rectusfaszie mit einer resorbierbaren Polyglactin-1-Naht. Verschließen Sie das Unterhautgewebe am Kameratrokar und 12 mm Assistenztrokar mit resorbierbarer Polyglactin-3-0-Naht. Schließen Sie alle Hautschnitte mit Hautheftern.
9. Nachsorge
- Bringen Sie den Patienten auf die postoperative Pflegestation und überwachen Sie ihn für 2-3 Stunden. Verlegen Sie den Patienten nach Genehmigung durch den Anästhesisten und Chirurgen auf die Krankenhausstation.
- Lassen Sie den Patienten die Aufnahme von klaren Flüssigkeiten wieder aufnehmen. Erlauben Sie die Aufnahme von fester Nahrung und regen Sie an, während des ersten postoperativen Tages herumzulaufen. Entfernen Sie den Harnröhrenkatheter am dritten postoperativen Tag und messen Sie das Miktionsvolumen und das Restblasenvolumen. Ersetzen Sie den Katheter bei erheblichem Restvolumen und entfernen Sie ihn 1 Woche später in der Poliklinik.
- Entlassung des Patienten am dritten postoperativen Tag. Entfernen Sie die Hauthefter zwischen dem 10. und 14. postoperativen Tag durch den Hausarzt. Verabreichen Sie niedermolekulares Heparin subkutan bis zum 20. postoperativen Tag durch eine Krankenschwester zu Hause oder durch den Patienten selbst.
Ergebnisse
Allen Patienten mit lokalem oder lokal fortgeschrittenem Prostatakrebs mit einer Lebenserwartung >10 Jahren und ohne anästhesiologische Kontraindikationen wurde RS-RARP als eine der Behandlungsmöglichkeiten für ihre Erkrankung angeboten. Patienten, die sich einer zytoreduktiven radikalen Prostatektomie wegen metastasierendem Prostatakrebs im Rahmen einer klinischen Studie oder einer radikalen Prostatektomie unterzogen, wurde RS-RARP nicht angeboten, und Patienten mit vorderen Tumoren wurde vorzugsweise SA-RARP angebot...
Diskussion
Während RS-RAP wird der gesamte Eingriff durchgeführt, indem man sich der Blase durch das hintere Ende nähert. Folglich ist der Hauptunterschied zu SA-RARP die Erhaltung des Retzius-Raumes. Die Erhaltung des Retzius-Raumes hat mehrere anatomische Vorteile7: Erstens wird die Blase nicht von der Bauchdecke gelöst und die Nabelbänder werden nicht transeziert. Daher bleibt die Blase in ihrer anatomischen Position. Zweitens werden die vordere Detrusorschürze und die puboprostatischen Bänder nich...
Offenlegungen
Die Autoren haben keine Interessenkonflikte.
Danksagungen
Für diese Forschung wurden keine Mittel erhalten.
Materialien
| Name | Company | Catalog Number | Comments |
| adhesive tape | BSNmedical | 15200028 | Tensoplast |
| assistant trocar 5mm | Aesculap | EKO17R | reusable trocar |
| assistant trocar 12mm | Conmed | iAS12-120LPi | AirSeal trocar |
| barbed wire | Covidien | VLOCM0024 | for vesico-urethral anastomosis |
| Cadiere forceps | Intuitive | 470049 | robotic instrument, grasper |
| camera 30° | Intuitive | 470027 | endoscope |
| cefazolin | Sandoz | BE217296 | Belgian farmaceutical registration |
| CO2-insufflator | Conmed | AS-iFS2 | AirSeal insufflator |
| Da Vinci Xi system | Intuitive | 600062 | robotic system |
| endobag | Covidien | 173050G | Endo Catch 10mm |
| endoscopic hem-o-lok applier | Teleflex | 544995T | to apply the locking clips |
| fenestrated bipolar forceps | Intuitive | 470205 | robotic instrument, bipolar forceps |
| Hasson cone 8mm trocar | Intuitive | 470398 | only at the camera trocar |
| heparin, low molecular weight (enoxaparin) | Sanofi | BE144347 | Belgian farmaceutical registration |
| hydrogel coated latex transurethral catheter | Bard | D226416 | Biocath |
| insufflation cable | Conmed | ASM-EVAC1 | AirSeal Tri-lumen filtered tube set |
| laparoscopic grasper | Aesculap | PO235R | Atraumatic wave grasper, double action |
| large needle driver | Intuitive | 470006 | roboic instrument, needle driver |
| locking clip | Grena | 5-13mm | Click'aVplus |
| metallic clips 5mm | Aesculap | PL453SU | for vessel ligation |
| monopolar curved scissor | Intuitive | 470179 | robotic instrument, hot shears |
| mosquito clamp | Innovia Medical | MQC2025-D | to secure bladder suspension stitch |
| natriumlaurylsulfoacetate-sorbitol-natriumcitratedihydrate clysma | Johnson & Johnson Consumer BV | RVG 05069 | Belgian farmaceutical registration |
| polyglactin 3.0 suture | Ethicon | V442H | stay suture bladder neck, subcutaneous sutures |
| polyglactin 1 suture | Ethicon | D9708 | stay suture fascia and fascia closurie |
| povidone-iodine alcoholic solution | Mylan | BE230736 | Belgian farmaceutical registration |
| robotic trocar 8mm | Intuitive | 470002 | standard length |
| Skin stapler | Covidien | 8886803712 | skin closure |
| sterile drapes robotic arms | Intuitive | 470015 | draping system robotic arms |
| suction-irrigation device | Geyi | GYSL-5X330 | laparoscopic use by assitant |
| suspension sutures | Ethicon | 628H | Ethilon 2-0 nylon suture |
| thrombo-embolus deterrent stockings | Covidien | 7203 | T.E.D. stockings |
| warming blanket device | 3M | 54200 | Bear Hugger |
Referenzen
- Mottet, N., et al. EAU-EANM-ESTRO-ESUR-SIOG Guidelines on Prostate Cancer-2020 Update. Part 1: Screening, Diagnosis, and Local Treatment with Curative Intent. European Urology. 79 (2), 243-262 (2021).
- Ilic, D., et al. Laparoscopic and robotic-assisted versus open radical prostatectomy for the treatment of localised prostate cancer. The Cochrane Database of Systematic Reviews. 9 (9), (2017).
- Ab del Raheem, A., et al. Retzius-sparing robot-assisted radical prostatectomy versus open retropubic radical prostatectomy: a prospective comparative study with 19-month follow-up. Minerva Urologica e Nefrologica: The Italian Journal of Urology and Nephrology. 72 (5), 586-594 (2020).
- Gandaglia, G., et al. Comparative effectiveness of robot-assisted and open radical prostatectomy in the postdissemination era. Journal of Clinical Oncology : Official Journal of the American Society of Clinical Oncology. 32 (14), 1419-1426 (2014).
- Ficarra, V., et al. Systematic review and meta-analysis of studies reporting urinary continence recovery after robot-assisted radical prostatectomy. European Urology. 62 (3), 405-417 (2012).
- Martini, A., et al. Contemporary techniques of prostate dissection for robot-assisted prostatectomy. European Urology. 78 (4), 583-591 (2020).
- Galfano, A., et al. A new anatomic approach for robot-assisted laparoscopic prostatectomy: a feasibility study for completely intrafascial surgery. European Urology. 58 (3), 457-461 (2010).
- Checcucci, E., et al. Retzius-sparing robot-assisted radical prostatectomy vs the standard approach: a systematic review and analysis of comparative outcomes. BJU International. 125 (1), 8-16 (2020).
- Montorsi, F., et al. Best practices in robot-assisted radical prostatectomy: recommendations of the Pasadena Consensus Panel. European Urology. 62 (3), 368-381 (2012).
- Stabile, A., et al. Multiparametric MRI for prostate cancer diagnosis: current status and future directions. Nature Reviews. Urology. 17 (1), 41-61 (2020).
- Dindo, D., Demartines, N., Clavien, P. A. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Annals of Surgery. 240 (2), 205-213 (2004).
- Xylinas, E., et al. Evaluation of combined oncological and functional outcomes after radical prostatectomy: trifecta rate of achieving continence, potency and cancer control--a literature review. Urology. 76 (5), 1194-1198 (2010).
- Walz, J., et al. A critical analysis of the current knowledge of surgical anatomy related to optimization of cancer control and preservation of continence and erection in candidates for radical prostatectomy. European Urology. 57 (2), 179-192 (2010).
- Walz, J., et al. A critical analysis of the current knowledge of surgical anatomy of the prostate related to optimisation of cancer control and preservation of continence and erection in candidates for radical prostatectomy: An update. European Urology. 70 (2), 301-311 (2016).
- Albisinni, S., et al. Systematic review comparing Anterior vs Retzius-sparing robotic assisted radical prostatectomy: can the approach really make a difference. Minerva Urology and Nephrology. , (2021).
- Menon, M., et al. Functional recovery, oncologic outcomes and postoperative complications after robot-assisted radical prostatectomy: An evidence-based analysis comparing the Retzius sparing and standard approaches. The Journal of Urology. 199 (5), 1210-1217 (2018).
- Olivero, A., et al. Retzius-sparing robotic radical prostatectomy for surgeons in the learning curve: A propensity score-matching analysis. European Urology Focus. 7 (4), 772-778 (2021).
- Galfano, A., et al. Retzius-sparing robot-assisted radical prostatectomy: early learning curve experience in three continents. BJU International. 127 (4), 412-417 (2021).
- Galfano, A., et al. Beyond the learning curve of the Retzius-sparing approach for robot-assisted laparoscopic radical prostatectomy: oncologic and functional results of the first 200 patients with >/= 1 year of follow-up. European Urology. 64 (6), 974-980 (2013).
- Hoffman, K. E., et al. Patient-reported outcomes through 5 years for active surveillance, surgery, brachytherapy, or external beam radiation with or without androgen deprivation therapy for localized prostate cancer. JAMA. 323 (2), 149-163 (2020).
- Dalela, D., et al. A pragmatic randomized controlled trial examining the impact of the Retzius-sparing approach on early urinary continence recovery after robot-assisted radical prostatectomy. European Urology. 72 (5), 677-685 (2017).
- Yossepowitch, O., et al. Positive surgical margins after radical prostatectomy: a systematic review and contemporary update. European Urology. 65 (2), 303-313 (2014).
- Vale, C. L., et al. Adjuvant or early salvage radiotherapy for the treatment of localised and locally advanced prostate cancer: a prospectively planned systematic review and meta-analysis of aggregate data. Lancet. 396 (10260), 1422-1431 (2020).
- Lumen, N., et al. Safe introduction of robot-assisted radical prostatectomy after a training program in a high-volume robotic centre. Urologia Internationalis. 91 (2), 145-152 (2013).
- Galfano, A., Secco, S., Bocciardi, A. M. Mottrie A. Retzius-sparing robot-assisted laparoscopic radical prostatectomy: An international survey on surgical details and worldwide diffusion. European Urology Focus. 6 (5), 1021-1023 (2020).
- Checcucci, E., et al. Precision prostate cancer surgery: an overview of new technologies and techniques. Minerva Urologica e Nefrologica: The Italian Journal of Urology and Nephrology. 71 (5), 487-501 (2019).
- Grasso, A. A., et al. Posterior musculofascial reconstruction after radical prostatectomy: an updated systematic review and a meta-analysis. BJU International. 118 (1), 20-34 (2016).
- Manfredi, M., et al. Total anatomical reconstruction during robot-assisted radical prostatectomy: focus on urinary continence recovery and related complications after 1000 procedures. BJU international. 124 (3), 477-486 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten