A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
קביעת יציבות הסרום של האנזים אדנוזין דמינאז 1 אנושי
In This Article
Summary
במאמר זה נפרט שיטות לאפיון יכולתו של אנזים לשמור על תפקודו כאשר הוא מודגר בטמפרטורה של 37°C בסרום אנושי, תכונה פרמקולוגית המכונה יציבות הסרום שלו. יכולת זו עשויה להיות גורם מפתח בניבוי הפרופיל הפרמקוקינטי של אנזים והתאמתו לשימוש טיפולי.
Abstract
הרעיון של יציבות אנזים משמש בדרך כלל כדי להתייחס ליציבות התרמו-יציבה של אנזים - יכולתו לשמור על מבנה ופעילות ככל שהטמפרטורה עולה. עבור אנזים טיפולי, מדדים אחרים של יציבות עשויים גם הם להיות קריטיים, במיוחד יכולתו לשמור על תפקוד בסרום האנושי בטמפרטורה של 37 מעלות צלזיוס, שאנו מכנים יציבות בסרום. במאמר זה אנו מתארים בדיקה חוץ-גופית להערכת יציבות הסרום של האנזים הומו ספיינס אדנוזין דיאמינאז I (HsADA1) באמצעות הליך מיקרו-צלחת מבוסס ספיגה. באופן ספציפי, כתב יד זה מתאר את הכנת החוצצים והריאגנטים, שיטה המארגנת את הצירוף של HsADA1 בסרום, שיטה לניתוח דגימות הבדיקה באמצעות קורא microplate, וניתוח נלווה כדי לקבוע את חלק הפעילות שאנזים HsADA1 שומר בסרום כפונקציה של זמן. בהמשך נדון בשיקולים להתאמת פרוטוקול זה לאנזימים אחרים, תוך שימוש בדוגמה של אנזים הומו ספיינס קינורנינאז, כדי לסייע בהסתגלות הפרוטוקול לאנזימים אחרים שבהם יציבות הסרום מעניינת.
Introduction
השיטה הבאה מאפשרת למשתמש להעריך כמותית את יכולתו של אנזים לשמור על פעילותו כאשר הוא נחשף לתנאים המחקים את מה שהוא ייתקל בו לאחר הזרקה לווריד. שיטת in vitro מחקה תנאי in vivo כאלה וכוללת דגירה של האנזים בסרום אנושי משולב ב 37 מעלות צלזיוס וניתוח בזמן של שימור פעילות האנזים. אנו מתייחסים ליכולתו של אנזים לשמור על פעילות בתנאים אלה כיציבות הסרום שלו, ושיטת הניתוח לפעילות האנזים מנצלת את ההבדלים בספיגה בין הסובסטרט של האנזים לבין המוצר המתקבל. הרעיון של יציבות בסרום אינו רק ספציפי לאנזים ויושם גם במספר שיטות טיפול אחרות. לדוגמה, יציבות הסרום של אפטמרים RNA המכוונים לחלבוני ספייק COVID הוערכה בעבר על ידי ניטור הפירוק שלהם לאחר הדגירה עם סרום עגל עוברי1. פפטידים אנטיבקטריאליים הוערכו גם ביכולתם לדכא צמיחת חיידקים לאחר הדגירה עם סרום אנושי2.
HsADA1 הוא אנזים המזרז את ההמרה של אדנוזין או 2-deoxyadenosine לתוך inosine או 2-deoxyinosine, בהתאמה3. אדנוזין יש שיא ספיגה של 260 ננומטר, בעוד inosine נספג חזק ביותר ב 250 ננומטר4. ניתן לזהות את השינוי הזה בשיאי הספיגה בקורא מיקרו-צלחות על ידי ירידה בעוצמת הספיגה ב-260 ננומטר כאשר מוסיפים HsADA1 לאדנוזין. לאנזים HsADA1 השלכות חשובות בגוף האדם, ומחסור בו גורם לכשל חיסוני משולב חמור (ADA-SCID)5. הומולוג הבקר של HsADA1, BtADA1, יכול לשמש כתחליף אנזים לטיפול ב- ADA-SCID, והראינו בעבר כי HsADA1 פראי מאבד את פעילותו כאשר הוא מודגר עם נסיוב אנושי מאוגד, מה שעלול לעכב את השימוש בו כטיפול6. לכן, בחרנו באנזים HsADA1 כדי להדגים הליך לקביעת יציבות הסרום של אנזים. שיטת טיהור מפורטת עבור HsADA1 תוארה בעבר6.
בפרוטוקול הבא (כמפורט באיור 1), אנו מדגימים כיצד לדגור במשותף על HsADA1 מסוג בר בסרום אנושי משולב בטמפרטורה של 37°C. במהלך תקופה זו, דגימות הבדיקה נלקחות בנקודות זמן מוגדרות ומוקפאות במהירות הבזק לניתוח עתידי. לאחר שנלקחו כל הדגימות, מתבצעת בדיקת מיקרו-צלחות שבה כל דגימה משולבת עם המצע, כאשר ירידת הספיגה המתקבלת היא מתאם לפעילות השמורה של האנזים. מוצגות תוצאות מייצגות המדגימות את יציבות הסרום של HsADA1, ומכיוון שמדד זה עשוי להיות רלוונטי לקביעת הערך הטיפולי הפוטנציאלי של אנזימים אחרים, אנו דנים גם בשיקולים להתאמת פרוטוקול זה לאנזים הומו ספיינס קינורנינאז מהונדס (HsKYNase) ולכל אנזים באופן כללי יותר. HsKYNase הוא אנזים המעורב בחילוף החומרים של טריפטופן והוא מסוגל לפרק את תוצרי הלוואי של טריפטופן kynurenine ו hydroxy-kynurenine (OH-Kyn) לחומצה אנתראנילית וחומצה הידרוקסי-אנתראנילית (OH-AA), בהתאמה. אפנון בתיווך אנזים של מטבוליזם טריפטופן עשוי להיות בעל רלוונטיות טיפולית7.
Protocol
1. דגירה בסרום
- הכינו מלאי של 10x HsADA1 ב-1x PBS pH 7.4 (1x PBS) בריכוז סופי של 10 מיקרומטר. הפשירו אליקוט של 15 מ"ל של סרום אנושי מאוגד וחממו אותו מראש ל-37°C. לחמם מראש aliquot 50 מ"ל של 1x PBS ל 37 ° C.
- הכינו את תערובות הדגירה של האנזים-סרום על ידי הוספת 100 μL של ציר HsADA1 10x ל-900 μL של סרום אנושי בצינור מיקרוצנטריפוגה בעל קישור נמוך, המכונה תערובת אנזים + סרום. בצינור מיקרוצנטריפוגה נפרד בעל קשירה נמוכה, הוסף 100 μL של מלאי 10x HsADA1 ל- 900 μL של 1x PBS לשם השוואה לבקרה שאינה בסרום, המכונה תערובת אנזים + 1x PBS. הריכוז הסופי של HsADA1 בכל תערובת יהיה 1 מיקרומטר.
- הכינו בקרה נוספת בצינור מיקרוצנטריפוגה בעל קשירה נמוכה המורכב מ-100 μL של 1x PBS מעורבב עם 900 μL של סרום אנושי מאוגם. זה ישמש כבקרה ללא אנזים עבור תערובת אנזים + סרום. בנוסף, בצע בקרה המורכבת מ -1 מ"ל של PBS 1x. זה ישמש כבקרה שאינה אנזים עבור תערובת האנזים + 1x PBS.
- Aliquot 100 μL של כל תערובת משלב 1.2 לתוך צינורות נפרדים בעלי קישור נמוך לדלל 1: 1 עם 100 μL של 30% (v/v) גליצרול ב 1x PBS. יש להקפיא במהירות הבזק עם חנקן נוזלי ולאחסן בטמפרטורה של -80°C. דגימות אלה יהיו נקודת הזמן של יום 0, וריכוז HsADA1 בהן יהיה 500 ננומטר. חזור על שלב זה עבור תערובות הבקרה שאינן אנזימים מ-1.3. אוטמים את כל האנזימים ושולטים בתערובות עם סרט שקוף ומניחים אותם באינקובטור של 37°C.
- לאחר 24 שעות, aliquot 100 μL של כל דגימה מודגרת לדלל 1: 1 עם 100 μL של 30% (v/v) גליצרול ב 1x PBS. יש להקפיא במהירות הבזק עם חנקן נוזלי ולאחסן בטמפרטורה של -80°C. דגימות אלה יהיו נקודת הזמן של היום הראשון. החזירו את כל תערובות האנזימים והבקרה לאינקובטור של 37°C. חזור על שלב זה ב- 72 שעות וב- 120 שעות.
הערה: דגימות עלי-מצוטטות אינן חייבות בהכרח להיות קפואות באמצעות הבזק. לחלופין, המשתמש יכול לבצע את הבדיקה מבוססת המיקרו-צלחת מיד לאחר לקיחת כל דגימה, אם כי יש להכין עקומות סטנדרטיות טריות ומלאי מצע אדנוזין בכל פעם שהדגימה נבדקת.
2. בדיקה מבוססת מיקרופלייט
- הכינו את קורא המיקרו-לוחות על-ידי הגדרת פרוטוקול קריאה קינטית (איור 2) כדי למדוד את הספיגה ב-260 ננומטר עם מרווח הקריאה הקצר ביותר למשך 30 דקות, ולחמם את הקורא לנקודת קבע של 37°C.
- הפשירו את כל הדגימות שנאספו על קרח. יש לדלל כל דגימה מופשרת ביחס 1:10 באמצעות 1x PBS שחומם מראש ל-37°C כמדלל בצינורות מיקרוצנטריפוגות בעלות קישור נמוך. ריכוז HsADA1 החדש בדגימות אלה יהיה 50 ננומטר.
- בצע דילול של 10x ל-1x PBS גם מדגימת הבקרה של סרום שאינו אנזים. בנוסף, הכינו מלאי אדנוזין של 5 מ"מ על ידי הוספת 66.8 מ"ג אדנוזין ל-50 מ"ל של 1x PBS. הכינו דילול אדנוזין של 250 מיקרומטר על ידי הוספת 400 מיקרוליטר של מלאי האדנוזין ל-7,600 מיקרוליטר של 1x PBS וחממו אותו מראש ל-37 מעלות צלזיוס באינקובטור.
- למיקרו-צלחת תואמת UV של 96 בארות, הוסף 160 μL של דילול אדנוזין של 250 μM ו- 40 μL של כל דגימת חלבון מדולל בטריפליקט לקבלת נפח כולל של 200 μL. זה יניב ריכוז אדנוזין סופי של 200 מיקרומטר וריכוז אנזים סופי של 10 ננומטר.
- חזור על הדילול עבור דגימות הבקרה על ידי הוספת 40 μL של הסרום המדולל או 1x PBS פקדים ו 160 μL של דילול אדנוזין 250 μM במשולש. זה גם יניב ריכוז אדנוזין סופי של 200 מיקרומטר אך ללא אנזים.
הערה: ייתכן שיהיה מועיל להוסיף תחילה את כל דגימות האנזים והבקרה המדוללות בנפרד למיקרו-צלחת ולאחר מכן להוסיף את מצע האדנוזין עם מיקרופיפטה של 12 ערוצים כדי להפחית את זמן הטעינה הכולל. בנוסף, יש להשתמש בלוחות שקופים UV בשלב זה כדי למנוע מהצלחת עצמה לבלבל את אות הספיגה הנמדד. - מדוד את הספיגה של כל באר ב 260 ננומטר במשך 30 דקות ב 37 ° C. לאחר שתסיים, יצא את הנתונים לגיליון אלקטרוני לניתוח נוסף.
3. ניתוח נתוני קורא microplate
- קבע את שיפוע האזור הליניארי של נתוני הספיגה כפונקציה של הזמן עבור הדקות הראשונות של נתוני המיקרו-לוחית. עבור הדגימות המדוללות בסרום, זה התאים ל~120 שניות הראשונות. עבור 1x PBS מדולל דגימות, זה התאים הראשון ~ 270 s. שיפוע זה של ערכי ספיגה יורדים יהיה בעל ערך מספרי שלילי ויהיו לו יחידות שינוי ביחידות הספיגה לשנייה (ΔA260/s).
- החסרו את שיפוע הבקרה השלילית המורכבת מסרום אנושי מאוגד מהשיפוע של נתוני האנזים + הסרום. בצע את אותה פעולה על האנזים + תערובות PBS 1x על ידי חיסור השיפוע של בקרת PBS 1x.
- נרמל את כל השיפועים המותאמים לשיפוע המקורי ב- t=0 h כדי לקבל את חלק הפעילות שנותר באמצעות משוואה 1.
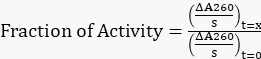 משוואה 1
משוואה 1 - התווה את שבריר הפעילות שנותר לעומת הזמן.
תוצאות
הנתונים מראים את תוצאות הבדיקה שבוצעה עם Wildtype HsADA1. איור 3A,B ממחיש את עקומות הירידה בספיגה ב-260 ננומטר של הדגימות שמקורן בתערובות 1x PBS/סרום-אנזים עבור סוג הבר HsADA1 לאחר הוספת אדנוזין. ירידה זו בספיגה כפונקציה של נתוני זמן היא מה שהמשתמש עשוי לצפות עם ...
Discussion
פרוטוקול זה משתמש בשינוי ספיגה כאשר המצע מומר למוצר כדי לאמוד את הפעילות של אנזים. ככזה, המצע והמוצר חייבים להיות בעלי פרופילים ספקטרליים נפרדים. זה המקרה עם אדנוזין ואינוזין שניהם בעלי פרופילים ספקטרליים נפרדים ומקדמי הכחדה בין 260-265 ננומטר 6,8,12,13.
Disclosures
JB ו- MRJ הם ממציאים על פטנטים או בקשות פטנט הקשורות לאנזימי אדנוזין דמינאז ו / או kynureninase. לכל המחברים האחרים אין ניגודי עניינים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי המכונים הלאומיים לבריאות [1DP2CA280622-01] ומימון של Biolocity. אנו מודים לד"ר מריה ג'נינגס ולאנדריאה פוקס על אספקת וקטורי הביטוי HsADA1 ו-HsKYNase.
Materials
| Name | Company | Catalog Number | Comments |
| Adenosine | Sigma Aldrich | A9251-25G | 25 g |
| BioTek Synergy HT Microplate Reader | |||
| Eppendorf LoBind Microcentrifuge Tubes: Protein | Fisher Scientific | 13-698-795 | 2 mL |
| Glycerol | Fisher Scientific | G33-4 | 4 L |
| HsKYNase66-W102H-T333N | In-house | ||
| Human Serum, Pooled | MP Biomedicals | 92931149 | 100 mL |
| Hydroxy-kynurenine | Cayman Chemicals | 27778 | |
| Inosine | TCI | I0037 | 25 g |
| PBS, 1x pH 7.4+/- 0.1 | Corning | 21-040-CM | |
| Pyridoxal 5-phosphate monohydrate, 99% | Thermo Scientifc | 228170010 | 1 g |
| UV-STAR MICROPLATE, 96 WELL, COC, F-BOTTOM | Greiner Bio | 655801 | |
| Wildtype Human Adenosine Deaminase 1 | In-house |
References
- Valero, J., et al. A serum-stable RNA aptamer specific for SARS-COV-2 neutralizes viral entry. Proc Natl Acad Sci U S A. 118 (50), e2112942118 (2021).
- Iannuzo, N., et al. High-throughput screening identifies synthetic peptides with antibacterial activity against mycobacterium abscessus and serum stability. ACS Omega. 7 (27), 23967-23977 (2022).
- Ma, M. T., Jennings, M. R., Blazeck, J., Lieberman, R. L. Catalytically active holo homo sapiens adenosine deaminase i adopts a closed conformation. Acta Crystallograph Sect D. 78 (1), 91-103 (2022).
- Li, W., et al. Determination of 4 nucleosides via one reference compound in chinese cordyceps by hplc-uv at equal absorption wavelength. Natural Prod Comm. 18 (3), 1934578X231161410 (2023).
- Whitmore, K. V., Gaspar, H. B. Adenosine deaminase deficiency - more than just an immunodeficiency. Front Immunol. 7, 314 (2016).
- Jennings, M. R., et al. Optimized expression and purification of a human adenosine deaminase in E. coli and characterization of its asp8asn variant. Prot Express Purificat. 213, 106362 (2024).
- Blazeck, J., et al. Bypassing evolutionary dead ends and switching the rate-limiting step of a human immunotherapeutic enzyme. Nat Catalysis. 5 (10), 952-967 (2022).
- Lu, J., Grenache, D. G. Development of a rapid, microplate-based kinetic assay for measuring adenosine deaminase activity in body fluids. Clinica Chimica Acta. 413 (19), 1637-1640 (2012).
- Maciel, L. G., Dos Anjos, J. V., Soares, T. A. Fast and low-cost evaluation of hydroxykynurenine activity. MethodsX. 7, 100982 (2020).
- Bokman, A. H., Schweigert, B. S. 3-hydroxyanthranilic acid metabolism. Iv. Spectrophotometric evidence for the formation of an intermediate. Arch Biochem Biophys. 33 (2), 270-276 (1951).
- Tanford, C. . Advances in protein chemistry. 23, 121-282 (1968).
- Tritsch, G. L. Validity of the continuous spectrophotometric assay of kalckar for adenosine deaminase activity. Anal Biochem. 129 (1), 207-209 (1983).
- Gracia, E., et al. The catalytic site structural gate of adenosine deaminase allosterically modulates ligand binding to adenosine receptors. FASEB J. 27 (3), 1048-1061 (2013).
- Kalckar, H. M. Differential spectrophotometry of purine compounds by means of specific enzymes: Iii. Studies of the enzymes of purine metabolism. J Bio Chem. 167 (2), 461-475 (1947).
- Hartwick, R., Jeffries, A., Krstulovic, A., Brown, P. R. An optimized assay for adenosine deaminase using reverse phase high pressure liquid chromatography. J Chromatographic Sci. 16 (9), 427-435 (1978).
- Paul, M. K., Grover, V., Mukhopadhyay, A. K. Merits of hplc-based method over spectrophotometric method for assessing the kinetics and inhibition of mammalian adenosine deaminase. J Chromatography B. 822 (1), 146-153 (2005).
- Ubbink, J. B., Vermaak, W. J. H., Bissbort, S. H. High-performance liquid chromatographic assay of human lymphocyte kynureninase activity levels. J Chromatography B: Biomed Sci Appl. 566 (2), 369-375 (1991).
- Tsentalovich, Y. P., Snytnikova, O. A., Forbes, M. D. E., Chernyak, E. I., Morozov, S. V. Photochemical and thermal reactivity of kynurenine. Exp Eye Res. 83 (6), 1439-1445 (2006).
- Demain, A. L., Vaishnav, P. Production of recombinant proteins by microbes and higher organisms. Biotechnol Adv. 27 (3), 297-306 (2009).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Faber, M. S., Whitehead, T. A. Data-driven engineering of protein therapeutics. Curr Opin Biotechnol. 60, 104-110 (2019).
- Das, S., Zhao, L., Elofson, K., Finn, M. G. Enzyme stabilization by virus-like particles. Biochemistry. 59 (31), 2870-2881 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved