Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Определение сывороточной стабильности фермента аденозиндезаминазы 1 человека
В этой статье
Резюме
В этой статье мы подробно описываем методы характеристики способности фермента сохранять функцию при инкубации при 37 °C в сыворотке крови человека, фармакологическое свойство, называемое его стабильностью в сыворотке. Эта способность может быть ключевым фактором в прогнозировании фармакокинетического профиля фермента и его пригодности для терапевтического использования.
Аннотация
Понятие стабильности фермента обычно используется для обозначения термостабильности фермента — его способности сохранять структуру и активность при повышении температуры. Для терапевтического фермента другие показатели стабильности также могут иметь решающее значение, в частности, его способность сохранять функцию в сыворотке крови человека при 37 °C, которую мы называем стабильностью сыворотки. В данной статье мы описываем анализ in vitro для оценки сывороточной стабильности фермента аденозиндезаминазы I (HsADA1) дикого типа Homo sapiens с использованием микропланшетной процедуры, основанной на абсорбции. В частности, в данной рукописи описывается приготовление буферов и реагентов, метод организации коинкубации HsADA1 в сыворотке, метод анализа тестовых образцов с помощью считывателя микропланшетов и сопутствующий анализ для определения доли активности, которую фермент HsADA1 сохраняет в сыворотке в зависимости от времени. Далее мы обсудим соображения по адаптации этого протокола к другим ферментам на примере фермента кинурениназы Homo sapiens , чтобы помочь адаптировать протокол к другим ферментам, где стабильность сыворотки представляет интерес.
Введение
Следующий метод позволяет пользователю количественно оценить способность фермента сохранять свою активность при воздействии условий, которые имитируют те, с которыми он столкнется после внутривенной инъекции. Метод in vitro имитирует такие условия in vivo и состоит из инкубации фермента в объединенной сыворотке крови человека при 37 °C и временного анализа сохранения активности фермента. Мы называем способность фермента сохранять активность в этих условиях стабильностью его сыворотки крови, а метод анализа активности фермента использует различия в абсорбции между субстратом фермента и полученным продуктом. Концепция стабильности сыворотки является не только ферментоспецифичной, но и применяется к нескольким другим методам лечения. Например, сывороточная стабильность аптамеров РНК, нацеленных на шиповидные белки COVID, ранее оценивалась путем мониторинга их деградации после инкубации с сывороткой плода 1 телят. Антибактериальные пептиды также были оценены на предмет их способности подавлять рост бактерий после инкубации с объединенной сывороткой 2человека.
HsADA1 является ферментом, который катализирует превращение аденозина или 2-дезоксиаденозина в инозин или 2-дезоксиинозин,соответственно3. Аденозин имеет пик поглощения 260 нм, в то время как инозин поглощается сильнее всего при 250нм4. Этот сдвиг пиков поглощения может быть обнаружен на микропланшете по снижению интенсивности поглощения на длине волны 260 нм, когда HsADA1 добавляется к аденозину. Фермент HsADA1 имеет важное значение для организма человека, и его дефицит вызывает тяжелый комбинированный иммунодефицит (ADA-SCID)5. Бычий гомолог HsADA1, BtADA1, может быть использован в качестве ферментозаместительной терапии для лечения ADA-SCID, и ранее мы показали, что дикий тип HsADA1 теряет свою активность при инкубации с объединенной сывороткой человека, что потенциально препятствует его использованию в качестве терапевтического6. Поэтому мы выбрали фермент дикого типа HsADA1, чтобы продемонстрировать процедуру определения стабильности фермента в сыворотке крови. Подробный метод очистки HsADA1 был описан ранее6.
В следующем протоколе (как подробно описано на рисунке 1) мы демонстрируем, как проводить совместную инкубацию HsADA1 дикого типа в объединенной сыворотке крови человека при 37 °C. В течение этого времени отбираются тестовые образцы в определенные моменты времени и замораживаются для последующего анализа. После того, как все образцы были взяты, проводится анализ на микропланшетах, в ходе которого каждый образец объединяется с субстратом, при этом результирующее снижение абсорбции является корреляцией с сохраненной активностью фермента. Представлены репрезентативные результаты, иллюстрирующие сывороточную стабильность HsADA1, и, поскольку этот показатель может иметь отношение к определению потенциальной терапевтической ценности других ферментов, мы также обсуждаем соображения по адаптации этого протокола к модифицированному ферменту кинурениназе Homo sapiens (HsKYNase) и любым ферментам в более общем плане. HsKYNase является ферментом, участвующим в метаболизме триптофана и способным расщеплять побочные продукты триптофана кинуренин и гидрокси-кинуренин (OH-Kyn) в антраниловую кислоту и гидроксиантраниловую кислоту (OH-AA) соответственно. Фермент-опосредованная модуляция метаболизма триптофана может иметь терапевтическое значение7.
протокол
1. Инкубация сыворотки
- Приготовьте 10-кратный запас HsADA1 в 1x PBS pH 7,4 (1x PBS) при конечной концентрации 10 мкМ. Разморозьте 15 мл аликвоты объединенной человеческой сыворотки и предварительно нагрейте ее до 37 °C. Разогрейте 50 мл аликвоты 1x PBS до 37 °C.
- Приготовьте инкубационные смеси ферментов и сыворотки, добавив 100 мкл 10x запаса HsADA1 к 900 мкл объединенной человеческой сыворотки в микроцентрифужной пробирке с низким уровнем связывания, называемой смесью фермент + сыворотка. В отдельную микроцентрифужную пробирку с низким уровнем связывания добавьте 100 мкл 10x HsADA1 к 900 мкл 1x PBS для сравнения с несывороточным контролем, называемым смесью фермент + 1x PBS. Конечная концентрация HsADA1 в каждой смеси составит 1 мкМ.
- Приготовьте дополнительный контроль в микроцентрифужной пробирке с низким уровнем связывания, состоящей из 100 мкл 1x PBS, смешанного с 900 мкл объединенной человеческой сыворотки. Это послужит неферментным контролем для смеси фермент + сыворотка. Дополнительно сделайте контроль, состоящий из 1 мл 1x PBS. Это будет служить в качестве неферментативного контроля для фермента + 1x PBS смеси.
- Распределите 100 мкл каждой смеси с этапа 1.2 в отдельные пробирки с низким уровнем связывания и разбавьте 1:1 100 мкл 30% (v/v) глицерина в 1x PBS. Мгновенную заморозку жидким азотом и хранить при температуре -80 °C. Эти образцы будут иметь временную точку дня 0, а концентрация HsADA1 в них составит 500 нМ. Повторите этот шаг для смесей без ферментов из 1.3. Запечатайте все ферменты и контрольные смеси прозрачной пленкой и поместите их в инкубатор с температурой 37 °C.
- Через 24 ч внесите 100 мкл каждого инкубированного образца и разбавьте 1:1 100 мкл 30% (v/v) глицерина в 1x PBS. Мгновенную заморозку жидким азотом и хранить при температуре -80 °C. Эти образцы будут временной точкой дня 1. Верните все ферментные и контрольные смеси в инкубатор при температуре 37 °C. Повторите этот шаг через 72 ч и 120 ч.
ПРИМЕЧАНИЕ: Аликвотированные образцы не обязательно должны быть мгновенно заморожены. В качестве альтернативы пользователь может выполнить анализ на основе микропланшетов сразу после взятия каждого образца, хотя при каждом тестировании образца необходимо готовить свежие стандартные кривые и запасы аденозинового субстрата.
2. Анализ на микропланшетах
- Подготовьте считыватель микропланшетов, настроив протокол кинетического считывания (рис. 2) для измерения поглощения при длине волны 260 нм с кратчайшим интервалом считывания в течение 30 мин и предварительно нагрейте считыватель до заданного значения 37 °C.
- Разморозьте все собранные образцы на льду. Разбавьте каждый размороженный образец в соотношении 1:10 с использованием 1x PBS, предварительно нагретого до 37 °C, в качестве разбавителя в микроцентрифужных пробирках с низким уровнем связывания. Новая концентрация HsADA1 в этих образцах составит 50 нМ.
- Также сделайте 10-кратное разведение до 1x PBS из контрольного образца сыворотки, не содержащего ферментов. Кроме того, приготовьте 5 мМ аденозина, добавив 66,8 мг аденозина к 50 мл 1x PBS. Приготовьте 250 μМ разведение аденозина, добавив 400 μL аденозинового запаса к 7 600 μL 1x PBS и предварительно подогрейте его до 37 °C в инкубаторе.
- В 96-луночный УФ-совместимый микропланшет добавьте 160 мкл 250 мкМ разведения аденозина и 40 мкл каждого разведенного образца белка в трех экземплярах, чтобы получить общий объем 200 мкл. Это дает конечную концентрацию аденозина 200 мкМ и конечную концентрацию фермента 10 нМ.
- Повторите разведение для контрольных образцов, добавив 40 мкл разбавленной сыворотки или 1x PBS контрольной группы и 160 мкл 250 мкМ аденозина в тройном разведении. Это также дает конечную концентрацию аденозина 200 мкМ, но без фермента.
ПРИМЕЧАНИЕ: Может быть полезно сначала добавить все разведенные ферменты и контрольные образцы по отдельности на микропланшет, а затем добавить аденозиновый субстрат с помощью 12-канальной микропипетки для сокращения общего времени загрузки. Кроме того, на этом этапе необходимо использовать УФ-прозрачные пластины, чтобы предотвратить искажение измеренного сигнала поглощения на самой пластине. - Измерьте поглощение каждой лунки при длине волны 260 нм в течение 30 минут при 37 °C. После этого экспортируйте данные в электронную таблицу для дальнейшего анализа.
3. Анализ данных считывателя микропланшетов
- Определите наклон линейной области данных о поглощении в зависимости от времени для первых нескольких минут данных микропланшета. Для образцов, разбавленных сывороткой, это соответствовало первым ~120 с. Для 1x PBS-разбавленных образцов это соответствовало первым ~270 с. Этот наклон убывающих значений поглощения будет иметь отрицательное числовое значение и будет иметь единицы изменения в единицах поглощения в секунду (ΔA260/с).
- Вычтите наклон отрицательного контроля, состоящего из объединенной сыворотки крови человека, из наклона данных фермента + сыворотки. Проделайте ту же операцию со смесью фермент + 1x PBS, вычитая наклон элемента управления 1x PBS.
- Нормализуем все скорректированные уклоны до исходного уклона при t=0 ч, чтобы получить долю оставшейся активности, используя уравнение 1.
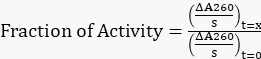 Уравнение 1
Уравнение 1 - Составьте график зависимости оставшейся активности от времени.
Результаты
На рисунках представлены результаты пробирного анализа при проведении с диким типом HsADA1. На рисунках 3A, B показаны кривые снижения абсорбции на длине волны 260 нм образцов, полученных из 1x PBS/сывороточно-ферментных смесей для HsADA1 дикого типа пос...
Обсуждение
В этом протоколе используется изменение абсорбции при преобразовании субстрата в продукт для измерения активности фермента. Таким образом, подложка и продукт должны иметь различные спектральные профили. Это относится к аденозину и инозину, которые имеют различные с...
Раскрытие информации
JB и MRJ являются изобретателями по патентам или патентным заявкам, связанным с ферментами аденозиндезаминазой и/или кинурениназа. У всех остальных авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Эта работа была поддержана Национальным институтом здравоохранения [1DP2CA280622-01] и финансированием Biolocity. Мы благодарим доктора Марию Дженнингс и Андреа Фокс за предоставление векторов экспрессии HsADA1 и HsKYNase.
Материалы
| Name | Company | Catalog Number | Comments |
| Adenosine | Sigma Aldrich | A9251-25G | 25 g |
| BioTek Synergy HT Microplate Reader | |||
| Eppendorf LoBind Microcentrifuge Tubes: Protein | Fisher Scientific | 13-698-795 | 2 mL |
| Glycerol | Fisher Scientific | G33-4 | 4 L |
| HsKYNase66-W102H-T333N | In-house | ||
| Human Serum, Pooled | MP Biomedicals | 92931149 | 100 mL |
| Hydroxy-kynurenine | Cayman Chemicals | 27778 | |
| Inosine | TCI | I0037 | 25 g |
| PBS, 1x pH 7.4+/- 0.1 | Corning | 21-040-CM | |
| Pyridoxal 5-phosphate monohydrate, 99% | Thermo Scientifc | 228170010 | 1 g |
| UV-STAR MICROPLATE, 96 WELL, COC, F-BOTTOM | Greiner Bio | 655801 | |
| Wildtype Human Adenosine Deaminase 1 | In-house |
Ссылки
- Valero, J., et al. A serum-stable RNA aptamer specific for SARS-COV-2 neutralizes viral entry. Proc Natl Acad Sci U S A. 118 (50), e2112942118 (2021).
- Iannuzo, N., et al. High-throughput screening identifies synthetic peptides with antibacterial activity against mycobacterium abscessus and serum stability. ACS Omega. 7 (27), 23967-23977 (2022).
- Ma, M. T., Jennings, M. R., Blazeck, J., Lieberman, R. L. Catalytically active holo homo sapiens adenosine deaminase i adopts a closed conformation. Acta Crystallograph Sect D. 78 (1), 91-103 (2022).
- Li, W., et al. Determination of 4 nucleosides via one reference compound in chinese cordyceps by hplc-uv at equal absorption wavelength. Natural Prod Comm. 18 (3), 1934578X231161410 (2023).
- Whitmore, K. V., Gaspar, H. B. Adenosine deaminase deficiency - more than just an immunodeficiency. Front Immunol. 7, 314 (2016).
- Jennings, M. R., et al. Optimized expression and purification of a human adenosine deaminase in E. coli and characterization of its asp8asn variant. Prot Express Purificat. 213, 106362 (2024).
- Blazeck, J., et al. Bypassing evolutionary dead ends and switching the rate-limiting step of a human immunotherapeutic enzyme. Nat Catalysis. 5 (10), 952-967 (2022).
- Lu, J., Grenache, D. G. Development of a rapid, microplate-based kinetic assay for measuring adenosine deaminase activity in body fluids. Clinica Chimica Acta. 413 (19), 1637-1640 (2012).
- Maciel, L. G., Dos Anjos, J. V., Soares, T. A. Fast and low-cost evaluation of hydroxykynurenine activity. MethodsX. 7, 100982 (2020).
- Bokman, A. H., Schweigert, B. S. 3-hydroxyanthranilic acid metabolism. Iv. Spectrophotometric evidence for the formation of an intermediate. Arch Biochem Biophys. 33 (2), 270-276 (1951).
- Tanford, C. . Advances in protein chemistry. 23, 121-282 (1968).
- Tritsch, G. L. Validity of the continuous spectrophotometric assay of kalckar for adenosine deaminase activity. Anal Biochem. 129 (1), 207-209 (1983).
- Gracia, E., et al. The catalytic site structural gate of adenosine deaminase allosterically modulates ligand binding to adenosine receptors. FASEB J. 27 (3), 1048-1061 (2013).
- Kalckar, H. M. Differential spectrophotometry of purine compounds by means of specific enzymes: Iii. Studies of the enzymes of purine metabolism. J Bio Chem. 167 (2), 461-475 (1947).
- Hartwick, R., Jeffries, A., Krstulovic, A., Brown, P. R. An optimized assay for adenosine deaminase using reverse phase high pressure liquid chromatography. J Chromatographic Sci. 16 (9), 427-435 (1978).
- Paul, M. K., Grover, V., Mukhopadhyay, A. K. Merits of hplc-based method over spectrophotometric method for assessing the kinetics and inhibition of mammalian adenosine deaminase. J Chromatography B. 822 (1), 146-153 (2005).
- Ubbink, J. B., Vermaak, W. J. H., Bissbort, S. H. High-performance liquid chromatographic assay of human lymphocyte kynureninase activity levels. J Chromatography B: Biomed Sci Appl. 566 (2), 369-375 (1991).
- Tsentalovich, Y. P., Snytnikova, O. A., Forbes, M. D. E., Chernyak, E. I., Morozov, S. V. Photochemical and thermal reactivity of kynurenine. Exp Eye Res. 83 (6), 1439-1445 (2006).
- Demain, A. L., Vaishnav, P. Production of recombinant proteins by microbes and higher organisms. Biotechnol Adv. 27 (3), 297-306 (2009).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Faber, M. S., Whitehead, T. A. Data-driven engineering of protein therapeutics. Curr Opin Biotechnol. 60, 104-110 (2019).
- Das, S., Zhao, L., Elofson, K., Finn, M. G. Enzyme stabilization by virus-like particles. Biochemistry. 59 (31), 2870-2881 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены