Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bestimmung der Serumstabilität des humanen Adenosin-Desaminase-1-Enzyms
In diesem Artikel
Zusammenfassung
In diesem Artikel beschreiben wir Methoden zur Charakterisierung der Fähigkeit eines Enzyms, seine Funktion beizubehalten, wenn es bei 37 °C in menschlichem Serum inkubiert wird, eine pharmakologische Eigenschaft, die als Serumstabilität bezeichnet wird. Diese Fähigkeit kann ein Schlüsselfaktor bei der Vorhersage des pharmakokinetischen Profils eines Enzyms und seiner Eignung für den therapeutischen Einsatz sein.
Zusammenfassung
Das Konzept der Enzymstabilität wird in der Regel verwendet, um sich auf die Thermostabilität eines Enzyms zu beziehen - seine Fähigkeit, Struktur und Aktivität bei steigender Temperatur beizubehalten. Für ein therapeutisches Enzym können auch andere Stabilitätsmaße entscheidend sein, insbesondere seine Fähigkeit, die Funktion im menschlichen Serum bei 37 °C beizubehalten, was wir als Serumstabilität bezeichnen. In dieser Arbeit beschreiben wir einen in vitro Assay zur Beurteilung der Serumstabilität des Wildtyp-Enzyms Homo sapiens Adenosin-Deaminase I (HsADA1) unter Verwendung eines absorptionsbasierten Mikroplattenverfahrens. Insbesondere beschreibt dieses Manuskript die Herstellung von Puffern und Reagenzien, ein Verfahren zur Anordnung der Koinkubation von HsADA1 im Serum, ein Verfahren zur Analyse der Testproben unter Verwendung eines Mikroplatten-Readers und eine begleitende Analyse zur Bestimmung des Anteils der Aktivität, den ein HsADA1-Enzym im Serum als Funktion der Zeit beibehält. Wir diskutieren ferner Überlegungen zur Anpassung dieses Protokolls an andere Enzyme, indem wir ein Beispiel eines Homo sapiens-Kynureninase-Enzyms verwenden, um die Anpassung des Protokolls an andere Enzyme zu unterstützen, bei denen die Serumstabilität von Interesse ist.
Einleitung
Die folgende Methode ermöglicht es einem Anwender, die Fähigkeit eines Enzyms, seine Aktivität aufrechtzuerhalten, quantitativ zu beurteilen, wenn es Bedingungen ausgesetzt wird, die dem entsprechen, was es nach einer intravenösen Injektion vorfinden wird. Die In-vitro-Methode ahmt solche in vivo-Bedingungen nach und besteht aus der Inkubation des Enzyms in gepooltem Humanserum bei 37 °C und zeitlichen Analysen der Beibehaltung der Enzymaktivität. Wir bezeichnen die Fähigkeit eines Enzyms, die Aktivität unter diesen Bedingungen aufrechtzuerhalten, als seine Serumstabilität, und die Analysemethode für die Enzymaktivität nutzt Unterschiede in der Absorption zwischen dem Substrat eines Enzyms und dem resultierenden Produkt. Das Konzept der Serumstabilität ist nicht nur enzymspezifisch, sondern wurde auch auf mehrere andere Behandlungsmodalitäten angewendet. So wurde beispielsweise die Serumstabilität von RNA-Aptameren, die auf COVID-Spike-Proteine abzielen, bereits durch die Überwachung ihres Abbaus nach der Inkubation mit fötalem Kälberserum1 bewertet. Antibakterielle Peptide wurden auch auf ihre Fähigkeit untersucht, das Bakterienwachstum nach der Inkubation mit gepooltem humanem Serumzu unterdrücken 2.
HsADA1 ist ein Enzym, das die Umwandlung von Adenosin oder 2-Desoxyadenosin in Inosin bzw. 2-Desoxyinosin katalysiert3. Adenosin hat einen Absorptionspeak von 260 nm, während Inosin bei 250 nm am stärksten absorbiertwird 4. Diese Verschiebung der Absorptionsspitzen kann auf einem Mikroplatten-Reader durch eine Abnahme der Absorptionsintensität bei 260 nm nachgewiesen werden, wenn HsADA1 zu Adenosin hinzugefügt wird. Das Enzym HsADA1 hat wichtige Auswirkungen auf den menschlichen Körper, und sein Mangel verursacht einen schweren kombinierten Immundefekt (ADA-SCID)5. Das Rinderhomolog von HsADA1, BtADA1, kann als Enzymersatztherapeutikum für die Behandlung von ADA-SCID verwendet werden, und wir haben bereits gezeigt, dass Wildtyp-HsADA1 seine Aktivität verliert, wenn es mit gepooltem humanem Serum inkubiert wird, was seine Verwendung als Therapeutikum möglicherweise behindert6. Daher haben wir das Wildtyp-Enzym HsADA1 ausgewählt, um ein Verfahren zur Bestimmung der Serumstabilität eines Enzyms zu demonstrieren. Eine detaillierte Aufreinigungsmethode für HsADA1 wurde bereits beschrieben6.
Im folgenden Protokoll (wie in Abbildung 1 beschrieben) zeigen wir, wie Wildtyp-HsADA1 in gepooltem humanem Serum bei 37 °C co-inkubiert wird. Während dieser Zeit werden zu definierten Zeitpunkten Testproben entnommen und für die spätere Analyse schockgefroren. Sobald alle Proben entnommen wurden, wird ein Mikrotiterplatten-Assay durchgeführt, bei dem jede Probe mit dem Substrat kombiniert wird, wobei die resultierende Absorptionsabnahme eine Korrelation für die erhaltene Aktivität des Enzyms darstellt. Repräsentative Ergebnisse, die die Serumstabilität von HsADA1 veranschaulichen, werden gezeigt, und da diese Metrik für die Bestimmung des potenziellen therapeutischen Wertes anderer Enzyme relevant sein kann, diskutieren wir auch Überlegungen zur Anpassung dieses Protokolls an ein manipuliertes Homo sapiens-Kynureninase-Enzym (HsKYNase) und alle Enzyme im Allgemeinen. HsKYNase ist ein Enzym, das am Stoffwechsel von Tryptophan beteiligt ist und in der Lage ist, die Tryptophan-Nebenprodukte Kynurenin und Hydroxy-Kynurenin (OH-Kyn) zu Anthranilsäure bzw. Hydroxy-Anthranilsäure (OH-AA) abzubauen. Die enzymvermittelte Modulation des Tryptophanstoffwechsels kann von therapeutischer Relevanz sein7.
Protokoll
1. Inkubation im Serum
- Bereiten Sie eine 10-fache Brühe HsADA1 in 1x PBS pH 7,4 (1x PBS) in einer Endkonzentration von 10 μM vor. Tauen Sie ein 15-ml-Aliquot des gepoolten Humanserums auf und erwärmen Sie es auf 37 °C. Erwärmen Sie ein 50 mL aliquot von 1x PBS auf 37 °C.
- Bereiten Sie die Enzym-Serum-Inkubationsgemische vor, indem Sie 100 μl des 10x HsADA1-Stammes zu 900 μl gepooltem Humanserum in einem Mikrozentrifugenröhrchen mit geringer Bindung hinzufügen, das als Enzym + Serum-Mischung bezeichnet wird. Geben Sie in einem separaten Mikrozentrifugenröhrchen mit geringer Bindung 100 μl des 10x HsADA1-Stammes zu 900 μl 1x PBS zum Vergleich mit einer Nicht-Serumkontrolle, die als Enzym + 1x PBS-Mischung bezeichnet wird. Die Endkonzentration von HsADA1 in jedem Gemisch beträgt 1 μM.
- Bereiten Sie eine zusätzliche Kontrolle in einem Mikrozentrifugenröhrchen mit geringer Bindung vor, das aus 100 μl 1x PBS gemischt mit 900 μl gepooltem humanem Serum besteht. Dies dient als Nicht-Enzym-Kontrolle für die Enzym + Serum-Mischung. Machen Sie zusätzlich eine Kontrolle, die aus 1 mL 1x PBS besteht. Dies dient als Nicht-Enzym-Kontrolle für das Enzym + 1x PBS-Gemisch.
- Aliquotieren Sie 100 μl jedes Gemisches aus Schritt 1.2 in separate Röhrchen mit geringer Bindung und verdünnen Sie es 1:1 mit 100 μl 30 % (v/v) Glycerin in 1x PBS. Mit flüssigem Stickstoff schockgefrieren und bei -80 °C lagern. Diese Proben sind der Zeitpunkt von Tag 0, und die Konzentration von HsADA1 in ihnen beträgt 500 nM. Dieser Schritt wird für die Nicht-Enzym-Kontrollmischungen aus Nummer 1.3 wiederholt. Verschließen Sie alle Enzyme und Kontrollgemische mit einer transparenten Folie und geben Sie sie in einen 37 °C heißen Inkubator.
- Nach 24 h aliquotieren Sie 100 μl jeder inkubierten Probe und verdünnen sie 1:1 mit 100 μl 30 % (v/v) Glycerin in 1x PBS. Mit flüssigem Stickstoff schockgefrieren und bei -80 °C lagern. Bei diesen Beispielen handelt es sich um den Zeitpunkt von Tag 1. Alle Enzym- und Kontrollgemische wieder in den 37 °C-Inkubator geben. Wiederholen Sie diesen Schritt bei 72 h und 120 h.
HINWEIS: Aliquotierte Proben müssen nicht unbedingt schockgefroren werden. Alternativ kann der Benutzer den Mikrotiterplatten-basierten Assay unmittelbar nach der Entnahme jeder Probe durchführen, obwohl jedes Mal, wenn eine Probe getestet wird, frische Standardkurven und Adenosin-Substratbestände vorbereitet werden sollten.
2. Mikrotiterplatten-basierter Assay
- Bereiten Sie den Mikroplatten-Reader vor, indem Sie ein kinetisches Leseprotokoll einrichten (Abbildung 2), um die Absorption bei 260 nm mit dem kürzesten Leseintervall für 30 Minuten zu messen und den Reader auf einen Sollwert von 37 °C vorzuheizen.
- Tauen Sie alle gesammelten Proben auf Eis auf. Jede aufgetaute Probe wird 1:10 mit 1x PBS verdünnt, das auf 37 °C als Verdünnungsmittel in Mikrozentrifugenröhrchen mit geringer Bindung vorgewärmt wird. Die neue HsADA1-Konzentration in diesen Proben wird 50 nM betragen.
- Führen Sie eine 10-fache Verdünnung in 1x PBS auch aus der Nicht-Enzym-Serum-Kontrollprobe durch. Bereiten Sie zusätzlich eine 5 mM Adenosin-Brühe vor, indem Sie 66,8 mg Adenosin zu 50 mL 1x PBS hinzufügen. Bereiten Sie eine 250 μM Verdünnung von Adenosin vor, indem Sie 400 μl des Adenosinstocks zu 7.600 μl 1x PBS hinzufügen und in einem Inkubator auf 37 °C vorwärmen.
- Zu einer UV-kompatiblen 96-Well-Mikroplatte fügen Sie 160 μl der 250 μM Adenosinverdünnung und 40 μl jeder verdünnten Proteinprobe in dreifacher Ausfertigung hinzu, um ein Gesamtvolumen von 200 μl zu erhalten. Dies ergibt eine endgültige Adenosinkonzentration von 200 μM und eine endgültige Enzymkonzentration von 10 nM.
- Wiederholen Sie die Verdünnung für die Kontrollproben, indem Sie 40 μl des verdünnten Serums oder 1x PBS-Kontrollen und 160 μl der 250 μM Adenosinverdünnung in dreifacher Ausfertigung hinzufügen. Dies ergibt auch eine endgültige Adenosinkonzentration von 200 μM, jedoch ohne Enzym.
HINWEIS: Es kann von Vorteil sein, zuerst alle verdünnten Enzym- und Kontrollproben einzeln in die Mikroplatte zu geben und dann das Adenosinsubstrat mit einer 12-Kanal-Mikropipette hinzuzufügen, um die Gesamtladezeit zu verkürzen. Zusätzlich müssen in diesem Schritt UV-transparente Platten verwendet werden, um zu verhindern, dass die Platte selbst das gemessene Absorptionssignal verfälscht. - Messen Sie die Extinktion jeder Vertiefung bei 260 nm für 30 min bei 37 °C. Sobald dies erledigt ist, exportieren Sie die Daten zur weiteren Analyse in eine Tabelle.
3. Analyse der Daten von Mikroplatten-Readern
- Bestimmen Sie die Steigung des linearen Bereichs der Absorptionsdaten als Funktion der Zeit für die ersten Minuten der Mikroplattendaten. Bei den serumverdünnten Proben entsprach dies den ersten ~120 s. Bei den 1x PBS-verdünnten Proben entsprach dies den ersten ~270 s. Diese Steigung der degressiven Absorptionswerte hat einen negativen numerischen Wert und hat Einheiten für die Änderung der Absorptionseinheiten pro Sekunde (ΔA260/s).
- Subtrahieren Sie die Steigung der Negativkontrolle, die aus gepooltem Humanserum besteht, von der Steigung der Enzym + Serumdaten. Führen Sie den gleichen Vorgang mit den Enzym + 1x PBS-Mischungen durch, indem Sie die Steigung der 1x PBS-Kontrolle subtrahieren.
- Normalisieren Sie alle angepassten Steigungen auf die ursprüngliche Steigung bei t=0 h, um den Anteil der verbleibenden Aktivität unter Verwendung von Gleichung 1 zu erhalten.
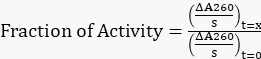 Gleichung 1
Gleichung 1 - Plotten Sie den Anteil der verbleibenden Aktivität über die Zeit.
Ergebnisse
Die Abbildungen zeigen die Ergebnisse des Assay-Laufs, der mit Wildtyp-HsADA1 durchgeführt wurde. Abbildung 3A,B zeigt die Absorptionsabfallkurven bei 260 nm der Proben, die aus den 1x PBS/Serum-Enzym-Gemischen für Wildtyp HsADA1 nach Zugabe von Adenosin stammen. Diese abnehmende Absorption in Abhängigkeit von den Zeitdaten ist das, was der Benutzer nach erfolgreichem Abschluss des Mikroplatten-basierten Assays erwarten kann und ähnelt d...
Diskussion
Dieses Protokoll verwendet die Absorptionsänderung, wenn das Substrat in das Produkt umgewandelt wird, um die Aktivität eines Enzyms zu messen. Daher müssen das Substrat und das Produkt unterschiedliche spektrale Profile aufweisen. Dies ist der Fall bei Adenosin und Inosin, die beide unterschiedliche spektrale Profile und Extinktionskoeffizienten zwischen 260-265 nmaufweisen 6,8,12,13.
Offenlegungen
JB und MRJ sind Erfinder von Patenten oder Patentanmeldungen im Zusammenhang mit Adenosin-Deaminase- und/oder Kynureninase-Enzymen. Alle anderen Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde von den National Institutes of Health [1DP2CA280622-01] unterstützt und von Biolocity finanziert. Wir danken Dr. Maria Jennings und Andrea Fox für die Bereitstellung der HsADA1- und HsKYNase-Expressionsvektoren.
Materialien
| Name | Company | Catalog Number | Comments |
| Adenosine | Sigma Aldrich | A9251-25G | 25 g |
| BioTek Synergy HT Microplate Reader | |||
| Eppendorf LoBind Microcentrifuge Tubes: Protein | Fisher Scientific | 13-698-795 | 2 mL |
| Glycerol | Fisher Scientific | G33-4 | 4 L |
| HsKYNase66-W102H-T333N | In-house | ||
| Human Serum, Pooled | MP Biomedicals | 92931149 | 100 mL |
| Hydroxy-kynurenine | Cayman Chemicals | 27778 | |
| Inosine | TCI | I0037 | 25 g |
| PBS, 1x pH 7.4+/- 0.1 | Corning | 21-040-CM | |
| Pyridoxal 5-phosphate monohydrate, 99% | Thermo Scientifc | 228170010 | 1 g |
| UV-STAR MICROPLATE, 96 WELL, COC, F-BOTTOM | Greiner Bio | 655801 | |
| Wildtype Human Adenosine Deaminase 1 | In-house |
Referenzen
- Valero, J., et al. A serum-stable RNA aptamer specific for SARS-COV-2 neutralizes viral entry. Proc Natl Acad Sci U S A. 118 (50), e2112942118 (2021).
- Iannuzo, N., et al. High-throughput screening identifies synthetic peptides with antibacterial activity against mycobacterium abscessus and serum stability. ACS Omega. 7 (27), 23967-23977 (2022).
- Ma, M. T., Jennings, M. R., Blazeck, J., Lieberman, R. L. Catalytically active holo homo sapiens adenosine deaminase i adopts a closed conformation. Acta Crystallograph Sect D. 78 (1), 91-103 (2022).
- Li, W., et al. Determination of 4 nucleosides via one reference compound in chinese cordyceps by hplc-uv at equal absorption wavelength. Natural Prod Comm. 18 (3), 1934578X231161410 (2023).
- Whitmore, K. V., Gaspar, H. B. Adenosine deaminase deficiency - more than just an immunodeficiency. Front Immunol. 7, 314 (2016).
- Jennings, M. R., et al. Optimized expression and purification of a human adenosine deaminase in E. coli and characterization of its asp8asn variant. Prot Express Purificat. 213, 106362 (2024).
- Blazeck, J., et al. Bypassing evolutionary dead ends and switching the rate-limiting step of a human immunotherapeutic enzyme. Nat Catalysis. 5 (10), 952-967 (2022).
- Lu, J., Grenache, D. G. Development of a rapid, microplate-based kinetic assay for measuring adenosine deaminase activity in body fluids. Clinica Chimica Acta. 413 (19), 1637-1640 (2012).
- Maciel, L. G., Dos Anjos, J. V., Soares, T. A. Fast and low-cost evaluation of hydroxykynurenine activity. MethodsX. 7, 100982 (2020).
- Bokman, A. H., Schweigert, B. S. 3-hydroxyanthranilic acid metabolism. Iv. Spectrophotometric evidence for the formation of an intermediate. Arch Biochem Biophys. 33 (2), 270-276 (1951).
- Tanford, C. . Advances in protein chemistry. 23, 121-282 (1968).
- Tritsch, G. L. Validity of the continuous spectrophotometric assay of kalckar for adenosine deaminase activity. Anal Biochem. 129 (1), 207-209 (1983).
- Gracia, E., et al. The catalytic site structural gate of adenosine deaminase allosterically modulates ligand binding to adenosine receptors. FASEB J. 27 (3), 1048-1061 (2013).
- Kalckar, H. M. Differential spectrophotometry of purine compounds by means of specific enzymes: Iii. Studies of the enzymes of purine metabolism. J Bio Chem. 167 (2), 461-475 (1947).
- Hartwick, R., Jeffries, A., Krstulovic, A., Brown, P. R. An optimized assay for adenosine deaminase using reverse phase high pressure liquid chromatography. J Chromatographic Sci. 16 (9), 427-435 (1978).
- Paul, M. K., Grover, V., Mukhopadhyay, A. K. Merits of hplc-based method over spectrophotometric method for assessing the kinetics and inhibition of mammalian adenosine deaminase. J Chromatography B. 822 (1), 146-153 (2005).
- Ubbink, J. B., Vermaak, W. J. H., Bissbort, S. H. High-performance liquid chromatographic assay of human lymphocyte kynureninase activity levels. J Chromatography B: Biomed Sci Appl. 566 (2), 369-375 (1991).
- Tsentalovich, Y. P., Snytnikova, O. A., Forbes, M. D. E., Chernyak, E. I., Morozov, S. V. Photochemical and thermal reactivity of kynurenine. Exp Eye Res. 83 (6), 1439-1445 (2006).
- Demain, A. L., Vaishnav, P. Production of recombinant proteins by microbes and higher organisms. Biotechnol Adv. 27 (3), 297-306 (2009).
- Gräslund, S., et al. Protein production and purification. Nat Methods. 5 (2), 135-146 (2008).
- Faber, M. S., Whitehead, T. A. Data-driven engineering of protein therapeutics. Curr Opin Biotechnol. 60, 104-110 (2019).
- Das, S., Zhao, L., Elofson, K., Finn, M. G. Enzyme stabilization by virus-like particles. Biochemistry. 59 (31), 2870-2881 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten