È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurazione della β-ossidazione degli acidi grassi in una sospensione di epatociti di topo appena isolati
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
L'β-ossidazione degli acidi grassi è una via metabolica essenziale responsabile della generazione di energia in molti tipi di cellule diverse, compresi gli epatociti. Qui, descriviamo un metodo per misurare l'β-ossidazione degli acidi grassi in epatociti primari appena isolati utilizzando acido palmitico marcato con 14C.
Abstract
L'β-ossidazione degli acidi grassi è una via metabolica chiave per soddisfare le richieste energetiche del fegato e fornire substrati e cofattori per processi aggiuntivi, come la chetogenesi e la gluconeogenesi, che sono essenziali per mantenere l'omeostasi del glucosio in tutto il corpo e supportare la funzione extra-epatica degli organi nello stato a digiuno. La β-ossidazione degli acidi grassi avviene all'interno dei mitocondri e dei perossisomi ed è regolata attraverso molteplici meccanismi, tra cui l'assorbimento e l'attivazione degli acidi grassi, i livelli di espressione enzimatica e la disponibilità di cofattori come il coenzima A e NAD +. Nei saggi che misurano la β-ossidazione degli acidi grassi negli omogeneizzati epatici, la lisi cellulare e l'aggiunta comune di livelli soprafisiologici di cofattori mascherano gli effetti di questi meccanismi regolatori. Inoltre, l'integrità degli organelli negli omogeneizzati è difficile da controllare e può variare significativamente tra i preparati. La misurazione dell'β-ossidazione degli acidi grassi negli epatociti primari intatti supera le insidie di cui sopra. Questo protocollo descrive un metodo per la misurazione dell'ossidazione β degli acidi grassi in una sospensione di epatociti primari di topo appena isolati incubati con acido palmitico marcato con 14C. Evitando ore o giorni di coltura, questo metodo ha il vantaggio di preservare meglio i livelli di espressione proteica e l'attività della via metabolica del fegato originale, compresa l'attivazione della β-ossidazione degli acidi grassi osservata negli epatociti isolati da topi a digiuno rispetto ai topi nutriti.
Introduzione
L'β-ossidazione degli acidi grassi è un processo essenziale nel metabolismo dei lipidi, fornendo un percorso catabolico per bilanciare la sintesi e l'assunzione di acidi grassi dalla dieta. Questo processo genera energia per più organi, tra cui il muscolo cardiaco, la corteccia renale e il fegato a digiuno, e utilizza acidi grassi ottenuti dalla dieta, lipolisi del tessuto adiposo e depositi interni di trigliceridi 1,2.
L'ossidazione dell'acido grasso attraverso la via β-ossidazione provoca l'accorciamento sequenziale della catena acilica grassa di due carboni alla volta, rilasciati come acetil-CoA, e questo processo si verifica sia nei mitocondri che nei perossisomi. Mentre la maggior parte degli acidi grassi subisce solo β-ossidazione, alcuni vengono ossidati a diversi carboni prima di entrare in questo percorso. Ad esempio, gli acidi grassi 3-metil-sostituiti, come l'acido fitanico, subiscono la rimozione di un carbonio mediante α-ossidazione nei perossisomi prima di entrare nella via di β-ossidazione. Allo stesso modo, alcuni acidi grassi vengono prima convertiti in acidi grassi dicarbossilici mediante ossidazione del gruppo metilico terminale (ω-ossidazione) nel reticolo endoplasmatico prima di essere ossidati preferenzialmente nei perossisomi da β-ossidazione3.
Indipendentemente dall'organello specifico, un acido grasso deve prima essere convertito in un tioestere coenzima A (CoA), o acil-CoA, per essere ossidato attraverso la via di β-ossidazione. β-ossidazione degli acil-CoA a catena lunga nella matrice mitocondriale richiede la navetta carnitina per la loro traslocazione, dove la carnitina palmitoiltransferasi 1 (CPT1) catalizza la conversione degli acil-CoA in acilcarnitine ed è l'enzima limitante la velocità in questo processo4. Una volta traslocati nella matrice mitocondriale, gli acil-CoA vengono riformati e fungono da substrati per il meccanismo di β-ossidazione mitocondriale. Nello stato a digiuno, l'acetil-CoA prodotto attraverso β-ossidazione nei mitocondri epatici è principalmente incanalato alla chetogenesi. I perossisomi fungono da sito primario per la β-ossidazione degli acidi grassi a catena molto lunga, a catena ramificata e dicarbossilici. I perossisomi non richiedono la navetta carnitina per importare substrati di acidi grassi, ma importano i corrispondenti acil-CoA attraverso l'attività dei trasportatori a cassetta legante ATP (ABC) ABCD1-35. All'interno dei perossisomi, gli acil-CoA vengono quindi ossidati da un insieme dedicato di enzimi, distinti dal meccanismo di β-ossidazione degli acidi grassi mitocondriali. Sia i mitocondri che i perossisomi richiedono anche un apporto di NAD+ e CoA libero per ossidare le catene aciliche grasse. I livelli di CoA nel fegato hanno dimostrato di aumentare in risposta al digiuno, sostenendo l'aumento del tasso di ossidazione degli acidi grassi che si verifica in questo stato6. Inoltre, l'aumento della degradazione del CoA nei perossisomi si traduce in una diminuzione selettiva dell'ossidazione degli acidi grassi perossisomali7. Pertanto, il processo di ossidazione degli acidi grassi all'interno della cellula è regolato dai livelli di espressione e dalle attività degli enzimi coinvolti nell'attivazione, nel trasporto e nell'ossidazione degli acidi grassi, nonché dalle concentrazioni di cofattori e altri metaboliti in più compartimenti subcellulari.
Le procedure che utilizzano gli omogeneizzati tissutali per misurare l'ossidazione degli acidi grassi distruggono l'architettura cellulare che regola e supporta questo processo, portando a una raccolta di dati che non riflette accuratamente il metabolismo in vivo. Mentre le tecniche che utilizzano epatociti primari placcati preservano questo sistema, la coltura di cellule isolate per lunghi periodi di tempo comporta una perdita del profilo di espressione genica in vivo che era presente nelle cellule quando vivevano ancora all'interno dell'animale 8,9. Il seguente protocollo descrive un metodo per isolare gli epatociti primari e dosare la loro capacità di β-ossidazione degli acidi grassi immediatamente dopo l'isolamento e in sospensione, utilizzando acido [1-14C]palmitico. Il test si basa sulla misurazione della radioattività associata ai metaboliti acidosolubili (ASM) o a prodotti, come l'acetil-CoA, prodotti dalla β-ossidazione dell'acido [1-14C]palmitico10,11.
Protocollo
Tutte le procedure sperimentali sui topi (C57BL/6J, maschi, 9-11 settimane di età) sono state approvate dall'Institutional Animal Care and Use Committees (IACUC) della West Virginia University.
1. Isolamento degli epatociti
- Preparazione
- Nei giorni precedenti l'isolamento degli epatociti, preparare i tamponi e i terreni di coltura cellulare elencati nella Tabella 1. Impostare un bagno d'acqua con la temperatura impostata a 37 °C vicino a dove verrà eseguito l'intervento chirurgico.
- Il giorno dell'isolamento degli epatociti, sotto una cappa a flusso laminare, trasferire 35 mL di Tampone 1 in un tubo centrifugo sterile da 50 mL e 70 mL di Tampone 2 in un becher sterile da 100 mL o flacone.
- Aggiungere antibiotici gentamicina (50 μg/mL) e penicillina/streptomicina (1x) a entrambi i tamponi.
- Trasferire 20 mL di Tampone 2 come preparato al punto 1.1.3 in una capsula di coltura cellulare da 100 mm e metterla su ghiaccio.
- Trasferire i restanti 50 mL di Tampone 2 in un tubo sterile da 50 mL per centrifuga. Posizionare i tubi da 50 ml contenenti i tamponi 1 e 2 integrati con antibiotici in un bagno d'acqua impostato a 37 °C e lasciarli scaldare per almeno 15 minuti prima di iniziare la perfusione.
NOTA: Se si eseguono isolamenti di più epatociti in una sessione, aumentare il numero di aliquote integrate con antibiotici dei tamponi 1 e 2 per prepararsi di conseguenza. - Scongelare un'aliquota della soluzione di collagenasi e mantenere sul ghiaccio.
NOTA: Se correttamente conservato, non vi è alcuna perdita significativa di attività enzimatica nelle soluzioni di collagenasi congelate e scongelate fino a 3 volte e utilizzate entro 3 settimane dalla preparazione. - Preparare gli strumenti chirurgici e la pompa peristaltica. Sterilizzare le linee della pompa peristaltica facendo circolare 15 ml di etanolo al 70%, seguiti da 15 ml di acqua sterile.
- Collegare un ago da 22 G alla linea di uscita (Figura 1A). Il filtro cavo di un catetere funziona bene come connettore. Riempire le linee con buffer 1 e ispezionare le linee, il connettore e l'ago per assicurarsi che non vi siano bolle d'aria intrappolate.
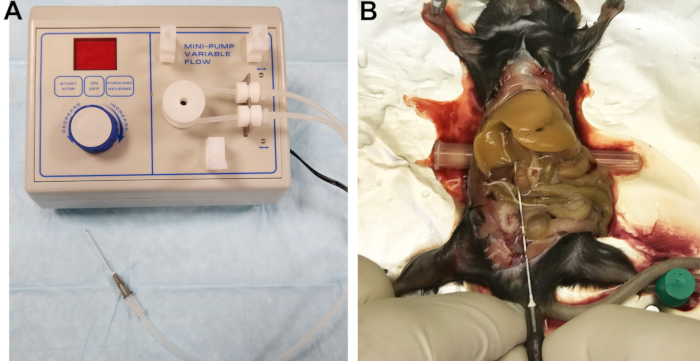
Figura 1: Apparato di perfusione e fegato perfuso. (A) Pompa peristaltica con linea di uscita collegata all'ago utilizzato per cannulare e perfondere il fegato. (B) Il successo della cannulazione è indicato da uno sbiancamento immediato e omogeneo del fegato. Fare clic qui per visualizzare una versione più grande di questa figura.
- Perfusione e dissociazione epatica
- Anestetizzare un topo tramite inalazione di isoflurano con aria di grado medico come gas vettore, utilizzando il 4% di isoflurano per l'induzione e l'1,5% di isoflurano per mantenere l'anestesia. Verificare la profondità dell'anestesia valutando la perdita del riflesso del pedale.
- Quando non c'è risposta al pizzicamento delle dita, posizionare il mouse in posizione supina su una tavola chirurgica, allungare gli arti e fissarli alla tavola con perni.
- Spruzzare liberamente l'addome e il torace del topo con il 70% di etanolo.
- Usando la pinza, tirare su la pelle e la parete addominale vicino alla base dell'addome e tagliare lateralmente, su entrambi i lati della linea mediana e fino al diaframma, per esporre gli organi.
- Esporre la vena cava inferiore (IVC) spostando l'intestino sul lato destro e capovolgendo delicatamente i lobi del fegato verso l'alto. Inserire un piccolo oggetto cilindrico, come un cappuccio ad ago, sotto la parte posteriore del mouse per inclinare leggermente l'IVC e facilitarne la cannulazione (Figura 1B).
- Avviare la pompa alla velocità più bassa e, con il Buffer 1 che scorre, inserire l'ago nell'IVC.
- Tagliare la vena porta per alleviare la pressione e consentire il drenaggio del sangue e dei tamponi di perfusione, quindi aumentare immediatamente la portata a 7 ml / min. Se fatto correttamente, il fegato si sbollenterà uniformemente entro pochi secondi (Figura 1B).
- Per risultati più coerenti, tenere l'ago in posizione a mano per l'intera durata della perfusione.
- Perfondere il fegato con tampone caldo 1. Per evitare l'introduzione di bolle d'aria, assicurarsi che la linea inserita nel tubo contenente Buffer 1 rimanga continuamente sommersa.
- Mentre si verifica la perfusione, aggiungere 130 μL di soluzione di collagenasi al tampone 2 e mescolare pipettando su e giù o mescolando con una pipetta sierologica da 5 ml o 10 ml.
- Poiché il volume nel tubo contenente buffer 1 diminuisce a circa 5 ml, aggiungere lentamente 5 mL di buffer 2 al buffer 1 mediante pipettaggio sul lato del tubo. L'obiettivo è evitare di introdurre bolle d'aria nella linea durante il passaggio dal Buffer 1 al Buffer 2.
- Attendere che il volume diminuisca nuovamente a 5 mL e aggiungere lentamente altri 5 mL di Buffer 2. Ripeti ancora una volta. Quando il Buffer 2 sostituisce il Buffer 1 e inizia la dissociazione, il fegato si gonfia.
- Aggiungere il Buffer 2 rimanente al tubo originariamente contenente buffer 1. Interrompere la perfusione quando nel tubo rimangono circa 5-10 ml di Tampone 2.
NOTA: Mentre il tampone 2 sta perfondendo il fegato, la vena porta può essere bloccata in modo intermittente con una pinza per 5 s. Questo passaggio è facoltativo, ma il conseguente aumento della pressione in tutto il fegato può migliorare la sua dissociazione e, quindi, la resa finale degli epatociti. - Asportare con cura il fegato e trasferirlo nella piastra di coltura da 100 mm contenente i 20 ml di Buffer 2 ghiacciato messi da parte al punto 1.1.4.
- Sotto il cappuccio a flusso laminare, rompere delicatamente il fegato usando forbici chirurgiche e pinzette.
- Aggiungere circa 20 ml di M199 ghiacciato alla sospensione epatocitaria e filtrarla attraverso un filtro cellulare da 100 μm utilizzando lo stantuffo di una siringa per promuovere delicatamente il rilascio di epatociti aggiuntivi da pezzi di fegato più grandi.
- Lavare la piastra di coltura da 100 mm e il filtro cellulare con M199 aggiuntivo fino a quando il tubo di raccolta non è pieno.
- Centrifugare la sospensione a 50 x g per 2 min a 4 °C. Aspirare accuratamente il surnatante e risospese delicatamente il pellet di epatociti in 30 ml di M199 freddo facendo roteare.
- Pellet gli epatociti come indicato al punto 1.2.18. Ripetere il lavaggio ancora una volta.
- Risospese gli epatociti in 10 ml di M199 caldo e determinare la vitalità e la resa utilizzando il metodo di esclusione blu tripano e un emocitometro12.
- Diluire le cellule in M199 riscaldate a 37 ºC ad una concentrazione finale di 1,0 x 106 cellule vitali/mL e iniziare immediatamente il test.
2. Saggio di β-ossidazione degli acidi grassi
NOTA: Il test è condotto in triplice copia e ogni miscela di reazione contiene 750.000 cellule, 1,35 mg/mL di albumina sierica bovina (BSA), 100 μM di acido palmitico e 0,4 μCi [1-14C]di acido palmitico in un volume finale di 2 ml.
ATTENZIONE: i composti radioattivi sono pericolosi. Acquistare, gestire, conservare e smaltire materiale radioattivo in conformità con le normative istituzionali, statali e federali.
- Preparazione
- Nei giorni precedenti il test, preparare le soluzioni di acido palmitico e BSA (Tabella 1) e conservarle a -20 °C.
- Il giorno del test, completare i passaggi 2.1.3-2.1.9 prima di iniziare la perfusione epatica.
- Scongelare le soluzioni di acido palmitico e BSA. Preparare la miscela di substrato per reazioni multiple più un eccesso del 20%-30%, con una tipica configurazione del test mostrata nella Tabella 2.
- Aliquota 13,5 μL di soluzione di BSA per reazione in un tubo microcentrifuga e caldo a 41 °C, quindi aggiungere 1 μL della soluzione di acido palmitico da 200 mM (BSA: rapporto molare dell'acido palmitico = 1:5) per reazione.
NOTA: E' preferibile erogare soluzioni preparate utilizzando solventi organici, quali le soluzioni di acido palmitico radioattivo e non radioattivo, con pipetta a spostamento positivo e apposite punte. - Vortice vigoroso e incubazione a 41 °C per facilitare la formazione dell'acido palmitico solubile: complesso BSA. Vortice occasionalmente durante il periodo di incubazione.
- La miscela apparirà inizialmente torbida ma si chiarirà completamente dopo 20-30 minuti di incubazione a 41 °C. Tenerlo a 41 °C fino al momento di iniziare le reazioni.
- Aliquota 133 μL di acido perclorico 1 M in tubi microcentrifuga da 1,5 mL per fermare le reazioni.
ATTENZIONE: L'acido perclorico è un acido forte e un forte ossidante. Per la manipolazione di questa mescola sono necessari dispositivi di protezione adeguati. - Aliquota 485,5 μL di M199 per reazione in un tubo e mantenerlo a 37 °C per diluire il BSA radioattivo: complesso di acido palmitico preparato ai passaggi 2.1.4-2.1.6 prima di iniziare le reazioni.
- Erogare 750 μL di M199 in tanti tubi a fondo tondo da 14 mL quanti sono i campioni. Se lo si desidera, aggiungere inibitori dell'β-ossidazione degli acidi grassi, come etomoxir, rotenone e antimicina, incluso un controllo del veicolo (Tabella 2).
- Durante le fasi di lavaggio degli epatociti, 10-15 minuti prima di iniziare le reazioni, trasferire le provette preparate al punto 2.1.9 in un bagno d'acqua tremante impostato a 37 °C e agitando a 180-200 giri / min.
- Avvio, arresto e analisi delle reazioni di β-ossidazione degli acidi grassi
- Se la vitalità degli epatociti è accettabile (tipicamente ≥ 75%, Figura 2), per ogni reazione, trasferire 0,8 μL di acido [1-14 C]palmitico (0,5 mCi/mL) al tubo microcentrifuga contenente la soluzione di acido palmitico BSA: chiarificata (fasi 2.1.4-2.1.6). Vortice e ritorno al bagno d'acqua a 41 °C.
- Per equilibrare gli epatociti a 37 °C e pre-incubarli con inibitori (se presenti), subito dopo la risospensione finale degli epatociti (fase 1.2.21), trasferire 750 μL della sospensione epatocitaria con una pipetta da 1 mL a ciascuna delle provette a fondo tondo da 14 mL nel bagno d'acqua tremante (fasi 2.1.9-2.1.10) e ruotare brevemente a bassa velocità per miscelare.
- Scaglionare ogni aggiunta di 30 s e incubare per 15 min. Per salvare un campione per la determinazione delle proteine, trasferire un'altra aliquota di epatociti in un tubo microcentrifuga da 1,5 ml e ruotare a 3.000 x g per 5 minuti.
NOTA: durante l'erogazione, la sospensione degli epatociti deve essere continuamente ruotata o mescolata delicatamente con la pipetta da 1 mL di erogazione per evitare l'assestamento e la grande variabilità del numero di cellule tra i campioni. - Rimuovere il surnatante e conservare il pellet a -80 °C fino a quando non è pronto a misurare la quantità totale di proteine nel campione per normalizzare i risultati (Figura 3).
- Mentre gli epatociti sono in pre-incubazione a 37 °C, aggiungere il complesso radioattivo BSA: acido palmitico al mezzo caldo in 2.1.8 e mantenere a 37 °C fino a quando non è pronto per iniziare le reazioni. Questo è il mix di substrato finale.
- Per iniziare le reazioni, rimuovere gli epatociti dal bagno d'acqua e aggiungere 500 μL di miscela di substrato.
- Vortice a bassa velocità per 5 s per risospese completamente le cellule e tornare al bagno d'acqua. Ripeti con tutti i campioni, barcollando di 30 s.
- Incubare per 15 min. Avviare una serie di reazioni e arrestare immediatamente (vedere i passaggi 2.2.10-2.2.11) per determinare la radioattività di fondo (Tabella 2).
- Trasferire aliquote duplicate (200-250 μL) della miscela di substrato rimanente in flaconcini di scintillazione da 6 mL e mettere da parte per contare. Utilizzare questi conteggi per calcolare la radioattività corrispondente agli nmoli totali di acido palmitico disponibili per l'ossidazione in 500 μL di miscela di substrato.
- Per fermare le reazioni, rimuovere gli epatociti dal bagno d'acqua, risospese gli epatociti vorticosamente a velocità moderata, quindi trasferire 400 μL della sospensione epatocitaria alle tube microcentrifuga contenenti acido perclorico.
- Tappare immediatamente i tubi. Ripetete questa sequenza per tutti i campioni, barcollando di 30 s.
- Ruotare vigorosamente i tubi microcentrifuga da 1,5 mL e farli ruotare lungo i tubi microcentrifuga da 1,5 mL a 13.000 x g per 10 minuti.
- Trasferire 300 μL del surnatante in un flaconcino di scintillazione da 6 mL, aggiungere 4 mL di liquido di scintillazione e contare la radioattività nei campioni e le aliquote della miscela di substrato (fase 2.2.9) in un contatore di scintillazione.
ATTENZIONE: Dopo la centrifugazione, aprire i tubi sotto una cappa aspirante per evitare di respirare i 14C-CO2 prodotti dalla completa ossidazione di 14C-acetil-CoA generati dall'acido grasso β-ossidazione e rilasciati dalle condizioni acide.
| Buffer/Componenti multimediali | Importo | Concentrazione finale | Disposizioni |
| Soluzione C | |||
| Kcl | 1,79 g | 480 metri quadrati | Aggiungere acqua a 50 ml. Conservare a 4 °C |
| MgSO4 eptaidrato | 1,48 g | 120 mM | |
| KH2PO4 | 0,81 g | 119 metri quadrati | |
| Tampone Krebs-Henseleit (KHB), privo di calcio | |||
| NaCl | 7,0 g | 120 mM | Aggiungere acqua a 900 mL, regolare il pH a 7,4 e portare il volume finale a 1 L. Conservare a 4 °C |
| NaHCO3 · | 2,0 g | 24 metri quadrati | |
| 1 M HEPES pH 7,45 | 5 ml | 5 mM | |
| Glucosio | 1 o 2 g | 5,6 o 11 mM | |
| Soluzione C | 10 ml | ||
| Buffer 1 | |||
| KHB · | 500 ml | Mescolare i componenti e sterilizzare il filtro. Conservare a 4 °C | |
| 50 mM EGTA | 1,0 ml | 0,1 mM | |
| Buffer 2 | |||
| KHB · | 500 ml | Mescolare i componenti e sterilizzare il filtro. Conservare a 4 °C | |
| 1 M CaCl2 diidrato | 686 μL | 1,4 mM | |
| Soluzione di gentamicina | |||
| Gentamicina solfato | 0,5 g | 50 mg/ml | Aggiungere acqua a 10 ml e filtrare sterilizzare. Aliquota e conservazione a -20 °C |
| Soluzione di collagenasi | |||
| Collagenasi I e II miscela | 10 mg | 7 mg/ml | Sciogliere l'intero contenuto del flaconcino in 1,43 ml di acqua. Aliquota e conservazione a -20 °C |
| M199 · | |||
| M199 · | 1 sacchetto | Aggiungere acqua a 900 ml e regolare il pH a 7,2-7,4. Portare il volume finale a 1 L e filtrare sterilizzare. Conservare a 4 °C | |
| NaHCO3 · | 2,2 g | 26 metri quadrati | |
| 1 M HEPES (grado di coltura cellulare) | 25 ml | 25 metri quadrati | |
| Glucosio extra (solo per topi nutriti) | 1 g | 11 mM | |
| Soluzione BSA | |||
| BSA senza acidi grassi | 400 mg | 20% (p/v) | Sciogliere in 2 ml di acqua. Aliquota e conservazione a -20 °C |
| Soluzione di acido palmitico non radioattivo | |||
| Acido palmitico | 103 mg | 200 metri quadrati | Sciogliere in 2 ml di etanolo, conservare a -20 °C |
| 1 M Acido perclorico | |||
| 70% Acido perclorico | 3,5 ml | 1 M | Diluire a 40 ml con acqua. Conservare a temperatura ambiente |
Tabella 1: Tamponi, fluidi e altre soluzioni necessarie per l'isolamento degli epatociti e il saggio di β-ossidazione degli acidi grassi
| Numero di reazione | Inibitori ± M199 | Sospensione epatocitaria (μL) | Miscela di substrato (μL) | ||||
| Volume (μL) | Etomoxir | ||||||
| 1 | 750 | - | Preriscaldamento a 37 °C | 750 | Pre-incubazione a 37 °C per 15 min | 500 | Incubazione a 37 °C per 15 min |
| 2 | |||||||
| 3 | |||||||
| 4 | + | ||||||
| 5 | |||||||
| 6 | |||||||
| 7 | + | Fermati immediatamente | |||||
| 8 | |||||||
| 9 | |||||||
Tabella 2: Esempio di setup sperimentale per una sospensione epatocitaria dosata in triplice copia in presenza e assenza di etomoxir.
Risultati
La perfusione epatica qui descritta produce tipicamente 30-40 milioni di cellule / fegato con vitalità media dell'80%, come stimato dall'esclusione del tripano blu (Figura 2). La concentrazione tipica di glucosio nel tampone di Krebs-Henseleit (KHB), che viene utilizzato per preparare i tamponi di perfusione 1 e 2, è di 11 mM. Quando si misura l'β-ossidazione degli acidi grassi negli epatociti isolati da topi a digiuno, la concentrazione di glucosio nel KHB può essere abbassata per rappr...
Discussione
Durante la perfusione epatica, è fondamentale evitare l'introduzione di bolle d'aria, in quanto bloccano i microcapillari nel fegato, impedendo o limitando la circolazione tampone e diminuendo complessivamente la resa e la vitalità degli epatociti20,21. Precauzioni, come l'ispezione ravvicinata della linea di ingresso riempita di tampone prima della cannulazione dell'IVC ed evitare di sollevare la linea di ingresso dal tubo contenente buffer 1 per passare al bu...
Divulgazioni
Gli autori non hanno conflitti di interesse da divulgare.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institutes of Health grant R35GM119528 a Roberta Leonardi.
Materiali
| Name | Company | Catalog Number | Comments |
| (R)-(+)-Etomoxir sodium salt | Tocris Bioscience | 4539/10 | |
| [1-14C]-Palmitic acid, 50–60 mCi/mmol, 0.5 mCi/mL | American Radiolabeled Chemicals | ARC 0172A | |
| 1 M HEPES, sterile | Corning | 25060CI | |
| 10 µL disposable capillaries/pistons for positive displacement pipette | Mettler Toledo | 17008604 | |
| 1000 µL, 200 µL, and 10 µL pipettes and tips | |||
| 5 mL, 10 mL, and 25 mL serological pipettes | |||
| 50 mL sterile centrifuge tubes | CellTreat | 229421 | |
| 70% Perchloric acid | Fisher Scientific | A2296-1LB | |
| BSA, fatty acid-free | Fisher Scientific | BP9704100 | |
| CaCl2 dihydrate | MilliporeSigma | 223506 | |
| D-(+)-Glucose | MilliporeSigma | G7021 | |
| EGTA | Gold Biotechnology | E-217 | |
| Ethanol | Pharmco | 111000200CSPP | |
| Filter System, 0.22 μm PES Filter, 500 mL, Sterile | CellTreat | 229707 | |
| Gentamicin sulphate | Gold Biotechnology | G-400-25 | |
| HDPE, 6.5 mL scintillation vials | Fisher Scientific | 03-342-3 | |
| Hemocytometer | |||
| Hypodermic needles 22 G, 1.5 in | BD Biosciences | 305156 | |
| Isoflurane | VetOne | 502017 | |
| KCl | Fisher Scientific | BP366-1 | |
| KH2PO4 | MilliporeSigma | P5655 | |
| Liberase TM Research Grade | MilliporeSigma | 5401119001 | Defined blend of purified collagenase I and II with a medium concentration of thermolysin |
| M199 medium | MilliporeSigma | M5017 | |
| MgSO4 heptahydrate | MilliporeSigma | M1880 | |
| Microcentrifuge | Fisher Scientific | accuSpin Micro 17 | |
| Microdissecting Scissors | Roboz Surgical Instrument Co | RS-5980 | |
| NaCl | Chem-Impex International | 30070 | |
| NaHCO3 | Acros Organics | 424270010 | |
| Palmitic acid | MilliporeSigma | P0500 | |
| Penicillin/streptomycin (100x) | Gibco | 15140122 | |
| Phosphate buffered saline (PBS) | Cytiva Life Sciences | SH30256.01 | |
| Positive displacement pipette MR-10, 10 µL | Mettler Toledo | 17008575 | |
| Refrigerated centrifuge with inserts for 50 mL conical tubes | Eppendorf | 5810 R | |
| Round-bottom, 14 mL, polypropylene culture test tubes | Fisher Scientific | 14-956-9A | |
| Scintillation counter | Perkin Elmer | TriCarb 4810 TR | |
| ScintiVerse BD cocktail | Fisher Scientific | SX18-4 | |
| Shaking water bath, 30 L capacity | New Brunswick Scientific | Model G76 | |
| Sterile cell strainers, 100 µm | Fisher Scientific | 22363549 | |
| Thumb Dressing Forceps | Roboz Surgical Instrument Co | RS-8120 | |
| Trypan Blue | Corning | 25900CI | |
| Variable-flow peristaltic pump | Fisher Scientific | 138762 | |
| Water baths, 2–2.5 L capacity |
Riferimenti
- Alves-Bezerra, M., Cohen, D. E. Triglyceride Metabolism in the Liver. Comprehensive Physiology. 8 (1), 1-8 (2017).
- Lopaschuk, G. D., Ussher, J. R., Folmes, C. D., Jaswal, J. S., Stanley, W. C. Myocardial fatty acid metabolism in health and disease. Physiological Reviews. 90 (1), 207-258 (2010).
- Mannaerts, G. P., van Veldhoven, P. P. Functions and organization of peroxisomal beta-oxidation. Annals of the New York Academy of Sciences. 804, 99-115 (1996).
- Kerner, J., Hoppel, C. Fatty acid import into mitochondria. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1486 (1), 1-17 (2000).
- Baker, A., et al. Peroxisomal ABC transporters: functions and mechanism. Biochemical Society Transactions. 43 (5), 959-965 (2015).
- Leonardi, R., Rehg, J. E., Rock, C. O., Jackowski, S. Pantothenate kinase 1 is required to support the metabolic transition from the fed to the fasted state. PloS One. 5 (6), 11107 (2010).
- Shumar, S. A., Kerr, E. W., Fagone, P., Infante, A. M., Leonardi, R. Overexpression of Nudt7 decreases bile acid levels and peroxisomal fatty acid oxidation in the liver. Journal of Lipid Research. 60 (5), 1005-1019 (2019).
- Richert, L., et al. Gene expression in human hepatocytes in suspension after isolation is similar to the liver of origin, is not affected by hepatocyte cold storage and cryopreservation, but is strongly changed after hepatocyte plating. Drug Metabolism and Disposition: The Biological Fate of Chemicals. 34 (5), 870-879 (2006).
- Colbert, R. A., Amatruda, J. M., Young, D. A. Changes in the expression of hepatocyte protein gene-products associated with adaptation of cells to primary culture. Clinical Chemistry. 30 (12), 2053-2058 (1984).
- Spurway, T. D., Sherratt, H. A., Pogson, C. I., Agius, L. The flux control coefficient of carnitine palmitoyltransferase I on palmitate beta-oxidation in rat hepatocyte cultures. Biochemical Journal. 323, 119-122 (1997).
- Consitt, L. A., et al. Peroxisome proliferator-activated receptor-gamma coactivator-1alpha overexpression increases lipid oxidation in myocytes from extremely obese individuals. Diabetes. 59 (6), 1407-1415 (2010).
- Lee, S. M., Schelcher, C., Demmel, M., Hauner, M., Thasler, W. E. Isolation of human hepatocytes by a two-step collagenase perfusion procedure. Journal of Visualized Experiments: JoVE. (79), e50615 (2013).
- Lilly, K., Chung, C., Kerner, J., VanRenterghem, R., Bieber, L. L. Effect of etomoxiryl-CoA on different carnitine acyltransferases. Biochemical Pharmacology. 43 (2), 353-361 (1992).
- Yu, X. X., Drackley, J. K., Odle, J. Rates of mitochondrial and peroxisomal beta-oxidation of palmitate change during postnatal development and food deprivation in liver, kidney and heart of pigs. Journal of Nutrition. 127 (9), 1814-1821 (1997).
- Yu, X. X., Drackley, J. K., Odle, J., Lin, X. Response of hepatic mitochondrial and peroxisomal beta-oxidation to increasing palmitate concentrations in piglets. Biology of the Neonate. 72 (5), 284-292 (1997).
- Veerkamp, J. H., van Moerkerk, H. T. Peroxisomal fatty acid oxidation in rat and human tissues. Effect of nutritional state, clofibrate treatment and postnatal development in the rat. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 875 (2), 301-310 (1986).
- Hakvoort, T. B., et al. Interorgan coordination of the murine adaptive response to fasting. Journal of Biological Chemistry. 286 (18), 16332-16343 (2011).
- Sokolovic, M., et al. The transcriptomic signature of fasting murine liver. BMC Genomics. 9, 528 (2008).
- Kersten, S., et al. Peroxisome proliferator-activated receptor alpha mediates the adaptive response to fasting. Journal of Clinical Investigation. 103 (11), 1489-1498 (1999).
- Li, W. C., Ralphs, K. L., Tosh, D. Isolation and culture of adult mouse hepatocytes. Methods in Molecular Biology. 633, 185-196 (2010).
- Ng, I. C., et al. Isolation of Primary Rat Hepatocytes with Multiparameter Perfusion Control. Journal of Visualized Experiments: JoVE. (170), e62289 (2021).
- Shen, L., Hillebrand, A., Wang, D. Q., Liu, M. Isolation and primary culture of rat hepatic cells. Journal of Visualized Experiments: JoVE. (64), e3917 (2012).
- Fulgencio, J. P., Kohl, C., Girard, J., Pegorier, J. P. Effect of metformin on fatty acid and glucose metabolism in freshly isolated hepatocytes and on specific gene expression in cultured hepatocytes. Biochemical Pharmacology. 62 (4), 439-446 (2001).
- Leonardi, R., Rock, C. O., Jackowski, S. Pank1 deletion in leptin-deficient mice reduces hyperglycaemia and hyperinsulinaemia and modifies global metabolism without affecting insulin resistance. Diabetologia. 57 (7), 1466-1475 (2014).
- Bougarne, N., et al. PPARalpha blocks glucocorticoid receptor alpha-mediated transactivation but cooperates with the activated glucocorticoid receptor alpha for transrepression on NF-kappaB. Proceedings of the National Academy of Sciences of the United States of America. 106 (18), 7397-7402 (2009).
- Korelova, K., Jirouskova, M., Sarnova, L., Gregor, M. Isolation and 3D collagen sandwich culture of primary mouse hepatocytes to study the role of cytoskeleton in bile canalicular formation in vitro. Journal of Visualized Experiments: JoVE. (154), e60507 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon