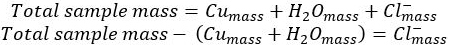Determinazione della formula empirica (minima)
Panoramica
Fonte: Laboratorio del Dr. Neal Abrams - SUNY College of Environmental Science and Forestry
Determinare la formula chimica di un composto è al centro di ciò che i chimici fanno in laboratorio ogni giorno. Sono disponibili molti strumenti per aiutare in questa determinazione, ma uno dei più semplici (e più accurati) è la determinazione della formula empirica. Perché è utile? A causa della legge di conservazione della massa, qualsiasi reazione può essere seguita gravimetricamente o da un cambiamento di massa. La formula empirica fornisce il più piccolo rapporto di numero intero tra elementi (o composti) all'interno di un composto molecolare. In questo esperimento, l'analisi gravimetrica sarà utilizzata per determinare la formula empirica dell'idrato di cloruro di rame, CuxCly·nH2O.
Procedura
1. Disidratare l'idrato
- Pesare accuratamente un campione di cloruro di rame idrato e metterlo in un crogiolo pre-essiccato e catramato. È importante che il crogiolo venga essiccato al di sopra di 120 °C per allontanare l'umidità adsorbita. In genere, 1-2 g di composto saranno sufficienti.
- Riscaldare il campione utilizzando un bruciatore Bunsen o un'altra fonte di fiamma fino a quando non cambia colore da blu-verdastro a bruno-rossastro (Figura 1). Questo cambiamento di colore è indica
Risultati
- Rsperimento
- Riscaldare 1,25 g di cloruro di rame idrato in un crogiolo. Dopo il riscaldamento e quindi il raffreddamento, la massa finale è di 0,986 g di cloruro di rame, CuxCly.
- Sciogliere il campione CuxCly in 50 ml di acqua deionizzata e aggiungere 0,2 g di rete fine di alluminio al becher.
- Dopo aver reagito e sciolto l'alluminio in eccesso, vengono recuperati 0,198 g di metallo di rame essiccato.
- Sottrarre la massa di rame e acqua dall'idrato di cl.
Applicazione e Riepilogo
In un esempio, supponiamo che una biomolecola sconosciuta contenente solo C, H e O agisca bene come un nuovo combustibile. Un modo per determinare la formula del carburante sarebbe quello di bruciarlo in aria e analizzare i prodotti:
CxHyOz + O2 → mCO2 + nH2O
Mentre O2 è in eccesso, sapremmo che tutto il carbonio in CO2 ha origine dalla biomolecola e tutto l'idrogeno sarebbe p...
Vai a...
Video da questa raccolta:

Now Playing
Determinazione della formula empirica (minima)
General Chemistry
182.0K Visualizzazioni

Vetreria di laboratorio e relativi usi
General Chemistry
656.4K Visualizzazioni

Soluzioni e concentrazioni
General Chemistry
274.3K Visualizzazioni

Determinazione della densità di un solido e di un liquido
General Chemistry
556.2K Visualizzazioni

Determinazione della composizione percentuale di massa in una soluzione acquosa
General Chemistry
383.6K Visualizzazioni

Determinazione delle regole di solubilità di composti ionici
General Chemistry
141.4K Visualizzazioni

Uso del pH-metro
General Chemistry
346.1K Visualizzazioni

Introduzione alla titolazione
General Chemistry
424.7K Visualizzazioni

Legge dei gas perfetti
General Chemistry
78.5K Visualizzazioni

Determinazione spettrofotometrica di una costante di equilibrio
General Chemistry
158.5K Visualizzazioni

Principio di Le Châtelier
General Chemistry
265.4K Visualizzazioni

Depressione del punto di congelamento per l'identificazione di un composto sconosciuto
General Chemistry
160.7K Visualizzazioni

Determinazione dell'equazione cinetica e dell'ordine di reazione
General Chemistry
196.1K Visualizzazioni

Utilizzo della calorimetria a scansione differenziale per misurare cambiamenti nell'entalpia
General Chemistry
44.5K Visualizzazioni

Complessi chimici di coordinazione
General Chemistry
91.5K Visualizzazioni