È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Assemblaggio di modelli di doppio strato lipidico supportati e sospesi per lo studio delle interazioni molecolari
In questo articolo
Riepilogo
Questo protocollo descrive la formazione di vescicole unilipidiche e multilipidiche, doppi strati lipidici supportati e doppi strati lipidici sospesi. Questi modelli in vitro possono essere adattati per incorporare una varietà di tipi di lipidi e possono essere utilizzati per studiare varie interazioni molecolari e macromolecole.
Abstract
Le membrane cellulari modello sono un utile strumento di screening con applicazioni che vanno dalla scoperta precoce di farmaci agli studi di tossicità. La membrana cellulare è una barriera protettiva cruciale per tutti i tipi di cellule, separando i componenti cellulari interni dall'ambiente extracellulare. Queste membrane sono composte in gran parte da un doppio strato lipidico, che contiene gruppi di testa idrofili esterni e gruppi di coda idrofobici interni, insieme a varie proteine e colesterolo. La composizione e la struttura dei lipidi stessi svolgono un ruolo cruciale nella regolazione della funzione biologica, comprese le interazioni tra le cellule e il microambiente cellulare, che può contenere farmaci, tossine biologiche e sostanze tossiche ambientali. In questo studio, vengono descritti metodi per formulare cellule uni-lipidiche e multi-lipidiche supportate e sospese che imitano i doppi strati lipidici. In precedenza, sono stati sviluppati doppi strati lipidici uni-lipidici di fosfatidilcolina (PC) e doppi strati lipidici ispirati al trofoblasto placentare multilipidico per l'uso nella comprensione delle interazioni molecolari. Qui verranno presentati i metodi per ottenere entrambi i tipi di modelli a doppio strato. Per le cellule che imitano i doppi strati multilipidici, la composizione lipidica desiderata viene prima determinata tramite estrazione lipidica da cellule primarie o linee cellulari seguita da cromatografia liquida-spettrometria di massa (LC-MS). Utilizzando questa composizione, le vescicole lipidiche vengono fabbricate utilizzando un metodo di idratazione ed estrusione a film sottile e il loro diametro idrodinamico e il potenziale zeta sono caratterizzati. I doppi strati lipidici supportati e sospesi possono quindi essere formati utilizzando la microbilancia di cristallo di quarzo con monitoraggio della dissipazione (QCM-D) e su una membrana porosa per l'uso in un saggio di permeabilità della membrana artificiale parallela (PAMPA), rispettivamente. I risultati rappresentativi evidenziano la riproducibilità e la versatilità dei modelli lipidici a doppio strato di membrana cellulare in vitro. I metodi presentati possono aiutare nella valutazione rapida e facile dei meccanismi di interazione, come la permeazione, l'adsorbimento e l'incorporamento, di varie molecole e macromolecole con una membrana cellulare, aiutando nello screening dei farmaci candidati e nella previsione della potenziale tossicità cellulare.
Introduzione
La membrana cellulare, composta principalmente da fosfolipidi, colesterolo e proteine, è un componente cruciale di tutte le cellule viventi1. Con l'organizzazione guidata dall'anfifilicità lipidica, la membrana cellulare funziona come una barriera protettiva e regola il modo in cui la cellula interagisce con l'ambiente circostante2. Diversi processi cellulari dipendono dalla composizione lipidica e proteica della membrana1,2. Ad esempio, le interazioni della membrana cellulare sono importanti per un'efficace somministrazione di farmaci3. Prodotti farmaceutici, biologici, nanomateriali, tossine biologiche e sostanze tossiche ambientali possono influire sull'integrità di una membrana cellulare, influenzando così la funzione cellulare4. La costruzione di modelli di membrana che imitano le cellule in vitro basati sulla composizione lipidica delle membrane cellulari ha il potenziale per fornire strumenti facili per migliorare notevolmente lo studio del potenziale impatto di questi materiali sulle cellule.
I doppi strati lipidici modello includono vescicole lipidiche, doppi strati lipidici supportati e doppi strati lipidici sospesi. I doppi strati lipidici supportati sono un modello della membrana cellulare fosfolipidica comunemente usata nelle applicazioni biotecnologiche in cui le vescicole lipidiche vengono rotte su un materiale di substrato supportato5,6,7,8,9. Una tecnica comune utilizzata per monitorare la formazione di doppio strato è la microbilancia a cristallo di quarzo con monitoraggio della dissipazione (QCM-D), che esamina l'adsorbimento delle vescicole rispetto alle proprietà liquide sfuse in situ8,10,11, 12,13,14 . In precedenza, QCM-D è stato utilizzato per dimostrare che in condizioni di flusso, una volta che una copertura critica delle vescicole delle vescicole lipidiche di fosfatidilcolina (PC) è raggiunta sulla superficie, si rompono spontaneamente in rigidi doppi strati lipidici15. Lavori precedenti hanno anche studiato la formazione di doppi strati lipidici supportati con composizioni lipidiche variabili16,l'incorporazione di proteine lipidiche17, 18,19e l'utilizzo di cuscini polimerici20,producendo doppi strati lipidici supportati in grado di imitare vari aspetti della funzione della membrana cellulare.
I doppi strati lipidici sono stati utilizzati per imitare varie barriere biologiche dai livelli subcellulari a quelli degli organi, tra cui mitocondrio, globuli rossi e membrane delle cellule epatiche alterando i componenti fosfolipidi, colesterolo e glicolipidi21. Queste vescicole multilipidiche più complesse possono richiedere metodi aggiuntivi per ottenere la rottura delle vescicole, a seconda della composizione lipidica. Ad esempio, studi precedenti hanno utilizzato un peptide α-elicoidale (AH) derivato dalla proteina non strutturale 5A del virus dell'epatite C per indurre la formazione di doppio strato destabilizzando le vescicole lipidiche adsorbite22,23. Utilizzando questo peptide AH, i doppi strati lipidici supportati che imitano le cellule placentari sono stati precedentemente formati24. Il grande potenziale dei doppi strati lipidici supportati per applicazioni biomediche è stato dimostrato con indagini che abbracciano il trasporto molecolare e delle nanoparticelle25,26,le interazioni tossicorie ambientali27,l'assemblaggio e la funzione proteica17,18,19,la disposizione e l'inserimento dei peptidi28,29,lo screening farmacologico30e le piattaforme microfluidiche31.
I doppi strati lipidici sospesi sono stati utilizzati per studi di screening farmaceutico tramite un test parallelo di permeabilità della membrana artificiale (PAMPA) in cui un doppio strato lipidico è sospeso attraverso un inserto idrofobico poroso32,33,34,35. Sono stati sviluppati modelli lipidici PAMPA per diverse interfacce biologiche tra cui le interfacce sangue-cervello, buccale, intestinale e transdermica36. Combinando le tecniche a doppio strato lipidico supportate e PAMPA, è possibile studiare a fondo l'adsorbimento, la permeabilità e l'incorporazione di composti all'interno dei componenti lipidici di un tessuto o di un tipo di cellula desiderato.
Questo protocollo descrive la fabbricazione e l'applicazione di modelli lipidici a doppio strato di membrana cellulare in vitro per studiare diverse interazioni molecolari. La preparazione di entrambi i doppi strati lipidici e multilipidici supportati e sospesi è dettagliata. Per formare un doppio strato lipidico supportato, le vescicole lipidiche vengono prima sviluppate utilizzando metodi di idratazione ed estrusione a film sottile seguiti da caratterizzazione fisico-chimica. Viene discussa la formazione di un doppio strato lipidico supportato utilizzando il monitoraggio QCM-D e la fabbricazione di membrane lipidiche sospese per l'uso in PAMPA. Infine, vengono esaminate vescicole multilipidiche per lo sviluppo di membrane che imitano cellule più complesse. Utilizzando entrambi i tipi di membrane lipidiche fabbricate, questo protocollo dimostra come questo strumento possa essere utilizzato per studiare le interazioni molecolari. Nel complesso, questa tecnica costruisce cellule che imitano i doppi strati lipidici con elevata riproducibilità e versatilità.
Protocollo
1. Sviluppo di vescicole uni-lipidiche
- Metodo di idratazione a film sottile
- Preparazione e conservazione di soluzioni lipidiche
NOTA: Tutti i passaggi che utilizzano il cloroformio devono essere eseguiti in una cappa aspirante chimica. Il cloroformio deve sempre essere pipettato utilizzando punte per pipette in fibra di carbonio sicure per solventi. Le soluzioni contenenti cloroformio devono essere sempre conservate in flaconcini di vetro.- Preparare una soluzione madre lipidica da 10 mg/mL aggiungendo il volume appropriato di cloroformio nel flaconcino contenente la polvere lipidica e mescolare bene. Ad esempio, aggiungere 20 ml di cloroformio a 200 mg di L-α-fosfatidilcolina (uovo, pollo) (eggPC). La soluzione madre può essere prodotta a una concentrazione diversa, se necessario.
NOTA: Se il lipide in polvere è stato conservato in una fiala, dopo aver aggiunto il trasferimento del cloroformio a un flaconcino di vetro con un tappo rivestito in politetrafluoroetilene (PTFE). - Sigillare il tappo del flaconcino con Parafilm e conservare a -20 °C per un massimo di 6 mesi.
- Preparare una soluzione madre lipidica da 10 mg/mL aggiungendo il volume appropriato di cloroformio nel flaconcino contenente la polvere lipidica e mescolare bene. Ad esempio, aggiungere 20 ml di cloroformio a 200 mg di L-α-fosfatidilcolina (uovo, pollo) (eggPC). La soluzione madre può essere prodotta a una concentrazione diversa, se necessario.
- Formazione di un film lipidico secco
- Aggiungere il volume appropriato di soluzione madre lipidica in un flaconcino di vetro pulito necessario per una concentrazione finale di vescicola di 2,5 mg/mL. Ad esempio, per formare 1 mL di vescicole di PC all'uovo a 2,5 mg/mL, pipettare 250 μL di soluzione madre di PC all'uovo nel flaconcino.
NOTA: il volume preparato può dipendere dal processo di estrusore utilizzato (vedere il passaggio 1.3). Il volume massimo consigliato del mini estrusore è di 1 mL mentre l'ampio intervallo di volume dell'estrusore è di 5-50 ml. - Rimuovere il cloroformio dalla soluzione madre lipidica utilizzando un flusso di gas N2 (ultrapuro grado 5.0).
- Per garantire la completa rimozione del cloroformio, collegare il film lipidico essiccato al vuoto e lasciare agire per almeno 4 ore.
NOTA: il processo può essere interrotto qui. Se il film lipidico non verrà utilizzato immediatamente dopo l'essiccazione sottovuoto, conservare in un essiccatore fino all'uso. Abbiamo osservato che questi film lipidici producono vescicole di qualità simile dopo 1 settimana di conservazione in queste condizioni; la qualità delle vescicole dopo periodi di conservazione più lunghi, se necessario, dovrebbe essere ulteriormente esplorata.
- Aggiungere il volume appropriato di soluzione madre lipidica in un flaconcino di vetro pulito necessario per una concentrazione finale di vescicola di 2,5 mg/mL. Ad esempio, per formare 1 mL di vescicole di PC all'uovo a 2,5 mg/mL, pipettare 250 μL di soluzione madre di PC all'uovo nel flaconcino.
- Esecuzione di cicli di congelamento-scongelamento-vortice
- Preparare una soluzione tampone di cloruro di sodio Tris (NaCl) contenente 10 mM di base di Tris e 100 mM di NaCl. Reidratare il film lipidico essiccato con il volume richiesto di tampone Tris NaCl per ottenere una concentrazione finale di vescicola di 2,5 mg/mL e vortice per circa 15-30 s.
- Trasferire la sospensione di vescicole in un contenitore con ghiaccio secco fino a congelamento, circa 30 minuti. Dopo che il campione è stato completamente congelato, scongelare la sospensione a bagnomaria a 30-40 °C. Vortice la sospensione di vescicole scongelate.
NOTA: il liquido N2 può essere utilizzato al posto del ghiaccio secco. Trasferire la sospensione della vescicola in azoto liquido per 30 s, quindi scongelare immediatamente a bagnomaria a 80 ° C. - Ripetere il passaggio 1.1.3.2 altre 4 volte, per un totale di 5 cicli di congelamento-scongelamento-vortice.
- Preparazione e conservazione di soluzioni lipidiche
- Estrusione
NOTA: Dopo aver completato i cicli di congelamento-scongelamento-vortice, si formano vescicole multilamellari. L'estrusione aiuta a ridurre le dimensioni e a sviluppare grandi vescicole unilamellari.- Mini (1 mL) processo di estrusore
- Pulire accuratamente tutti i componenti dell'estrusore utilizzando un detergente delicato in acqua ultrapura e risciacquare almeno tre volte con acqua ultrapura assicurandosi che tutto il detergente venga rimosso. Asciugare con gas N2.
- Assemblare i due supporti a membrana interna e gli O-ring (diametro interno di 12,7 mm; diametro esterno di 15,2 mm). Posizionare ciascun supporto della membrana in modo che l'O-ring sia rivolto verso l'alto.
- Pre-bagnare un supporto filtrante con acqua ultrapura. Posizionarlo sulla superficie di supporto della membrana all'interno dell'O-ring. Ripetere per il secondo supporto interno della membrana.
- Posizionare un supporto interno della membrana nell'involucro esterno dell'estrusore. Posizionare una membrana in policarbonato da 100 nm sul supporto interno della membrana, direttamente sopra il supporto del filtro.
NOTA: Le membrane in policarbonato sono conservate separatamente tra i pezzi di carta di colore blu. Rimuovere la carta separante prima di inserirla sul supporto della membrana. - Posizionare il secondo supporto interno della membrana nell'involucro esterno dell'estrusore con l'O-ring e il lato di supporto del filtro rivolto verso la membrana in policarbonato. Fissare il cuscinetto in PTFE nel dado di ritenuta e chiudere a vite con l'involucro esterno dell'estrusore. Agganciare l'estrusore nel blocco riscaldante.
- Caricare la sospensione della vescicola lipidica in una delle siringhe e posizionare la siringa nel blocco termico dell'estrusore, inserendo completamente l'ago in un'estremità dell'estrusore. Inserire la seconda siringa vuota sul lato opposto e bloccare entrambe le siringhe utilizzando le clip del braccio sul blocco termico.
NOTA: se necessario, posizionare il blocco di calore dell'estrusore su una piastra calda e impostare la temperatura su un valore superiore alla temperatura di transizione del lipide. Inserire un termometro nel supporto integrato nel blocco termico per letture accurate della temperatura e attendere fino al raggiungimento della temperatura richiesta (~ 15 min). Le vescicole lipidiche dell'uovo PC non richiedono calore durante l'estrusione. - Spingere lentamente la sospensione della vescicola nella siringa vuota e poi di nuovo nella siringa originale. Monitorare le variazioni di pressione durante l'estrusione che indicano una perdita. Ripetere altre 20 volte per un totale di 21 passaggi attraverso la membrana in policarbonato. Trasferire le vescicole lipidiche in un flaconcino di vetro pulito per la conservazione.
NOTA: Il numero di estrusi può essere ottimizzato a seconda della composizione lipidica. - Se è stato utilizzato calore, consentire alla sospensione di vescicole estruse di raggiungere la temperatura ambiente. Conservare le vescicole lipidiche estruse a 4 °C fino a nuovo utilizzo.
NOTA: La durata raccomandata di conservazione delle vescicole dipende fortemente dalla composizione lipidica e le proprietà fisico-chimiche delle vescicole (ad es. diametro idrodinamico, potenziale zeta) devono essere monitorate nel tempo. Ad esempio, le vescicole di PC dell'uovo sono state conservate per almeno due settimane senza alcun cambiamento nelle dimensioni delle vescicole o nella capacità di formazione del doppio strato.
- Grande (5-50 mL) processo di estrusore
NOTA: seguire i passaggi 1.2.2.1-1.2.2.5 se è necessario calore per il lipide scelto. Andare al passaggio 1.2.2.5 se il calore non è necessario. I passaggi 1.2.2.1-1.2.2.4 non sono necessari per il PC dell'uovo.- Riempire un matraccio da 1 L con acqua ad osmosi inversa (RO).
NOTA: non utilizzare acqua ultrapura per circolare attraverso il sistema da 50 ml in quanto può causare la lisciviazione di ioni metallici dal cilindro dell'estrusore. - Posizionare il pallone da 1 L a bagnomaria su una piastra calda e impostare la piastra calda a una temperatura superiore alla temperatura di transizione del lipide.
- Collegare il cilindro campione al pallone con tubo flessibile tramite l'ingresso sul cilindro campione. Attaccare il tubo sull'uscita del cilindro alla parte superiore del pallone da 1 L. Fissare il tubo sia all'ingresso che all'uscita, se necessario. Ciò creerà un flusso unidirezionale dell'acqua attraverso il cilindro del campione.
- Accendere la pompa per avviare la circolazione dell'acqua. Se è necessario riscaldare, attendere circa 30-45 minuti affinché il cilindro del campione raggiunga la temperatura desiderata.
- Collegare il tappo del cilindro del campione a un serbatoio di azoto tramite il connettore flessibile collegato all'unità della valvola limitatrice di pressione.
- Pulire tutte le parti dell'estrusore da 50 mL con etanolo al 70% (v/v).
- Assemblare l'estrusore posizionando il supporto dello schermo del foro grande, il disco sinterizzato, i dischi di scarico e la membrana in policarbonato nello spazio nel supporto inferiore dell'estrusore. Collegare i supporti superiore e inferiore dell'estrusore utilizzando le quattro viti e serrare.
- Fissare l'unità estrusore al cilindro campione avvitando sul fondo e serrando con una chiave inglese per fissare.
NOTA: se si utilizza calore, posizionare un termometro nel cilindro e attendere che l'acqua abbia raggiunto la temperatura desiderata prima di continuare. Ciò garantirà che la temperatura del campione venga mantenuta durante l'intero processo di estrusione. - Riempire il cilindro del campione con acqua ultrapura. Estrudere l'acqua attraverso l'unità estrusore prima di aggiungere il campione nel cilindro del campione. Questo viene fatto per pre-bagnare le membrane, simile al mini estrusore.
NOTA: Assicurarsi che il tappo sia completamente avvitato e che la valvola limitatrice di pressione sia chiusa completamente prima di accendere l'azoto. Per questo passaggio è necessaria una pressione minima (~ 5-10 psi). - Aggiungere la sospensione della vescicola lipidica nel cilindro del campione e avvitare la parte superiore chiusa. Aumentare lentamente la pressione fino a quando il campione inizia a gocciolare dall'unità estrusore ad una velocità di circa 2-3 gocce/s in un flaconcino di vetro pulito.
NOTA: non aumentare rapidamente la pressione in questa fase, poiché troppa pressione potrebbe influire negativamente sulle membrane e portare a un'estrusione infruttuosa. - Una volta che tutto il campione è stato estruso, spegnere l'alimentazione N2 e rilasciare la pressione nel cilindro del campione aprendo lentamente la valvola limitatrice di pressione. Versare nuovamente le vescicole lipidiche nel cilindro del campione e ripetere il passaggio 1.2.2.11, altre 9 volte per un totale di 10 estrusi.
NOTA: La pressione richiesta per l'estrusione può diminuire con l'aumentare del numero di estrusi, poiché il campione diventa più omogeneo e di dimensioni più vicine alla dimensione dei pori della membrana in policarbonato. - Conservare la sospensione di vescicole lipidiche estruse a 4 °C fino a nuovo utilizzo.
- Riempire un matraccio da 1 L con acqua ad osmosi inversa (RO).
- Mini (1 mL) processo di estrusore
2. Caratterizzazione delle vescicole lipidiche
- Misurazione idrodinamica del diametro mediante diffusione dinamica della luce (DLS)
- Vescicole lipidiche Vortex e pipetta 50 μL della sospensione di vescicole lipidiche in una cuvetta monouso a basso volume. Coprire per evitare la contaminazione con polvere e detriti.
- Caricare la sospensione della vescicola nello strumento DLS, inserire i dettagli del campione ed eseguire la misurazione utilizzando il software associato.
- Potenziale Zeta
- Preparare una cellula zeta capillare piegata lavando con acqua ultrapura, etanolo al 70% e acqua ultrapura usando siringhe che si collegano agli ingressi della cellula. Spingere delicatamente il liquido attraverso la cella 3-4 volte e svuotare completamente la cella prima di passare alla soluzione successiva.
- Vortice delle vescicole lipidiche e preparare una diluizione 1:10 (v/v) delle vescicole lipidiche in acqua ultrapura.
- Caricare la sospensione di vescicole lipidiche diluite. Rimuovere le bolle d'aria spingendo la sospensione avanti e indietro tra le siringhe. Attaccare i tappi a ciascun ingresso.
NOTA: è fondamentale rimuovere tutte le bolle, in quanto ciò avrà un impatto sulla misurazione. - Posizionare la cella zeta nella camera del campione, assicurandosi che gli elettrodi siano in contatto. Chiudere la parte superiore della camera del campione. Nel software associato, inserire i dettagli del campione e raccogliere la misurazione.
3. Formare un doppio strato lipidico supportato da uni-lipidi usando QCM-D
- Preparazioni di soluzioni
- Preparare una soluzione al 2% (p/v) di sodio dodecil solfato (SDS) in acqua ultrapura. Mescolare su un piatto fino a completa dissoluzione. Soluzioni di lavoro aliquote di almeno 10 ml di acqua ultrapura, 2% SDS e Tris NaCl.
- Preparare una diluizione delle vescicole lipidiche nel tampone Tris NaCl. La concentrazione di vescicole dipende dall'applicazione. Per il PC dell'uovo, concentrazioni nell'intervallo di 0,01-0,5 mg / mL hanno dimostrato di provocare una formazione di doppio strato lipidico supportata con successo.
- Pulizia dei sensori in cristallo di quarzo rivestiti di silice
NOTA: la pulizia dei cristalli QCM-D dipende dal materiale superficiale del sensore utilizzato. Per formare doppi strati lipidici supportati, in questo protocollo vengono utilizzati cristalli di quarzo rivestiti di silice e dettagliati di seguito come adattati dalla procedura operativa standard del produttore.- Inserire il sensore di cristallo di quarzo rivestito di silice nel modulo di flusso assicurando che la "t" sul cristallo si allinei con la "t" sul modulo. Avvitare il modulo di flusso chiuso.
NOTA: se il QCM-D utilizzato consente di collegare ed eseguire contemporaneamente più moduli di flusso, ripetere le seguenti procedure per i moduli aggiuntivi in base alle esigenze. - Inserire il modulo di flusso nella base dello strumento con gli elettrodi del modulo di flusso che si collegano al sistema di analisi. Bloccare il modulo in posizione.
- Collegare il tubo di ingresso e di uscita al modulo di flusso e alla pompa. Posizionare il tubo nelle protezioni di tenuta e chiudere il coperchio del sistema di analisi. Posizionare un contenitore per i rifiuti all'uscita della pompa per raccogliere le soluzioni esaurite.
- Per eseguire la pulizia, accendere prima la pompa. Impostare la velocità del flusso a 400 μL/min. Inserire il tubo di ingresso in acqua ultrapura e scorrere 5-10 ml attraverso il modulo.
- Commutare il tubo di ingresso in SDS al 2% e scorrere 5-10 mL attraverso il modulo. Riportare il tubo di ingresso in acqua ultrapura e scorrere 10-20 ml attraverso il modulo. Rimuovere il tubo di ingresso dalla soluzione e far scorrere l'aria attraverso il tubo fino a quando tutto il liquido non viene espulso.
NOTA: Il protocollo di pulizia di cui sopra viene utilizzato quotidianamente prima e dopo ogni misurazione. Una pulizia accurata può essere eseguita secondo necessità. In breve, per eseguire una pulizia approfondita, smontare i moduli di flusso. Tutti i componenti ad eccezione del lato elettrodo del modulo di flusso devono essere immersi in SDS al 2% (p/v) e sonicati a bagno, seguiti da un accurato risciacquo con acqua ultrapura e asciugatura con un flusso di gas N2. Il componente del modulo di flusso contenente i perni dell'elettrodo non deve mai essere a contatto con il liquido. - Rimuovere il sensore dal modulo di flusso e risciacquare il sensore con acqua ultrapura. Asciugare il sensore con un flusso di gas N2. Asciugare il modulo di flusso con un flusso di gas N2. Assicurarsi che l'elettrodo rimanga sempre privo di liquidi.
- In una cappa aspirante chimica, inserire il sensore di cristallo di quarzo rivestito di silice in uno strumento di pulizia ultravioletto (UV) / ozono. Accendere lo strumento e consentire il trattamento per almeno 2 minuti. Rimuovere i sensori con attenzione e tornare nel modulo di flusso.
- Inserire il sensore di cristallo di quarzo rivestito di silice nel modulo di flusso assicurando che la "t" sul cristallo si allinei con la "t" sul modulo. Avvitare il modulo di flusso chiuso.
- Formazione di una linea di base Tris NaCl
- Accendere lo strumento analizzatore per collegarlo al software associato e impostare la temperatura sul valore desiderato per il doppio strato lipidico supportato. Lasciare che la temperatura si stabilizzi all'ingresso desiderato.
NOTA: se la temperatura impostata è superiore alla temperatura ambiente, tutte le soluzioni devono essere riscaldate alla stessa temperatura utilizzando un blocco termico. - Configurare la misurazione e trovare tutte le frequenze di risonanza e le dissipazioni del sensore per i toni 3, 5, 7, 9, 11 e 13 prima di iniziare la misurazione.
NOTA: il 1° overtone può essere ignorato in quanto questa armonica è eccessivamente sensibile e produce dati rumorosi. - Accendere la pompa e impostare la portata a 175 μL/min o la portata sperimentale desiderata.
- Pulire il tubo di ingresso con etanolo prima di inserirlo in Tris NaCl. Avviare la misurazione e iniziare a scorrere Tris NaCl.
NOTA: i dati vengono raccolti e monitorati in tempo reale. Il passaggio da aria a liquido nel modulo di flusso sarà osservato nel software di raccolta dati mediante un rapido aumento del cambiamento di dissipazione(ΔD)e una diminuzione del cambiamento di frequenza(ΔF). - Consentire a Tris NaCl di fluire attraverso il modulo per 5-10 minuti, assicurando che i valori basali di ΔF e ΔD nel liquido rimangano stabili.
- Accendere lo strumento analizzatore per collegarlo al software associato e impostare la temperatura sul valore desiderato per il doppio strato lipidico supportato. Lasciare che la temperatura si stabilizzi all'ingresso desiderato.
- Formazione di un doppio strato lipidico supportato da uni lipidi
- Arrestare la pompa e rimuovere il tubo di ingresso dalla soluzione tris NaCl e inserirlo con attenzione nella soluzione di vescicola lipidica. Retrocorrere per 5 s per rimuovere eventuali bolle d'aria dal tubo di ingresso, quindi continuare il flusso in avanti. Riavviare la misurazione nel software per azzerare la linea di base.
NOTA: Fare attenzione ad evitare bolle d'aria nel tubo, che possono fluire attraverso il modulo e interrompere la formazione di due strati e la registrazione dei dati. - Flusso di vescicole lipidiche fino a quando la formazione di due strati è osservata in tempo reale nel software di acquisizione dati (almeno 8 minuti per le vescicole del PC dell'uovo).
- Ripetere il passaggio 3.4.1 per cambiare il tubo di ingresso dalle vescicole lipidiche al tampone Tris NaCl.
NOTA: se l'applicazione desiderata è quella di studiare le interazioni molecolari, continuare direttamente al passaggio 6.1 senza interrompere il flusso della soluzione o l'acquisizione dei dati. Se la formazione di due strati è il punto finale, procedere al passaggio 3.4.4. - Nel software, interrompere la misurazione e salvare il file. Arrestare la pompa.
- Pulire il modulo di flusso e il sensore di cristallo di quarzo rivestito di silice seguendo i passaggi del protocollo 3.2.4 e 3.2.5.
- Arrestare la pompa e rimuovere il tubo di ingresso dalla soluzione tris NaCl e inserirlo con attenzione nella soluzione di vescicola lipidica. Retrocorrere per 5 s per rimuovere eventuali bolle d'aria dal tubo di ingresso, quindi continuare il flusso in avanti. Riavviare la misurazione nel software per azzerare la linea di base.
4. Formare un doppio strato lipidico sospeso
NOTA: Il protocollo per la formazione di un doppio strato lipidico sospeso è adattato dal protocollo PARALLELO DI PERMEABILITÀ A MEMBRANA ARTIFICIALE (PAMPA) fornito dal produttore della piastra filtrante37.
- Solubilizzare il lipide desiderato in dodecano a 20 mg/mL (ad esempio, 1,2-dioleoil- sn-glicero-3-fosfocolina (DOPC)).
- Aggiungere 5 μL della soluzione lipidica al compartimento donatore, che è una piastra filtrante multischermo porosa in polivinilidene difluoruro (PVDF) a 96 pozzetti (dimensione dei pori di 0,45 μm).
- Immergere immediatamente la piastra filtrante nel compartimento accettore, che è una piastra ricevente di trasporto contenente 300 μL di 1× soluzione salina tamponata con fosfato (PBS). Aggiungere 200 μL di 1× PBS al compartimento donatore.
NOTA: possono essere inclusi controlli di filtri con soli lipidi e filtri non trattati esposti a 1× PBS. - Continui direttamente al paragrafo 6.2 per studiare le interazioni molecolari con il doppio strato lipidico sospeso. Si raccomanda di completare lo studio entro 16 ore dalla formazione del doppio strato sospeso.
5. Sviluppo di cellule multilipidiche che imitano vescicole e doppi strati
- Estrazione lipidica da cellule di mammifero
NOTA: L'estrazione lipidica segue l'approccio Bligh-Dyer38.- Coltivare la linea cellulare desiderata come appropriato. Dopo aver raggiunto il 70-80% di confluenza (pallone T75), staccare le cellule utilizzando l'acido tripsina-etilendiamminatretaacetico a 37 °C per 5 minuti.
- Centrifugare le celle a 200 × g per 5 min. Rimuovere il surnatante e risospese il pellet cellulare in 1 mL di acqua ultrapura.
- Aggiungere 3,75 mL di una miscela 1:2 (v/v) di cloroformio:metanolo alla sospensione cellulare e al vortice per 15 min. Quindi, aggiungere 1,25 ml di cloroformio e vortice per 1 minuto. Infine, aggiungere 1,25 ml di acqua e vortice per 1 minuto.
- Centrifugare miscela cellulare a 1000 x g per 10 min. Raccogliere lo strato inferiore di liquido, che contiene lipidi nella fase organica. Asciugare sotto un flusso di gas N2.
- Quantificare il contenuto lipidico utilizzando la cromatografia liquida-spettrometria di massa (LC-MS) utilizzando una fase inversa C18, 3,5 μm × colonna da 50 mm.
- Per la fase mobile, preparare due soluzioni, la prima con acetonitrile 60:40 (v/v) e la seconda con isopropanolo:acetonitrile 90:10 (v/v). Il formiato di ammonio deve essere aggiunto a entrambe le soluzioni ad una concentrazione finale di 10 mM. Oltre 60 minuti, aumentare il gradiente di fase mobile dal 35% (v/v) della seconda soluzione al 95% (v/v).
- Rilevare l'effluente in modalità di ionizzazione negativa, con MS a scansione completa consecutiva e MS/MS tandem. Identificare le singole specie di fosfolipidi dai loro rapporti massa-carica (m/z). Analizza gli spettri di massa dalla frammentazione della dissociazione indotta dalla collisione, utilizzando gli strumenti di analisi della spettrometria di massa LIPID MAPS. Ottenere cromatogrammi ionici estratti per integrare l'area sotto la curva, determinando l'abbondanza di ciascuna specie lipidica.
- Eseguire i passaggi 5.1.5-5.1.7 per uno standard lipidico contenente le principali classi lipidiche per determinare le relative sensibilità di rilevamento per ogni diversa classe di fosfolipidi.
- Sviluppo di vescicole multilipidiche
- Seguire i passaggi di cui al punto 1.1.1 per preparare soluzioni lipidiche per i lipidi che rappresentano ciascun componente a doppio strato desiderato, come identificato nel passaggio 5.1.
- Sulla base delle composizioni lipidiche ottenute dalla fase 5.1, aggiungere il volume appropriato di materiale lipidico/cloroformio in un flaconcino di vetro pulito necessario per una concentrazione finale di vescicola di 2,5 mg/ml. Rimuovere la soluzione essiccante al cloroformio sfuso sotto un flusso di gas N2.
- Seguire i passaggi 1.1.2, 1.1.3 e 1.2 per formare vescicole multilipidiche. Seguire il passaggio 2 per la caratterizzazione delle vescicole.
- Formare un doppio strato lipidico supportato da più lipidi usando QCM-D
NOTA: Alcune vescicole multilipidiche possono provocare la rottura spontanea delle vescicole lipidiche e la formazione di due strati simili alle vescicole PC uni-lipidiche presentate nella fase 3. Tuttavia, vescicole multilipidiche più complesse possono richiedere un input esterno per aiutare nella rottura delle vescicole. Qui, il peptide AH viene utilizzato per destabilizzare il foglietto esterno della vescicola con conseguente formazione di doppio strato. Altri metodi per ottenere la destabilizzazione e la rottura delle vescicole possono essere considerati, se lo si desidera.- Seguire il passaggio 3 per formare il doppio strato lipidico supportato da più lipidi utilizzando le vescicole multilipidiche formate nel passaggio 5.2.
- Se non si osserva la rottura spontanea delle vescicole in un doppio strato, tentare la destabilizzazione delle vescicole utilizzando il peptide AH. Preparare il peptide AH (sequenza peptidica: H-Ser−Gly−Ser−Trp−Leu−Arg−Asp−Val−Trp−Asp−Trp−Ile−Cys−Thr−Val−Thr−Asp−Phe−Lys−Thr−Trp−Leu−Gln−Ser−Lys−Leu−Asp−Tyr−Lys−Asp-NH2) a 13 μM in Tris NaCl con 1% (v/v) dimetilsolfossido, DMSO.
- Seguire i passaggi 3.4.1-3.4.3. Dopo il passaggio 3.4.3, cambiare il tubo di ingresso nella soluzione peptidica AH. Introdurre la soluzione nel modulo di flusso fino a quando ΔF e ΔD non vengono osservati dalla nuova aggiunta di soluzione. Arrestare la pompa e lasciare che il peptide AH incuba con le vescicole per 10 minuti.
- Commutare il tubo di ingresso in Tris NaCl e avviare il flusso per rimuovere il peptide AH dalle vescicole rotte che portano alla formazione di successo di un doppio strato lipidico.
NOTA: se l'applicazione desiderata è quella di studiare le interazioni molecolari, continuare la direzione del passaggio 6.1 senza interrompere il flusso della soluzione o l'acquisizione dei dati. - Nel software, interrompere la misurazione e salvare il file. Arrestare la pompa.
- Pulire il modulo di flusso e il sensore di cristallo di quarzo rivestito di silice seguendo i passaggi del protocollo 3.2.4-3.2.6.
- Doppi strati multilipidici sospesi
- Solubilizzare la miscela di lipidi desiderati in dodecane a 20 mg/mL.
- Preparare una soluzione di miscela lipidica da 5 μL utilizzando la composizione che imita la cellula desiderata.
- Seguire i passaggi 4.2 e 4.3.
NOTA: Continuare direttamente al passaggio 6.2 per studiare le interazioni molecolari con il doppio strato lipidico sospeso.
6. Studi di interazione molecolare con doppi strati uni-lipidici e multi-lipidici
- Studiare le interazioni molecolari con un doppio strato lipidico supportato utilizzando QCM-D
- Preparare una soluzione della molecola desiderata per studiare l'adsorbimento con un doppio strato lipidico supportato. Ad esempio, preparare una soluzione di 200 μM di (2-etilesil) ftalato (DEHP) in Tris NaCl con 1% (v/v) DMSO.
- Se la soluzione molecolare viene preparata in Tris NaCl, può essere fluita direttamente dopo il passaggio 3.4.3 per un doppio strato unilipidico o 5.3.4 per un doppio strato multilipidico. Se la molecola deve essere preparata in un solvente diverso, inserire invece il tubo di ingresso nel solvente desiderato da solo per almeno 5 minuti (ad esempio, Tris NaCl con 1% (v / v) DMSO per DEHP).
NOTA: Le variazioni di viscosità dovute al solvente possono essere monitorate e considerate facendolo scorrere prima e dopo l'introduzione della molecola di interesse. - Commutare il tubo di ingresso nella soluzione contenente la molecola di interesse e il flusso per almeno 5 minuti. Il flusso può anche essere interrotto e il liquido contenente la molecola desiderata può essere lasciato incubare con il doppio strato, se lo si desidera.
- Riportare il tubo di ingresso al solo solvente molecolare se qualcosa di diverso da Tris NaCl. Flusso per almeno 5 min. Quindi, commutare il tubo di ingresso in Tris NaCl e scorrere per almeno 5 minuti.
- Nel software, interrompere la misurazione e salvare il file. Arrestare la pompa.
- Pulire il modulo di flusso e il sensore di cristallo di quarzo rivestito di silice seguendo i passaggi del protocollo 3.2.4-3.2.6.
- Studiare le interazioni molecolari con i doppi strati lipidici sospesi utilizzando PAMPA
- Preparare una soluzione della molecola desiderata. Ad esempio, preparare un DEHP da 200 μM in 1× PBS con DMSO all'1% (v/v).
- Preparare una nuova piastra ricevitore di trasporto con 300 μL di PBS fresco da 1x per pozzetto.
- Immediatamente dopo il passaggio 3.3 per un doppio strato sospeso unipidico o 4.4.3 per un doppio strato sospeso multilipidico, rimuovere il PBS da 1× dal compartimento donatore della piastra filtrante multischermo e sostituirlo con 200 μL della soluzione in esame. Immergere immediatamente nella piastra del ricevitore di trasporto preparata al punto 6.2.2.
- Incubare con un leggero dondolo per il periodo di tempo desiderato (ad esempio, 2 ore) a 25 °C.
- Dopo l'incubazione, raccogliere 150 μL della soluzione dai compartimenti donatore e accettore. Misurare la concentrazione della molecola in entrambi i campioni utilizzando un metodo appropriato basato sulle proprietà di questa molecola.
- Ad esempio, utilizzare uno spettrofotometro a micropiastre con la lunghezza d'onda di assorbanza appropriata, ad esempio 280 nm per DEHP, e confrontare con una curva standard della molecola di interesse.
- Calcola la permeabilità apparente (Papp) della molecola di interesse usando le seguenti equazioni:
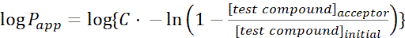 (1)
(1)
Dove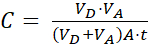 (2)
(2)
NOTA: [composto di prova]accettore è la concentrazione della molecola di interesse (ad esempio, DEHP) al momento, t, nel compartimento accettore; e [composto di prova]iniziale è la concentrazione iniziale della molecola. A è l'area della membrana, t è il tempo, VD è il volume del compartimento del donatore e VA è il volume del compartimento dell'accettore.
Risultati
Questo protocollo descrive in dettaglio i metodi per la formazione di doppi strati lipidici supportati e sospesi (Figura 1). Il primo passo per formare un doppio strato lipidico supportato è quello di sviluppare vescicole lipidiche. Il mini estrusore consente di preparare piccoli volumi di vescicole lipidiche (1 mL o meno), mentre il grande estrusore consente di preparare 5-50 mL di vescicole lipidiche in un unico lotto. Le distribuzioni dimensionali delle vescicole unilipidiche formate dal...
Discussione
Questo protocollo consente la formazione di vescicole lipidiche, doppi strati lipidici supportati e doppi strati lipidici sospesi. Qui vengono presentati i passaggi critici per formare ciascuna di queste strutture. Quando si formano vescicole lipidiche, è importante estrudere al di sopra della temperatura di transizione del lipide39. Quando è al di sotto della temperatura di transizione, il lipide è fisicamente presente nella sua fase gel ordinata39. In questa fase ordin...
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse o interessi finanziari concorrenti.
Riconoscimenti
Questo materiale si basa sul lavoro sostenuto dalla National Science Foundation nell'ambito della sovvenzione n. 1942418 assegnata ad AS e di una borsa di ricerca universitaria della National Science Foundation assegnata a C.M.B.H., nell'ambito della sovvenzione n. 1644760. Eventuali opinioni, risultati e conclusioni o raccomandazioni espresse in questo materiale sono quelle degli autori e non riflettono necessariamente le opinioni della National Science Foundation. Gli autori ringraziano il Dr. Noel Vera-González per l'acquisizione dei dati di caratterizzazione delle vescicole lipidiche. Gli autori ringraziano il professor Robert Hurt (Brown University) per l'uso del suo Zetasizer. Gli autori ringraziano la Brown University Mass Spectrometry Facility, in particolare il Dr. Tun-Li Shen per l'assistenza nella quantificazione della composizione lipidica.
Materiali
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-glycero-3-phosphocholine (POPC, 16:0-18:1 PC) | Avanti Polar Lipids | 850457 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phospho-L-serine (sodium salt) (POPS, 16:0-18:1 PS) | Avanti Polar Lipids | 840034 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine (16:0-18:1 PE) | Avanti Polar Lipids | 850757 | |
| 1,2-dioleoyl-sn-glycero-2-phospho-L-serine (DOPS, 18:1 PS) | Avanti Polar Lipids | 840035 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC, 18:1 (Δ9-Cis) PC) | Avanti Polar Lipids | 850375 | |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE, 18:1 (Δ9-Cis) PE) | Avanti Polar Lipids | 850725 | |
| 1,2-distearoyl-sn-glycero-3-ethylphosphocholine (chloride salt) (18:0 EPC (Cl Salt)) | Avanti Polar Lipids | 890703 | |
| 3 mL Luer-Loc syringes | BD | 309657 | |
| 40 mL sample vial, amber with polytetrafluoroethylene (PTFE)/rubber liner | Duran Wheaton Kimble | W224605 | |
| Acetonitrile | Sigma-Aldrich | 271004 | |
| Alconox | Fisher Scientific | 50-821-781 | |
| Ammonium formate | Millipore Sigma | LSAC70221 | |
| C18, 3.5 um x 50 mm column, SunFire | Waters | 186002551 | |
| Chloroform | Millipore Sigma | LSAC288306 | |
| Cuvette UV Micro LCH 8.5 mm, 50 um, RPK | Sarstedt | 67.758.001 | |
| Di(2-ethylhexyl) phthalate (DEHP) | Millipore Sigma | 36735 | |
| Dimethyl sulfoxide (DMSO) | Millipore Sigma | LSAC472301 | |
| Ethanol | Pharmco | 111000200 | |
| Filter supports, 10 mm | Avanti Polar Lipids | 610014 | Size for mini extruder |
| Folded capillary zeta cell | Malvern Panalytical | DTS1070 | |
| Isopropanol | Sigma-Aldrich | 190764-4L | |
| Kimwipes | Kimberly Clark | 34256 | |
| L-α-phosphatidylinositol (soy) (Soy PI) | Avanti Polar Lipids | 840044 | |
| L-α-phosphitidylcholine (Egg, Chicken) | Avanti Polar Lipids | 840051 | |
| LiposoFast ® LF-50 | Avestin, Inc. | ||
| Methanol | Sigma-Aldrich | 179337 - 4L | |
| Mini-extruder set with holder/heating block | Avanti Polar Lipids | 610000 | |
| MultiScreen-IP Filter Plate, 0.45 µm, clear, sterile | Millipore Sigma | MAIPS4510 | for PAMPA studies |
| Nitrogen gas, ultrapure | TechAir | NI T5.0 | |
| Nuclepore hydrophilic membranes, polycarbonate, 19 mm, 0.1 um | Whatman | 800309 | Size for mini extruder |
| Nuclepore hydrophilic membranes, polycarbonate, 25 mm, 0.1 um | Whatman | 110605 | Size for large extruder |
| Parafilm | Bemis | PM999 | |
| Phosphate buffer saline (PBS), 10x | Genesee Scienfitic | 25-507X | Dilute to 1x |
| Qsoft 401 software | Biolin Scientific | ||
| Quartz Crystal Microbalance with Dissipation Q-Sense Analyzer | Biolin Scientific | ||
| Scintillation vials, borosilicate glass vials, 20 mL | Duran Wheaton Kimble | 986561 | |
| Silicon Dioxide, thin QSensors | Biolin Scientific | QSX 303 | |
| Sodium chloride (NaCl) | Millipore Sigma | LSACS5886 | |
| Sodium dodecyl sulfate (SDS) | Fisher Scientific | BP166-100 | |
| Solvent Safe pipette tips | Sigma-Aldrich | S8064 | |
| Sphingomyelin (Egg, Chicken) | Avanti Polar Lipids | 860061 | |
| Trizma base | Millipore Sigma | LSACT1503 | |
| Trypsin-ethylenediaminetretaacetic acid | Caisson Labs | TRL01-6X100ML | |
| Whatman drain disc, 25 mm | Whatman | 230600 | Size for large extruder |
| Zetasizer ZS90 | Malvern Panalytical | ||
| Zetasizer 7.01 software | Malvern Panalytical |
Riferimenti
- Lucio, M., Lima, J. L. F. C., Reis, S. Drug-Membrane Interactions: Significance for Medicinal Chemistry. Current Medicinal Chemistry. 17 (17), 1795-1809 (2010).
- Mayne, C. G., et al. The cellular membrane as a mediator for small molecule interaction with membrane proteins. Biochimica et Biophysica Acta - Biomembranes. 1858 (10), 2290-2304 (2016).
- Bunea, A. I., Harloff-Helleberg, S., Taboryski, R., Nielsen, H. M. Membrane interactions in drug delivery: Model cell membranes and orthogonal techniques. Advances in Colloid and Interface Science. 281, 102177 (2020).
- Peetla, C., Stine, A., Labhasetwar, V. Biophysical interactions with model lipid membranes: Applications in drug discovery and drug delivery. Molecular Pharmaceutics. 6 (5), 1264-1276 (2009).
- Richter, R., Mukhopadhyay, A., Brisson, A. Pathways of Lipid Vesicle Deposition on Solid Surfaces: A Combined QCM-D and AFM Study. Biophysical Journal. 85 (5), 3035-3047 (2003).
- Lind, T. K., Cárdenas, M., Wacklin, H. P. Formation of supported lipid bilayers by vesicle fusion: Effect of deposition temperature. Langmuir. 30 (25), 7259-7263 (2014).
- Mingeot-Leclercq, M. -. P., Deleu, M., Brasseur, R., Dufrêne, Y. F. Atomic force microscopy of supported lipid bilayers. Nature protocols. 3 (10), 1654-1659 (2008).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: an integrated view. Langmuir the ACS journal of surfaces and colloids. 22 (8), 3497-3505 (2006).
- Chan, Y. -. H. M., Boxer, S. G. Model membrane systems and their applications. Current Opinion in Chemical Biology. 11 (6), 581-587 (2007).
- Edvardsson, M., Svedhem, S., Wang, G., Richter, R., Rodahl, M., Kasemo, B. QCM-D and reflectometry instrument: applications to supported lipid structures and their biomolecular interactions. Analytical chemistry. 81 (1), 349-361 (2009).
- Rodahl, M., et al. Simultaneous frequency and dissipation factor QCM measurements of biomolecular adsorption and cell adhesion. Faraday Discussions. 107, 229-246 (1997).
- Keller, C. A., Glasmästar, K., Zhdanov, V. P., Kasemo, B. Formation of Supported Membranes from Vesicles. Physical Review Letters. 84 (23), 5443-5446 (2000).
- Keller, C. A., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical journal. 75 (3), 1397-1402 (1998).
- Cho, N. -. J., Frank, C. W., Kasemo, B., Höök, F. Quartz crystal microbalance with dissipation monitoring of supported lipid bilayers on various substrates. Nature protocols. 5 (6), 1096-1106 (2010).
- Bailey, C. M., Tripathi, A., Shukla, A. Effects of Flow and Bulk Vesicle Concentration on Supported Lipid Bilayer Formation. Langmuir. 33 (43), 11986-11997 (2017).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature reviews. Molecular cell biology. 9 (2), 112-124 (2008).
- Rossi, C., Chopineau, J. Biomimetic tethered lipid membranes designed for membrane-protein interaction studies. European Biophysics Journal. 36 (8), 955-965 (2007).
- Hatty, C. R., et al. Investigating the interactions of the 18 kDa translocator protein and its ligand PK11195 in planar lipid bilayers. Biochimica et Biophysica Acta - Biomembranes. 1838 (3), 1019-1030 (2014).
- Min, Y., Kristiansen, K., Boggs, J. M., Husted, C., Zasadzinski, J. a., Israelachvili, J. Interaction forces and adhesion of supported myelin lipid bilayers modulated by myelin basic protein. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3154-3159 (2009).
- Heath, G. R., et al. Layer-by-layer assembly of supported lipid bilayer poly-l-lysine multilayers. Biomacromolecules. 17 (1), 324-335 (2016).
- Alberts, B., Lewis, J. The Lipid Bilayer. Molecular Biology of the Cell. , 6-11 (2013).
- Cho, N. J., Wang, G., Edvardsson, M., Glenn, J. S., Hook, F., Frank, C. W. Alpha-helical peptide-induced vesicle rupture revealing new insight into the vesicle fusion process as monitored in situ by quartz crystal microbalance-dissipation and reflectometry. Analytical Chemistry. 81 (12), 4752-4761 (2009).
- Hardy, G. J., Nayak, R., Munir Alam, S., Shapter, J. G., Heinrich, F., Zauscher, S. Biomimetic supported lipid bilayers with high cholesterol content formed by α-helical peptide-induced vesicle fusion. Journal of Materials Chemistry. 22 (37), 19506-19513 (2012).
- Bailey-Hytholt, C. M., Shen, T. L., Nie, B., Tripathi, A., Shukla, A. Placental Trophoblast-Inspired Lipid Bilayers for Cell-Free Investigation of Molecular Interactions. ACS Applied Materials and Interfaces. 12 (28), 31099-31111 (2020).
- Domenech, O., Francius, G., Tulkens, P. M., Van Bambeke, F., Dufrêne, Y., Mingeot-Leclercq, M. -. P. Interactions of oritavancin, a new lipoglycopeptide derived from vancomycin, with phospholipid bilayers: Effect on membrane permeability and nanoscale lipid membrane organization. Biochimica et biophysica acta. 1788 (9), 1832-1840 (2009).
- Bailey, C. M., Kamaloo, E., Waterman, K. L., Wang, K. F., Nagarajan, R., Camesano, T. a. Size dependence of gold nanoparticle interactions with a supported lipid bilayer: A QCM-D study. Biophysical Chemistry. 203-204, 51-61 (2015).
- Bailey-Hytholt, C. M., Puranik, T., Tripathi, A., Shukla, A. Investigating interactions of phthalate environmental toxicants with lipid structures. Colloids and Surfaces B: Biointerfaces. 190, 110923 (2020).
- Wang, K. F., Nagarajan, R., Camesano, T. A. Antimicrobial peptide alamethicin insertion into lipid bilayer: a QCM-D exploration. Colloids and surfaces. B, Biointerfaces. 116, 472-481 (2014).
- Lozeau, L. D., Rolle, M. W., Camesano, T. A. A QCM-D study of the concentration- and time-dependent interactions of human LL37 with model mammalian lipid bilayers. Colloids and Surfaces B: Biointerfaces. 167 (1), 229-238 (2018).
- Kongsuphol, P., Fang, K. B., Ding, Z. Lipid bilayer technologies in ion channel recordings and their potential in drug screening assay. Sensors and Actuators B: Chemical. 185, 530-542 (2013).
- Ren, X., et al. Design, fabrication, and characterization of archaeal tetraether free-standing planar membranes in a PDMS-and PCB-based fluidic platform. ACS Applied Materials & Interfaces. 6 (15), 12618-12628 (2014).
- Seo, P. R., Teksin, Z. S., Kao, J. P. Y., Polli, J. E. Lipid composition effect on permeability across PAMPA. European Journal of Pharmaceutical Sciences. 29 (3-4), 259-268 (2006).
- Avdeef, A. The rise of PAMPA. Expert Opinion on Drug Metabolism & Toxicology. 1 (2), 325-342 (2005).
- Avdeef, A., Artursson, P., Neuhoff, S., Lazorova, L., Gråsjö, J., Tavelin, S. Caco-2 permeability of weakly basic drugs predicted with the Double-Sink PAMPA method. European Journal of Pharmaceutical Sciences. 24 (4), 333-349 (2005).
- Campbell, S. D., Regina, K. J., Kharasch, E. D. Significance of Lipid Composition in a Blood-Brain Barrier-Mimetic PAMPA Assay. Journal of Biomolecular Screening. 19 (3), 437-444 (2014).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Schmidt, D., Lynch, J. Evaluation of the reproducibility of Parallel Artificial Membrane Permation Assays (PAMPA). EMD Millipore Corporation. , (2020).
- Bligh, E. G., Dyer, W. J. A Rapid Method of Total Lipid Extraction and Purification. Canadian Journal of Biochemistry and Physiology. 37 (8), 911-917 (1959).
- Nayar, R., Hope, M. J., Cullis, P. R. Generation of large unilamellar vesicles from long-chain saturated phosphatidylcholines by extrusion technique. BBA - Biomembranes. 986 (2), 200-206 (1989).
- Lind, T. K., Skida, M. W. A., Cárdenas, M. Formation and Characterization of Supported Lipid Bilayers Composed of Phosphatidylethanolamine and Phosphatidylglycerol by Vesicle Fusion, a Simple but Relevant Model for Bacterial Membranes. ACS Omega. 4 (6), 10687-10694 (2019).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Bermejo, M., et al. PAMPA-a drug absorption in vitro model: 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones. European Journal of Pharmaceutical Sciences. 21 (4), 429-441 (2004).
- Kerns, E. H., Di, L., Petusky, S., Farris, M., Ley, R., Jupp, P. Application of parallel artificial membrane permeability assay and Caco-2 permeability. Journal of Pharmaceutical Sciences. 93 (6), 1440-1453 (2004).
- Masungi, C., et al. Parallel artificial membrane permeability assay (PAMPA) combined with a 10-day multiscreen Caco-2 cell culture as a tool for assessing new drug candidates. Pharmazie. 63 (3), 194-199 (2008).
- Vera-González, N., et al. Anidulafungin liposome nanoparticles exhibit antifungal activity against planktonic and biofilm Candida albicans. Journal of Biomedical Materials Research - Part A. 108 (11), 2263-2276 (2020).
- Barenholz, Y., Gibbes, D., Litman, B. J., Goll, J., Thompson, T. E., Carlson, F. D. A simple method for the preparation of homogeneous phospholipid vesicles. Biochemistry. 16 (1), 2806-2810 (1977).
- El Kirat, K., Morandat, S., Dufrêne, Y. F. Nanoscale analysis of supported lipid bilayers using atomic force microscopy. Biochimica et Biophysica Acta - Biomembranes. 1798 (4), 750-765 (2010).
- Tawa, K., Morigaki, K. Substrate-supported phospholipid membranes studied by surface plasmon resonance and surface plasmon fluorescence spectroscopy. Biophysical Journal. 89 (4), 2750-2758 (2005).
- Koenig, B. W., et al. Neutron Reflectivity and Atomic Force Microscopy Studies of a Lipid Bilayer in Water Adsorbed to the Surface of a Silicon Single Crystal. Langmuir. 12 (5), 1343-1350 (1996).
- Lind, T. K., Cárdenas, M. Understanding the formation of supported lipid bilayers via vesicle fusion-A case that exemplifies the need for the complementary method approach (Review). Biointerphases. 11 (2), 020801 (2016).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surface Science Reports. 61 (10), 429-444 (2006).
- Isaksson, S., et al. Protein-Containing Lipid Bilayers Intercalated with Size-Matched Mesoporous Silica Thin Films. Nano Letters. 17 (1), 476-485 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon