Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Тестирование иммунотерапии рака на гуманизированной мышиной модели с опухолями человека
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этом протоколе описывается генерация мышей иммунной системы человека (HIS) для иммуноонкологических исследований. Инструкции и соображения по использованию этой модели для тестирования иммунотерапевтических средств человека на опухолях человека, имплантированных в эту модель, представлены с акцентом на характеристику реакции иммунной системы человека на опухоль.
Аннотация
Изменение иммуносупрессивной природы микроокружения опухоли имеет решающее значение для успешного лечения рака иммунотерапевтическими препаратами. Модели рака мышей крайне ограничены в своем разнообразии и страдают от плохого перевода в клинику. Чтобы служить более физиологической доклинической моделью для исследований иммунотерапии, этот протокол был разработан для оценки лечения опухолей человека у мышей, восстановленных с иммунной системой человека. Этот уникальный протокол демонстрирует развитие иммунной системы человека (HIS, «гуманизированный») мышей с последующей имплантацией опухоли человека, либо ксенотрансплантата, полученного из клеточной линии (CDX), либо ксенотрансплантата, полученного из пациента (PDX). Мыши HIS генерируются путем инъекции CD34+ гемопоэтических стволовых клеток человека, выделенных из пуповинной крови, в новорожденных мышей с высоким иммунодефицитом BRGS (BALB/c Rag2-/- IL2RγC-/- NODSIRPα), которые также способны принимать ксеногенную опухоль. Подчеркивается важность кинетики и особенностей развития иммунной системы человека и имплантации опухоли. Наконец, описана углубленная оценка микроокружения опухоли с помощью проточной цитометрии. В многочисленных исследованиях с использованием этого протокола было обнаружено, что опухолевое микроокружение отдельных опухолей повторяется у мышей HIS-PDX; «Горячие» опухоли проявляют большую иммунную инфильтрацию, в то время как «холодные» опухоли этого не делают. Эта модель служит испытательным полигоном для комбинированной иммунотерапии широкого спектра опухолей человека и представляет собой важный инструмент в поисках персонализированной медицины.
Введение
Модели рака мышей важны для установления основных механизмов роста опухоли и иммунного ускользания. Однако исследования по лечению рака на мышиных моделях дали конечную трансляцию в клинику из-за ограниченных сингенных моделей и видоспецифических различий 1,2. Появление иммунной терапии в качестве доминирующего подхода к борьбе с опухолями подтвердило необходимость модели in vivo с функциональной иммунной системой человека. Достижения в области мышей иммунной системы человека (мышей HIS) за последнее десятилетие позволили изучать иммуноонкологию in vivo при самых разных типах рака и иммунотерапевтических агентах 3,4,5,6. Модели опухолей человека, включая ксенотрансплантаты, полученные из клеточной линии, и ксенотрансплантаты, полученные от пациента (CDX и PDX соответственно), хорошо растут у мышей с HIS и в большинстве случаев почти идентичны их росту у иммунодефицитного хозяина, лишенного гемопоэтического приживления человека 7,8. Основываясь на этом ключевом выводе, исследователи использовали мышиную модель HIS для изучения иммунотерапии человека, включая комбинированную терапию, предназначенную для изменения микроокружения опухоли (TME) для снижения иммуносупрессии и, таким образом, усиления иммунно-направленного уничтожения опухоли. Эти доклинические модели помогают решить проблемы гетерогенности рака человека, а также могут прогнозировать успех лечения, а также контролировать токсичность лекарств, связанных с иммунитетом 9,10.
Для получения мышиной модели с иммунной системой человека путем введения гемопоэтических стволовых клеток человека требуется мышь-реципиент с иммунодефицитом, которая не будет отторгать ксенотрансплантат. Современные модели мышей HIS получены из иммунодефицитных штаммов мышей, о которых сообщалось более 30 лет назад. Первым описанным иммунодефицитным штаммом мышей были мыши с ТКИД, у которых отсутствовали Т- и В-клетки11, за которыми следовал гибрид NOD-SCID с полиморфизмом SIRPα, ответственным за толерантность макрофагов мыши к клеткам человека, из-за повышенного связывания аллеля NOD SIRPα с молекулой CD47человека 12,13. В начале 2000-х годов делеция общей гамма-цепи рецептора IL-2 (IL-2Rγc) на штаммах с иммунодефицитом BALB/c и NOD изменила правила игры для усиленного приживления человека из-за генетических делеций, запрещающих развитие NK-клеток хозяина14,15,16,17. Альтернативные модели, такие как мыши BRG и NRG, достигают дефицита Т- и В-клеток путем делеции гена Rag1 или Rag2, необходимого для перестройки генов рецепторов Т- и В-клеток и, следовательно, созревания и выживания лимфоцитов18,19. Мышь BRGS (BALB/c -Rag2 nullIl2R γCnullSirpαNOD), используемая в настоящем описании, сочетает в себе дефицит цепи IL-2Rγ и аллель NOD SIRPα на фоне Rag2-/-, в результате чего мышь с высоким иммунодефицитом отсутствует без Т, В или NK-клеток, но с достаточной энергией и здоровьем, чтобы обеспечить долгосрочное приживление более 30 недель13.
Мыши HIS могут быть получены несколькими способами, при этом инъекция PBMC человека является наиболее прямым методом15,18,20. Тем не менее, у этих мышей наблюдается выраженная экспансия активированных Т-клеток человека, что приводит к реакции «трансплантат против хозяина» (РТПХ) к 12-недельному возрасту, что препятствует долгосрочным исследованиям. В качестве альтернативы, гемопоэтические стволовые клетки человека из пуповинной крови (КБ), костного мозга и печени плода также могут быть использованы для приживления и производства иммунной системы человека de novo. В этой системе гемопоэтические стволовые клетки продуцируют многолинейную иммунную систему человека с генерацией Т, В и врожденных иммунных клеток, которые, что важно, толерантны к мыши-хозяину, по сравнению с мышами PBMC, которые развивают в основном Т-клетки. Поэтому РТПХ отсутствует или сильно задерживается, и исследования могут быть распространены на мышей до 10-месячного возраста. CB обеспечивает простой, доступный и неинвазивный источник CD34+ гемопоэтических стволовых клеток человека, который облегчает приживление нескольких мышей HIS с генетически идентичной иммунной системой 17,18,20,21. За последние несколько лет модели мышей HIS широко использовались для изучения иммунотерапии и TME 3,4,5,6. Несмотря на развитие иммунной системы человека у этих мышей, опухоли ксенотрансплантата человека растут с той же скоростью по сравнению с контрольными иммунодефицитными мышами и допускают сложное взаимодействие между раковыми клетками и иммунными клетками, что важно для поддержания микроокружения привитого PDX 3,7,8 . Этот протокол был использован для проведения более 50 исследований, в которых тестировались методы лечения мышей HIS-BRGS с PDX и CDX. Важным выводом является то, что опухоли человека у мышей HIS сохраняют свой уникальный TME, определяемый молекулярной оценкой опухоли по отношению к исходному образцу пациента и характеристиками иммунного инфильтрата 3,22,23. Наша группа фокусируется на углубленной оценке ГИС как в иммунных органах, так и в опухоли с использованием многопараметрической проточной цитометрии. Здесь мы описываем протокол гуманизации мышей BRGS, оценку химеризма, имплантацию опухолей человека, измерения роста опухоли, назначение лечения рака и анализ клеток HIS с помощью проточной цитометрии.
протокол
Все работы с животными выполнялись в соответствии с протоколами на животных, одобренными Комитетом по уходу за животными и их использованию Университета Колорадо в Денвере (протоколы IACUC #00593 и #00021). Все работы с животными выполнялись в соответствии с Управлением ресурсов лабораторных животных (OLAR), аккредитованным Американской ассоциацией по уходу за лабораторными животными, в медицинском кампусе Университета Колорадо в Денвере. Все образцы пуповинной крови человека были получены в качестве донорства от неидентифицированных доноров и, таким образом, не подлежат утверждению комитетом по этике исследований на людях.
ПРИМЕЧАНИЕ: Композиции всех сред и растворов, упомянутых в протоколе, включены в дополнительный файл 1. На рисунке 1 показан общий протокол генерации и анализа иммунных ответов на опухоли у мышей HIS-BRGS.
1. Генерация мышей HIS
- Разведение мышей BALB/c -Rag2 null Il2RγCnull SirpαNOD (BRGS)
ПРИМЕЧАНИЕ: Этот штамм крайне иммунодефицитен, в нем нет Т, В или NK-клеток. Поэтому необходимо использовать строгие меры для предотвращения оппортунистических инфекций. Поддерживайте колонию на диете, содержащей триметоприм и сульфадиазин, по чередуя 2-недельный график с обычной диетой. Поддерживайте в помещении с максимально возможным уровнем предосторожности (например, в барьерном душевом помещении с ограниченным доступом).- Поддерживайте колонии гомозиготных мышей BALB/c -Rag2 null Il2RγC null Sirpα NOD (BRGS) и BALB/c Rag2 null Il2RγC null SirpaBalb/c (BRG) в качестве селекционеров.
- Разводить BRGS N/N×BRG B/B для получения щенков BRGSB/N, которые будут использоваться в качестве реципиентов стволовых клеток человека. В этой колонии BRGSB/N более здоровы, чем BRGS N/N, и приживаются на эквивалентных уровнях (больше, чем BRG).
- Выделение стволовых клеток человека CD34+ из пупочного CB
ПРИМЕЧАНИЕ: Для этой процедуры не используются антибиотики. Поэтому необходима хорошая стерильная техника.- Поместите коническую пробирку объемом 50 мл, а также 3 конические пробирки по 15 мл и ~10 пробирок по 50 мл в стерилизованный шкаф биобезопасности (BSC). Опрыскайте мешок для сбора крови 70% этанолом и дайте ему высохнуть в BSC.
- Рассчитайте количество конических пробирок объемом 50 мл, необходимых для изоляции градиента плотности CB = объем CB/15, округленное в большую сторону и до четного числа пробирок. Рассчитайте объем крови на пробирку = объем CB / количество пробирок. Осторожно налейте кровь из мешка CB в каждую коническую трубку; это максимум 15 мл на пробирку. Используйте автоматический пипеттор и серологическую пипетку объемом 25 мл, чтобы смешать кровь 1:1 со стерильным PBS путем пипетки вверх и вниз.
- Используйте автоматический пипеттор на низкой скорости и серологическую пипетку объемом 10 мл, чтобы медленно подложить кровь раствором градиента плотности комнатной температуры (RT) 1,077 г / мл (см. Таблицу материалов), не нарушая границу раздела. Следите за тем, чтобы наконечник пипетки не касался дна тюбика. Повторите для всех пробирок. Затем центрифугу в течение 30 мин при 850 x g, без торможения, при RT, чтобы обеспечить поддержание градиента плотности.
- Визуализируйте клеточную охристую шерсть поверх градиента плотности 1,077 г/мл в виде мутно-белого слоя. Удалите и отбросьте слой плазмы примерно на 10 мл выше охристой оболочки с помощью серологической пипетки объемом 25 мл и автоматического пипеттора.
- Соберите охристую шерсть стерильной переносной или серологической пипеткой. Используйте пипетку как шпатель, чтобы соскрести клетки со стороны конической трубки, отпуская колбу (или медленно пипетируя), чтобы вытянуть клетки. Объедините охристые покрытия из двух конических пробирок объемом 50 мл в одну новую коническую пробирку объемом 50 мл.
- Промойте клетки, налив 45 мл стерильного HBSS, содержащего 2% FBS, в каждую коническую пробирку. Центрифуга в течение 11 мин при 360 x g при RT.
- Аспирируйте промывочный материал до гранул во всех тюбиках. Используйте серологическую пипетку объемом 10 мл и автоматический дозатор для ресуспендирования первой гранулы в 10 мл HBSS, содержащей 2% FBS. Ресуспендируйте каждую гранулу в тех же 10 мл HBSS и промойте каждую пробирку дополнительными 10 мл HBSS, чтобы собрать все клетки в одну пробирку.
- Налейте 45 мл стерильного HBSS, содержащего 2% FBS, в коническую пробирку. Центрифуга в течение 10 мин при 360 x g, при 4 °C.
- Аспирируйте промывочный буфер вниз к грануле ячейки и ресуспендируйте гранулу в 20 мл буфера магнитного сепаратора ячеек (см. Таблицу материалов). Удалите небольшую аликвоту, чтобы подсчитать клетки с помощью гемацитометра в разведении 1:20 в метиленовом синем. Добавьте количество синих и белых ячеек. Центрифуга при 360 x g, в течение 10 мин при 4 °C.
ПРИМЕЧАНИЕ: В этом протоколе используется технология магнитных шариков (см. Таблицу материалов). Протокол может быть модифицирован для использования с любой технологией разделения клеток, с достаточной чистотой и выходом стволовых клеток CD34+. - Аспирируют надосадочную жидкость и ресуспендируют гранулу CD34+ клеток, выделенную из пуповинной крови, в 300 мкл буфера магнитного сепаратора клеток на 1 x 108 клеток. Сначала добавьте 100 мкл реагента, блокирующего FcR, а затем 100 мкл магнитных шариков CD34+ на 1 x 108 ячеек. Инкубировать при 4 °C в течение 30 мин (без льда).
- Добавьте 5 мл буфера сепаратора магнитных ячеек на 1 x 108 ячеек и вращайте при 360 x g в течение 10 мин при 4 ° C. Повторите этап промывки и ресуспендируйте гранулу в 500 мкл буфера-сепаратора магнитных ячеек на 1 x 108 ячеек в конической пробирке объемом 15 мл с маркировкой «нефракционированная».
- Пометьте еще две конические трубки по 15 мл «CD34-» и «CD34+». Поместите три конические пробирки объемом 15 мл (нефракционированные, CD34- и CD34+) в пазы A1, B1 и C1 соответственно на охлаждающей стойке (см. Таблицу материалов). Разделите ячейки с помощью двухколоночной программы положительного отбора на автоматическом магнитном сепараторе ячеек (см. Таблицу материалов) в BSC в соответствии с инструкциями производителя прибора.
- Расширение и замораживание CD34+ стволовых клеток человека
- Аликвотируйте 10 мкл восстановленной клеточной суспензии CD34+ (2 мл) на предметном стекле гемоцитометра и подсчитайте клетки под 10-кратным увеличением. Рассчитайте общее количество клеток CD34+, умножив количество ячеек на 2 x 104. Разделите общее количество клеток CD34+ на 250 000, чтобы рассчитать количество флаконов для замораживания (50 000 клеток на детеныша мыши до расширения in vitro ).
- Приготовьте CB medium 10% FCS Iscove (плюс 1 мл дополнительно для потери фильтрации), дополненный 40 нг / мл фактора стволовых клеток, 20 нг / мл Flt3L и 10 нг / мл IL-6, и пропустите через фильтр 0,22 мкм. Ресуспендируют клетки CD34+ при 100 000 на мл среды CB и инкубируют при 37 ° C. На 3-й день добавляют эквивалентный объем среды ХБ без цитокинов в колбу, содержащую клетки, и среду ХБ с цитокинами.
ПРИМЕЧАНИЕ: Добавление этих цитокинов в среду CB способствует выживанию и экспансии клеток CD34+, предотвращая дифференцировку. - Соберите расширенные клетки CD34+ на 5-й день. Пипеткой суспензию клеток вверх и вниз и соберите в коническую пробирку объемом 50 мл. Добавьте достаточное количество CB medium, чтобы покрыть дно колбы. С помощью клеточного скребка соскребите все дно колбы. Соберите все среды в одну и ту же пробирку объемом 50 мл и центрифугу при 360 x g в течение 11 минут.
- Ресуспендируют клетки в 2 мл среды CB. Сохраните последнюю каплю из пипетки в 96-луночную пластину для подсчета. Разбавьте клетки 1:1 трипановым синим и добавьте 10 мкл в гемацитометр, затем подсчитайте и усредните клетки из четырех квадрантов. Рассчитайте общее количество клеток CD34+, умножив количество клеток на 4 x 104, и запишите жизнеспособность.
- Сделайте n+1 мл замораживающей среды, где n - количество замораживающих флаконов, рассчитанное на шаге 1.3.1. Приготовьте морозильную среду, добавив 10% (об. / об.) ДМСО в FBS и держите на льду. Пометьте криовиалы CB#, CD34+ d5 и датой.
- Отжимайте клетки CD34+ при 360 x g в течение 10 мин при 4 ° C. Аспирируйте среду вниз к грануле и ресуспендируйте гранулу ячейки в морозильной среде. Аликвотируйте 1 мл клеточной суспензии на каждый флакон и равномерно разделите остаток между флаконами. Добавьте флаконы в морозильную камеру изопропанола, охлажденные до 4 ° C, поместите при -80 ° C и переведите на жидкий азот для хранения в течение >90 дней.
- Облучение детенышей мыши
- Соберите щенков BRGSB/N через 1-3 дня после рождения в автоклавную пластиковую коробку с набивкой. Добавьте небольшое количество подстилки вместе со щенками. Пометьте коробку номером клетки и количеством щенков.
- Настройте облучатель (см. Таблицу материалов) на дозу 300 рад. Поместите коробку с щенками в облучатель и подвергните их воздействию 300 рад. Отнесите щенков обратно в клетку, сложите их в кучу и накройте подстилкой.
- Инъекции щенков и подготовка клеток CD34+
- Начало подготовки клеток CD34+ через ~3 ч после облучения. Нагрейте 10 мл среды CB в конической пробирке объемом 50 мл. Выполняйте все действия в стерильном BSC.
- Извлеките один флакон in vitro расширенных и замороженных клеток CD34+ на каждые четыре-шесть щенков для инъекции. Быстро разморозьте при 55 ° C, пока не станет видно небольшое количество льда, и добавьте клетки в нагретую среду CB (флакон все еще должен быть прохладным на ощупь). Используйте 1 мл среды для ополаскивания каждого флакона и вращайте клетки при 360 x g в течение 12 мин при 4 ° C.
ПРИМЕЧАНИЕ: Было обнаружено, что быстрое оттаивание при 55 ° C дает лучшую жизнеспособность клеток (90% -95%), чем оттаивание при 37 ° C. - Тщательно аспирируйте среду. Ресуспендируйте (небольшую) гранулу в 2 мл среды CB, осторожно перемешайте и добавьте ~ 30 мкл клеточной суспензии в одну лунку в счетной пластине. Разбавьте 1:1 трипановым синим, затем добавьте 10 мкл в гемоцитометр и подсчитайте и усредните клетки из четырех квадрантов.
- Рассчитайте общее количество клеток CD34+, умножив количество клеток на 4 x 104 , а затем запишите жизнеспособность. Отжим при 360 x g в течение 12 мин при 4 °C.
- Осторожно аспирируйте среду и ресуспендируйте клеточную гранулу в 100 мкл стерильного PBS на n + 1 детенышей для инъекции, в результате чего получается 250 000-450 000 клеток CD34 + на мышь. Поместите коническую трубку на лед в транспортный контейнер и отправляйтесь в виварий для инъекции щенка.
- Принесите в виварий BSC тепловую лампу, подгузники, шприц объемом 1 мл, иглу 18 г, иглу 30 г и клеточный препарат CD34+ в стерильных контейнерах. Поместите стерильный подгузник на ~ 2 фута под нагревательную лампу. Достаньте клетку с подстилкой, которую нужно впрыснуть, и поместите ее в BSC.
- Соберите шприц со скошенной иглой 18 G. Совместив угол наклона конической трубки со скосом иглы, аккуратно перемешайте и вытяните клеточную суспензию. Положите щенков на подгузник, чтобы они согрелись (следите за перегревом). Удалите воздух из шприца и замените иглу 18 G на иглу 30 G, а затем осторожно нажимайте на шприц, пока суспензия клеток не окажется прямо на кончике иглы.
ПРИМЕЧАНИЕ: В качестве альтернативы можно использовать инсулиновый шприц. - Отводите по одному щенку к краю подгузника подальше от нагревательной лампы. Обездвижите щенка на боку под большим и указательным пальцами, чтобы было хорошо видно лицо. Обратите внимание на вену поперек щеки под тем местом, где будет ухо. Введите иглу неглубоко в ближайшую к глазу вену (IV) и медленно введите 50 мкл клеток.
- Проверьте, не образуется ли пузырь от подкожной инъекции. Если это так, вставьте иглу глубже и приступайте к введению клеток. Небольшая капля крови/гематомы будет видна при успехе.
ПРИМЕЧАНИЕ: Обратитесь к процедуре Gombash Lampe et al.24 в отношении инъекции щенков. - Когда щенок все еще обездвижен, выполните внутрипеченочную инъекцию (ИГ) еще 50 мкл клеток (всего 100 мкл на щенка IV+ИГ). Печень можно визуализировать как темное пятно между белой молочной лентой и грудной клеткой. Положите инъецированного щенка на подгузник подальше от непривитых щенков и нагрейте.
ПРИМЕЧАНИЕ: Внутривенная инъекция приводит к лучшему долгосрочному химеризму, чем только инъекция ИГ25, но внутривенные инъекции не всегда успешны. Таким образом, разделение инъекции между внутривенными и ИГ обеспечивает приживление у большего процента мышей. - Повторите инъекции в лицевую вену и ИГ для всех щенков. Счистите кровь, верните детенышей в гнездо в клетке и накройте подстилкой.
2. Тестирование химеризма человека в крови
- Тест химеризма в крови мышей HIS в возрасте 10 и 14 недель. Соберите 50 мкл крови через ретроорбитальную вену или с помощью альтернативного метода, одобренного IACUC.
- При ретроорбитальных кровотечениях обезболивайте мышей испарителем изофлурана, установленным на 5, в течение 1-2 минут, а затем уменьшите настройку испарителя до 4. При необходимости выключите испаритель, чтобы мыши оставались достаточно насыщенными кислородом во время анестезии. Не держите мышей под изофлураном более 5 мин.
- Поместите нос анестезированной мыши в носовой конус испарителя изофлурана и поместите каплю анальгетика (0,5% офтальмологического раствора пропаракаина HCl USP) на глаз.
- Через 1 минуту удалите пропаракаин с помощью стерильной марли, проптовысьте глаз и вставьте 75-миллиметровую гепаринизированную гематокритную трубку ретроорбитально, чтобы собрать 50 мкл крови. Вытолкните кровь в микропробирку объемом 1,5 мл, содержащую 50 мкл гепарина, и осторожно перемешайте.
- Зажмите закрытый глаз стерильной марлей, чтобы остановить кровотечение, и нанесите каплю пропаракаина. Извлеките мышь из изофлурана и восстановите в чистой клетке.
- Выделение PBMC из крови мыши
- Смешайте кровь / гепарин, осторожно пипеткой вверх и вниз и медленно наложив сверху 500 мкл градиента плотности 1,077 г / мл, стараясь не нарушить границу раздела. Центрифугируйте пробирки при 1,220 x g в течение 20 мин при RT без тормозов.
- Визуализируйте клеточную охристую шерсть в виде облачного слоя поверх градиента плотности 1,077 г/мл под плазмой. Удалите как можно больше клеток из охристой оболочки с помощью пипетки объемом 200 мкл и добавьте в новые пробирки объемом 1,5 мл, содержащие 750 мкл питательной среды. Центрифуга при 360 x g в течение 11 мин при RT.
- Аспирируйте среду до 50 мкл и ресуспендируйте гранулы в 750 мкл питательной среды. Центрифугу при 360 x g в течение 10 мин при 4 °C и снова аспирируйте до 50 мкл. Клетки готовы к ресуспендированию в поверхностном окрашивании.
- Поверхностное окрашивание и проточный цитометрический анализ
- Заполните рабочий лист окрашивания панели (таблица 1; рабочий лист «Панель кровопускания спектрального потока») с номерами мыши и приготовьте коктейль для окрашивания антител, добавив все флуоресцентные антитела в буфер для окрашивания (дополнительный файл 1). Сделайте макет пластины, чтобы добавить образцы в 96-луночную U-образную нижнюю пластину. Разметьте днища скважин с помощью перманентного маркера. Титруют антитела с использованием стандартной процедуры перед окрашиванием для определения соответствующей концентрации26.
- Добавьте 62 мкл коктейля для поверхностных пятен в каждую лунку 96-луночной U-образной нижней пластины. Ресуспендируют клетки в 50 мкл, оставшихся в пробирке, и добавляют каждый образец в соответствующую лунку. Включите лунку для положительного контроля окрашивания (человеческие PBMC + спленоциты мыши, 1 x 106 клеток каждая) для окрашивания рядом с образцами. Смешайте пипеткой и инкубируйте смесь в течение 15 минут при температуре 4 °C.
- Центрифуга при 680 x g в течение 3 мин при 4 °C. Вылейте пластину в раковину, чтобы удалить надосадочную жидкость, и промойте клетки, ресуспендируя в 150 мкл окрашивающего буфера путем осторожного пипетирования ~ 10x. Отжим и ресуспендирование каждой лунки в 150 мкл окрашивающего буфера.
- Соберите данные для 100 мкл каждого образца на проточном цитометре (см. Таблицу материалов) и экспортируйте файлы .fcs. Импортируйте файлы .fcs в программное обеспечение для редактирования данных потока (см. Таблицу материалов). Примените полигональные ворота к графику FSC-A x SSC-A, окружающему ячейки, исключая любой мусор. Выделите ячейки внутри ворот (см. Таблицу 1; «Стробирование стравливания спектрального потока»).
- Измените оси на (FSC-A x FSC-H) и затворите ячейки, содержащиеся на линейной диагонали, исключая дублеты, выступающие из линии. Выделите эти ячейки и измените оси на (hCD45 x mCD45).
- Примените полигональные ворота к популяции hCD45+ и примените имя «человек». Примените полигональный вентиль к популяции mCD45+ и примените имя «мышь». Создайте статистику подсчета как для людей, так и для мышей.
- Выберите человеческую популяцию и измените оси на (CD19 x CD3). Примените полигональные ворота к ячейкам CD19+ и назовите их «B-ячейками». Примените полигональные ворота к популяции CD3+ и назовите его «Т-клетки». Примените полигональные ворота к двойной отрицательной популяции и назовите ее «NonTB».
- Выберите популяцию Т-клеток и измените оси на (CD8 x CD4). Примените полигональные ворота к положительным популяциям CD4 и CD8 и назовите их «CD4+» и «CD8+» соответственно.
- Выберите популяцию, не связанную с туберкулезом, и измените оси на (CD56 x миелоид). Примените полигональные ворота к общей популяции CD56, включая двойные положительные события, и назовите их «NK-клетками». Примените полигональные ворота к CD56-отрицательной и миелоидно-положительной популяции и назовите ее «миелоидной».
- Создайте таблицу для процентной и подсчитываемой статистики всех популяций и экспортируйте ее в программное обеспечение для работы с электронными таблицами (см. Таблицу материалов). Рассчитайте химеризм %hCD45 = %hCD45/(%hCD45 + mCD45).
- Исключите мышей HIS, которые содержат <20% hCD45+ (mCD45 + hCD45) для дальнейших экспериментов.
ПРИМЕЧАНИЕ: В этом исследовании PBMC были приготовлены с использованием разделения градиента плотности 1,077 г / мл для более чистого истощения эритроцитов. Эта процедура исключила гранулоциты человека и мыши из слоя PBMC. В качестве альтернативы можно использовать лизис эритроцитов.
3. Инъекция опухолей мышам
- Перед инъекцией опухоли подтвердите количество Т-клеток по данным 14-недельного кровотечения. Опухоли вводят, чтобы быть готовыми к сбору между 20-26 неделями, если Т-клетки составляют >20%, и между 24-28 неделями, если Т-клетки составляют <20% от общей популяции иммунных клеток. Такое время инъекции гарантирует, что мыши находятся в возрасте 20-28 недель и имеют достаточное количество Т-клеток в конце исследования.
- Инъекция ксенотрансплантатов, полученных из клеточной линии (CDX)
ПРИМЕЧАНИЕ: Процедура описана с использованием клеток аденокарциномы молочной железы MDA-MB-231 (см. Таблицу материалов) в качестве примера.- Разморозьте аликвоту замороженных клеток, промойте 1 раз, ресуспендируя в 10 мл DMEM с добавлением 10% FBS, 1% PenStrep и 1% заменимых аминокислот, и центрифугу при 360 x g в течение 10 мин при 4 ° C. Аспирировать среду и ресуспендировать в 10 мл DMEM с добавлением 10% FBS, 1% PenStrep и 1% заменимых аминокислот в колбе T25 и инкубировать при 37 ° C с 5% CO2.
ПРИМЕЧАНИЕ: Клеточные линии аутентифицируются с помощью ПЦР для обеспечения правильного типа клеток. Клеточные надосадочные жидкости проверяются на микоплазму с помощью биохимического анализа перед инъекцией. - Проход и расширение клеток во время фазы экспоненциального роста при слиянии около 80%.
- Аспирировать среду, промыть клетки 5-10 мл стерильного PBS (рН 7,2) и инкубировать с 1 мл 0,25% трипсина-ЭДТА в течение 1-5 мин до отрыва клеток от колбы.
- Добавьте 5 мл того же ДМЭМ и перемешайте, пипеткой вверх и вниз. Поместите все 6 мл клеточной суспензии в новую колбу T75, обработанную тканевой культурой (разведение 1:3), и добавьте еще 10 мл DMEM.
- Прохождение клеток каждые 2-3 дня при 80% слиянии при разбавлении 1:3 в DMEM для расширения клеток.
- Соберите клетки с 0,25% трипсина-ЭДТА во время фазы экспоненциального роста в течение шести пассажей и промойте PBS. Смешайте PBS и экстракт базальной мембраны (см. Таблицу материалов) в соотношении 1:1 и добавьте в клетки в конечной концентрации 5 x 107 клеток/мл.
- Обезболивайте мышей изофлураном, как описано на шаге 2.1.1. Подкожно вводят 100 мкл (5 x 106 клеток) суспензии опухолевых клеток в каждую сторону с помощью иглы 23 G.
- Разморозьте аликвоту замороженных клеток, промойте 1 раз, ресуспендируя в 10 мл DMEM с добавлением 10% FBS, 1% PenStrep и 1% заменимых аминокислот, и центрифугу при 360 x g в течение 10 мин при 4 ° C. Аспирировать среду и ресуспендировать в 10 мл DMEM с добавлением 10% FBS, 1% PenStrep и 1% заменимых аминокислот в колбе T25 и инкубировать при 37 ° C с 5% CO2.
- Выполните инъекцию ксенотрансплантатов пациента (PDX) с использованием троакаров. Процедура впрыска и другие инструкции по разработке и обслуживанию модели PDX доступны в литературе27.
4. Измерение роста опухоли
- Проверяйте прогресс опухоли один раз в неделю после имплантации, ощупывая вдоль бока рост опухоли. Как только опухоли прощупываются, обезболите мышей изофлураном (как описано на шаге 2.1.1) и побрейте каждую сторону электрическим триммером, заботясь об опухоли, чтобы предотвратить изъязвления по мере роста опухоли.
ПРИМЕЧАНИЕ: Мышей можно брить перед инъекцией опухоли, чтобы предотвратить травмы кожи вокруг опухолей; Тем не менее, скорость роста волос может препятствовать измерениям опухоли. - Измеряйте длину и ширину опухолей два раза в неделю с помощью штангенциркуля и записывайте измерения в мм. Сообщайте об измерениях опухоли в виде объема опухоли (мм3), используя формулу
 . Следите за тем, чтобы опухолевая нагрузка не превышала 2000 мм3 на одну опухоль или общий объем 3000мм3.
. Следите за тем, чтобы опухолевая нагрузка не превышала 2000 мм3 на одну опухоль или общий объем 3000мм3.
ПРИМЕЧАНИЕ: Рекомендации по использованию мышей в исследованиях рака варьируются в зависимости от местоположения. Пожалуйста, ознакомьтесь с политикой ухода за животными и их использования в учреждении исследователя.
5. Медикаментозное лечение
- Распределите мышей HIS в эквивалентные группы лечения на основе химеризма hCD45, химеризма hCD3 и химеризма hCD8. Как только опухоли достигнут в среднем 100мм3 , начинают медикаментозное лечение.
ПРИМЕЧАНИЕ: Количество мышей в группе основано на количестве мышей HIS, сгенерированных из CB. Рекомендуется минимум четыре мыши в группе. Недвудольное многогрупповое сопоставление (например, в программном обеспечении R-vivo Manila) полезно для этой группировки28. - Путь и частота приема лекарств
- Вводите ингибиторы анти-PD-1 (ниволумаб, пембролизумаб) внутриперитонально (внутривенно) по 30 мг / кг 1 раз в неделю или 20 мг / кг 2 раза в неделю для однократного лечения или 10-15 мг / кг 2 раза в неделю для комбинированного лечения.
- Дозируйте комбинированную терапию, такую как таргетная терапия, химиотерапия и облучение, в соответствии с планом эксперимента. Таргетная терапия и химиотерапия могут проводиться через пероральный зонд, внутривенные инъекции или пищу.
ПРИМЕЧАНИЕ: Дозы могут варьироваться и оптимизироваться в соответствии с опубликованными данными и моделью опухоли. Исследования доз часто тестируются на реципиентах с иммунодефицитом до исследований HIS на мышах.
- Следите за мышами не реже 3 раз в неделю на предмет изменений в состоянии здоровья, таких как потеря веса, рыхлые фекалии, сгорбленная осанка, снижение подвижности и потеря шерсти. Некоторые симптомы могут быть признаками токсичности лекарств или РТПХ, и дозировку препарата может потребоваться уменьшить или прекратить. Усыпляйте мышей по мере необходимости в соответствии с политикой ухода за животными и их использования.
6. Забор тканей и опухолей мыши в конце исследования
- Усыпляют мышей по отдельности в соответствии с институциональными и ветеринарными рекомендациями, используя сжатый газ CO 2 с расходом 2,75 л / мин. Наблюдайте за мышами, содержащимися в CO2, в течение 1 минуты после смерти, а затем выполняйте вывих шейки матки в качестве вторичной формы эвтаназии.
- Забор крови
- Соберите кровь с помощью внутрисердечной пункции. Держите мышь в вертикальном положении и вставьте шприц объемом 1 мл с иглой 25 G прямо в сердце с линии, расположенной слева от средней линии и ниже ребер. Соберите кровь в шприц, в идеале через один длинный забор и переложите в маркированную пробирку объемом 1,5 мл.
ПРИМЕЧАНИЕ: Дополнительные вставки игл могут быть выполнены для тщательного сбора дополнительной крови из углов полости легкого. - Оставьте кровь при температуре 4 °C на 1 ч, затем центрифугируйте кровь в микроцентрифуге в течение 6 мин при 7 800 x g. Соберите прозрачную жидкость (сыворотку) над границей раздела крови во вторую чистую и маркированную пробирку объемом 1,5 мл. Храните сыворотку при температуре -20 °C для последующего анализа, например, для анализа воспалительных цитокинов человека и мыши или титров иммуноглобулинов.
- Соберите кровь с помощью внутрисердечной пункции. Держите мышь в вертикальном положении и вставьте шприц объемом 1 мл с иглой 25 G прямо в сердце с линии, расположенной слева от средней линии и ниже ребер. Соберите кровь в шприц, в идеале через один длинный забор и переложите в маркированную пробирку объемом 1,5 мл.
- Рассечение тканей
- После инъекции и роста опухолевых клеток у мышей и введения медикаментозного лечения собирают ткани. Поместите мышей на доску для рассечения пенопласта со штифтами, чтобы удерживать их на месте, а руки и ноги вытянуть под углом 45 °. Сделайте разрез посередине туловища, начиная с таза и доходя до подбородка, стараясь не резать брюшину (хотя это не обязательно). Подтяните кожу к краю и удерживайте на месте булавками.
- Извлеките лимфатические узлы (ЛН) с помощью тонких щипцов в следующем порядке: паховые, подмышечные, шейные, брыжеечные, пищеводного отверстия диафрагмы.
ПРИМЕЧАНИЕ: У мышей HIS LN часто очень маленькие, напоминающие анлаж, или «воспаленные» с отчетливым внешним видом, в отличие от мышей дикого типа. Поэтому из каждого участка берется ткань, напоминающая LN. Периферические LN часто выглядят как заполненные жидкостью «шарики», в то время как брыжеечные LN более плотные. Брыжеечные LN являются наиболее очевидными и последовательными и наблюдаются как один или два отдельных более плотных узла, в отличие от струны. - Поместите LN на одну сторону предметных стекол из матового стекла в 8 мл питательной среды в чашке Петри. Держа предметные стекла под перпендикулярными углами матовыми краями внутрь, аккуратно прижимайте ткани до тех пор, пока клеточное содержимое не освободится.
- Промойте предметные стекла несколько раз, раздвинув их и вместе, чтобы освободить максимальное количество ячеек. Соберите клетки с помощью стеклянной пипетки диаметром 5 дюймов и отфильтруйте их через пипетку с ватной пробкой диаметром 9 дюймов в коническую пробирку объемом 15 мл с маркировкой.
- Извлеките селезенку из верхней левой части живота с помощью двух пар щипцов или щипцов и ножниц. Обратите внимание на размер селезенки как оценку объема ресуспендированной среды. Собирайте и фильтруйте селезенку путем механического разложения с использованием предметных стекол с матовым стеклом, как в случае с LN.
ПРИМЕЧАНИЕ: Можно использовать любую методику подготовки тканей к одноклеточным суспензиям. - Выполните подсчет и ресуспендирование клеток из образцов тканей, как описано ниже.
- Центрифугируйте лимфатические клетки в дозе 360 x g в течение 10 мин при 4 °C. Аспирируйте жидкость и ресуспендируйте клеточную гранулу в 1 мл уборочной среды с ДНКазой.
- Удаляют эритроциты из клеток селезенки путем инкубации с 3 мл буфера для лизиса ACK при RT в течение 3 мин с последующим добавлением 10 мл питательной среды/ДНКазы. Снова центрифугируйте клетки селезенки, аспирируйте надосадочную жидкость и ресуспендируйте клетки в 1-10 мл питательной среды/ДНКазы в зависимости от размера селезенки (например, 1 мл для очень маленьких селезенок и до 10 мл для самых больших селезенок).
- Добавьте аликвоту 10 мкл клеточной суспензии к 90 мкл среды и рассчитывайте на гемоцитометре. Центрифугируют LN и клетки селезенки, аспирируют надосадочные жидкости и ресуспендируют клетки в собираемой среде в концентрации 1 x 10-8 клеток/мл или минимум 80 мкл.
- Извлеките опухоли.
- Удалите опухоль с открытого бока, удерживая опухоль щипцами, медленно разрезая края опухоли диссекционными ножницами.
- После удаления опухоли взвесьте ее и удалите 1/4 для обработки РНК и иммуногистохимии (IHC). Разделите 1/4 опухоли пополам; поместить одну половину (1/8 всей опухоли) в криовальную камеру, мгновенно заморозить в жидкости N2 и хранить при -80 °C для последующих геномных исследований.
- Поместите другую 1/8 опухоли в меченую пробирку для образца, содержащую 10% формалина. На следующий день промойте и ресуспендируйте салфетку в 70% этаноле до будущего использования. Поместите оставшиеся 3/4 опухоли в 6-сантиметровую посуду и измельчите на кусочки ~1 мм с помощью лезвия скальпеля.
- Транспортируйте кусочки опухоли в диссоциационную трубку (см. Таблицу материалов), промойте посуду 5 мл неполной среды, инфильтрирующей опухоль лейкоцитов (TIL), и добавьте в диссоциационную трубку.
ПРИМЕЧАНИЕ: При опухолях массой >0,4 г промыть посуду 10 мл неполной среды TIL и добавить в диссоциационную трубку. - Добавьте препарат коллагеназы (см. Таблицу материалов) в конечной концентрации 50 мг/мл в ткань в диссоциационной трубке. Диссоциируют ткань с помощью механической диссоциации при 37 ° C в течение от 30 мин до 1 ч, в зависимости от твердости опухоли.
- После диссоциации пропустите суспензию через фильтр размером 100 мкм в коническую трубку объемом 50 мл и промойте фильтр 10 мл полной среды TIL. Сыворотка в этой среде остановит реакцию коллагеназы и защитит клетки от дальнейшей деградации.
- Центрифугу одноэлементной суспензии при 360 x g в течение 10 мин при 4 °C. Ресуспендируйте гранулы в достаточно питательной среде с помощью ДНКазы, чтобы клеточная суспензия могла легко пройти через наконечник пипетки P1000 и записать объем для последующего анализа.
ПРИМЕЧАНИЕ: Меньший объем увеличивает сбор опухолевых иммунных клеток, но более восприимчив к засорению проточного цитометра.
7. Окрашивание клеток и проточные цитометрические анализы
- Подготовка пятен и покрытие ячеек
- Приготовьте коктейли для окрашивания: в день сбора урожая добавьте количество образцов в рабочий лист окрашивания (таблица 2; Рабочие листы «Панель обычного потока A», «Панель спектрального потока B» и «Панель обычного потока C») для всех пятен и печати. Приготовьте коктейли для окрашивания пятен A и B в окрашивающем буфере (SB), добавив каждое антитело по отдельности с новым наконечником, пометив каждый реагент на ходу, и храните при температуре 4 ° C до тех пор, пока не понадобится. Приготовьте соответствующие жизнеспособные красители в PBS, не содержащем азидов, и храните при температуре 4 °C до тех пор, пока они не понадобятся (перед использованием нагрейте до RT). Приготовьте коктейль поверхностного окрашивания C на 2-й день в SB вместе с внутриклеточными пятнами B и C в соответствующих буферах пермеабилизации.
- Создайте макет планшета для всех образцов в листе окрашивания и отдайте в лунки 100 мкл ПБС, не содержащего азидов. Включите неокрашенный контроль для каждой ткани и окрашивания (для спектральной цитометрии).
- Добавьте клетки в 96-луночные планшеты, содержащие 50 мкл PBS. Для окрашивания А ресуспендировать каждую группу тканей в соответствующем объеме, как указано на листе окрашивания, и хранить при температуре 4 ° C до получения на проточном цитометре в тот же день. Для окрашиваний B и C добавьте 25 мкл лимфы и 60 мкл клеточных суспензий, не относящихся к лимфатической ткани, в лунки с PBS.
- Проводят in vitro стимуляцию цитокинов для выявления путем внутриклеточного окрашивания с использованием красителя С.
- Центрифугируйте 96-луночную пластину с пятном C с шага 7.1.3 при 680 x g в течение 3 мин при 4 °C. Добавьте 200 мкл полной среды TIL (RPMI 1640, 10 мМ HEPES [pH 7], 10% FBS) в каждую лунку. Храните пластину с клеточной суспензией при температуре 4 °C в течение ночи.
- Рано утром следующего дня разбавьте коктейль для стимуляции клеток (см. Таблицу материалов) в соотношении 1:500 на полном носителе TIL. Центрифугируйте пластину, содержащую суспензию ячеек при 680 x g , чтобы гранулировать ячейки, и щелкните, чтобы удалить среду. Ресуспендируют клетки в 200 мкл приготовленного коктейля для стимуляции клеток и инкубируют при 37 °C в течение 1 ч.
- Добавьте 25 мкл раствора ингибитора транспорта белка, содержащего монензин, в разведении 1:1000 в полной среде TIL, перемешайте клетки и инкубируйте при 37 ° C в течение дополнительных 4 часов, чтобы обеспечить внутриклеточное накопление цитокинов.
- Выполните окрашивание клеток.
- Для пятен А и В (1-й день) и для пятен С (2-й день) центрифугу при 680 х г в течение 3 мин при 4 °С. Переверните пластины и добавьте в лунки соответствующие красители. Хорошо перемешайте, аккуратно пипеткой вверх и вниз с помощью многоканальной пипетки, и выдерживайте в течение 15 минут при ЛТ.
- Центрифугируйте пластины (как на шаге 7.1.5.1), затем добавьте соответствующие поверхностные пятна на пластины и аккуратно перемешайте путем пипетки многоканальной пипеткой. Инкубировать в течение 15 минут при 4 ° C и снова центрифугировать. Переверните пластины, промойте клетки, аккуратно пипетируя вверх и вниз 150 мкл SB и центрифугу.
- Переверните пластины, повторите стирку, осторожно пипеткой вверх и вниз с 150 мкл SB, и центрифугу при 680 x g в течение 3 мин при 4 ° C. Для окрашивания А ресуспендируйте каждую группу тканей в соответствующем объеме, как указано на листе окрашивания, и храните при температуре 4 °C. Для пятна B зафиксируйте с помощью фиксатора набора факторов транскрипции FoxP3 (см. Таблицу материалов) в течение 30 минут при RT. Для окрашивания С зафиксируйте в 1% (об./об.) параформальдегид в SB в течение 30 мин при RT.
- Центрифугируйте неподвижные пластины при 480 x g в течение 3 мин при 4 °C. Стирка 1x в SB. Для пятна B клетки можно оставить на ночь.
- Пермеабилизация клеток: ресуспендирование лунок в 150 мкл буфера для пермеабилизации набора факторов транскрипции FoxP3 для окрашивания B и в 0,5% (мас./об.) сапонина в SB для окрашивания C. Инкубировать в течение 15 мин при ЛТ. Центрифугировать неподвижные пластины при 480 x g в течение 3 мин при 4 °C.
- Переверните пластины и добавьте соответствующие коктейли для внутриклеточного окрашивания для окрашивания В и С. Инкубируйте в течение 30 минут при ЛТ.
- Центрифугируйте неподвижные пластины при 480 x g в течение 3 мин при 4 ° C и перелистывайте пластины. Промойте клетки 150 мкл соответствующих буферов пермеабилизации (окрашивание B, буфер пермеабилизации набора факторов транскрипции FoxP3; окрашивание C, сапонин).
- Переверните пластины и промойте пипеткой вверх и вниз в 150 мкл SB. Центрифуга при 480 x g в течение 3 мин при 4 °C. Переверните пластины и ресуспендируйте клетки в SB по группам тканей в соответствующих объемах, указанных на листе окрашивания.
ПРИМЕЧАНИЕ: В настоящее время образцы готовы к получению с помощью спектральной проточной цитометрии. - Установите проточный цитометр (см. Таблицу материалов) с соответствующими элементами управления одиночным окрашиванием для каждого окрашивания и неокрашенными образцами для каждой группы тканей, чтобы учесть различия в автофлуоресценции во время разменивания. Получите соответствующие объемы для каждой группы тканей, как определено на листе окрашивания (таблица 2), и экспортируйте файлы .fcs.
- Анализ данных проточной цитометрии
- С помощью программного обеспечения для анализа проточной цитометрии (см. Таблицу материалов) создайте новое рабочее пространство. Создайте новые группы для каждого органа (LN, селезенки и TIL). Импортируйте FCS-файлы для каждого органа в группу.
- Создайте двумерную точечную диаграмму, установите для осей значение (FSC-A x SSC-A) и примените полигональный вентиль к клеточным событиям, избегая событий на ребрах (все ячейки затворяют). Выберите события ячеек, измените оси на (FSC-A x FSC-H) и примените полигональный вентиль к событиям на линейной диагонали, исключив события, которые отклоняются от диагонали для создания «синглетного» вентиля. Выберите затвор «синглеты» и измените оси на (hCD45 x mCD45). Примените полигональные вентили к положительным событиям hCD45 и mCD45 и назовите их «человек» и «мышь» соответственно.
- Выберите человеческую популяцию и измените ось Y на Живую/Мертвую Воду. Примените полигональные ворота к живой / мертвой отрицательной популяции hCD45 и назовите ее «живым человеком». Выберите популяцию мыши и измените ось X на Live/Dead Aqua. Примените полигональные ворота к живой / мертвой отрицательной популяции mCD45 и назовите ее «живой мышью».
- Аналогичным образом выберите родительский затвор и оси X и Y, как описано в рабочих листах «Обычное стробирование потока A», «Стробирование спектрального потока B» и «Обычное стробирование потока C» (таблица 2), чтобы изолировать указанные популяции (например, В-клетки человека, активированные Т-клетки).
ПРИМЕЧАНИЕ: Репрезентативные ворота для каждого пятна (кровотечение, A, B, C) включены в дополнительный файл 2. - Создавайте таблицы подсчета и экспорта частоты в программном обеспечении для анализа проточной цитометрии для всех групп населения и экспортируйте их в программное обеспечение для работы с электронными таблицами. Родительская популяция для частот указана в таблице 2.
- Используйте данные для создания графиков на основе экспериментальных групп лечения.
ПРИМЕЧАНИЕ: Данные также могут быть проанализированы с помощью пакетов R в программном обеспечении для анализа. С помощью функции объединения можно создать один файл .fcs из всех анализируемых образцов. Эти данные могут быть уменьшены по размерам с помощью алгоритма T-SNE при добавлении параметров ключевых слов для типа ткани и группы лечения. Затем алгоритм FlowSOM можно использовать для кластеризации популяций, а инструмент ClusterExplorer можно использовать для идентификации популяций. Новые клеточные популяции могут быть идентифицированы таким образом, визуально сравнены и количественно определены между группами лечения или в различных тканях. - Сопоставьте иммунные параметры опухолей в одной и той же группе лечения с ростом этой опухоли, чтобы определить иммунотипы, которые коррелируют с ингибированием роста опухоли. Количественно определите рост опухоли по удельной скорости роста (SGR) для этой опухоли, измерению, которое учитывает разницу в объемах опухоли за определенное время. Это измерение нормализует опухоли, собранные в разные дни из-за здоровья мышей и дат начала лечения.
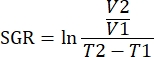
Результаты
В соответствии с протоколом опухоли на боку и экспериментальной временной шкалой (рис. 1) рост опухоли и иммунный ответ на терапию таргетным ингибитором тирозинкиназы (ИТК) и комбинированное лечение ниволумабом были изучены в двух различных PDX колоректального рака чело?...
Обсуждение
За последние 6 лет, используя наш опыт как в области иммунологии, так и в области гуманизированных мышей, наша исследовательская группа разработала столь необходимую доклиническую модель для тестирования иммунотерапии на различных опухолях человека 3,7,30,31.<...
Раскрытие информации
Никакой.
Благодарности
Мы хотели бы поблагодарить как Центр исследований животных (OLAR) за заботу о наших мышах, так и общий ресурс проточной цитометрии, поддерживаемый грантом поддержки онкологического центра (P30CA046934) в нашем институте, за их огромную помощь во всей нашей работе. Мы также выражаем признательность Гейл Экхардт и Анне Капассо за наше первое сотрудничество по изучению иммунотерапии PDX человека в нашей модели HIS-BRGS. Это исследование было частично поддержано грантом поддержки онкологического центра Национального института здравоохранения P30CA06934 с использованием общего ресурса PHISM (доклинические модели иммунной системы человека), RRID: SCR_021990 и общего ресурса по проточной цитометрии, RRID: SCR_022035. Это исследование было частично поддержано NIAID Национальных институтов здравоохранения по контракту No 75N93020C00058.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL syringe w/needles | McKesson | 1031815 | |
| 15 mL tubes | Grenier Bio-One | 188271 | |
| 2-mercaptoethanol | Sigma | M6250 | |
| 50 mL tubes | Grenier Bio-One | 227261 | |
| AutoMACS Pro Separator | Miltenyi | 130-092-545 | |
| BD Golgi Stop Protein Transport Inhibitor with monensin | BD Bioscience | BDB563792 | |
| BSA | Fisher Scientific | BP1600100 | |
| Cell Stim Cocktail | Life Technologies | 509305 | |
| Chill 15 Rack | Miltenyi | 130-092-952 | |
| Cotton-plugged glass pipettes | Fisher Scientific | 13-678-8B | |
| Cultrex Basement membrane extract | R&D Systems | 363200502 | |
| Cytek Aurora | Cytek | ||
| DNase | Sigma | 9003-98-9 | |
| eBioscience FoxP3/Transcription Factor Staining Buffer Set | Invitrogen | 00-5523-00 | |
| Embryonic Stemcell FCS | Gibco | 10439001 | |
| Eppendorf Tubes; 1.5 mL volume | Grenier Bio-One | 616201 | |
| Excel | Microsoft | ||
| FBS | Benchmark | 100-106 500mL | |
| Ficoll Hypaque | GE Healthcare | 45001752 | |
| FlowJo Software | BD Biosciences | ||
| Forceps - fine | Roboz Surgical | RS5045 | |
| Forceps normal | Dumont | RS4919 | |
| Formaldehyde | Fisher | F75P1GAL | |
| Frosted Glass Slides | Corning | 1255310 | |
| Gentlemacs C-Tubes | Miltenyi | 130-096-334 | |
| GentleMACS Dissociator | Miltenyi | 130-093-235 | |
| glass pipettes | DWK Life Sciences | 63A53 | |
| Glutamax | Gibco | 11140050 | |
| HBSS w/ Ca & Mg | Sigma | 55037C | |
| HEPES | Corning | MT25060CI | |
| IgG standard | Sigma | I2511 | |
| IgM standard | Sigma | 401108 | |
| IMDM | Gibco | 12440053 | |
| Liberase DL | Roche | 5466202001 | |
| LIVE/DEAD Fixable Blue | Thermo | L23105 | |
| MDA-MB-231 | ATCC | HTB-26 | |
| MEM | Gibco | 1140050 | |
| mouse anti-human IgG-AP | Southern Biotech | JDC-10 | |
| mouse anti-human IgG-unabeled | Southern Biotech | H2 | |
| mouse anti-human IgM-AP | Southern Biotech | UHB | |
| mouse anti-human IgM-unlabeled | Southern Biotech | SA-DA4 | |
| MultiRad 350 | Precision X-Ray | ||
| PBS | Corning | 45000-446 | |
| Pen Strep | Gibco | 15140122 | |
| Petri Dishes | Fisher Scientific | FB0875713A | |
| p-nitrophenyl substrate | Thermo | 34045 | |
| PRISM | Graphpad | ||
| Rec Hu FLT3L | R&D systems | 308-FK-005/CF | |
| Rec Hu IL6 | R&D systems | 206-IL-010/CF | |
| Rec Hu SCF | R&D systems | 255SC010 | |
| RPMI 1640 | Corning | 45000-39 | |
| Saponin | Sigma | 8047-15-2 | |
| Scissors | McKesson | 862945 | |
| Serological pipettes 25 mL | Fisher Scientific | 1367811 | |
| Sterile filter | Nalgene | 567-0020 | |
| Sterile molecular water | Sigma | 7732-18-5 | |
| Yeti Cell Analyzer | Bio-Rad | 12004279 | |
| Zombie Green | biolegend | 423112 |
Ссылки
- Chulpanova, D. S., Kitaeva, K. V., Rutland, C. S., Rizvanov, A. A., Solovyeva, V. V. Mouse tumor models for advanced cancer immunotherapy. International Journal of Molecular Sciences. 21 (11), 4118 (2020).
- Olson, B., Li, Y., Lin, Y., Liu, E. T., Patnaik, A. Mouse models for cancer immunotherapy research. Cancer Discovery. 8 (11), 1358-1365 (2018).
- Marin-Jimenez, J. A., et al. Testing cancer immunotherapy in a human immune system mouse model: correlating treatment responses to human chimerism, therapeutic variables and immune cell phenotypes. Frontiers in Immunology. 12, 607282 (2021).
- Yin, L., Wang, X. J., Chen, D. X., Liu, X. N., Wang, X. J. Humanized mouse model: a review on preclinical applications for cancer immunotherapy. American Journal of Cancer Research. 10 (12), 4568-4584 (2020).
- Cogels, M. M., et al. Humanized mice as a valuable pre-clinical model for cancer immunotherapy research. Frontiers in Oncology. 11, 784947 (2021).
- Jin, K. T., et al. Development of humanized mouse with patient-derived xenografts for cancer immunotherapy studies: A comprehensive review. Cancer Science. 112 (7), 2592-2606 (2021).
- Capasso, A., et al. Characterization of immune responses to anti-PD-1 mono and combination immunotherapy in hematopoietic humanized mice implanted with tumor xenografts. Journal for Immunotherapy of Cancer. 7 (1), 37 (2019).
- Wang, M., et al. Humanized mice in studying efficacy and mechanisms of PD-1-targeted cancer immunotherapy. The FASEB Journal. 32 (3), 1537-1549 (2018).
- Yong, K. S. M., et al. Humanized mouse as a tool to predict immunotoxicity of human biologics. Frontiers in Immunology. 11, 553362 (2020).
- Shen, H. W., Jiang, X. L., Gonzalez, F. J., Yu, A. M. Humanized transgenic mouse models for drug metabolism and pharmacokinetic research. Current Drug Metabolism. 12 (10), 997-1006 (2011).
- Bosma, G. C., Custer, R. P., Bosma, M. J. A severe combined immunodeficiency mutation in the mouse. Nature. 301 (5900), 527-530 (1983).
- Shultz, L. D., et al. Multiple defects in innate and adaptive immunologic function in NOD/LtSz-scid mice. The Journal of Immunology. 154 (1), 180-191 (1995).
- Legrand, N., et al. Functional CD47/signal regulatory protein alpha (SIRP(alpha)) interaction is required for optimal human T- and natural killer- (NK) cell homeostasis in vivo. Proceedings of the National Academy of Sciences. 108 (32), 13224-13229 (2011).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ito, M., et al. NOD/SCID/gamma(c)(null) mouse: an excellent recipient mouse model for engraftment of human cells. Blood. 100 (9), 3175-3182 (2002).
- Shultz, L. D., et al. Human lymphoid and myeloid cell development in NOD/LtSz-scid IL2R gamma null mice engrafted with mobilized human hemopoietic stem cells. The Journal of Immunology. 174 (10), 6477-6489 (2005).
- Traggiai, E., et al. Development of a human adaptive immune system in cord blood cell-transplanted mice. Science. 304 (5667), 104-107 (2004).
- Theocharides, A. P., Rongvaux, A., Fritsch, K., Flavell, R. A., Manz, M. G. Humanized hemato-lymphoid system mice. Haematologica. 101 (1), 5-19 (2016).
- Goldman, J. P., et al. Enhanced human cell engraftment in mice deficient in RAG2 and the common cytokine receptor gamma chain. British Journal of Haematology. 103 (2), 335-342 (1998).
- Stripecke, R., et al. Innovations, challenges, and minimal information for standardization of humanized mice. EMBO Molecular Medicine. 12 (7), (2020).
- Allen, T. M., et al. Humanized immune system mouse models: progress, challenges and opportunities. Nature Immunology. 20 (7), 770-774 (2019).
- Gammelgaard, O. L., Terp, M. G., Preiss, B., Ditzel, H. J. Human cancer evolution in the context of a human immune system in mice. Molecular Oncology. 12 (10), 1797-1810 (2018).
- Rios-Doria, J., Stevens, C., Maddage, C., Lasky, K., Koblish, H. K. Characterization of human cancer xenografts in humanized mice. Journal for Immunotherapy of Cancer. 8 (1), 000416 (2020).
- Gombash Lampe, S. E., Kaspar, B. K., Foust, K. D. Intravenous injections in neonatal mice. Journal of Visualized Experiments. (93), e52037 (2014).
- Lang, J., Weiss, N., Freed, B. M., Torres, R. M., Pelanda, R. Generation of hematopoietic humanized mice in the newborn BALB/c-Rag2null Il2rγnull mouse model: a multivariable optimization approach. Clinical Immunology. 140 (1), 102-116 (2011).
- Laskowski, T. J., Hazen, A. L., Collazo, R. S., Haviland, D. Rigor and reproducibility of cytometry practices for immuno-oncology: a multifaceted challenge. Cytometry Part A. 97 (2), 116-125 (2020).
- Bagby, S., et al. Development and maintenance of a preclinical patient derived tumor xenograft model for the investigation of novel anti-cancer therapies. Journal of Visualized Experiments. (115), e54393 (2016).
- Laajala, T. D., et al. Optimized design and analysis of preclinical intervention studies in vivo. Scientific Reports. 6, 30723 (2016).
- Na, Y. S., et al. Establishment of patient-derived xenografts from patients with gastrointestinal stromal tumors: analysis of clinicopathological characteristics related to engraftment success. Scientific Reports. 10 (1), 7996 (2020).
- Tentler, J. J., et al. RX-5902, a novel beta-catenin modulator, potentiates the efficacy of immune checkpoint inhibitors in preclinical models of triple-negative breast cancer. BMC Cancer. 20 (1), 1063 (2020).
- Lang, J., et al. Development of an adrenocortical cancer humanized mouse model to characterize anti-PD1 effects on tumor microenvironment. The Journal of Clinical Endocrinology & Metabolism. 105 (1), 26-42 (2020).
- Lang, J., et al. Studies of lymphocyte reconstitution in a humanized mouse model reveal a requirement of T cells for human B cell maturation. The Journal of Immunology. 190 (5), 2090-2101 (2013).
- Katano, I., et al. NOD-Rag2null IL-2Rγnull mice: an alternative to NOG mice for generation of humanized mice. Experimental Animalas. 63 (3), 321-330 (2014).
- Brehm, M. A., et al. Parameters for establishing humanized mouse models to study human immunity: analysis of human hematopoietic stem cell engraftment in three immunodeficient strains of mice bearing the IL2rγ(null) mutation. Clinical Immunology. 135 (1), 84-98 (2010).
- Hasgur, S., Aryee, K. E., Shultz, L. D., Greiner, D. L., Brehm, M. A. Generation of immunodeficient mice bearing human immune systems by the engraftment of hematopoietic stem cells. Methods in Molecular Biology. 1438, 67-78 (2016).
- Andre, M. C., et al. Long-term human CD34+ stem cell-engrafted nonobese diabetic/SCID/IL-2Rγnull mice show impaired CD8+ T cell maintenance and a functional arrest of immature NK cells. The Journal of Immunology. 185 (5), 2710-2720 (2010).
- Wunderlich, M., et al. Improved multilineage human hematopoietic reconstitution and function in NSGS mice. PLoS One. 13 (12), 0209034 (2018).
- Lee, J., Brehm, M. A., Greiner, D., Shultz, L. D., Kornfeld, H. Engrafted human cells generate adaptive immune responses to Mycobacterium bovis BCG infection in humanized mice. BMC Immunology. 14, 53 (2013).
- Masse-Ranson, G., et al. Accelerated thymopoiesis and improved T-cell responses in HLA-A2/-DR2 transgenic BRGS-based human immune system mice. European Journal of Immunology. 49 (6), 954-965 (2019).
- Oswald, E., et al. Immune cell infiltration pattern in non-small cell lung cancer PDX models is a model immanent feature and correlates with a distinct molecular and phenotypic make-up. Journal for Immunotherapy of Cancer. 10 (4), 004412 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены