È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurazione del tasso di lipolisi nel tessuto adiposo murino ex vivo e nei preadipociti primari differenziati in vitro
In questo articolo
Riepilogo
La lipolisi dei trigliceridi negli adipociti è un importante processo metabolico che porta alla liberazione degli acidi grassi liberi e del glicerolo. Qui, forniamo un protocollo dettagliato per misurare la lipolisi basale e stimolata negli adipociti e nel tessuto adiposo ex vivo dei topi.
Abstract
Gli adipociti immagazzinano energia sotto forma di trigliceridi nelle goccioline lipidiche. Questa energia può essere mobilitata tramite lipolisi, dove le catene laterali degli acidi grassi vengono scisse sequenzialmente dalla spina dorsale del glicerolo, con conseguente rilascio di acidi grassi liberi e glicerolo. A causa della bassa espressione della glicerolo chinasi negli adipociti bianchi, i tassi di ricaptazione del glicerolo sono trascurabili, mentre la ricaptazione degli acidi grassi è dettata dalla capacità di legare gli acidi grassi dei componenti dei mezzi come l'albumina. Sia il rilascio di glicerolo che di acidi grassi nei mezzi possono essere quantificati mediante saggi colorimetrici per determinare la velocità lipolitica. Misurando questi fattori in più punti temporali, è possibile determinare il tasso lineare di lipolisi con elevata sicurezza. Qui, forniamo un protocollo dettagliato per la misurazione della lipolisi in adipociti differenziati in vitro e tessuto adiposo ex vivo da topi. Questo protocollo può anche essere ottimizzato per altre linee cellulari di preadipociti o tessuto adiposo di altri organismi; Vengono discusse considerazioni e parametri di ottimizzazione. Questo protocollo è progettato per essere utile per determinare e confrontare il tasso di lipolisi adipocitaria tra modelli murini e trattamenti.
Introduzione
I nutrienti in eccesso sono immagazzinati nel tessuto adiposo bianco sotto forma di trigliceridi nel nucleo lipidico neutro delle goccioline lipidiche. Le riserve di trigliceridi vengono mobilitate tramite lipolisi, un processo mediante il quale le catene laterali degli acidi grassi vengono scisse sequenzialmente dalla trigliceride lipasi del tessuto adiposo (ATGL), dalla lipasi ormonosensibile (HSL) e dalla monogliceride lipasi (MGL), con conseguente rilascio di acidi grassi liberi (FFA) e della spina dorsale del glicerolo 1,2. La lipolisi è attivata dalla segnalazione delle catecolamine nel tessuto adiposo. I terminali nervosi simpatici rilasciano localmente catecolamine, che si legano ai recettori β-adrenergici sulla membrana plasmatica degli adipociti. Dopo il legame del ligando, questi recettori accoppiati a proteine G (GPCR) attivano l'adenilil ciclasi tramite Gαs. La successiva attivazione della protein chinasi A (PKA) da parte di cAMP provoca la sovraregolazione sia di ATGL che di HSL. La fosforilazione della perilipina-1 da parte della PKA provoca la dissociazione di ABHD5 (noto anche come CGI-58), che lega e coattiva ATGL3. PKA fosforila direttamente HSL, promuovendo la sua traslocazione dal citosol alla goccia lipidica, dove l'interazione con la perilipina-1 fosforilata promuove ulteriormente la sua attività lipasi 4,5,6,7. La terza lipasi coinvolta nella lipolisi, MGL, non sembra essere regolata dalla segnalazione 8 della catecolamine. È importante sottolineare che la sintesi dei trigliceridi negli adipociti è mediata dalla via di sintesi dei lipidi del glicerolo, che non comporta la formazione di monogliceridi come intermedio; invece, le glicerolo-3-fosfato aciltransferasi catalizzano la formazione di acido lisofosfatidico, che viene combinato con un altro acil-CoA grasso per formare acido fosfatidico e quindi isomerizzato a digliceridi prima della sintesi finale dei trigliceridi (Figura 1)9,10,11.

Figura 1: Lipolisi e vie di sintesi dei lipidi del glicerolo. In alto: Via lipolitica; enzimi mostrati in rosso: trigliceridi lipasi del tessuto adiposo (ATGL), lipasi ormonale sensibile (HSL) e monogliceride lipasi (MGL). In basso: via di sintesi dei lipidi del glicerolo; enzimi mostrati in verde: digliceride aciltransferasi (DGAT), fosfatasi dell'acido fosfatidico (PAP), acido lisofosfatidico aciltransferasi (LPAT, noto anche come LPAAT) e glicerolo-3-fosfato aciltransferasi (GPAT). Lipidi: trigliceridi (TG), digliceridi (DG), monogliceridi (MG), acidi grassi liberi (FFA), acil-CoA grassi (FA-CoA), acido lisofosfatidico (LPA) e acido fosfatidico (PA). Altri metaboliti: fosfato inorganico (Pi) e glicerolo-3-fosfato (G3P). Fare clic qui per visualizzare una versione ingrandita di questa figura.
L'adenosina extracellulare è un altro importante regolatore della lipolisi, lavorando attraverso GPCR accoppiati Gs e Gi per influenzare l'attività dell'adenilciclasi. Il recettore dell'adenosina predominante negli adipociti, ADORA1, inibisce l'adenilil ciclasi e quindi la lipolisi attraverso l'attivazione di Gi12. Espresso a livelli più bassi, e principalmente negli adipociti bruni, ADORA2A attiva la lipolisi tramite la segnalazione Gs 13. ADORA1 influisce sia sulla lipolisi basale che sulla risposta agli agonisti adrenergici. L'effetto dell'adenosina sulla lipolisi può essere controllato aggiungendo adenosina deaminasi per neutralizzare l'adenosina, così come l'agonista specifico ADORA1 fenilisopropiladenosina14,15. L'attivazione ormonale dei GPCR accoppiati a Gq può anche influenzare la lipolisi attraverso l'attivazione della fosfolipasi C e della protein chinasi C16,17,18,19. I segnali infiammatori influenzano anche i tassi lipolitici. L'attivazione di TLR4 da parte di LPS (e altre endotossine) aumenta il tasso lipolitico attivando ERK, che fosforila perilipina-1 e HSL20. TNF-α attiva anche la lipolisi tramite l'attivazione di ERK e NF-κB, nonché la downregulation trascrizionale della fosfodiesterasi PDE-3B e CIDEC21,22,23. IL-6 è stata anche associata ad un aumento della lipolisi degli adipociti, specialmente nel tessuto adiposo mesenterico, il cui rilascio di FFA influisce sulla steatosi epatica e sulla gluconeogenesi24,25,26.
La lipolisi viene soppressa durante lo stato di alimentazione dall'insulina. AKT fosforila e attiva PDE-3B per sopprimere la segnalazione cAMP e prevenire l'attivazione di PKA27. L'insulina sottoregola anche trascrizionalmente ATGL28. L'obesità promuove la resistenza alle catecolamine attraverso una varietà di meccanismi, tra cui la downregulation dei recettori β-adrenergici negli adipociti 29,30,31,32,33. Gli adipociti esprimono tutti e tre i recettori β-adrenergici (β-1, β-2 e β-3). Mentre i recettori adrenergici β-1 e β-2 sono espressi ubiquitariamente, il recettore adrenergico β-3 è espresso prevalentemente negli adipociti nei topi34,35. L'espressione di Adrb3 è indotta da C/EBPα durante l'adipogenesi36. Il recettore adrenergico β-3 è altamente espresso negli adipociti maturi. L'attivazione dei recettori adrenergici β-1 e β-2 è autolimitante a causa dell'inibizione del feedback da parte dell'β-arrestina37. L'inibizione a feedback del recettore adrenergico β-3 è mediata da altre vie di segnalazione, che riducono l'espressione di Adrb3 33,38,39.
Numerosi composti possono essere utilizzati per attivare la lipolisi degli adipociti. Le catecolamine sono i principali attivatori fisiologici della lipolisi. La noradrenalina (o noradrenalina) e l'epinefrina (o adrenalina) attivano tutti e tre i recettori β-adrenergici40. La noradrenalina e l'epinefrina influenzano anche la lipolisi attraverso l'attivazione della segnalazione del recettore α-adrenergico41. Gli agonisti del recettore β-adrenergico comunemente usati includono l'isoproterenolo, che è un agonista del recettore β-adrenergico non selettivo, e gli agonisti del recettore adrenergico β-3 CL-316,243 e mirabegron42. Dato che gli adipociti esprimono prevalentemente il recettore adrenergico β-3, usiamo CL-316.243 come esempio qui. La sua specificità per il recettore adrenergico β-3 lo rende anche un attivatore relativamente specifico della segnalazione delle catecolamine degli adipociti, che può essere tranquillamente utilizzato anche in vivo. Si noti che la concentrazione comunemente usata di 10 μM CL-316,243 in coltura cellulare è ordini di grandezza superiore alla dose ~0,1 μM richiesta per ottenere una risposta massima33. Forskolin bypassa il recettore adrenergico, attivando direttamente l'adenilil ciclasi e la segnalazione lipolitica a valle. Ci sono molti altri attivatori, così come i soppressori della lipolisi. Quando si seleziona un composto per stimolare la lipolisi, la specificità del recettore e le vie di segnalazione a valle devono essere attentamente considerate all'interno del disegno sperimentale.
Il tasso di lipolisi nel tessuto adiposo bianco è un importante fattore metabolico che influisce sulla tolleranza al freddo e sulla disponibilità di nutrienti durante il digiuno o l'esercizio fisico43,44,45,46. Lo scopo di questo protocollo è quello di misurare il tasso di lipolisi negli adipociti e nel tessuto adiposo, che faciliterà la comprensione del metabolismo degli adipociti e di come può influenzare il fenotipo metabolico di vari modelli murini. Per quantificare il tasso lipolitico, misuriamo l'aspetto dei prodotti lipolitici nei mezzi (cioè FFA e glicerolo). Il metodo si basa sul rilascio di prodotti lipolitici dall'adipocita nei media. Poiché gli adipociti bianchi esprimono bassi livelli di glicerolo chinasi, i tassi di ricaptazione del glicerolo sono bassi47. Al contrario, dovrebbe essere considerata anche la produzione di FFA e glicerolo da vie metaboliche diverse dalla lipolisi. Gli adipociti sembrano esprimere una fosfatasi con attività contro il glicerolo-3 fosfato, consentendo la produzione di glicerolo dal glicerolo-3-fosfato derivato dal glucosio48,49,50. La glicolisi è una fonte di glicerolo-3-fosfato utilizzato per la riesterificazione dell'FFA negli adipociti bianchi. Quando i livelli di glucosio sono limitati, la gliceroneogenesi richiede altre fonti di carbonio 3, come il lattato e il piruvato51. La canalizzazione degli FFA rilasciati dalla lipolisi all'interno della cellula e il loro destino metabolico è poco compreso; Gli FFA rilasciati dalla lipolisi devono essere convertiti in acil-CoA grasso, prima di essere riesterificati o sottoposti a β-ossidazione. Sembra che gli FFA rilasciati dalla lipolisi probabilmente escano dalla cellula prima di essere ripresi e convertiti in acil-CoA grasso 52,53,54,55,56,57,58,59,60,61,62 . Gli FFA possono essere sequestrati al di fuori della cellula dall'albumina. È importante sottolineare che gli FFA a catena lunga sono noti per inibire la lipolisi a retroazione se non sono sequestrati dall'albumina 63,64,65,66,67. Pertanto, l'ottimizzazione della capacità tampone FFA dei mezzi durante il test di lipolisi è fondamentale. La procedura qui descritta è simile ai metodi precedentemente pubblicati per misurare il tasso lipolitico negli adipociti e nel tessuto adiposo ex vivo di topi e umani 15,68,69,70,71. Questo protocollo differisce attraverso l'uso del campionamento seriale; Eseguendo il campionamento seriale, possiamo convalidare internamente che la lipolisi viene misurata nella fase lineare e utilizzare più misurazioni per calcolare il tasso di lipolisi, riducendo così l'errore di misurazione per aumentare la fiducia nel valore calcolato finale. Lo svantaggio del campionamento seriale è che il test richiede più tempo e reagenti; Tuttavia, il periodo di tempo più lungo riduce l'impatto dell'errore di misurazione sull'errore standard delle stime del tasso. Inoltre, questo protocollo misura sia FFA che il rilascio di glicerolo e considera il rapporto FFA:rilascio di glicerolo con l'obiettivo di raggiungere un rapporto 3:1, come ci si aspetterebbe dalla lipolisi completa e dal rilascio di prodotti lipolitici nei mezzi72.
Protocollo
L'uso di tutti gli animali è stato approvato dall'Institutional Animal Care and Use Committee (IACUC) presso il Weill Cornell Medical College della Cornell University.
1. Preparazione di tamponi e piastre di raccolta
- Produrre albumina sierica bovina al 5% (BSA) sciogliendo 5 g di BSA in 100 ml di terreno di Eagle modificato di Dulbecco (DMEM) senza rosso fenolo. Mescolare delicatamente la BSA per scioglierla (agitare è controproducente). Una volta che il BSA è completamente sciolto, filtrare e sterilizzare il fluido con un filtro da 0,2 μm. Conservare il fluido BSA a 4 °C per un massimo di 1 mese.
- Effettuare concentrazioni di lavoro di mezzi di controllo e stimolazione. Mezzi di controllo: 5% BSA media con controllo del veicolo. Mezzi di stimolazione: 5% BSA media con 0,5 μM CL-316,243. Crea nuovi mezzi di stimolazione per ogni esperimento.
- Riscaldare il fluido da utilizzare a 37 °C. Etichettare una piastra da 96 pozzetti per la raccolta dei supporti.
2. Preparazione del campione
- Eseguire la coltura cellulare come descritto di seguito. Eseguire tutto il lavoro delle celle in una cappa aspirante sterile per ridurre al minimo la contaminazione esterna.
- Isolare e differenziare i preadipociti primari, come in73,74.
- Preadipociti primari su piastra ad alta densità, come 1 x 105 cellule/pozzetto in una piastra a 24 pozzetti in 1 mL/pozzetto di terreno di coltura (15% siero fetale bovino (FBS) e 1x penicillina-streptomicina-glutammina in DMEM/F12).
- Dopo che le cellule raggiungono il 100% di confluenza, differenziare con 5 μM di desametasone, 0,5 mM di 3-isobutil-1-metilxantina, 1 μg/mL di insulina e 1 μM di tiazolidinedione (TZD) in terreni di coltura per 3 giorni. Quindi, passare a terreni di coltura con 1 μg / ml di insulina per almeno 3 giorni per far crescere le goccioline lipidiche. Utilizzare 1 mL/pozzetto di fluido nella piastra a 24 pozzetti.
- Cambiare i terreni di coltura (1 ml/pozzetto) con insulina ogni 2 o 3 giorni. Le cellule possono essere mantenute in terreni con insulina per un massimo di 2 settimane. Utilizzare solo colture in cui i tassi di differenziazione sono superiori al 90% e sono simili tra i gruppi per questo test, poiché la differenziazione ridotta potrebbe essere interpretata erroneamente come una riduzione della velocità lipolitica.
- Coltura delle cellule in terreni privi di insulina per 24 ore prima di misurare la lipolisi.
NOTA: L'insulina nei mezzi mantiene le goccioline lipidiche, ma inibisce anche la lipolisi. L'incubazione senza insulina per 24 ore consente una completa attivazione lipolitica senza perdita di volume di goccioline lipidiche. In alcuni sistemi, il tempo di coltura senza insulina potrebbe dover essere abbreviato o esteso.
- Lavare le cellule con DPBS una volta per rimuovere il siero residuo dai terreni di coltura.
NOTA: Questo protocollo non include la fame di siero, che può attivare la lipolisi. La fame di siero può essere impiegata a discrezione del ricercatore.
- Isolare e differenziare i preadipociti primari, come in73,74.
- Eseguire colture ex vivo come descritto di seguito.
- Preparare una piastra a 6 pozzetti, con un pozzetto per ogni tessuto da raccogliere da ciascun topo. Posizionare 4 ml di DMEM a temperatura ambiente in ciascun pozzetto da utilizzare.
NOTA: BSA nel supporto di raccolta non è necessario. - Preparare una piastra a 48 pozzetti per il test di lipolisi, con un pozzetto per ogni replica. Posizionare 400 μL di DMEM a temperatura ambiente in ciascun pozzetto da utilizzare. Utilizzare da due a quattro pozzetti di controllo e da due a quattro pozzetti stimolati per tessuto per topo.
- Eutanasia del topo per lussazione cervicale in anestesia, con un metodo secondario come il pneumotorace bilaterale. Qui, abbiamo usato un topo femmina C57BL / 6J di 32 g, di 7 mesi, alimentato con una dieta ricca di grassi del 45% per 4 mesi.
NOTA: Questo protocollo può essere utilizzato anche per i maschi, così come altri ceppi, diete ed età. - Spruzzare con etanolo al 70% e utilizzare le forbici per fare una piccola incisione laterale (~ 1 cm) al centro della pelle addominale, separare la pelle pizzicando entrambi i lati con pollice e indice e piegare la pelle addominale inferiore per rivelare i depositi sottocutanei posteriori. Individuare e rimuovere il linfonodo inguinale e smussare sezionare il tessuto adiposo inguinale immediatamente posteriore al linfonodo inguinale usando una pinza.
- Per raccogliere il tessuto adiposo gonadico, effettuare un'incisione laterale e verticale nel peritoneo per accedere alla cavità peritoneale. Tenere il cuscinetto di grasso gonadico con una pinzetta e tagliare lungo l'utero (o l'epididimo per i maschi) per rimuovere il tessuto adiposo gonadico. Posizionare i depositi raccolti in una piastra a 6 pozzetti.
- Rimuovere il tessuto dal pozzo, posizionare su un tappetino di silicone e tagliare a pezzi da 5 a 7 mg con le forbici.
- Pesare da 25 a 30 mg (cinque o sei pezzi) per ciascun saggio e metterli in una piastra di dosaggio a 48 pozzetti. Asciugare il fazzoletto su un asciugamano pulito prima di pesare per rimuovere eventuali supporti. Pesare il peso barca dopo la rimozione del tessuto e registrare il peso di eventuali residui lasciati indietro. Pulire la barca di peso tra i campioni e ri-tare se necessario. Utilizzare una nuova barca di peso per ogni tessuto.
- Una volta pesati tutti i campioni di tessuto, posizionare la piastra di dosaggio a 48 pozzetti in un incubatore a 37 °C, 10% CO2 per 15 minuti.
- Preparare una piastra a 6 pozzetti, con un pozzetto per ogni tessuto da raccogliere da ciascun topo. Posizionare 4 ml di DMEM a temperatura ambiente in ciascun pozzetto da utilizzare.
3. Saggio di lipolisi
- Eseguire la raccolta multimediale. Effettuare il trasferimento dei mezzi e la successiva raccolta dei campioni in una cappa aspirante sterile per ridurre al minimo la potenziale contaminazione da fonti esterne.
- A t = 0, rimuovere il mezzo e aggiungere 400 μL per pozzetto di mezzo di controllo o di stimolazione, quindi posizionare il saggio della piastra in un incubatore a 37 °C, 10% di CO2 . Per la coltura di tessuti ex vivo , rimuovere con cautela i terreni utilizzando una pipetta; L'aspirazione non dovrebbe mai essere usata.
NOTA: In alternativa, preparare una seconda piastra con mezzi di controllo e stimolazione e trasferire i tessuti. - A t = 1, 2, 3 e 4 h, raccogliere 200 μL di media, sostituirli con 200 μL dei mezzi di controllo o di stimolazione appropriati e riportare la piastra di analisi all'incubatore. Conservare il piatto di raccolta a 4 °C. Per determinare la capacità tampone FFA del supporto BSA, utilizzare una raccolta aggiuntiva a 24 ore.
NOTA: Gli esperimenti possono essere fermati qui e i supporti raccolti possono essere memorizzati a -20 °C.
- A t = 0, rimuovere il mezzo e aggiungere 400 μL per pozzetto di mezzo di controllo o di stimolazione, quindi posizionare il saggio della piastra in un incubatore a 37 °C, 10% di CO2 . Per la coltura di tessuti ex vivo , rimuovere con cautela i terreni utilizzando una pipetta; L'aspirazione non dovrebbe mai essere usata.
4. Saggio colorimetrico FFA
- Riscaldare i reagenti a temperatura ambiente e sciogliere un flacone di colorante A con un flacone di solvente A e un flacone di colorante reagente B con un flacone di solvente B. Dalla data di ricostituzione, questi reagenti sono meglio utilizzati entro 1 settimana. Eliminare 1 mese dopo la ricostituzione.
- Scongelare e mescolare i campioni.
- Create una curva standard FFA. La soluzione standard è 1 mM. Utilizzare il seguente volume con i reagenti per la curva standard: 25 μL, 20 μL, 15 μL, 10 μL, 10 μL (diluizione 1:2), 10 μL (diluizione 1:4), 10 μL (diluizione 1:8) e 10 μL di acqua per l'intervallo massimo. Per bassi livelli di FFA, possono essere più applicabili 10 μL di 1 mM, 0,8 mM, 0,6 mM, 0,4 mM, 0,2 mM, 0,1 mM e 0,05 mM.
- Standard di pipette e campioni in una piastra di dosaggio da 96 pozzetti. Il volume del campione consigliato è di 10 μL. Includere tre pozzetti con lo stesso volume di supporti BSA dei campioni per la correzione dello sfondo.
NOTA: Se le concentrazioni del campione non rientrano nell'intervallo della curva standard, ripetere il test, regolando il volume del campione a 2-25 μL. - Aggiungere 150 μL di reagente A a ciascun pozzetto e mescolare. Evitare di generare bolle. Fai scoppiare eventuali bolle con un ago di calibro sottile. Incubare la piastra di dosaggio a 37 °C per 5 minuti.
- Leggere l'assorbanza della piastra a 550 nm e 660 nm di riferimento (lettura A).
- Aggiungere 75 μL di reagente B a ciascun pozzetto e mescolare. Evitare di generare bolle. Fai scoppiare eventuali bolle con un ago di calibro sottile. Incubare la piastra di dosaggio a 37 °C per 5 minuti.
- Leggere nuovamente l'assorbanza della piastra a 550 nm e 660 nm di riferimento (lettura B).
5. Saggio colorimetrico del glicerolo
- Ricostituire il reagente glicerolo libero con 36 ml di acqua ultrapura e acclimatarsi a temperatura ambiente. Questi reagenti sono meglio utilizzati entro poche settimane. Eliminare 2 mesi dopo la ricostituzione.
- Scongelare e mescolare i campioni.
- Creare una curva standard del glicerolo effettuando una diluizione seriale a sette punti, 2 volte della soluzione standard di glicerolo e un bianco d'acqua.
NOTA: La curva standard è relativamente lineare fino a 25 μL di glicerolo da 2,8 mM, ma non lineare a concentrazioni più elevate. - Pipettare 25 μL ciascuno di standard e campioni nella piastra di dosaggio a 96 pozzetti. Includere tre pozzetti con il supporto BSA per la correzione dello sfondo.
- Aggiungere 175 μL di reagente di glicerolo libero a ciascun pozzetto e mescolare. Evitare di generare bolle. Fai scoppiare eventuali bolle con un ago di calibro sottile. Incubare la piastra di dosaggio a 37 °C per 5 minuti.
- Leggere l'assorbanza della piastra a 540 nm.
6. Calcolo della velocità lipolitica
- Iniziare con i valori di densità ottica (OD). Per il glicerolo, utilizzare direttamente i valori A540 OD. Calcolare l'OD del test FFA secondo la seguente formula:
OD = (Lettura B: A 550 - A 660) - (Lettura A: A550 - A 660) - Utilizzare la curva standard per calcolare i livelli di FFA e glicerolo nei campioni raccolti. Tracciare i valori OD standard sull'asse y e sull'asse x, utilizzare concentrazioni standard relative al volume del campione (cioè, la concentrazione dei pozzetti con 20 μL di 1 mM FFA standard su una piastra con campioni da 10 μL è pari a 2 mM). Adatta una linea di tendenza lineare:
y = mx + b - Ispezionare visivamente la curva standard e rimuovere eventuali punti al di fuori dell'intervallo lineare del test. Calcolare le concentrazioni del campione usando l'equazione:
Concentrazione del campione: x = (OD - b) ÷ m - Regolare e rianalizzare i campioni che non rientrano nell'intervallo di analisi lineare. Per ottenere la concentrazione finale del campione, sottrarre la concentrazione dei pozzetti di fondo contenenti solo mezzi BSA dalla concentrazione dei campioni.
- Calcolare le moli di FFA e glicerolo prodotte da ciascun campione in ogni punto temporale, secondo la formula:
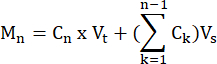
dove C n = concentrazione al tempo t = n; Vt = volume totale nel pozzo; Vs = volume di raccolta dei campioni; e M n = moli prodotti al tempo t = n (quando le concentrazioni sono in mM e i volumi sono in mL l'output è μMol).
Ad esempio, in vari momenti:
M 1 = C1 × Vt
M 4 = C4 × Vt + (C1 + C2+ C3)Vs
o
M 4 = C4 × Vt + C3 × V s + C2 × V s + C1 ×V s - Normalizzare il peso del tessuto dividendo per il peso del tessuto per ciascun campione in grammi per ottenere unità di μmol / g. Per le cellule in coltura, i valori sono presentati come μmol/pozzetto. Assicurarsi che il numero di celle e l'efficienza di differenziazione siano comparabili da bene a bene.
NOTA: Le differenze nell'efficienza della proliferazione o della differenziazione complicheranno l'interpretazione dei risultati e richiederanno un altro metodo di normalizzazione (ad esempio, normalizzazione a proteina; vedi discussione). - Calcolare la pendenza del μmol/g prodotto (asse y) rispetto al tempo (asse x) per ciascun campione singolarmente.
- In un foglio di calcolo, questa operazione può essere eseguita utilizzando la funzione =SLOPE(known_ys,known_xs). In una nuova cella, digitare "=SLOPE" (quindi utilizzare il cursore per evidenziare i valori di glicerolo o FFA del campione in μmol/g, quindi per evidenziare i valori temporali corrispondenti).
- Verificare la linearità dei dati. I valori R2 sono un modo rapido per determinare la linearità dei campioni. In un foglio di calcolo, questo può essere fatto usando la funzione =RSQ(known_ys,known_xs), nello stesso modo descritto nel passaggio 6.7.1, ma l'input iniziale è =RSQ. Assicurarsi che i valori di R2 siano > 0,98; Valori più bassi indicano una deviazione dalla linearità. Ciò può derivare da un errore di misurazione/campionamento o da una perdita di linearità.
- Un altro modo per testare la linearità consiste nell'eseguire una regressione lineare per ogni campione e tracciare i residui. In un software di analisi statistica, generare una tabella XY con un singolo valore Y per ogni punto temporale. Selezionare Analizza > regressione lineare semplice e selezionare la casella per Grafico residuo prima di premere OK. Il grafico residuo verrà visualizzato come un nuovo grafico.
- Utilizzare l'FFA e il tasso di produzione di glicerolo (cioè la pendenza [(μmol / g / h]) per ciascun campione come singolo punto dati per eseguire analisi statistiche e tracciare i valori se vengono confrontate diverse condizioni lipolitiche. Se i tassi lipolitici vengono confrontati tra genotipi, utilizzare due o tre campioni per animale come repliche tecniche e utilizzare la media per un punto dati per animale, in modo che la dimensione del campione sia uguale al numero di animali.
Risultati
Abbiamo misurato il tasso lipolitico basale e stimolato degli adipociti differenziati in vitro. I preadipociti primari del tessuto adiposo bianco inguinale sono stati differenziati in adipociti mediante il trattamento di cellule confluenti con 5 μM di desametasone, 0,5 mM di IBMX, 1 μg/mL di insulina e 1 μM di troglitazone per 4 giorni, seguiti da un ulteriore trattamento di 3 giorni con 1 μg/mL di insulina. Le cellule sono state incubate in terreni senza insulina per 24 ore prima del test di lipolisi. Al te...
Discussione
Qui, forniamo un protocollo di base per misurare il tasso di lipolisi negli adipociti e nel tessuto adiposo ex vivo . Per quantificare la lipolisi, è importante misurare la velocità lipolitica nella fase lineare. Utilizziamo una tecnica di campionamento seriale, in cui una grande frazione di media viene raccolta e sostituita con nuovi terreni a intervalli regolari. Questo metodo semiconservativo consente l'aggiunta di BSA fresco con capacità tampone FFA e ritarda l'inibizione del feedback, estendendo la durat...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla sovvenzione del National Institutes of Health degli Stati Uniti R01DK126944 a SMR.
Materiali
| Name | Company | Catalog Number | Comments |
| 24-Well tissue culture treated plate | Corning Inc | 3527 | Must be tissue culture treated for adipocyte differntiation |
| 48-Well flat bottom plate with lid | Corning Inc | 353078 | Can be tissue culture treated |
| 6-Well flat bottom plate with lid | Corning Inc | 353046 | Can be tissue culture treated |
| 96-Well PCR Plate | USA sceintific | 1402-9100 | Any conical 0.2 mL PCR plate will be convenient |
| Bovine Serum Albumin | Sigma Aldrich | A9418 | FFA free BSA such as A8806, is also commonly used. The BSA should not have detectable FFA, also lot to lot variations in BSA can impact the observed rate of lipolysis |
| CL-316,243 | Sigma Aldrich | C5976 | CAS #: 138908-40-4 availaible from other suppliers |
| CO2 incubator | PHCBI | MCO-170AICUVH | CO2 should ideally be set to 10% for adipose tissue, however 5% CO2 will also work |
| DMEM, low glucose, no phenol red | Thermofischer | 11054020 | Any phenol red free media should work, DMEM/F12, RPMI, but should contain volatile buffering capacity, i.e. biocarbonate |
| FFA-free Bovine serum albumin | Equitech-Bio, Inc, | BAH66 | |
| Free Glycerol Reagent | Sigma Aldrich | F6428 | |
| Glycerol Standard Solution | Sigma Aldrich | G7793 | This can also be made by diluting glycerol to the desired concentration |
| HR Series NEFA Standard Solution | Fujifilm | 276-76491 | |
| HR Series NEFA-HR (2) Color Reagent A | Fujifilm | 999-34691 | |
| HR Series NEFA-HR (2) Color Reagent B | Fujifilm | 991-34891 | |
| HR Series NEFA-HR (2) Solvent A | Fujifilm | 995-34791 | |
| HR Series NEFA-HR (2) Solvent B | Fujifilm | 993-35191 | |
| Microbiological Incubator | Fischer Scientific | S28668 | Any incubator at 37C can be used |
| Nunc MicroWell 96-Well Plates | Thermo Scientific | 269620 | Any optically clear, flat bottom 96-well plate works |
| Silicone Laboratory Benchtop Mat | VWR | 76045-300 | Glass plate can also be used. Absorbant surfaces are not recommended |
| Spectrophotometer/Microplate Reader | Molecular devices | SpectraMax i3x | Any plate reader that can read at 540, 550 and 660 mm will work |
| V Bovine serum albumin | Sigma-Aldrich | 810531 | |
| WypAll X70 Wipers | Kimberly-Clark | 41200 | Any high quality paper towel will work |
Riferimenti
- Vaughan, M., Berger, J. E., Steinberg, D. Hormone-sensitive lipase and monoglyceride lipase activities in adipose tissue. The Journal of Biological Chemistry. 239, 401-409 (1964).
- Zimmermann, R., et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase. Science. 306 (5700), 1383-1386 (2004).
- Lass, A., et al. Adipose triglyceride lipase-mediated lipolysis of cellular fat stores is activated by CGI-58 and defective in Chanarin-Dorfman syndrome. Cell Metabolism. 3 (5), 309-319 (2006).
- Stralfors, P., Bjorgell, P., Belfrage, P. Hormonal regulation of hormone-sensitive lipase in intact adipocytes: identification of phosphorylated sites and effects on the phosphorylation by lipolytic hormones and insulin. Proceedings of the National Academy of Sciences. 81 (11), 3317-3321 (1984).
- Miyoshi, H., et al. Perilipin promotes hormone-sensitive lipase-mediated adipocyte lipolysis via phosphorylation-dependent and -independent mechanisms. The Journal of Biological Chemistry. 281 (23), 15837-15844 (2006).
- Sztalryd, C., et al. Perilipin A is essential for the translocation of hormone-sensitive lipase during lipolytic activation. The Journal of Cell Biology. 161 (6), 1093-1103 (2003).
- Lafontan, M., Langin, D. Lipolysis and lipid mobilization in human adipose tissue. Progress in Lipid Research. 48 (5), 275-297 (2009).
- Grabner, G. F., Xie, H., Schweiger, M., Zechner, R. Lipolysis: cellular mechanisms for lipid mobilization from fat stores. Nature Metabolism. 3 (11), 1445-1465 (2021).
- Weiss, S. B., Kennedy, E. P., Kiyasu, J. Y. The enzymatic synthesis of triglycerides. The Journal of Biological Chemistry. 235, 40-44 (1960).
- Kennedy, E. P. Biosynthesis of complex lipids. Federation Proceedings. 20, 934-940 (1961).
- Wendel, A. A., Lewin, T. M., Coleman, R. A. Glycerol-3-phosphate acyltransferases: rate limiting enzymes of triacylglycerol biosynthesis. Biochimica et Biophysica Acta. 1791 (6), 501-506 (2009).
- Johansson, S. M., Lindgren, E., Yang, J. N., Herling, A. W., Fredholm, B. B. Adenosine A1 receptors regulate lipolysis and lipogenesis in mouse adipose tissue-interactions with insulin. European Journal of Pharmacology. 597 (1-3), 92-101 (2008).
- Gnad, T., et al. Adenosine activates brown adipose tissue and recruits beige adipocytes via A2A receptors. Nature. 516 (7531), 395-399 (2014).
- Fried, S. K., et al. Resistance to the antilipolytic effect of insulin in adipocytes of African-American compared to Caucasian postmenopausal women. Journal of Lipid Research. 51 (5), 1193-1200 (2010).
- Lee, M. J., Fried, S. K. Optimal protocol for the differentiation and metabolic analysis of human adipose stromal cells. Methods in Enzymology. 538, 49-65 (2014).
- Fricke, K., Heitland, A., Maronde, E. Cooperative activation of lipolysis by protein kinase A and protein kinase C pathways in 3T3-L1 adipocytes. Endocrinology. 145 (11), 4940-4947 (2004).
- Bergan, H. E., Kittilson, J. D., Sheridan, M. A. PKC and ERK mediate GH-stimulated lipolysis. Journal of Molecular Endocrinology. 51 (2), 213-224 (2013).
- Schmitz-Peiffer, C. The tail wagging the dog--regulation of lipid metabolism by protein kinase C. The FEBS Journal. 280 (21), 5371-5383 (2013).
- Carmen, G. Y., Victor, S. M. Signalling mechanisms regulating lipolysis. Cellular Signalling. 18 (4), 401-408 (2006).
- Zu, L., et al. Bacterial endotoxin stimulates adipose lipolysis via toll-like receptor 4 and extracellular signal-regulated kinase pathway. The Journal of Biological Chemistry. 284 (9), 5915-5926 (2009).
- Zhang, H. H., Halbleib, M., Ahmad, F., Manganiello, V. C., Greenberg, A. S. Tumor necrosis factor-alpha stimulates lipolysis in differentiated human adipocytes through activation of extracellular signal-related kinase and elevation of intracellular cAMP. Diabetes. 51 (10), 2929-2935 (2002).
- Tan, X., et al. TNF-α downregulates CIDEC via MEK/ERK pathway in human adipocytes. Obesity. 24 (5), 1070-1080 (2016).
- Laurencikiene, J., et al. NF-kappaB is important for TNF-alpha-induced lipolysis in human adipocytes. Journal of Lipid Research. 48 (5), 1069-1077 (2007).
- van Hall, G., et al. Interleukin-6 stimulates lipolysis and fat oxidation in humans. The Journal of Clinical Endocrinology and Metabolism. 88 (7), 3005-3010 (2003).
- Wueest, S., et al. Mesenteric fat lipolysis mediates obesity-associated hepatic steatosis and insulin resistance. Diabetes. 65 (1), 140-148 (2016).
- Trujillo, M. E., et al. Interleukin-6 regulates human adipose tissue lipid metabolism and leptin production in vitro. The Journal of Clinical Endocrinology and Metabolism. 89 (11), 5577-5582 (2004).
- Kitamura, T., et al. Insulin-induced phosphorylation and activation of cyclic nucleotide phosphodiesterase 3B by the serine-threonine kinase Akt. Molecular and Cellular Biology. 19 (9), 6286-6296 (1999).
- Chakrabarti, P., et al. Insulin inhibits lipolysis in adipocytes via the evolutionarily conserved mTORC1-Egr1-ATGL-mediated pathway. Molecular and Cellular Biology. 33 (18), 3659-3666 (2013).
- Collins, S., Daniel, K. W., Petro, A. E., Surwit, R. S. Strain-specific response to beta 3-adrenergic receptor agonist treatment of diet-induced obesity in mice. Endocrinology. 138 (1), 405-413 (1997).
- Surwit, R. S., Dixon, T. M., Petro, A. E., Daniel, K. W., Collins, S. Diazoxide restores beta3-adrenergic receptor function in diet-induced obesity and diabetes. Endocrinology. 141 (10), 3630-3637 (2000).
- Gettys, T. W., et al. Age-dependent changes in beta-adrenergic receptor subtypes and adenylyl cyclase activation in adipocytes from Fischer 344 rats. Endocrinology. 136 (5), 2022-2032 (1995).
- Mowers, J., et al. Inflammation produces catecholamine resistance in obesity via activation of PDE3B by the protein kinases IKKε and TBK1. eLife. 2, e01119 (2013).
- Valentine, J. M., et al. β3-Adrenergic receptor downregulation leads to adipocyte catecholamine resistance in obesity. The Journal of Clinical Investigation. 132 (2), e153357 (2022).
- Collins, S., et al. Impaired expression and functional activity of the beta 3- and beta 1-adrenergic receptors in adipose tissue of congenitally obese (C57BL/6J ob/ob) mice. Molecular Endocrinology. 8 (4), 518-527 (1994).
- Collins, S., Surwit, R. S. The beta-adrenergic receptors and the control of adipose tissue metabolism and thermogenesis. Recent Progress in Hormone Research. 56, 309-328 (2001).
- Dixon, T. M., Daniel, K. W., Farmer, S. R., Collins, S. CCAAT/enhancer-binding protein alpha is required for transcription of the beta 3-adrenergic receptor gene during adipogenesis. The Journal of Biological Chemistry. 276 (1), 722-728 (2001).
- Lohse, M. J., Benovic, J. L., Codina, J., Caron, M. G., Lefkowitz, R. J. beta-Arrestin: a protein that regulates beta-adrenergic receptor function. Science. 248 (4962), 1547-1550 (1990).
- Nantel, F., et al. The human beta 3-adrenergic receptor is resistant to short term agonist-promoted desensitization. Molecular Pharmacology. 43 (4), 548-555 (1993).
- Liggett, S. B., Freedman, N. J., Schwinn, D. A., Lefkowitz, R. J. Structural basis for receptor subtype-specific regulation revealed by a chimeric beta 3/beta 2-adrenergic receptor. Proceedings of the National Academy of Sciences. 90 (8), 3665-3669 (1993).
- Baker, J. G. The selectivity of beta-adrenoceptor agonists at human beta1-, beta2- and beta3-adrenoceptors. British Journal of Pharmacology. 160 (5), 1048-1061 (2010).
- Lafontan, M. Inhibition of epinephrine-induced lipolysis in isolated white adipocytes of aging rabbits by increased alpha-adrenergic responsiveness. Journal of Lipid Research. 20 (2), 208-216 (1979).
- Baker, J. G. The selectivity of beta-adrenoceptor antagonists at the human beta1, beta2 and beta3 adrenoceptors. British Journal of Pharmacology. 144 (3), 317-322 (2005).
- Jensen, M. D., Nielsen, S. Insulin dose response analysis of free fatty acid kinetics. Metabolism. 56 (1), 68-76 (2007).
- Jensen, M. D., Haymond, M. W., Gerich, J. E., Cryer, P. E., Miles, J. M. Lipolysis during fasting. Decreased suppression by insulin and increased stimulation by epinephrine. The Journal of Clinical Investigation. 79 (1), 207-213 (1987).
- Heckmann, B. L., et al. Defective adipose lipolysis and altered global energy metabolism in mice with adipose overexpression of the lipolytic inhibitor G0/G1 switch gene 2 (G0S2). The Journal of Biological Chemistry. 289 (4), 1905-1916 (2014).
- Shin, H., et al. Lipolysis in brown adipocytes is not essential for cold-induced thermogenesis in mice. Cell Metabolism. 26 (5), 764.e5-777.e5 (2017).
- Treble, D. H., Mayer, J. Glycerolkinase activity in white adipose tissue of obese-hyperglycaemic mice. Nature. 200, 363-364 (1963).
- Possik, E., et al. New mammalian glycerol-3-phosphate phosphatase: role in beta-cell, liver and adipocyte metabolism. Frontiers in Endocrinology. 12, 706607 (2021).
- Romero Mdel, M., Sabater, D., Fernandez-Lopez, J. A., Remesar, X., Alemany, M. Glycerol production from glucose and fructose by 3T3-L1 cells: a mechanism of adipocyte defense from excess substrate. PLoS One. 10 (10), e0139502 (2015).
- Mugabo, Y., et al. Identification of a mammalian glycerol-3-phosphate phosphatase: Role in metabolism and signaling in pancreatic beta-cells and hepatocytes. Proceedings of the National Academy of Sciences. 113 (4), E430-E439 (2016).
- Hanson, R. W., Reshef, L. Glyceroneogenesis revisited. Biochimie. 85 (12), 1199-1205 (2003).
- Vaughan, M. The production and release of glycerol by adipose tissue incubated in vitro. The Journal of Biological Chemistry. 237, 3354-3358 (1962).
- Jensen, M. D., Ekberg, K., Landau, B. R. Lipid metabolism during fasting. American Journal of Physiology-Endocrinology and Metabolism. 281 (4), E789-E793 (2001).
- Ballard, F. J., Hanson, R. W., Leveille, G. A. Phosphoenolpyruvate carboxykinase and the synthesis of glyceride-glycerol from pyruvate in adipose tissue. The Journal of Biological Chemistry. 242 (11), 2746-2750 (1967).
- Reshef, L., Hanson, R. W., Ballard, F. J. A possible physiological role for glyceroneogenesis in rat adipose tissue. The Journal of Biological Chemistry. 245 (22), 5979-5984 (1970).
- Gorin, E., Tal-Or, Z., Shafrir, E. Glyceroneogenesis in adipose tissue of fasted, diabetic and triamcinolone treated rats. European Journal of Biochemistry. 8 (3), 370-375 (1969).
- Elia, M., Zed, C., Neale, G., Livesey, G. The energy cost of triglyceride-fatty acid recycling in nonobese subjects after an overnight fast and four days of starvation. Metabolism. 36 (3), 251-255 (1987).
- Reshef, L., et al. Glyceroneogenesis and the triglyceride/fatty acid cycle. Journal of Biological Chemistry. 278 (33), 30413-30416 (2003).
- Edens, N. K., Leibel, R. L., Hirsch, J. Mechanism of free fatty acid re-esterification in human adipocytes in vitro. Journal of Lipid Research. 31 (8), 1423-1431 (1990).
- Vaughan, M., Steinberg, D. Effect of hormones on lipolysis and esterification of free fatty acids during incubation of adipose tissue in vitro. Journal of Lipid Research. 4, 193-199 (1963).
- Brooks, B., Arch, J. R., Newsholme, E. A. Effects of hormones on the rate of the triacylglycerol/fatty acid substrate cycle in adipocytes and epididymal fat pads. Federation of European Biochemical Societies Letters. 146 (2), 327-330 (1982).
- Bjorntorp, P., Karlsson, M., Hovden, A. Quantitative aspects of lipolysis and reesterification in human adipose tissue in vitro. Acta Medica Scandinavica. 185 (1-2), 89-97 (1969).
- Angel, A., Desai, K., Halperin, M. L. Free fatty acid and ATP levels in adipocytes during lipolysis. Metabolism. 20 (1), 87-99 (1971).
- Husted, A. S., et al. Autocrine negative feedback regulation of lipolysis through sensing of NEFAs by FFAR4/GPR120 in WAT. Molecular Metabolism. 42, 101103 (2020).
- Fain, J. N., Shepherd, R. E. Free fatty acids as feedback regulators of adenylate cyclase and cyclic 3':5'-AMP accumulation in rat fat cells. The Journal of Biological Chemistry. 250 (16), 6586-6592 (1975).
- Burns, T. W., Langley, P. E., Terry, B. E., Robinson, G. A. The role of free fatty acids in the regulation of lipolysis by human adipose tissue cells. Metabolism. 27 (12), 1755-1762 (1978).
- Kalderon, B., et al. Suppression of adipose lipolysis by long-chain fatty acid analogs. Journal of Lipid Research. 53 (5), 868-878 (2012).
- Schweiger, M., et al. Measurement of lipolysis. Methods in Enzymology. 538, 171-193 (2014).
- Decaunes, P., Bouloumie, A., Ryden, M., Galitzky, J. Ex vivo analysis of lipolysis in human subcutaneous adipose tissue explants. Bio-Protocol. 8 (3), e2711 (2018).
- Roy, D., Myers, J. M., Tedeschi, A. Protocol for assessing ex vivo lipolysis of murine adipose tissue. STAR Protocols. 3 (3), 101518 (2022).
- Baskaran, P., Thyagarajan, B. Measurement of basal and forskolin-stimulated lipolysis in inguinal adipose fat pads. Journal of Visualized Experiments. 125 (125), 55625 (2017).
- Reilly, S. M., et al. Catecholamines suppress fatty acid re-esterification and increase oxidation in white adipocytes via STAT3. Nature Metabolism. 2 (7), 620-634 (2020).
- Liu, L., et al. Isolation of mouse stromal vascular cells for monolayer culture. Methods in Molecular Biology. 1566, 9-16 (2017).
- DeLuca, J. H., Reilly, S. M. . Methods in Molecular Biology. , (2023).
- Richard, G., Vernon, R. A. C. New Perspectives in Adipose Tissue. Butterworth-Heinemann. , (1985).
- Brito, M. N., Botion, L. M., Brito, N. A., Kettelhut, I. C., Migliorini, R. H. Lipolysis and glycerokinase activity in brown adipose tissue of rat fed a high protein, carbohydrate-free diet. Hormone and Metabolic Research. 26 (1), 51-52 (1994).
- Bertin, R. Glycerokinase activity and lipolysis regulation in brown adipose tissue of cold acclimated rats. Biochimie. 58 (4), 431-434 (1976).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon