JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
단세포 물질 특성 측정을 위한 전단 분석 프로토콜
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 시험관 내에서 암성 및 비암성 세포주의 기계적 특성의 정량화를 설명합니다. 암세포와 정상 세포의 역학에서 보존된 차이는 예후와 진단에 영향을 미칠 수 있는 바이오마커로 작용할 수 있습니다.
초록
불규칙한 생체 역학은 광범위한 연구 대상인 암 생물학의 특징입니다. 셀의 기계적 특성은 재료의 기계적 특성과 유사합니다. 스트레스와 긴장에 대한 세포의 저항력, 이완 시간 및 탄력성은 모두 다른 유형의 세포와 비교하고 도출할 수 있는 특성입니다. 암성(악성) 세포와 정상(비악성) 세포의 기계적 특성을 정량화함으로써 연구자들은 이 질병의 생물물리학적 기초를 추가로 밝힐 수 있습니다. 암세포의 기계적 특성은 정상 세포의 기계적 특성과 일관되게 다른 것으로 알려져 있지만, 배양 중인 세포로부터 이러한 특성을 추론하는 표준 실험 절차는 부족합니다.
이 논문은 유체 전단 분석을 사용하여 시험관 내에서 단일 세포의 기계적 특성을 정량화하는 절차를 간략하게 설명합니다. 이 분석의 원리는 단일 세포에 유체 전단 응력을 적용하고 시간 경과에 따른 세포 변형을 광학적으로 모니터링하는 것입니다. 세포 기계적 특성은 디지털 이미지 상관 관계 (DIC) 분석을 사용하고 DIC 분석에서 생성 된 실험 데이터에 적절한 점탄성 모델을 맞추는 데 사용됩니다. 전반적으로, 여기에 요약된 프로토콜은 치료하기 어려운 암의 진단을 위한 보다 효과적이고 표적화된 방법을 제공하는 것을 목표로 합니다.
서문
암성 세포와 비암성 세포 간의 생물물리학적 차이를 연구하면 새로운 진단 및 치료 기회를 얻을 수 있습니다1. 생체역학/기계생물학의 차이가 종양 진행 및 치료 저항성에 어떻게 기여하는지 이해하면 표적 치료 및 조기 진단을 위한 새로운 길을 제시할 수 있습니다2.
암세포의 기계적 성질이 정상 세포와 다르다는 것은 알려져 있지만(예를 들어, 원형질막과 핵막의 점탄성)3,4,5, 살아있는 세포에서 이러한 성질을 측정하기 위한 견고하고 재현 가능한 방법은 부족하다6. 전단 분석 방법은 단일 세포에 유체 전단 응력을 가하고 적용된 응력 3,4,5,7,8,9에 대한 개별 반응 및 저항을 분석하여 세포의 기계적 특성을 정량화하는 데 사용됩니다. 단일 세포의 기계적 특성을 특성화하기 위해 여러 방법 및 기술이 사용되었지만, 이들은 i) 원자력 현미경(AFM)과 관련된 압흔 깊이, 복잡한 팁 형상 또는 기판 경화로 인한 세포막을 천공/손상시킴으로써 세포 재료 특성에 영향을 미치는 경향이 있습니다.10,11, ii) 광학 트래핑(12) 동안 세포 광손상을 유도하고, 13, 또는 iii) 마이크로피펫 흡인과 관련된 복잡한 스트레스 상태 유도14,15. 이러한 외부 효과는 세포 점탄성 측정 6,16,17의 정확도에 상당한 불확실성과 관련이 있습니다.
이러한 한계를 해결하기 위해 여기에 설명된 전단 분석 방법은 공정에서 세포 물질 특성에 영향을 주지 않고 신체의 생리학적 흐름을 시뮬레이션할 수 있는 고도로 제어 가능하고 간단한 접근 방식을 제공합니다. 이 분석에서 유체 전단 응력은 순환 동안 종양 간질 내 또는 혈액 내의 체액에 의해 신체의 세포가 경험하는 기계적 응력을 나타냅니다18,19,20. 또한, 이러한 체액 스트레스는 종양 형성 세포와 비종양 형성 세포 사이에서 변하는 진행, 이동, 전이 및 세포 사멸을 포함하여 암세포에서 다양한 악성 행동을 촉진합니다 19,21,22,23. 더욱이, 암세포의 변형된 기계적 특징(즉, 암세포는 종종 동일한 기관 내에서 발견되는 정상 세포보다 "부드럽다")은 암세포가 적대적인 종양 미세 환경에서 지속되고, 주변 정상 조직을 침범하고, 먼 부위로 전이될 수 있도록 한다24,25,26. 세포가 생리학적 수준의 유체 전단 응력을 경험하는 유사 생물학적 환경을 생성함으로써 생리학적으로 관련이 있고 세포를 파괴하지 않는 과정이 달성됩니다. 이러한 적용된 유체 전단 응력에 대한 세포 반응을 통해 세포의 기계적 특성을 특성화할 수 있습니다.
이 논문은 적용된 전단 응력 하에서 암성 및 비암성 세포의 기계적 특성과 거동에 대한 광범위한 연구를 위한 전단 분석 프로토콜을 제공합니다. 세포는 탄성 있고 점성이있는 방식으로 외력에 반응하므로 점탄성 물질3로 이상화 될 수 있습니다. 이 기술은 (i) 분산된 단일 세포의 세포 배양, (ii) 유체 전단 응력의 제어된 적용, (iii) 세포 거동의 현장 이미징 및 관찰(응력 및 변형에 대한 내성 포함), (iv) 변형 정도를 결정하기 위한 세포의 변형률 분석, (v) 단일 세포의 점탄성 특성 특성화로 분류됩니다. 이러한 기계적 특성과 거동을 조사함으로써 복잡한 세포 역학을 정량화 가능한 데이터로 증류할 수 있습니다. 이 방법을 설명하는 프로토콜은 다양한 악성 및 비악성 세포 유형을 분류하고 비교할 수 있습니다. 이러한 차이를 정량화하면 진단 및 치료 바이오마커를 확립할 수 있습니다.
프로토콜
1. 단세포 전단 분석을 위한 준비
- 세포 배양
- 2mL의 배양 배지가 들어 있는 35mm x 10mm 페트리 접시에 약 50,000개의 현탁 단일 세포를 시딩합니다.
참고: 파종 전에 부유 세포를 소용돌이쳐 세포 응집체를 분해합니다. - 세포를 37°C에서 배양하고 세포 부착 및 완전한 세포골격 단백질 형성을 위해 10 내지 48시간 사이를 허용한다.
참고: 세포 응집을 피하면서 적절한 세포 성장과 부착을 보장하기 위해 세포 부착 기간과 증식 및 성장 속도를 고려하십시오. 이러한 매개 변수는 셀 유형에 따라 다릅니다.
- 2mL의 배양 배지가 들어 있는 35mm x 10mm 페트리 접시에 약 50,000개의 현탁 단일 세포를 시딩합니다.
2. 전단 분석 실험
- 전단 분석 점성 유동 매체의 제조
- 약간 점성이 있는 유동 배지(0.015-0.02 Pa·s)를 보장하기 위해 0.05wt%의 무독성 및 비알레르기성 메틸셀룰로오스(4Pa·s)를 측정하여 배양 배지에 추가합니다.
- 균일한 혼합을 보장하기 위해 마그네틱 교반기/핫 플레이트를 사용하여 ~60-70°C의 온도에서 기본 배양 배지를 ~10-20분 동안 예열합니다. 매체를 계속 교반하면서 메틸셀룰로오스 입자의 응고를 피하기 위해 빠르게 분산되도록 메틸셀룰로오스를 부드럽게 첨가합니다. 이 과정을 ~15-24시간 동안 계속하여 매체 + 셀룰로오스의 투명한 용액을 보장합니다.
알림: 용액을 과도하게 가열하지 마십시오. - 유동 매체의 점도를 측정하려면 레오미터를 사용하여 ~0.5-1mL의 대표적인 유동 매체를 테스트합니다. 판독값에서 유체 점도를 결정하고 이 값을 사용하여 전단 유체 매체(μ)의 점도를 나타내고 방정식 2를 사용하여 전단 응력을 계산합니다.
- 전단 장치 설정
- 점성 배양 배지의 주입 및 회수를 위해 프로그래밍 가능한 주사기 펌프에 연결된 이중 주사기(60mL 또는 100mL)의 전단 분석 시스템을 설정합니다(그림 1).
- 두 주사기를 1/16인치 튜빙 및 튜빙 커넥터를 통해 플로우 챔버에 부착합니다.
- 고무 개스킷을 고정하여 유로를 따라 단일 셀에 제어되고 균일한 흐름을 제공합니다(그림 1). 고무 개스킷은 달성하고자 하는 유동 프로파일(층류 또는 난류)과 원하는 관찰 영역(예: 길이 22.5mm, 너비 2.5mm, 높이 0.254mm)에 따라 다양한 크기로 제공됩니다(그림 1).
- 지정된 속도(예: 60mL/분)로 일정량의 유체(예: 1mL/분)를 주입 및 배출하도록 펌프를 프로그래밍하고 해당 주사기(예: 60mL)를 선택합니다.
알림: 걸림이나 오작동을 방지하기 위해 최대 주입 및 인출 볼륨 사전 설정을 고려하십시오. 필요한 펌프 전단 속도를 계산하기 위해 방정식 (2)를 사용합니다(필요한 응력과 점도를 알고 있다고 가정).
- 전단 설정
- 준비된 점성 유동 매체로 주사기를 채 웁니다.
- 60mL 또는 100mL(또는 필요에 따라)의 점성 유동 매체로 채워진 주사기와 빈 60mL 주사기를 프로그래밍 가능한 주사기 펌프의 해당 위치에 부착합니다. 튜빙 및 튜빙 커넥터를 통해 두 주사기를 플로우 챔버에 연결합니다.
- 단일 셀을 쉽게 식별하고 유동 챔버와 페트리 접시 사이의 고정 연결을 보장하려면 고무 개스킷을 유동 챔버에 부착하십시오.
- 관심 있는 세포가 들어 있는 페트리 접시에서 세포 배양 배지를 흡인합니다.
- 인산염 완충 식염수(PBS)를 사용하여 죽은 세포와 느슨하게 부착된 세포를 씻어냅니다.
- PBS를 흡인합니다.
- 플로우 챔버와 고무 개스킷(~34mm x 9mm)을 부착된 셀이 들어 있는 페트리 접시(35mm x 10mm)에 삽입하고 고정합니다.
- 장착된 미세유체 유동 챔버 + 세포를 배양된 접시에 도립 현미경 위에 놓고 높은 픽셀 값(일반적으로 40x 에서 63x 배율 사이)의 고품질 이미지를 얻을 수 있을 만큼 충분히 높은 현미경 대물렌즈와 디스플레이 모니터를 사용합니다.
- 디스플레이 모니터의 현미경 소프트웨어에서 라이브 이미지 (일부 소프트웨어의 경우 타임랩스) 옵션을 선택합니다. PC의 현미경 소프트웨어에 t(타임랩스) 기능이 있거나 비디오 녹화를 할 수 있는지 확인합니다.
- 현미경 대물렌즈에 초점을 맞춰 적절한 대비와 뚜렷한 세포 가장자리를 보장합니다. 이는 전단 후 이미지 분석에 필요합니다. 현미경 스테이지를 움직여 세포가 디스플레이 모니터에 선명하게 보이고 라이브 이미지인지 확인합니다.
- 장착된 유동 챔버 + 페트리 접시(개스킷을 유동 챔버에 끼워 생성된 영역/경로)의 이미징/유동 경로 내에서 셀 또는 여러 개의 개별 셀을 선택합니다.
- 전단 및 이미징
- 지속적으로 균일한 흐름을 유지하려면 유사한 주입 및 회수 속도를 선택하고 일반적으로 1mL/분에서 5mL/분 사이의 유체의 층류 를 보장합니다. 낮은 층류 영역의 경우 Reynold의 Re 수를 100< 확인합니다.
- 전단 펌프에서 실행을 클릭하여 전단 유체(준비된 점성 매체)를 연속적인 속도로 주입 및 배출합니다. 수액 주입 중에 기포가 없는지 확인하십시오., 이는 세포에 설명되지 않은 외부 스트레스를 유발할 수 있기 때문입니다.
- 주입된 전단액이 현미경으로 관심 있는 세포와 접촉하기 전에 현미경 소프트웨어에서 녹화를 클릭하여 비디오 녹화 를 시작합니다.
- 7분 동안 또는 원하는 스트레스 노출 기간 동안 또는 관심 있는 세포가 접시 바닥에서 잘릴 때까지 계속 기록합니다. 원하는 대로 실행이 완료되면 현미경 소프트웨어에서 기록 중지 를 클릭합니다.
- 녹음을 저장하고 .tiff 파일로 추출합니다. 가급적이면 손쉬운 분석을 위해 초당 1프레임 으로 이미지를 추출합니다.
3. 데이터 처리
- 디지털 영상 상관 절차(영상 분석)
- 현미경에서 촬영한 내용을 비디오 파일로 추출한 경우 이미지 프레임(가급적.tiff 파일 형식)으로 변환합니다.
- 전단 분석 기록에서 파생된 이미지를 Davis 10.1.2 소프트웨어(DIC 소프트웨어)로 가져와서 각각의 새 이미지(변형된 이미지)에서 참조 이미지의 각 픽셀 블록(하위 집합)을 찾아 세포의 자연 패턴화된 구조의 움직임을 추적합니다(그림 2).
- 최적화된 상관관계를 위해 31 x 31픽셀의 부분 집합 크기, 20픽셀의 스텝 크기(각 부분 집합의 변형 거리) 및 마지막 이미지에 대한 새 이미지의 변형을 추적하는 차동 추적 옵션의 합 을 활용합니다. 이 상관관계의 결과는 MATLAB에서 추가 분석을 위해 .csv 파일로 내보낼 수 있는 변형률 시간 플롯(그림 3)입니다.
- 선택한 단일 셀에 대한 관심 영역을 매핑합니다. 매핑된 셀 내에서 임의의 점을 선택하여 변형을 추적합니다. 셀과 같은 불규칙한 모양의 경우 다각형 마스크를 사용하여 셀의 기하 도형을 매핑합니다.
- 매핑 후 스트레인 게이지 추가를 클릭하고 정의된 세포 경계 내의 지점에서 개별 스트레인 게이지 를 그려 분석할 세포의 특정 지점(핵 또는 세포질)을 선택합니다.
- 실행( Run )을 클릭하여 변형률 처리를 시작하고 변형률 대 시간 데이터를 얻습니다.
- 생성된 변형률 플롯을 두 번 클릭(또는 마우스 오른쪽 버튼 클릭)하고 데이터를 스프레드시트로 내보내기를 선택합니다.
4. 기계적 성질 특성화
- 점탄성 특성 분석
- MATLAB에서 쉽게 읽을 수 있도록 DIC 소프트웨어의 변형 시간 데이터가 포함된 .csv 파일을 별도의 폴더에 저장합니다.
- MATLAB을 실행하고 편집기 탭을 클릭하여 편집기 페이지를 열고 스프레드시트를 셀별로 읽는 코드를 작성합니다.
- 분석할 데이터가 포함된 폴더에 액세스하도록 MATLAB 경로(관심 있는 파일에 액세스하는 폴더 경로)를 변경합니다(예: Users/Username/Desktop/data).
- MATLAB 편집기 페이지에서 사용자 지정 코드를 사용하여 스프레드시트 데이터에 액세스합니다. 예를 들어, a1= xlsread('data','run1','A4:A183'), 여기서 a1은 식별자를 나타내고, xlsread는 .csv 파일(이 경우 스프레드시트)을 읽어 들이는 MATLAB 함수이고, data는 파일 이름이고, run1은 시트 이름이고, A4:A183은 분석할 스프레드시트 데이터의 셀 A에서 관심 있는 데이터의 범위입니다. 완전한 적합을 위해 x와 y(각각 시간 및 변형률)를 분석하십시오. 예를 들어:
a1=xlsread('데이터','run1','A4:A183');
b1=xlsread('데이터','run1','B4:B183');
a1 = x(시간) 및 b1 = y(변형률). - MATLAB에서 앱 | 커브 피팅 | 사용자 지정 방정식. 대표 사용자 지정 방정식을 지우고 점탄성 모델 방정식 [방정식 (1)]을 입력합니다. 여기서 ε는 x 변수를 나타내고 t는 y 변수를 나타냅니다.
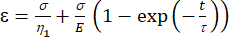 (1개)
(1개)
여기서, ε는 변형률을, σ는 전단 응력을 나타내고, η 1은 점도를 나타내고, E는 탄성을 나타내고, t는 시간을 나타내고, τ는 완화 시간을 나타내며, 이는 1차 변형 후 셀이 원래 모양으로 복귀하는 데 필요한 최대 시간을 특징으로 한다. τ =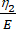 로 표시되며, 여기서 η 2는 두 번째 대시 포트에 대한 2차 점도 항입니다(그림 4).
로 표시되며, 여기서 η 2는 두 번째 대시 포트에 대한 2차 점도 항입니다(그림 4). - 새 변수를 사용자 지정 방정식 인터페이스 내의 점탄성 파라미터에 재할당합니다. (ε, η1, E, σ, t 및 τ =
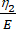 ) 는 각각 (x, a, b, K, y 및 c)를 나타냅니다. 여기서 x와 y는 각각 독립변수와 종속변수이다. 전단 응력(σ)은 식 (2)를 사용하여 결정할 수 있습니다.
) 는 각각 (x, a, b, K, y 및 c)를 나타냅니다. 여기서 x와 y는 각각 독립변수와 종속변수이다. 전단 응력(σ)은 식 (2)를 사용하여 결정할 수 있습니다.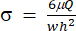 (2개)
(2개)
여기서, μ는 전단유체 매질의 점도를 나타내고, Q는 펌프 유량을 나타내며, w 와 h 는 각각 도 1C에 도시된 유동채널의 폭과 높이이다. - 데이터 선택을 클릭하여 각 데이터 세트에 대한 시간(a1) 및 변형률(b1)을 선택합니다.
- Auto Fit 상자 옵션이 선택되어 있는지 확인합니다. 이렇게 하면 데이터(x 및 y)가 선택될 때 피팅이 자동으로 실행됩니다.
- 피팅 방법을 선택하여 경계 조건을 조입니다. 방법(Methods) 카테고리에서 고급 옵션(Advanced Options)을 클릭하고 비선형 최소제곱(Nonlinear Least Squares)을 선택합니다. Robust(강력)에서 Off(끄기)를 선택하고 Algorithm(알고리즘)에서 Trust-Region(신뢰 지역)을 선택합니다. 다른 모든 매개 변수는 그대로 둡니다.
- 피팅 후 새로운 변수(a, b, c)는 각각 셀의 점탄성 특성, 점도, 탄성 및 이완 시간(η1, E, EQUAT)을 나타냅니다(그림 5).
- 데이터 출력이 점탄성 모델의 실제 적합치로 간주될 수 있는지 확인하기 위해 적합치의 높은 R-제곱 값(R2 > 80%)을 찾습니다(그림 3)
결과
DIC 및 점탄성 모델을 사용한 변형 분석과 결합된 전단 분석 프로토콜은 시험관 내에서 단일 세포의 기계적 특성을 정량화하는 데 성공적입니다. 이 방법은 정상 인간 유방 세포(MCF-10A)3,4,9, 전이성이 적은 삼중 음성 유방암 세포(MDA-MB-468)3, 삼중 음성 유방암 세포(MDA-MB-231)3, 인간 골육종 세포 7,8, 그리고 가장 최근에는 교?...
토론
세포와 주변의 기계적 미세 환경 및 기계적 응력에 대한 반응을 시뮬레이션하기 위해 유사 기계 생물학적 환경을 설정하는 것을 포함하는 전단 분석 방법은 세포 기계적 특성 카탈로그를 생성했으며, 그 패턴은 암 세포주 3,4,5,7,8 사이에서 보존 된 물리적 이형성을 보여줍니다
공개
저자는 공개할 경쟁적인 재정적 이해 관계가 없습니다.
감사의 말
저자들은 이 기술을 처음 개척한 Worcester Polytechnic Institute의 Soboyejo 그룹의 이전 연구원인 Drs. Yifang Cao, Jingjie Hu 및 Vanessa Uzonwanne에게 감사드립니다. 이 연구는 국립 암 연구소 (NIH / NCI K22 CA258410 to M.D.)의 지원을 받았다. 피규어는 BioRender.com 로 만들어졌습니다.
자료
| Name | Company | Catalog Number | Comments |
| CELL CULTURE | |||
| .25% Trypsin, 2.21 mM EDTA, 1x[-] sodium bicarbonate | Corning | 25-053-ci | For cellular detachment from substrate in cell culture |
| 15 mL centrifuge tubes | Falcon by Corning | 05-527-90 | |
| 35 mm Petri dishes | Corning | 430165 | |
| 50 mL centrifuge tubes | Falcon by Corning | 14-432-22 | |
| centrifuge | any | For sterile cell culture | |
| Dulbecco's Modification of Eagle's Medium (DMEM) 1x | Corning | 10-013-cv | Or any other media for culturing cells. DMEM was used for culturing U87 cells |
| gloves | any | For sterile cell culture | |
| Heracell Vios 160i CO2 Incubator | Thermo Scientific | 51033770 | For Incubation during cell culture |
| Hood | any | For sterile cell culture | |
| micropipette | any | For sterile cell culture | |
| micropipette tips | any | For sterile cell culture | |
| Microscope | Leica/any | For sterile cell culture | |
| Phosphate Buffered Saline without calcium and magnesium PBS, 1x | Corning | 21-040-CM | |
| pipetman | any | For sterile cell culture | |
| pipette tips | any | For sterile cell culture | |
| Precision GP 10 liquid incubator | Thermo Scientific | TSGP02 | |
| T25 flask | Corning | 430639 | |
| T75 flask | Corning | 430641U | |
| SHEAR ASSAY | |||
| 100 mL beaker | any | For creating DMEM + methyl cellulose viscous shear media | |
| DMEM | Corning | ||
| Flow chamber + rubber gasket | Glycotech | 31-001 | Circular Flow chamber Kit ( for 35 mm tissue culture dishes) |
| Hybrid Rheometer | HR-2 Discovery Hybrid Rheometer | For determination of shear fluid viscosity | |
| magnetic stir bar | any | For creating DMEM + methyl cellulose viscous shear media | |
| magnetic stir plate | any | For creating DMEM + methyl cellulose viscous shear media | |
| methyl cellulose | any | To increase viscosity of DMEM in flow media | |
| Syringe Pump | KD Scientific Geminin 88 plus | 788088 | For programming fluid infusion and withdrawal |
| syringes, tubing, and connectors | For shear apparatus setup | ||
| SOFTWARE | |||
| ABAQUS software | Simulia | ||
| Digitial Image Correlation software | LaVision, Germany | DAVIS 10.1.2 | |
| Imaging software | Leica/any microscope software | ||
| MATLAB | MATLAB | MATLAB_R2020B |
참고문헌
- Sethi, S., Ali, S., Philip, P. A., Sarkar, F. H. Clinical advances in molecular biomarkers for cancer diagnosis and therapy. International Journal of Molecular Sciences. 14 (7), 14771-14784 (2013).
- Runel, G., Lopez-Ramirez, N., Chlasta, J., Masse, I. Biomechanical properties of cancer cells. Cells. 10 (4), 887 (2021).
- Hu, J., Zhou, Y., Obayemi, J. D., Du, J., Soboyejo, W. O. An investigation of the viscoelastic properties and the actin cytoskeletal structure of triple negative breast cancer cells. Journal of the Mechanical Behavior of Biomedical Materials. 86, 1-13 (2018).
- Onwudiwe, K., et al. Investigation of creep properties and the cytoskeletal structures of non-tumorigenic breast cells and triple-negative breast cancer cells. Journal of Biomedical Materials Research. Part A. 110 (5), 1004-1020 (2022).
- Ani, C. J., et al. A shear assay study of single normal/breast cancer cell deformation and detachment from poly-di-methyl-siloxane (PDMS) surfaces. Journal of the Mechanical Behavior of Biomedical Materials. 91, 76-90 (2019).
- Suresh, S. Biomechanics and biophysics of cancer cells. Acta Biomaterialia. 3 (4), 413-438 (2007).
- Cao, Y., et al. Investigation of the viscoelasticity of human osteosarcoma cells using a shear assay method. Journal of Materials Research. 21 (8), 1922-1930 (2006).
- Cao, Y. On the measurement of human osteosarcoma cell elastic modulus using shear assay experiments. Journal of Materials Science. Materials in Medicine. 18 (1), 103-109 (2007).
- Onwudiwe, K., et al. Actin cytoskeletal structure and the statistical variations of the mechanical properties of non-tumorigenic breast and triple-negative breast cancer cells. Journal of the Mechanical Behavior of Biomedical Materials. 119, 104505 (2021).
- Kirmizis, D., Logothetidis, S. Atomic force microscopy probing in the measurement of cell mechanics. International Journal of Nanomedicine. 5, 137-145 (2010).
- Haase, K., Pelling, A. E. Investigating cell mechanics with atomic force microscopy. Journal of the Royal Society. Interface. 12 (104), 20140970 (2015).
- Zhang, H., Liu, K. K. Optical tweezers for single cells. Journal of the Royal Society. Interface. 5 (24), 671-690 (2008).
- Peterman, E. J. G., Gittes, F., Schmidt, C. F. Laser-induced heating in optical traps. Biophysical Journal. 84, 1308-1316 (2003).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33 (1), 15-22 (2000).
- Evans, E., Yeung, A. Apparent viscosity and corticcal tension of blood granulocytes determined by micropipet aspiration. Biophysical Journal. 56 (1), 151-160 (1989).
- Van Vliet, K. J., Bao, G., Suresh, S. The biomechanics toolbox: experimental approaches for living cells and biomolecules. Acta Materialia. 51 (19), 5881-5905 (2003).
- Moeendarbary, E., Harris, A. R. Cell mechanics: principles, practices, and prospects. Wiley Interdisciplinary Reviews. Systems Biology and Medicine. 6 (5), 371-388 (2014).
- Choi, H. Y., et al. Hydrodynamic shear stress promotes epithelial-mesenchymal transition by downregulating ERK and GSK3beta activities. Breast Cancer Research. 21 (1), 6 (2019).
- Northcott, J. M., Dean, I. S., Mouw, J. K., Weaver, V. M. Feeling stress: The mechanics of cancer progression and aggression. Frontiers in Cell and Developmental Biology. 6, 17 (2018).
- Onwudiwe, K., Najera, J., Siri, S., Datta, M. Do tumor mechanical stresses promote cancer immune escape. Cells. 11 (23), 3840 (2022).
- Heldin, C. H., Rubin, K., Pietras, K., Ostman, A. High interstitial fluid pressure - an obstacle in cancer therapy. Nature Reviews. Cancer. 4 (10), 806-813 (2004).
- Krog, B. L., Henry, M. D. Biomechanics of the circulating tumor cell microenvironment. Advances in Experimental Medicine and Biology. 1092, 209-233 (2018).
- Moose, D. L., et al. Cancer cells resist mechanical destruction in circulation via RhoA/actomyosin-dependent mechano-adaptation. Cell Reports. 30 (11), 3864-3874 (2020).
- Mao, B. H., Nguyen Thi, K. M., Tang, M. J., Kamm, R. D., Tu, T. Y. The interface stiffness and topographic feature dictate interfacial invasiveness of cancer spheroids. Biofabrication. 15 (1), (2023).
- Kashani, A. S., Packirisamy, M. Cancer cells optimize elasticity for efficient migration. Royal Society Open Science. 7 (10), 200747 (2020).
- Riehl, B. D., Kim, E., Bouzid, T., Lim, J. Y. The role of microenvironmental cues and mechanical loading milieus in breast cancer cell progression and metastasis. Frontiers in Bioengineering and Biotechnology. 8, 608526 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유