Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kararlı İzotop izlemeyi kullanma Kompleks Hücre Toplulukları Sıralama alt popülasyonlar Metabolizma Ölçme Bir Yöntem
Bu Makalede
Özet
This article describes a method for studying cellular metabolism in complex communities of multiple cell types, using a combination of stable isotope tracing, cell sorting to isolate specific cell types, and mass spectrometry.
Özet
Mammalian cell types exhibit specialized metabolism, and there is ample evidence that various co-existing cell types engage in metabolic cooperation. Moreover, even cultures of a single cell type may contain cells in distinct metabolic states, such as resting or cycling cells. Methods for measuring metabolic activities of such subpopulations are valuable tools for understanding cellular metabolism. Complex cell populations are most commonly separated using a cell sorter, and subpopulations isolated by this method can be analyzed by metabolomics methods. However, a problem with this approach is that the cell sorting procedure subjects cells to stresses that may distort their metabolism.
To overcome these issues, we reasoned that the mass isotopomer distributions (MIDs) of metabolites from cells cultured with stable isotope-labeled nutrients are likely to be more stable than absolute metabolite concentrations, because MIDs are formed over longer time scales and should be less affected by short-term exposure to cell sorting conditions. Here, we describe a method based on this principle, combining cell sorting with liquid chromatography-high resolution mass spectrometry (LC-HRMS). The procedure involves analyzing three types of samples: (1) metabolite extracts obtained directly from the complex population; (2) extracts of "mock sorted" cells passed through the cell sorter instrument without gating any specific population; and (3) extracts of the actual sorted populations. The mock sorted cells are compared against direct extraction to verify that MIDs are indeed not altered by the cell sorting procedure itself, prior to analyzing the actual sorted populations. We show example results from HeLa cells sorted according to cell cycle phase, revealing changes in nucleotide metabolism.
Giriş
Yüksek organizmalar daha karmaşık işlevleri hakkında getirmek için işbirliği farklı hücre tiplerinin karmaşık topluluklar içerir. Örneğin, tümörler de sadece kanserli hücreleri, ancak fibroblastlar, kan damarlarını oluşturan ve genellikle bağışıklık hücresi 1 infiltratlarının hücreleri içerir; Kan bağışıklık hücresi alt tiplerinin 2 onlarca karmaşık bir karışımını içerir; ve hatta kültürlenmiş hücre çizgileri, luminal ve göğüs kanseri hücrelerinin 3 taban alt tipleri gibi birden fazla alt popülasyonlarının, oluşabilirler. Metabolik "işbirliği" sergileyebilir arada Dahası, farklı hücre tipleri. Örneğin, beyinde, astrositler bu alt tabakayı 4 okside nöronlara ardından "beslenen" dir laktat, glikoz dönüştürmek için düşünülen; T lenfositleri sistein 5 kaynağı olarak bitişik dendritik hücreler göre bazı bağlamlarda vardır; ve kanser hücrelerinin Asso ile işbirliği yapabilirtümör 6 kaygılar da fibroblastlar. Bu tür sistemlerin metabolik davranışını anlamak için, ayrı ve mevcut olan çeşitli hücre tipleri metabolik etkinliklerini ölçmek için gereklidir.
Bugüne kadar hücre türlerini ayırmak için en yaygın kullanılan yöntem floresan aktive hücre sıralama olduğunu. Bu yöntem, hücre tipi veya ilgi durumu floresan antikorlar, işlenmiş floresan proteinleri ifade ya da diğer boyalar kullanarak "etiketli" koşuluyla, geniş çapta uygulanabilir. Bir seçenek hücre sıralayıcı ile birbirinden bağımsız olarak hücre türleri, yeniden kültür elde edilen ayrı hücre tipleri için, ve daha sonra bu kültürler 7 metabolizması çalışmalar yapmak. Hücre tipi veya fenotip kültür şartlarında stabildir ve hücre döngüsü devletler, ne de ko-kültürlerde metabolik işbirliği gibi geçici davranış yakalama olamaz Ancak, bu sadece uygulanabilir. Bu gibi durumlarda, metabolizma, böylece doğrudan ölçülmelidirrted hücreleri. Bu prosedür sıralama hücre kendi metabolizmasını 8 bozulabilir gerilimlere hücreleri tabi çünkü zorlu ve biz bu yaklaşımı 9, 10 alarak sadece bir kaç çalışmalar farkındayız. Özellikle, mutlak metaboliti bolluğu ölçümleri artık güvenilir böylece amino asitler gibi önemli metabolitleri, hücre sıralama tamponunda tutulan hücrelerden sızabilir bulduk 11 (sıralı fraksiyonları arasındaki göreceli karşılaştırma hala değerli olabilir rağmen).
Bu sorunları aşmak için, biz sıralama öncesinde duraylı izotop hücreleri etiket ve hücresel metabolitleri yerine metabolit bolluklarının MID odaklanmak. MID uzun zaman ölçeklerinde üzerinde oluştuğu için, daha az sıralama koşullara kısa süreli maruz kalma etkilenen edilmelidir. Biz DA sağlayacak kadar hassastır tam tarama yüksek çözünürlüklü kütle spektrometresi kullanılarak MID ölçmekhücre sıralama zamanın yaklaşık 30-60 dk gerektiren yaklaşık 500.000 sıralanmış hücrelerden başlayarak metabolitlerin yüzlerce, üzerinde ta. kültür çanak gözlenen MID orijinal kültür bulunanların temsil olmasını sağlamak için yapılır bir arasında bir karşılaştırma doğrudan kontrolü (herhangi bir özel nüfus yolluk olmadan cep sıralayıcı enstrüman geçirilerek hücreleri) ve metabolit çıkarma "mock sınıflandırılmaktadır". kararlı izotop izleyicilerin seçimi bağlı olarak, çeşitli metabolik yollar bu yöntemle ele alınabilir.
Protokol
1. Metabolit Ekstraksiyon
- Çanak Ekstraksiyon
- izotop etiketli kültür ortamı + diyaliz takviyeleri (serum veya diğer büyüme takviyeleri) içinde üç kopya halinde bir 6-yuvalı plaka içindeki kültür hücreleri hücreler% 75 konfluent hale gelene kadar.
Not: U- 13 C-Glukoz% 40 ihtiva eden RPMI içinde 48 saat ve% 70 U 13 C, 15, N2-glutamin ve% 5 diyaliz edilmiş FBS (Fetal Sığır Serumu) için Buraya Kültür HeLa hücreleri. Diyaliz FBS etiketlenmiş ortamı kontamine olabilir küçük molekül ağırlıklı metabolitleri kurtulmak için kullanılır. gerçek deneyden önce diyaliz ek hücrelerin kültürlenmesi Hücreler ortam içinde normal olarak büyüme sağlamak için önerilir. Takviyeler, gece boyunca yılan derisinden diyaliz tüpü kullanılarak 0.15 M NaCI çözeltisi içinde diyalize edilmiştir. - Ekstraksiyon ıskarta kültür medya gününde, 500 uL soğuk HBSS ile iki kez kuyu durulayın ve sonra atın.
NOT: Burada HBSS% 40 içeren kullanın U-13 C-Glukoz bu kültür ortamında da olduğu. - Ekle 600 uL% 100 metanol, kuru buz üzerinde ön soğutulmuştur.
- kuru buz ve bir hücre kazıyıcı ile hücre malzemeyi çıkarmak için çanak aktarın.
- Dikkatle kütle spektrometresi analize kadar -80 ° C 'de, bir mikrosantrifüj tüpü ve saklamak için hücre ekstreleri pipetle.
- izotop etiketli kültür ortamı + diyaliz takviyeleri (serum veya diğer büyüme takviyeleri) içinde üç kopya halinde bir 6-yuvalı plaka içindeki kültür hücreleri hücreler% 75 konfluent hale gelene kadar.
- Sahte sıralanmış hücrelerinin alınması
- izotop etiketli kültür ortamı + diyaliz takviyeleri üç kez 100 mm tabak kültür hücreleri.
Not: 100 mm tabak 48 saat süreyle burada kültür, HeLa hücreleri, hücre sayısının (~ 4 x 10 6) 500,000 kriteri hücreleri elde etmek için gereklidir, çünkü. HeLa hücreleri özü Bu sayı metabolitlerinin iyi bir ölçüm elde etmek için gerekli oldu. Kullanılan kültür ortamı RPMI% 40 U 13 C-Glikoz ve% 70 U 13 C, 15, N2-glutamin ve diyaliz FBS,% 5 idi. - ekstraksiyon, ıskarta kültür ortamı gününde, w kuyu durulayıni 1.5 ml ılık HBSS ve sonra atın.
- 37 ° C'de 4 dakika için 1.5 ml tripsin / EDTA ekleyerek hücreleri ayırın. 4 ° C veya buz aşağıdaki adımları uygulayın.
- 3 mL buz gibi soğuk HBSS (Hank Dengeli Tuz Çözeltisi) + diyaliz ek eklenerek tripsin devre dışı bırakır.
- 3 dakika boyunca 750 x g'de 15 ml tüp ve santrifüj hücreleri toplamak.
- 1-2 x 10 6 hücre / mL, tek hücre elde etmek için 40 mikron hücre süzgeçler geçmesine ve 5 ml tüp transfer konsantrasyonunda HBSS + diyaliz ek + 1 mM EDTA içinde pelletini.
- Sıralama, sadece tekli grubu için bu hücre sıralayıcı gating arasındaki hücreler, 4 ° C'de 3 dakika boyunca 750 x g'de santrifüj kriteri hücreleri.
NOT: Burada sıralama HeLa enstrüman basıncı 27 psi ile bir oran 1000 olayları / s hücreleri, ve 100 mikron memesi kullanarak. HeLa hücreleri büyük yüzden mümkün olduğunca sağlam pelet almak için yavaş bir olay hızı ve geniş memede tasnif edilmelidir. throughou soğuk blok hücreleri tutunt metabolizmayı azaltmak için sıralama. Sıralama prosedürün ayrıntılı bir açıklama, daha önce 12 tarif edilmiştir. - Süpernatantı atın ve metanol eklemeden önce homojen bir pelet elde etmek için 50 uL buz dH 2 O pelletini. şirketinden pelet soğuk metanol eklenmesi tekrar süspansiyon zor katı pelet oluşturur.
- kuru buzda muhafaza 540 uL metanol ilave edilerek metabolitleri ekstrakte ve sıvı kromatografisi kadar -80 ° C özler devam - yüksek çözünürlüklü kütle spektrometrisi (LC-HRMS) analizi.
- izotop etiketli kültür ortamı + diyaliz takviyeleri üç kez 100 mm tabak kültür hücreleri.
- Hücre döngüsünün Ekstraksiyon hücrelerini kriteri
- Kültür ortamı + diyaliz takviyeleri üç kez 100 mm tabak kültür hücreleri.
NOT: Geminin Fucci Yeşil G1 (negatif) ve SG2M (pozitif) hücrelerin sıralama için izin verir (MAG1-hGem) sondası 13 içeren Burada kültür HeLa hücreleri. Hücreler için izotop izleme ortam içinde kültive edilebilirgerektiği gibi uzun s. Burada etiketsiz medyada 46 saat boyunca onları kültürlü var, o zaman biz RPMI% 40 U- 13 C-Glikoz ve% 70 U 13 C içeren açtınız, 15 N2-Glutamin 2 saat önce sıralama başlangıç. Bu kısa bir darbe etiketleme gerektiren hücre döngüsü evreleri hakkında çalışma yapabilmek amacıyla yapıldı. - ekstraksiyon, ıskarta kültür ortamı gününde, 1.5 mL sıcak HBSS ile kuyu durulayın ve sonra atın.
- 37 ° C'de 4 dakika için 1.5 ml tripsin / EDTA ekleyerek hücreleri ayırın. 4 ° C veya buz aşağıdaki adımları uygulayın.
- 3 ml buz HBSS + diyaliz takviyesi ekleyerek tripsin devre dışı bırakın.
- 3 dakika boyunca 750 x g'de 15 ml tüp ve santrifüj hücreleri toplamak.
- 1-2 x 10 6 hücre / mL, tek hücre elde etmek için 40 mikron hücre süzgeçler geçmesine ve 5 ml tüp transfer konsantrasyonunda HBSS + diyaliz ek + 1 mM EDTA içinde pelletini.
- Hücre sıralayıcı g yoluyla sırala hücreleriDaha sonra, enkaz ve çiftleri dışarı ating ilgi hücre markeri için yolluk ve santrifüj sıralanmış hücreler 4 ° C'de 3 dakika boyunca 750 xg'de.
NOT: Burada sıralama HeLa enstrüman basıncı 27 psi ile bir oran 1000 olayları / s hücreleri, ve 100 mikron memesi kullanarak. metabolizma hızını azaltmak için sıralama boyunca soğuk bloklar hücreleri tutun. - Süpernatantı atın ve metanol eklemeden önce homojen bir pelet elde etmek için 50 uL buz dH 2 O pelletini. şirketinden pelet soğuk metanol eklenmesi tekrar süspansiyon zor katı pelet oluşturur.
- kuru buzda muhafaza 540 uL metanol ilave edilerek metabolitleri ekstrakte ve LC-HRMS analize kadar -80 ° C 'de özler tutun.
- Kültür ortamı + diyaliz takviyeleri üç kez 100 mm tabak kültür hücreleri.
2. Kütle Spektrometre Analiz
Not: Burada bir LC-HRMS sistemde hücre özleri analiz etmek için protokol açıklar. Hücre ekstrelerinin analizi için herhangi bir metabolomiks yöntemleri kullanılabilir. Tam taramaAnaliz metabolitlerin geniş bir tespit edilmesi için yararlı olabilir.
- Bir kütle spektrometresi referans kalibrasyon karışımı kullanılarak aleti kalibre edin.
- 15 saniye için 30 dakika ve vorteks için buz üzerinde çözülme hücre ekstreleri.
- 4 ° C'de 13,000 x g'de 10 dakika süre ile bir eğirme filtresi ve santrifüj hücre ekstresi 100 uL aktarın.
- LC-HRMS sistemi üzerine süzüntü 12.5 mcL enjekte edilir.
- (ZIC®-HILIC) kolonu (150 mm x 4.6 mm, 5 um partikül ebatlı) bir zitteriyonik Hidrofilik interaksiyon sıvı kromatografisi kullanılarak ayrı metabolitler% 0.1 formik bir gradyan elüsyonu kullanılarak ZIC®-HILIC kılavuz sütunun (20 mm ile 2.1 x) ile donatılmış su içinde asit (solvent A) ve asetonitril (çözücü B). Çözücü A% 20 gradyan elüsyonu başlatın ve 17 dakika içinde% 80 kadar arttırır. Sırasıyla, en az 400 uL akışı 1 ve kolon sıcaklığı ve numune tablası 23 ° C'de ve 4 ° C'de 4 dakika boyunca bu oran muhafaza edin.
- Bir i kullanınmetabolitler algılama, iyonizasyon kaynağı olarak pozitif ve negatif mod hem de ısıtılmış bir elektrosprey (lH-ESI II) ve 70.000 tam genişliği yarı maksimum (FWHM) içindeki bir kütlenin güçte tam tarama tedarik etme kipinde kromatografik ayırma bağlanmış Nstrument ( m / z 200).
- akış 45 oranında, 350 ° C'de 10 Au (rasgele birim) ve set buharlaştırıcı sıcaklığında ve pozitif mod ve -3.5 kV 4 kV elektrosprey voltajında kılıf gaz ve yardımcı gaz için azot (saflık>% 99.995) kullanarak negatif modda.
3. Veri Analizi
- standartlar mevcuttur ve numunelerde kaliteli zirveleri göstermek hangi metabolitler bir sayı seçin. Kaliteli zirveleri gürültü oranı yüksek sinyal var. Zirve kalite kontrol ve yanlış izotopları dahil değil emin olmak çok önemlidir. şekil ve / veya saklama süresi farklı izotopik tepe muhtemelen yanlış.
- izotop etiketli örnekleri (kütle isotopomer hesaplamak içinMI) Tüm MIS toplam pik alanları ile her MI pik alanı bölerek kesirler.
- Olarak, sırasıyla, 13 ° C ve 15 N, zenginleştirme etiketli karbon / azot fraksiyonları hesaplayın
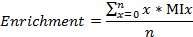
burada, n, metaboliti içindeki toplam karbon sayısı (ya da nitrojen, sırasıyla) 'dir, ve karışımı X MI bölümüdür.
NOT: Tüm hesaplamalar programlama dilleri kullanılarak yapılabilir.
Sonuçlar
Bir örnek olarak, burada, hücre döngüsü faz göre düzenlenmiş HeLa hücrelerinin metabolizmasını araştıran bir deney tarif eder. Her iki karbon ve nitrojen merkez metabolitlerin geniş bir etiket için, U-13C-glükoz ve U, 13C, izleyiciler olarak 15 N-glutamin ile 48 saat boyunca hücrelerin kültürü yapıldı. Izotopların ara seviyeleri daha değişik MI desen 14 üretmek eğilimindedir doğrulama deney için zengin ...
Tartışmalar
Bizim yöntemi hücresel metabolitleri MID bir hücrenin metabolik faaliyetleri "tarihini" yansıtması ilkesine dayanmaktadır. Bu, daha önceki bir hücre ayırma prosedürü, hücrelerin karmaşık eden oluştu şekilde mümkün hücrelerin alt popülasyonunda metabolik faaliyetlerini araştırmak için yapar. Buna karşılık, metabolitleri pik alanları sıralanmış hücreler ve kültür çanak 11 doğrudan çıkarma özleri arasında belirgin farklılıklar göstermektedir. Böl?...
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
The authors would like to thank Dr. Anas Kamleh for valuable help with optimizing mass spectrometry methods, and Annika von Vollenhoven for assistance with cell sorting. This research was supported by the Swedish Foundation for Strategic Research (grant no. FFL12-0220) and the Strategic Programme in Cancer Research (IR, RN); the Swedish Heart-Lung Foundation (CEW, HG); and Mary Kay Foundation (JW, MJ).
Malzemeler
| Name | Company | Catalog Number | Comments |
| HBSS | Sigma | H6648 | |
| INFLUX (inFlux v7 Sorter) | BD Biosciences | ||
| U-13C-Glucose | Cambridge isotopes | 40762-22-9 / GLC-018 | |
| U-13C,15N2-Glutamine | Cambridge isotopes | CNLM-1275-H-0.1 | |
| Methanol (JT Baker), HPLC grade | VWR | BAKR8402.2500 | |
| Ultrafree - MC - VV centrifugal Filters. Durapore PVDF 0.1 µm | Millipore | UFC30VV00 | |
| Ultimate 3,000 UHPLC | Thermo Fisher scientific | ||
| Q-Exactive Orbitrap Mass spectrometer | Thermo Fisher scientific | ||
| Merk-Sequant ZIC HILIC column (150 mm x 4.6 mm, 5 µm) | Merck KGaA | 1.50444.0001 | |
| Merk-Sequant ZIC HILIC guard column (20 mm x 2.1 mm) | Merck KGaA | ||
| Acetonitrile Optima LC-MS, amber glass | Fisher Scientific | A955-212 | |
| Milli-Q water | Millipore | Produced with a Milli-Q Gradient system | |
| Myrsyra 99.5% Optima (Formic acid) | Fisher Scientific | 11423423 | |
| X100 Screw Vial 1.5 ml, 8-425 32x11.6 mm, amber, 100 units | Thermo Fisher scientific | 10560053 | |
| X100 Lock Skruv Vitt PTFE Packing 8-425 (Screw caps) | Thermo Fisher scientific | 12458636 | |
| ProteoMass LTQ/FT-Hybrid ESI Pos. Mode Cal Mix | Sigma-Aldrich | MSCAL5 | Calibration kit |
| SNAKESKIN 10K MWCO | Thermo Fisher scientific | 88245 | |
| Mathematica v.10 | Wolfram Research |
Referanslar
- Gregersen, P. K. Cell type-specific eQTLs in the human immune system. Nat. Genet. 44 (5), 478-480 (2012).
- Heppner, G. H. Tumor heterogeneity. Cancer Res. 44 (6), 2259-2265 (1984).
- Prat, A., et al. Characterization of cell lines derived from breast cancers and normal mammary tissues for the study of the intrinsic molecular subtypes. Breast Cancer Res. Treat. 142 (2), 237-255 (2013).
- Magistretti, P. J., Allaman, I. A Cellular Perspective on Brain Energy Metabolism and Functional Imaging. Neuron. 86 (4), 883-901 (2015).
- Angelini, G., et al. Antigen-presenting dendritic cells provide the reducing extracellular microenvironment required for T lymphocyte activation. Proc. Natl. Acad. Sci. U. S. A. 99, 1491-1496 (2002).
- Koukourakis, M. I., Giatromanolaki, A., Harris, A. L., Sivridis, E. Comparison of metabolic pathways between cancer cells and stromal cells in colorectal carcinomas: A metabolic survival role for tumor-associated stroma. Cancer Res. 66 (2), 632-637 (2006).
- Hollenbaugh, J. A., Munger, J., Kim, B. Metabolite profiles of human immunodeficiency virus infected CD4+ T cells and macrophages using LC-MS/MS analysis. Virology. 415 (2), 153-159 (2011).
- Richardson, G. M., Lannigan, J., Macara, I. G. Does FACS perturb gene expression. Cytom. Part A. 87 (2), 166-175 (2015).
- Moussaieff, A., et al. High-resolution metabolic mapping of cell types in plant roots. Proc. Natl. Acad. Sci. U. S. A. 110 (13), E1232-E1241 (2013).
- Johnson, C., et al. A metabolic signature of colon cancer initiating cells. Cancer Metab. 2, 32 (2014).
- Roci, I., et al. Metabolite Profiling and Stable Isotope Tracing in Sorted Subpopulations of Mammalian Cells. Anal. Chem. 88 (5), 2707-2713 (2016).
- Shapiro, H. . Practical flow cytometry. , (2003).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Noack, S., Wiechert, W. Quantitative metabolomics: A phantom. Trends Biotechnol. 32 (5), 238-244 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır