A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التسلل الزراعي القسري بالفراغ للتحول في النبات للنباتات المتمردة: الكاكاو كدراسة حالة
In This Article
Summary
هنا ، نقدم البروتوكول الأول للتسلل الفراغي الموضعي للدراسات في الجسم الحي للتحول الوراثي للنباتات كبيرة الحجم. باستخدام هذه المنهجية ، حققنا لأول مرة التحول العابر للكاكاو بوساطة Agrobacterium في النبات.
Abstract
عابر في تحول النبات هو بديل سريع وفعال من حيث التكلفة للتحول الوراثي للنبات. تعتمد معظم بروتوكولات التحول في النبات على استخدام التحول بوساطة Agrobacterium. ومع ذلك ، فإن البروتوكولات المستخدمة حاليا موحدة للنباتات الصغيرة الحجم بسبب القيود المادية والاقتصادية لإخضاع النباتات كبيرة الحجم للمعالجة الفراغية. يقدم هذا العمل بروتوكولا فعالا للتسلل الزراعي الموضعي القائم على الفراغ المخصص للنباتات كبيرة الحجم. لتقييم فعالية الطريقة المقترحة ، اختبرنا استخدامها في نباتات الكاكاو ، وهي أنواع نباتية استوائية متمردة على التحول الجيني. سمح بروتوكولنا بتطبيق ما يصل إلى 0.07 ميجا باسكال فراغ ، مع التكرار ، على جزء جوي موضعي من أوراق الكاكاو ، مما يجعل من الممكن إجبار تسلل Agrobacterium إلى المساحات بين الخلايا للأوراق المرفقة. نتيجة لذلك ، حققنا عابر بوساطة Agrobacterium في تحويل النبات لأوراق الكاكاو المرفقة التي تعبر عن نظام مراسل RUBY. هذا هو أيضا أول Agrobacterium بوساطة في تحول النبات العابر للكاكاو. سيسمح هذا البروتوكول بتطبيق طريقة الترشيح الزراعي القائمة على الفراغ على الأنواع النباتية الأخرى ذات القيود المماثلة في الحجم ويفتح الباب أمام توصيف الجينات في النبات في الأنواع الخشبية الكبيرة الحجم المتمردة.
Introduction
تعد طرق التحول الوراثي للنبات ضرورية لاختبار الوظائف البيولوجية للجينات وهي مفيدة بشكل خاص اليوم نظرا للعدد الكبير من الجينات غير المميزة المتوقعة في عصر ما بعد الجينوم1. يمكن استخدام هذه الطرق للحصول على خطوط محولة بالكامل أو للتعبير عن الجينات بشكل عابر. يحدث التحول المستقر عندما يصبح الحمض النووي الأجنبي الذي تناوله المضيف مدمجا بشكل كامل ولا رجعة فيه في جينوم المضيف ، ويتم نقل التعديلات الجينية إلى الأجيال اللاحقة. يحدث التعبير العابر ، المعروف باسم التحول العابر ، من النسخ المتعددة من T-DNA المنقولة بواسطة Agrobacterium إلى الخلية ، والتي لم يتم دمجها في الجينوم المضيف ، ويبلغ ذروته بعد 2-4 أيام من الإصابة2.
تجدر الإشارة إلى أن مقايسات التعبير العابر غالبا ما تكون كافية للتوصيف الوظيفي للجينات ويمكن أن تقدم العديد من المزايا على التحول المستقر. على سبيل المثال ، لا يتطلب التحول العابر إجراءات تجديد قائمة على زراعة الأنسجة. ميزة أخرى هي أنه متوافق مع التحليل الوظيفي للجينات في النبات ، وتوجد العديد من الأمثلة الناجحة للبروتوكولات الموحدة جيدا لأنواع النباتات النموذجية ، مثل Arabidopsis thaliana3 و Nicotiana benthamiana4 ، ولكنها لا تزال محدودة في الأنواع غير النموذجية5.
يعتمد تطوير المقايسات العابرة على توافر طرق فعالة لنقل الجينات. لهذا ، تعتمد الأساليب الأكثر شيوعا على تسلل Agrobacterium ، والذي يستفيد من قدرة Agrobacterium الفريدة على نقل الحمض النووي إلى الخلايا النباتية6. أداة أخرى مفيدة لهذه التحليلات هي استخدام جينات المراسل ، مثل البروتينات الفلورية الخضراء (GFP) ، β-glucuronidase (GUS) ، luciferase ، أو RUBY ، وكلها تستخدم لتتبع أحداث التحول. من بين أنظمة المراسلين هذه ، يعد RUBY حاليا أسهل تصور ويعتمد على تحويل التيروزين إلى betalains من خلال ثلاثة تفاعلات خطوة إنزيمية. على عكس أنظمة المراسلة الأخرى ، يمكن ملاحظة betalains الناتجة بسهولة كأصباغ ذات ألوان زاهية على الأنسجة النباتية المحولة دون الحاجة إلى معدات متطورة أو متفاعلات إضافية7.
عند التسلل إلى تعليق Agrobacterium في الفضاء بين الخلايا لميزوفيل الأوراق ، فإن الخطوة الأكثر أهمية للعدوى الزراعية الناجحة هي التغلب على الحاجز المادي الذي تفرضه بشرة البشرة للأوراق8. بينما بالنسبة لبعض النباتات ، فإن تدرج الضغط الناتج عن حقنة بدون إبرة (حقنة تسلل زراعي) يكفي لتسلل زراعي فعال ، كما يحدث في Nicotiana benthamiana9 ، قد تتطلب الأنواع النباتية الأخرى تدرجا أكبر للضغط مثل الذي تم إنشاؤه بمساعدة مضخات التفريغ10. في العمليات بمساعدة الفراغ ، يحدث التسلل الزراعي في خطوتين. في الأول ، يعمل الفراغ على إخضاع المادة النباتية لضغط منخفض ، مما يجبر على إطلاق الغازات من المساحات الهوائية المتوسطة من خلال الثغور والجروح. ثم ، خلال مرحلة إعادة الضغط ، يتسلل تعليق Agrobacterium إلى المساحات بين الخلايا عبر الثغور والجروح11.
بالمقارنة مع تسلل المحاقن ، يسمح التسلل الفراغي بتكرار استخدام أعلى وقابلية للتكرار والقدرة على التحكم في الضغط والمدة في كل مرحلة من مراحل عملية التسلل10. في أوراق الأنواع النباتية المختلفة مثل السبانخ (Spinacia oleracea)12 ، الفاوانيا (نبات خشبي معمر) (Paeonia ostii)13 ، واللوبيا (Vigna unguiculata)14 ، حققت بروتوكولات التسلل الزراعي الفراغي معدل تسلل أعمق من تسلل المحاقن. وبالمثل ، في الطماطم (Lycopersicon esculentum)15 ، والجربرة (Gerbera hybrida)16 ، أنتج التسلل الزراعي الفراغي إسكاتا جينيا أقوى وأكثر اتساقا من تسلل المحاقن. ميزة إضافية للتسلل الفراغي هي انخفاض الاعتماد على النمط الوراثي ، مقارنة بتسلل المحاقن ، والذي لوحظ مؤخرا في ثلاثة أنواع من الحمضيات (Fortunella obovata ، Citrus limon ، و C. grandis)17. ومع ذلك ، عند محاولة تطبيق التسلل الزراعي الفراغي على النباتات الكبيرة جدا بحيث لا يمكن وضعها في المجففات ، يمكن أن يكون حجم غرف التفريغ قيدا ، كما يحدث عادة مع النباتات الخشبية الاستوائية.
أدناه ، نصف بروتوكولا يتغلب على القيود المكانية لغرف التفريغ ، ويختبر فائدته في التحول العابر لأوراق الكاكاو. نقدم أول طريقة تسلل فراغ موضعية للكاكاو ، والتي لا تتطلب معدات إضافية وحتى تسمح باستخدام نفس المجففات المختبرية المستخدمة في تسلل المصنع بأكمله ، ولكن مع تكيف بسيط يسمح بالوصول إلى جزء من النبات داخل غرفة التفريغ ، مما يسمح باستخدامه في مراحل مختلفة من تطوير المصنع. لاختبار فائدة طريقة التسلل الفراغي الموضعية المقترحة ، اخترنا الكاكاو كوكيل لأنواع النباتات الاستوائية ذات الأوراق الكبيرة التي يصعب تحويلها. باستخدام طريقة التسلل الموضعية هذه ، أبلغنا مؤخرا عن أول تعبير عابر في النبات في الأفوكادو عن طريق التسلل الفراغي بوساطة Agrobacterium مع ظروف تم تحسينها مسبقا للأوراق المنفصلة18 ، وهنا نبلغ عن أول تعبير عابر في النبات في الكاكاو.
Protocol
1. ثقافة أجروباكتريوم توميفاسينس
- ذوبان الخلايا الكهربائية من سلالة Agrobacterium tumefaciens LBA4404.
- أضف 1 مل من شعير الخميرة (YM; الجدول 1) مرق إلى أنبوب ثقافة 17 مم × 100 مم. احفظ هذا الأنبوب لوقت لاحق ، واحتفظ به في درجة حرارة الغرفة (RT).
- في أنبوب ميكروفوج سعة 1.5 مل ، أضف 30 ميكرولتر من خلايا Agrobacterium المذابة و 100-250 نانوغرام (حتى 5 ميكرولتر) من الحمض النووي الذي يحتوي على 35S: RUBY. تخلط بلطف.
ملاحظة: كان 35S: RUBY هدية من يوندي تشاو. لتجنب انحناء العينة ، قلل من وجود المركبات الأيونية قدر الإمكان. قد تكون هذه المركبات الأيونية أملاح متبقية من ترسيب الإيثانول للحمض النووي19. - في هذه المرحلة ، ضع كوفيت التثقيب الكهربائي 1 مم على الجليد.
- انقل مزيج التعليق السابق إلى كوفيت تبريد كهربائي 1 مم. احتفظ بكل شيء على الجليد. امسح الأقطاب المعدنية للكوفيت.
- اضبط جهاز الحفر الكهربائي على Agr (2.2 كيلو فولت ، ~ 5 مللي ثانية ، 1 نبضة). ضع الكوفيت داخل غرفة التثقيب الكهربائي.
- اضغط على زر النبض . تسجيل معلمات النبض. إذا كانت العينة مقوسة ، فشلت عملية التثقيب الكهربائي.
ملاحظة: من الأهمية بمكان نقل الخلايا بسرعة إلى مرق YM مباشرة بعد النبض. يمكن أن يؤدي تأخير هذا النقل إلى تقليل كفاءة التحول بشكل كبير20. - على الفور ، استخدم مرق YM المحفوظ لنقل الخلايا من الكوفيت إلى أنبوب 17 مم × 100 مم. أعد تعليق الخلايا برفق.
- احتضان الخلايا المحولة لمدة 3 ساعات عند 28 درجة مئوية و 250 دورة في الدقيقة على حاضنة مدارية.
ملاحظة: هذه الثقافة لا تحتوي على مضادات حيوية. كن حذرا بشأن الظروف العقيمة المناسبة. - قم بخط هذه الثقافة على لوحات أجار YM الانتقائية21. بالنسبة لسلالة LBA4404-RUBY المحولة ، تأكد من أن هذه الألواح تحتوي على ريفامبيسين (25 ميكروغرام / مل) ، وسبكتينومايسين (50 ميكروغرام / مل) ، والستربتومايسين (50 ميكروغرام / مل). احتضن هذا الطبق طوال الليل في حاضنة قائمة 28 درجة مئوية.
ملاحظة: في هذا البروتوكول ، تم استخدام المتجه 35S: RUBY ، والذي يمنح مقاومة بكتيرية للسبكتينومايسين (50 ميكروغرام / مل) ويعمل كمراسل مرئي على الأنسجة النباتية المتسللة. - تلقيح المستعمرات من الثقافة الليلية على 12.5 مل من خليط من مرق YM ومرق لوريا بيرتاني (LB) (بنسبة 9: 1 ، على التوالي) ، 10 mM من MES ، درجة الحموضة 5.722. تأكد من أن هذا الوسط السائل الانتقائي يحتوي على نفس المضادات الحيوية المستخدمة في الخطوة 1.10. راجع الجدول 1 لمعرفة مكونات وتركيزات هذه الوسائط.
- عند احتضان Agrobacterium ، اترك مساحة تهوية كافية للثقافة ، حوالي 4 إلى 5 أضعاف حجم السائل. استخدم مرق YM لسلالة Agrobacterium LBA4404 لتجنب تكتل الخلايا23.
- احتضان الثقافة لمدة 16 ساعة عند 250 دورة في الدقيقة على حاضنة مدارية 28 درجة مئوية.
- قم بتوسيع نطاق الثقافة حتى 10 أضعاف الحجم الأولي بنفس الوسيط المستخدم في الخطوة 1.11.
- احتضان الثقافة لمدة 16 ساعة و 250 دورة في الدقيقة على حاضنة مدارية 28 درجة مئوية.
- اضبط الثقافة الليلية على كثافة بصرية (OD600) تبلغ 0.4. أضف 20 ميكرومتر من الأسيتوسيرينجون (AS).
- احتضان عند 250 دورة في الدقيقة على حاضنة مدارية 28 درجة مئوية حتى يصل OD600 إلى حوالي 1.0.
- أجهزة الطرد المركزي الخلايا عند 4 500 × g لمدة 10 دقائق عند 20 درجة مئوية.
- أعد تعليق الحبيبات بمحلول التعليق (10 mM MES ، 10 mM MgCl2 ، pH 5.7) ، مع ضبط OD600 إلى 0.6. أضف 200 ميكرومتر مثل24.
ملاحظة: احتضان محلول التعليق مسبقا عند 28 درجة مئوية. إذا كان محلول التعليق باردا عند إضافته ، فسوف تترسب الخلايا. - اترك المعلق البكتيري لمدة 2-24 ساعة في الظروف المظلمة و 25 درجة مئوية. التحريض غير مطلوب22.
2. اختيار النبات
- اختر نباتا له فرع بأوراق في المرحلة المثلى للتسلل الزراعي.
ملاحظة: قد يكون النبات كامل النمو أو شجرة ناضجة. بالنسبة للكاكاو ، يوصى باستخدام الأوراق الصغيرة من المرحلة C. هذه الأوراق برونزية إلى خضراء فاتحة اللون. لم يتم توسيعها بالكامل ولا جامدة مثل أوراق المرحلةD 25 (الشكل 1).- كعنصر تحكم ، قم في نفس الوقت بإجراء تسلل زراعي على نباتات أخرى (على سبيل المثال ، Nicotiana tabacum) بكفاءة تسلل زراعي عالية تم الإبلاغ عنها للسلالة والناقل المستخدم.
ملاحظة: إذا لم يتم الحصول على نتائج إيجابية في هذا التحكم ، فمن الممكن أن تكون النتائج السلبية ناتجة عن الإجهاد أو الناقل المستخدم.
- كعنصر تحكم ، قم في نفس الوقت بإجراء تسلل زراعي على نباتات أخرى (على سبيل المثال ، Nicotiana tabacum) بكفاءة تسلل زراعي عالية تم الإبلاغ عنها للسلالة والناقل المستخدم.
3. إعداد غرفة فراغ
- كغرفة تفريغ ، استخدم مجففا يحتوي على مقياس فراغ لقياس ضغط الفراغ بالداخل.
- أضف 250 ميكرومتر من حمض الياسمونيك (JA)18,26 إلى تعليق Agrobacterium من الخطوة 1.19.
- انقل مزرعة Agrobacterium إلى دورق واسع الفم لغمر الفرع والأوراق المحددة. ثم ضع الدورق مع ثقافة Agrobacterium داخل المجفف.
- ضع الفرع بين المجفف وغطاءه. تأكد من غمر الأوراق المرغوبة داخل ثقافة Agrobacterium . بعد ذلك ، استخدم حلقة القفز ، وهي حلقة مستديرة ذات فتحة تسمح لفرع النبات بدخول المجفف. تعمل حلقة القفز أيضا كفاصل بين الجزء السفلي والعلوي من المجفف.
- تأكد من أن الحشية مستقرة هيكليا بدرجة كافية لتجنب سحقها بالغطاء ، ومرنة بما يكفي للانحناء والتكيف مع محيط المجفف ، وليست مصنوعة من مادة مسامية.
ملاحظة: استخدمت هذه الدراسة سلكا معدنيا مقطعا يتكون من عدة أسلاك أصغر ملتوية معا ، ومغلفة بمادة بلاستيكية غير مسامية تشبه الحشية (الشكل 2). - لتثبيت الفرع على المجفف ، استخدم مادة انطباع السيليكون. تأكد من أن المادة لزجة وغير مسامية وخاملة كيميائيا للمجفف والنبات ، وسهلة التطبيق وملء الفجوات الصغيرة بين الفرع والحشية والمجفف.
- بمجرد أن تتبلمر مادة انطباع السيليكون (يستغرق ذلك حوالي 1 دقيقة) وتثبت الفرع في مكانه ، أغلق المجفف. تأكد من عدم ترك أي ثغرات.
- قم بتوصيل المجفف بمضخة التفريغ (الشكل 3).
4. تسلل الفراغ
- ابدأ تشغيل مضخة التفريغ حتى تصل إلى -0.07 ميجا باسكال.
- بمجرد وصوله إلى هذا الضغط ، أغلق صمام الضغط وأوقف تشغيل مضخة التفريغ. حافظ على هذا الضغط لمدة 5 دقائق.
- افتح صمام الضغط لاستعادة ضغط الغرفة.
ملاحظة: هذه خطوة حاسمة. استعادة ضغط الغرفة تدريجيا وثبات. قد يستغرق الأمر ما يصل إلى 3 دقائق لإعادة ضغط المجفف بالكامل. تزيد إعادة الضغط الممتدة من عدد البكتيريا المتسللة داخل الأنسجة10. - كرر هذه العملية مرتين أخريين.
- أخرج الفرع من تعليق الخلية والمجفف.
- تنظيف الأوراق المتسللة بالماء المقطر.
5. حضانة الأوراق المتسللة
- دع الأوراق المتسللة تبقى في ظروف مظلمة عند 25 درجة مئوية لمدة 48 ساعة.
- بعد ذلك ، قم بتعريض الأنسجة المخترقة لفترة ضوئية فاتحة / داكنة 16/8 ساعة.
- تقييم تحول الأوراق العابرة بعد 3-7 أيام من الإصابة (DPI).

الشكل 1: أوراق الكاكاو مراحل النمو. (أ-ه) مراحل النمو25. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
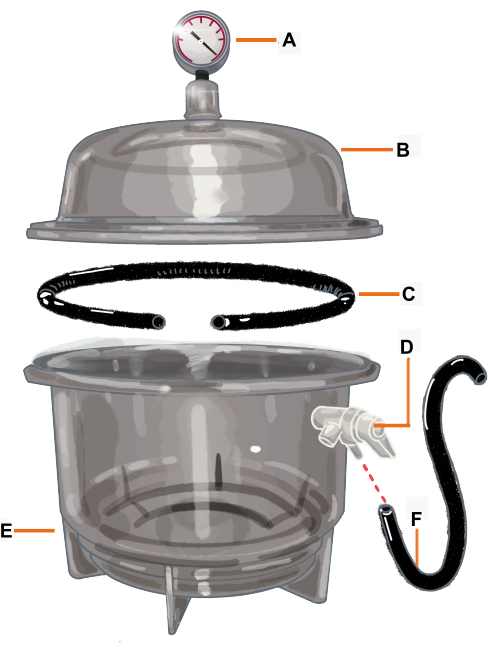
الشكل 2: تكوين غرفة الفراغ ومكوناتها. غرفة التفريغ عبارة عن مجفف متصل بمقياس فراغ. يتم قطع الحشية / الحلقة O بحيث يكون لها فتحة حيث سيتم وضع الفرع. (أ) مقياس الفراغ ، (ب) الغطاء ، (ج) الحشية / الحلقة O ، (د) صمام الضغط ، (ه) المجفف ، (و) الخرطوم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: في نظام التسلل الزراعي فراغ بلانتا . لتجنب خسائر الفراغ أثناء عملية التسلل ، من الأهمية بمكان تأمين الفرع بالمجفف والحشية / الحلقة O بمادة انطباع السيليكون. (أ) نبات الكاكاو، (ب) غرفة التفريغ، (ج) مادة انطباع السيليكون، (د) الأوراق المغمورة على معلق Agrobacterium ، (ه) مضخة التفريغ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
يقدم هذا البروتوكول طريقة فعالة للتسلل الزراعي للنباتات الخشبية كبيرة الحجم. باستخدام هذا البروتوكول ، تمكنا من تحقيق ضغط فراغ يبلغ -0.07 ميجا باسكال ، مما أدى إلى تسلل فعال وموضعي لأوراق الكاكاو. في الشكل 4 ، نلاحظ عملية إعداد نظام التسلل ، وفي الشكل 5 ، التكو...
Discussion
في هذا العمل ، قدمنا بروتوكول تسلل زراعي فعال ومنخفض التكلفة للتحول العابر للنباتات الخشبية في النبات ، باستخدام نباتات الكاكاو كمثال. بالنظر إلى القيد المعروف الذي تمثله بشرة الأوراق لتحويل الأنسجة النباتية ، ركزنا على تطوير استراتيجية لتسهيل التسلل الزراعي عن طريق الفراغ في النب?...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان.
Acknowledgements
نشكر ليك. خيسوس فوينتيس غونزاليس ونستور إيفان روبلز أوليفاريس لمساعدتهما في تصوير لقطات الفيديو. نعترف بالهدايا السخية التي قدمتها الدكتورة أنطونيا جوتيريز مورا من CIATEJ (نباتات الكاكاو Theobroma ). كما نشكر CIATEJ و Laboratorio Nacional PlanTECC ، المكسيك ، على دعم المرافق. 1135375 وأجرى المعهد دراسات ماجستير بتمويل من المجلس الوطني للإنسانيات والعلوم والتكنولوجيا في المكسيك (CONAHCYT). تعترف RUL بالدعم المقدم من المجلس الحكومي للعلوم والتكنولوجيا في خاليسكو (COECYTJAL) ، وأمانة الابتكار العلمي والتكنولوجيا (SICYT) ، خاليسكو ، المكسيك (منحة 7270-2018).
Materials
| Name | Company | Catalog Number | Comments |
| 35S:RUBY plasmid | Addgene | 160908 | http://n2t.net/addgene:160908 ; RRID:Addgene_160908 |
| 1 mm electroporation cuvette | Thermo Fisher Scientific | FB101 | Fisherbrand Electroporation Cuvettes Plus |
| Desiccator | Bel-Art SP SCIENCEWARWE | F42400-2121 | |
| Freeze dryer | LABCONCO | 700402040 | |
| K2HPO4 | Sigma Aldrich | P8281-500G | For YM medium add 0.38 g/L |
| LBA4404 ElectroCompetent Agrobacterium | Intact Genomics USA | 1285-12 | https://intactgenomics.com/product/lba4404-electrocompetent-agrobacterium/ |
| Mannitol | Sigma Aldrich | 63560-250G-F | For YM medium add 10 g/L |
| MES | Sigma Aldrich | PHG0003 | (For LB, YM and resuspension medium) add 1.95 g/L (10mM) |
| MgCl2 | Sigma Aldrich | M8266 | For resuspension medium add 0.952 g/L (10 mM) |
| MgSO4·7H20 | Sigma Aldrich | 63138-1KG | For YM medium add 0.204 g/L |
| MicroPulser Electroporation Apparatus | Biorad | 165-2100 | |
| NaCl | Karal | 60552 | For LB medium add 5 g/L; For YM medium add 0.1 g/L |
| NanoDrop One Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | 13-400-518 | |
| President Silicone Impression material | COLTENE | 60019938 | |
| Rifampicin | Gold-Bio | R-120-1 | (100 mg/mL) |
| Silicone Impression material gun | Andent | TBT06 | |
| Spectinomycin | Gold-Bio | S-140-SL10 | (100 mg/mL) |
| Streptomycin | Gold-Bio | S-150-SL10 | (100 mg/mL) |
| Tryptone enzymatic digest from casein | Sigma Aldrich | 95039-1KG-F | For LB medium add 10 g/L |
| Yeast extract | MCD LAB | 9031 | For LB medium add 5 g/L; For YM medium add 0.4 g/L |
References
- Yang, J., Jia, M., Guo, J., Huang, L. Q. Functional Genome of Medicinal Plants. Molecular Pharmacognosy. , (2019).
- Janssen, B. J., Gardner, R. C. Localized transient expression of GUS in leaf discs following cocultivation with Agrobacterium. Plant Molecular Biology. 14 (1), 61-72 (1990).
- Wang, X., et al. Identification and functional analysis of in vivo phosphorylation sites of the Arabidopsis BRASSINOSTEROID-INSENSITIVE1 receptor kinase. Plant Cell. 17 (6), 1685-1703 (2005).
- Pan, Z., et al. In vivo assembly of the sorgoleone biosynthetic pathway and its impact on agroinfiltrated leaves of Nicotiana benthamiana. The New Phytologist. 230 (2), 683-697 (2021).
- Manavella, P. A., Chan, R. L. Transient transformation of sunflower leaf discs via an agrobacterium-mediated method: Applications for gene expression and silencing studies. Nature Protocols. 4 (11), 1699-1707 (2009).
- Guo, M., Ye, J., Gao, D., Xu, N., Yang, J. Agrobacterium-mediated horizontal gene transfer: Mechanism, biotechnological application, potential risk and forestalling strategy. Biotechnology Advances. 37 (1), 259-270 (2019).
- He, Y., Zhang, T., Sun, H., Zhan, H., Zhao, Y. A reporter for noninvasively monitoring gene expression and plant transformation. Horticulture Research. 7 (1), 152 (2020).
- Zheng, L., et al. An improved and efficient method of Agrobacterium syringe infiltration for transient transformation and its application in the elucidation of gene function in poplar. BMC Plant Biology. 21 (1), 54 (2021).
- Leuzinger, K., et al. Efficient agroinfiltration of plants for high-level transient expression of recombinant proteins. Journal of Visualized Experiments: JoVE. 77, 50521 (2013).
- Chincinska, I. A. Leaf infiltration in plant science: old method, new possibilities. Plant Methods. 17 (1), 83 (2021).
- Simmons, C. W., Vandergheynst, J. S., Upadhyaya, S. K. A model of agrobacterium tumefaciens vacuum infiltration into harvested leaf tissue and subsequent in planta transgene transient expression. Biotechnology and Bioengineering. 102 (3), 965-970 (2009).
- Cao, D. V., et al. Optimization of Agrobacterium -mediated transient expression of heterologous genes in spinach. Plant Biotechnology Reports. 11, 397-405 (2017).
- Xie, L., et al. Virus-induced gene silencing in the perennial woody Paeonia ostii. PeerJ. 7, ee7001 (2019).
- Prasad Babu, K., Maligeppagol, M., Asokan, R., Krishna Reddy, M. Screening of a multi-virus resistant RNAi construct in cowpea through transient vacuum infiltration method. Virusdisease. 30 (2), 269-278 (2019).
- Ekengren, S. K., Liu, Y., Schiff, M., Dinesh-Kumar, S. P., Martin, G. B. Two MARK cascades, NPR1, and TGA transcription factors play a role in Pto-mediated disease resistance in tomato. The Plant Journal: for Cell and Molecular Biology. 36 (6), 905-917 (2003).
- Deng, X., et al. Virus-induced gene silencing for Asteraceae-a reverse genetics approach for functional genomics in Gerbera hybrida. Plant Biotechnology Journal. 10 (8), 970-978 (2012).
- Wang, F., et al. Use of TRV-mediated VIGS for functional genomics research in citrus. Plant Cell, Tissue and Organ Culture. 139 (3), 609-613 (2019).
- Salazar-González, J. A., et al. In-planta transient transformation of avocado (Persea americana) by vacuum agroinfiltration of aerial plant parts. Plant Cell Tissue Organ Cult. 152, 635-646 (2023).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- GoldBio. . Electrotransformation of Agrobacterium tumefaciens Protocol. , (2018).
- Lindbo, J. A. TRBO: a high-efficiency tobacco mosaic virus RNA-based overexpression vector. Plant Physiology. 145 (4), 1232-1240 (2007).
- Rajasekaran, K., Curtis, I. S. Agrobacterium-Mediated Genetic Transformation of Cotton. Transgenic Crops of the World. , (2004).
- Llave, C., Kasschau, K. D., Carrington, J. C. Virus-encoded suppressor of posttranscriptional gene silencing targets a maintenance step in the silencing pathway. Proceedings of the National Academy of Sciences of the United States of America. 97 (24), 13401-13406 (2000).
- Fister, A. S., et al. Protocol: transient expression system for functional genomics in the tropical tree Theobroma cacao L. Plant Methods. 12, 19 (2016).
- Jung, S. -. K., et al. Agrobacterium tumefaciens mediated transient expression of plant cell wall-degrading enzymes in detached sunflower leaves. Biotechnology Progress. 30 (1), 905-915 (2014).
- Wroblewski, T., Tomczak, A., Michelmore, R. Optimization of Agrobacterium-mediated transient assays of gene expression in lettuce, tomato and Arabidopsis. Plant Biotechnology Journal. 3 (2), 259-273 (2005).
- Keith, C. V., Ramos-Sobrinho, R., Marelli, J. -. P., Brown, J. K. Construction of an infectious clone of the Badnavirus Cacao Swollen Shoot Ghana M Virus and infectivity by gene gun- and Agrobacterium-mediated inoculation. Frontiers in Agronomy. 3, 774863 (2021).
- Fister, A. S., Landherr, L., Maximova, S. N., Guiltinan, M. J. Transient expression of CRISPR/Cas9 machinery targeting TcNPR3 enhances defense response in Theobroma cacao. Frontiers in Plant Science. 9, 268 (2018).
- Grützner, R., et al. Engineering betalain biosynthesis in tomato for high level betanin production in fruits. Frontiers in Plant Science. 12, 682443 (2021).
- Saifi, S. K., Passricha, N., Tuteja, R., Kharb, P., Tuteja, N. In planta transformation: A smart way of crop improvement. Advancement in Crop Improvement Techniques. 21, 351-362 (2020).
- Huda, K. M., et al. OsACA6, a P-type IIB Ca2+ ATPase promotes salinity and drought stress tolerance in tobacco by ROS scavenging and enhancing the expression of stress-responsive genes. The Plant Journal: for Cell and Molecular Biology. 76 (6), 997-1015 (2013).
- Micheli, F., et al. Functional Genomics of Cacao. Advances in Botanical Research. 55, 119-177 (2010).
- Bailey, B. A., et al. Fungal and plant gene expression during the colonization of cacao seedlings by endophytic isolates of four Trichoderma species. Planta. 224 (6), 1449-1464 (2006).
- Motamayor, J. C., et al. Geographic and genetic population differentiation of the Amazonian chocolate tree (Theobroma cacao L). PLoS ONE. 3 (10), e3311 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved