Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Vakuumforcierte Agroinfiltration zur In-planta-Transformation widerspenstiger Pflanzen: Kakao als Fallstudie
In diesem Artikel
Zusammenfassung
Hier stellen wir das erste Protokoll für die lokalisierte Vakuuminfiltration für in vivo-Studien zur genetischen Transformation von Großpflanzen vor. Mit dieser Methodik haben wir zum ersten Mal die Agrobacterium-vermittelte transiente Transformation von Kakao erreicht.
Zusammenfassung
Die transiente in planta-Transformation ist eine schnelle und kostengünstige Alternative zur pflanzengenetischen Transformation. Die meisten Protokolle für die In-planta-Transformation basieren auf der Verwendung von Agrobacterium-vermittelter Transformation. Die derzeit verwendeten Protokolle sind jedoch aufgrund der physikalischen und wirtschaftlichen Einschränkungen, die mit einer Vakuumbehandlung verbunden sind, für kleine Anlagen standardisiert. Diese Arbeit stellt ein effektives Protokoll für die lokalisierte vakuumbasierte Agroinfiltration vor, das auf große Pflanzen zugeschnitten ist. Um die Wirksamkeit der vorgeschlagenen Methode zu bewerten, testeten wir ihre Anwendung in Kakaopflanzen, einer tropischen Pflanzenart, die gegen genetische Transformation resistent ist. Unser Protokoll ermöglichte es, ein Vakuum von bis zu 0,07 MPa mit Wiederholungen auf einen lokalisierten oberirdischen Teil der Kakaoblätter anzuwenden, wodurch es möglich wurde, die Infiltration von Agrobacterium in die Interzellularräume der anhaftenden Blätter zu erzwingen. Als Ergebnis erreichten wir die Agrobacterium-vermittelte transiente in planta-Transformation von anhaftenden Kakaoblättern, die für das RUBY-Reportersystem exprimiert werden. Dies ist auch die erste Agrobacterium-vermittelte transiente Umwandlung von Kakao in planta . Dieses Protokoll würde die Anwendung der vakuumbasierten Agroinfiltrationsmethode auf andere Pflanzenarten mit ähnlichen Größenbeschränkungen ermöglichen und die Tür für die In-planta-Charakterisierung von Genen in widerspenstigen holzigen, großformatigen Arten öffnen.
Einleitung
Pflanzengenetische Transformationsmethoden sind unerlässlich, um die biologischen Funktionen von Genen zu testen, und sind heute besonders nützlich angesichts der großen Anzahl uncharakterisierter Gene, die in der postgenomischen Äravorhergesagt wurden 1. Diese Methoden können verwendet werden, um vollständig transformierte Linien zu erhalten oder Gene vorübergehend zu exprimieren. Eine stabile Transformation tritt auf, wenn die fremde DNA, die der Wirt aufgenommen hat, vollständig und irreversibel in das Wirtsgenom integriert wird und die genetischen Veränderungen an nachfolgende Generationen weitergegeben werden. Die vorübergehende Expression, die als vorübergehende Transformation bezeichnet wird, erfolgt aus den mehreren Kopien der T-DNA, die von Agrobacterium in die Zelle übertragen werden und nicht in das Wirtsgenom integriert wurden, und erreicht 2-4 Tage nach der Infektion ihren Höhepunkt2.
Es ist erwähnenswert, dass transiente Expressionsassays oft für die funktionelle Charakterisierung von Genen ausreichen und mehrere Vorteile gegenüber einer stabilen Transformation bieten können. Beispielsweise erfordert die transiente Transformation keine gewebekulturbasierten Regenerationsverfahren. Ein weiterer Vorteil ist, dass es mit der funktionellen Analyse von Genen in planta kompatibel ist, die mehrere erfolgreiche Beispiele von Protokollen gibt, die für Modellpflanzenarten wie Arabidopsis thaliana3 und Nicotiana benthamiana4 gut standardisiert sind, aber bei Nicht-Modellarten5 immer noch begrenzt sind.
Die Entwicklung transienter Assays hängt von der Verfügbarkeit effizienter Gentransfermethoden ab. Die beliebtesten Ansätze basieren dabei auf der Agrobacterium-Infiltration , die sich die einzigartige Fähigkeit von Agrobacterium zunutze macht, DNA auf Pflanzenzellen zu übertragen6. Ein weiteres nützliches Werkzeug für diese Analysen ist die Verwendung von Reportergenen wie grün fluoreszierenden Proteinen (GFP), β-Glucuronidase (GUS), Luciferase oder RUBY, die alle zur Verfolgung von Transformationsereignissen eingesetzt werden. Unter diesen Reportersystemen ist RUBY derzeit am einfachsten zu visualisieren und beruht auf der Umwandlung von Tyrosin in Betalaine durch drei enzymatische Stufenreaktionen. Im Gegensatz zu anderen Reportersystemen können die resultierenden Betalaine leicht als hell gefärbte Pigmente auf transformiertem Pflanzengewebe beobachtet werden, ohne dass ausgeklügelte Geräte oder zusätzliche Reaktanten erforderlich sind7.
Bei der Infiltration einer Agrobacterium-Suspension in den interzellulären Raum des Blattmesophylls ist der kritischste Schritt für eine erfolgreiche Agroinfektion die Überwindung der physikalischen Barriere, die durch die epidermale Kutikula der Blätter auferlegt wird8. Während bei einigen Pflanzen ein mit einer nadellosen Spritze erzeugter Druckgradient (Spritzen-Agroinfiltration) für eine effiziente Agroinfiltration ausreicht, wie es bei Nicotiana benthamiana9 der Fall ist, benötigen andere Pflanzenarten möglicherweise einen größeren Druckgradienten, wie er mit Hilfe von Vakuumpumpen10 erzeugt wird. Bei vakuumunterstützten Prozessen erfolgt die Agroinfiltration in zwei Schritten. Im ersten Fall dient das Vakuum dazu, das Pflanzenmaterial einem reduzierten Druck auszusetzen, wodurch die Freisetzung von Gasen aus den mesophyllen Lufträumen durch Spaltöffnungen und Wunden erzwungen wird. Dann infiltriert die Agrobacterium-Suspension während einer Druckentlastungsphase die Interzellularräume über die Spaltöffnungen und Wunden11.
Im Vergleich zur Spritzeninfiltration ermöglicht die Vakuuminfiltration eine höhere Nutzungshäufigkeit, Wiederholbarkeit und die Möglichkeit, Druck und Dauer in jeder Phase des Infiltrationsprozesses zu kontrollieren10. In Blättern verschiedener Pflanzenarten wie Spinat (Spinacia oleracea)12, Pfingstrose (eine holzige Staude) (Paeonia ostii)13 und Kuherbse (Vigna unguiculata)14 erreichten Vakuum-Agroinfiltrationsprotokolle eine tiefere Infiltrationsrate als Spritzeninfiltration. In ähnlicher Weise führte die Vakuum-Agroinfiltration bei Tomaten (Lycopersicon esculentum)15 und Gerbera (Gerbera hybrida)16 zu einem stärkeren und gleichmäßigeren Gen-Silencing als bei der Spritzeninfiltration. Ein weiterer Vorteil der Vakuuminfiltration ist die geringere Abhängigkeit vom Genotyp im Vergleich zur Spritzeninfiltration, die kürzlich bei drei Zitrussorten (Fortunella obovata, Citrus limon und C. grandis) beobachtet wurde17. Wenn Sie jedoch versuchen, die Vakuum-Agroinfiltration auf Pflanzen anzuwenden, die zu groß sind, um in Exsikkatoren zu passen, kann die Größe der Vakuumkammern eine Einschränkung darstellen, wie es typischerweise bei tropischen Gehölzen der Fall ist.
Im Folgenden beschreiben wir ein Protokoll, das die räumliche Begrenzung von Vakuumkammern überwindet und seinen Nutzen für die transiente Transformation von Kakaoblättern in planta testet. Wir präsentieren die erste lokalisierte Vakuuminfiltrationsmethode für Kakao, die keine zusätzliche Ausrüstung erfordert und sogar die Verwendung der gleichen Laborexsikkatoren ermöglicht, die für die Infiltration der gesamten Pflanze verwendet werden, jedoch mit einer einfachen Anpassung, die den Zugang zu einem Teil der Pflanze in der Vakuumkammer ermöglicht und den Einsatz in verschiedenen Stadien der Pflanzenentwicklung ermöglicht. Um die Nützlichkeit der vorgeschlagenen lokalisierten Vakuuminfiltrationsmethode zu testen, wählten wir Kakao als Stellvertreter einer großblättrigen tropischen Pflanzenart, die schwer zu transformieren ist. Mit dieser lokalisierten Infiltrationsmethode berichteten wir kürzlich über die erste transiente Expression von planta in Avocado durch Agrobacterium-vermittelte Vakuuminfiltration mit Bedingungen, die zuvor für abgelöste Blätter optimiert waren18, und hier berichten wir über die erste transiente Expression von planta in Kakao.
Protokoll
1. Agrobacterium tumefaciens-Kultur
- Elektrokompetente Zellen von Agrobacterium tumefaciens Stamm LBA4404 auftauen.
- Fügen Sie 1 ml Hefemalz (YM; Tabelle 1) Brühe in ein 17 mm x 100 mm großes Kulturröhrchen. Bewahren Sie dieses Röhrchen für später auf und bewahren Sie es bei Raumtemperatur (RT) auf.
- In ein 1,5-ml-Mikrofugenröhrchen 30 μl der aufgetauten Agrobacterium-Zellen und 100-250 ng (bis zu 5 μl) der DNA mit 35S:RUBY geben. Vorsichtig mischen.
HINWEIS: Der 35S:RUBY war ein Geschenk von Yunde Zhao. Um Probenlichtbögen zu vermeiden, reduzieren Sie das Vorhandensein ionischer Verbindungen so weit wie möglich. Diese ionischen Verbindungen können Restsalze aus der Ethanolfällung von DNA19 sein. - Legen Sie an dieser Stelle eine 1 mm Elektroporationsküvette auf Eis.
- Die vorherige Suspensionsmischung in eine gekühlte 1 mm Elektroporationsküvette geben. Halten Sie alles auf Eis. Wischen Sie die metallischen Elektroden der Küvette ab.
- Stellen Sie den Elektroporator auf Agr (2,2 kV, ~5 ms, 1 Impuls). Legen Sie die Küvette in die Elektroporationskammer.
- Drücken Sie die Pulse-Taste. Registrieren Sie die Impulsparameter. Wenn die Probe einen Lichtbogen bildete, versagte der Elektroporationsprozess.
HINWEIS: Es ist wichtig, die Zellen direkt nach dem Impuls schnell in die YM-Brühe zu überführen. Eine Verzögerung dieser Übertragung kann die Transformationseffizienz drastisch verringern20. - Verwenden Sie sofort die gespeicherte YM-Bouillon, um die Zellen von der Küvette in das 17 mm x 100 mm große Rohr zu übertragen. Resuspendieren Sie die Zellen sanft.
- Inkubieren Sie die transformierten Zellen 3 Stunden lang bei 28 °C und 250 U/min in einem Orbitalinkubator.
HINWEIS: Diese Kultur enthält keine Antibiotika; Seien Sie vorsichtig mit den richtigen aseptischen Bedingungen. - Streifen Sie diese Kultur auf selektive YM-Agarplatten21. Stellen Sie für den transformierten LBA4404-RUBY-Stamm sicher, dass diese Platten Rifampicin (25 μg/ml), Spectinomycin (50 μg/ml) und Streptomycin (50 μg/ml) enthalten. Inkubieren Sie diese Platte über Nacht in einem 28 °C stehenden Inkubator.
HINWEIS: In diesem Protokoll wurde der Vektor 35S:RUBY verwendet, der eine bakterielle Resistenz gegen Spectinomycin (50 μg/ml) verleiht und als visueller Reporter auf infiltriertem Pflanzengewebe fungiert. - Beimpfen Sie die Kolonien aus der Übernachtkultur mit 12,5 ml einer Mischung aus YM-Bouillon und Luria Bertani (LB)-Bouillon (im Verhältnis 9:1), 10 mM MES, pH 5,722. Es ist sicherzustellen, dass dieses selektive flüssige Medium die gleichen Antibiotika enthält, die in Schritt 1.10 verwendet wurden. In Tabelle 1 finden Sie die Inhaltsstoffe und Konzentrationen für diese Medien.
- Lassen Sie bei der Inkubation von Agrobacterium genügend Belüftungsraum für die Kultur, etwa das 4- bis 5-fache des Flüssigkeitsvolumens. Verwenden Sie YM-Bouillon für Agrobacterium-Stamm LBA4404, um Zellverklumpungen zu vermeiden23.
- Inkubieren Sie die Kultur 16 Stunden lang bei 250 U/min auf einem 28 °C Orbitalinkubator.
- Skalieren Sie die Kultur auf das 10-fache des ursprünglichen Volumens mit dem gleichen Medium, das in Schritt 1.11 verwendet wurde.
- Inkubieren Sie die Kultur für 16 h und 250 U/min auf einem 28 °C Orbitalinkubator.
- Stellen Sie die Übernachtkultur auf eine optische Dichte (OD600) von 0,4 ein. Fügen Sie 20 μM Acetosyringon (AS) hinzu.
- Inkubieren Sie bei 250 U/min auf einem 28 °C Orbitalinkubator, bis OD600 etwa 1,0 erreicht.
- Die Zellen werden bei 4 500 x g 10 min bei 20 °C zentrifugiert.
- Resuspendieren Sie das Pellet mit einer Suspensionslösung (10 mM MES, 10 mM MgCl2, pH 5,7) und stellen Sie OD600 auf 0,6 ein. 200 μM AS24 zugeben.
HINWEIS: Die Suspensionslösung bei 28 °C vorinkubieren. Wenn die Suspensionslösung bei der Zugabe kalt ist, fallen die Zellen aus. - Lassen Sie die Bakteriensuspension 2-24 h bei Dunkelheit und 25 °C stehen. Rühren ist nicht erforderlich22.
2. Pflanzenauswahl
- Wählen Sie eine Pflanze mit einem Zweig mit Blättern im optimalen Stadium für die Agroinfiltration.
HINWEIS: Die Pflanze kann ausgewachsen oder ein ausgewachsener Baum sein. Für Kakao werden junge Blätter des C-Stadiums empfohlen. Diese Blätter sind bronze- bis hellgrün gefärbt; sie sind weder vollständig ausgedehnt noch so starr wie die Blätter des StadiumsD 25 (Abbildung 1).- Führen Sie als Kontrolle gleichzeitig eine Agroinfiltration an anderen Pflanzen (z. B. Nicotiana tabacum) mit einer hohen Agroinfiltrationseffizienz durch, die für den verwendeten Stamm und Vektor angegeben wird.
HINWEIS: Wenn bei dieser Kontrolle keine positiven Ergebnisse erzielt werden, ist es möglich, dass die negativen Ergebnisse auf die Dehnung oder den verwendeten Vektor zurückzuführen sind.
- Führen Sie als Kontrolle gleichzeitig eine Agroinfiltration an anderen Pflanzen (z. B. Nicotiana tabacum) mit einer hohen Agroinfiltrationseffizienz durch, die für den verwendeten Stamm und Vektor angegeben wird.
3. Aufbau der Vakuumkammer
- Verwenden Sie als Vakuumkammer einen Exsikkator mit einem Vakuummeter, um den Vakuumdruck im Inneren zu messen.
- 250 μM Jasmonsäure (JA)18,26 werden der Agrobacterium-Suspension aus Schritt 1.19 zugegeben.
- Übertragen Sie die Agrobacterium-Kultur in ein Weithalsbecherglas, um den ausgewählten Zweig und die Blätter einzutauchen. Stellen Sie dann das Becherglas mit der Agrobacterium-Kultur in den Exsikkator.
- Legen Sie den Zweig zwischen den Exsikkator und seinen Deckel. Achten Sie darauf, die gewünschten Blätter in die Agrobacterium-Kultur zu tauchen. Verwenden Sie als Nächstes einen Biegering, einen runden Ring mit einem Ausschnitt, durch den der Pflanzenzweig in den Exsikkator gelangen kann. Der Biegering fungiert auch als Abstandshalter zwischen der Unter- und Oberseite des Exsikkators.
- Stellen Sie sicher, dass die Dichtung strukturstabil genug ist, um nicht mit dem Deckel gequetscht zu werden, flexibel genug, um sich zu biegen und an den Umfang des Exsikkators anzupassen, und nicht aus einem porösen Material besteht.
HINWEIS: In dieser Studie wurde ein Litzendraht aus Metall verwendet, der aus mehreren kleineren Drähten besteht, die miteinander verdrillt sind und mit einem nicht porösen Kunststoffmaterial beschichtet sind, das einer Dichtung ähnelt (Abbildung 2). - Um den Ast auf dem Exsikkator zu befestigen, verwenden Sie Silikon-Abformmaterial. Stellen Sie sicher, dass das Material klebrig, nicht porös, chemisch inert für den Exsikkator und die Pflanze ist und sich leicht auftragen lässt, und füllen Sie kleine Lücken zwischen dem Abzweig, der Dichtung und dem Exsikkator.
- Sobald das Silikonabformmaterial polymerisiert ist (dies dauert ca. 1 min) und den Ast fixiert, schließen Sie den Exsikkator. Achten Sie darauf, keine Lücken zu lassen.
- Schließen Sie den Exsikkator an die Vakuumpumpe an (Abbildung 3).
4. Vakuum-Infiltration
- Starten Sie die Vakuumpumpe, bis sie -0,07 MPa erreicht.
- Sobald dieser Druck erreicht ist, schließen Sie das Druckventil und schalten Sie die Vakuumpumpe aus. Halten Sie diesen Druck 5 Minuten lang aufrecht.
- Öffnen Sie das Druckventil, um den Kammerdruck wiederherzustellen.
HINWEIS: Dies ist ein kritischer Schritt. Stellen Sie den Kammerdruck allmählich und gleichmäßig wieder her. Es kann bis zu 3 Minuten dauern, bis der Exsikkator wieder vollständig unter Druck gesetzt ist. Eine längere Druckentlastung erhöht die Anzahl der in das Gewebe eingedrungenen Bakterien10. - Wiederholen Sie diesen Vorgang noch zweimal.
- Nehmen Sie den Zweig von der Zellsuspension und dem Exsikkator.
- Reinigen Sie die infiltrierten Blätter mit destilliertem Wasser.
5. Inkubation von infiltrierten Blättern
- Lassen Sie die infiltrierten Blätter 48 h bei 25 °C dunkel stehen.
- Setzen Sie dann das infiltrierte Gewebe einer 16/8-stündigen Hell-/Dunkel-Photoperiode aus.
- Bewerten Sie die vorübergehende Blatttransformation 3-7 Tage nach der Infektion (DPI).

Abbildung 1: Kakaoblätter Entwicklungsstadien. (A-E) Entwicklungsstadien25. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
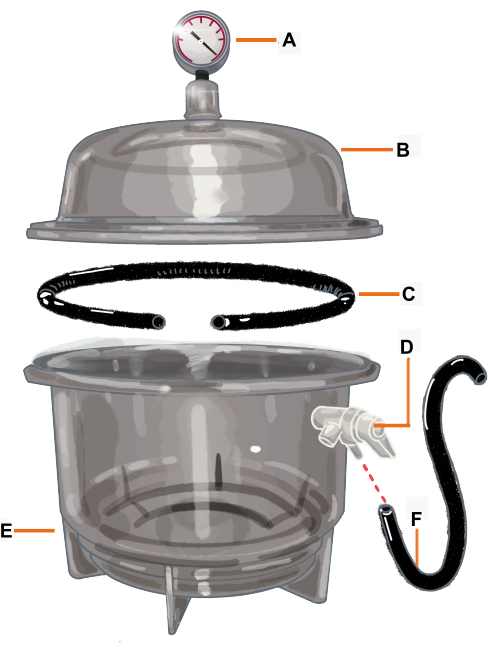
Abbildung 2: Vakuumkammerkonfiguration und ihre Komponenten. Die Vakuumkammer ist ein Exsikkator, der mit einem Vakuummeter verbunden ist. Die Dichtung / der O-Ring ist so geschnitten, dass sie eine Öffnung hat, in der der Abzweig platziert wird. (A) Vakuummeter, (B) Deckel, (C) Dichtung / O-Ring, (D) Druckventil, (E) Exsikkator, (F) Schlauch. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Im planta Vakuum-Agroinfiltrationssystem. Um Vakuumverluste während des Infiltrationsprozesses zu vermeiden, ist es wichtig, den Abzweig am Exsikkator und die Dichtung/den O-Ring mit Silikon-Abformmaterial zu befestigen. (A) Kakaopflanze, (B) Vakuumkammer, (C) Silikonabformmaterial, (D) Blätter auf Agrobacterium-Suspension getaucht, (E) Vakuumpumpe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Dieses Protokoll stellt eine effektive Agroinfiltrationsmethode für große Gehölze dar. Mit diesem Protokoll konnten wir einen Vakuumdruck von -0,07 MPa erreichen, was zu einer effektiven, lokalisierten Infiltration von Kakaoblättern führte. In Abbildung 4 sehen wir den Einrichtungsprozess des Infiltrationssystems und in Abbildung 5 die endgültige Konfiguration.
Diskussion
In dieser Arbeit haben wir ein effizientes, kostengünstiges Agroinfiltrationsprotokoll für die transiente Transformation von Gehölzen in planta am Beispiel von Kakaopflanzen vorgestellt. Angesichts der bekannten Einschränkung, die die Kutikula von Blättern für die Transformation von Pflanzengewebe darstellt, konzentrierten wir uns auf die Entwicklung einer Strategie zur Erleichterung der Agroinfiltration durch Vakuum bei Gehölzen, die diesem Verfahren normalerweise widerspenstig gegenüberstehen.
Offenlegungen
Autoren haben keinen Interessenkonflikt zu deklarieren.
Danksagungen
Wir danken Lic. Jesús Fuentes González und Néstor Iván Robles Olivares für ihre Unterstützung beim Filmen des Videomaterials. Wir danken Dr. Antonia Gutierrez Mora von CIATEJ (Theobroma-Kakaopflanzen ). Wir danken auch CIATEJ und Laboratorio Nacional PlanTECC, Mexiko, für die Unterstützung der Einrichtung. H.E.H.D. (CVU: 1135375) führte Masterstudien mit finanzieller Unterstützung des Consejo Nacional de Humanidades, Ciencia y Tecnología, México (CONAHCYT) durch. R.U.L. dankt der Unterstützung des Consejo Estatal de Ciencia y Tecnología de Jalisco (COECYTJAL) und der Secretaría de Innovación Ciencia y Tecnología (SICYT), Jalisco, Mexiko (Grant 7270-2018).
Materialien
| Name | Company | Catalog Number | Comments |
| 35S:RUBY plasmid | Addgene | 160908 | http://n2t.net/addgene:160908 ; RRID:Addgene_160908 |
| 1 mm electroporation cuvette | Thermo Fisher Scientific | FB101 | Fisherbrand Electroporation Cuvettes Plus |
| Desiccator | Bel-Art SP SCIENCEWARWE | F42400-2121 | |
| Freeze dryer | LABCONCO | 700402040 | |
| K2HPO4 | Sigma Aldrich | P8281-500G | For YM medium add 0.38 g/L |
| LBA4404 ElectroCompetent Agrobacterium | Intact Genomics USA | 1285-12 | https://intactgenomics.com/product/lba4404-electrocompetent-agrobacterium/ |
| Mannitol | Sigma Aldrich | 63560-250G-F | For YM medium add 10 g/L |
| MES | Sigma Aldrich | PHG0003 | (For LB, YM and resuspension medium) add 1.95 g/L (10mM) |
| MgCl2 | Sigma Aldrich | M8266 | For resuspension medium add 0.952 g/L (10 mM) |
| MgSO4·7H20 | Sigma Aldrich | 63138-1KG | For YM medium add 0.204 g/L |
| MicroPulser Electroporation Apparatus | Biorad | 165-2100 | |
| NaCl | Karal | 60552 | For LB medium add 5 g/L; For YM medium add 0.1 g/L |
| NanoDrop One Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | 13-400-518 | |
| President Silicone Impression material | COLTENE | 60019938 | |
| Rifampicin | Gold-Bio | R-120-1 | (100 mg/mL) |
| Silicone Impression material gun | Andent | TBT06 | |
| Spectinomycin | Gold-Bio | S-140-SL10 | (100 mg/mL) |
| Streptomycin | Gold-Bio | S-150-SL10 | (100 mg/mL) |
| Tryptone enzymatic digest from casein | Sigma Aldrich | 95039-1KG-F | For LB medium add 10 g/L |
| Yeast extract | MCD LAB | 9031 | For LB medium add 5 g/L; For YM medium add 0.4 g/L |
Referenzen
- Yang, J., Jia, M., Guo, J., Huang, L. Q. Functional Genome of Medicinal Plants. Molecular Pharmacognosy. , (2019).
- Janssen, B. J., Gardner, R. C. Localized transient expression of GUS in leaf discs following cocultivation with Agrobacterium. Plant Molecular Biology. 14 (1), 61-72 (1990).
- Wang, X., et al. Identification and functional analysis of in vivo phosphorylation sites of the Arabidopsis BRASSINOSTEROID-INSENSITIVE1 receptor kinase. Plant Cell. 17 (6), 1685-1703 (2005).
- Pan, Z., et al. In vivo assembly of the sorgoleone biosynthetic pathway and its impact on agroinfiltrated leaves of Nicotiana benthamiana. The New Phytologist. 230 (2), 683-697 (2021).
- Manavella, P. A., Chan, R. L. Transient transformation of sunflower leaf discs via an agrobacterium-mediated method: Applications for gene expression and silencing studies. Nature Protocols. 4 (11), 1699-1707 (2009).
- Guo, M., Ye, J., Gao, D., Xu, N., Yang, J. Agrobacterium-mediated horizontal gene transfer: Mechanism, biotechnological application, potential risk and forestalling strategy. Biotechnology Advances. 37 (1), 259-270 (2019).
- He, Y., Zhang, T., Sun, H., Zhan, H., Zhao, Y. A reporter for noninvasively monitoring gene expression and plant transformation. Horticulture Research. 7 (1), 152 (2020).
- Zheng, L., et al. An improved and efficient method of Agrobacterium syringe infiltration for transient transformation and its application in the elucidation of gene function in poplar. BMC Plant Biology. 21 (1), 54 (2021).
- Leuzinger, K., et al. Efficient agroinfiltration of plants for high-level transient expression of recombinant proteins. Journal of Visualized Experiments: JoVE. 77, 50521 (2013).
- Chincinska, I. A. Leaf infiltration in plant science: old method, new possibilities. Plant Methods. 17 (1), 83 (2021).
- Simmons, C. W., Vandergheynst, J. S., Upadhyaya, S. K. A model of agrobacterium tumefaciens vacuum infiltration into harvested leaf tissue and subsequent in planta transgene transient expression. Biotechnology and Bioengineering. 102 (3), 965-970 (2009).
- Cao, D. V., et al. Optimization of Agrobacterium -mediated transient expression of heterologous genes in spinach. Plant Biotechnology Reports. 11, 397-405 (2017).
- Xie, L., et al. Virus-induced gene silencing in the perennial woody Paeonia ostii. PeerJ. 7, ee7001 (2019).
- Prasad Babu, K., Maligeppagol, M., Asokan, R., Krishna Reddy, M. Screening of a multi-virus resistant RNAi construct in cowpea through transient vacuum infiltration method. Virusdisease. 30 (2), 269-278 (2019).
- Ekengren, S. K., Liu, Y., Schiff, M., Dinesh-Kumar, S. P., Martin, G. B. Two MARK cascades, NPR1, and TGA transcription factors play a role in Pto-mediated disease resistance in tomato. The Plant Journal: for Cell and Molecular Biology. 36 (6), 905-917 (2003).
- Deng, X., et al. Virus-induced gene silencing for Asteraceae-a reverse genetics approach for functional genomics in Gerbera hybrida. Plant Biotechnology Journal. 10 (8), 970-978 (2012).
- Wang, F., et al. Use of TRV-mediated VIGS for functional genomics research in citrus. Plant Cell, Tissue and Organ Culture. 139 (3), 609-613 (2019).
- Salazar-González, J. A., et al. In-planta transient transformation of avocado (Persea americana) by vacuum agroinfiltration of aerial plant parts. Plant Cell Tissue Organ Cult. 152, 635-646 (2023).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- GoldBio. . Electrotransformation of Agrobacterium tumefaciens Protocol. , (2018).
- Lindbo, J. A. TRBO: a high-efficiency tobacco mosaic virus RNA-based overexpression vector. Plant Physiology. 145 (4), 1232-1240 (2007).
- Rajasekaran, K., Curtis, I. S. Agrobacterium-Mediated Genetic Transformation of Cotton. Transgenic Crops of the World. , (2004).
- Llave, C., Kasschau, K. D., Carrington, J. C. Virus-encoded suppressor of posttranscriptional gene silencing targets a maintenance step in the silencing pathway. Proceedings of the National Academy of Sciences of the United States of America. 97 (24), 13401-13406 (2000).
- Fister, A. S., et al. Protocol: transient expression system for functional genomics in the tropical tree Theobroma cacao L. Plant Methods. 12, 19 (2016).
- Jung, S. -. K., et al. Agrobacterium tumefaciens mediated transient expression of plant cell wall-degrading enzymes in detached sunflower leaves. Biotechnology Progress. 30 (1), 905-915 (2014).
- Wroblewski, T., Tomczak, A., Michelmore, R. Optimization of Agrobacterium-mediated transient assays of gene expression in lettuce, tomato and Arabidopsis. Plant Biotechnology Journal. 3 (2), 259-273 (2005).
- Keith, C. V., Ramos-Sobrinho, R., Marelli, J. -. P., Brown, J. K. Construction of an infectious clone of the Badnavirus Cacao Swollen Shoot Ghana M Virus and infectivity by gene gun- and Agrobacterium-mediated inoculation. Frontiers in Agronomy. 3, 774863 (2021).
- Fister, A. S., Landherr, L., Maximova, S. N., Guiltinan, M. J. Transient expression of CRISPR/Cas9 machinery targeting TcNPR3 enhances defense response in Theobroma cacao. Frontiers in Plant Science. 9, 268 (2018).
- Grützner, R., et al. Engineering betalain biosynthesis in tomato for high level betanin production in fruits. Frontiers in Plant Science. 12, 682443 (2021).
- Saifi, S. K., Passricha, N., Tuteja, R., Kharb, P., Tuteja, N. In planta transformation: A smart way of crop improvement. Advancement in Crop Improvement Techniques. 21, 351-362 (2020).
- Huda, K. M., et al. OsACA6, a P-type IIB Ca2+ ATPase promotes salinity and drought stress tolerance in tobacco by ROS scavenging and enhancing the expression of stress-responsive genes. The Plant Journal: for Cell and Molecular Biology. 76 (6), 997-1015 (2013).
- Micheli, F., et al. Functional Genomics of Cacao. Advances in Botanical Research. 55, 119-177 (2010).
- Bailey, B. A., et al. Fungal and plant gene expression during the colonization of cacao seedlings by endophytic isolates of four Trichoderma species. Planta. 224 (6), 1449-1464 (2006).
- Motamayor, J. C., et al. Geographic and genetic population differentiation of the Amazonian chocolate tree (Theobroma cacao L). PLoS ONE. 3 (10), e3311 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten