È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Agroinfiltrazione forzata sottovuoto per la trasformazione in planta di piante recalcitranti: il cacao come caso di studio
In questo articolo
Riepilogo
Qui presentiamo il primo protocollo per l'infiltrazione sottovuoto localizzata per studi in vivo della trasformazione genetica di piante di grandi dimensioni. Utilizzando questa metodologia, abbiamo ottenuto per la prima volta la trasformazione transitoria del cacao mediata da Agrobacterium in planta .
Abstract
La trasformazione transitoria delle piante è un'alternativa rapida ed economica alla trasformazione genetica delle piante. La maggior parte dei protocolli per la trasformazione in planta si basa sull'uso della trasformazione mediata da Agrobacterium. Tuttavia, i protocolli attualmente in uso sono standardizzati per impianti di piccole dimensioni a causa dei vincoli fisici ed economici di sottoporre impianti di grandi dimensioni a un trattamento sottovuoto. Questo lavoro presenta un protocollo efficace per l'agroinfiltrazione localizzata sottovuoto personalizzata per impianti di grandi dimensioni. Per valutare l'efficacia del metodo proposto, ne abbiamo testato l'uso nelle piante di cacao, una specie vegetale tropicale recalcitrante alla trasformazione genetica. Il nostro protocollo ha permesso di applicare fino a 0,07 MPa di vuoto, con ripetizioni, su una parte aerea localizzata delle foglie di cacao, rendendo possibile l'infiltrazione di Agrobacterium negli spazi intercellulari delle foglie attaccate. Di conseguenza, abbiamo ottenuto il transiente mediato da Agrobacterium nella trasformazione planta delle foglie di cacao attaccate che si esprimono per il sistema reporter RUBY. Questa è anche la prima trasformazione transitoria del cacao mediata da Agrobacterium in planta . Questo protocollo consentirebbe l'applicazione del metodo di agroinfiltrazione basato sul vuoto ad altre specie vegetali con vincoli dimensionali simili e aprirebbe la porta alla caratterizzazione in pianta di geni in specie legnose recalcitranti di grandi dimensioni.
Introduzione
I metodi di trasformazione genetica delle piante sono essenziali per testare le funzioni biologiche dei geni e sono particolarmente utili oggi, dato il gran numero di geni non caratterizzati previsti nell'era post-genomica1. Questi metodi possono essere utilizzati per ottenere linee completamente trasformate o per esprimere geni in modo transitorio. La trasformazione stabile si verifica quando il DNA estraneo che l'ospite ha assorbito diventa completamente e irreversibilmente integrato nel genoma dell'ospite e le modificazioni genetiche vengono trasmesse alle generazioni successive. L'espressione transitoria, nota come trasformazione transitoria, si verifica dalle copie multiple di T-DNA trasferite da Agrobacterium nella cellula, che non sono state integrate nel genoma dell'ospite, e raggiunge il picco 2-4 giorni dopo l'infezione2.
Vale la pena notare che i saggi di espressione transitoria sono spesso sufficienti per la caratterizzazione funzionale dei geni e possono offrire diversi vantaggi rispetto alla trasformazione stabile. Ad esempio, la trasformazione transitoria non richiede procedure di rigenerazione basate sulla coltura tissutale. Un altro vantaggio è che è compatibile con l'analisi funzionale dei geni in pianta , esistendo diversi esempi di successo di protocolli ben standardizzati per specie vegetali modello, come Arabidopsis thaliana3 e Nicotiana benthamiana4, ma ancora limitati nelle specie non modello5.
Lo sviluppo di saggi transitori si basa sulla disponibilità di metodi efficienti di trasferimento genico. Per questo, gli approcci più popolari si basano sull'infiltrazione di Agrobacterium , che sfrutta la capacità unica di Agrobacterium di trasferire il DNA alle cellule vegetali6. Un altro strumento utile per queste analisi è l'uso di geni reporter, come le proteine fluorescenti verdi (GFP), la β-glucuronidasi (GUS), la luciferasi o RUBY, tutti impiegati per tracciare gli eventi di trasformazione. Tra questi sistemi reporter, RUBY è attualmente il più facile da visualizzare e si basa sulla conversione della tirosina in betalaine attraverso tre reazioni enzimatiche a gradini. A differenza di altri sistemi reporter, le betalaine risultanti possono essere facilmente osservate come pigmenti dai colori vivaci su tessuti vegetali trasformati senza la necessità di apparecchiature sofisticate o reagenti aggiuntivi7.
Quando si infiltra una sospensione di Agrobacterium nello spazio intercellulare del mesofillo fogliare, il passo più critico per un'agroinfezione di successo è il superamento della barriera fisica imposta dalla cuticola epidermica delle foglie8. Mentre per alcune piante è sufficiente un gradiente di pressione creato con una siringa senza ago (siringa Agroinfiltration) per un'agroinfiltrazione efficiente, come avviene in Nicotiana benthamiana9, altre specie vegetali possono richiedere un gradiente di pressione maggiore come quello creato con l'ausilio di pompe a vuoto10. Nei processi assistiti dal vuoto, l'agroinfiltrazione avviene in due fasi. Nel primo, il vuoto serve a sottoporre il materiale vegetale a una pressione ridotta, forzando il rilascio di gas dagli spazi aerei del mesofillo attraverso stomi e ferite. Quindi, durante una fase di ripressurizzazione, la sospensione di Agrobacterium si infiltra negli spazi intercellulari attraverso gli stomi e le ferite11.
Rispetto all'infiltrazione a siringa, l'infiltrazione sottovuoto consente una maggiore frequenza di utilizzo, ripetibilità e la capacità di controllare la pressione e la durata in ogni fase del processo di infiltrazione10. Nelle foglie di diverse specie vegetali come gli spinaci (Spinacia oleracea)12, la peonia (una pianta legnosa perenne) (Paeonia ostii)13 e il fagiolo dall'occhio (Vigna unguiculata)14, i protocolli di agroinfiltrazione sottovuoto hanno raggiunto un tasso di infiltrazione più profondo rispetto all'infiltrazione a siringa. Allo stesso modo, nel pomodoro (Lycopersicon esculentum)15 e nella gerbera (Gerbera hybrida)16, l'agroinfiltrazione sotto vuoto ha prodotto un silenziamento genico più forte e uniforme rispetto all'infiltrazione con siringa. Un ulteriore vantaggio dell'infiltrazione sottovuoto è la minore dipendenza dal genotipo, rispetto all'infiltrazione a siringa, che è stata osservata recentemente in tre varietà di agrumi (Fortunella obovata, Citrus limon e C. grandis)17. Tuttavia, quando si cerca di applicare l'agroinfiltrazione sottovuoto a piante troppo grandi per essere inserite negli essiccatori, le dimensioni delle camere a vuoto possono essere un limite, come in genere accade con le piante legnose tropicali.
Di seguito, descriviamo un protocollo che supera la limitazione spaziale delle camere a vuoto, testandone l'utilità per la trasformazione in planta transitoria delle foglie di cacao. Presentiamo il primo metodo di infiltrazione sottovuoto localizzato per cacao, che non necessita di attrezzature aggiuntive e consente addirittura l'utilizzo degli stessi essiccatori da laboratorio utilizzati per l'infiltrazione dell'intera pianta, ma con un semplice adattamento che consente l'accesso di una parte della pianta all'interno della camera a vuoto, consentendone l'utilizzo in diverse fasi di sviluppo della pianta. Per testare l'utilità del metodo di infiltrazione sottovuoto localizzato proposto, abbiamo selezionato il cacao come proxy di una specie di pianta tropicale a foglia larga e difficile da trasformare. Utilizzando questo metodo di infiltrazione localizzata, abbiamo recentemente riportato la prima espressione transitoria di planta nell'avocado mediante infiltrazione sottovuoto mediata da Agrobacterium con condizioni precedentemente ottimizzate per foglie staccate18, e qui riportiamo la prima espressione transitoria di planta nel cacao.
Protocollo
1. Coltura di Agrobacterium tumefaciens
- Scongelare le cellule elettrocompetenti del ceppo Agrobacterium tumefaciens LBA4404.
- Aggiungere 1 mL di Malto Lievitato (YM; Tabella 1) brodo in una provetta di coltura di 17 mm x 100 mm. Conservare questo tubo per dopo e conservarlo a temperatura ambiente (RT).
- In una provetta da 1,5 mL, aggiungere 30 μL di cellule di Agrobacterium scongelate e 100-250 ng (fino a 5 μL) di DNA contenente 35S:RUBY. Mescolare delicatamente.
NOTA: Il 35S:RUBY è stato un regalo di Yunde Zhao. Per evitare la formazione di archi elettrici nel campione, ridurre il più possibile la presenza di composti ionici. Questi composti ionici possono essere sali residui della precipitazione dell'etanolo del DNA19. - A questo punto, posizionare una cuvetta per elettroporazione da 1 mm sul ghiaccio.
- Trasferire la miscela di sospensione precedente in una cuvetta per elettroporazione fredda da 1 mm. Tieni tutto in ghiaccio. Pulire gli elettrodi metallici della cuvetta.
- Impostare l'elettroporatore su Agr (2,2 kV, ~5 ms, 1 impulso). Posizionare la cuvetta all'interno della camera di elettroporazione.
- Premere il pulsante Pulse . Registrare i parametri dell'impulso. Se il campione si è inarcato, il processo di elettroporazione non è riuscito.
NOTA: È fondamentale trasferire rapidamente le cellule nel brodo YM subito dopo l'impulso. Ritardare questo trasferimento può ridurre drasticamente l'efficienza della trasformazione20. - Utilizzare immediatamente il brodo YM risparmiato per trasferire le cellule dalla cuvetta alla provetta da 17 mm x 100 mm. Risospendere delicatamente le cellule.
- Incubare le cellule trasformate per 3 ore a 28 °C e 250 rpm su un incubatore orbitale.
NOTA: Questa coltura non contiene antibiotici; Prestare attenzione alle corrette condizioni asettiche. - Strisciare questa coltura su piastre di agar YM selettive21. Per il ceppo LBA4404-RUBY trasformato, assicurarsi che queste piastre contengano rifampicina (25 μg/mL), spectinomicina (50 μg/mL) e streptomicina (50 μg/mL). Incubare questa piastra per una notte in un'incubatrice permanente a 28 °C.
NOTA: In questo protocollo è stato utilizzato il vettore 35S:RUBY , che conferisce resistenza batterica alla spectinomicina (50 μg/mL) e funziona come reporter visivo sul tessuto vegetale infiltrato. - Inoculare le colonie della coltura notturna su 12,5 mL di una miscela di brodo YM e brodo Luria Bertani (LB) (in proporzione 9:1, rispettivamente), 10 mM di MES, pH 5,722. Assicurarsi che questo terreno liquido selettivo contenga gli stessi antibiotici utilizzati al punto 1.10. Fare riferimento alla Tabella 1 per vedere gli ingredienti e le concentrazioni di questi mezzi.
- Quando si incuba l'Agrobacterium, lasciare uno spazio di aerazione sufficiente per la coltura, circa 4-5 volte il volume del liquido. Utilizzare il brodo YM per LBA4404 del ceppo Agrobacterium per evitare l'aggregazione delle cellule23.
- Incubare la coltura per 16 ore a 250 giri/min su un incubatore orbitale a 28 °C.
- Scalare la coltura fino a 10 volte il volume iniziale con lo stesso terreno utilizzato nel passaggio 1.11.
- Incubare la coltura per 16 ore e 250 rpm su un incubatore orbitale a 28 °C.
- Regolare la coltura notturna su una densità ottica (OD600) di 0,4. Aggiungere 20 μM di acetosiringone (AS).
- Incubare a 250 giri/min su un incubatore orbitale a 28 °C fino a quando OD600 raggiunge circa 1,0.
- Centrifugare le cellule a 4 500 x g per 10 minuti a 20 °C.
- Risospendere il pellet con soluzione di sospensione (10 mM MES, 10 mM MgCl2, pH 5,7), regolando OD600 a 0,6. Aggiungere 200 μM AS24.
NOTA: Pre-incubare la soluzione in sospensione a 28 °C. Se la soluzione di sospensione è fredda quando viene aggiunta, le cellule precipiteranno. - Lasciare agire la sospensione batterica per 2-24 ore al buio e a 25 °C. L'agitazione non è richiesta22.
2. Selezione delle piante
- Scegli una pianta con un ramo con foglie nella fase ottimale per l'agroinfiltrazione.
NOTA: La pianta può essere adulta o matura. Per il cacao si consigliano le foglie giovani dello stadio C. Queste foglie sono di colore da bronzo a verde chiaro; non sono completamente espansi né rigidi come le foglie dello stadio D25 (Figura 1).- Come controllo, eseguire contemporaneamente l'agroinfiltrazione su altre piante (ad esempio, Nicotiana tabacum) con un'elevata efficienza di agroinfiltrazione che viene riportata per il ceppo e il vettore utilizzato.
NOTA: Se non si ottengono risultati positivi in questo controllo, è possibile che i risultati negativi siano dovuti alla deformazione o al vettore utilizzato.
- Come controllo, eseguire contemporaneamente l'agroinfiltrazione su altre piante (ad esempio, Nicotiana tabacum) con un'elevata efficienza di agroinfiltrazione che viene riportata per il ceppo e il vettore utilizzato.
3. Configurazione della camera a vuoto
- Come camera a vuoto, utilizzare un essiccatore dotato di un vacuometro per misurare la pressione del vuoto all'interno.
- Aggiungere 250 μM di acido jasmonico (JA)18,26 alla sospensione di Agrobacterium dal punto 1.19.
- Trasferire la coltura di Agrobacterium in un becher a bocca larga per immergere il ramo e le foglie selezionati. Quindi, posizionare il becher con la coltura di Agrobacterium all'interno dell'essiccatore.
- Posizionare il ramo tra l'essiccatore e il suo coperchio. Assicurati di immergere le foglie desiderate all'interno della coltura di Agrobacterium . Quindi, usa un anello di salto, che è un anello rotondo con un ritaglio che consente al ramo della pianta di entrare nell'essiccatore. L'anello di salto funge anche da distanziatore tra la parte inferiore e superiore dell'essiccatore.
- Assicurarsi che la guarnizione sia strutturalmente abbastanza stabile da evitare di essere schiacciata con il coperchio, abbastanza flessibile da piegarsi e adattarsi alla circonferenza dell'essiccatore e non realizzata in materiale poroso.
NOTA: Questo studio ha utilizzato un filo metallico intrecciato costituito da diversi fili più piccoli attorcigliati insieme, rivestiti con un materiale plastico non poroso simile a una guarnizione (Figura 2). - Per fissare il ramo sull'essiccatore, utilizzare materiale da impronta in silicone. Assicurarsi che il materiale sia appiccicoso, non poroso, chimicamente inerte per l'essiccatore e la pianta e facile da applicare e riempire piccoli spazi tra il ramo, la guarnizione e l'essiccatore.
- Una volta che il materiale da impronta in silicone polimerizza (ci vuole circa 1 minuto) e fissa il ramo in posizione, chiudere l'essiccatore. Assicurati di non lasciare spazi vuoti.
- Collegare l'essiccatore alla pompa del vuoto (Figura 3).
4. Infiltrazione sottovuoto
- Avviare la pompa del vuoto fino a -0,07 MPa.
- Una volta raggiunta questa pressione, chiudere la valvola di pressione e spegnere la pompa del vuoto. Mantenere questa pressione per 5 min.
- Aprire la valvola di pressione per ripristinare la pressione della camera.
NOTA: questo è un passaggio critico. Ripristinare la pressione della camera in modo graduale e costante. Potrebbero essere necessari fino a 3 minuti per ripressurizzare completamente l'essiccatore. La ripressurizzazione prolungata aumenta il numero di batteri infiltrati all'interno del tessuto10. - Ripeti questo processo altre due volte.
- Togliere il ramo dalla sospensione cellulare e dall'essiccatore.
- Pulire le foglie infiltrate con acqua distillata.
5. Incubazione delle foglie infiltrate
- Lasciare le foglie infiltrate al buio a 25 °C per 48 h.
- Quindi, esporre il tessuto infiltrato a un fotoperiodo luce/buio di 16/8 ore.
- Valutare la trasformazione fogliare transitoria 3-7 giorni dopo l'infezione (DPI).

Figura 1: Fasi di sviluppo delle foglie di cacao. (A-E) Fasi di sviluppo25. Fare clic qui per visualizzare una versione più grande di questa figura.
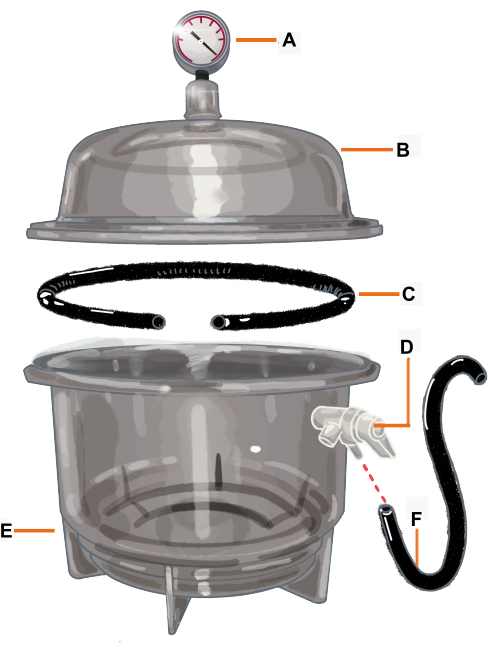
Figura 2: Configurazione della camera a vuoto e suoi componenti. La camera a vuoto è un essiccatore collegato a un vacuometro. La guarnizione/O-ring è tagliata in modo da avere un'apertura in cui verrà posizionato il ramo. (A) Vacuometro, (B) Coperchio, (C) Guarnizione/O-ring, (D) Valvola di pressione, (E) Essiccatore, (F) Tubo flessibile. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Nel sistema di agroinfiltrazione sottovuoto planta . Per evitare perdite di vuoto durante il processo di infiltrazione, è fondamentale fissare il ramo all'essiccatore e la guarnizione/O-ring con materiale da impronta in silicone. (A) Pianta di cacao, (B) Camera a vuoto, (C) Materiale da impronta in silicone, (D) Foglie immerse in sospensione di Agrobacterium , (E) Pompa a vuoto. Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
Questo protocollo presenta un efficace metodo di agroinfiltrazione per piante legnose di grandi dimensioni. Con questo protocollo, siamo stati in grado di raggiungere una pressione del vuoto di -0,07 MPa, con conseguente infiltrazione efficace e localizzata delle foglie di cacao. Nella Figura 4, osserviamo il processo di impostazione del sistema di infiltrazione e nella Figura 5, la configurazione finale.
Discussione
In questo lavoro, abbiamo presentato un protocollo di agroinfiltrazione efficiente e a basso costo per la trasformazione transitoria in planta di piante legnose, utilizzando come esempio le piante di cacao. Dato il ben noto vincolo che la cuticola delle foglie rappresenta per la trasformazione dei tessuti vegetali, ci siamo concentrati sullo sviluppo di una strategia per facilitare l'agroinfiltrazione sottovuoto nelle piante legnose, che solitamente sono recalcitranti a questa procedura.
Divulgazioni
Gli autori non hanno alcun conflitto di interessi da dichiarare.
Riconoscimenti
Ringraziamo Lic. Jesús Fuentes González e Néstor Iván Robles Olivares per la loro assistenza nelle riprese del filmato. Riconosciamo le generose donazioni della Dott.ssa Antonia Gutierrez Mora di CIATEJ (piante di Theobroma cacao ). Ringraziamo anche CIATEJ e Laboratorio Nacional PlanTECC, Messico, per il supporto alla struttura. H.E.H.D. (CVU: 1135375) ha condotto studi di master con il finanziamento del Consejo Nacional de Humanidades, Ciencia y Tecnología, Messico (CONAHCYT). R.U.L. riconosce il sostegno del Consejo Estatal de Ciencia y Tecnología de Jalisco (COECYTJAL) e della Secretaría de Innovación Ciencia y Tecnología (SICYT), Jalisco, Messico (Grant 7270-2018).
Materiali
| Name | Company | Catalog Number | Comments |
| 35S:RUBY plasmid | Addgene | 160908 | http://n2t.net/addgene:160908 ; RRID:Addgene_160908 |
| 1 mm electroporation cuvette | Thermo Fisher Scientific | FB101 | Fisherbrand Electroporation Cuvettes Plus |
| Desiccator | Bel-Art SP SCIENCEWARWE | F42400-2121 | |
| Freeze dryer | LABCONCO | 700402040 | |
| K2HPO4 | Sigma Aldrich | P8281-500G | For YM medium add 0.38 g/L |
| LBA4404 ElectroCompetent Agrobacterium | Intact Genomics USA | 1285-12 | https://intactgenomics.com/product/lba4404-electrocompetent-agrobacterium/ |
| Mannitol | Sigma Aldrich | 63560-250G-F | For YM medium add 10 g/L |
| MES | Sigma Aldrich | PHG0003 | (For LB, YM and resuspension medium) add 1.95 g/L (10mM) |
| MgCl2 | Sigma Aldrich | M8266 | For resuspension medium add 0.952 g/L (10 mM) |
| MgSO4·7H20 | Sigma Aldrich | 63138-1KG | For YM medium add 0.204 g/L |
| MicroPulser Electroporation Apparatus | Biorad | 165-2100 | |
| NaCl | Karal | 60552 | For LB medium add 5 g/L; For YM medium add 0.1 g/L |
| NanoDrop One Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | 13-400-518 | |
| President Silicone Impression material | COLTENE | 60019938 | |
| Rifampicin | Gold-Bio | R-120-1 | (100 mg/mL) |
| Silicone Impression material gun | Andent | TBT06 | |
| Spectinomycin | Gold-Bio | S-140-SL10 | (100 mg/mL) |
| Streptomycin | Gold-Bio | S-150-SL10 | (100 mg/mL) |
| Tryptone enzymatic digest from casein | Sigma Aldrich | 95039-1KG-F | For LB medium add 10 g/L |
| Yeast extract | MCD LAB | 9031 | For LB medium add 5 g/L; For YM medium add 0.4 g/L |
Riferimenti
- Yang, J., Jia, M., Guo, J., Huang, L. Q. Functional Genome of Medicinal Plants. Molecular Pharmacognosy. , (2019).
- Janssen, B. J., Gardner, R. C. Localized transient expression of GUS in leaf discs following cocultivation with Agrobacterium. Plant Molecular Biology. 14 (1), 61-72 (1990).
- Wang, X., et al. Identification and functional analysis of in vivo phosphorylation sites of the Arabidopsis BRASSINOSTEROID-INSENSITIVE1 receptor kinase. Plant Cell. 17 (6), 1685-1703 (2005).
- Pan, Z., et al. In vivo assembly of the sorgoleone biosynthetic pathway and its impact on agroinfiltrated leaves of Nicotiana benthamiana. The New Phytologist. 230 (2), 683-697 (2021).
- Manavella, P. A., Chan, R. L. Transient transformation of sunflower leaf discs via an agrobacterium-mediated method: Applications for gene expression and silencing studies. Nature Protocols. 4 (11), 1699-1707 (2009).
- Guo, M., Ye, J., Gao, D., Xu, N., Yang, J. Agrobacterium-mediated horizontal gene transfer: Mechanism, biotechnological application, potential risk and forestalling strategy. Biotechnology Advances. 37 (1), 259-270 (2019).
- He, Y., Zhang, T., Sun, H., Zhan, H., Zhao, Y. A reporter for noninvasively monitoring gene expression and plant transformation. Horticulture Research. 7 (1), 152 (2020).
- Zheng, L., et al. An improved and efficient method of Agrobacterium syringe infiltration for transient transformation and its application in the elucidation of gene function in poplar. BMC Plant Biology. 21 (1), 54 (2021).
- Leuzinger, K., et al. Efficient agroinfiltration of plants for high-level transient expression of recombinant proteins. Journal of Visualized Experiments: JoVE. 77, 50521 (2013).
- Chincinska, I. A. Leaf infiltration in plant science: old method, new possibilities. Plant Methods. 17 (1), 83 (2021).
- Simmons, C. W., Vandergheynst, J. S., Upadhyaya, S. K. A model of agrobacterium tumefaciens vacuum infiltration into harvested leaf tissue and subsequent in planta transgene transient expression. Biotechnology and Bioengineering. 102 (3), 965-970 (2009).
- Cao, D. V., et al. Optimization of Agrobacterium -mediated transient expression of heterologous genes in spinach. Plant Biotechnology Reports. 11, 397-405 (2017).
- Xie, L., et al. Virus-induced gene silencing in the perennial woody Paeonia ostii. PeerJ. 7, ee7001 (2019).
- Prasad Babu, K., Maligeppagol, M., Asokan, R., Krishna Reddy, M. Screening of a multi-virus resistant RNAi construct in cowpea through transient vacuum infiltration method. Virusdisease. 30 (2), 269-278 (2019).
- Ekengren, S. K., Liu, Y., Schiff, M., Dinesh-Kumar, S. P., Martin, G. B. Two MARK cascades, NPR1, and TGA transcription factors play a role in Pto-mediated disease resistance in tomato. The Plant Journal: for Cell and Molecular Biology. 36 (6), 905-917 (2003).
- Deng, X., et al. Virus-induced gene silencing for Asteraceae-a reverse genetics approach for functional genomics in Gerbera hybrida. Plant Biotechnology Journal. 10 (8), 970-978 (2012).
- Wang, F., et al. Use of TRV-mediated VIGS for functional genomics research in citrus. Plant Cell, Tissue and Organ Culture. 139 (3), 609-613 (2019).
- Salazar-González, J. A., et al. In-planta transient transformation of avocado (Persea americana) by vacuum agroinfiltration of aerial plant parts. Plant Cell Tissue Organ Cult. 152, 635-646 (2023).
- Dower, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- GoldBio. . Electrotransformation of Agrobacterium tumefaciens Protocol. , (2018).
- Lindbo, J. A. TRBO: a high-efficiency tobacco mosaic virus RNA-based overexpression vector. Plant Physiology. 145 (4), 1232-1240 (2007).
- Rajasekaran, K., Curtis, I. S. Agrobacterium-Mediated Genetic Transformation of Cotton. Transgenic Crops of the World. , (2004).
- Llave, C., Kasschau, K. D., Carrington, J. C. Virus-encoded suppressor of posttranscriptional gene silencing targets a maintenance step in the silencing pathway. Proceedings of the National Academy of Sciences of the United States of America. 97 (24), 13401-13406 (2000).
- Fister, A. S., et al. Protocol: transient expression system for functional genomics in the tropical tree Theobroma cacao L. Plant Methods. 12, 19 (2016).
- Jung, S. -. K., et al. Agrobacterium tumefaciens mediated transient expression of plant cell wall-degrading enzymes in detached sunflower leaves. Biotechnology Progress. 30 (1), 905-915 (2014).
- Wroblewski, T., Tomczak, A., Michelmore, R. Optimization of Agrobacterium-mediated transient assays of gene expression in lettuce, tomato and Arabidopsis. Plant Biotechnology Journal. 3 (2), 259-273 (2005).
- Keith, C. V., Ramos-Sobrinho, R., Marelli, J. -. P., Brown, J. K. Construction of an infectious clone of the Badnavirus Cacao Swollen Shoot Ghana M Virus and infectivity by gene gun- and Agrobacterium-mediated inoculation. Frontiers in Agronomy. 3, 774863 (2021).
- Fister, A. S., Landherr, L., Maximova, S. N., Guiltinan, M. J. Transient expression of CRISPR/Cas9 machinery targeting TcNPR3 enhances defense response in Theobroma cacao. Frontiers in Plant Science. 9, 268 (2018).
- Grützner, R., et al. Engineering betalain biosynthesis in tomato for high level betanin production in fruits. Frontiers in Plant Science. 12, 682443 (2021).
- Saifi, S. K., Passricha, N., Tuteja, R., Kharb, P., Tuteja, N. In planta transformation: A smart way of crop improvement. Advancement in Crop Improvement Techniques. 21, 351-362 (2020).
- Huda, K. M., et al. OsACA6, a P-type IIB Ca2+ ATPase promotes salinity and drought stress tolerance in tobacco by ROS scavenging and enhancing the expression of stress-responsive genes. The Plant Journal: for Cell and Molecular Biology. 76 (6), 997-1015 (2013).
- Micheli, F., et al. Functional Genomics of Cacao. Advances in Botanical Research. 55, 119-177 (2010).
- Bailey, B. A., et al. Fungal and plant gene expression during the colonization of cacao seedlings by endophytic isolates of four Trichoderma species. Planta. 224 (6), 1449-1464 (2006).
- Motamayor, J. C., et al. Geographic and genetic population differentiation of the Amazonian chocolate tree (Theobroma cacao L). PLoS ONE. 3 (10), e3311 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon